Method Article
커프 기법을 통한 마우스 경동맥에 조직 공학 혈관 이식편 이식
요약
여기에서는 커프 기법을 사용하여 조직 공학 혈관 이식편을 마우스 경동맥에 이식하기 위한 프로토콜을 제시하여 혈관 조직 재생 메커니즘을 조사하는 데 적합한 동물 모델을 제공합니다.
초록
직경이 작은 혈관 이식편의 개발은 전 세계적인 노력이었으며 수많은 연구 그룹이 이 분야에 기여하고 있습니다. 동물 실험은 특히 임상적 적용이 없는 경우 혈관 이식편의 효능과 안전성을 평가하는 데 중추적인 역할을 합니다. 대체 동물 모델과 비교했을 때, 마우스 이식 모델은 잘 정의된 유전적 배경, 질병 모델 구축을 위한 성숙한 방법, 간단한 수술 절차 등 여러 가지 이점을 제공합니다. 이러한 장점을 바탕으로 본 연구는 쥐의 경동맥에 조직 공학적 혈관 이식편을 이식하기 위한 간단한 커프 기술을 고안했습니다. 이 기술은 정전기 방사를 통해 폴리카프로락톤(PCL) 소구경 혈관 이식편을 제작하는 것으로 시작되었으며, 그 후 관류 흡착을 통해 이식편에 대식세포를 파종하는 것으로 시작되었습니다. 그 후, 세포화된 조직 공학 혈관 이식편을 커프 기술을 사용하여 마우스 경동맥에 이식하여 개통성 및 재생 능력을 평가했습니다. 생체 내 이식 30일 후, 혈관 개통은 신조직 재생의 증거와 이식편의 내강 내에 내피층 형성과 함께 만족스러운 것으로 밝혀졌습니다. 모든 데이터는 통계 및 그래프 소프트웨어를 사용하여 분석되었습니다. 이 연구는 혈관 재생의 세포 원천과 활성 물질의 작용 메커니즘을 탐색하는 데 사용할 수 있는 마우스 경동맥 이식 모델을 성공적으로 확립했습니다. 또한, 새로운 소구경 혈관 이식편의 개발을 위한 이론적 지원을 제공합니다.
서문
심혈관 질환의 유병률과 사망률은 전 세계적으로 증가하고 있으며, 이는 중대한 공중 보건 문제를 나타냅니다1. 혈관 우회술은 중증 관상 동맥 심장 질환 및 말초 혈관 질환에 효과적인 중재술이다2. 직경이 6mm를 초과하는 인공 혈관 이식편의 사용은 임상 환경에서 잘 문서화되어 있습니다. 반대로, 직경이 6mm 미만인 사람은 혈전증과 내막 증식증이 발생하기 쉬우며, 이는 상당한 재협착 위험으로 이어질 수 있다3. 최근 몇 년 동안 소구경 혈관 이식편의 연구 개발이 크게 발전했음에도 불구하고 여러 제품이 임상 적용에 접근함에 따라 여러 가지 과제가 남아 있습니다 4,5. 여기에는 상대적으로 낮은 장기 개통률, 제한된 혈관 재생, 재생 메커니즘에 대한 불충분한 이해 등이 포함됩니다.
새로운 소구경 혈관 이식편의 전임상 평가는 다양한 동물 모델에서의 생체 내 이식에 의존합니다. 가장 일반적으로 사용되는 모델에는 양 경동맥, 개 대퇴 동맥, 토끼 경동맥 및 쥐 복부 동맥 이식 모델 6,7,8,9가 포함됩니다. 혈관 이식편의 개통성은 양, 돼지, 개와 같은 중대형 동물에서 평가할 수 있습니다. 그러나 이러한 연구에는 필요한 전문 지식과 장비로 인해 상당한 비용이 듭니다. 또한 기술적 복잡성으로 인해 구현에 어려움이 있습니다. 대조적으로, 토끼 및 쥐와 같은 작은 동물 모델에는 명확하게 정의된 유전적 배경을 가진 잘 확립된 형질전환 종이 부족하여 혈관 재생 메커니즘을 연구하는 데 상당한 장애물이 있습니다.
앞서 언급한 동물 모델과 비교했을 때, 마우스 모델은 비교적 간단한 수술 절차, 유전자 조작 마우스를 생성하기 위한 잘 정립된 방법론 및 명확하게 정의된 유전적 배경을 제공합니다. 그러나 마우스 혈관의 직경이 작기 때문에 혈관 이식에서 종단 간 문합은 기술적으로 복잡하여 상당한 전문 지식이 필요하고 상대적으로 성공률이 낮습니다. 절차의 복잡성을 줄이고 혈관 이식 이식의 성공률을 높이기 위해 본 연구에서는 마우스 경동맥 이식 모델에서 커프 기술을 사용했습니다.
생체 내 이식 후, 혈관 이식편은 혈관 조직 재생에 기여하는 내인성 세포를 모집할 수 있습니다. 이러한 세포의 존재는 이식편의 평활근 층의 내피화와 재생을 촉진합니다. 10. 그러나 혈관 조직 재생에 관여하는 세포의 출처와 유형은 여전히 불분명하며, 여러 경쟁 이론이 연구 중이다11. 이 중 염증세포와 줄기세포의 역할에 대한 연구가 집중되어 있습니다. Breuer 등은 인간 골수 유래 단핵구(human bone marrow-derived monocytes, hBMC)를 혈관 이식편에 파종한 결과, 파종된 세포가 단핵구 화학유인 단백질-1(MCP-1)의 방출을 통해 숙주 세포를 이식벽으로 모집하여 혈관 조직 재생을 촉진한다는 사실을 발견했다12. 본 연구에서는 효율적인 관류 흡착 세포 파종(constructing method)을 제안하여 폴리카프로락톤(PCL) 소구경 혈관 이식편에 대식세포를 시딩하는 데 성공적으로 사용했습니다. 이식 후 이러한 세포는 지속적인 생존력을 보였습니다.
이 기사에서는 커프 기술을 사용하여 마우스에서 조직 공학 혈관 이식편과 경동맥 이식 절차를 준비하는 방법론에 대해 자세히 설명합니다. 이 공정은 정전기 방사를 통해 정의된 매개변수를 가진 PCL 소구경 혈관 이식편을 제작하는 것으로 시작됩니다. 그 후, 이식에 적합한 것으로 간주되는 이식편은 기계적 테스트를 거칩니다. 그런 다음 대식세포는 관류 흡착 방법을 사용하여 혈관 이식편에 파종됩니다. 마지막으로, 커프 기법을 사용하여 대식세포 파종 혈관 이식편을 마우스 경동맥에 이식하고, 생체 내 이식 1개월 후 개통 및 재생 특성을 분석합니다.
이 기술은 마우스 모델에서 혈관 이식의 효능과 성공률을 향상시킬 수 있는 잠재력을 가지고 있습니다. 또한, 이 모델은 혈관 재생의 세포 공급원, 중추 유전자 및 활성 인자의 기저에 있는 메커니즘을 조사하는 데 사용할 수 있으며, 새로운 소구경 혈관 이식편의 기능적 변형 및 개발에 대한 이론적, 방법론적 지원을 제공할 수 있습니다.
프로토콜
모든 동물 시술은 중국의학원(Chinese Academy of Medical Sciences) 방사선의학연구소(Institute of Radiation Medicine)의 동물실험윤리위원회(Animal Experiment Ethical Committee)의 승인을 받았으며 실험동물의 관리 및 사용에 대한 지침을 준수했습니다. 이 연구에는 체중이 25-30g인 6-8주 된 수컷 C57BL/6 마우스가 사용되었습니다. 이 연구에 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 소구경 혈관 이식편의 제작
참고: 전기방사 기법을 사용하여 소구경 PCL 혈관 이식편을 제작합니다13.
- 12시간 동안 실온(RT)에서 헥사플루오로이소프로판올(HFIP)을 10%, 15% 및 20%(w/v)로 PCL 용액을 준비합니다.
- PCL 용액을 10mL 주사기에 넣고 21G 스테인리스 스틸 바늘로 주사기를 배치합니다.
- 텅스텐 강철 맨드릴(직경 0.7mm, 길이 20cm)을 수집 기기에 놓습니다.
- 전기방사 기법을 사용하여 9개 그룹의 PCL 혈관 이식편을 제작합니다. 대용량 연결tage 전원 공급 장치를 바늘에 연결합니다. 내경이 0.7mm인 텅스텐 강철 막대를 바늘 앞의 고정된 거리에 수용 장치로 배치합니다.
참고: 혈관 이식 그룹에 대한 설명은 표 1에 나와 있으며, 혈관 이식편의 매개변수는 표 2에 자세히 설명되어 있습니다. - 제작된 혈관 이식편을 배출 과정에 적용합니다. 잔류 용매를 제거하기 위해 진공 건조 오븐에 72시간 동안 혈관 이식편을 놓습니다.
- 이식편을 의료용 알코올에 30분 동안 담그고 밤새 자외선에 노출시켜 소독합니다.
- 주사전자현미경(SEM)을 사용하여 혈관 이식편의 미세한 형태를 관찰합니다. 전도성 접착제를 사용하여 혈관 이식편을 SEM 표본 스테이지에 부착하고 코팅을 위해 금 스퍼터링 장치에 넣습니다.
- 15kV의 가속 전압에서 SEM을 사용하여 혈관 이식편의 구조와 섬유 형태를 관찰합니다. ImageJ 소프트웨어를 사용하여 SEM 이미지(n = 5)에서 섬유 직경과 기공 크기를 측정합니다.
- 인장 시험기를 사용하여 혈관 이식편의 기계적 특성(인장 및 탄성 특성)을 평가합니다. 혈관 이식편의 상단과 하단을 1cm 간격으로 고정된 클램프로 고정합니다.
- 파열될 때까지 10mm/분의 속도로 혈관 이식편을 늘립니다. 인장 시험기에서 응력-변형률 곡선을 수집합니다.
- 최대 하중(2-15N), 파단 응력(5-30MPa), 파단 응력(200%-1500%) 및 탄성 계수(1-20MPa)14를 포함한 기계적 매개변수를 계산합니다.
- 통계 및 그래프 소프트웨어를 사용하여 통계 분석을 수행합니다. 데이터를 표준 편차± 평균으로 표현합니다. 일원 분산 분석에서 Tukey의 사후 검정을 사용하여 여러 그룹 간의 일변량 차이를 분석하고 비교합니다. *P < 0.05, **P < 0.01, ***P < 0.001.
2. 혈관 이식편에 대식세포를 파종하는 것
알림: 모든 용액과 재료가 멸균되었는지 확인하십시오. 세포 배양실 내에서 모든 작업을 수행합니다.
- RAW264.7(마우스 단핵구 대식세포)을 접착 조건에서 플라스크에 배양합니다(그림 1A). 1% 페니실린-스트렙토마이신과 10% 소 태아 혈청이 보충된 완전한 Dulbecco's modified Eagle's medium(DMEM)을 사용하여 세포 배양 배지를 준비합니다. 플라스크를 37% 이산화탄소가 들어 있는 5°C 인큐베이터에 넣습니다.
- 세포 스크레이퍼를 사용하여 대식세포를 수집합니다. 1mL 피펫을 사용하여 배지를 버리고 PBS로 세포를 세척합니다.
- 배양 플라스크에 2mL의 새 배지를 추가하고 세포 스크레이퍼로 표면을 부드럽게 긁습니다. 수집된 세포를 튜브에 옮기고 실온에서 5분 동안 1,000 x g 의 속도로 원심분리합니다. 5 × 106 세포를 100 μL의 완전한 배지에 재현탁합니다.
- DMEM과 4,000 x g으로 4,000 x g 으로 5분 동안 원심분리를 채운 15mL 튜브에 PCL 혈관 이식편(길이 1cm)을 놓습니다. 이식편이 튜브 바닥으로 가라앉을 때까지 이 과정을 여러 번 반복하여 DMEM으로 재료가 완전히 침투할 수 있도록 합니다.
- 여과지 층을 깐 10cm 페트리 접시를 준비합니다. 적신 PCL 혈관 이식편을 여과지에 놓고 굴려 여분의 매체를 제거합니다.
- 10μL 피펫을 사용하여 10μL의 세포 현탁액을 취하여 혈관 이식편의 한쪽 끝에 주입합니다. 현탁액의 균일한 분포를 용이하게 하기 위해 여과지 위로 혈관 이식편을 회전합니다. 각 말단을 5회 주입하여 총 10회 주입합니다(그림 1B, C).
- 대식세포가 로드된 혈관 이식편을 1mL의 완전한 배지가 포함된 24웰 플레이트에 넣고 이식 전에 세포 배양 인큐베이터에서 2시간 동안 배양합니다.
- 이식벽 내의 세포 분포를 결정합니다. 동결절편을 위해 대식세포 부하 혈관 이식편을 광간섭단층촬영(OCT) 화합물에 삽입하십시오. 세포핵을 4',6-디아미디노-2-페닐린돌(DAPI)으로 염색하고 형광 현미경으로 관찰합니다.
3. 쥐 경동맥 이식 모형
참고: 동물 시술을 위해 멸균 수술 부위를 유지하십시오. 수술 전에 모든 수술 기구와 일회용품을 소독하십시오.
- 각각 무게가 25-30g인 건강한 수컷 C57BL/6 마우스 3마리를 선택합니다. 수술 전날 쥐를 단식시킵니다. 각 동물에 하나의 혈관 이식편을 이식하여 총 3개의 이식편을 이식합니다.
- 나일론 튜브로 커프를 구성하고(그림 2A) 그림 2B에 혈관 커프 기술의 개략도를 제시합니다.
- 50mg/kg 농도의 펜토바르비탈나트륨을 복강내 주사하여 마우스를 마취합니다(기관에서 승인된 프로토콜에 따름). 근육 이완과 호흡을 보장하여 효과적인 마취를 확인하십시오. 마취 중 건조를 방지하기 위해 눈에 바셀린 안연 연고를 바르십시오.
- 마우스를 수술대에 누운 자세로 놓고 목의 털을 제거합니다. 요오드로 수술 부위를 소독합니다. 무균 환경을 유지하기 위해 비수술 부위를 멸균 거즈로 덮습니다(그림 3A).
- 안과 가위를 사용하여 하악골에서 흉골까지 정중선 절개(길이 1.5-2cm)를 만듭니다. 왼쪽 침샘을 들어 올리고 왼쪽 쇄골근을 절제하여 수술 시야를 넓힙니다. 마이크로 핀셋을 사용하여 왼쪽 총경동맥을 노출시킵니다(그림 3B).
- 마이크로핀셋을 사용하여 좌측 경동맥을 분리합니다(그림 3C).
- 9-0 봉합사를 사용하여 중간 부분의 두 위치에서 경동맥을 결찰합니다. 마이크로 가위를 사용하여 두 합자 사이의 동맥을 절제합니다. 양쪽 끝의 동맥을 통해 커프를 통과시키고 동맥 클립을 사용하여 동맥과 커프를 함께 고정합니다(그림 3D).
- 동맥을 바깥쪽으로 돌려 커프 본체를 덮고 마이크로펜셉으로 9-0 봉합사를 사용하여 커프에 고정합니다(그림 3E).
- 경동맥의 양쪽 끝 사이에 이식편 끝을 동맥 커프 위로 밀어 넣고 9-0 봉합사로 고정하여 혈관 이식편을 이식합니다(그림 3F).
참고: 커프, 경동맥 및 혈관 이식편의 차원 데이터는 표 3에 제시되어 있습니다. 이식편과 커프의 직경이 마우스 경동맥의 직경과 밀접하게 일치하지만, 문합 내강 직경과 이식편 직경 사이에 불일치가 존재합니다. 문합 내강 직경은 커프의 내경(0.5mm)에서 경동맥 벽 두께(0.1mm)의 두 배를 빼서 계산되며, 그 결과 루멘 직경은 0.3mm가 됩니다. 혈관 이식편은 내경이 0.7mm로 약 2.3배(0.7mm / 0.3mm = 2.3)의 불일치를 유발합니다. - 양쪽 끝의 동맥 클립을 제거하고 이식 부위에 식염수를 관개합니다. 원위 동맥 맥동을 관찰하여 혈관 이식편의 개통성을 평가합니다(그림 3G).
- 왼쪽 타액선을 재배치하고 6-0 봉합사를 사용하여 수술 부위를 봉합합니다(그림 3H).
4. 시술 후 관리 및 분석
- 마우스를 37°C 인큐베이터로 옮기고 의식을 회복할 때까지 활력 징후를 지속적으로 모니터링합니다.
- 수술 후 통증 완화를 위해 5mg/kg의 카비놀을 주사합니다.
- 복구 기간 동안 마우스를 모니터링하고 완전히 회복될 때까지 그룹 하우징에 반환하지 마십시오.
- 이식 1개월 후 마우스를 마취하고 조직학적 분석을 위해 혈관 이식편 샘플을 채취합니다9.
- CO2 질식을 통한 안락사를 수행한 후 윤리 지침에 따라 자궁경부 탈구를 수행합니다.
결과
매개변수가 다른 작은 직경의 혈관 이식편은 전기 방사를 통해 성공적으로 준비되었습니다. SEM 이미지는 섬유가 균일하게 분포되어 있고 공극 구조의 존재와 함께 이식벽 내에서 불규칙한 배열을 나타내는 것을 보여주었습니다(그림 4). PCL의 농도가 증가함에 따라 섬유 직경과 기공 크기가 모두 증가했습니다. 각 혈관 이식 그룹에 대한 구체적인 값은 표 2에 제시되어 있습니다. 기계적 테스트 결과는 모든 혈관 이식편이 필요한 기계적 표준을 충족한다는 것을 보여주었습니다. 파단 시 최대 하중 및 변형률은 PCL 농도가 높을수록 증가하고(그림 5A-C), 탄성 계수는 감소합니다(그림 5D). 이러한 결과를 바탕으로 PCL 농도가 15%이고 벽 두께가 150μm인 소구경 혈관 이식편을 후속 실험을 위한 최적의 이식편으로 선택했습니다.
이 연구에서는 관류 흡착 방법을 사용하여 혈관 이식편에 대식세포를 파종했습니다. SEM 분석을 통해 대식세포가 혈관 이식편에 성공적으로 파종되고 균일한 분포를 보이는 것을 확인했습니다(그림 6A). DAPI 염색을 거친 단면 이식편에서는 파종된 대식세포가 이식편 내강에서 이식편 벽으로 침투한 것으로 나타났습니다(그림 6B).
생체 내 이식 후 30일이 지난 후 동물의 생존율은 100%였으며 이식된 3개의 혈관 이식편 중 2개는 특허 상태로 유지되어 마우스 모델에서 만족스러운 결과를 보였습니다. 동맥류나 이식편의 식별 가능한 섬유성 캡슐화는 실체현미경 하에서 관찰되지 않았습니다(그림 7A). 세포 침투 및 조직 재생의 정도는 조직학적 분석을 통해 추가로 평가되었습니다. 헤마톡실린(Hematoxylin)과 에오신(eosin, H&E) 염색 결과, 이식편 벽 내에서 상당한 세포 침투가 있었고 이식편의 내부 내강(inner lumen) 내에서 신조직이 형성된 것으로 나타났습니다(그림 7B). CD31 면역형광 염색은 이식편의 내강 내에서 내피 조직의 단일 층이 상대적으로 손상되지 않은 내피 세포 커버리지를 가지고 재생하는 것을 보여주었습니다(그림 7C).

그림 1: 세포 파종 절차. (A) RAW264.7 세포의 배양. 눈금 막대 : 100 μm. (B) 세포 파종 과정의 개략도. (C) 관류-흡착 방법을 사용하여 이식벽에 파종된 RAW264.7 세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 커프 기술. (A) 혈관 커프의 준비. (B) 혈관 커프 기술의 개략도. 이 방법을 사용하여 혈관 이식편을 경동맥에 이식했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 마우스 모델에서 혈관 이식을 위한 수술 절차. (A) 마취제 주입, 누운 자세로 마우스를 배치하고 발을 고정합니다. (B) 수술 부위의 노출. (C) 경동맥의 격리. (D) 경동맥 주위의 커프 배치. (E) 커프 몸체에 대한 동맥의 외전 및 9-0 봉합사를 사용한 고정. (F) 동맥 커프 위의 혈관 이식편을 슬리브링하고 봉합합니다. (G) 혈관 클램프 제거. (H) 피부 폐쇄. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 전기방사 폴리카프로락톤(PCL) 혈관 이식편의 형태. 혈관 이식편의 잘 정의된 섬유 구조를 보여주는 대표적인 주사 전자 현미경(SEM) 이미지. 스케일 바: 500 μm 및 50 μm (확대 이미지). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 전기방사 PCL 혈관 이식편의 기계적 특성. 세로 방향의 혈관 이식편의 기계적 특성화, 최대 하중(A), 최대 응력(B), 파단 변형률(C) 및 탄성 계수(D)를 보여줍니다. 데이터는 평균 ± 표준 편차(SD)(n = 3)로 표현됩니다. *P < 0.05, **P < 0.01, ***P < 0.001, 일원 분산 분석 후 Tukey의 사후 검정. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 세포 로딩 이식편의 특성화. (A) 대표적인 SEM 이미지 및 (B) 세포 적재 혈관 이식편의 4',6-디아미디노-2-페닐린돌(DAPI) 염색으로 성공적인 대식세포 이식 및 균일한 분포를 보여줍니다. 스케일 바: 30 μm 및 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
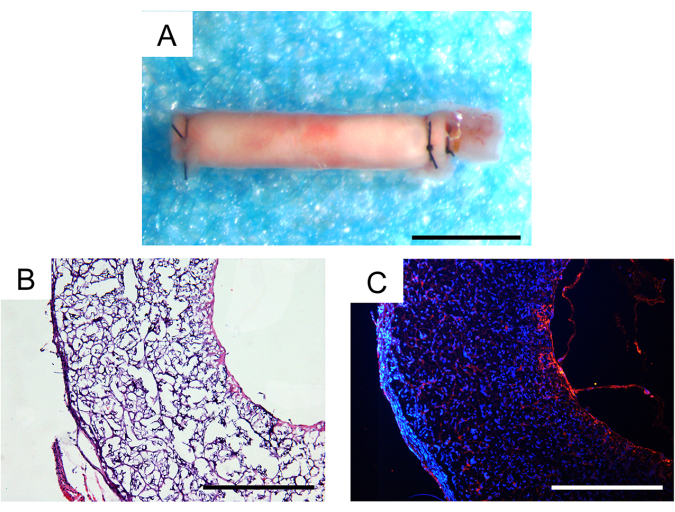
그림 7: 이식 1개월 후 이식된 혈관 이식편의 조직학적 분석. (A) 동맥류 형성 또는 섬유성 캡슐화가 없음을 보여주는 입체 이미지. 스케일 바 : 500 μm. (B) Hematoxylin 및 eosin (H & E) 염색은 우수한 세포화 및 조직 재생을 보여줍니다. 스케일 바 : 200 μm. (C) CD31 면역 형광 염색은 내강 표면에 내피 세포의 단층을 나타냅니다. 눈금 막대 : 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 그룹 | PCL의 농도 용액(%) | 혈관 이식편의 두께(μm) | 바늘 수집기 거리(cm) | 유량 (mL/h) | 전압 (킬로헤르트) |
| 10%-100 | 10 | 100 | 15 | 2 | 18 |
| 10%-150 | 10 | 150 | 15 | 2 | 18 |
| 10%-200 | 10 | 200 | 15 | 2 | 18 |
| 15%-100 | 15 | 100 | 15 | 2 | 18 |
| 15%-150 | 15 | 150 | 15 | 2 | 18 |
| 15%-200 | 15 | 200 | 15 | 2 | 18 |
| 20%-100 | 20 | 100 | 13 | 8 | 12 |
| 20%-150 | 20 | 150 | 13 | 8 | 12 |
| 20%-200 | 20 | 200 | 13 | 8 | 12 |
표 1: 혈관 이식 그룹에 대한 설명. PCL, 폴리카프로락톤.
| 그룹 | 섬유 직경 (μm) | 모공 크기 (μm) |
| 10%-100 | 0.51±0.12 | 2.48±1.38 |
| 10%-150 | 0.91±0.4 | 1.83±0.84 |
| 10%-200 | 0.73±0.35 아니요 | 2.24±0.83분 |
| 15%-100 | 1.85±0.3 | 8.91±2.87 아니요 |
| 15%-150 | 1.82±0.34 | 8.41±2.72 |
| 15%-200 | 2.18±0.47호 | 9.59±3.01마루 |
| 20%-100 | 3.61±1.02년 | 13.95±4.7 |
| 20%-150 | 3.06±0.56 | 13.12±3.36 |
| 20%-200 | 3.46±0.66 | 13.92±4.19 |
표 2: 다양한 혈관 이식편의 구조적 매개변수.
| 그룹 | 내경(mm) | 외경(mm) | 벽 두께(μm) | 길이 (cm) |
| 경동맥 | 0.5-0.6 | 0.6-0.7 | 100 | / |
| 혈관 이식편 | 0.7 | 1 | 150 | 0.8 |
| 커프스 | 0.5 | 0.63 | 65 | / |
표 3: 커프, 경동맥 및 혈관 이식편의 차원 데이터.
토론
쥐의 경동맥에 조직 공학적 혈관 이식편을 이식하기 위한 커프 기술의 사용은 심혈관 연구에서 중요한 진전을 나타냅니다15. 이 기술의 중요한 단계에는 세포 파종 및 이식 이식이 포함됩니다. 이 연구에서는 불균일한 세포 파종 및 낮은 세포 생존율과 관련된 문제를 해결하기 위해 대식세포 파종 밀도를 향상시키기 위해 관류 흡착 접근법을 사용했습니다. 이 방법을 통해 대식세포가 혈관 이식벽에 침투하여 고르게 분포할 수 있었습니다.
혈관 이식과 관련하여, 종단 간 문합16과 반대되는 커프 기법은 특히 직경이 더 작은 혈관에 적용될 때 더 높은 협착 발생률과 관련이 있을 수 있습니다. 이러한 효과를 최소화하기 위해, 내부 및 외부 직경이 마우스의 경동맥과 밀접하게 일치하는 커프가 선택되었습니다. 관련 차원은 표 3에 나와 있습니다.
이 기술은 마우스 경동맥에 혈관 이식편을 삽입하기 위한 보다 간단한 수술 절차를 용이하게 합니다. 직경이 작은 혈관 이식편에 대한 이전 연구에서 가장 자주 사용된 동물 모델에는 양 경정맥 동정맥루와 쥐 복부 동맥 이식 모델이 포함됩니다17,18. 이러한 모델은 혈관 이식편의 기계적 강도와 조직 리모델링 능력을 평가하는 데 효과적입니다. 그러나 그들은 근본적인 메커니즘을 규명하는 능력에 한계가 있습니다. 유전자 변형 마우스는 혈관 재생 메커니즘을 조사하는 데 중요한 모델로 부상하여 다른 동물 모델의 한계를 해결했습니다.
예를 들어, Apolipoprotein E (ApoE) 녹아웃 마우스는 고콜레스테롤혈증과 죽상경화성 병변이 자연적으로 발생하며,19 이는 혈관 이식이 필요한 임상 상태를 시뮬레이션하는 데 유용한 모델입니다. ApoE-knockout 마우스의 혈관 개통 및 재생을 평가하면 혈관 이식편의 임상 번역을 위한 중요한 참조 데이터를 얻을 수 있습니다. 또한 유전자가 결핍된 마우스를 활용하여 혈관 재생에서 주요 유전자의 역할을 조사할 수 있습니다. 혈관 기능의 중요한 조절자인 내피 산화질소 합성효소(endothelial nitric oxide synthase, eNOS)는 산화질소의 주요 공급원입니다20. eNOS 유전자가 결핍된 마우스는 이 유전자가 혈관 리모델링에 영향을 미치는 메커니즘을 밝히기 위한 연구 모델 역할을 합니다. 또한, 혈관 조직 재생에 관여하는 세포의 기원은 리포터 유전자 도구 마우스21,22를 사용하여 생체 내 세포 표지 및 계통 추적을 통해 탐색할 수 있습니다.
이 기술은 사용되는 동물의 수와 이식 기간과 관련하여 특정 제한이 있습니다. 본 연구는 주로 단기 적인 생체 내 접근 방식을 사용하여 이 이식 방법의 타당성을 평가하는 데 중점을 두었습니다. 향후 연구에서는 표본 크기를 늘리고 장기 평가를 수행하여 이 방법이 동맥류 형성, 개통 및 내막 증식증에 미치는 영향을 종합적으로 평가해야 합니다.
또한, 이식편 개통률은 66.6%였는데, 이는 문합 부위의 직경 불일치(2.3배)에 의해 영향을 받았을 수 있습니다. 이러한 불일치는 국소적인 혈류 장애로 이어져 혈전증의 위험을 증가시킬 수 있습니다. 직경 불일치를 줄이기 위해 커프 설계를 최적화하고 개통률에 미치는 영향을 조사하기 위한 추가 연구가 필요합니다.
결론적으로, 커프 기법을 기반으로 한 마우스 경동맥 이식 모델은 직경이 작은 혈관 이식편의 생물학적 평가를 위한 간단하고 효과적인 동물 모델을 제공합니다. 또한 혈관 조직 리모델링에서 다양한 세포 유형의 역할과 기본 재생 메커니즘을 조사할 수 있습니다.
공개
저자는 상충되는 재정적 이해관계가 없습니다.
감사의 말
이 연구를 위한 자금은 중국 국립 자연과학 재단 프로젝트(no. 32101098, 32071356 및 82272158)와 CAMS 의료 과학 혁신 기금(no. 2022-I2M-1-023)에서 제공했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1% penicillin-streptomycin | Solarbio | P1400 | |
| 10% fetal bovine serum | Gibco | A5256701 | |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 4',6-Diamidino-2-Phenylindole (DAPI) | SouthernBiotech | 0100-20 | |
| Alcohol | Tianjin Chemical Reaggent Company | 1083 | |
| Anti-Mouse CD31 primary antibody | BD Bioscience | 553370 | |
| Arterial clips | RWD Life Science | R31005-06 | |
| C57BL/6 mice | Beijing Vital River Laboratory Animal Technology Company | ||
| Dulbecco's modified eagle medium (DMEM) | Gibco | 11966025 | |
| Electrostatic spinning machine | Yunfan Technology | DP30 | |
| Goat anti-rat IgG (Alexa Fluor 555) | Invitrogen | A-21434 | |
| Hematoxylin and eosin (H&E) | Solarbio | G1120 | |
| Hexafluoroisopropanol (HFIP) | McClean | H811026 | |
| Iodophor | LIRCON | V273068 | |
| Microscissors | World Precision Instruments | 14124 | |
| Microtweezers | World Precision Instruments | 500338 | |
| Normal goat serum | Boster | AR0009 | |
| Normal saline | Cisen Pharmaceutical company | H20113369 | |
| Nylon tube for cuff | Portex | ||
| Optimal cutting temperature compound (OCT) | Sakara | 4583 | |
| Pentobarbital sodium | Sigma | P3761 | |
| Phosphate Buffered Saline (PBS) | Solarbio | P1003 | |
| Poly(ε-caprolactone) (PCL) pellets (Mn = 80,000) | Sigma | 704067 | |
| RAW264.7 macrophages | Biyuntian Biotechnology | ||
| Scanning electron microscope (SEM) | Zeiss | PHENOM-XL-G2 | |
| Surgical sutures 6-0 | Ningbo Chenghe microapparatus factory | 220919 | |
| Surgical sutures 9-0 | Ningbo Chenghe microapparatus factory | 221006 | |
| Syringe | Changqiang Medical Devices | 0197 | |
| Tensile testing machine | Instron | WDW-5D |
참고문헌
- Adhikary, D., Barman, S., Ranjan, R., Stone, H. A systematic review of major cardiovascular risk factors: A growing global health concern. Cureus. 14 (10), e30119 (2022).
- Alexander, J. H., Smith, P. K. Coronary-artery bypass grafting. N Engl J Med. 374 (20), 1954-1964 (2016).
- Jeong, Y., Yao, Y., Yim, E. K. F. Current understanding of intimal hyperplasia and effect of compliance in synthetic small diameter vascular grafts. Biomater Sci. 8 (16), 4383-4395 (2020).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: Two phase 2 single-arm trials. Lancet. 387 (10032), 2026-2034 (2016).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Sci Transl Med. 11 (485), eaau6934 (2019).
- Wang, C., Li, Z., Zhang, L., Sun, W., Zhou, J. Long-term results of triple-layered small diameter vascular grafts in sheep carotid arteries. Med Eng Phys. 85, 1-6 (2020).
- Tanaka, T., et al. Evaluation of small-diameter silk vascular grafts implanted in dogs. JTCVS Open. 6, 148-156 (2021).
- Jin, X., et al. Preparation of small-diameter tissue-engineered vascular grafts electrospun from heparin end-capped PCL and evaluation in a rabbit carotid artery replacement model. Macromol Biosci. 19 (8), e1900114 (2019).
- Xiao, Y., et al. Fabrication of small-diameter in situ tissue engineered vascular grafts with core/shell fibrous structure and a one-year evaluation via rat abdominal vessel replacement model. Biomater Adv. 165, 214018 (2024).
- Wei, Y., Wang, F., Guo, Z., Zhao, Q. Tissue-engineered vascular grafts and regeneration mechanisms. J Mol Cell Cardiol. 165, 40-53 (2022).
- Cleary, M. A., et al. Vascular tissue engineering: The next generation. Trends Mol Med. 18 (7), 394-404 (2012).
- Roh, J. D., et al. Tissue-engineered vascular grafts transform into mature blood vessels via an inflammation-mediated process of vascular remodeling. Proc Natl Acad Sci U S A. 107 (10), 4669-4674 (2010).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- Wu, Y., et al. Peptide-tethered vascular grafts enable blood vessel regeneration via endogenous cell recruitment and neovascularization. Compos B Eng. 252, 110504 (2023).
- Hu, Y., Xu, Q. Vessel graft atherosclerosis in murine models. Curr Drug Targets. 9 (3), 239-250 (2008).
- Qin, K., et al. Implantation of electrospun vascular grafts with optimized structure in a rat model. J Vis Exp. (136), e57340 (2018).
- Geelhoed, W. J., et al. A novel method for engineering autologous non-thrombogenic in situ tissue-engineered blood vessels for arteriovenous grafting. Biomaterials. 229, 119577 (2020).
- Wu, P., et al. Construction of vascular graft with circumferentially oriented microchannels for improving artery regeneration. Biomaterials. 242, 119922 (2020).
- Vasquez, E. C., Peotta, V. A., Gava, A. L., Pereira, T. M., Meyrelles, S. S. Cardiac and vascular phenotypes in the apolipoprotein e-deficient mouse. J Biomed Sci. 19 (1), 22 (2012).
- Garcia, V., Sessa, W. C. Endothelial nos: Perspective and recent developments. Br J Pharmacol. 176 (2), 189-196 (2019).
- He, L., et al. Enhancing the precision of genetic lineage tracing using dual recombinases. Nat Med. 23 (12), 1488-1498 (2017).
- Wang, F., et al. Nitric oxide improves regeneration and prevents calcification in bio-hybrid vascular grafts via regulation of vascular stem/progenitor cells. Cell Rep. 39 (12), 110981 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유