Method Article
カフ法 による マウス頸動脈への組織改変血管移植片の移植
要約
ここでは、カフ技術を使用してマウス頸動脈に組織工学的血管移植片を移植するためのプロトコルが提示され、血管組織再生メカニズムを調査するための適切な動物モデルが提供されます。
要約
小径血管グラフトの開発は世界的な取り組みであり、この分野には多数の研究グループが貢献しています。動物実験は、特に臨床応用がない場合に、血管移植片の有効性と安全性を評価する上で極めて重要な役割を果たします。他の動物モデルと比較して、マウス移植モデルには、明確に定義された遺伝的背景、疾患モデル構築のための成熟した方法、簡単な外科的処置など、いくつかの利点があります。これらの利点に基づいて、本研究では、マウス頸動脈に組織改変された血管移植片を移植するための簡単なカフ技術を考案しました。この技術は、静電紡糸 による ポリカプロラクトン(PCL)小径血管移植片の作製から始まり、続いて灌流吸着による移植片へのマクロファージの播種が始まりました。その後、細胞化した組織改変血管移植片をカフ技術を用いてマウス頸動脈に移植し、開存性と再生能力を評価しました。 30日間のin vivo 移植後、血管の開存性は満足のいくものであることが判明し、新組織再生と移植片の内腔内に内皮層が形成されたという証拠が示されました。すべてのデータは、統計およびグラフ作成ソフトウェアを使用して分析されました。本研究は、血管再生の細胞源や活性物質の作用機序の探索に利用できるマウス頸動脈移植モデルの確立に成功しました。さらに、新しい小径血管グラフトの開発を理論的に支持します。
概要
心血管疾患の有病率と死亡率は世界的に増加しており、公衆衛生上の重大な懸念事項となっています1。血管バイパス移植は、重度の冠状動脈性心疾患および末梢血管疾患に対する効果的な介入です2。直径が6mmを超える人工血管グラフトの使用は、臨床現場で十分に文書化されています。逆に、直径が6mm未満の人は血栓症や内膜過形成を起こしやすく、再狭窄のリスクがかなり高くなる可能性があります3。近年、小径血管移植片の研究開発は大きく進歩しており、いくつかの製品が臨床応用に近づいていますが、複数の課題が残っています4,5。これには、長期開存率が比較的低いこと、血管再生が限られていること、再生メカニズムの理解が不十分であることなどが含まれます。
新規小径血管移植片の前臨床評価は、さまざまな動物モデルでのin vivo移植に依存しています。最も一般的に使用されるモデルには、ヒツジ頸動脈、イヌ大腿動脈、ウサギ頸動脈、およびラット腹部動脈移植モデル6,7,8,9が含まれます。血管移植片の開存性は、羊、豚、犬などの中型から大型の動物で評価できます。ただし、これらの研究には、必要な専門知識と設備のためにかなりの費用がかかります。さらに、その技術的な複雑さは、実装に課題をもたらします。対照的に、ウサギやラットなどの小動物モデルには、明確に定義された遺伝的背景を持つ確立されたトランスジェニック種が欠けており、血管再生メカニズムの研究において大きな障害となっています。
前述の動物モデルと比較して、マウスモデルは比較的簡単な外科的処置、遺伝子操作マウスを生成するための確立された方法論、および明確に定義された遺伝的背景を提供します。しかし、マウスの血管の直径が小さいため、血管移植におけるエンドツーエンドの吻合は技術的に複雑になり、かなりの専門知識が必要で、成功率は比較的低くなります。手技の複雑さを軽減し、血管移植の成功率を向上させるために、本研究ではマウス頸動脈移植モデルにカフ技術を採用しました。
in vivo移植後、血管移植片は血管組織の再生に寄与する内因性細胞を動員できます。これらの細胞の存在は、移植片の平滑筋層の内皮化および再生を促進する。10.しかし、血管組織の再生に関与する細胞の起源と種類は不明のままであり、複数の競合する理論が調査中です11。これらの中で、研究は炎症細胞と幹細胞の役割に焦点を当てています。Breuerらは、ヒト骨髄由来単球(hBMC)を血管移植片に播種し、播種された細胞が単球化学誘引性タンパク質-1(MCP-1)の放出を介して宿主細胞を移植片壁に動員し、それによって血管組織の再生を促進することを発見しました12。本研究では、効率的な灌流吸着細胞播種法を提案し、ポリカプロラクトン(PCL)小径血管移植片にマクロファージを播種することに成功しました。着床後、これらの細胞は持続的な生存率を示しました。
この記事では、カフ技術を使用したマウスの組織工学的血管移植片の調製方法と頸動脈移植手順について詳しく説明します。このプロセスは、静電紡糸 による 定義されたパラメータを持つPCL小径血管グラフトの作製から始まります。その後、移植に適していると判断された移植片は、機械的試験を受けます。次に、マクロファージを灌流吸着法を使用して血管移植片に播種します。最後に、マクロファージを播種した血管移植片をカフ法を用いてマウス頸動脈に移植し、 in vivo 移植の1か月後に開存性と再生特性を解析します。
この技術は、マウスモデルにおける血管移植の有効性と成功率を高める可能性を秘めています。さらに、このモデルを使用して、血管再生における細胞源、重要な遺伝子、および活性因子の根底にあるメカニズムを調べることができ、新しい小径血管移植片の機能修飾と開発に理論的および方法論的なサポートを提供します。
プロトコル
すべての動物実験は、中国医学院放射線医学研究所の動物実験倫理委員会によって承認され、実験動物の世話と使用に関するガイドラインに準拠していました。この研究では、体重25〜30 gの6〜8週齢の雄C57BL / 6マウスを使用しました。本試験で使用した試薬および機器の詳細は、 資料表に記載されています。
1. 小径血管グラフトの作製
注:エレクトロスピニング技術を使用して小径PCL血管移植片を作製します13。
- ヘキサフルオロイソプロパノール(HFIP)中のPCL溶液を10%、15%、および20%(w / v)で室温(RT)で12時間調製します。
- PCL溶液を10 mLシリンジにロードし、21 Gのステンレス製ニードルでシリンジを位置決めします。
- タングステン鋼製のマンドレル(直径0.7 mm、長さ20 cm)を収集装置に置きます。
- エレクトロスピニング技術を使用して、PCL血管移植片の9つのグループを作製します。高容量を接続しますtage電源を針に。内径0.7mmのタングステン鋼棒を針の前の一定の距離で受信装置として配置します。
注:血管移植片群の説明は 表1に記載されており、血管移植片のパラメータは 表2に詳述されています。 - 作製した血管移植片を避難プロセスにかけます。血管移植片を真空乾燥オーブンに72時間置き、残留溶媒を除去します。
- 移植片を医療用アルコールに30分間浸し、一晩紫外線にさらして滅菌します。
- 走査型電子顕微鏡(SEM)を使用して、血管移植片の顕微鏡的形態を観察します。血管移植片を導電性接着剤でSEM試料ステージに取り付け、金スパッタリング装置に入れてコーティングします。
- SEMを用いて、15kVの加速電圧で血管移植片の構造と繊維形態を観察します。ImageJソフトウェアを使用して、SEM画像(n = 5)から繊維径と細孔径を測定します。
- 引張試験機を使用して、血管グラフトの機械的特性(引張特性と弾性特性)を評価します。血管移植片の上端と下端を、1cm間隔で固定されたクランプでクランプします。
- 血管移植片を破裂するまで10 mm / minの速度で伸ばします。.引張試験機から応力-ひずみ曲線を収集します。
- 最大荷重(2-15 N)、破断時応力(5-30 MPa)、破断時ひずみ(200%-1500%)、弾性率(1-20 MPa)14などの機械的パラメータを計算します。
- 統計ソフトウェアとグラフ作成ソフトウェアを使用して統計分析を実行します。データを平均±標準偏差として表します。一元配置分散分析(ANOVA)でテューキーのポストホック検定を使用して、複数のグループ間の単変量差を解析および比較します。*P < 0.05、**P < 0.01、***P < 0.001。
2. 血管移植片へのマクロファージの播種
注:すべての溶液と材料が無菌であることを確認してください。すべての操作は細胞培養室内で行います。
- RAW264.7(マウス単球マクロファージ)を付着条件下でフラスコで培養します(図1A)。1%ペニシリン-ストレプトマイシンと10%ウシ胎児血清を添加した完全なダルベッコ改変イーグルス培地(DMEM)を使用して細胞培養培地を調製します。フラスコを5%の二酸化炭素を含む37°Cのインキュベーターに入れます。
- 細胞スクレーパーを使用してマクロファージを収集します。1mLピペットで培地を捨て、PBSで細胞を洗浄します。
- 2 mLの新鮮な培地を培養フラスコに加え、セルスクレーパーで表面をやさしくこすります。採取した細胞をチューブに移し、1,000 x g で室温で5分間遠心分離します。5細胞×106細胞を 100 μLの完全培地に再懸濁します。
- DMEMを充填した15 mLチューブにPCL血管グラフト(長さ1 cm)を入れ、4,000 x g で5分間遠心分離します。グラフトがチューブの底に沈むまでこのプロセスを数回繰り返し、DMEMによる材料の完全浸透を確保します。
- 濾紙を敷き詰めた10cmのシャーレを用意します。湿らせたPCL血管グラフトを濾紙に置き、転がして余分な媒体を取り除きます。
- 10 μLのピペットを使用して10 μLの細胞懸濁液を採取し、血管移植片の一端に注入します。血管グラフトを濾紙上で回転させて、懸濁液の均一な分布を促進します。各端を5回注入し、合計10回の注入を行います(図1B、C)。
- マクロファージをロードした血管移植片を、1 mLの完全培地を含む24ウェルプレートに入れ、細胞培養インキュベーターで2時間インキュベートしてから移植します。
- グラフト壁内の細胞の分布を決定します。マクロファージをロードした血管移植片を光干渉断層撮影法(OCT)化合物に埋め込み、凍結切片化を行います。細胞核を4',6-ジアミジノ-2-フェニルリンドール(DAPI)で染色し、蛍光顕微鏡で観察します。
3. マウス頸動脈移植モデル
注:動物の処置のために無菌の手術エリアを維持してください。手術前に、すべての手術器具と使い捨て器具を滅菌してください。
- 健康な雄のC57BL/6マウスを3匹選択し、それぞれの体重は25〜30gです。手術の前日にマウスを絶食します。各動物に1つの血管移植片を移植し、合計3つの移植片を移植します。
- ナイロンチューブからカフを作成し(図2A)、 図2Bの血管カフ技術の概略図を示します。
- ペントバルビタールナトリウムを 50 mg/kg の濃度で腹腔内注射することによりマウスに麻酔をかけます (施設で承認されたプロトコルに従います)。筋肉の弛緩と呼吸を確保することにより、効果的な麻酔を確認します。麻酔中の乾燥を防ぐために、ワセリン眼科用軟膏を目に塗ります。.
- マウスを手術台の仰臥位に置き、首の毛を取り除きます。ヨードフォアで手術部位を滅菌します。無菌環境を維持するために、非外科的領域を滅菌ガーゼで覆います(図3A)。
- 眼科用ハサミを使用して、下顎骨から胸骨まで正中線切開(長さ1.5〜2 cm)を行います。左唾液腺を浮上させ、左中乳突筋を切除して手術視野を広げます。マイクロピンセットを使用して左総頸動脈を露出させます(図3B)。
- マイクロ鉗子を使用して左頸動脈を分離します(図3C)。
- 頸動脈を中央部の2か所に9-0縫合糸を使用して結紮します。マイクロハサミを使用して、2つの結紮糸の間の動脈を切断します。カフを両端の動脈に通し、動脈クリップを使用して動脈とカフを一緒に固定します(図3D)。
- 動脈を外側に向け、カフ本体を覆い、マイクロ鉗子付きの9-0縫合糸を使用してカフに固定します(図3E)。
- 頸動脈の両端の間に血管移植片を移植するには、移植片の端を動脈カフの上にスライドさせ、9-0縫合糸で固定します(図3F)。
注:カフ、頸動脈、および血管移植片の寸法データを表3に示します。移植片とカフの直径はマウスの頸動脈の直径と密接に一致するが、吻合部の内腔の直径と移植片の直径との間には不一致が存在する。吻合部内腔径は、カフ内径(0.5mm)から頸動脈壁の厚さ(0.1mm)の2倍を差し引いて計算し、内腔径は0.3mmとなります。血管移植片の内径は0.7mmで、約2.3倍(0.7mm/0.3mm=2.3)のミスマッチが生じます。 - 両端の動脈クリップを取り外し、生理食塩水で移植部位を洗浄します。遠位動脈の脈動を観察することにより、血管移植片の開存性を評価します(図3G)。
- 左唾液腺の位置を変更し、6-0縫合糸を使用して手術部位を閉じます(図3H)。
4. 手続き後のケアと分析
- マウスを37°Cのインキュベーターに移し、意識を取り戻すまでバイタルサインを継続的に監視します。
- 術後の痛みを和らげるために5 mg / kgカルビノールを注射します。
- 回復期間中はマウスを監視し、完全に回復するまでグループハウジングに戻さないでください。
- 移植後1ヶ月でマウスに麻酔をかけ、組織学的解析のために血管移植片サンプルを採取する9。
- CO2 窒息による安楽死と、それに続く倫理ガイドラインに従って子宮頸部脱臼を行います。
結果
異なるパラメータを持つ小径の血管移植片を、エレクトロスピニングにより成功裏に調製しました。SEM画像では、繊維が均一に分布し、グラフト壁内に不規則な配置を示し、細孔構造が存在することが明らかになりました(図4)。PCLの濃度が増加すると、繊維径と細孔径の両方が増加しました。各血管移植群の具体的な値を表2に示します。機械的試験の結果、すべての血管移植片が必要な機械的基準を満たしていることが示されました。PCL濃度が高くなり、血管壁の厚さが大きくなると、最大破断時の荷重とひずみが増加し(図5A-C)、弾性率は減少しました(図5D)。これらの知見に基づき、PCL濃度が15%、壁厚が150μmの小径血管移植片を、その後の実験に最適な移植片として選択しました。
この研究では、灌流吸着法を使用してマクロファージを血管移植片に播種しました。SEM分析により、マクロファージが血管移植片に首尾よく播種され、均一な分布を示したことが確認されました(図6A)。DAPI染色を行った横断グラフトにより、播種されたマクロファージがグラフト内腔からグラフト壁に浸潤していることが明らかになりました(図6B)。
in vivo移植から30日後の生存率は100%で、移植された3つの血管移植片のうち2つは特許を保持しており、これはマウスモデルで満足のいく結果でした。実体顕微鏡下では、動脈瘤やグラフトの識別可能な線維性カプセル化は観察されませんでした(図7A)。細胞浸潤と組織再生の程度は、組織学的分析を通じてさらに評価されました。ヘマトキシリンおよびエオシン(H&E)染色により、グラフト壁内にかなりの細胞浸潤が見られ、グラフトの内部内腔内に新組織が形成されていることが明らかになりました(図7B)。CD31免疫蛍光染色は、移植片の内腔内の内皮組織の単層の再生を実証し、内皮細胞の被覆率は比較的無傷でした(図7C)。

図1:細胞播種手順(A)RAW264.7細胞の培養。スケールバー:100μm.(B)細胞播種プロセスの概略図。(C)RAW264.7細胞を灌流吸着法を用いて移植壁に播種した。この図の拡大版を表示するには、ここをクリックしてください。

図2:カフ技術。 (A)血管カフの準備。(B)血管カフ技術の概略図。血管移植片は、この方法を使用して頸動脈に移植されました。 この図の拡大版を表示するには、ここをクリックしてください。

図3:マウスモデルにおける血管移植の外科的処置(A)麻酔薬の注射、マウスの仰臥位への位置決め、および足の固定。(B)手術部位の露出。(C)頸動脈の分離。(D)頸動脈の周りのカフの配置。(E)カフ本体上の動脈の外転と9-0縫合糸を使用した固定。(F)動脈カフ上の血管移植片のスリーブと縫合。(G)血管クランプの取り外し。(H)スキンクロージャー。この図の拡大版を表示するには、ここをクリックしてください。

図4:エレクトロスピニングポリカプロラクトン(PCL)血管移植片の形態。 代表的な走査型電子顕微鏡(SEM)画像は、血管移植片の明確に定義された線維構造を示しています。スケールバー:500μm、50μm(拡大画像)。 この図の拡大版を表示するには、ここをクリックしてください。

図5:エレクトロスピニングPCL血管移植片の機械的特性。 縦方向の血管グラフトの機械的特性評価、最大荷重(A)、最大応力(B)、破断時ひずみ(C)、弾性率(D)を示します。データは平均±標準偏差(SD)(n = 3)で表されます。*P < 0.05、**P < 0.01、***P < 0.001、一元配置分散分析とそれに続くテューキーの事後検定。 この図の拡大版を表示するには、ここをクリックしてください。

図6:細胞負荷グラフトの特性評価。 (A)代表的なSEM画像と(B)細胞負荷血管移植片の4',6-ジアミジノ-2-フェニルインドール(DAPI)染色、マクロファージ移植の成功と均一な分布を示しています。スケールバー:30 μmおよび100 μmこの 図の拡大版を表示するには、ここをクリックしてください。
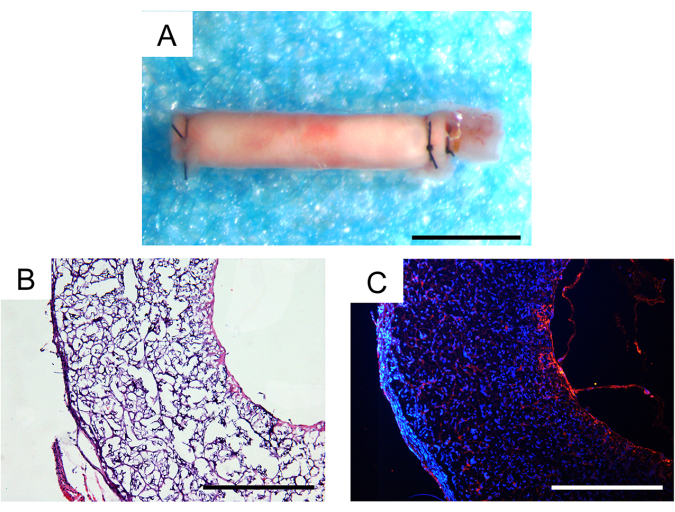
図7:移植後1ヶ月後の外植血管移植片の組織学的解析 (A)動脈瘤形成や線維性カプセル化がない立体画像。スケールバー:500 μm. (B) ヘマトキシリンおよびエオシン(H&E)染色は、良好な細胞化および組織再生を示しています。スケールバー:200 μm. (C) 管腔表面に内皮細胞の単層を明らかにするCD31免疫蛍光染色。スケールバー:200μmこの 図の拡大版を表示するには、ここをクリックしてください。
| 群 | PCLの濃度 ソリューション(%) | 血管グラフトの厚さ(μm) | ニードルコレクター距離(cm) | 流量 (mL/h) | 電圧 (kV) |
| 10%-100 | 10 | 100 | 15 | 2 | 18 |
| 10%-150 | 10 | 150 | 15 | 2 | 18 |
| 10%-200 | 10 | 200 | 15 | 2 | 18 |
| 15%-100 | 15 | 100 | 15 | 2 | 18 |
| 15%-150 | 15 | 150 | 15 | 2 | 18 |
| 15%-200 | 15 | 200 | 15 | 2 | 18 |
| 20%-100 | 20 | 100 | 13 | 8 | 12 |
| 20%-150 | 20 | 150 | 13 | 8 | 12 |
| 20%-200 | 20 | 200 | 13 | 8 | 12 |
表1:血管移植群の説明。 PCL、ポリカプロラクトン。
| 群 | 繊維径 (μm) | 細孔径 (μm) |
| 10%-100 | 0.51±0.12 | 2.48±1.38 |
| 10%-150 | 0.91±0.4 | 1.83±0.84 |
| 10%-200 | 0.73±0.35 | 2.24±0.83 |
| 15%-100 | 1.85±0.3 | 8.91±2.87 |
| 15%-150 | 1.82±0.34 | 8.41±2.72 |
| 15%-200 | 2.18±0.47 | 9.59±3.01 |
| 20%-100 | 3±611月02日 | 13.95±4.7 |
| 20%-150 | 3.06±0.56 | 13.12±3.36 |
| 20%-200 | 3.46±0.66 | 13.92±4.19 |
表2:さまざまな血管移植片の構造パラメータ。
| 群 | 内径(mm) | 外径(mm) | 壁の厚さ(μm) | 長さ(cm) |
| 頸動脈 | 0.5-0.6 | 0.6-0.7 | 100 | / |
| 血管移植片 | 0.7 | 1 | 150 | 0.8 |
| 袖口 | 0.5 | 0.63 | 65 | / |
表3:カフ、頸動脈、および血管移植片の寸法データ。
ディスカッション
マウス頸動脈に組織工学的血管移植片を移植するためのカフ技術の使用は、心血管研究における大きな進歩を表しています15。この技術の重要なステップには、細胞播種と移植片移植が含まれます。この研究では、灌流吸着アプローチを採用してマクロファージの播種密度を高め、不均一な細胞播種と細胞生存率の低下に関連する問題に対処しました。この方法により、マクロファージは血管移植壁に浸潤し、それを均等に分配することができました。
血管移植に関しては、エンドツーエンドの吻合16とは対照的に、カフ技術は、特により小さな直径の血管に適用される場合、狭窄の発生率が高いことと関連している可能性がある。この影響を最小限に抑えるために、マウス頸動脈の内径と外径が密接に一致するカフが選択されました。関連するディメンションを 表3に示します。
この技術は、マウス頸動脈への血管移植片移植のためのより簡単な外科的処置を容易にします。小径血管移植片の以前の研究で最も頻繁に使用された動物モデルには、ヒツジ頸静脈動静脈瘻とラット腹部動脈移植モデルが含まれます17,18。これらのモデルは、血管移植片の機械的強度と組織リモデリング能力を評価するのに効果的です。しかし、その根底にあるメカニズムを解明する能力には限界があります。遺伝子改変マウスは、血管再生メカニズムを研究するための重要なモデルとして浮上しており、他の動物モデルの限界に対処しています。
例えば、アポリポタンパク質E(ApoE)ノックアウトマウスは、高コレステロール血症やアテローム性動脈硬化症の病変を自発的に発症します19、これは血管移植を必要とする臨床状態をシミュレートするための貴重なモデルとなっています。ApoEノックアウトマウスにおける血管の開存性と再生の評価は、血管移植片の臨床翻訳のための重要な参照データを提供します。さらに、遺伝子欠損マウスを利用して、血管再生における主要な遺伝子の役割を調べることができます。血管機能の重要な調節因子である内皮一酸化窒素合成酵素(eNOS)は、一酸化窒素の主要な供給源です20。eNOS遺伝子欠損マウスは、この遺伝子が血管リモデリングに影響を与えるメカニズムを解明するための研究モデルとして機能します。さらに、血管組織の再生に関与する細胞の起源は、レポーター遺伝子ツールマウス21,22を用いたin vivo細胞標識および系統追跡を通じて探索することができる。
この技術には、使用する動物の数と移植の期間に関して一定の制限があります。本研究は、主に、短期的な in vivo アプローチを使用して、この移植方法の実現可能性を評価することに焦点を当てました。今後の研究では、サンプルサイズを増やし、動脈瘤の形成、開存性、および内膜過形成に対するこの方法の影響を包括的に評価するための長期評価を実施する必要があります。
また、移植片の開存率は66.6%であり、これは吻合部位の直径のミスマッチ(2.3倍)の影響を受けている可能性がある。このミスマッチは、局所的な血流障害を引き起こし、血栓症のリスクを高める可能性があります。直径の不一致を減らし、開存率への影響を調査するためにカフの設計を最適化するには、さらなる研究が必要です。
結論として、カフ技術に基づくマウス頸動脈移植モデルは、小径血管移植片の生物学的評価のためのシンプルで効果的な動物モデルを提供します。さらに、血管組織のリモデリングにおける様々な細胞タイプの役割や、その根底にある再生メカニズムの解明も可能になります。
開示事項
著者は、相反する金銭的利益を持っていません。
謝辞
本研究の資金は、中国国家自然科学基金会のプロジェクト(第32101098号、第32071356号、第82272158号)とCAMS Innovation Fund for Medical Sciences(第2022-I2M-1-023号)から資金提供を受けました。
資料
| Name | Company | Catalog Number | Comments |
| 1% penicillin-streptomycin | Solarbio | P1400 | |
| 10% fetal bovine serum | Gibco | A5256701 | |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 4',6-Diamidino-2-Phenylindole (DAPI) | SouthernBiotech | 0100-20 | |
| Alcohol | Tianjin Chemical Reaggent Company | 1083 | |
| Anti-Mouse CD31 primary antibody | BD Bioscience | 553370 | |
| Arterial clips | RWD Life Science | R31005-06 | |
| C57BL/6 mice | Beijing Vital River Laboratory Animal Technology Company | ||
| Dulbecco's modified eagle medium (DMEM) | Gibco | 11966025 | |
| Electrostatic spinning machine | Yunfan Technology | DP30 | |
| Goat anti-rat IgG (Alexa Fluor 555) | Invitrogen | A-21434 | |
| Hematoxylin and eosin (H&E) | Solarbio | G1120 | |
| Hexafluoroisopropanol (HFIP) | McClean | H811026 | |
| Iodophor | LIRCON | V273068 | |
| Microscissors | World Precision Instruments | 14124 | |
| Microtweezers | World Precision Instruments | 500338 | |
| Normal goat serum | Boster | AR0009 | |
| Normal saline | Cisen Pharmaceutical company | H20113369 | |
| Nylon tube for cuff | Portex | ||
| Optimal cutting temperature compound (OCT) | Sakara | 4583 | |
| Pentobarbital sodium | Sigma | P3761 | |
| Phosphate Buffered Saline (PBS) | Solarbio | P1003 | |
| Poly(ε-caprolactone) (PCL) pellets (Mn = 80,000) | Sigma | 704067 | |
| RAW264.7 macrophages | Biyuntian Biotechnology | ||
| Scanning electron microscope (SEM) | Zeiss | PHENOM-XL-G2 | |
| Surgical sutures 6-0 | Ningbo Chenghe microapparatus factory | 220919 | |
| Surgical sutures 9-0 | Ningbo Chenghe microapparatus factory | 221006 | |
| Syringe | Changqiang Medical Devices | 0197 | |
| Tensile testing machine | Instron | WDW-5D |
参考文献
- Adhikary, D., Barman, S., Ranjan, R., Stone, H. A systematic review of major cardiovascular risk factors: A growing global health concern. Cureus. 14 (10), e30119 (2022).
- Alexander, J. H., Smith, P. K. Coronary-artery bypass grafting. N Engl J Med. 374 (20), 1954-1964 (2016).
- Jeong, Y., Yao, Y., Yim, E. K. F. Current understanding of intimal hyperplasia and effect of compliance in synthetic small diameter vascular grafts. Biomater Sci. 8 (16), 4383-4395 (2020).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: Two phase 2 single-arm trials. Lancet. 387 (10032), 2026-2034 (2016).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Sci Transl Med. 11 (485), eaau6934 (2019).
- Wang, C., Li, Z., Zhang, L., Sun, W., Zhou, J. Long-term results of triple-layered small diameter vascular grafts in sheep carotid arteries. Med Eng Phys. 85, 1-6 (2020).
- Tanaka, T., et al. Evaluation of small-diameter silk vascular grafts implanted in dogs. JTCVS Open. 6, 148-156 (2021).
- Jin, X., et al. Preparation of small-diameter tissue-engineered vascular grafts electrospun from heparin end-capped PCL and evaluation in a rabbit carotid artery replacement model. Macromol Biosci. 19 (8), e1900114 (2019).
- Xiao, Y., et al. Fabrication of small-diameter in situ tissue engineered vascular grafts with core/shell fibrous structure and a one-year evaluation via rat abdominal vessel replacement model. Biomater Adv. 165, 214018 (2024).
- Wei, Y., Wang, F., Guo, Z., Zhao, Q. Tissue-engineered vascular grafts and regeneration mechanisms. J Mol Cell Cardiol. 165, 40-53 (2022).
- Cleary, M. A., et al. Vascular tissue engineering: The next generation. Trends Mol Med. 18 (7), 394-404 (2012).
- Roh, J. D., et al. Tissue-engineered vascular grafts transform into mature blood vessels via an inflammation-mediated process of vascular remodeling. Proc Natl Acad Sci U S A. 107 (10), 4669-4674 (2010).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- Wu, Y., et al. Peptide-tethered vascular grafts enable blood vessel regeneration via endogenous cell recruitment and neovascularization. Compos B Eng. 252, 110504 (2023).
- Hu, Y., Xu, Q. Vessel graft atherosclerosis in murine models. Curr Drug Targets. 9 (3), 239-250 (2008).
- Qin, K., et al. Implantation of electrospun vascular grafts with optimized structure in a rat model. J Vis Exp. (136), e57340 (2018).
- Geelhoed, W. J., et al. A novel method for engineering autologous non-thrombogenic in situ tissue-engineered blood vessels for arteriovenous grafting. Biomaterials. 229, 119577 (2020).
- Wu, P., et al. Construction of vascular graft with circumferentially oriented microchannels for improving artery regeneration. Biomaterials. 242, 119922 (2020).
- Vasquez, E. C., Peotta, V. A., Gava, A. L., Pereira, T. M., Meyrelles, S. S. Cardiac and vascular phenotypes in the apolipoprotein e-deficient mouse. J Biomed Sci. 19 (1), 22 (2012).
- Garcia, V., Sessa, W. C. Endothelial nos: Perspective and recent developments. Br J Pharmacol. 176 (2), 189-196 (2019).
- He, L., et al. Enhancing the precision of genetic lineage tracing using dual recombinases. Nat Med. 23 (12), 1488-1498 (2017).
- Wang, F., et al. Nitric oxide improves regeneration and prevents calcification in bio-hybrid vascular grafts via regulation of vascular stem/progenitor cells. Cell Rep. 39 (12), 110981 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved