Method Article
Implantation eines Tissue-Engineering-Gefäßtransplantats in die Halsschlagader der Maus mittels Manschettentechnik
In diesem Artikel
Zusammenfassung
In dieser Arbeit wird ein Protokoll für die Implantation eines Tissue-Engineering-Gefäßtransplantats in die Halsschlagader der Maus mit Hilfe der Manschettentechnik vorgestellt, das ein geeignetes Tiermodell für die Untersuchung von Regenerationsmechanismen des Gefäßgewebes bietet.
Zusammenfassung
Die Entwicklung von Gefäßtransplantaten mit kleinem Durchmesser ist ein globales Unterfangen, an dem zahlreiche Forschungsgruppen beteiligt sind. Tierversuche spielen eine zentrale Rolle bei der Bewertung der Wirksamkeit und Sicherheit von Gefäßtransplantaten, insbesondere in Ermangelung klinischer Anwendungen. Im Vergleich zu alternativen Tiermodellen bietet das Mausimplantationsmodell mehrere Vorteile, darunter einen gut definierten genetischen Hintergrund, eine ausgereifte Methode zur Konstruktion von Krankheitsmodellen und ein einfaches chirurgisches Vorgehen. Basierend auf diesen Vorteilen wurde in der vorliegenden Studie eine einfache Manschettentechnik für die Implantation von Tissue-Engineering-Gefäßtransplantaten in die Halsschlagader der Maus entwickelt. Diese Technik begann mit der Herstellung von Polycaprolacton (PCL)-Gefäßtransplantaten mit kleinem Durchmesser durch elektrostatisches Spinnen, gefolgt von der Aussaat von Makrophagen auf die Transplantate durch Perfusionsadsorption. Anschließend wurden die zellularisierten Tissue-Engineering-Gefäßtransplantate mit Hilfe der Manschettentechnik in die Halsschlagader der Maus transplantiert, um die Durchgängigkeit und Regenerationsfähigkeit zu bewerten. Nach 30 Tagen In-vivo-Implantation erwies sich die Durchgängigkeit der Gefäße als zufriedenstellend, mit Hinweisen auf eine Regeneration des Neogewebes und die Bildung einer Endothelschicht innerhalb des Lumens der Transplantate. Alle Daten wurden mit Hilfe von Statistik- und Grafiksoftware analysiert. In dieser Studie wurde erfolgreich ein Implantationsmodell der Halsschlagader der Maus etabliert, mit dem die zellulären Quellen der Gefäßregeneration und die Wirkmechanismen von Wirkstoffen erforscht werden können. Darüber hinaus bietet es theoretische Unterstützung für die Entwicklung neuartiger Gefäßtransplantate mit kleinem Durchmesser.
Einleitung
Die Prävalenz und Mortalität von Herz-Kreislauf-Erkrankungen nehmen weltweit zu und stellen ein erhebliches Problem für die öffentliche Gesundheit dar1. Die vaskuläre Bypass-Transplantation ist ein wirksamer Eingriff bei schweren koronaren Herzkrankheiten und peripheren Gefäßerkrankungen2. Die Verwendung von künstlichen Gefäßtransplantaten mit Durchmessern von mehr als 6 mm ist im klinischen Umfeld gut dokumentiert. Umgekehrt sind Personen mit einem Durchmesser unter 6 mm anfällig für Thrombosen und Intimahyperplasie, was zu einem erheblichen Risiko für Restenoseführen kann 3. Trotz erheblicher Fortschritte in der Forschung und Entwicklung von Gefäßtransplantaten mit kleinem Durchmesser in den letzten Jahren, bei denen sich mehrere Produkte der klinischen Anwendung nähern, bleiben mehrere Herausforderungenbestehen 4,5. Dazu gehören eine relativ niedrige Langzeitdurchgängigkeit, eine eingeschränkte Gefäßregeneration und ein unzureichendes Verständnis des Regenerationsmechanismus.
Die präklinische Evaluierung neuartiger Gefäßtransplantate mit kleinem Durchmesser beruht auf der In-vivo-Implantation in verschiedenen Tiermodellen. Zu den am häufigsten verwendeten Modellen gehören die Implantationsmodelle für die Halsschlagader von Schafen, die Oberschenkelarterie des Hundes, die Karotisarterie des Kaninchens und die Implantationsmodelle für die Baucharterie von Ratten 6,7,8,9. Die Durchgängigkeit von Gefäßtransplantaten kann bei mittelgroßen bis großen Tieren wie Schafen, Schweinen und Hunden beurteilt werden. Diese Studien sind jedoch aufgrund des erforderlichen Fachwissens und der erforderlichen Ausrüstung mit erheblichen Kosten verbunden. Darüber hinaus stellt ihre technische Komplexität eine Herausforderung bei der Implementierung dar. Im Gegensatz dazu fehlen in Kleintiermodellen wie Kaninchen und Ratten gut etablierte transgene Spezies mit klar definiertem genetischen Hintergrund, was ein erhebliches Hindernis bei der Untersuchung der Mechanismen der vaskulären Regeneration darstellt.
Im Vergleich zu den oben genannten Tiermodellen bietet das Mausmodell ein relativ einfaches chirurgisches Vorgehen, eine etablierte Methodik zur Erzeugung gentechnisch veränderter Mäuse und einen klar definierten genetischen Hintergrund. Der geringe Durchmesser der Mausblutgefäße macht die End-to-End-Anastomose bei der Gefäßtransplantation jedoch technisch komplex, erfordert viel Fachwissen und führt zu einer relativ geringen Erfolgsquote. Um die Komplexität des Verfahrens zu reduzieren und die Erfolgsrate der Implantation von Gefäßtransplantaten zu verbessern, wurde in der vorliegenden Studie die Manschettentechnik in einem Mausmodell zur Implantation der Halsschlagader eingesetzt.
Nach der In-vivo-Implantation können Gefäßtransplantate endogene Zellen rekrutieren, die zur Regeneration des Gefäßgewebes beitragen. Das Vorhandensein dieser Zellen erleichtert die Endothelisierung und Regeneration der glatten Muskelschicht von Transplantaten. 10. Die Quelle und die Art der Zellen, die an der Regeneration des Gefäßgewebes beteiligt sind, sind jedoch unklar, und es werden mehrere konkurrierende Theorien untersucht11. Unter diesen hat sich die Forschung auf die Rolle von Entzündungs- und Stammzellen konzentriert. Breuer et al. säten menschliche Monozyten aus dem Knochenmark (hBMCs) auf Gefäßtransplantate und fanden heraus, dass die ausgesäten Zellen durch die Freisetzung des Monozyten-Chemoattractant-Proteins-1 (MCP-1) Wirtszellen in die Transplantatwand rekrutierten und dadurch die Regeneration des Gefäßgewebesförderten 12. In dieser Studie wurde eine effiziente Perfusionsadsorptionszell-Seeding-Methode vorgeschlagen und erfolgreich eingesetzt, um Makrophagen auf Polycaprolacton (PCL) Gefäßtransplantate mit kleinem Durchmesser zu säen. Nach der Implantation zeigten diese Zellen eine anhaltende Lebensfähigkeit.
Dieser Artikel beschreibt die Methodik zur Herstellung von Tissue-Engineering-Gefäßtransplantaten und das Verfahren zur Implantation der Halsschlagader bei Mäusen mit der Manschettentechnik. Der Prozess beginnt mit der Herstellung von PCL-Gefäßtransplantaten mit kleinem Durchmesser und definierten Parametern durch elektrostatisches Spinnen. Anschließend werden die Transplantate, die für die Implantation als geeignet erachtet werden, einer mechanischen Prüfung unterzogen. Makrophagen werden dann mit der Perfusionsadsorptionsmethode auf die Gefäßtransplantate ausgesät. Schließlich werden mit Makrophagen gesäte Gefäßtransplantate mit Hilfe der Manschettentechnik in die Halsschlagader der Maus implantiert, und die Durchgängigkeit und regenerativen Eigenschaften werden nach einem Monat der In-vivo-Implantation analysiert.
Diese Technik hat das Potenzial, die Wirksamkeit und Erfolgsraten der Gefäßtransplantation in Mausmodellen zu verbessern. Darüber hinaus kann das Modell verwendet werden, um die Mechanismen zu untersuchen, die Zellquellen, zentralen Genen und aktiven Faktoren der Gefäßregeneration zugrunde liegen, und bietet theoretische und methodische Unterstützung für die funktionelle Modifikation und Entwicklung neuartiger Gefäßtransplantate mit kleinem Durchmesser.
Protokoll
Alle tierexperimentellen Verfahren wurden von der Ethikkommission für Tierversuche des Instituts für Strahlenmedizin der Chinesischen Akademie der Medizinischen Wissenschaften genehmigt und entsprachen den Richtlinien für die Pflege und Verwendung von Labortieren. In dieser Studie wurden männliche C57BL/6-Mäuse im Alter von 6-8 Wochen mit einem Körpergewicht von 25-30 g verwendet. Einzelheiten zu den in dieser Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Herstellung von Gefäßtransplantaten mit kleinem Durchmesser
HINWEIS: Herstellung von PCL-Gefäßtransplantaten mit kleinem Durchmesser unter Verwendung der Elektrospinning-Technik13.
- PCL-Lösungen mit 10 %, 15 % und 20 % (w/v) in Hexafluorisopropanol (HFIP) bei Raumtemperatur (RT) für 12 h herstellen.
- Laden Sie die PCL-Lösungen in eine 10-ml-Spritze und positionieren Sie die Spritze mit einer 21-G-Edelstahlnadel.
- Legen Sie einen Dorn aus Wolframstahl (0,7 mm Durchmesser, 20 cm Länge) auf das Entnahmeinstrument.
- Stellen Sie neun Gruppen von PCL-Gefäßtransplantaten mit der Elektrospinning-Technik her. Schließen Sie ein Hochspannungsnetzteil an die Nadel an. Positionieren Sie einen Wolframstahlstab mit einem Innendurchmesser von 0,7 mm in festem Abstand vor der Nadel als Aufnahmevorrichtung.
HINWEIS: Die Beschreibung der Gefäßtransplantatgruppen ist in Tabelle 1 enthalten, und die Parameter der Gefäßtransplantate sind in Tabelle 2 aufgeführt. - Die hergestellten Gefäßtransplantate werden einem Evakuierungsprozess unterzogen. Legen Sie die Gefäßtransplantate für 72 Stunden in einen Vakuumtrockenofen, um Lösungsmittelreste zu entfernen.
- Sterilisieren Sie die Transplantate, indem Sie sie 30 Minuten lang in medizinischen Alkohol tauchen und über Nacht UV-Licht aussetzen.
- Beobachten Sie die mikroskopische Morphologie der Gefäßtransplantate mit einem Rasterelektronenmikroskop (REM). Befestigen Sie die Gefäßtransplantate mit leitfähigem Klebstoff auf dem REM-Probentisch und legen Sie sie zur Beschichtung in das Goldsputtergerät.
- Beobachten Sie die Struktur und Fasermorphologie der Gefäßtransplantate mit REM bei einer Beschleunigungsspannung von 15 kV. Messen Sie den Faserdurchmesser und die Porengröße aus REM-Bildern (n = 5) mit der ImageJ-Software.
- Bewerten Sie die mechanischen Eigenschaften (Zug- und Elastizitätseigenschaften) der Gefäßtransplantate mit einer Zugprüfmaschine. Klemmen Sie das obere und untere Ende des Gefäßtransplantats mit festen Klammern im Abstand von 1 cm fest.
- Dehnen Sie das Gefäßtransplantat mit einer Geschwindigkeit von 10 mm/min bis zur Ruptur. Erfassen Sie die Spannungs-Dehnungs-Kurve von der Zugprüfmaschine.
- Berechnen Sie mechanische Parameter, einschließlich maximaler Belastung (2-15 N), Bruchspannung (5-30 MPa), Bruchdehnung (200 %-1500 %) und Elastizitätsmodul (1-20 MPa)14.
- Führen Sie statistische Analysen mit Statistik- und Grafiksoftware durch. Geben Sie Daten als Mittelwert ± Standardabweichung aus. Analysieren und vergleichen Sie univariate Unterschiede zwischen mehreren Gruppen mit dem Post-hoc-Test von Tukey in unidirektionaler ANOVA. *P < 0,05, **P < 0,01, ***P < 0,001.
2. Aussaat von Makrophagen auf Gefäßtransplantate
HINWEIS: Stellen Sie sicher, dass alle Lösungen und Materialien steril sind. Führen Sie alle Vorgänge im Zellkulturraum durch.
- Kultur RAW264.7 (Monozyten-Makrophagen der Maus) in Kolben unter adhärenten Bedingungen (Abbildung 1A). Bereiten Sie das Zellkulturmedium mit vollständigem modifiziertem Eagle-Medium (DMEM) von Dulbecco vor, das mit 1 % Penicillin-Streptomycin und 10 % fötalem Rinderserum ergänzt wird. Die Kolben werden in einen 37 °C heißen Inkubator mit 5 % Kohlendioxid gestellt.
- Sammeln Sie Makrophagen mit einem Zellschaber. Entsorgen Sie das Medium mit einer 1-ml-Pipette und waschen Sie die Zellen mit PBS.
- 2 ml frisches Medium werden in den Kulturkolben gegeben und die Oberfläche vorsichtig mit einem Zellschaber abgekratzt. Die gesammelten Zellen in ein Röhrchen umfüllen und bei 1.000 x g für 5 min bei Raumtemperatur zentrifugieren. 5 × 106 Zellen werden in 100 μl vollständiges Medium resuspendiert.
- Legen Sie ein PCL-Gefäßtransplantat (1 cm lang) in ein mit DMEM gefülltes 15-ml-Röhrchen und zentrifugieren Sie es 5 Minuten lang bei 4.000 x g . Wiederholen Sie diesen Vorgang mehrmals, bis das Transplantat auf den Boden des Röhrchens sinkt, um eine vollständige Infiltration des Materials mit DMEM zu gewährleisten.
- Bereiten Sie eine 10 cm große Petrischale vor, die mit einer Schicht Filterpapier ausgelegt ist. Legen Sie das angefeuchtete PCL-Gefäßtransplantat auf das Filterpapier und rollen Sie es, um überschüssiges Medium zu entfernen.
- Nehmen Sie 10 μl der Zellsuspension mit einer 10 μl Pipette und injizieren Sie sie in ein Ende des Gefäßtransplantats. Drehen Sie das Gefäßtransplantat über das Filterpapier, um eine gleichmäßige Verteilung der Suspension zu ermöglichen. Injizieren Sie jedes Ende fünfmal, also insgesamt zehn Injektionen (Abbildung 1B,C).
- Legen Sie das mit Makrophagen beladene Gefäßtransplantat in eine 24-Well-Platte mit 1 ml vollständigem Medium und inkubieren Sie es vor der Implantation 2 Stunden lang in einem Zellkultur-Inkubator.
- Bestimmen Sie die Verteilung der Zellen innerhalb der Transplantatwand. Betten Sie das mit Makrophagen beladene Gefäßtransplantat in eine optische Kohärenztomographie (OCT)-Verbindung für die Kryosektion ein. Zellkerne mit 4',6-Diamidino-2-phenylindol (DAPI) färben und unter einem Fluoreszenzmikroskop betrachten.
3. Modell zur Implantation der Halsschlagader aus der Maus
HINWEIS: Halten Sie einen sterilen Operationsbereich für Eingriffe an Tieren bereit. Sterilisieren Sie alle chirurgischen Instrumente und Einwegartikel vor der Operation.
- Wählen Sie drei gesunde männliche C57BL/6-Mäuse mit einem Gewicht von jeweils 25-30 g aus. Fasten Sie die Mäuse am Tag vor der Operation. Implantieren Sie bei jedem Tier ein Gefäßtransplantat, also insgesamt drei Transplantate.
- Konstruieren Sie Manschetten aus einem Nylonschlauch (Abbildung 2A) und stellen Sie das schematische Diagramm der Gefäßmanschettentechnik in Abbildung 2B dar.
- Anästhesieren Sie die Mäuse durch intraperitoneale Injektion von Natrium-Pentobarbital in einer Konzentration von 50 mg/kg (gemäß institutionell anerkannten Protokollen). Bestätigen Sie eine wirksame Anästhesie, indem Sie die Muskelentspannung und eine gleichmäßige Atmung gewährleisten. Tragen Sie Vaseline-Augensalbe auf die Augen auf, um Trockenheit während der Anästhesie zu verhindern.
- Positionieren Sie die Maus in Rückenlage auf dem Operationstisch und entfernen Sie die Nackenhaare. Sterilisieren Sie den Operationsbereich mit einem Iodophor. Decken Sie den nicht-chirurgischen Bereich mit steriler Gaze ab, um eine sterile Umgebung zu gewährleisten (Abbildung 3A).
- Machen Sie mit einer Augenschere einen Schnitt in der Mittellinie (1,5-2 cm lang) vom Unterkiefer bis zum Brustbein. Heben Sie die linken Speicheldrüsen an und entfernen Sie den linken Cleidomastoideus-Muskel, um das chirurgische Sichtfeld zu vergrößern. Legen Sie die linke Arteria carotis communis mit einer Mikropinzette frei (Abbildung 3B).
- Isolieren Sie die linke Halsschlagader mit einer Mikrozange (Abbildung 3C).
- Lilizieren Sie die Halsschlagader an zwei Stellen im mittleren Teil mit einer 9-0-Naht. Durchschneiden Sie die Arterie zwischen den beiden Ligaturen mit einer Mikroschere. Führen Sie die Manschette an jedem Ende durch die Arterien und befestigen Sie Arterie und Manschette mit arteriellen Clips (Abbildung 3D).
- Drehen Sie die Arterie nach außen, um den Manschettenkörper zu bedecken, und befestigen Sie ihn mit einer 9-0-Naht mit einer Mikrozange an der Manschette (Abbildung 3E).
- Implantieren Sie ein Gefäßtransplantat zwischen den beiden Enden der Halsschlagader, indem Sie die Transplantatenden über die Arterienmanschette schieben und mit 9-0-Nähten sichern (Abbildung 3F).
HINWEIS: Die Maßdaten der Manschette, der Halsschlagader und des Gefäßtransplantats sind in Tabelle 3 aufgeführt. Obwohl die Durchmesser des Transplantats und der Manschette eng mit denen der Halsschlagadern der Maus übereinstimmen, besteht eine Diskrepanz zwischen dem Durchmesser des Anastomosenlumens und dem Durchmesser des Transplantats. Der Anastomosendurchmesser wird berechnet, indem die doppelte Dicke der Halsschlagaderwand (0,1 mm) vom Innendurchmesser der Manschette (0,5 mm) subtrahiert wird, was einen Lumendurchmesser von 0,3 mm ergibt. Das Gefäßtransplantat hat einen Innendurchmesser von 0,7 mm, was zu einer etwa 2,3-fachen Fehlanpassung (0,7 mm / 0,3 mm = 2,3) führt. - Entfernen Sie die arteriellen Klammern an beiden Enden und spülen Sie die Implantationsstelle mit Kochsalzlösung. Beurteilen Sie die Durchgängigkeit des Gefäßtransplantats durch Beobachtung der distalen arteriellen Pulsation (Abbildung 3G).
- Die linke Speicheldrüse wird neu positioniert und die Operationsstelle mit 6-0-Nähten verschlossen (Abbildung 3H).
4. Nachsorge und Analyse
- Bringen Sie die Maus in einen 37 °C heißen Inkubator und überwachen Sie kontinuierlich ihre Vitalfunktionen, bis sie wieder zu Bewusstsein kommt.
- Injizieren Sie 5 mg/kg Carbinol zur postoperativen Schmerzlinderung.
- Überwachen Sie die Maus während des Wiederherstellungszeitraums und geben Sie sie erst dann wieder in das Gruppengehäuse zurück, wenn sie vollständig wiederhergestellt ist.
- Betäuben Sie die Mäuse einen Monat nach der Implantation und entnehmen Sie die Gefäßtransplantatproben für die histologische Analyse9.
- Führen Sie Euthanasie durch CO2 -Erstickung mit anschließender Gebärmutterhalsluxation gemäß ethischen Richtlinien durch.
Ergebnisse
Gefäßtransplantate mit kleinem Durchmesser und unterschiedlichen Parametern wurden erfolgreich durch Elektrospinnen präpariert. REM-Aufnahmen zeigten, dass die Fasern gleichmäßig verteilt waren und eine unregelmäßige Anordnung innerhalb der Transplantatwand aufwiesen, wobei Porenstrukturen vorhanden waren (Abbildung 4). Mit zunehmender PCL-Konzentration nahmen sowohl der Faserdurchmesser als auch die Porengröße zu. Spezifische Werte für jede Gefäßtransplantatgruppe sind in Tabelle 2 aufgeführt. Die Ergebnisse der mechanischen Tests zeigten, dass alle Gefäßtransplantate die geforderten mechanischen Standards erfüllten. Die maximale Belastung und Bruchdehnung nahm mit höheren PCL-Konzentrationen und größerer Gefäßwanddicke zu (Abbildung 5A-C), während der Elastizitätsmodul abnahm (Abbildung 5D). Basierend auf diesen Erkenntnissen wurden Gefäßtransplantate mit kleinem Durchmesser und einer PCL-Konzentration von 15% und einer Wandstärke von 150 μm als optimale Transplantate für nachfolgende Experimente ausgewählt.
In dieser Studie wurden Makrophagen mit der Perfusionsadsorptionsmethode auf Gefäßtransplantate ausgesät. Die REM-Analyse bestätigte, dass Makrophagen erfolgreich auf die Gefäßtransplantate ausgesät wurden und eine gleichmäßige Verteilung aufwiesen (Abbildung 6A). Querschnittstransplantate, die einer DAPI-Färbung unterzogen wurden, zeigten, dass die ausgesäten Makrophagen aus dem Transplantatlumen in die Transplantatwand infiltriert waren (Abbildung 6B).
Dreißig Tage nach der In-vivo-Implantation lag die Überlebensrate der Tiere bei 100 %, und zwei der drei implantierten Gefäßtransplantate blieben offen, was in Mausmodellen ein zufriedenstellendes Ergebnis war. Unter dem Stereomikroskop wurden keine Aneurysmen oder erkennbare fibröse Verkapselung der Transplantate beobachtet (Abbildung 7A). Das Ausmaß der zellulären Infiltration und Geweberegeneration wurde durch histologische Analysen weiter untersucht. Die Hämatoxylin- und Eosin-Färbung (H&E) zeigte eine erhebliche zelluläre Infiltration in der Transplantatwand und die Bildung von Neogewebe im inneren Lumen des Transplantats (Abbildung 7B). Die CD31-Immunfluoreszenzfärbung zeigte die Regeneration einer einzelnen Schicht Endothelgewebes im inneren Lumen der Transplantate mit relativ intakter Endothelzellabdeckung (Abbildung 7C).

Abbildung 1: Verfahren der Zellaussaat. (A) Kultur von RAW264.7-Zellen. Maßstabsbalken: 100 μm. (B) Schematische Darstellung des Zellaussaatprozesses. (C) RAW264.7-Zellen, die mit der Perfusionsadsorptionsmethode an die Transplantatwand ausgesät werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Manschettentechnik. (A) Vorbereitung von Gefäßmanschetten. (B) Schematische Darstellung der Gefäßmanschettentechnik. Bei dieser Methode wurden Gefäßtransplantate in die Halsschlagader implantiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Chirurgisches Vorgehen bei der Implantation eines Gefäßtransplantats in einem Mausmodell. (A) Injektion von Anästhetika, Positionierung der Maus in Rückenlage und Ruhigstellung der Pfoten. (B) Freilegung des Operationsbereichs. (C) Isolierung der Halsschlagader. (D) Platzierung der Manschette um die Halsschlagader. (E) Eversion der Arterie über den Manschettenkörper und Fixierung mit einer 9-0-Naht. (F) Schlauch des Gefäßtransplantats über die arterielle Manschette und Naht. (G) Entfernung von Gefäßklemmen. (H) Verschluss der Haut. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Morphologie von Gefäßtransplantaten aus elektrogesponnenem Polycaprolacton (PCL). Repräsentative Rasterelektronenmikroskopie-Bilder (REM), die die gut definierte fibröse Struktur der Gefäßtransplantate zeigen. Maßstabsleisten: 500 μm und 50 μm (vergrößerte Bilder). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Mechanische Eigenschaften von elektrogesponnenen PCL-Gefäßtransplantaten. Mechanische Charakterisierung der Gefäßtransplantate in Längsrichtung mit maximaler Belastung (A), maximaler Belastung (B), Bruchdehnung (C) und Elastizitätsmodul (D). Die Daten werden als Mittelwert ± Standardabweichung (SD) (n = 3) ausgedrückt. *P < 0,05, **P < 0,01, ***P < 0,001, einfache ANOVA, gefolgt von Tukeys Post-hoc-Test. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Charakterisierung von zellbeladenen Transplantaten. (A) Repräsentative REM-Bilder und (B) 4',6-Diamidino-2-phenylindol (DAPI)-Färbung von zellbeladenen Gefäßtransplantaten, die eine erfolgreiche Makrophagenimplantation und gleichmäßige Verteilung zeigen. Maßstabsleisten: 30 μm und 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
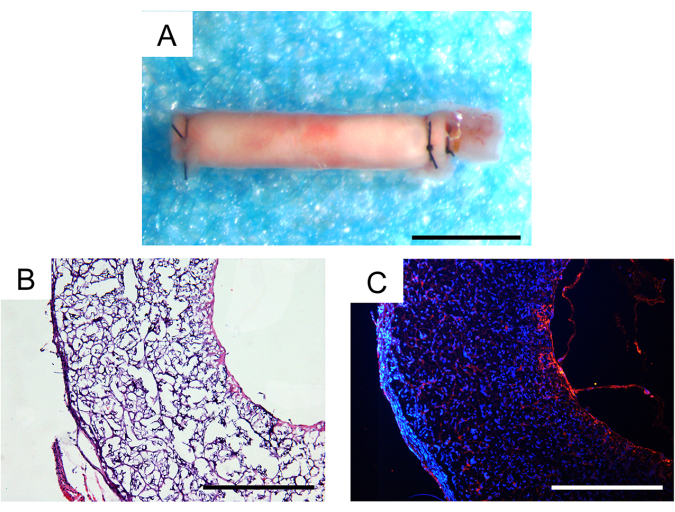
Abbildung 7: Histologische Analyse von explantierten Gefäßtransplantaten einen Monat nach der Implantation. (A) Stereoskopisches Bild, das keine Aneurysmabildung oder fibröse Verkapselung zeigt. Maßstabsbalken: 500 μm. (B) Hämatoxylin- und Eosin-Färbung (H&E), die eine gute Zellularisierung und Geweberegeneration zeigt. Maßstabsbalken: 200 μm. (C) CD31-Immunfluoreszenzfärbung, die eine Monoschicht aus Endothelzellen auf der luminalen Oberfläche zeigt. Maßstab: 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Gruppe | Konzentration von PCL Lösung (%) | Dicke des Gefäßtransplantats (μm) | Abstand Nadel-Sammler (cm) | Durchflussmenge (mL/h) | Spannung (kV) |
| 10%-100 | 10 | 100 | 15 | 2 | 18 |
| 10%-150 | 10 | 150 | 15 | 2 | 18 |
| 10%-200 | 10 | 200 | 15 | 2 | 18 |
| 15%-100 | 15 | 100 | 15 | 2 | 18 |
| 15%-150 | 15 | 150 | 15 | 2 | 18 |
| 15%-200 | 15 | 200 | 15 | 2 | 18 |
| 20%-100 | 20 | 100 | 13 | 8 | 12 |
| 20%-150 | 20 | 150 | 13 | 8 | 12 |
| 20%-200 | 20 | 200 | 13 | 8 | 12 |
Tabelle 1: Beschreibung der Gefäßtransplantatgruppen. PCL, Polycaprolacton.
| Gruppe | Durchmesser der Faser (μm) | Porengröße (μm) |
| 10%-100 | 0,51±0,12 | 2.48±1.38 kg |
| 10%-150 | 0,91±0,4 | 1,83±0,84 kg |
| 10%-200 | 0,73±0,35 | 2,24±0,83 kg |
| 15%-100 | 1,85±0,3 kg | 8,91±2,87 kg |
| 15%-150 | 1,82±0,34 kg | 8.41±2.72 Uhr |
| 15%-200 | 2.18±0.47 kg | 9.59±3.01 Uhr |
| 20%-100 | 3.61±1.02 kg | 13.95±4.7 kg |
| 20%-150 | 3,06±0,56 kg | 13.12±3.36 Uhr |
| 20%-200 | 3,46±0,66 kg | 13.92±4.19 Uhr |
Tabelle 2: Strukturelle Parameter verschiedener Gefäßtransplantate.
| Gruppe | Innendurchmesser (mm) | Außendurchmesser (mm) | Wandstärke (μm) | Länge (cm) |
| Halsschlagader | 0.5-0.6 | 0.6-0.7 | 100 | / |
| Gefäßtransplantat | 0.7 | 1 | 150 | 0.8 |
| Manschette | 0.5 | 0.63 | 65 | / |
Tabelle 3: Dimensionsdaten der Manschette, der Halsschlagader und des Gefäßtransplantats.
Diskussion
Die Verwendung der Manschettentechnik zur Implantation von Tissue-Engineering-Gefäßtransplantaten in die Halsschlagader der Maus stellt einen bedeutenden Fortschritt in der kardiovaskulären Forschungdar 15. Zu den kritischen Schritten dieser Technik gehören die Zellaussaat und die Transplantatimplantation. In dieser Studie wurde ein Perfusionsadsorptionsansatz verwendet, um die Aussaatdichte von Makrophagen zu erhöhen, um Probleme im Zusammenhang mit ungleichmäßiger Zellaussaat und geringer Zellviabilität zu lösen. Diese Methode ermöglichte es Makrophagen, die Gefäßtransplantatwand zu infiltrieren und gleichmäßig zu verteilen.
In Bezug auf die Gefäßimplantation kann die Manschettentechnik im Gegensatz zur End-to-End-Anastomose16 mit einer höheren Inzidenz von Stenosen verbunden sein, insbesondere wenn sie bei Gefäßen mit kleinerem Durchmesser angewendet wird. Um diesen Effekt zu minimieren, wurden Manschetten mit Innen- und Außendurchmessern gewählt, die denen der Halsschlagadern der Maus sehr nahe kommen. Die relevanten Abmessungen sind in Tabelle 3 aufgeführt.
Diese Technik ermöglicht ein einfacheres chirurgisches Verfahren für die Implantation von Gefäßtransplantaten in die Halsschlagader der Maus. Zu den Tiermodellen, die in früheren Studien mit Gefäßtransplantaten mit kleinem Durchmesser am häufigsten verwendet wurden, gehören die Halsschlagfistel des Schafs und die Implantationsmodelle für die Baucharterie der Ratte17,18. Diese Modelle sind effektiv für die Beurteilung der mechanischen Festigkeit und der Gewebeumbaukapazität von Gefäßtransplantaten; Sie sind jedoch nur begrenzt in ihrer Fähigkeit, die zugrundeliegenden Mechanismen aufzuklären. Genetisch veränderte Mäuse haben sich zu einem wichtigen Modell für die Untersuchung von Gefäßregenerationsmechanismen entwickelt, das die Grenzen anderer Tiermodelle überwindet.
Zum Beispiel entwickeln Apolipoprotein E (ApoE)-Knockout-Mäuse spontan Hypercholesterinämie und atherosklerotische Läsionen19, was sie zu einem wertvollen Modell für die Simulation klinischer Zustände macht, die eine Gefäßtransplantation erfordern. Die Bewertung der vaskulären Durchgängigkeit und Regeneration in ApoE-Knockout-Mäusen liefert wichtige Referenzdaten für die klinische Translation von Gefäßtransplantaten. Darüber hinaus können gendefiziente Mäuse verwendet werden, um die Rolle von Schlüsselgenen bei der Gefäßregeneration zu untersuchen. Die endotheliale Stickstoffmonoxid-Synthase (eNOS), ein kritischer Regulator der Gefäßfunktion, ist eine Hauptquelle für Stickstoffmonoxid20. Mäuse mit eNOS-Gen-defizienten Methoden dienen als Forschungsmodell, um die Mechanismen aufzuklären, durch die dieses Gen den Gefäßumbau beeinflusst. Darüber hinaus kann die Herkunft von Zellen, die an der Regeneration von Gefäßgewebe beteiligt sind, durch in vivo Zellmarkierung und Abstammungsverfolgung mit Hilfe von Reportergen-Tool-Mäusen erforscht werden21,22.
Diese Technik hat gewisse Einschränkungen hinsichtlich der Anzahl der verwendeten Tiere und der Dauer der Transplantation. Die vorliegende Studie konzentrierte sich in erster Linie auf die Bewertung der Machbarkeit dieser Veredelungsmethode mit Hilfe eines kurzfristigen in vivo-Ansatzes . Zukünftige Studien sollten die Stichprobengröße erhöhen und Langzeitauswertungen durchführen, um den Einfluss dieser Methode auf die Aneurysmabildung, Durchgängigkeit und Intimahyperplasie umfassend zu bewerten.
Darüber hinaus betrug die Durchgängigkeitsrate des Transplantats 66,6 %, was möglicherweise durch eine Durchmesserabweichung (2,3-fach) an der Anastomosenstelle beeinflusst wurde. Diese Diskrepanz kann zu lokalen Durchblutungsstörungen führen, die das Thromboserisiko erhöhen. Weitere Studien sind erforderlich, um das Manschettendesign zu optimieren, um Durchmesserdiskrepanzen zu reduzieren und deren Auswirkungen auf die Durchgängigkeitsraten zu untersuchen.
Zusammenfassend lässt sich sagen, dass das auf der Manschettentechnik basierende Implantationsmodell der Halsschlagader der Maus ein einfaches und effektives Tiermodell für die biologische Bewertung von Gefäßtransplantaten mit kleinem Durchmesser darstellt. Darüber hinaus ermöglicht es die Untersuchung der Rolle verschiedener Zelltypen beim Umbau von Gefäßgewebe und der zugrundeliegenden regenerativen Mechanismen.
Offenlegungen
Die Autoren haben keine widersprüchlichen finanziellen Interessen.
Danksagungen
Die Finanzierung dieser Studie erfolgte durch die Projekte der National Natural Science Foundation of China (Nr. 32101098, 32071356 und 82272158) und den CAMS Innovation Fund for Medical Sciences (Nr. 2022-I2M-1-023).
Materialien
| Name | Company | Catalog Number | Comments |
| 1% penicillin-streptomycin | Solarbio | P1400 | |
| 10% fetal bovine serum | Gibco | A5256701 | |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 4',6-Diamidino-2-Phenylindole (DAPI) | SouthernBiotech | 0100-20 | |
| Alcohol | Tianjin Chemical Reaggent Company | 1083 | |
| Anti-Mouse CD31 primary antibody | BD Bioscience | 553370 | |
| Arterial clips | RWD Life Science | R31005-06 | |
| C57BL/6 mice | Beijing Vital River Laboratory Animal Technology Company | ||
| Dulbecco's modified eagle medium (DMEM) | Gibco | 11966025 | |
| Electrostatic spinning machine | Yunfan Technology | DP30 | |
| Goat anti-rat IgG (Alexa Fluor 555) | Invitrogen | A-21434 | |
| Hematoxylin and eosin (H&E) | Solarbio | G1120 | |
| Hexafluoroisopropanol (HFIP) | McClean | H811026 | |
| Iodophor | LIRCON | V273068 | |
| Microscissors | World Precision Instruments | 14124 | |
| Microtweezers | World Precision Instruments | 500338 | |
| Normal goat serum | Boster | AR0009 | |
| Normal saline | Cisen Pharmaceutical company | H20113369 | |
| Nylon tube for cuff | Portex | ||
| Optimal cutting temperature compound (OCT) | Sakara | 4583 | |
| Pentobarbital sodium | Sigma | P3761 | |
| Phosphate Buffered Saline (PBS) | Solarbio | P1003 | |
| Poly(ε-caprolactone) (PCL) pellets (Mn = 80,000) | Sigma | 704067 | |
| RAW264.7 macrophages | Biyuntian Biotechnology | ||
| Scanning electron microscope (SEM) | Zeiss | PHENOM-XL-G2 | |
| Surgical sutures 6-0 | Ningbo Chenghe microapparatus factory | 220919 | |
| Surgical sutures 9-0 | Ningbo Chenghe microapparatus factory | 221006 | |
| Syringe | Changqiang Medical Devices | 0197 | |
| Tensile testing machine | Instron | WDW-5D |
Referenzen
- Adhikary, D., Barman, S., Ranjan, R., Stone, H. A systematic review of major cardiovascular risk factors: A growing global health concern. Cureus. 14 (10), e30119 (2022).
- Alexander, J. H., Smith, P. K. Coronary-artery bypass grafting. N Engl J Med. 374 (20), 1954-1964 (2016).
- Jeong, Y., Yao, Y., Yim, E. K. F. Current understanding of intimal hyperplasia and effect of compliance in synthetic small diameter vascular grafts. Biomater Sci. 8 (16), 4383-4395 (2020).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: Two phase 2 single-arm trials. Lancet. 387 (10032), 2026-2034 (2016).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Sci Transl Med. 11 (485), eaau6934 (2019).
- Wang, C., Li, Z., Zhang, L., Sun, W., Zhou, J. Long-term results of triple-layered small diameter vascular grafts in sheep carotid arteries. Med Eng Phys. 85, 1-6 (2020).
- Tanaka, T., et al. Evaluation of small-diameter silk vascular grafts implanted in dogs. JTCVS Open. 6, 148-156 (2021).
- Jin, X., et al. Preparation of small-diameter tissue-engineered vascular grafts electrospun from heparin end-capped PCL and evaluation in a rabbit carotid artery replacement model. Macromol Biosci. 19 (8), e1900114 (2019).
- Xiao, Y., et al. Fabrication of small-diameter in situ tissue engineered vascular grafts with core/shell fibrous structure and a one-year evaluation via rat abdominal vessel replacement model. Biomater Adv. 165, 214018 (2024).
- Wei, Y., Wang, F., Guo, Z., Zhao, Q. Tissue-engineered vascular grafts and regeneration mechanisms. J Mol Cell Cardiol. 165, 40-53 (2022).
- Cleary, M. A., et al. Vascular tissue engineering: The next generation. Trends Mol Med. 18 (7), 394-404 (2012).
- Roh, J. D., et al. Tissue-engineered vascular grafts transform into mature blood vessels via an inflammation-mediated process of vascular remodeling. Proc Natl Acad Sci U S A. 107 (10), 4669-4674 (2010).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- Wu, Y., et al. Peptide-tethered vascular grafts enable blood vessel regeneration via endogenous cell recruitment and neovascularization. Compos B Eng. 252, 110504 (2023).
- Hu, Y., Xu, Q. Vessel graft atherosclerosis in murine models. Curr Drug Targets. 9 (3), 239-250 (2008).
- Qin, K., et al. Implantation of electrospun vascular grafts with optimized structure in a rat model. J Vis Exp. (136), e57340 (2018).
- Geelhoed, W. J., et al. A novel method for engineering autologous non-thrombogenic in situ tissue-engineered blood vessels for arteriovenous grafting. Biomaterials. 229, 119577 (2020).
- Wu, P., et al. Construction of vascular graft with circumferentially oriented microchannels for improving artery regeneration. Biomaterials. 242, 119922 (2020).
- Vasquez, E. C., Peotta, V. A., Gava, A. L., Pereira, T. M., Meyrelles, S. S. Cardiac and vascular phenotypes in the apolipoprotein e-deficient mouse. J Biomed Sci. 19 (1), 22 (2012).
- Garcia, V., Sessa, W. C. Endothelial nos: Perspective and recent developments. Br J Pharmacol. 176 (2), 189-196 (2019).
- He, L., et al. Enhancing the precision of genetic lineage tracing using dual recombinases. Nat Med. 23 (12), 1488-1498 (2017).
- Wang, F., et al. Nitric oxide improves regeneration and prevents calcification in bio-hybrid vascular grafts via regulation of vascular stem/progenitor cells. Cell Rep. 39 (12), 110981 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten