Method Article
Implantation d’une greffe vasculaire issue de l’ingénierie tissulaire dans l’artère carotide de souris via la technique du brassard
Dans cet article
Résumé
Ici, un protocole est présenté pour l’implantation d’un greffon vasculaire issu de l’ingénierie tissulaire dans l’artère carotide de souris à l’aide de la technique du ballonnet, fournissant un modèle animal approprié pour l’étude des mécanismes de régénération du tissu vasculaire.
Résumé
Le développement de greffes vasculaires de petit diamètre a été une entreprise mondiale, avec de nombreux groupes de recherche contribuant à ce domaine. L’expérimentation animale joue un rôle central dans l’évaluation de l’efficacité et de l’innocuité des greffes vasculaires, en particulier en l’absence d’applications cliniques. Par rapport aux modèles animaux alternatifs, le modèle d’implantation de souris offre plusieurs avantages, notamment un patrimoine génétique bien défini, une méthode mature de construction de modèles de maladies et une procédure chirurgicale simple. Sur la base de ces avantages, la présente étude a mis au point une technique simple de brassard pour l’implantation de greffons vasculaires issus de l’ingénierie tissulaire dans l’artère carotide de la souris. Cette technique a commencé par la fabrication de greffons vasculaires de petit diamètre en polycaprolactone (PCL) par filage électrostatique, suivie de l’ensemencement de macrophages sur les greffons par adsorption par perfusion. Par la suite, les greffons vasculaires cellularisés issus de l’ingénierie tissulaire ont été transplantés dans l’artère carotide de la souris à l’aide de la technique du ballonnet pour évaluer la perméabilité et la capacité de régénération. Après 30 jours d’implantation in vivo , la perméabilité vasculaire s’est avérée satisfaisante, avec des signes de régénération néo-tissulaire et la formation d’une couche endothéliale dans la lumière des greffons. Toutes les données ont été analysées à l’aide d’un logiciel de statistiques et de graphiques. Cette étude a permis d’établir un modèle d’implantation de l’artère carotide chez la souris qui peut être utilisé pour explorer les sources cellulaires de la régénération vasculaire et les mécanismes d’action des substances actives. De plus, il fournit un soutien théorique pour le développement de nouvelles greffes vasculaires de petit diamètre.
Introduction
La prévalence et la mortalité des maladies cardiovasculaires augmentent à l’échelle mondiale, ce qui représente un problème de santé publique important1. Le pontage vasculaire est une intervention efficace pour les maladies coronariennes graves et les maladies vasculaires périphériques2. L’utilisation de greffes vasculaires artificielles d’un diamètre supérieur à 6 mm a été bien documentée en milieu clinique. À l’inverse, ceux dont le diamètre est inférieur à 6 mm sont sujets à la thrombose et à l’hyperplasie intimale, ce qui peut entraîner un risque considérable de resténose3. Malgré des avancées significatives dans la recherche et le développement de greffes vasculaires de petit diamètre ces dernières années, avec plusieurs produits approchant l’application clinique, de multiples défis subsistent 4,5. Il s’agit notamment d’un taux de perméabilité à long terme relativement faible, d’une régénération vasculaire limitée et d’une compréhension insuffisante du mécanisme de régénération.
L’évaluation préclinique de nouveaux greffons vasculaires de petit diamètre repose sur l’implantation in vivo dans divers modèles animaux. Les modèles les plus couramment utilisés comprennent l’artère carotide de mouton, l’artère fémorale de chien, l’artère carotide de lapin et les modèles d’implantation d’artère abdominalede rat 6,7,8,9. La perméabilité des greffes vasculaires peut être évaluée chez des animaux de taille moyenne à grande, tels que les moutons, les porcs et les chiens. Cependant, ces études impliquent des coûts importants en raison de l’expertise et de l’équipement requis. De plus, leur complexité technique pose un défi à la mise en œuvre. En revanche, les modèles de petits animaux tels que les lapins et les rats manquent d’espèces transgéniques bien établies avec des antécédents génétiques clairement définis, ce qui représente un obstacle important dans l’étude des mécanismes de régénération vasculaire.
Par rapport aux modèles animaux susmentionnés, le modèle murin offre une procédure chirurgicale relativement simple, une méthodologie bien établie pour générer des souris génétiquement modifiées et un patrimoine génétique clairement défini. Cependant, le petit diamètre des vaisseaux sanguins de souris rend l’anastomose de bout en bout dans la greffe vasculaire techniquement complexe, nécessitant une expertise significative et produisant un taux de réussite relativement faible. Afin de réduire la complexité de la procédure et d’améliorer le taux de réussite de l’implantation d’une greffe vasculaire, la présente étude a utilisé la technique du brassard dans un modèle d’implantation de l’artère carotide chez la souris.
Suite à une implantation in vivo , les greffes vasculaires peuvent recruter des cellules endogènes qui contribuent à la régénération du tissu vasculaire. La présence de ces cellules facilite l’endothélialisation et la régénération de la couche musculaire lisse des greffons. 10. Cependant, la source et le type de cellules impliquées dans la régénération du tissu vasculaire restent incertains, et de multiples théories concurrentes sont à l’étude11. Parmi celles-ci, les recherches ont porté sur les rôles des cellules inflammatoires et des cellules souches. Breuer et al. ont ensemencé des monocytes dérivés de la moelle osseuse humaine (hBMC) sur des greffes vasculaires et ont constaté que les cellules ensemencées recrutaient des cellules hôtes dans la paroi du greffon par la libération de la protéine chimioattractante des monocytes 1 (MCP-1), favorisant ainsi la régénération du tissu vasculaire12. Dans cette étude, une méthode efficace d’ensemencement cellulaire par adsorption de perfusion a été proposée et utilisée avec succès pour ensemencer des macrophages sur des greffons vasculaires de petit diamètre en polycaprolactone (PCL). Après l’implantation, ces cellules ont montré une viabilité soutenue.
Cet article détaille la méthodologie de préparation des greffes vasculaires issues de l’ingénierie tissulaire et la procédure d’implantation de l’artère carotide chez la souris à l’aide de la technique du brassard. Le processus commence par la fabrication de greffons vasculaires PCL de petit diamètre avec des paramètres définis par filage électrostatique. Par la suite, les greffons jugés aptes à l’implantation subissent des tests mécaniques. Les macrophages sont ensuite ensemencés sur les greffons vasculaires à l’aide de la méthode d’adsorption par perfusion. Enfin, des greffons vasculaires ensemencés de macrophages sont implantés dans l’artère carotide de la souris à l’aide de la technique du brassard, et la perméabilité et les propriétés régénératives sont analysées après un mois d’implantation in vivo .
Cette technique a le potentiel d’améliorer l’efficacité et les taux de réussite de la greffe vasculaire dans des modèles murins. De plus, le modèle peut être utilisé pour étudier les mécanismes sous-jacents aux sources cellulaires, aux gènes pivots et aux facteurs actifs de la régénération vasculaire, fournissant un soutien théorique et méthodologique pour la modification fonctionnelle et le développement de nouveaux greffons vasculaires de petit diamètre.
Protocole
Toutes les procédures sur les animaux ont été approuvées par le Comité d’éthique des expériences sur les animaux de l’Institut de médecine radiologique de l’Académie chinoise des sciences médicales et étaient conformes aux Directives pour le soin et l’utilisation des animaux de laboratoire. Des souris C57BL/6 mâles, âgées de 6 à 8 semaines, d’un poids corporel de 25 à 30 g, ont été utilisées dans cette étude. Les détails des réactifs et des équipements utilisés dans cette étude sont répertoriés dans la table des matériaux.
1. Fabrication de greffons vasculaires de petit diamètre
REMARQUE : Fabriquez des greffons vasculaires PCL de petit diamètre en utilisant la technique d’électrofilage13.
- Préparer des solutions de PCL à 10 %, 15 % et 20 % (p/v) dans de l’hexafluoroisopropanol (HFIP) à température ambiante (RT) pendant 12 h.
- Chargez les solutions PCL dans une seringue de 10 ml et positionnez la seringue à l’aide d’une aiguille en acier inoxydable de 21 G.
- Placez un mandrin en acier au tungstène (0,7 mm de diamètre, 20 cm de longueur) sur l’instrument de prélèvement.
- Fabriquer neuf groupes de greffons vasculaires PCL à l’aide de la technique d’électrofilage. Connectez une alimentation haute tension à l’aiguille. Positionnez une tige en acier au tungstène d’un diamètre intérieur de 0,7 mm à une distance fixe devant l’aiguille en tant que dispositif récepteur.
REMARQUE : La description des groupes de greffons vasculaires est fournie dans le tableau 1, et les paramètres des greffons vasculaires sont détaillés dans le tableau 2. - Soumettre les greffons vasculaires fabriqués à un processus d’évacuation. Placez les greffons vasculaires dans une étuve de séchage sous vide pendant 72 h pour éliminer les solvants résiduels.
- Stérilisez les greffons en les immergeant dans de l’alcool médical pendant 30 minutes et en les exposant à la lumière UV pendant la nuit.
- Observez la morphologie microscopique des greffons vasculaires à l’aide d’un microscope électronique à balayage (MEB). Fixez les greffons vasculaires à l’étage de l’échantillon MEB à l’aide d’un adhésif conducteur et placez-les dans le dispositif de pulvérisation d’or pour le revêtement.
- Observez la structure et la morphologie des fibres des greffons vasculaires à l’aide du MEB à une tension d’accélération de 15 kV. Mesurez le diamètre de la fibre et la taille des pores à partir d’images MEB (n = 5) à l’aide du logiciel ImageJ.
- Évaluer les propriétés mécaniques (propriétés de traction et d’élasticité) des greffons vasculaires à l’aide d’une machine d’essai de traction. Clampez les extrémités supérieure et inférieure du greffon vasculaire à l’aide de pinces fixes espacées de 1 cm.
- Étirer le greffon vasculaire à une vitesse de 10 mm/min jusqu’à rupture. Récupérez la courbe contrainte-déformation de la machine d’essai de traction.
- Calculez les paramètres mécaniques, y compris la charge maximale (2-15 N), la contrainte à la rupture (5-30 MPa), la déformation à la rupture (200 %-1500 %) et le module d’élasticité (1-20 MPa)14.
- Effectuer des analyses statistiques à l’aide de logiciels statistiques et graphiques. Exprimez les données sous forme de moyenne ± d’écart-type. Analysez et comparez les différences univariées entre plusieurs groupes à l’aide du test post hoc de Tukey dans l’ANOVA à un facteur. *P < 0,05, **P < 0,01, ***P < 0,001.
2. Ensemencement de macrophages sur des greffes vasculaires
REMARQUE : Assurez-vous que toutes les solutions et tous les matériaux sont stériles. Effectuer toutes les opérations dans la salle de culture cellulaire.
- Culture RAW264.7 (macrophage monocytaire de souris) dans des flacons dans des conditions d’adhérence (Figure 1A). Préparez le milieu de culture cellulaire en utilisant le milieu d’Eagle modifié de Dulbecco (DMEM) complet complété par 1 % de pénicilline-streptomycine et 10 % de sérum fœtal bovin. Placez les flacons dans un incubateur à 37 °C contenant 5 % de dioxyde de carbone.
- Prélever les macrophages à l’aide d’un grattoir cellulaire. Jeter le milieu à l’aide d’une pipette de 1 mL et laver les cellules avec du PBS.
- Ajouter 2 mL de milieu frais dans la fiole de culture et gratter doucement la surface à l’aide d’un grattoir cellulaire. Transférez les cellules collectées dans un tube et centrifugez à 1 000 x g pendant 5 min à température ambiante. Mettre en suspension 5 × 106 cellules dans 100 μL de milieu complet.
- Placez un greffon vasculaire PCL (1 cm de longueur) dans un tube de 15 mL rempli de DMEM et centrifugez-le à 4 000 x g pendant 5 min. Répétez ce processus plusieurs fois jusqu’à ce que le greffon coule au fond du tube, assurant une infiltration complète du matériau avec DMEM.
- Préparez une boîte de Pétri de 10 cm recouverte d’une couche de papier filtre. Placez le greffon vasculaire PCL humidifié sur le papier filtre et roulez-le pour éliminer l’excès de milieu.
- Prélever 10 μL de suspension cellulaire à l’aide d’une pipette de 10 μL et l’injecter à une extrémité du greffon vasculaire. Faites pivoter le greffon vasculaire sur le papier filtre pour faciliter une distribution uniforme de la suspension. Injectez chaque extrémité cinq fois pour un total de dix injections (Figure 1B,C).
- Placez le greffon vasculaire chargé de macrophages dans une plaque de 24 puits contenant 1 mL de milieu complet et incubez pendant 2 h dans un incubateur de culture cellulaire avant l’implantation.
- Déterminer la répartition des cellules à l’intérieur de la paroi du greffon. Intégrez le greffon vasculaire chargé de macrophages dans un composé de tomographie par cohérence optique (OCT) pour la cryosection. Colorer les noyaux cellulaires avec du 4',6-diamidino-2-phénylindole (DAPI) et observer au microscope à fluorescence.
3. Modèle d’implantation de l’artère carotide de souris
REMARQUE : Maintenez une zone chirurgicale stérile pour les procédures animales. Stérilisez tous les instruments chirurgicaux et les produits jetables avant l’opération.
- Sélectionnez trois souris mâles C57BL/6 en bonne santé, pesant chacune de 25 à 30 g. Faites jeûner les souris la veille de l’opération. Implanter une greffe vasculaire chez chaque animal, pour un total de trois greffons.
- Construire des brassards à partir d’un tube en nylon (figure 2A) et présenter le schéma de la technique du brassard vasculaire à la figure 2B.
- Anesthésier les souris par injection intrapéritonéale de pentobarbital sodique à une concentration de 50 mg/kg (selon les protocoles approuvés par l’établissement). Confirmez l’efficacité de l’anesthésie en assurant la relaxation musculaire et même la respiration. Appliquez une pommade ophtalmique à base de vaseline sur les yeux pour prévenir la sécheresse pendant l’anesthésie.
- Placez la souris en position couchée sur la table d’opération et retirez les poils du cou. Stérilisez la zone chirurgicale avec de l’iodophore. Couvrez la zone non chirurgicale avec de la gaze stérile pour maintenir un environnement stérile (figure 3A).
- À l’aide de ciseaux ophtalmiques, faites une incision médiane (de 1,5 à 2 cm de longueur) de la mandibule au sternum. Élevez les glandes salivaires gauches et excisez le muscle cléido-mastoïdien gauche pour augmenter le champ de vision chirurgical. Exposez l’artère carotide commune gauche à l’aide d’une micropince à épiler (figure 3B).
- Isolez l’artère carotide gauche à l’aide d’une micropince (Figure 3C).
- Lister l’artère carotide à deux endroits dans la partie médiane à l’aide d’une suture 9-0. Transectez l’artère entre les deux ligatures à l’aide de microciseaux. Passez le brassard dans les artères à chaque extrémité et fixez l’artère et le brassard ensemble à l’aide de clips artériels (figure 3D).
- Tournez l’artère vers l’extérieur pour couvrir le corps du brassard et fixez-la au brassard à l’aide d’une suture 9-0 avec une micropince (Figure 3E).
- Implantez un greffon vasculaire entre les deux extrémités de l’artère carotide en glissant les extrémités du greffon sur le brassard de l’artère et en les fixant avec des sutures 9-0 (Figure 3F).
REMARQUE : Les données dimensionnelles du ballonnet, de l’artère carotide et de la greffe vasculaire sont présentées dans le tableau 3. Bien que les diamètres du greffon et du ballonnet correspondent étroitement à ceux des artères carotides de souris, il existe un décalage entre le diamètre de la lumière anastomotique et le diamètre du greffon. Le diamètre de la lumière anastomotique est calculé en soustrayant deux fois l’épaisseur de la paroi de l’artère carotide (0,1 mm) du diamètre intérieur du brassard (0,5 mm), ce qui donne un diamètre de lumière de 0,3 mm. Le greffon vasculaire a un diamètre intérieur de 0,7 mm, ce qui entraîne une discordance d’environ 2,3 fois (0,7 mm / 0,3 mm = 2,3). - Retirez les clips artériels aux deux extrémités et irriguez le site d’implantation avec une solution saline. Évaluer la perméabilité du greffon vasculaire en observant la pulsation artérielle distale (Figure 3G).
- Repositionnez la glande salivaire gauche et fermez le site chirurgical à l’aide de sutures 6-0 (Figure 3H).
4. Soins et analyse post-opératoires
- Transférez la souris dans un incubateur à 37 °C et surveillez en permanence ses signes vitaux jusqu’à ce qu’elle reprenne conscience.
- Injecter 5 mg/kg de carbinol pour soulager la douleur postopératoire.
- Surveillez la souris pendant la période de récupération et ne la renvoyez pas dans un logement de groupe tant qu’elle n’est pas complètement rétablie.
- Anesthésier les souris un mois après l’implantation et prélever les échantillons de greffon vasculaire pour une analyse histologique9.
- Effectuer l’euthanasie par asphyxie au CO2 suivie d’une luxation cervicale selon les directives éthiques.
Résultats
Des greffons vasculaires de petit diamètre avec différents paramètres ont été préparés avec succès par électrofilage. Les images MEB ont révélé que les fibres étaient uniformément réparties et présentaient une disposition irrégulière à l’intérieur de la paroi du greffon, avec la présence de structures poreuses (Figure 4). Au fur et à mesure que la concentration de PCL augmentait, le diamètre de la fibre et la taille des pores augmentaient. Les valeurs spécifiques pour chaque groupe de greffes vasculaires sont présentées dans le tableau 2. Les résultats des tests mécaniques ont démontré que toutes les greffes vasculaires répondaient aux normes mécaniques requises. La charge et la déformation maximales à la rupture augmentaient avec des concentrations plus élevées de LCP et une plus grande épaisseur de paroi vasculaire (figures 5A-C), tandis que le module d’élasticité diminuait (figure 5D). Sur la base de ces résultats, des greffons vasculaires de petit diamètre avec une concentration de PCL de 15 % et une épaisseur de paroi de 150 μm ont été sélectionnés comme les greffons optimaux pour les expériences ultérieures.
Dans cette étude, les macrophages ont été ensemencés sur des greffons vasculaires en utilisant la méthode d’adsorption par perfusion. L’analyse MEB a confirmé que les macrophages ont été ensemencés avec succès sur les greffons vasculaires et ont présenté une distribution uniforme (Figure 6A). Des greffons en coupe transversale soumis à une coloration DAPI ont révélé que les macrophages ensemencés s’étaient infiltrés de la lumière du greffon dans la paroi du greffon (Figure 6B).
Trente jours après l’implantation in vivo , le taux de survie des animaux était de 100 %, et deux des trois greffons vasculaires implantés restaient patents, ce qui était un résultat satisfaisant dans les modèles murins. Aucun anévrisme ou encapsulation fibreuse discernable des greffons n’a été observé au stéréomicroscope (Figure 7A). L’étendue de l’infiltration cellulaire et de la régénération tissulaire a été évaluée plus en détail par analyse histologique. La coloration à l’hématoxyline et à l’éosine (H&E) a révélé une infiltration cellulaire importante dans la paroi du greffon et la formation de néotissus dans la lumière interne du greffon (Figure 7B). La coloration par immunofluorescence CD31 a démontré la régénération d’une seule couche de tissu endothélial dans la lumière interne des greffons, avec une couverture cellulaire endothéliale relativement intacte (Figure 7C).

Figure 1 : Procédure d’ensemencement cellulaire. (A) Culture de cellules RAW264.7. Barre d’échelle : 100 μm. (B) Schéma du processus d’ensemencement des cellules. (C) Cellules RAW264.7 ensemencées sur la paroi du greffon à l’aide de la méthode de perfusion-adsorption. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Technique du brassard. (A) Préparation des brassards vasculaires. (B) Représentation schématique de la technique du brassard vasculaire. Des greffes vasculaires ont été implantées dans l’artère carotide à l’aide de cette méthode. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Procédure chirurgicale d’implantation d’un greffon vasculaire dans un modèle murin. (A) Injection d’anesthésiques, positionnement de la souris en position couchée et immobilisation des pattes. (B) Exposition de la zone chirurgicale. (C) Isolement de l’artère carotide. (D) Placement du brassard autour de l’artère carotide. (E) Eversion de l’artère sur le corps du brassard et fixation à l’aide d’une suture 9-0. (F) Gainage du greffon vasculaire sur le ballonnet artériel et suture. (G) Retrait des pinces vasculaires. (H) Fermeture de la peau. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Morphologie des greffes vasculaires de polycaprolactone électrofilée (PCL). Des images représentatives de microscopie électronique à balayage (MEB) démontrant la structure fibreuse bien définie des greffons vasculaires. Barres d’échelle : 500 μm et 50 μm (images agrandies). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Propriétés mécaniques des greffes vasculaires PCL électrofilées. Caractérisation mécanique des greffons vasculaires dans le sens longitudinal, montrant la charge maximale (A), la contrainte maximale (B), la déformation à la rupture (C) et le module d’élasticité (D). Les données sont exprimées en moyenne ± en écart-type (ET) (n = 3). *P < 0,05, **P < 0,01, ***P < 0,001, ANOVA à un facteur suivie du test post hoc de Tukey. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Caractérisation des greffons chargés de cellules. (A) Des images MEB représentatives et (B) une coloration au 4',6-diamidino-2-phénylindole (DAPI) de greffons vasculaires chargés de cellules, montrant une implantation réussie de macrophages et une distribution uniforme. Barres d’échelle : 30 μm et 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
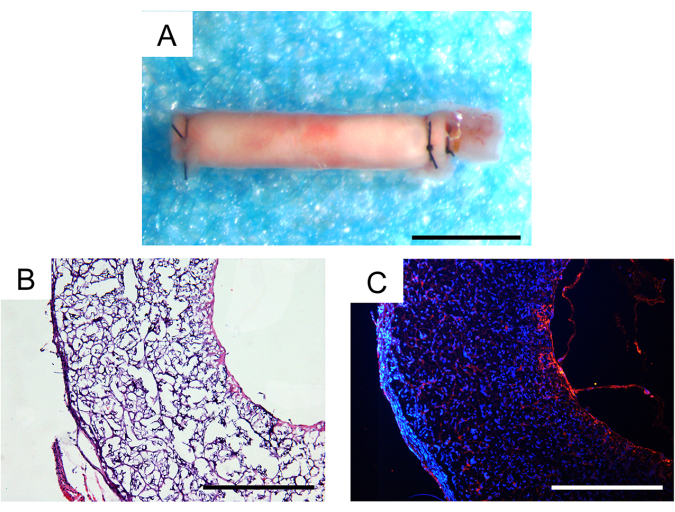
Figure 7 : Analyse histologique de greffons vasculaires explantés un mois après l’implantation. (A) Image stéréoscopique ne montrant aucune formation d’anévrisme ou d’encapsulation fibreuse. Barre d’échelle : 500 μm. (B) Coloration à l’hématoxyline et à l’éosine (H&E) démontrant une bonne cellularisation et une bonne régénération tissulaire. Barre d’échelle : 200 μm. (C) Coloration par immunofluorescence CD31 révélant une monocouche de cellules endothéliales sur la surface luminale. Barre d’échelle : 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Groupe | Concentration de PCL solution ( %) | Épaisseur du greffon vasculaire (μm) | Distance aiguille-collecteur (cm) | débit (mL/h) | tension (kV) |
| 10%-100 | 10 | 100 | 15 | 2 | 18 |
| 10%-150 | 10 | 150 | 15 | 2 | 18 |
| 10%-200 | 10 | 200 | 15 | 2 | 18 |
| 15%-100 | 15 | 100 | 15 | 2 | 18 |
| 15%-150 | 15 | 150 | 15 | 2 | 18 |
| 15%-200 | 15 | 200 | 15 | 2 | 18 |
| 20%-100 | 20 | 100 | 13 | 8 | 12 |
| 20%-150 | 20 | 150 | 13 | 8 | 12 |
| 20%-200 | 20 | 200 | 13 | 8 | 12 |
Tableau 1 : Description des groupes de greffes vasculaires. PCL, polycaprolactone.
| Groupe | Diamètre de la fibre (μm) | Taille des pores (μm) |
| 10%-100 | 0,51±0,12 | 2.48±1.38 |
| 10%-150 | 0,91±0,4 | 1,83±0,84 |
| 10%-200 | 0,73±0,35 | 2,24±0,83 |
| 15%-100 | 1,85±0,3 | 8,91±2,87 |
| 15%-150 | 1,82±0,34 | 8.41±2.72 |
| 15%-200 | 2,18±0,47 | 9.59±3.01 |
| 20%-100 | 3.61±1.02 | 13.95±4.7 |
| 20%-150 | 3,06±0,56 | 13.12±3.36 |
| 20%-200 | 3,46±0,66 | 13.92±4.19 |
Tableau 2 : Paramètres structurels des différentes greffes vasculaires.
| Groupe | Diamètre intérieur (mm) | Diamètre extérieur (mm) | Épaisseur de paroi (μm) | Longueur(cm) |
| carotide | 0.5-0.6 | 0.6-0.7 | 100 | / |
| greffe vasculaire | 0.7 | 1 | 150 | 0.8 |
| manchette | 0.5 | 0.63 | 65 | / |
Tableau 3 : Données dimensionnelles du ballonnet, de l’artère carotide et de la greffe vasculaire.
Discussion
L’utilisation de la technique du brassard pour l’implantation de greffes vasculaires issues de l’ingénierie tissulaire dans l’artère carotide de la souris représente une avancée significative dans la recherche cardiovasculaire15. Les étapes critiques de cette technique comprennent l’ensemencement cellulaire et l’implantation de greffons. Cette étude a utilisé une approche d’adsorption par perfusion pour améliorer la densité d’ensemencement des macrophages afin de résoudre les problèmes liés à l’ensemencement cellulaire non uniforme et à la faible viabilité cellulaire. Cette méthode a permis aux macrophages de s’infiltrer dans la paroi vasculaire du greffon et de la répartir uniformément.
En ce qui concerne l’implantation vasculaire, la technique du ballonnet, par opposition à l’anastomose de bout en bout16, peut être associée à une incidence plus élevée de sténose, en particulier lorsqu’elle est appliquée sur des vaisseaux de plus petits diamètres. Pour minimiser cet effet, des brassards dont les diamètres interne et externe correspondent étroitement à ceux des artères carotides de souris ont été sélectionnés. Les dimensions pertinentes sont indiquées dans le tableau 3.
Cette technique facilite une procédure chirurgicale plus simple pour l’implantation d’un greffon vasculaire dans l’artère carotide de la souris. Les modèles animaux les plus fréquemment utilisés dans les études précédentes sur les greffes vasculaires de petit diamètre comprennent la fistule artérioveineuse jugulaire de mouton et les modèles d’implantation de l’artère abdominale chez le rat17,18. Ces modèles sont efficaces pour évaluer la résistance mécanique et la capacité de remodelage tissulaire des greffes vasculaires ; Cependant, leur capacité à élucider les mécanismes sous-jacents est limitée. Les souris génétiquement modifiées sont apparues comme un modèle important pour l’étude des mécanismes de régénération vasculaire, en remédiant aux limites d’autres modèles animaux.
Par exemple, les souris knock-out de l’apolipoprotéine E (ApoE) développent spontanément une hypercholestérolémie et des lésions athéroscléreuses19, ce qui en fait un modèle précieux pour simuler des conditions cliniques nécessitant une transplantation vasculaire. L’évaluation de la perméabilité et de la régénération vasculaires chez les souris knock-out ApoE fournit des données de référence importantes pour l’application clinique des greffons vasculaires. De plus, les souris déficientes en gènes peuvent être utilisées pour étudier les rôles des gènes clés dans la régénération vasculaire. L’oxyde nitrique synthase endothéliale (eNOS), un régulateur essentiel de la fonction vasculaire, est une source primaire d’oxyde nitrique20. Les souris déficientes en gène eNOS servent de modèle de recherche pour élucider les mécanismes par lesquels ce gène influence le remodelage vasculaire. De plus, l’origine des cellules impliquées dans la régénération du tissu vasculaire peut être explorée grâce au marquage cellulaire in vivo et au traçage de la lignée à l’aide de souris outils de gènes rapporteurs21,22.
Cette technique présente certaines limites concernant le nombre d’animaux utilisés et la durée de la transplantation. La présente étude s’est principalement concentrée sur l’évaluation de la faisabilité de cette méthode de greffe à l’aide d’une approche in vivo à court terme. Les études futures devraient augmenter la taille de l’échantillon et mener des évaluations à long terme afin d’évaluer de manière exhaustive l’impact de cette méthode sur la formation d’anévrisme, la perméabilité et l’hyperplasie intimale.
De plus, le taux de perméabilité du greffon était de 66,6 %, ce qui peut avoir été influencé par un décalage de diamètre (2,3 fois) au site d’anastomose. Ce décalage peut entraîner des troubles localisés de la circulation sanguine, augmentant le risque de thrombose. D’autres études sont nécessaires pour optimiser la conception des brassards afin de réduire les écarts de diamètre et d’étudier leurs effets sur les taux de perméabilité.
En conclusion, le modèle d’implantation de l’artère carotide de souris basé sur la technique du brassard fournit un modèle animal simple et efficace pour l’évaluation biologique des greffes vasculaires de petit diamètre. De plus, il permet d’étudier les rôles de différents types de cellules dans le remodelage des tissus vasculaires et les mécanismes de régénération sous-jacents.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts financiers conflictuels.
Remerciements
Le financement de cette étude a été fourni par les projets de la Fondation nationale des sciences naturelles de Chine (n° 32101098, 32071356 et 82272158) et le Fonds d’innovation CAMS pour les sciences médicales (n° 2022-I2M-1-023).
matériels
| Name | Company | Catalog Number | Comments |
| 1% penicillin-streptomycin | Solarbio | P1400 | |
| 10% fetal bovine serum | Gibco | A5256701 | |
| 4% paraformaldehyde | Solarbio | P1110 | |
| 4',6-Diamidino-2-Phenylindole (DAPI) | SouthernBiotech | 0100-20 | |
| Alcohol | Tianjin Chemical Reaggent Company | 1083 | |
| Anti-Mouse CD31 primary antibody | BD Bioscience | 553370 | |
| Arterial clips | RWD Life Science | R31005-06 | |
| C57BL/6 mice | Beijing Vital River Laboratory Animal Technology Company | ||
| Dulbecco's modified eagle medium (DMEM) | Gibco | 11966025 | |
| Electrostatic spinning machine | Yunfan Technology | DP30 | |
| Goat anti-rat IgG (Alexa Fluor 555) | Invitrogen | A-21434 | |
| Hematoxylin and eosin (H&E) | Solarbio | G1120 | |
| Hexafluoroisopropanol (HFIP) | McClean | H811026 | |
| Iodophor | LIRCON | V273068 | |
| Microscissors | World Precision Instruments | 14124 | |
| Microtweezers | World Precision Instruments | 500338 | |
| Normal goat serum | Boster | AR0009 | |
| Normal saline | Cisen Pharmaceutical company | H20113369 | |
| Nylon tube for cuff | Portex | ||
| Optimal cutting temperature compound (OCT) | Sakara | 4583 | |
| Pentobarbital sodium | Sigma | P3761 | |
| Phosphate Buffered Saline (PBS) | Solarbio | P1003 | |
| Poly(ε-caprolactone) (PCL) pellets (Mn = 80,000) | Sigma | 704067 | |
| RAW264.7 macrophages | Biyuntian Biotechnology | ||
| Scanning electron microscope (SEM) | Zeiss | PHENOM-XL-G2 | |
| Surgical sutures 6-0 | Ningbo Chenghe microapparatus factory | 220919 | |
| Surgical sutures 9-0 | Ningbo Chenghe microapparatus factory | 221006 | |
| Syringe | Changqiang Medical Devices | 0197 | |
| Tensile testing machine | Instron | WDW-5D |
Références
- Adhikary, D., Barman, S., Ranjan, R., Stone, H. A systematic review of major cardiovascular risk factors: A growing global health concern. Cureus. 14 (10), e30119 (2022).
- Alexander, J. H., Smith, P. K. Coronary-artery bypass grafting. N Engl J Med. 374 (20), 1954-1964 (2016).
- Jeong, Y., Yao, Y., Yim, E. K. F. Current understanding of intimal hyperplasia and effect of compliance in synthetic small diameter vascular grafts. Biomater Sci. 8 (16), 4383-4395 (2020).
- Lawson, J. H., et al. Bioengineered human acellular vessels for dialysis access in patients with end-stage renal disease: Two phase 2 single-arm trials. Lancet. 387 (10032), 2026-2034 (2016).
- Kirkton, R. D., et al. Bioengineered human acellular vessels recellularize and evolve into living blood vessels after human implantation. Sci Transl Med. 11 (485), eaau6934 (2019).
- Wang, C., Li, Z., Zhang, L., Sun, W., Zhou, J. Long-term results of triple-layered small diameter vascular grafts in sheep carotid arteries. Med Eng Phys. 85, 1-6 (2020).
- Tanaka, T., et al. Evaluation of small-diameter silk vascular grafts implanted in dogs. JTCVS Open. 6, 148-156 (2021).
- Jin, X., et al. Preparation of small-diameter tissue-engineered vascular grafts electrospun from heparin end-capped PCL and evaluation in a rabbit carotid artery replacement model. Macromol Biosci. 19 (8), e1900114 (2019).
- Xiao, Y., et al. Fabrication of small-diameter in situ tissue engineered vascular grafts with core/shell fibrous structure and a one-year evaluation via rat abdominal vessel replacement model. Biomater Adv. 165, 214018 (2024).
- Wei, Y., Wang, F., Guo, Z., Zhao, Q. Tissue-engineered vascular grafts and regeneration mechanisms. J Mol Cell Cardiol. 165, 40-53 (2022).
- Cleary, M. A., et al. Vascular tissue engineering: The next generation. Trends Mol Med. 18 (7), 394-404 (2012).
- Roh, J. D., et al. Tissue-engineered vascular grafts transform into mature blood vessels via an inflammation-mediated process of vascular remodeling. Proc Natl Acad Sci U S A. 107 (10), 4669-4674 (2010).
- Wang, Z., et al. The effect of thick fibers and large pores of electrospun poly(ε-caprolactone) vascular grafts on macrophage polarization and arterial regeneration. Biomaterials. 35 (22), 5700-5710 (2014).
- Wu, Y., et al. Peptide-tethered vascular grafts enable blood vessel regeneration via endogenous cell recruitment and neovascularization. Compos B Eng. 252, 110504 (2023).
- Hu, Y., Xu, Q. Vessel graft atherosclerosis in murine models. Curr Drug Targets. 9 (3), 239-250 (2008).
- Qin, K., et al. Implantation of electrospun vascular grafts with optimized structure in a rat model. J Vis Exp. (136), e57340 (2018).
- Geelhoed, W. J., et al. A novel method for engineering autologous non-thrombogenic in situ tissue-engineered blood vessels for arteriovenous grafting. Biomaterials. 229, 119577 (2020).
- Wu, P., et al. Construction of vascular graft with circumferentially oriented microchannels for improving artery regeneration. Biomaterials. 242, 119922 (2020).
- Vasquez, E. C., Peotta, V. A., Gava, A. L., Pereira, T. M., Meyrelles, S. S. Cardiac and vascular phenotypes in the apolipoprotein e-deficient mouse. J Biomed Sci. 19 (1), 22 (2012).
- Garcia, V., Sessa, W. C. Endothelial nos: Perspective and recent developments. Br J Pharmacol. 176 (2), 189-196 (2019).
- He, L., et al. Enhancing the precision of genetic lineage tracing using dual recombinases. Nat Med. 23 (12), 1488-1498 (2017).
- Wang, F., et al. Nitric oxide improves regeneration and prevents calcification in bio-hybrid vascular grafts via regulation of vascular stem/progenitor cells. Cell Rep. 39 (12), 110981 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon