Research Article
Ménétrier Hastalığı için Fare Modellerinin Geliştirilmesi
Bu Makalede
Özet
Mevcut çalışma, MT-TGFα farelerinin midede spazmolitik polipeptit eksprese eden metaplazi (SPEM) sergilediğini göstermektedir. Promotörün sızdırması, ana hücre soylarının SPEM'e kadar izlendiğinin gösterilmesini engelledi. Bu nedenle, ek olarak doksisiklin ile indüklenebilir bir fare modeli (Doxi-TGFα) geliştirdik ve SPEM'in ana hücrelerden türetildiğini doğruladık.
Özet
Ménétrier hastalığı (MD), dev rugal kıvrımlar, azalmış asit salgısı ve protein kaybı ile karakterize nadir görülen edinsel premalign bir mide hastalığıdır. MD hastaları, midede büyüme faktörü-α (TGFa) dönüştüren bir EGF reseptörü (EGFR) ligandının ekspresyonunun arttığını gösterir. EGFR nötralize edici antikor olan setuksimab, hızlı klinik iyileşme ve histolojik remisyon ile sonuçlanır. Bu bulguların ötesinde, etiyoloji ve altta yatan moleküler mekanizmalar iyi anlaşılamamıştır. Metallothionein (MT)-TGFα transgenik fare serisi, foveolar hiperplazi ve parietal hücre kaybı dahil olmak üzere MD'nin histopatolojik özelliklerini özetleyen ilk MD fare modelidir. Bu fare modelinde TGFα, ağır metal kaynaklı MT arttırıcı/promotör tarafından çalıştırılır. Önceki çalışmalar, TGFa'yı indüklemek için içme suyunda çinko sülfat (ZnSO4) veya intraperitoneal kadmiyum sülfat (CdSO4) enjeksiyonlarında kullanılmıştır. Bununla birlikte, MT-TGFα farelerinin ağır metal tedavisi olmadan fenotipler geliştirdiğini ve bu da promotörün sızıntısını gösterdiğini bulduk. Ayrıca, TGFa'nın aşırı ekspresyonunun, ana hücre farklılaşması için önemli bir transkripsiyon faktörü olan Mist1 ekspresyonunu baskıladığını ve böylece Mist1-CreERT2 fare hattını kullanan baş hücrelerde genetik manipülasyonu engellediğini bulduk. Bunun üstesinden gelmek için, TGFa'nın doksisiklin tedavisi (CMV-rtTA; TetO-TGFα). Doxi-TGFα fare modeli, MT-TGFα modelinden daha hafif fenotipler geliştirmesine rağmen, foveolar hiperplazi ve parietal hücre kaybı dahil olmak üzere MD'nin özelliklerini özetlemiştir. Doxi-TGFα fare modelini kullanarak, spazmolitik polipeptit eksprese eden metaplazinin (SPEM) MD'de indüklendiğini ve SPEM'in Mist1-CreERT2 fare hattı kullanılarak soy takibi yoluyla ana hücrelerden türetildiğini bulduk. Hem MT-TGFα hem de Doxi-TGFα fare modelleri, MD'nin in vivo modellerini sunar ve MD patogenezinin altında yatan moleküler mekanizmaları ve hastalık için tedavi seçeneklerini araştırmak için yararlıdır. Doxi-TGFα fareleri, TGFa'nın diğer dokularda aşırı ekspresyonunun etkilerini incelemek için de yararlı bir model olacaktır.
Giriş
Protein kaybettiren hipertrofik gastropati olarak da bilinen Ménétrier hastalığı (MD), nadir görülen bir gastrik premalign durumdur. MD hastalarının mideleri, mide mukus sekresyonunun artmasına ve parietal hücre sayısının azalmasına yol açan masif foveoler hiperplazi gösterir, bu da mide asidi sekresyonunun azalmasına neden olur. Ek olarak, mide mukozasında seçici olarak protein kaybolur, bu da hipoalbüminemi ve periferik ödemlereyol açar 1,2,3. MD'nin patogenezi bilinmemektedir, ta ki metallothionein (MT) gen arttırıcı/promotörü kontrolü altında TGFa'yı aşırı eksprese eden transgenik farelerin midede MD fenotiplerini özetlediği bildirilenekadar bilinmemektedir 4,5. MD hastalarından alınan mideler ayrıca bir EGF reseptörü (EGFR) ligandı olan TGFα ekspresyonunun arttığını gösterdi. Bir anti-EGFR antikoru olan Cetuximab'ın MD için ilk etkili tıbbi tedavi olduğu bildirilmiştir ve bu da TGFα aşırı ekspresyonu ile EGFR aktivasyonunun MD6,7'nin patogenezine katkıda bulunduğunu doğrulamıştır.
O zamandan beri, MT-TGFα fare serisi, MD için bir fare modeli olarak kullanılmaktadır. TGFα ekspresyonu ağır metal yanıt geni tarafından düzenlendiğinden, metallotiyonin arttırıcı / promotörü, içme suyunda çinko sülfat (ZnSO4) veya intraperitoneal kadmiyum sülfat (CdSO4) enjeksiyonları TGFα ekspresyonunu indüklemek için kullanılmıştır 5,8. MT-TGFα fare modeli, MD fenotipleri için daha fazla karakterize edilmiştir. Bu fare modeli kullanılarak, TGFα'nın müsin salgılayan yüzey foveolar hücre farklılaşmasını indüklediği, asit salgılayan parietal hücre ve pepsinojen salgılayan ana hücre soylarınafarklılaşmayı inhibe ettiği gösterilmiştir 9,10. Ayrıca mide cisimciği/fundik mukozanın antralize olduğu ve mide bezlerinin tabanında trefoil faktör 2 (TFF2) pozitif hücrelerin bulunduğu gösterilmiştir, bu da MD8,11'de spazmolitik polipeptit eksprese eden metaplazi (SPEM) olduğunu düşündürmektedir.
Bu çalışmada, MT-TGFα farelerin ağır metal tedavisi olmadan MD özellikleri geliştirdiğini gösteriyoruz. Bu fenotipler, ana hücre farklılaşması için gerekli olan ve SPEM'de kaybolan bir transkripsiyon faktörü olan Mist1 ekspresyonunun kaybını içerir. Mist1 kaybı nedeniyle, Mist1-CreERT212 fare hattı, MD'deki SPEM'in soy takibi ile ana hücrelerden kaynaklanıp kaynaklanmadığını incelemek için MT-TGFα fare hattı ile birlikte kullanılamadı. MT-TGFα fare modelinin sızıntısının üstesinden gelmek amacıyla yeni bir MD fare modeli geliştirdik (CMV-rtTA13; TetO-TGFα14), burada TGFα doksisiklin tedavisi (Doxi-TGFα) ile indüklenir. Bu fare modelinin aynı zamanda MD'nin özelliklerini de gösterdiğini onayladık. Doxi-TGFα fare modelini kullanarak, SPEM'in Mist1-CreERT2 fare serisini kullanarak soy takibi yoluyla ana hücrelerden ortaya çıktığını gösterdik. Bu çalışmada iki MD fare modeli tanıtılmaktadır. Her iki model de patogenezi araştırmak ve potansiyel terapötik hedefleri araştırmak için kullanılabilir. Yeni Doxi-TGFα fare, MD fenotiplerinin başlatılmasının hassas bir şekilde kontrol edilmesi gerektiğinde veya Mist1-CreERT2 fare serisi kullanılarak ana hücrelerde genetik modifikasyon gerektiğinde özellikle değerli olacaktır.
Protokol
Tüm hayvancılık ve prosedürler, Yale Üniversitesi'ndeki Kurumsal Hayvan Bakımı ve Kullanımı Komiteleri tarafından ve Araştırma, Öğretim ve Testlerde Kullanılan Hayvanların Kullanımı ve Bakımına İlişkin ABD Hükümeti İlkelerine uygun olarak onaylanmıştır.
1. Fare deneyleri
- Fare tedavileri
- MT-TGFα farelerini (2-4 aylık hem erkek hem de dişi) TGFα aşırı ekspresyonunu indüklemek için 2 hafta boyunca içme suyunda 25 mM ZnSO4 ile tedavi edin.
- CMV-rtTA/+'yı tedavi edin; TetO-TGFα / + (Doxi-TGFa) fareler (2-4 aylık yaşlarda hem erkek hem de dişi), TGFα aşırı ekspresyonunu indüklemek için 2 hafta boyunca içme suyunda 2 mg / mL doksisiklin ile.
- Bir Mist1-CreERT2/+ ekleyin; R26-LSL-mTmG/+ erkek veya dişi fare ve MD fare modellerinde ana hücrelerin soy takibi için üreme kafesine karşı cinsten bir Doxi-TGFα fare ekleyin.
- Mist1-CreERT2/+ enjekte edin; R26-LSL-mTmG/+; CMV-rtTA/+; TetO-TGFα / + fareler (2-4 aylık yaşlarda hem erkek hem de dişi) intraperitoneal olarak tamoksifen (37.5 mg / kg). Art arda 7 gün boyunca, karnın sağ ve sol alt kadranları arasında geçiş yaparak ve iç organlara çarpmaktan kaçınarak enjekte edin. 2 hafta boyunca içme suyunda doksisiklin tedavisi (2 mg / mL) ile TGFα ekspresyonunu indükleyin.
NOT: Midede tamoksifen kaynaklı yaralanma olup olmadığını kontrol edin15,16, burada tamoksifen tedavisi olan ve olmayan vahşi tip farelerde parietal hücreleri sayarak yapıldığı gibi (Ek Şekil 1).
- Mide dokusu fiksasyonu
- 2 haftalık TGFα aşırı ekspresyonundan sonra fareleri izofluran doz aşımı ile ötenazi yapın. Kimyasal davlumbazda bir kurutucu kavanoz kullanarak, fareleri sıvı anestezik ile doğrudan teması önleyen delikli bir platforma yerleştirin. Kapağı kapatın ve fareleri 60 saniyeden fazla solunum eksikliği çekene kadar izleyin, ardından servikal çıkık gelir.
- Gastroözofageal bileşkeden keserek, mideye yapışık 5 mm duodenum ile duodenum kesilerek ve mide çevresindeki tüm peritoneal ligamentler makas ve forseps kullanılarak çıkarılarak mideyi diseke edin (Şekil 1A).
- Duodenal tarafa bağlı bir pipet ucu ile 10 mL'lik bir şırınga kullanarak fosfat tamponlu salin (PBS) damlatın. Luminal içeriği çıkarmak için parmaklarınızı kullanarak sıkın. 3x tekrarlayın (Şekil 1B).
- Pipet ucu takılı başka bir 10 mL şırınga kullanarak mideyi 2 mL% 10 formalin ile şişirin. Ucu mideden çıkarırken gastroduodenal bileşkede 5-10 saniye boyunca forseps ile sıkıca sıkıştırın (Şekil 1C).
- Şişirilmiş mideyi gece boyunca 4 °C'de çalkalanarak %10 formaline batırın (Şekil 1D).
DİKKAT: Formalin gibi toksik maddelerle çalışırken uygun koruyucu ekipman kullanın.
- Parafin gömülmesi için midenin hazırlanması
- Bir tıraş bıçağı kullanarak onikiparmak bağırsağını ve ön midiyi kesin (Şekil 1E). Mide dokusunu PBS ile 5 dakika, 3 kez çalkalayarak durulayın.
- Mideyi bir tıraş bıçağı kullanarak aynı kalınlıkta (3-5 mm) 3-4 halka halinde kesin. Oryantasyonu korumak için mide halkalarını% 2 agaroz içine gömün. Mide halkalarını, daha az eğri olan tarafı aynı yönde konumlandırarak proksimalden distal olanlara doğru sırayla yerleştirin (Şekil 1F).
- Agarozlara gömülü mide halkalarını bir doku kasetine yerleştirin (Şekil 1G) ve örnekleri parafin gömme17 için histoloji çekirdek tesisine gönderin.
2. İmmünofloresan boyama
- Slayt hazırlama
- Üzerlerinde parafin bölümleri bulunan kaydırakları kuru bir fırında veya 60 °C'ye ayarlanmış bir ısı bloğunda en az 1 saat ila gece boyunca ısıtın. Oda sıcaklığına soğumaya bırakın ve bir sürgülü rafa yerleştirin.
- Deparafinizasyon, rehidrasyon ve antijen alımı
- A ve B olmak üzere iki slayt kavanozunu etiketleyin ve her birini dokuyu tamamen daldırmak için yeterli Trilogy solüsyonuyla doldurun.
- Sürgülü rafı Kavanoz A'ya yerleştirin ve her iki kavanozu da düdüklü tencereye koyun. Düdüklü tencereyi 15 dakika yüksek basınca ayarlayın. Slaytları açmadan ve almadan önce düdüklü tencerenin soğumasını bekleyin.
- Parafinin slaytlardan çıkarıldığından emin olmak için sürgülü rafı hemen Kavanoz A'dan Kavanoz B'ye 2 dakika boyunca yerleştirin. Sürgüleri Kavanoz B'den çıkarın ve deiyonize (DI) suya koyun.
NOT: Kavanoz A, bir kez kullanılmış Üçleme ile doldurulabilir. Kavanoz B'de her zaman Yeni Üçleme kullanılmalıdır. - Blokaja devam etmeden önce slaytları 5 dakika boyunca Tris tamponlu tuzlu su içine (TBS) yerleştirin.
- Spesifik olmayan arka plan lekelenmesini engelleme
- Slaytları sürgülü raftan çıkarın ve fazla TBS'yi çıkarmak için yanlara doğru hafifçe vurun.
- Hidrofobik bir işaretleyici kullanarak dokunun etrafına bir kutu çizin. Dokuyu tamamen kaplamak için bloke edici tampon uygulayın ve oda sıcaklığında nemlendirilmiş bir odada 30-60 dakika inkübe edin.
- Primer antikorlarla inkübasyon
- Farklı konakçı türlerde yetiştirilen hedef proteinlerin birincil antikorlarını seçin ve üreticinin tavsiyesine göre antikor seyreltici içinde seyreltin. Bu çalışma için aşağıdaki antikorlar kullanıldı: H+/K+-ATPaz, GIF, Mist118,19 ve CD44v920,21. Primer antikorlar hakkında ayrıntılı bilgi Malzeme Tablosunda bulunabilir.
- Bloke edici tamponu çıkarın, seyreltilmiş antikorlar uygulayın ve slaytları nemlendirilmiş odaya geri yerleştirin. Gece boyunca 4 °C'de inkübe edin.
- Birincil antikorları çıkarın ve her yıkama için 5 dakika boyunca TBS'de 3x slaytları yıkayın.
- İkincil antikorlar ve lektinler
- Primer antikorların konakçı türüne göre sekonder antikorları seçin. Lektinler ikincil antikorlarla karıştırılabilir ve aynı anda uygulanabilir.
- İkincil antikorları ve lektinleri, antikor seyrelticideki üreticinin tavsiyelerine göre seyreltin. Bu çalışmada kullanılan ikincil antikorlar ve lektinler hakkında ayrıntılı bilgi Malzeme Tablosunda bulunabilir.
- İkincil antikorlar, lektinler ve DAPI (1 μg/mL) uygulayın ve slaytları nemlendirilmiş odaya geri yerleştirin. Oda sıcaklığında ışıktan uzakta 1 saat inkübe edin.
- Slaytları nemlendirilmiş hazneden çıkarın ve her yıkama için 5 dakika boyunca TBS ile 3x durulayın.
- Montaj ve mikroskopi hazırlama
- TBS'den bir slaytı çıkarın ve slaytı bir kağıt havlu üzerinde yanlamasına vurarak fazla sıvıyı çıkarın.
- 15-20 μL montaj ortamı ekleyin. Kenarlarından temiz bir lamel tutun ve bir kenarı, montaj ortamı aralarında olacak şekilde dokunun karşısına yerleştirin.
- Lameli yavaşça indirin, böylece ortam dokuya eşit şekilde yayılır ve kabarcıkların sıkışmasını önlemek için dikkatli olun.
- Kenarlardaki aşırı montaj ortamını emmek için bir görev mendili kullanın. Mikroskoba geçmeden önce bitmiş slaytı karanlıkta oda sıcaklığında kurutun. Kalan slaytlar için bu işlemi tekrarlayın.
Sonuçlar
Yetişkin vahşi tip (WT) ve MT-TGFα fareleri, kurban edilmeden önce 2 hafta boyunca içme suyunda çinko sülfat (25 mM ZnSO4) aldı. WT farelerinin mideleri kaba ve histolojik olarak normal görünüyordu. Belirgin bir kontrast olarak, MT-TGFα'nın mideleri büyük ölçüde kalınlaşmıştır (Şekil 2A). Mikroskobik olarak, bu mideler hem parietal hem de ana hücrelerin kaybıyla birlikte masif foveolar hiperplazi gösterdi (Şekil 2B-D), bu da Ménétrier hastalığının (MD) histolojik özelliklerini özetledi. Baş hücrelerin kaybı iki farklı şekilde ortaya çıkabilir: ana hücrelerin ölümü veya baş hücrelerden kaynaklanan spazmolitik polipeptit eksprese eden metaplazi (SPEM). Bu iki olasılığı ayırt etmek için, Mist1-CreERT2'yi çaprazlayarak ana hücrelerin soy izlemesini gerçekleştirdik; MT-TGFα farelere sahip R26-LSL-mTmG fareler. Bu fareler ilk önce düşük doz tamoksifen (art arda 7 gün boyunca intraperitoneal olarak 37.5 mg / kg) ile ana hücreleri GFP ile etiketlemek için ve daha sonra TGFα aşırı ekspresyonunu indüklemek için içme suyunda ZnSO4 ile muamele edildi. MT-TGFα farelerinde nadir GFP etiketli hücreler gözlemledik (veriler gösterilmemiştir). Ek olarak, MT-TGFα farelerinde ZnSO4'ün varlığında veya yokluğunda brüt ve histolojik fark yoktu (Şekil 3A-C). Bu bulgu için olası bir açıklama, TGFα'nın ana hücreler18 için önemli bir transkripsiyon faktörü olan Mist1'in ekspresyonunu azaltmış olabileceği ve Mist1-CreERT2 alelinin kullanışlılığını bozmuş olabileceğiydi. Aslında, ZnSO4 tedavisi olmayan MT-TGFα farelerinde Mist1 için immünohistokimyasal boyama kaybolmuştur (Şekil 3D).
MT-TGFα fare modelinin sızıntısının üstesinden gelmek için, doksisiklin ile indüklenebilen bir Doxi-TGFa transgenik modeline döndük. Bu, TetO-TGFα farelerinin14 bir CMV-rtTA fare hattı13'e çaprazlanmasıyla elde edildi; rtTA'nın midede eksprese edildiği daha önce bildirilmişti. Bu yeni MD fare modelinde 2 haftalık doksisiklin tedavisinin foveolar hiperplaziyi indüklediğini ve parietal ve ana hücre sayısını azalttığını doğruladık (Şekil 4A-C). MT-TGFα farelerindeki histomorfolojik özelliklerle karşılaştırıldığında, Doxi-TGFα fareleri daha az şiddetli mukozal kalınlık ve foveolar hiperplazi ve ayrıca parietal hücrelerde daha az azalma gösterdi (Ek Şekil 2). Bununla birlikte, Mist1-CreERT2 fare hattını kullanarak baş hücreleri soy izi yapabildik ve ana hücre soylarının da GSII ve CD44v920,21 ile etiketlendiğini doğruladık, bu da TGFα aşırı ekspresyonunun baş hücrelerden SPEM'i indüklediğini doğruladı (Şekil 4D).
Mevcut çalışma, MT-TGFα fare modelinin, ağır metal tedavisinin yokluğunda, muhtemelen promotör/güçlendiricinin içsel sızıntısı ve/veya ağır metal maruziyetinden kaçınılamaması nedeniyle MD'nin histopatolojik özelliklerini fenoskopilere tabi tuttuğunu göstermektedir (Şekil 3 ve Ek Şekil 2). TGFα, Mist1 ifadesini bastırdığından, Mist1-CreERT2 fare serisi MT-TGFα fare modelinde kullanılamaz. TGFα ekspresyonunun doksisiklin tedavisi ile indüklenebileceği yeni bir MD fare modeli oluşturduk. Bu yeni Doxi-TGFα MD fare modelini kullanarak, TGFα aşırı ekspresyonunun ana hücrelerden türetilen SPEM'i indüklediğini doğrulayabildik. Doxi-TGFα MD fare modeli, TGFα ekspresyonunun hassas kontrolünün gerekli olduğu durumlarda ve ayrıca Mist1-CreERT2 fare serisi kullanılarak ana hücrelerde genetik değişikliğin gerekli olduğu durumlarda faydalı olacaktır.
Veri kullanılabilirliği:
Tüm ham veriler ek dosyalar olarak mevcuttur.
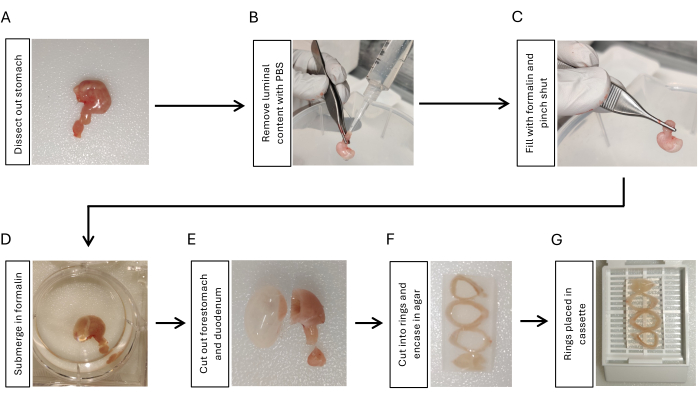
Şekil 1: Mide dokusu gömmesinin fiksasyonu ve hazırlanması için iş akışı. (A) Mideyi, duodenumun kısa bir segmenti (3-5 mm) ile birlikte inceleyin. (B) Pipet uçlu bir şırınga kullanarak duodenumdan PBS'yi aşılayarak ve parmaklarınızla 3 kez sıkarak luminal içeriği çıkarın. (C) Bir şırınga kullanarak mideyi duodenumdan formalin ile şişirin ve formalini tutmak için gastroduodenal bileşkeyi sıkıştırın. (D) Mideyi formaline batırın ve gece boyunca 4 ° C'de çalkalayarak sabitleyin. (E) Ön mideye ve duodenuma bir jiletle çıkarın ve PBS ile durulayın. (F) Mide gövdesini ve antrumu kesitsel bir şekilde 3-4 halka halinde kesin ve mide dokusu halkalarının oryantasyonunu korumak için bunları %2 agaroz içine gömün. (G) Agaroz gömülü dokuyu kasetlere yerleştirin. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
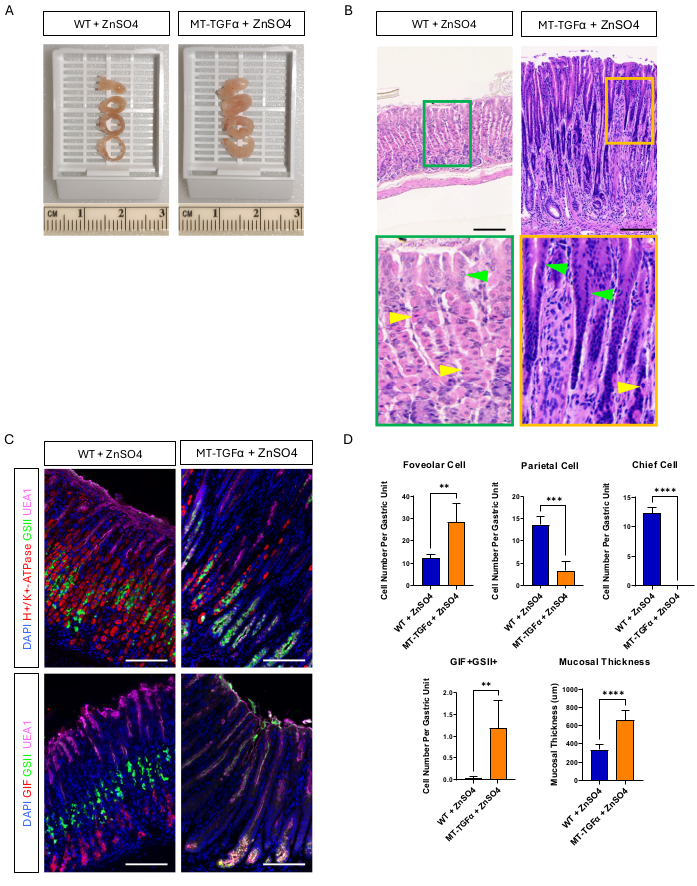
Şekil 2: Ağır metal ZnSO4 ile muamele edilmiş MT-TGFα farelerinin brüt ve mikroskobik fenotipleri. (A) MT-TGFα farelerinde (sağda) mide duvarı, kontrol farelerine (solda) kıyasla daha kalındır. (B) MT-TGFα farelerinden (sağda) alınan mide, masif foveolar hiperplazi ve parietal hücre kaybı gösterir. Sarı ok uçları parietal hücreleri, yeşil ok uçları ise foveolar hücreleri gösterir. Ölçek çubukları 100 μm'yi temsil eder. (C) İmmünofloresan boyama, MT-TGFα fare midesinin (sağda) foveolar hücre (UEA1 pozitif) ve SPEM hücresi (GIF ve GSII çift pozitif) ve parietal hücre (H + / K + -ATPaz pozitif) ve baş hücre (GIF tek pozitif) sayılarında azalma gösterdiğini doğrular. Ölçek çubukları 100 μm'yi temsil eder. (D) ZnSO4 (n = 5) ile tedavi edilen vahşi tip (WT) farelerde ve ZnSO4 (n = 3) ile MT-TGFα farelerinde farklı epitel hücre tiplerinin ve mukozal kalınlığın ölçülmesi. Hata çubukları standart sapmayı gösterir (**p < 0.01, ***p < 0.001, ****p < 0.0001). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
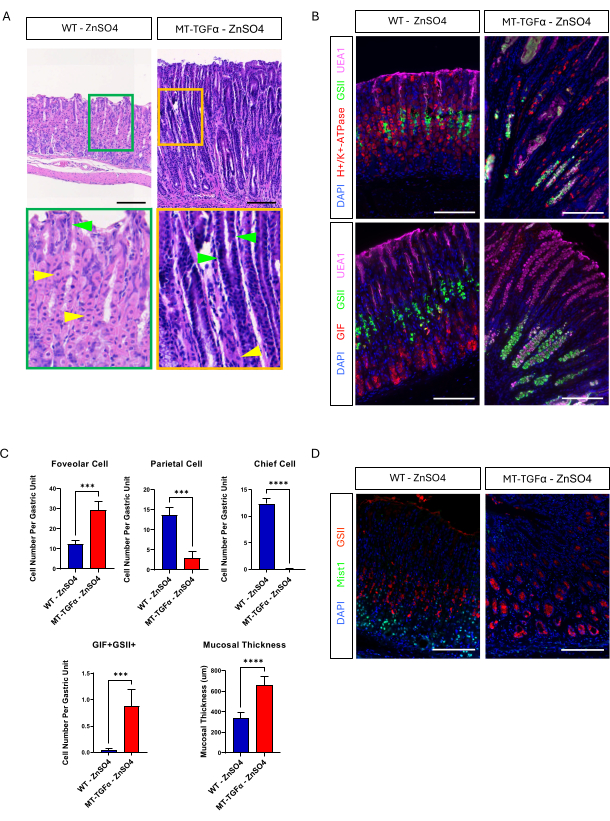
Şekil 3: MT-TGFα fareleri, ağır metal tedavisi olmadan mide fenotipleri geliştirir. (A) MT-TGFα farelerinden alınan mide (sağda), ağır metal tedavisi olmadan masif foveolar hiperplazi ve parietal hücre kaybı gösterir. Sarı ok uçları parietal hücreleri, yeşil ok uçları ise foveolar hücreleri gösterir. Ölçek çubukları 100 μm'yi temsil eder. (B) İmmünofloresan boyama, MT-TGFα fare midesinin (sağda) ağır metal tedavisi olmadan arttığını doğrular, foveolar hücre (UEA1 pozitif) ve SPEM hücresi (GIF ve GSII çift pozitif) ve parietal hücre sayısında azalma (H +/K +-ATPaz pozitif) ve baş hücre (GIF tek pozitif) kontrol faresi midesine (solda) kıyasla. Ölçek çubukları 100 μm'yi temsil eder. (C) ZnSO4 (n = 5) ve MT-TGFα fareleri ZnSO4 (n = 3) olmayan WT farelerinde farklı epitel hücre tiplerinin ve mukozal kalınlığın miktar tayini. Hata çubukları standart sapmayı gösterir (***p < 0.001, ****p < 0.0001). (D) MT-TGFα farelerinden alınan mide (sağda), normalde ana hücrelerde (solda) eksprese edilen Mist1 ekspresyonunun kaybını gösterir. GSII, mukoza boynu hücreleri için bir belirteçtir. Ölçek çubukları 100 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
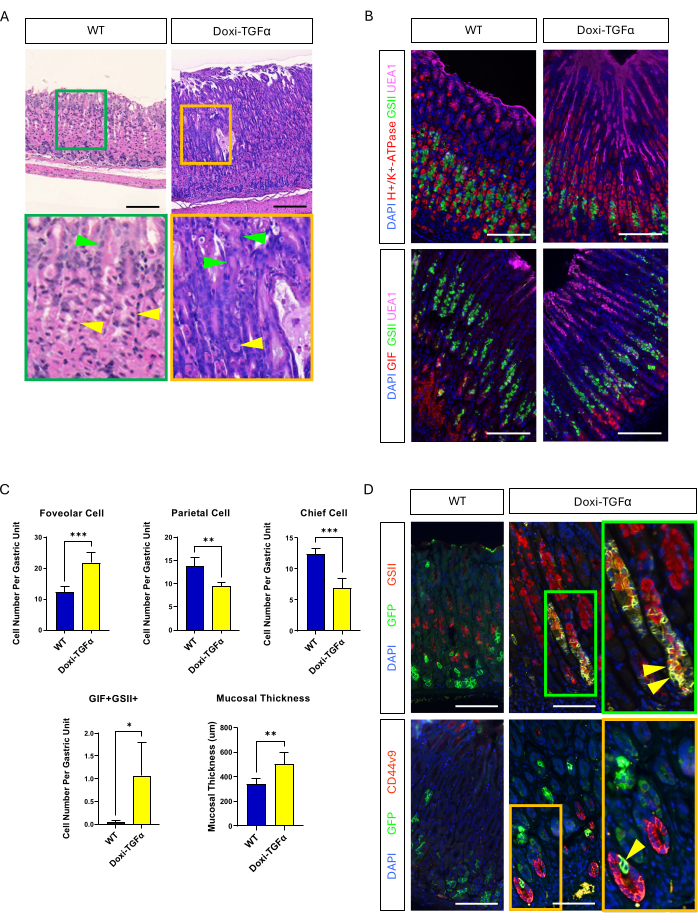
Şekil 4: Doksisiklin ile indüklenebilir TGFα fare modeli (Doxi-TGFα), Ménétrier hastalığı fenotiplerini özetler ve bu fare modelinde SPEM oluşumu doğrulanır. (A) CMV-rtTA'dan mide; TetO-TGFα fareleri (Doxi-TGFα; sağda) masif foveolar hiperplazi ve azalmış parietal hücre sayısı gösterir. Sarı ok uçları parietal hücreleri, yeşil ok uçları ise foveolar hücreleri gösterir. Ölçek çubukları 100 μm'yi temsil eder. (B) İmmünofloresan boyama, Doxi-TGFα fare midesinin (sağda), kontrol faresi midesine (solda) kıyasla foveolar hücrelerin (UEA1 pozitif) ve SPEM hücrelerinin (GIF ve GSII çift pozitif) sayısının arttığını ve parietal hücrelerin (H+/K+-ATPaz pozitif) ve ana hücrelerin (GIF tek pozitif) sayısının azaldığını doğrular. Ölçek çubukları 100 μm'yi temsil eder. (C) WT farelerinde (n = 5) ve Doxi-TGFα farelerinde (n = 5) farklı epitel hücre tiplerinin ve mukozal kalınlığın ölçülmesi. Hata çubukları standart sapmayı gösterir (*p < 0.05, **p < 0.01, ***p < 0.001). (D) Mist1-CreERT2 kullanılarak ana hücrelerin soy takibi (GFP pozitif); R26-LSL-mTmG fare serisi, GFP pozitif hücrelerin Doxi-TGFα fare midesinde GSII ve CD44v9 için de pozitif olduğunu ortaya koymaktadır, bu da ana hücrelerden türetilen SPEM oluşumunu doğrularken, kontrol midesi (solda) neredeyse hiç GFP pozitif hücre göstermemektedir, ayrıca GSII veya CD44v9 için pozitiftir. Ölçek çubukları 100 μm'yi temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Düşük doz tamoksifen (TMX) tedavisi mide mukozal hasarına neden olmaz. Art arda yedi günlük düşük doz TMX tedavisi (37.5 mg / kg), parietal hücre sayısının korunması ile örneklenen gastrik mukozal hasara neden olmaz. (A) TMX işlemi olmayan (sol panel) ve TMX işlemi uygulanmış (sağ panel) temsili H&E görüntüleri. Ölçek çubukları 100 μm'yi temsil eder. (B) WT farelerinde (n = 5) ve TMX tedavisi ile WT'de (n = 5) mide ünitesi başına parietal hücre sayısının ölçülmesi. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Şekil 2: Farklı Ménétrier hastalığı (MD) fare modelleri arasında fenotiplerin karşılaştırılması. (A) ZnSO4 tedavisi ile MT-TGFα, ZnSO4 tedavisi olmayan MT-TGFα ve Doxi-TGFα MD fare modelleri foveolar hiperplazi, parietal ve şef hücrelerin kaybı, artmış spazmolitik polipeptit eksprese eden metaplazi (SPEM) hücreleri (GIF ve GSII ko-lokalize hücreler) ve kalınlaşmış mukoza. ZnSO4 tedavi grupları olan ve olmayan MT-TGFα arasında fenotipik fark yoktur. Doxi-TGFα fare modeli, MT-TGFα fare modeline göre daha az şiddetli fenotipler gösterir. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Ménétrier hastalığı (MD), TGFα aşırı ekspresyonunun neden olduğu nadir bir premalign mide hastalığıdır 1,2,3. Metallotiyonin gen arttırıcı/promotörü (MT-TGFa) kontrolü altında TGFa'yı aşırı eksprese eden transgenik fareler, bugüne kadar MD için tek fare modeli olmuştur 4,5. Metallothionein geni ağır metale duyarlı olduğundan, içme suyuna çinko sülfat eklenir veya bu fare modelinde TGFa'yı indüklemek için kadmiyum sülfat enjekte edilir 5,8. MD'deki karakteristik fenotiplerden biri, mide bezlerinin tabanındaki ana hücrelerin, hem mukoza boynu hücrelerinde hem de antral müsin hücrelerinde bulunan belirteçler için pozitif olan müsinöz hücrelerle yer değiştirmesidir. Bu, ana hücrelerin ölümü veya baş hücrelerin spazmolitik polipeptit eksprese eden metaplaziye (SPEM) yeniden programlanmasıyla ortaya çıkabilir8,11. Bu, bir MD fare modelinde ana hücrelerin soy izlemesi ile test edilebilir. Mist1-CreERT2'yi kullanarak ana hücrelerin soyunu izlemeye çalıştık; Mist1 pozitif baş hücrelerin membran hedefli GFP ile etiketlendiği R26-LSL-mTmG fareleri. Bununla birlikte, MT-TGFα farelerinde yalnızca sınırlı sayıda GFP etiketli hücre gözlemledik. Bu, GFP etiketli ana hücrelerin çoğunun TGFα aşırı ekspresyonu nedeniyle öldüğünü veya baş hücrelerdeki GFP etiketlemesinin etkinliğinin çok düşük olduğunu göstermektedir. TGFα aşırı ekspresyonu8 ile hücre ölümünde bir artış olmadığı bildirildiğinden, ağır metal tedavisi olmayan MT-TGFα fareleri değerlendirerek Mist1 ekspresyonu kaybı olasılığını inceledik. Foveolar hiperplazi ve parietal ve ana hücre kaybı dahil olmak üzere ağır metal tedavisi olmayan MT-TGFα farelerindeki tam fenotipler bizi şaşırttı. Ayrıca, ağır metal tedavisi olmadan bile MT-TGFα farelerinde Mist1 ekspresyonunun kaybolduğunu doğruladık. Daha önce, ağır metal maruziyetinin ortadan kaldırılamaması nedeniyle MT-TGFα farelerinde TGFα ekspresyonunun sıkı bir şekilde kontrol edilmediği bildirilmiştir; bununla birlikte, TGFα ekspresyonu ağır metal tedavisi ile önemli ölçüde artmıştır8. Ağır metal tedavisi olmayan MT-TGFα farelerinde daha önce kapsamlı fenotipik değerlendirme yapılmamıştır. Mevcut çalışma, MT-TGFα farelerinin ağır metal tedavisi olmadan tam fenotipik tezahür geliştirdiğini göstermektedir.
MT-TGFα farelerinde ağır metal muamelesinden önce bile Mist1 ekspresyonu kaybolduğu için, TGFα ekspresyonunun spesifik olarak kontrol edildiği başka bir fare modeline ihtiyaç duyulmuştur, böylece fenotipler TGFα aşırı ekspresyonunun indüksiyonu olmadan gelişmez. TGFα ekspresyonunun doksisiklin tedavisi (Doxi-TGFa) ile indüklendiği yeni bir MD fare modeli oluşturduk. Bu fare modelinin, MD'nin ana fenotipleri olan foveolar hiperplaziye ve parietal ve ana hücrelerin kaybına neden olduğunu doğruladık. Mist1-CreERT2'yi kullanarak soy izleme şefi hücrelerini yapabildik; Bu fare modelindeki R26-LSL-mTmG fareleri ve bazı GFP etiketli hücrelerin de GSII ve CD44v9 ile etiketlendiğini buldu, bu da SPEM'in bu yeni MD fare modelinde meydana geldiğini doğruladı. TGFα aşırı ekspresyonu ile midede SPEM geliştiğini doğrulayan ilk rapordur. SPEM daha sık görülen premalign bir mide rahatsızlığıdır, bu da MD hastalarında mide kanserinin artmasının nedeni olabilir22,23.
Mist1-CreERT2 fare hattının kullanılmasının bir uyarısı, Mist1'in mide kök hücrelerindede eksprese edilebileceğinin bildirilmiş olmasıdır 24. Düşük bir doz (37.5 mg / kg) tamoksifen tedavisinin, doksisiklin tedavisinden önce daha erken zaman noktalarında bile isthmus bölgesinde minimal aktivasyon ile daha spesifik olarak ana hücrelerde Cre aktivasyonunu indüklediğini bulduk. Benzer bulgular daha önce de bildirilmiştir25. Mist1-CreERT2 kullanarak soy izleme; R26-LSL-mTmG fareleri, GFP ve SPEM markörü (GSII ve CD44v9) yakınında GFP pozitif hücreler gösterir, çift pozitif hücreler esas olarak ana hücrelerin bulunduğu tabanda lokalizedir (Şekil 4C). GFP ve SPEM işaretleyici çift pozitif hücreler kök hücrelerden izlenirse, kök hücrelerin bulunduğu kısmusa doğru daha fazla GFP pozitif hücre olması gerekirdi. Alternatif olarak, doksisiklin ile indüklenebilen GIF-rtTA fare hattı26 veya GPR30-rtTA fare hattı27, ana hücrelerin genetik modifikasyonları veya soy takibi için MT-TGFα fareleri ile birlikte kullanılabilir. Bununla birlikte, ZnSO4 tedavisi olmayan MT-TGFα farelerinde GIF pozitif hücreler azalır (Şekil 3B,C) ve ZnSO4 tedavisi olmayan MT-TGFα farelerinde ortaya çıkan SPEM'de GPR30 pozitif hücreler kaybolur. Bu nedenle, Mist1-CreERT2 fare serisi ile çaprazlanan Doxi-TGFα farelere kıyasla daha az verimli olacaklardır.
Mevcut çalışma, MT-TGFα farelerinin ağır metal tedavisi olmadan midede tam fenotipik değişiklikler geliştirdiğini göstermektedir. Ayrıca fenotiplerden birinin Mist1 ekspresyonunun kaybı olduğunu ve bunun Mist1-CreERT2'nin kullanımını engellediğini gösteriyoruz; R26-LSL-mTmG fare hattından soy izleme şefi hücrelerine. Yeni bir MD fare modeli olan Doxi-TGFα'yı oluşturduk ve SPEM'in bu fare modelini kullanarak MD'de geliştiğini ilk kez doğruladık. Bu yeni MD fare modeli, MD fenotiplerinin gelişiminin hassas kontrolünün gerekli olduğu ve Mist1-CreERT2 fare hattı kullanılarak ana hücrelerde genetik modifikasyonların gerekli olduğu durumlarda faydalı olacaktır. MD fenotipleri, TGFα aşırı ekspresyonu ile EGFR sinyal aktivasyonu ile indüklenir. Bununla birlikte, gözlenen fenotiplerden hangi hücre tiplerinin sorumlu olduğu EGFR aktivasyonu bilinmemektedir. Doxi-TGFα fare modelini kullanarak, şu anda Mist1-CreERT2 fare serisini kullanan ana hücreler de dahil olmak üzere farklı hücre tiplerinde EGFR sinyalizasyonunun rolünü araştırıyoruz.
Açıklamalar
Tüm yazarların açıklanması gereken herhangi bir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma Ulusal Diyabet ve Sindirim ve Böbrek Hastalıkları Enstitüsü (K08 DK124686 WJH) tarafından desteklenmiştir. Makaleyi düzenledikleri için Gina Della Porta ve Sarah E. Glass'a teşekkür ederiz.
Yazar katkısı:
TTG deneyler yaptı, şekiller üretti, el yazmasını yazdı ve el yazmasını düzenledi. AK Parti deneyler yaptı, rakamlar üretti, el yazmasını yazdı ve el yazmasını düzenledi. SKM, TetO-TGFα fare serisini sağladı ve el yazmasını düzenledi. RJC deneyler tasarladı ve el yazmasını düzenledi. WJH deneyler tasarladı, deneyler yaptı, verileri yorumladı, literatürü araştırdı, el yazmasını yazdı ve el yazmasını düzenledi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Mouse anti H+/K+-ATPase antibody | A gift from Dr. Eunyoung Choi | N/A | Dilution: 1:10000 |
| Antibody Diluent | Abcam | 559148 | |
| Anti-rabbit GFP | Life Technologies Corporation | A11122 | Dilution: 1:500 |
| Charged Glass Slides | Fisher | 22-178-277 | |
| Cover Slips | Globe Scientific | 1411-10 | |
| Donkey anti-mouse 594 | Invitrogen | A12102 | Dilution: 1:500 |
| Donkey anti-rabbit 488 | Invitrogen | A21206 | Dilution: 1:500 |
| Donkey anti-rabbit 594 | Invitrogen | A21207 | Dilution: 1:500 |
| Donkey anti-rat 594 | Invitrogen | A21209 | Dilution: 1:500 |
| Doxyclycine Hyclate | TCI | D4116 | |
| Flouromount-G | Thermo fischer | 00-4958-02 | |
| GSII 488 | Invitrogen | L21415 | Dilution: 1:500 |
| Hydrophobic Marker | Electron Microscopy Sciences | 71312 | |
| Incubator | Labnet | I 5110 | |
| MIST1/bHLHa15 (D7N4B) XP Rabbit mAb | Cell Signaling | 14896S | Dilution: 1:200 |
| Pressure Cooker (6QT) | Cuisinart | CPC-600N1 | |
| Protein Block | Abcam | AB64226 | |
| Rabbit anti-GIF antibody | MyBioSource | MBS2028736 | Dilution: 1:200 |
| Rat anti CD44v9 mAb | Cosmo Bio | LKG-M002 | Dilution: 1:20000 |
| Slide Jars | Simport | M906-12AS | |
| Tamoxifen | Sigma-Aldrich | T5648 | |
| Trilogy | Sigma | 922P-10-RUO | |
| UEA1 Dylight 649 | Vector Laboratories | DL-1068 | Dilution: 1:500 |
Referanslar
- Huh, W. J., Coffey, R. J., Washington, M. K. Menetrier's disease: Its mimickers and pathogenesis. J Pathol Transl Med. 50 (1), 10-16 (2016).
- Tanksley, J. Jr, Tanksley, J. Pierre menetrier and his disease. Trans Am Clin Climatol Assoc. 123, discussion 133-124 126-133 (2012).
- Rich, A., et al. Distinguishing menetrier's disease from its mimics. Gut. 59 (12), 1617-1624 (2010).
- Takagi, H., Jhappan, C., Sharp, R., Merlino, G. Hypertrophic gastropathy resembling menetrier's disease in transgenic mice overexpressing transforming growth factor alpha in the stomach. J Clin Invest. 90 (3), 1161-1167 (1992).
- Dempsey, P. J., et al. Possible role of transforming growth factor alpha in the pathogenesis of menetrier's disease: Supportive evidence form humans and transgenic mice. Gastroenterology. 103 (6), 1950-1963 (1992).
- Fiske, W. H., et al. Efficacy of cetuximab in the treatment of menetrier's disease. Sci Transl Med. 1 (8), 8ra18(2009).
- Burdick, J. S., et al. Treatment of menetrier's disease with a monoclonal antibody against the epidermal growth factor receptor. N Engl J Med. 343 (23), 1697-1701 (2000).
- Goldenring, J. R., et al. Overexpression of transforming growth factor-alpha alters differentiation of gastric cell lineages. Dig Dis Sci. 41 (4), 773-784 (1996).
- Sharp, R., et al. Transforming growth factor alpha disrupts the normal program of cellular differentiation in the gastric mucosa of transgenic mice. Development. 121 (1), 149-161 (1995).
- Bockman, D. E., Sharp, R., Merlino, G. Regulation of terminal differentiation of zymogenic cells by transforming growth factor alpha in transgenic mice. Gastroenterology. 108 (2), 447-454 (1995).
- Nomura, S., et al. Evidence for repatterning of the gastric fundic epithelium associated with menetrier's disease and tgfalpha overexpression. Gastroenterology. 128 (5), 1292-1305 (2005).
- Shi, G., et al. Loss of the acinar-restricted transcription factor mist1 accelerates kras-induced pancreatic intraepithelial neoplasia. Gastroenterology. 136 (4), 1368-1378 (2009).
- Kistner, A., et al. Doxycycline-mediated quantitative and tissue-specific control of gene expression in transgenic mice. Proc Natl Acad Sci U S A. 93 (20), 10933-10938 (1996).
- Hardie, W. D., et al. Conditional expression of transforming growth factor-alpha in adult mouse lung causes pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 286 (4), L741-L749 (2004).
- Keeley, T. M., Horita, N., Samuelson, L. C. Tamoxifen-induced gastric injury: Effects of dose and method of administration. Cell Mol Gastroenterol Hepatol. 8 (3), 365-367 (2019).
- Huh, W. J., et al. Tamoxifen induces rapid, reversible atrophy, and metaplasia in mouse stomach. Gastroenterology. 142 (1), 21-24.e7 (2012).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods Enzymol. 533, 225-233 (2013).
- Ramsey, V. G., et al. The maturation of mucus-secreting gastric epithelial progenitors into digestive-enzyme secreting zymogenic cells requires mist1. Development. 134 (1), 211-222 (2007).
- Huh, W. J., et al. Xbp1 controls maturation of gastric zymogenic cells by induction of mist1 and expansion of the rough endoplasmic reticulum. Gastroenterology. 139 (6), 2038-2049 (2010).
- Engevik, A. C., et al. The development of spasmolytic polypeptide/tff2-expressing metaplasia (spem) during gastric repair is absent in the aged stomach. Cell Mol Gastroenterol Hepatol. 2 (5), 605-624 (2016).
- Wada, T., et al. Functional role of cd44v-xct system in the development of spasmolytic polypeptide-expressing metaplasia. Cancer Sci. 104 (10), 1323-1329 (2013).
- Halldorsdottir, A. M., et al. Spasmolytic polypeptide-expressing metaplasia (spem) associated with gastric cancer in iceland. Dig Dis Sci. 48 (3), 431-441 (2003).
- Yamaguchi, H., Goldenring, J. R., Kaminishi, M., Lee, J. R. Identification of spasmolytic polypeptide expressing metaplasia (spem) in remnant gastric cancer and surveillance postgastrectomy biopsies. Dig Dis Sci. 47 (3), 573-578 (2002).
- Hayakawa, Y., et al. Mist1 expressing gastric stem cells maintain the normal and neoplastic gastric epithelium and are supported by a perivascular stem cell niche. Cancer Cell. 28 (6), 800-814 (2015).
- Saenz, J. B., Vargas, N., Cho, C. J., Mills, J. C. Regulation of the double-stranded rna response through adar1 licenses metaplastic reprogramming in gastric epithelium. JCI Insight. 7 (3), e153511(2022).
- Caldwell, B., Meyer, A. R., Weis, J. A., Engevik, A. C., Choi, E. Chief cell plasticity is the origin of metaplasia following acute injury in the stomach mucosa. Gut. 71 (6), 1068-1077 (2022).
- Hata, M., et al. Gpr30-expressing gastric chief cells do not dedifferentiate but are eliminated via pdk-dependent cell competition during development of metaplasia. Gastroenterology. 158 (6), 1650-1666.e15 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır