Research Article
Desarrollo de modelos murinos para la enfermedad de Ménétrier
En este artículo
Resumen
El estudio actual demuestra que los ratones MT-TGFα exhiben metaplasia espasmolítica que expresa polipéptidos (SPEM) en el estómago. La permeabilidad del promotor impidió la demostración de que los principales linajes celulares se remontan a SPEM. Por lo tanto, desarrollamos adicionalmente un modelo de ratón inducible por doxiciclina (Doxi-TGFα) y confirmamos que SPEM se deriva de células principales.
Resumen
La enfermedad de Ménétrier (MD) es un trastorno gástrico premaligno adquirido poco frecuente caracterizado por pliegues rugosos gigantes, disminución de la secreción de ácido y pérdida de proteínas. Los pacientes con distrofia muscular muestran un aumento de la expresión de un ligando del receptor de EGF (EGFR), el factor de crecimiento transformante α (TGFα) en el estómago. El anticuerpo neutralizante del EGFR, cetuximab, produce una rápida mejoría clínica y remisión histológica. Más allá de estos hallazgos, la etiología y los mecanismos moleculares subyacentes no se comprenden bien. La línea de ratones transgénicos Metalotioneína (MT)-TGFα es el primer modelo de ratón con distrofia muscular que recapitula las características histopatológicas de la distrofia muscular, incluida la hiperplasia foveolar y la pérdida de células parietales. En este modelo de ratón, el TGFα es impulsado por el potenciador/promotor de MT inducible por metales pesados. Estudios previos han utilizado sulfato de zinc (ZnSO4) en agua potable o inyecciones intraperitoneales de sulfato de cadmio (CdSO4) para inducir TGFα. Sin embargo, encontramos que los ratones MT-TGFα desarrollan fenotipos sin tratamiento con metales pesados, lo que indica fugas del promotor. También encontramos que la sobreexpresión de TGFα suprime la expresión de Mist1, un factor de transcripción importante para la diferenciación de las células principales, lo que dificulta la manipulación genética en las células principales que utilizan la línea de ratón Mist1-CreERT2. Para superar esto, desarrollamos un modelo de ratón inducible (Doxi-TGFα) en el que el TGFα es inducido por el tratamiento con doxiciclina (CMV-rtTA; TetO-TGFα). Aunque el modelo de ratón Doxi-TGFα desarrolla fenotipos más leves que el modelo MT-TGFα, recapituló las características de la DM, incluida la hiperplasia foveolar y la pérdida de células parietales. Utilizando el modelo de ratón Doxi-TGFα, encontramos que la metasia espasmolítica que expresa polipéptidos (SPEM) se induce en la MD, y el SPEM se deriva de las células principales mediante el rastreo de linaje utilizando la línea de ratón Mist1-CreERT2. Tanto el modelo de ratón MT-TGFα como el modelo de ratón Doxi-TGFα ofrecen modelos in vivo de DM y son útiles para investigar los mecanismos moleculares que subyacen a la patogénesis de la DM y las opciones de tratamiento para la enfermedad. Los ratones Doxi-TGFα también serán un modelo útil para estudiar los efectos de la sobreexpresión de TGFα en otros tejidos.
Introducción
La enfermedad de Ménétrier (MD), también conocida como gastropatía hipertrófica perdedora de proteínas, es una afección gástrica premaligna poco frecuente. Los estómagos de los pacientes con distrofia muscular muestran una hiperplasia foveolar masiva, que conduce a un aumento de la secreción de moco gástrico, y una disminución del número de células parietales, lo que conduce a una disminución de la secreción de ácido gástrico. Además, la proteína se pierde selectivamente a través de la mucosa gástrica, lo que conduce a hipoalbuminemia y edema periférico 1,2,3. La patogenia de la distrofia muscular no se conocía hasta que se informó de que los ratones transgénicos que sobreexpresaban TGFα bajo el control del potenciador/promotor del gen de la metalotioneína (MT) recapitulaban los fenotipos de la distrofia muscular en el estómago 4,5. Los estómagos de los pacientes con distrofia muscular también mostraron una mayor expresión de TGFα, un ligando del receptor de EGF (EGFR). Se ha informado de que el cetuximab, un anticuerpo anti-EGFR, es el primer tratamiento médico eficaz para la distrofia muscular, lo que confirma que la activación del EGFR por la sobreexpresión de TGFα contribuye a la patogénesis de la distrofia muscular 6,7.
Desde entonces, la línea de ratón MT-TGFα se ha utilizado como modelo de ratón para la MD. Debido a que la expresión de TGFα está regulada por el gen de respuesta a metales pesados, se han utilizado potenciadores/promotores de metalotioneína, sulfato de zinc (ZnSO4) en agua potable o inyecciones intraperitoneales de sulfato de cadmio (CdSO4) para inducir la expresión de TGFα 5,8. El modelo de ratón MT-TGFα se ha caracterizado aún más para los fenotipos de la distrofia muscular. Utilizando este modelo de ratón, se ha demostrado que el TGFα induce la diferenciación de las células foveolares de superficie secretoras de mucina, mientras que inhibe la diferenciación en linajes de células parietales secretoras de ácido y células principales secretoras de pepsinógenos 9,10. También se ha demostrado que el cuerpo gástrico/mucosa fúndica se antraliza y que las células positivas para el factor trébol 2 (TFF2) están presentes en la base de las glándulas gástricas, lo que sugiere que la metaplasia espasmolítica que expresa polipéptidos (SPEM) ocurre en la DM 8,11.
En el estudio actual, mostramos que los ratones MT-TGFα desarrollan características de MD sin tratamiento con metales pesados. Estos fenotipos incluyen la pérdida de la expresión de Mist1, un factor de transcripción que es esencial para la diferenciación celular principal y que se pierde en SPEM. Debido a la pérdida de Mist1, la línea de ratón Mist1-CreERT212 no se pudo utilizar junto con la línea de ratón MT-TGFα para examinar si SPEM en MD surge de las células principales mediante el rastreo de linaje. Con el objetivo de superar la permeabilidad del modelo de ratón MT-TGFα, desarrollamos un nuevo modelo de ratón MD (CMV-rtTA13; TetO-TGFα14) donde el TGFα es inducido por el tratamiento con doxiciclina (Doxi-TGFα). Confirmamos que este modelo de mouse también muestra características de MD. Utilizando el modelo de ratón Doxi-TGFα, demostramos que SPEM surge de las células principales mediante el rastreo de linaje utilizando la línea de ratón Mist1-CreERT2. En el presente estudio presentamos dos modelos de ratón con distrofia muscular. Ambos modelos se pueden utilizar para investigar la patogénesis y buscar posibles dianas terapéuticas. El nuevo ratón Doxi-TGFα será especialmente valioso cuando el inicio de los fenotipos de MD deba controlarse con precisión o cuando se requiera la modificación genética en las células principales utilizando la línea de ratones Mist1-CreERT2.
Protocolo
Toda la cría de animales y los procedimientos fueron aprobados por los Comités Institucionales de Cuidado y Uso de Animales de la Universidad de Yale y de acuerdo con los Principios del Gobierno de los Estados Unidos para la Utilización y el Cuidado de los Animales Utilizados en la Investigación, la Enseñanza y las Pruebas.
1. Experimentos con ratones
- Tratamientos con ratones
- Tratar a los ratones MT-TGFα (tanto machos como hembras a las edades de 2 a 4 meses) con 25 mM de ZnSO4 en agua potable durante 2 semanas para inducir la sobreexpresión de TGFα.
- Tratar el CMV-rtTA/+; Ratones TetO-TGFα/+ (Doxi-TGFα) (machos y hembras a las edades de 2-4 meses) con 2 mg/mL de doxiciclina en agua potable durante 2 semanas para inducir la sobreexpresión de TGFα.
- Agregue un Mist1-CreERT2/+; Ratón macho o hembra R26-LSL-mTmG/+ y añadir un ratón Doxi-TGFα del sexo opuesto en la jaula de cría para el rastreo del linaje de las células principales en modelos de ratón MD.
- inyectar Mist1-CreERT2/+; R26-LSL-mTmG/+; CMV-rtTA/+; Ratones TetO-TGFα/+ (machos y hembras a las edades de 2-4 meses) con tamoxifeno (37,5 mg/kg) por vía intraperitoneal. Inyectar durante 7 días consecutivos, alternando entre los cuadrantes inferiores derecho e izquierdo del abdomen y evitando golpear los órganos internos. Inducir la expresión de TGFα mediante tratamiento con doxiciclina (2 mg/mL) en agua potable durante 2 semanas.
NOTA: Verifique que no haya lesiones inducidas por tamoxifeno en el estómago15,16, como se hace aquí contando las células parietales en ratones de tipo salvaje con y sin tratamiento con tamoxifeno (Figura suplementaria 1).
- Fijación del tejido estomacal
- Eutanasia de ratones por sobredosis de isoflurano después de 2 semanas de sobreexpresión de TGFα. Usando un frasco desecador en una campana de gases químicos, coloque a los ratones en una plataforma perforada que evite el contacto directo con el anestésico líquido. Cierre la tapa y controle a los ratones hasta que les falte la respiración durante más de 60 segundos, seguida de una luxación cervical.
- Diseccionar el estómago mediante una incisión en la unión gastroesofágica, una incisión en el duodeno con un duodeno de 5 mm unido al estómago y la extracción de todos los ligamentos peritoneales alrededor del estómago con tijeras y pinzas (Figura 1A).
- Instilar solución salina tamponada con fosfato (PBS) con una jeringa de 10 ml con una punta de pipeta unida al lado duodenal. Apriétalo con los dedos para eliminar el contenido luminal. Repita 3 veces (Figura 1B).
- Infle el estómago con 2 ml de formalina al 10% con otra jeringa de 10 ml con una punta de pipeta adherida. Sujete firmemente con pinzas la unión gastroduodenal durante 5-10 s mientras retira la punta del estómago (Figura 1C).
- Sumerja el estómago inflado en formol al 10% durante la noche a 4 °C agitando (Figura 1D).
PRECAUCIÓN: Utilice el equipo de protección adecuado cuando trabaje con sustancias tóxicas como la formalina.
- Preparación del estómago para la inclusión en parafina
- Cortar el duodeno y el anteestómago con una cuchilla de afeitar (Figura 1E). Enjuague el tejido estomacal con PBS durante 5 minutos, 3 veces agitando.
- Corta el estómago en 3-4 aros del mismo grosor (3-5 mm) con una cuchilla de afeitar. Incruste los anillos estomacales en agarosa al 2% para mantener la orientación. Coloque los anillos estomacales secuencialmente desde los proximales a los distales colocando el lado de menor curvatura en la misma dirección (Figura 1F).
- Coloque los anillos estomacales incrustados en las agarosas en un casete de papel (Figura 1G) y envíe las muestras a la instalación central de histología para su inclusión en parafina17.
2. Tinción inmunofluorescente
- Preparación de portaobjetos
- Caliente los portaobjetos con secciones de parafina en un horno seco o en un bloque de calor ajustado a 60 °C durante un mínimo de 1 h hasta toda la noche. Deje enfriar a temperatura ambiente y colóquelo en una rejilla deslizante.
- Desparafinación, rehidratación y recuperación de antígenos
- Etiquete dos frascos de portaobjetos, A y B, y llene cada uno con suficiente solución de Trilogy para sumergir completamente el tejido.
- Coloque la rejilla deslizante en el frasco A y coloque ambos frascos en una olla a presión. Pon la olla a presión alta durante 15 min. Deje que la olla a presión se enfríe antes de abrir y recuperar los portaobjetos.
- Coloque inmediatamente la rejilla de portaobjetos del frasco A en el frasco B durante 2 minutos para asegurarse de que la parafina se elimine de los portaobjetos. Retire los portaobjetos del frasco B y colóquelos en agua desionizada (DI).
NOTA: El frasco A se puede llenar con Trilogy usado una vez. New Trilogy siempre debe usarse en Jar B. - Coloque los portaobjetos en solución salina tamponada con Tris (TBS) durante 5 minutos antes de proceder al bloqueo.
- Bloqueo de tinciones de fondo inespecíficas
- Retire los portaobjetos de la rejilla de portaobjetos y golpéelos hacia los lados para eliminar el exceso de TBS.
- Dibuja un recuadro alrededor del tejido con un rotulador hidrofóbico. Aplique un tampón de bloqueo para cubrir completamente el tejido e incube durante 30-60 minutos en una cámara humidificada a temperatura ambiente.
- Incubación con anticuerpos primarios
- Seleccione los anticuerpos primarios de las proteínas diana cultivados en diferentes especies huésped y diluya en el diluyente de anticuerpos de acuerdo con las recomendaciones del fabricante. Para este estudio se utilizaron los siguientes anticuerpos: H+/K+-ATPasa, GIF, Mist118,19 y CD44v920,21. La información detallada sobre los anticuerpos primarios se puede encontrar en la Tabla de Materiales.
- Retire el tampón de bloqueo, aplique anticuerpos diluidos y vuelva a colocar los portaobjetos en la cámara humidificada. Incubar durante la noche a 4 °C.
- Elimine los anticuerpos primarios y lave los portaobjetos 3 veces en TBS durante 5 minutos para cada lavado.
- Anticuerpos secundarios y lectinas
- Elija los anticuerpos secundarios de acuerdo con la especie huésped de los anticuerpos primarios. Las lectinas pueden mezclarse con anticuerpos secundarios y aplicarse al mismo tiempo.
- Diluir los anticuerpos secundarios y las lectinas de acuerdo con las recomendaciones del fabricante en diluyente de anticuerpos. La información detallada de los anticuerpos secundarios y las lectinas utilizadas en este estudio se puede encontrar en la Tabla de Materiales.
- Aplique anticuerpos secundarios, lectinas y DAPI (1 μg/mL) y vuelva a colocar los portaobjetos en la cámara humidificada. Incubar durante 1 h a temperatura ambiente, lejos de la luz.
- Retire los portaobjetos de la cámara humidificada y enjuague 3 veces con TBS durante 5 minutos para cada lavado.
- Montaje y preparación de la microscopía
- Retire un portaobjetos del TBS y elimine el exceso de líquido golpeando el portaobjetos hacia los lados con una toalla de papel.
- Añadir 15-20 μL de medio de montaje. Sostenga un cubreobjetos limpio por los bordes y coloque un borde opuesto al pañuelo con el medio de montaje en medio.
- Baje lentamente el cubreobjetos para que el medio se extienda uniformemente sobre el tejido, teniendo cuidado de evitar atrapar burbujas.
- Use una toallita para absorber el medio de montaje excesivo alrededor de los bordes. Seque el portaobjetos terminado en la oscuridad a temperatura ambiente antes de proceder a la microscopía. Repita este proceso para las diapositivas restantes.
Resultados
Los ratones adultos de tipo salvaje (WT) y MT-TGFα recibieron sulfato de zinc (25 mM ZnSO4) en el agua potable durante 2 semanas antes del sacrificio. Los estómagos de los ratones WT parecían normales, macroscópica e histológicamente. En marcado contraste, los estómagos de MT-TGFα estaban densamente engrosados (Figura 2A). Microscópicamente, estos estómagos mostraron hiperplasia foveolar masiva con pérdida de células parietales y principales (Figura 2B-D), recapitulando las características histológicas de la enfermedad de Ménétrier (DM). La pérdida de células principales puede ocurrir de dos maneras diferentes: muerte de las células principales o metlasia espasmolítica que expresa polipéptidos (SPEM) que surge de las células principales. Para distinguir estas dos posibilidades, realizamos el rastreo del linaje de las células principales mediante el cruzamiento de Mist1-CreERT2; Ratones R26-LSL-mTmG con ratones MT-TGFα. Estos ratones fueron tratados primero con dosis bajas de tamoxifeno (37,5 mg/kg por vía intraperitoneal durante 7 días consecutivos) para marcar las células principales con GFP y luego con ZnSO4 en el agua de bebida para inducir la sobreexpresión de TGFα. Observamos células raras marcadas con GFP en los ratones MT-TGFα (datos no mostrados). Además, no hubo diferencias macroscópicas e histológicas en los ratones MT-TGFα en presencia o ausencia de ZnSO4 (Figura 3A-C). Una posible explicación para este hallazgo fue que TGFα puede haber reducido la expresión de Mist1, un factor de transcripción esencial para las células principales18, y subvertir la utilidad del alelo Mist1-CreERT2. De hecho, la tinción inmunohistoquímica para Mist1 se perdió en ratones MT-TGFα sin tratamiento con ZnSO4 (Figura 3D).
Para superar la permeabilidad del modelo de ratón MT-TGFα, recurrimos a un modelo transgénico Doxi-TGFa inducible por doxiciclina. Esto se logró mediante el cruzamiento de ratones TetO-TGFα14 con una línea de ratón CMV-rtTA13; se ha reportado previamente que la rtTA se expresa en el estómago. Confirmamos que 2 semanas de tratamiento con doxiciclina induce hiperplasia foveolar y disminución del número de células parietales y principales en este nuevo modelo de ratón MD (Figura 4A-C). En comparación con las características histomorfológicas de los ratones MT-TGFα, los ratones Doxi-TGFα mostraron un grosor de la mucosa menos grave e hiperplasia foveolar, así como una menor disminución de las células parietales (Figura complementaria 2). Sin embargo, pudimos trazar el linaje de las células principales utilizando la línea de ratón Mist1-CreERT2 y confirmamos que los linajes de células principales también están marcados con GSII y CD44v920,21, lo que confirma que la sobreexpresión de TGFα induce SPEM a partir de las células principales (Figura 4D).
El estudio actual muestra que el modelo de ratón MT-TGFα fenocopia las características histopatológicas de la DM en ausencia de tratamiento con metales pesados, probablemente debido a la fuga intrínseca del promotor/potenciador y/o a la incapacidad de evitar la exposición a metales pesados (Figura 3 y Figura complementaria 2). Dado que TGFα suprime la expresión de Mist1, la línea de ratón Mist1-CreERT2 no se puede utilizar en el modelo de ratón MT-TGFα. Generamos un nuevo modelo de ratón MD en el que la expresión de TGFα puede ser inducida por el tratamiento con doxiciclina. Utilizando este nuevo modelo de ratón Doxi-TGFα MD, pudimos confirmar que la sobreexpresión de TGFα induce SPEM derivado de las células principales. El modelo de ratón Doxi-TGFα MD será útil cuando sea necesario un control preciso de la expresión de TGFα y también cuando se requiera una alteración genética en las células principales utilizando la línea de ratón Mist1-CreERT2.
Disponibilidad de datos:
Todos los datos brutos están disponibles como archivos complementarios.
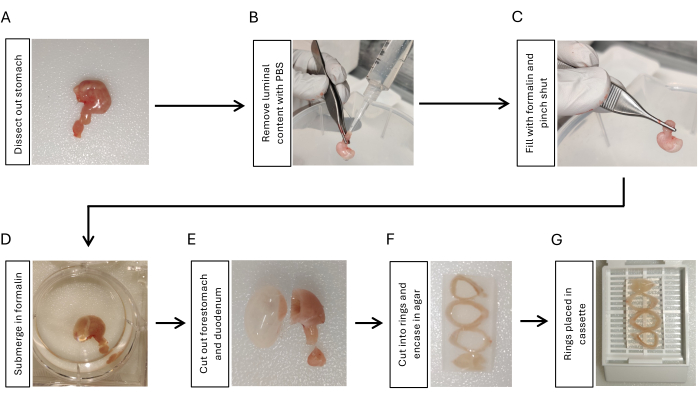
Figura 1: Flujo de trabajo para la fijación y preparación de la inclusión de tejido gástrico. (A) Diseccionar el estómago junto con un segmento corto (3-5 mm) del duodeno. (B) Eliminar el contenido luminal instilando PBS del duodeno con una jeringa con punta de pipeta y apretándolo con los dedos 3 veces. (C) Inflar el estómago con formalina del duodeno con una jeringa y pellizcar la unión gastroduodenal para retener la formalina. (D) Sumerja el estómago en formol y fije durante la noche a 4 °C agitando. (E) Retire el estómago anterior y el duodeno con una cuchilla de afeitar y enjuague con PBS. (F) Corte el cuerpo gástrico y el antro en 3-4 anillos de manera transversal e insértelos en agarosa al 2% para mantener la orientación de los anillos de tejido estomacal. (G) Coloque el tejido incrustado en agarosa en casetes. Haga clic aquí para ver una versión más grande de esta figura.
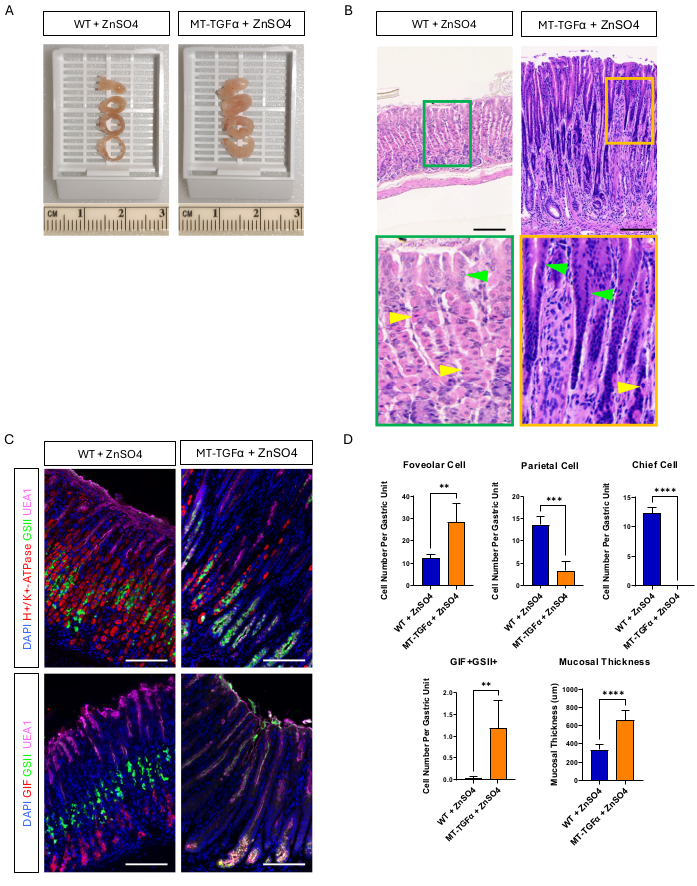
Figura 2: Fenotipos macroscópicos y microscópicos de ratones MT-TGFα tratados con el metal pesado ZnSO4. (A) La pared gástrica es más gruesa en los ratones MT-TGFα (derecha) en comparación con los ratones de control (izquierda). (B) El estómago de ratones MT-TGFα (derecha) muestra hiperplasia foveolar masiva y pérdida de células parietales. Las puntas de flecha amarillas indican células parietales y las puntas de flecha verdes indican células foveolares. Las barras de escala representan 100 μm. (C) La tinción inmunofluorescente confirma que el estómago de ratón MT-TGFα (derecha) muestra un mayor número de células foveolares (UEA1 positivo) y células SPEM (GIF y GSII doble positivo) y un menor número de células parietales (H+/K+-ATPasa positiva) y células principales (GIF simple positivo) en comparación con el estómago del ratón de control (izquierda). Las barras de escala representan 100 μm. (D) Cuantificación de diferentes tipos de células epiteliales y espesor de la mucosa en ratones de tipo salvaje (WT) tratados con ZnSO4 (n = 5) y ratones MT-TGFα con ZnSO4 (n = 3). Las barras de error indican la desviación estándar (**p < 0,01, ***p < 0,001, ****p < 0,0001). Haga clic aquí para ver una versión más grande de esta figura.
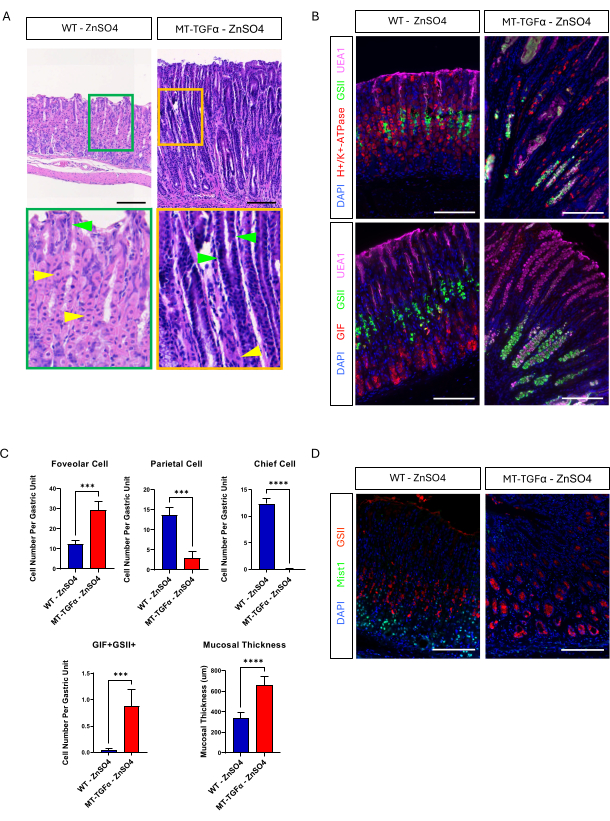
Figura 3: Los ratones MT-TGFα desarrollan fenotipos gástricos sin tratamiento con metales pesados. (A) El estómago de ratones MT-TGFα (derecha) muestra hiperplasia foveolar masiva y pérdida de células parietales sin tratamiento con metales pesados. Las puntas de flecha amarillas indican células parietales y las puntas de flecha verdes indican células foveolares. Las barras de escala representan 100 μm. (B) La tinción inmunofluorescente confirma que el estómago de ratón MT-TGFα (derecha) sin tratamiento con metales pesados muestra un mayor número de células foveolares (UEA1 positivo) y células SPEM (GIF y GSII doble positivo), y una disminución del número de células parietales (H+/K+-ATPasa positiva) y células principales (GIF simple positivo) en comparación con el estómago del ratón de control (izquierda). Las barras de escala representan 100 μm. (C) Cuantificación de diferentes tipos de células epiteliales y espesor de la mucosa en ratones WT sin ZnSO4 (n = 5) y ratones MT-TGFα ZnSO4 (n = 3). Las barras de error indican la desviación estándar (***p < 0,001, ****p < 0,0001). (D) El estómago de ratones MT-TGFα (derecha) muestra pérdida de la expresión de Mist1, que normalmente se expresa en las células principales (izquierda). GSII es un marcador de células mucosas del cuello. Las barras de escala representan 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
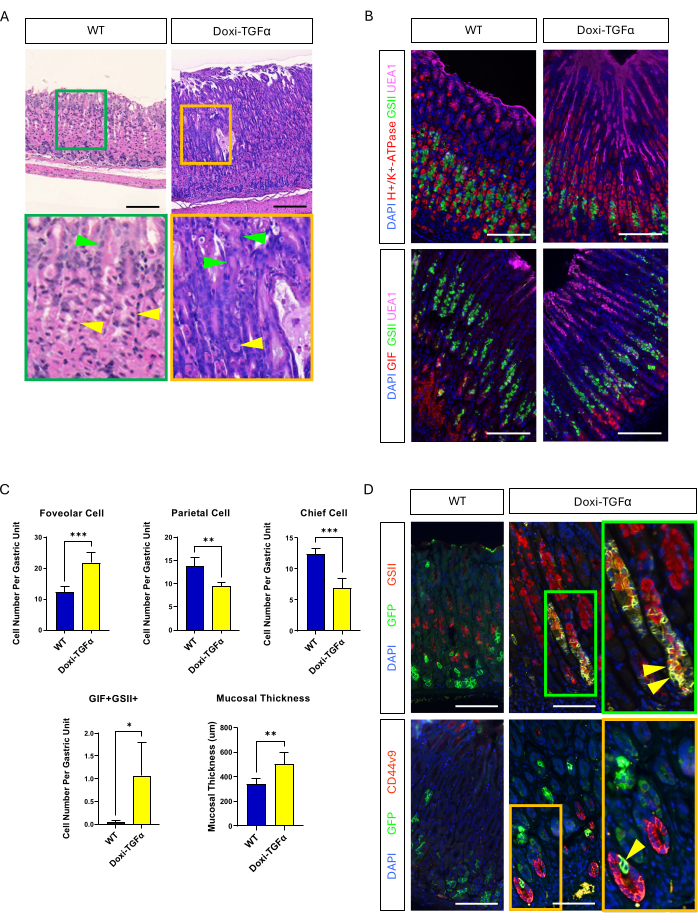
Figura 4: El modelo de ratón de TGFα inducible por doxiciclina (Doxi-TGFα) recapitula los fenotipos de la enfermedad de Ménétrier, y la formación de SPEM se confirma en este modelo de ratón. (A) Estómago de CMV-rtTA; Los ratones TetO-TGFα (Doxi-TGFα; derecha) muestran hiperplasia foveolar masiva y disminución del número de células parietales. Las puntas de flecha amarillas indican células parietales y las puntas de flecha verdes indican células foveolares. Las barras de escala representan 100 μm. (B) La tinción inmunofluorescente confirma que el estómago del ratón Doxi-TGFα (derecha) muestra un aumento en el número de células foveolares (UEA1 positivo) y células SPEM (GIF y GSII doble positivo), y una disminución en el número de células parietales (H+/K+-ATPasa positiva) y células principales (GIF simple positivo) en comparación con el estómago del ratón de control (izquierda). Las barras de escala representan 100 μm. (C) Cuantificación de diferentes tipos de células epiteliales y espesor de la mucosa en ratones WT (n = 5) y ratones Doxi-TGFα (n = 5). Las barras de error indican desviación estándar (*p < 0,05, **p < 0,01, ***p < 0,001). (D) Rastreo de linaje de células principales (GFP positivo) utilizando Mist1-CreERT2; La línea de ratones R26-LSL-mTmG revela que las células positivas para GFP también son positivas para GSII y CD44v9 en el estómago del ratón Doxi-TGFα, lo que confirma la formación de SPEM derivada de las células principales, mientras que el estómago de control (izquierda) muestra que casi no hay células positivas para GFP que también sean positivas para GSII o CD44v9. Las barras de escala representan 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: El tratamiento con dosis bajas de tamoxifeno (TMX) no induce lesión de la mucosa gástrica. Siete días consecutivos de tratamiento con TMX a dosis bajas (37,5 mg/kg) no inducen lesión de la mucosa gástrica, ejemplificada por el mantenimiento del número de células parietales. (A) Imágenes representativas de H&E sin tratamiento TMX (panel izquierdo) y con tratamiento TMX (panel derecho). Las barras de escala representan 100 μm. (B) Cuantificación del número de células parietales por unidad gástrica en ratones WT (n = 5) y WT con tratamiento con TMX (n = 5). Haga clic aquí para descargar este archivo.
Figura complementaria 2: Comparación de fenotipos entre diferentes modelos de ratón con enfermedad de Ménétrier (MD). (A) MT-TGFα con tratamiento con ZnSO4, MT-TGFα sin tratamiento con ZnSO4 y Doxi-TGFα MD modelos de ratón muestran hiperplasia foveolar, pérdida de células parietales y principales, aumento de las células espasmolíticas de metaplasia que expresan polipéptidos (SPEM) (células colocalizadas GIF y GSII) y engrosamiento de la mucosa. No hay diferencias fenotípicas entre los grupos de tratamiento con MT-TGFα con y sin ZnSO4. El modelo de ratón Doxi-TGFα muestra fenotipos menos graves que el modelo de ratón MT-TGFα. Haga clic aquí para descargar este archivo.
Discusión
La enfermedad de Ménétrier (MD) es un trastorno gástrico premaligno poco frecuente causado por la sobreexpresión de TGFα 1,2,3. Los ratones transgénicos que sobreexpresan TGFα bajo el control del potenciador/promotor del gen de la metalotioneína (MT-TGFα) han sido el único modelo de ratón para la DM hasta la fecha 4,5. Debido a que el gen de la metalotioneína responde a los metales pesados, se añade sulfato de zinc al agua potable o se inyecta sulfato de cadmio para inducir TGFα en este modelo de ratón 5,8. Uno de los fenotipos característicos de la distrofia muscular es la sustitución de las células principales de la base de las glándulas gástricas por células mucinosas que son positivas para los marcadores presentes tanto en las células mucosas del cuello como en las células de la mucina antral. Esto puede ocurrir por la muerte de las células principales o por la reprogramación de las células principales a metaplasia espasmolítica que expresa polipéptidos (SPEM)8,11. Esto se puede probar mediante el rastreo del linaje de las células principales en un modelo de ratón MD. Intentamos rastrear el linaje de las células principales utilizando el Mist1-CreERT2; Ratones R26-LSL-mTmG en los que las células principales positivas para Mist1 se marcan con GFP dirigida a la membrana. Sin embargo, solo observamos un número limitado de células marcadas con GFP en los ratones MT-TGFα. Esto sugiere que la mayoría de las células principales marcadas con GFP murieron debido a la sobreexpresión de TGFα o que la eficiencia del marcaje con GFP en las células principales fue demasiado baja. Debido a que se ha informado que no hubo un aumento en la muerte celular por la sobreexpresión de TGFα8, examinamos la posibilidad de una pérdida de la expresión de Mist1 mediante la evaluación de ratones MT-TGFα sin tratamiento con metales pesados. Nos sorprendieron los fenotipos completos en ratones MT-TGFα sin tratamiento con metales pesados, incluyendo hiperplasia foveolar y pérdida de células parietales y principales. También confirmamos que la expresión de Mist1 se pierde en ratones MT-TGFα incluso sin tratamiento con metales pesados. Se ha informado previamente que la expresión de TGFα no se controló estrictamente en ratones MT-TGFα debido a la incapacidad de eliminar la exposición a metales pesados; sin embargo, la expresión de TGFα se incrementó significativamente con el tratamiento con metales pesados8. No se ha realizado previamente una evaluación fenotípica completa en ratones MT-TGFα sin tratamiento con metales pesados. El estudio actual muestra que los ratones MT-TGFα desarrollan una manifestación fenotípica completa sin tratamiento con metales pesados.
Debido a que la expresión de Mist1 se perdió en los ratones MT-TGFα incluso antes del tratamiento con metales pesados, seguía siendo necesario otro modelo de ratón en el que la expresión de TGFα se controlara específicamente para que los fenotipos no se desarrollen sin la inducción de la sobreexpresión de TGFα. Generamos un nuevo modelo de ratón MD en el que la expresión de TGFα es inducida por el tratamiento con doxiciclina (Doxi-TGFα). Confirmamos que este modelo de ratón induce hiperplasia foveolar y pérdida de células parietales y principales, que son los principales fenotipos de la distrofia muscular. Pudimos rastrear el linaje de las células principales utilizando el Mist1-CreERT2; R26-LSL-mTmG en este modelo de ratón y encontró que algunas células marcadas con GFP también estaban marcadas con GSII y CD44v9, lo que confirma que SPEM ocurre en este nuevo modelo de ratón MD. Es el primer informe que confirma que SPEM se desarrolla en el estómago con sobreexpresión de TGFα. El SPEM es una afección gástrica premaligna más común, que puede ser la razón por la que el cáncer gástrico aumenta en los pacientes con DM22,23.
Una advertencia sobre el uso de la línea de ratón Mist1-CreERT2 es que se ha informado que Mist1 también puede expresarse en las células madre gástricas24. Encontramos que una dosis baja (37,5 mg/kg) de tratamiento con tamoxifeno induce la activación de Cre, más específicamente en las células principales, con una activación mínima en la región del istmo incluso en puntos de tiempo anteriores al tratamiento con doxiciclina. Hallazgos similares han sido reportados previamente25. Rastreo de linaje utilizando Mist1-CreERT2; Los ratones R26-LSL-mTmG muestran células GFP positivas cerca del marcador GFP y SPEM (GSII y CD44v9), las células dobles positivas se localizan principalmente en la base, donde se encuentran las células principales (Figura 4C). Si las células dobles positivas de los marcadores GFP y SPEM se rastrean a partir de las células madre, debería haber habido más células GFP positivas hacia el istmo donde se encuentran las células madre. Alternativamente, la línea de ratón GIF-rtTA inducible por doxiciclina26 o la línea de ratón GPR30-rtTA27 podrían utilizarse junto con ratones MT-TGFα para modificaciones genéticas o el rastreo del linaje de las células principales. Sin embargo, las células positivas para GIF disminuyen en los ratones MT-TGFα sin tratamiento con ZnSO4 (Figura 3B, C), y las células positivas para GPR30 se pierden en SPEM, lo que ocurre en ratones MT-TGFα sin tratamiento con ZnSO4. Por lo tanto, serán menos eficientes en comparación con los ratones Doxi-TGFα cruzados con la línea de ratones Mist1-CreERT2.
El estudio actual muestra que los ratones MT-TGFα desarrollan cambios fenotípicos completos en el estómago sin tratamiento con metales pesados. También mostramos que uno de los fenotipos es la pérdida de expresión de Mist1 y esto impide el uso de Mist1-CreERT2; Línea de ratón R26-LSL-mTmG para trazar células principales de linaje. Generamos un nuevo modelo de ratón con MD, Doxi-TGFα, y confirmamos por primera vez que SPEM se desarrolla en MD utilizando este modelo de ratón. Este novedoso modelo de ratón MD será útil cuando sea necesario un control preciso del desarrollo de los fenotipos MD y cuando se necesiten modificaciones genéticas en las células principales utilizando la línea de ratón Mist1-CreERT2. Los fenotipos de MD son inducidos por la activación de la señalización de EGFR por sobreexpresión de TGFα. Sin embargo, no se conoce la activación del EGFR en la que los tipos de células son responsables de los fenotipos observados. Utilizando el modelo de ratón Doxi-TGFα, actualmente estamos investigando el papel de la señalización de EGFR en diferentes tipos de células, incluidas las células principales que utilizan la línea de ratón Mist1-CreERT2.
Divulgaciones
Todos los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Este trabajo fue apoyado por el Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales (K08 DK124686 a WJH). Agradecemos a Gina Della Porta y Sarah E. Glass por editar el manuscrito.
Contribución del autor:
TTG llevó a cabo experimentos, generó figuras, escribió el manuscrito y editó el manuscrito. JDP llevó a cabo experimentos, generó figuras, escribió el manuscrito y editó el manuscrito. SKM proporcionó la línea de ratón TetO-TGFα y editó el manuscrito. RJC concibió experimentos y editó el manuscrito. WJH concibió experimentos, llevó a cabo experimentos, interpretó datos, buscó en la literatura, escribió el manuscrito y editó el manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Mouse anti H+/K+-ATPase antibody | A gift from Dr. Eunyoung Choi | N/A | Dilution: 1:10000 |
| Antibody Diluent | Abcam | 559148 | |
| Anti-rabbit GFP | Life Technologies Corporation | A11122 | Dilution: 1:500 |
| Charged Glass Slides | Fisher | 22-178-277 | |
| Cover Slips | Globe Scientific | 1411-10 | |
| Donkey anti-mouse 594 | Invitrogen | A12102 | Dilution: 1:500 |
| Donkey anti-rabbit 488 | Invitrogen | A21206 | Dilution: 1:500 |
| Donkey anti-rabbit 594 | Invitrogen | A21207 | Dilution: 1:500 |
| Donkey anti-rat 594 | Invitrogen | A21209 | Dilution: 1:500 |
| Doxyclycine Hyclate | TCI | D4116 | |
| Flouromount-G | Thermo fischer | 00-4958-02 | |
| GSII 488 | Invitrogen | L21415 | Dilution: 1:500 |
| Hydrophobic Marker | Electron Microscopy Sciences | 71312 | |
| Incubator | Labnet | I 5110 | |
| MIST1/bHLHa15 (D7N4B) XP Rabbit mAb | Cell Signaling | 14896S | Dilution: 1:200 |
| Pressure Cooker (6QT) | Cuisinart | CPC-600N1 | |
| Protein Block | Abcam | AB64226 | |
| Rabbit anti-GIF antibody | MyBioSource | MBS2028736 | Dilution: 1:200 |
| Rat anti CD44v9 mAb | Cosmo Bio | LKG-M002 | Dilution: 1:20000 |
| Slide Jars | Simport | M906-12AS | |
| Tamoxifen | Sigma-Aldrich | T5648 | |
| Trilogy | Sigma | 922P-10-RUO | |
| UEA1 Dylight 649 | Vector Laboratories | DL-1068 | Dilution: 1:500 |
Referencias
- Huh, W. J., Coffey, R. J., Washington, M. K. Menetrier's disease: Its mimickers and pathogenesis. J Pathol Transl Med. 50 (1), 10-16 (2016).
- Tanksley, J. Jr, Tanksley, J. Pierre menetrier and his disease. Trans Am Clin Climatol Assoc. 123, discussion 133-124 126-133 (2012).
- Rich, A., et al. Distinguishing menetrier's disease from its mimics. Gut. 59 (12), 1617-1624 (2010).
- Takagi, H., Jhappan, C., Sharp, R., Merlino, G. Hypertrophic gastropathy resembling menetrier's disease in transgenic mice overexpressing transforming growth factor alpha in the stomach. J Clin Invest. 90 (3), 1161-1167 (1992).
- Dempsey, P. J., et al. Possible role of transforming growth factor alpha in the pathogenesis of menetrier's disease: Supportive evidence form humans and transgenic mice. Gastroenterology. 103 (6), 1950-1963 (1992).
- Fiske, W. H., et al. Efficacy of cetuximab in the treatment of menetrier's disease. Sci Transl Med. 1 (8), 8ra18(2009).
- Burdick, J. S., et al. Treatment of menetrier's disease with a monoclonal antibody against the epidermal growth factor receptor. N Engl J Med. 343 (23), 1697-1701 (2000).
- Goldenring, J. R., et al. Overexpression of transforming growth factor-alpha alters differentiation of gastric cell lineages. Dig Dis Sci. 41 (4), 773-784 (1996).
- Sharp, R., et al. Transforming growth factor alpha disrupts the normal program of cellular differentiation in the gastric mucosa of transgenic mice. Development. 121 (1), 149-161 (1995).
- Bockman, D. E., Sharp, R., Merlino, G. Regulation of terminal differentiation of zymogenic cells by transforming growth factor alpha in transgenic mice. Gastroenterology. 108 (2), 447-454 (1995).
- Nomura, S., et al. Evidence for repatterning of the gastric fundic epithelium associated with menetrier's disease and tgfalpha overexpression. Gastroenterology. 128 (5), 1292-1305 (2005).
- Shi, G., et al. Loss of the acinar-restricted transcription factor mist1 accelerates kras-induced pancreatic intraepithelial neoplasia. Gastroenterology. 136 (4), 1368-1378 (2009).
- Kistner, A., et al. Doxycycline-mediated quantitative and tissue-specific control of gene expression in transgenic mice. Proc Natl Acad Sci U S A. 93 (20), 10933-10938 (1996).
- Hardie, W. D., et al. Conditional expression of transforming growth factor-alpha in adult mouse lung causes pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 286 (4), L741-L749 (2004).
- Keeley, T. M., Horita, N., Samuelson, L. C. Tamoxifen-induced gastric injury: Effects of dose and method of administration. Cell Mol Gastroenterol Hepatol. 8 (3), 365-367 (2019).
- Huh, W. J., et al. Tamoxifen induces rapid, reversible atrophy, and metaplasia in mouse stomach. Gastroenterology. 142 (1), 21-24.e7 (2012).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods Enzymol. 533, 225-233 (2013).
- Ramsey, V. G., et al. The maturation of mucus-secreting gastric epithelial progenitors into digestive-enzyme secreting zymogenic cells requires mist1. Development. 134 (1), 211-222 (2007).
- Huh, W. J., et al. Xbp1 controls maturation of gastric zymogenic cells by induction of mist1 and expansion of the rough endoplasmic reticulum. Gastroenterology. 139 (6), 2038-2049 (2010).
- Engevik, A. C., et al. The development of spasmolytic polypeptide/tff2-expressing metaplasia (spem) during gastric repair is absent in the aged stomach. Cell Mol Gastroenterol Hepatol. 2 (5), 605-624 (2016).
- Wada, T., et al. Functional role of cd44v-xct system in the development of spasmolytic polypeptide-expressing metaplasia. Cancer Sci. 104 (10), 1323-1329 (2013).
- Halldorsdottir, A. M., et al. Spasmolytic polypeptide-expressing metaplasia (spem) associated with gastric cancer in iceland. Dig Dis Sci. 48 (3), 431-441 (2003).
- Yamaguchi, H., Goldenring, J. R., Kaminishi, M., Lee, J. R. Identification of spasmolytic polypeptide expressing metaplasia (spem) in remnant gastric cancer and surveillance postgastrectomy biopsies. Dig Dis Sci. 47 (3), 573-578 (2002).
- Hayakawa, Y., et al. Mist1 expressing gastric stem cells maintain the normal and neoplastic gastric epithelium and are supported by a perivascular stem cell niche. Cancer Cell. 28 (6), 800-814 (2015).
- Saenz, J. B., Vargas, N., Cho, C. J., Mills, J. C. Regulation of the double-stranded rna response through adar1 licenses metaplastic reprogramming in gastric epithelium. JCI Insight. 7 (3), e153511(2022).
- Caldwell, B., Meyer, A. R., Weis, J. A., Engevik, A. C., Choi, E. Chief cell plasticity is the origin of metaplasia following acute injury in the stomach mucosa. Gut. 71 (6), 1068-1077 (2022).
- Hata, M., et al. Gpr30-expressing gastric chief cells do not dedifferentiate but are eliminated via pdk-dependent cell competition during development of metaplasia. Gastroenterology. 158 (6), 1650-1666.e15 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados