Research Article
Entwicklung von Mausmodellen für Morbus Ménétrier
In diesem Artikel
Zusammenfassung
Die aktuelle Studie zeigt, dass MT-TGFα-Mäuse im Magen eine spasmolytische Polypeptid-exprimierende Metaplasie (SPEM) aufweisen. Die Undichtigkeit des Promotors verhinderte den Nachweis, dass die Hauptzelllinien auf SPEM zurückgeführt werden können. Daher haben wir zusätzlich ein Doxycyclin-induzierbares Mausmodell (Doxi-TGFα) entwickelt und bestätigt, dass SPEM von Hauptzellen abgeleitet ist.
Zusammenfassung
Morbus Ménétrier (MD) ist eine seltene erworbene prämaligne Magenerkrankung, die durch riesige rugale Falten, verminderte Säuresekretion und Proteinverlust gekennzeichnet ist. MD-Patienten zeigen eine erhöhte Expression eines EGF-Rezeptors (EGFR)-Liganden, der den Wachstumsfaktor-α (TGFα) im Magen transformiert. Der EGFR-neutralisierende Antikörper Cetuximab führt zu einer raschen klinischen Verbesserung und histologischen Remission. Abgesehen von diesen Erkenntnissen sind die Ätiologie und die zugrundeliegenden molekularen Mechanismen noch nicht gut verstanden. Die transgene Mauslinie Metallothionein (MT)-TGFα ist das erste MD-Mausmodell, das histopathologische Merkmale der MD, einschließlich foveolärer Hyperplasie und Verlust von Parietalzellen, rekapituliert. In diesem Mausmodell wird TGFα durch den Schwermetall-induzierbaren MT-Enhancer/Promotor angetrieben. In früheren Studien wurde Zinksulfat (ZnSO4) in Trinkwasser oder intraperitoneale Injektionen von Cadmiumsulfat (CdSO4) verwendet, um TGFα zu induzieren. Wir fanden jedoch heraus, dass MT-TGFα-Mäuse Phänotypen ohne Schwermetallbehandlung entwickeln, was auf eine Leckage des Promotors hinweist. Wir fanden auch heraus, dass die Überexpression von TGFα die Mist1-Expression unterdrückt, einen Transkriptionsfaktor, der für die Differenzierung von Hauptzellen wichtig ist, wodurch die genetische Manipulation in Hauptzellen mit der Mist1-CreERT2-Mauslinie behindert wird. Um dies zu überwinden, haben wir ein induzierbares Mausmodell (Doxi-TGFα) entwickelt, in dem TGFα durch Doxycyclin-Behandlung (CMV-rtTA; TetO-TGFα). Obwohl das Doxi-TGFα-Mausmodell mildere Phänotypen entwickelt als das MT-TGFα-Modell, rekapitulierte es Merkmale der MD, einschließlich foveolärer Hyperplasie und Verlust von Parietalzellen. Unter Verwendung des Doxi-TGFα-Mausmodells fanden wir, dass die spasmolytische Polypeptid-exprimierende Metaplasie (SPEM) bei MD induziert wird und SPEM von Hauptzellen durch Abstammungsverfolgung unter Verwendung der Mist1-CreERT2-Mauslinie abgeleitet wird. Sowohl MT-TGFα- als auch Doxi-TGFα-Mausmodelle bieten In-vivo-Modelle von MD und sind nützlich für die Untersuchung der molekularen Mechanismen, die der MD-Pathogenese und den Behandlungsoptionen für die Krankheit zugrunde liegen. Die Doxi-TGFα-Mäuse werden auch ein nützliches Modell sein, um die Auswirkungen der Überexpression von TGFα in anderen Geweben zu untersuchen.
Einleitung
Morbus Ménétrier (MD), auch bekannt als proteinverlierende hypertrophe Gastropathie, ist eine seltene prämaligne Magenerkrankung. Die Mägen von MD-Patienten zeigen eine massive foveoläre Hyperplasie, die zu einer erhöhten Magenschleimsekretion führt, und eine verminderte Anzahl von Parietalzellen, was zu einer verminderten Magensäuresekretion führt. Darüber hinaus geht Protein selektiv über die Magenschleimhaut verloren, was zu Hypoalbuminämie und peripheren Ödemen führt 1,2,3. Die Pathogenese der MD war nicht bekannt, bis berichtet wurde, dass transgene Mäuse, die TGFα unter der Kontrolle des Metallothionein (MT)-Genverstärkers/-promotors überexprimierten, die Phänotypen der MD im Magen rekapitulierten 4,5. Mägen von MD-Patienten zeigten auch eine erhöhte Expression von TGFα, einem EGF-Rezeptor (EGFR)-Liganden. Es wurde berichtet, dass Cetuximab, ein Anti-EGFR-Antikörper, die erste wirksame medikamentöse Behandlung von MD war, was bestätigte, dass die EGFR-Aktivierung durch TGFα-Überexpression zur Pathogenese von MD beiträgt 6,7.
Seitdem wird die MT-TGFα-Mauslinie als Mausmodell für MD verwendet. Da die TGFα-Expression durch das Schwermetall-Reaktionsgen reguliert wird, wurden Metallothionein-Verstärker/Promotor Zinksulfat (ZnSO4) im Trinkwasser oder intraperitoneale Injektionen von Cadmiumsulfat (CdSO4) verwendet, um die TGFα-Expressionzu induzieren 5,8. Das MT-TGFα-Mausmodell wurde weiter für die Phänotypen der MD charakterisiert. Unter Verwendung dieses Mausmodells konnte gezeigt werden, dass TGFα die Differenzierung von Mucin-sezernierenden Oberflächen-Foveolärzellen induziert, während es die Differenzierung in säuresezernierende Parietalzellen und Pepsinogen-sezernierende Hauptzelllinien hemmt 9,10. Es wurde auch gezeigt, dass die Magenkörper-/Fundusschleimhaut antralisiert wird und dass Trefoil-Faktor 2 (TFF2)-positive Zellen an der Basis der Magendrüsen vorhanden sind, was darauf hindeutet, dass bei MDeine spasmolytische Polypeptid-exprimierende Metaplasie (SPEM) auftritt.
In der aktuellen Studie zeigen wir, dass MT-TGFα-Mäuse ohne Schwermetallbehandlung Merkmale von MD entwickeln. Zu diesen Phänotypen gehört der Verlust der Mist1-Expression, eines Transkriptionsfaktors, der für die Differenzierung der Hauptzellen essentiell ist und in SPEM verloren geht. Aufgrund des Verlusts von Mist1 konnte die Mist1-CreERT212-Mauslinie nicht zusammen mit der MT-TGFα-Mauslinie verwendet werden, um zu untersuchen, ob SPEM bei MD aus Hauptzellen durch Abstammungsverfolgung entsteht. Mit dem Ziel, die Undichtigkeit des MT-TGFα-Mausmodells zu überwinden, haben wir ein neues MD-Mausmodell (CMV-rtTA13; TetO-TGFα14), wobei TGFα durch Doxycyclin-Behandlung (Doxi-TGFα) induziert wird. Wir haben bestätigt, dass dieses Mausmodell auch Funktionen von MD aufweist. Unter Verwendung des Doxi-TGFα-Mausmodells zeigen wir, dass SPEM aus Hauptzellen durch Abstammungsverfolgung unter Verwendung der Mist1-CreERT2-Mauslinie entsteht. In der aktuellen Studie stellen wir zwei MD-Mausmodelle vor. Beide Modelle können zur Untersuchung der Pathogenese und zur Suche nach potenziellen therapeutischen Angriffspunkten verwendet werden. Die neue Doxi-TGFα-Maus wird besonders wertvoll sein, wenn die Initiation von MD-Phänotypen präzise kontrolliert werden muss oder wenn eine genetische Modifikation in Hauptzellen mit der Mist1-CreERT2-Mauslinie erforderlich ist.
Protokoll
Alle Tierhaltungen und -verfahren wurden von den Institutional Animal Care and Use Committees der Yale University und in Übereinstimmung mit den Grundsätzen der US-Regierung für die Nutzung und Pflege von Tieren, die in Forschung, Lehre und Tests verwendet werden, genehmigt.
1. Experimente mit Mäusen
- Behandlungen für Mäuse
- Behandlung von MT-TGFα-Mäusen (sowohl männlich als auch weiblich im Alter von 2-4 Monaten) mit 25 mM ZnSO4 in Trinkwasser für 2 Wochen, um eine TGFα-Überexpression zu induzieren.
- Behandlung von CMV-rtTA/+; TetO-TGFα/+ (Doxi-TGFα) Mäuse (sowohl männlich als auch weiblich im Alter von 2-4 Monaten) mit 2 mg/ml Doxycyclin im Trinkwasser für 2 Wochen, um eine TGFα-Überexpression zu induzieren.
- Fügen Sie ein Mist1-CreERT2/+; R26-LSL-mTmG/+ männliche oder weibliche Maus und geben Sie eine Doxi-TGFα-Maus des anderen Geschlechts in den Zuchtkäfig für die Abstammungsverfolgung der Hauptzellen in MD-Mausmodellen.
- Injizieren Sie Mist1-CreERT2/+; R26-LSL-mTmG/+; CMV-rtTA/+; TetO-TGFα/+ Mäuse (sowohl männlich als auch weiblich im Alter von 2-4 Monaten) mit Tamoxifen (37,5 mg/kg) intraperitoneal. Injizieren Sie an 7 aufeinanderfolgenden Tagen abwechselnd zwischen dem rechten und linken unteren Quadranten des Bauches und vermeiden Sie Schläge auf die inneren Organe. Induzieren Sie die TGFα-Expression durch Doxycyclin-Behandlung (2 mg/ml) im Trinkwasser für 2 Wochen.
HINWEIS:Es ist zu prüfen, ob keine Tamoxifen-induzierte Schädigung im Magenvorliegt 15,16, wie hier durch Zählen der Parietalzellen bei Wildtyp-Mäusen mit und ohne Tamoxifen-Behandlung (Ergänzende Abbildung 1).
- Fixierung des Magengewebes
- Euthanause von Mäusen durch Isofluran-Überdosierung nach 2 Wochen TGFα-Überexpression. Setzen Sie die Mäuse mit einem Exsikkatorbehälter in einem chemischen Abzug auf eine perforierte Plattform, die einen direkten Kontakt mit dem flüssigen Anästhetikum verhindert. Schließen Sie den Deckel und überwachen Sie die Mäuse, bis sie mehr als 60 s lang nicht atmen können, gefolgt von einer Gebärmutterhalsluxation.
- Präparieren Sie den Magen, indem Sie am gastroösophagealen Übergang schneiden, den Zwölffingerdarm mit einem 5 mm dicken Zwölffingerdarm, der am Magen befestigt ist, durchtrennen und alle Peritonealbänder um den Magen herum mit einer Schere und Pinzette entfernen (Abbildung 1A).
- Instillieren Sie phosphatgepufferte Kochsalzlösung (PBS) mit einer 10-ml-Spritze mit einer Pipettenspitze, die an der Zwölffingerdarmseite befestigt ist. Drücken Sie es mit den Fingern zusammen, um den luminalen Inhalt zu entfernen. 3x wiederholen (Abbildung 1B).
- Blasen Sie den Magen mit 2 ml 10% Formalin mit einer weiteren 10-ml-Spritze auf, an der eine Pipettenspitze befestigt ist. Klemmen Sie mit einer Pinzette am gastroduodenalen Übergang für 5-10 s fest, während Sie die Spitze aus dem Magen entfernen (Abbildung 1C).
- Tauchen Sie den aufgeblähten Magen über Nacht bei 4 °C unter Schütteln in 10 % Formalin (Abbildung 1D).
ACHTUNG: Verwenden Sie geeignete Schutzausrüstung, wenn Sie mit giftigen Substanzen wie Formalin arbeiten.
- Vorbereitung des Magens für die Paraffineinbettung
- Schneiden Sie den Zwölffingerdarm und den Vorderbauch mit einer Rasierklinge heraus (Abbildung 1E). Spülen Sie das Magengewebe 5 Minuten lang mit PBS aus, 3x unter Schütteln.
- Den Magen mit einer Rasierklinge in 3-4 gleich dicke Ringe (3-5 mm) schneiden. Betten Sie die Magenringe in 2% Agarose ein, um die Orientierung zu erhalten. Platzieren Sie die Magenringe nacheinander von den proximalen zu den distalen, indem Sie die Seite mit geringerer Krümmung in die gleiche Richtung positionieren (Abbildung 1F).
- Legen Sie die in Agarosen eingebetteten Magenringe in eine Gewebekassette (Abbildung 1G) und senden Sie die Proben zur Paraffineinbettung17 an die histologische Core Facility.
2. Immunfluoreszenz-Färbung
- Vorbereitung der Objektträger
- Schieben Sie die Objektträger mit Paraffinabschnitten in einem trockenen Ofen oder auf einem auf 60 °C eingestellten Heizblock für mindestens 1 Stunde bis über Nacht. Auf Raumtemperatur abkühlen lassen und in einen Schieberost legen.
- Entparaffinisierung, Rehydratation und Antigenrückgewinnung
- Beschriften Sie zwei Objektträgergläser, A und B, und füllen Sie sie jeweils mit so viel Trilogy-Lösung, dass das Gewebe vollständig untergetaucht ist.
- Stellen Sie den Schieberost in Glas A und stellen Sie beide Gläser in einen Schnellkochtopf. Stellen Sie den Schnellkochtopf 15 Minuten lang auf hohen Druck ein. Lassen Sie den Schnellkochtopf abkühlen, bevor Sie die Objektträger öffnen und entnehmen.
- Platzieren Sie das Objektträgergestell sofort für 2 Minuten von Glas A in Glas B, um sicherzustellen, dass das Paraffin von den Objektträgern entfernt wird. Nehmen Sie die Objektträger aus Glas B und legen Sie sie in entionisiertes (DI) Wasser.
HINWEIS: Glas A kann mit einmal verwendeter Trilogy gefüllt werden. Neue Trilogie sollte immer in Jar B verwendet werden. - Legen Sie die Objektträger 5 Minuten lang in Tris-gepufferte Kochsalzlösung (TBS), bevor Sie mit dem Blockieren fortfahren.
- Blockieren von unspezifischen Hintergrundflecken
- Nehmen Sie die Objektträger aus dem Objektträgergestell und klopfen Sie sie seitlich an, um überschüssiges TBS zu entfernen.
- Zeichnen Sie mit einem hydrophoben Marker einen Kasten um das Gewebe. Tragen Sie den Blockierungspuffer auf, um das Gewebe vollständig zu bedecken, und inkubieren Sie es 30-60 Minuten lang in einer befeuchteten Kammer bei Raumtemperatur.
- Inkubation mit Primärantikörpern
- Auswahl von Primärantikörpern von Zielproteinen, die in verschiedenen Wirtsspezies gezüchtet wurden, und Verdünnung in Antikörperverdünnungsmittel gemäß der Empfehlung des Herstellers. Für diese Studie wurden die folgenden Antikörper verwendet: H+/K+-ATPase, GIF, Mist118,19 und CD44v9 20,21. Detaillierte Informationen zu den Primärantikörpern finden Sie in der Materialtabelle.
- Entfernen Sie den Blockierungspuffer, tragen Sie verdünnte Antikörper auf und legen Sie die Objektträger wieder in die befeuchtete Kammer. Über Nacht bei 4 °C inkubieren.
- Entfernen Sie die primären Antikörper und waschen Sie die Objektträger 3x in TBS für 5 Minuten pro Waschgang.
- Sekundäre Antikörper und Lektine
- Wählen Sie Sekundärantikörper entsprechend der Wirtsspezies der Primärantikörper aus. Lektine können mit Sekundärantikörpern gemischt und gleichzeitig appliziert werden.
- Verdünnen Sie die Sekundärantikörper und Lektine gemäß den Empfehlungen des Herstellers in Antikörperverdünnungsmittel. Detaillierte Informationen zu den in dieser Studie verwendeten Sekundärantikörpern und Lektinen finden Sie in der Materialtabelle.
- Tragen Sie Sekundärantikörper, Lektine und DAPI (1 μg/ml) auf und legen Sie die Objektträger zurück in die befeuchtete Kammer. 1 h bei Raumtemperatur ohne Licht inkubieren.
- Nehmen Sie die Objektträger aus der befeuchteten Kammer und spülen Sie 3x mit TBS für 5 min pro Waschgang.
- Montage und Mikroskopievorbereitung
- Nehmen Sie einen Objektträger aus dem TBS und entfernen Sie überschüssige Flüssigkeit, indem Sie den Objektträger seitlich auf ein Papiertuch klopfen.
- Fügen Sie 15-20 μl Eindeckmedium hinzu. Halten Sie ein sauberes Deckglas an den Rändern fest und platzieren Sie eine Kante gegenüber dem Taschentuch mit dem Eindeckmedium dazwischen.
- Senken Sie das Deckglas langsam ab, so dass das Medium gleichmäßig auf dem Gewebe verteilt ist, und achten Sie darauf, dass keine Blasen eingeschlossen werden.
- Verwenden Sie ein Aufgabentuch, um überschüssiges Einbettmedium an den Rändern aufzusaugen. Trocknen Sie den fertigen Objektträger im Dunkeln bei Raumtemperatur, bevor Sie mit der Mikroskopie fortfahren. Wiederholen Sie diesen Vorgang für die restlichen Folien.
Ergebnisse
Erwachsene Wildtyp- (WT) und MT-TGFα-Mäuse erhielten 2 Wochen vor der Tötung Zinksulfat (25 mM ZnSO4) im Trinkwasser. Die Mägen von WT-Mäusen schienen grob und histologisch normal zu sein. Im Gegensatz dazu waren die Mägen von MT-TGFα stark verdickt (Abbildung 2A). Mikroskopisch zeigten diese Mägen eine massive foveoläre Hyperplasie mit Verlust sowohl der Parietal- als auch der Hauptzellen (Abbildung 2B-D), was die histologischen Merkmale der Ménétrier-Krankheit (MD) rekapituliert. Der Verlust von Hauptzellen kann auf zwei verschiedene Arten erfolgen: Tod von Hauptzellen oder spasmolytische Polypeptid-exprimierende Metaplasie (SPEM), die aus Hauptzellen entsteht. Um diese beiden Möglichkeiten zu unterscheiden, führten wir eine Abstammungsverfolgung von Hauptzellen durch Kreuzung von Mist1-CreERT2 durch; R26-LSL-mTmG-Mäuse mit MT-TGFα-Mäusen. Diese Mäuse wurden zunächst mit niedrig dosiertem Tamoxifen (37,5 mg/kg intraperitoneal an 7 aufeinanderfolgenden Tagen) behandelt, um die Hauptzellen mit GFP zu markieren, und dann mit ZnSO4 im Trinkwasser, um eine TGFα-Überexpression zu induzieren. Wir beobachteten seltene GFP-markierte Zellen in den MT-TGFα-Mäusen (Daten nicht gezeigt). Darüber hinaus gab es keine groben und histologischen Unterschiede bei den MT-TGFα-Mäusen in Gegenwart oder Abwesenheit von ZnSO4 (Abbildung 3A-C). Eine mögliche Erklärung für diesen Befund war, dass TGFα möglicherweise die Expression von Mist1, einem essentiellen Transkriptionsfaktor für die Hauptzellen18, reduziert und die Nützlichkeit des Mist1-CreERT2-Allels untergraben hat. Tatsächlich ging die immunhistochemische Färbung von Mist1 bei MT-TGFα-Mäusen ohne ZnSO4-Behandlung verloren (Abbildung 3D).
Um die Undichtigkeit des MT-TGFα-Mausmodells zu überwinden, haben wir uns einem Doxycyclin-induzierbaren Doxi-TGFa-transgenen Modell zugewandt. Dies wurde durch Kreuzung von TetO-TGFα-Mäusen14 mit einer CMV-rtTA-Mauslinie13 erreicht; Es wurde bereits berichtet, dass rtTA im Magen exprimiert wird. Wir bestätigten, dass eine 2-wöchige Behandlung mit Doxycyclin in diesem neuen MD-Mausmodell eine foveoläre Hyperplasie induziert und die Anzahl der parietalen und Hauptzellen verringert (Abbildung 4A-C). Im Vergleich zu histomorphologischen Merkmalen bei MT-TGFα-Mäusen zeigten Doxi-TGFα-Mäuse eine weniger schwere Schleimhautdicke und foveoläre Hyperplasie sowie eine geringere Abnahme der Parietalzellen (Ergänzende Abbildung 2). Nichtsdestotrotz konnten wir mit der Mist1-CreERT2-Mauslinie die Abstammungslinie der Hauptzellen verfolgen und bestätigten, dass die Hauptzelllinien auch mit GSII und CD44v9 markiert sind20,21, was bestätigt, dass die TGFα-Überexpression SPEM aus den Hauptzellen induziert (Abbildung 4D).
Die aktuelle Studie zeigt, dass das MT-TGFα-Mausmodell die histopathologischen Merkmale der MD ohne Schwermetallbehandlung phänokopiert, wahrscheinlich aufgrund der intrinsischen Leckheit des Promotors/Enhancers und/oder der Unfähigkeit, eine Schwermetallexposition zu vermeiden (Abbildung 3 und ergänzende Abbildung 2). Da TGFα die Mist1-Expression unterdrückt, kann die Mist1-CreERT2-Mauslinie nicht im MT-TGFα-Mausmodell verwendet werden. Wir haben ein neues MD-Mausmodell generiert, in dem die TGFα-Expression durch Doxycyclin-Behandlung induziert werden kann. Mit diesem neuen Doxi-TGFα MD-Mausmodell konnten wir bestätigen, dass die TGFα-Überexpression SPEM induziert, das von Hauptzellen abgeleitet wird. Das Doxi-TGFα MD-Mausmodell wird nützlich sein, wenn eine präzise Kontrolle der TGFα-Expression erforderlich ist und wenn eine genetische Veränderung in Hauptzellen mit der Mist1-CreERT2-Mauslinie erforderlich ist.
Datenverfügbarkeit:
Alle Rohdaten stehen als ergänzende Dateien zur Verfügung.
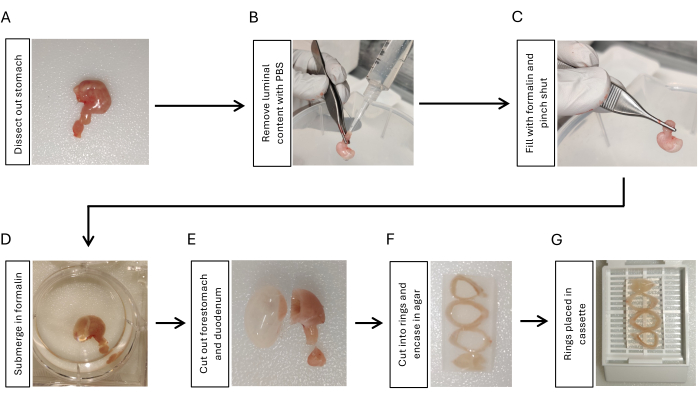
Abbildung 1: Arbeitsablauf für die Fixierung und Aufbereitung der Einbettung des Magengewebes. (A) Präparieren Sie den Magen zusammen mit einem kurzen Segment (3-5 mm) des Zwölffingerdarms. (B) Entfernen Sie den Luminalgehalt, indem Sie PBS mit einer Spritze mit Pipettenspitze aus dem Zwölffingerdarm träufeln und mit den Fingern 3x zusammendrücken. (C) Blasen Sie den Magen mit einer Spritze mit Formalin aus dem Zwölffingerdarm auf und kneifen Sie den gastroduodenalen Übergang zusammen, um das Formalin zurückzuhalten. (D) Den Magen in Formalin tauchen und über Nacht bei 4 °C unter Schütteln fixieren. (E) Den Vordermagen und den Zwölffingerdarm mit einer Rasierklinge entfernen und mit PBS abspülen. (F) Schneiden Sie den Magenkörper und das Antrum im Querschnitt in 3-4 Ringe und betten Sie sie in 2% Agarose ein, um die Ausrichtung der Magengeweberinge beizubehalten. (G) Legen Sie das in Agarose eingebettete Gewebe in Kassetten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
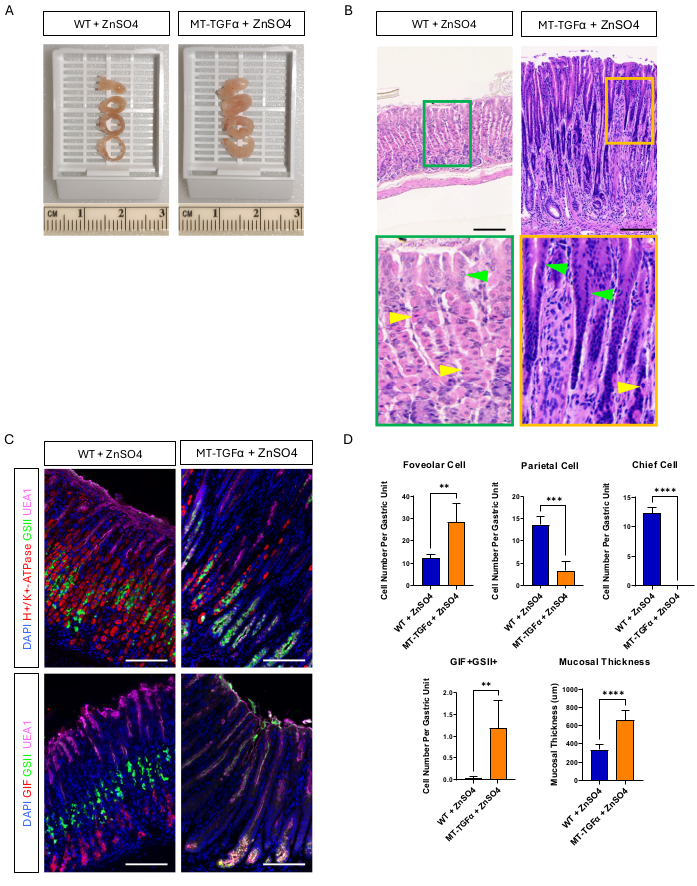
Abbildung 2: Grobe und mikroskopische Phänotypen von MT-TGFα-Mäusen, die mit dem Schwermetall ZnSO4 behandelt wurden. (A) Die Magenwand ist bei den MT-TGFα-Mäusen (rechts) dicker als bei den Kontrollmäusen (links). (B) Der Magen von MT-TGFα-Mäusen (rechts) zeigt eine massive foveoläre Hyperplasie und den Verlust von Parietalzellen. Gelbe Pfeilspitzen zeigen Parietalzellen und grüne Pfeilspitzen zeigen foveoläre Zellen an. Die Maßstabsbalken stellen 100 μm dar. (C) Die Immunfluoreszenzfärbung bestätigt, dass der MT-TGFα-Mausmagen (rechts) im Vergleich zum Kontrollmagen der Maus (links) eine erhöhte Anzahl von foveolären Zellen (UEA1-positiv) und SPEM-Zellen (GIF und GSII doppelt positiv) und eine verringerte Anzahl von Parietalzellen (H+/K+-ATPase-positiv) und Hauptzellen (GIF-einfach positiv) aufweist. Die Maßstabsbalken repräsentieren 100 μm. (D) Quantifizierung verschiedener Epithelzelltypen und Schleimhautdicken bei Wildtyp-Mäusen (WT), die mit ZnSO4 (n = 5) behandelt wurden, und MT-TGFα-Mäusen, die mit ZnSO4 (n = 3) behandelt wurden. Fehlerbalken zeigen die Standardabweichung an (**p < 0,01, ****p < 0,001, ****p < 0,0001). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
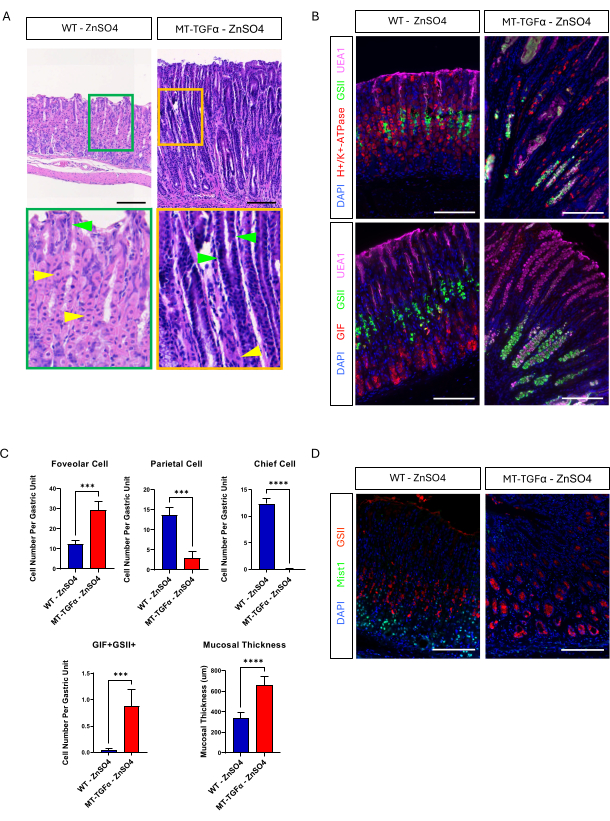
Abbildung 3: MT-TGFα-Mäuse entwickeln Magenphänotypen ohne Schwermetallbehandlung. (A) Der Magen von MT-TGFα-Mäusen (rechts) zeigt eine massive foveoläre Hyperplasie und den Verlust von Parietalzellen ohne Schwermetallbehandlung. Gelbe Pfeilspitzen zeigen Parietalzellen und grüne Pfeilspitzen zeigen foveoläre Zellen an. Die Skalenbalken stellen 100 μm dar. (B) Die Immunfluoreszenzfärbung bestätigt, dass der MT-TGFα-Mausmagen (rechts) ohne Schwermetallbehandlung eine erhöhte Anzahl von foveolären Zellen (UEA1-positiv) und SPEM-Zellen (GIF und GSII doppelt positiv) sowie eine verringerte Anzahl von Parietalzellen (H+/K+-ATPase-positiv) und Hauptzellen (GIF-einfach positiv) im Vergleich zum Kontrollmagen der Maus (links) zeigt. Die Maßstabsbalken repräsentieren 100 μm. (C) Quantifizierung verschiedener Epithelzelltypen und Schleimhautdicken bei WT-Mäusen ohne ZnSO4 (n = 5) und MT-TGFα-Mäusen mit ZnSO4 (n = 3). Fehlerbalken zeigen die Standardabweichung an (***p < 0,001, ****p < 0,0001). (D) Der Magen von MT-TGFα-Mäusen (rechts) zeigt einen Verlust der Mist1-Expression, die normalerweise in den Hauptzellen exprimiert wird (links). GSII ist ein Marker für Schleimhautzellen am Hals. Maßstabsleisten stellen 100 μm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
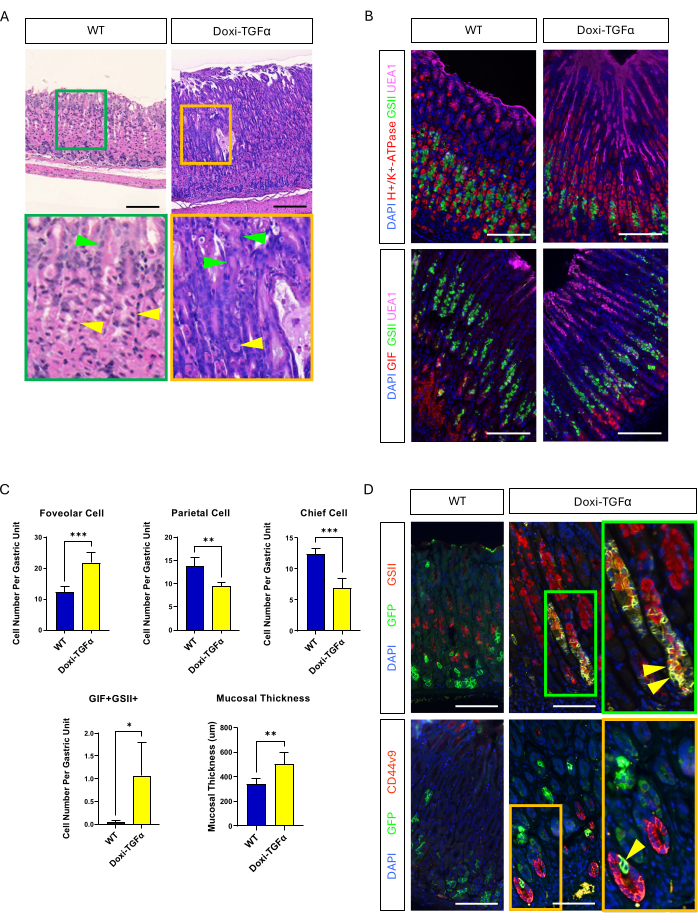
Abbildung 4: Das Doxycyclin-induzierbare TGFα-Mausmodell (Doxi-TGFα) rekapituliert die Ménétrier-Phänotypen, und die SPEM-Bildung ist in diesem Mausmodell bestätigt. (A) Magen aus CMV-rtTA; TetO-TGFα-Mäuse (Doxi-TGFα; rechts) zeigen eine massive foveoläre Hyperplasie und eine verminderte Anzahl von Parietalzellen. Gelbe Pfeilspitzen zeigen Parietalzellen und grüne Pfeilspitzen zeigen foveoläre Zellen an. Die Maßstabsbalken stellen 100 μm dar. (B) Die Immunfluoreszenzfärbung bestätigt, dass der Doxi-TGFα-Mausmagen (rechts) eine erhöhte Anzahl von foveolären Zellen (UEA1-positiv) und SPEM-Zellen (GIF und GSII doppelt positiv) sowie eine verringerte Anzahl von Parietalzellen (H+/K+-ATPase-positiv) und Hauptzellen (GIF-einfach positiv) im Vergleich zum Kontrollmagen der Maus (links) aufweist. Die Maßstabsbalken stellen 100 μm dar. (C) Quantifizierung verschiedener Epithelzelltypen und Schleimhautdicken bei WT-Mäusen (n = 5) und Doxi-TGFα-Mäusen (n = 5). Die Fehlerbalken zeigen die Standardabweichung an (*p < 0,05, **p < 0,01, ***p < 0,001). (D) Abstammungsverfolgung von Hauptzellen (GFP-positiv) mit Mist1-CreERT2; Die R26-LSL-mTmG-Mauslinie zeigt, dass GFP-positive Zellen auch im Doxi-TGFα-Mausmagen positiv für GSII und CD44v9 sind, was die SPEM-Bildung aus Hauptzellen bestätigt, während der Kontrollmagen (links) zeigt, dass fast keine GFP-positiven Zellen auch für GSII oder CD44v9 positiv sind. Die Maßstabsbalken stellen 100 μm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1: Die Behandlung mit niedrig dosiertem Tamoxifen (TMX) führt nicht zu einer Schädigung der Magenschleimhaut. Sieben aufeinanderfolgende Tage einer niedrig dosierten TMX-Behandlung (37,5 mg/kg) führen nicht zu einer Schädigung der Magenschleimhaut, was sich in der Aufrechterhaltung der parietalen Zellzahl zeigt. (A) Repräsentative H&E-Bilder ohne TMX-Behandlung (linkes Bild) und mit TMX-Behandlung (rechtes Bild). Die Maßstabsbalken stellen 100 μm dar. (B) Quantifizierung der parietalen Zellzahl pro Mageneinheit bei WT-Mäusen (n = 5) und WT mit TMX-Behandlung (n = 5). Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Vergleich der Phänotypen zwischen verschiedenen Mausmodellen der Ménétrier-Krankheit (MD). (A) MT-TGFα mit ZnSO4-Behandlung, MT-TGFα ohne ZnSO4-Behandlung und Doxi-TGFα MD-Mausmodelle zeigen foveoläre Hyperplasie, Verlust von Parietal- und Hauptzellen, vermehrte spasmolytische Polypeptid-exprimierende Metaplasie (SPEM)-Zellen (GIF- und GSII-kolokalisierte Zellen) und verdickte Mukosa. Es gibt keine phänotypischen Unterschiede zwischen MT-TGFα mit und ohne ZnSO4-Behandlungsgruppen. Das Doxi-TGFα-Mausmodell zeigt weniger schwere Phänotypen als das MT-TGFα-Mausmodell. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Morbus Ménétrier (MD) ist eine seltene prämaligne Magenerkrankung, die durch TGFα-Überexpression verursachtwird 1,2,3. Transgene Mäuse, die TGFα unter der Kontrolle des Metallothionein-Genverstärkers/-promotors (MT-TGFα) überexprimierten, waren bisher das einzige Mausmodell für MD 4,5. Da das Metallothionein-Gen auf Schwermetalle reagiert, wird in diesem Mausmodell Zinksulfat dem Trinkwasser zugesetzt oder Cadmiumsulfat injiziert, um TGFα zu induzieren 5,8. Einer der charakteristischen Phänotypen bei MD ist der Ersatz von Hauptzellen in der Basis der Magendrüsen durch muzinöse Zellen, die positiv für Marker sind, die sowohl in Schleimhautzellen als auch in antralen Muzinzellen vorhanden sind. Dies kann entweder durch den Tod von Häuptlingszellen oder durch die Umprogrammierung von Häuptlingszellen zu einer spasmolytischen Polypeptid-exprimierenden Metaplasie (SPEM) geschehen8,11. Dies kann durch die Abstammungsverfolgung von Hauptzellen in einem MD-Mausmodell getestet werden. Wir haben versucht, die Abstammungslinien der Hauptzellen mit dem Mist1-CreERT2 zu verfolgen; R26-LSL-mTmG-Mäuse, bei denen Mist1-positive Hauptzellen mit membran-targetiertem GFP markiert sind. Wir beobachteten jedoch nur eine begrenzte Anzahl von GFP-markierten Zellen in den MT-TGFα-Mäusen. Dies deutet darauf hin, dass entweder die meisten der GFP-markierten Hauptzellen aufgrund einer TGFα-Überexpression starben oder die Effizienz der GFP-Markierung in den Hauptzellen zu gering war. Da berichtet wurde, dass es keinen Anstieg des Zelltods durch TGFα-Überexpressiongab 8, untersuchten wir die Möglichkeit eines Verlusts der Mist1-Expression durch die Bewertung von MT-TGFα-Mäusen ohne Schwermetallbehandlung. Wir waren überrascht von den vollständigen Phänotypen bei MT-TGFα-Mäusen ohne Schwermetallbehandlung, einschließlich foveolärer Hyperplasie und Verlust von Parietal- und Hauptzellen. Wir bestätigten auch, dass die Mist1-Expression in MT-TGFα-Mäusen auch ohne Schwermetallbehandlung verloren geht. Es wurde bereits berichtet, dass die TGFα-Expression in MT-TGFα-Mäusen nicht streng kontrolliert wurde, da die Schwermetallexposition nicht eliminiert werden konnte. die TGFα-Expression wurde jedoch durch die Schwermetallbehandlung signifikant erhöht8. Eine umfassende phänotypische Bewertung wurde bisher bei MT-TGFα-Mäusen ohne Schwermetallbehandlung nicht durchgeführt. Die aktuelle Studie zeigt, dass MT-TGFα-Mäuse ohne Schwermetallbehandlung eine vollständige phänotypische Manifestation entwickeln.
Da die Mist1-Expression in den MT-TGFα-Mäusen bereits vor der Schwermetallbehandlung verloren ging, bestand weiterhin Bedarf an einem anderen Mausmodell, in dem die TGFα-Expression spezifisch kontrolliert wird, so dass sich Phänotypen nicht ohne Induktion einer TGFα-Überexpression entwickeln. Wir haben ein neuartiges MD-Mausmodell generiert, in dem die TGFα-Expression durch Doxycyclin-Behandlung (Doxi-TGFα) induziert wird. Wir haben bestätigt, dass dieses Mausmodell eine foveoläre Hyperplasie und den Verlust von Parietal- und Hauptzellen induziert, die die Hauptphänotypen der MD sind. Wir waren in der Lage, die Abstammung von Häuptlingszellen mit dem Mist1-CreERT2 zu verfolgen; R26-LSL-mTmG-Mäuse in diesem Mausmodell und stellte fest, dass einige GFP-markierte Zellen auch mit GSII und CD44v9 markiert waren, was bestätigt, dass SPEM in diesem neuartigen MD-Mausmodell vorkommt. Es ist der erste Bericht, der bestätigt, dass sich SPEM im Magen mit TGFα-Überexpression entwickelt. SPEM ist eine häufigere prämaligne Magenerkrankung, die der Grund für die Zunahme von Magenkrebs bei MD-Patienten sein kann22,23.
Ein Nachteil bei der Verwendung der Mist1-CreERT2-Mauslinie besteht darin, dass berichtet wurde, dass Mist1 auch in den Magenstammzellen exprimiert werden kann24. Wir fanden heraus, dass eine niedrige Dosis (37,5 mg/kg) der Tamoxifen-Behandlung eine Cre-Aktivierung induziert, insbesondere in den Hauptzellen, mit minimaler Aktivierung in der Isthmus-Region, selbst zu früheren Zeitpunkten vor der Doxycyclin-Behandlung. Ähnliche Ergebnisse wurden bereits berichtet25. Abstammungsverfolgung mit dem Mist1-CreERT2; R26-LSL-mTmG-Mäuse zeigen GFP-positive Zellen in der Nähe von GFP- und SPEM-Markern (GSII und CD44v9): Doppelt positive Zellen sind hauptsächlich in der Base lokalisiert, wo sich die Hauptzellen befinden (Abbildung 4C). Wenn die doppelt positiven Zellen der GFP- und SPEM-Marker aus den Stammzellen verfolgt werden, müsste es mehr GFP-positive Zellen in Richtung des Isthmus gegeben haben, wo sich die Stammzellen befinden. Alternativ könnten die Doxycyclin-induzierbare GIF-rtTA-Mauslinie26 oder die GPR30-rtTA-Mauslinie27 zusammen mit MT-TGFα-Mäusen für genetische Modifikationen oder die Abstammungsverfolgung der Hauptzellen verwendet werden. GIF-positive Zellen sind jedoch bei MT-TGFα-Mäusen ohne ZnSO4-Behandlung verringert (Abbildung 3B,C), und GPR30-positive Zellen gehen bei SPEM verloren, was bei MT-TGFα-Mäusen ohne ZnSO4-Behandlung auftritt. Daher sind sie im Vergleich zu Doxi-TGFα-Mäusen, die mit der Mist1-CreERT2-Mauslinie gekreuzt wurden, weniger effizient.
Die aktuelle Studie zeigt, dass MT-TGFα-Mäuse ohne Schwermetallbehandlung vollständige phänotypische Veränderungen im Magen entwickeln. Wir zeigen auch, dass einer der Phänotypen der Verlust der Mist1-Expression ist, was die Verwendung von Mist1-CreERT2 ausschließt; R26-LSL-mTmG-Mauslinie zur Spur der Hauptzellen der Abstammungslinie. Wir haben ein neuartiges MD-Mausmodell, Doxi-TGFα, generiert und zum ersten Mal bestätigt, dass SPEM bei MD mit diesem Mausmodell entwickelt wird. Dieses neuartige MD-Mausmodell wird nützlich sein, wenn eine genaue Kontrolle der Entwicklung von MD-Phänotypen erforderlich ist und wenn genetische Modifikationen in Hauptzellen mit der Mist1-CreERT2-Mauslinie erforderlich sind. MD-Phänotypen werden durch die Aktivierung des EGFR-Signalwegs durch TGFα-Überexpression induziert. Es ist jedoch nicht bekannt, bei welcher EGFR-Aktivierung Zelltypen für die beobachteten Phänotypen verantwortlich sind. Mit Hilfe des Doxi-TGFα-Mausmodells untersuchen wir derzeit die Rolle des EGFR-Signalwegs in verschiedenen Zelltypen, einschließlich Hauptzellen, die die Mist1-CreERT2-Mauslinie verwenden.
Offenlegungen
Alle Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde vom National Institute of Diabetes and Digestive and Kidney Diseases (K08 DK124686 bis WJH) unterstützt. Wir danken Gina Della Porta und Sarah E. Glass für die Bearbeitung des Manuskripts.
Beitrag des Autors:
TTG führte Experimente durch, generierte Zahlen, schrieb das Manuskript und redigierte das Manuskript. JDP führte Experimente durch, generierte Zahlen, schrieb das Manuskript und bearbeitete das Manuskript. SKM stellte die TetO-TGFα-Mauslinie zur Verfügung und editierte das Manuskript. RJC konzipierte Experimente und überarbeitete das Manuskript. WJH konzipierte Experimente, führte Experimente durch, interpretierte Daten, durchsuchte die Literatur, schrieb das Manuskript und redigierte das Manuskript.
Materialien
| Name | Company | Catalog Number | Comments |
| Mouse anti H+/K+-ATPase antibody | A gift from Dr. Eunyoung Choi | N/A | Dilution: 1:10000 |
| Antibody Diluent | Abcam | 559148 | |
| Anti-rabbit GFP | Life Technologies Corporation | A11122 | Dilution: 1:500 |
| Charged Glass Slides | Fisher | 22-178-277 | |
| Cover Slips | Globe Scientific | 1411-10 | |
| Donkey anti-mouse 594 | Invitrogen | A12102 | Dilution: 1:500 |
| Donkey anti-rabbit 488 | Invitrogen | A21206 | Dilution: 1:500 |
| Donkey anti-rabbit 594 | Invitrogen | A21207 | Dilution: 1:500 |
| Donkey anti-rat 594 | Invitrogen | A21209 | Dilution: 1:500 |
| Doxyclycine Hyclate | TCI | D4116 | |
| Flouromount-G | Thermo fischer | 00-4958-02 | |
| GSII 488 | Invitrogen | L21415 | Dilution: 1:500 |
| Hydrophobic Marker | Electron Microscopy Sciences | 71312 | |
| Incubator | Labnet | I 5110 | |
| MIST1/bHLHa15 (D7N4B) XP Rabbit mAb | Cell Signaling | 14896S | Dilution: 1:200 |
| Pressure Cooker (6QT) | Cuisinart | CPC-600N1 | |
| Protein Block | Abcam | AB64226 | |
| Rabbit anti-GIF antibody | MyBioSource | MBS2028736 | Dilution: 1:200 |
| Rat anti CD44v9 mAb | Cosmo Bio | LKG-M002 | Dilution: 1:20000 |
| Slide Jars | Simport | M906-12AS | |
| Tamoxifen | Sigma-Aldrich | T5648 | |
| Trilogy | Sigma | 922P-10-RUO | |
| UEA1 Dylight 649 | Vector Laboratories | DL-1068 | Dilution: 1:500 |
Referenzen
- Huh, W. J., Coffey, R. J., Washington, M. K. Menetrier's disease: Its mimickers and pathogenesis. J Pathol Transl Med. 50 (1), 10-16 (2016).
- Tanksley, J. Jr, Tanksley, J. Pierre menetrier and his disease. Trans Am Clin Climatol Assoc. 123, discussion 133-124 126-133 (2012).
- Rich, A., et al. Distinguishing menetrier's disease from its mimics. Gut. 59 (12), 1617-1624 (2010).
- Takagi, H., Jhappan, C., Sharp, R., Merlino, G. Hypertrophic gastropathy resembling menetrier's disease in transgenic mice overexpressing transforming growth factor alpha in the stomach. J Clin Invest. 90 (3), 1161-1167 (1992).
- Dempsey, P. J., et al. Possible role of transforming growth factor alpha in the pathogenesis of menetrier's disease: Supportive evidence form humans and transgenic mice. Gastroenterology. 103 (6), 1950-1963 (1992).
- Fiske, W. H., et al. Efficacy of cetuximab in the treatment of menetrier's disease. Sci Transl Med. 1 (8), 8ra18(2009).
- Burdick, J. S., et al. Treatment of menetrier's disease with a monoclonal antibody against the epidermal growth factor receptor. N Engl J Med. 343 (23), 1697-1701 (2000).
- Goldenring, J. R., et al. Overexpression of transforming growth factor-alpha alters differentiation of gastric cell lineages. Dig Dis Sci. 41 (4), 773-784 (1996).
- Sharp, R., et al. Transforming growth factor alpha disrupts the normal program of cellular differentiation in the gastric mucosa of transgenic mice. Development. 121 (1), 149-161 (1995).
- Bockman, D. E., Sharp, R., Merlino, G. Regulation of terminal differentiation of zymogenic cells by transforming growth factor alpha in transgenic mice. Gastroenterology. 108 (2), 447-454 (1995).
- Nomura, S., et al. Evidence for repatterning of the gastric fundic epithelium associated with menetrier's disease and tgfalpha overexpression. Gastroenterology. 128 (5), 1292-1305 (2005).
- Shi, G., et al. Loss of the acinar-restricted transcription factor mist1 accelerates kras-induced pancreatic intraepithelial neoplasia. Gastroenterology. 136 (4), 1368-1378 (2009).
- Kistner, A., et al. Doxycycline-mediated quantitative and tissue-specific control of gene expression in transgenic mice. Proc Natl Acad Sci U S A. 93 (20), 10933-10938 (1996).
- Hardie, W. D., et al. Conditional expression of transforming growth factor-alpha in adult mouse lung causes pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 286 (4), L741-L749 (2004).
- Keeley, T. M., Horita, N., Samuelson, L. C. Tamoxifen-induced gastric injury: Effects of dose and method of administration. Cell Mol Gastroenterol Hepatol. 8 (3), 365-367 (2019).
- Huh, W. J., et al. Tamoxifen induces rapid, reversible atrophy, and metaplasia in mouse stomach. Gastroenterology. 142 (1), 21-24.e7 (2012).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods Enzymol. 533, 225-233 (2013).
- Ramsey, V. G., et al. The maturation of mucus-secreting gastric epithelial progenitors into digestive-enzyme secreting zymogenic cells requires mist1. Development. 134 (1), 211-222 (2007).
- Huh, W. J., et al. Xbp1 controls maturation of gastric zymogenic cells by induction of mist1 and expansion of the rough endoplasmic reticulum. Gastroenterology. 139 (6), 2038-2049 (2010).
- Engevik, A. C., et al. The development of spasmolytic polypeptide/tff2-expressing metaplasia (spem) during gastric repair is absent in the aged stomach. Cell Mol Gastroenterol Hepatol. 2 (5), 605-624 (2016).
- Wada, T., et al. Functional role of cd44v-xct system in the development of spasmolytic polypeptide-expressing metaplasia. Cancer Sci. 104 (10), 1323-1329 (2013).
- Halldorsdottir, A. M., et al. Spasmolytic polypeptide-expressing metaplasia (spem) associated with gastric cancer in iceland. Dig Dis Sci. 48 (3), 431-441 (2003).
- Yamaguchi, H., Goldenring, J. R., Kaminishi, M., Lee, J. R. Identification of spasmolytic polypeptide expressing metaplasia (spem) in remnant gastric cancer and surveillance postgastrectomy biopsies. Dig Dis Sci. 47 (3), 573-578 (2002).
- Hayakawa, Y., et al. Mist1 expressing gastric stem cells maintain the normal and neoplastic gastric epithelium and are supported by a perivascular stem cell niche. Cancer Cell. 28 (6), 800-814 (2015).
- Saenz, J. B., Vargas, N., Cho, C. J., Mills, J. C. Regulation of the double-stranded rna response through adar1 licenses metaplastic reprogramming in gastric epithelium. JCI Insight. 7 (3), e153511(2022).
- Caldwell, B., Meyer, A. R., Weis, J. A., Engevik, A. C., Choi, E. Chief cell plasticity is the origin of metaplasia following acute injury in the stomach mucosa. Gut. 71 (6), 1068-1077 (2022).
- Hata, M., et al. Gpr30-expressing gastric chief cells do not dedifferentiate but are eliminated via pdk-dependent cell competition during development of metaplasia. Gastroenterology. 158 (6), 1650-1666.e15 (2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten