Research Article
Sviluppo di modelli murini per la malattia di Ménétrier
In questo articolo
Riepilogo
L'attuale studio dimostra che i topi MT-TGFα mostrano metaplasia spasmolitica che esprime polipeptidi (SPEM) nello stomaco. La perdita del promotore ha impedito la dimostrazione che le principali linee cellulari sono riconducibili a SPEM. Pertanto, abbiamo inoltre sviluppato un modello murino inducibile dalla doxiciclina (Doxi-TGFα) e abbiamo confermato che SPEM è derivato da cellule principali.
Abstract
La malattia di Ménétrier (MD) è una rara malattia gastrica premaligna acquisita, caratterizzata da pieghe rugali giganti, diminuzione della secrezione acida e perdita di proteine. I pazienti con MD mostrano un'aumentata espressione di un ligando del recettore EGF (EGFR), trasformando il fattore di crescita-α (TGFα) nello stomaco. L'anticorpo neutralizzante l'EGFR, cetuximab, determina un rapido miglioramento clinico e la remissione istologica. Al di là di questi risultati, l'eziologia e i meccanismi molecolari sottostanti non sono ben compresi. La linea murina transgenica Metallotioneina (MT)-TGFα è il primo modello murino di MD che ricapitola le caratteristiche istopatologiche della MD, tra cui l'iperplasia foveolare e la perdita di cellule parietali. In questo modello murino, il TGFα è guidato dall'enhancer/promotore MT inducibile da metalli pesanti. Studi precedenti hanno utilizzato il solfato di zinco (ZnSO4) nell'acqua potabile o iniezioni intraperitoneali di solfato di cadmio (CdSO4) per indurre il TGFα. Tuttavia, abbiamo scoperto che i topi MT-TGFα sviluppano fenotipi senza trattamento con metalli pesanti, indicando la perdita del promotore. Abbiamo anche scoperto che la sovraespressione di TGFα sopprime l'espressione di Mist1, un fattore di trascrizione importante per la differenziazione delle cellule principali, ostacolando così la manipolazione genetica nelle cellule principali utilizzando la linea murina Mist1-CreERT2. Per ovviare a ciò, abbiamo sviluppato un modello murino inducibile (Doxi-TGFα) in cui il TGFα è indotto dal trattamento con doxiciclina (CMV-rtTA; TetO-TGFα). Sebbene il modello murino Doxi-TGFα sviluppi fenotipi più lievi rispetto al modello MT-TGFα, ha riassunto le caratteristiche della MD, tra cui l'iperplasia foveolare e la perdita di cellule parietali. Utilizzando il modello murino Doxi-TGFα, abbiamo scoperto che la metaplasia spasmolitica che esprime polipeptidi (SPEM) è indotta nella MD e che la SPEM è derivata dalle cellule principali mediante tracciamento del lignaggio utilizzando la linea murina Mist1-CreERT2. Entrambi i modelli murini MT-TGFα e Doxi-TGFα offrono modelli in vivo di MD e sono utili per studiare i meccanismi molecolari alla base della patogenesi della MD e le opzioni di trattamento per la malattia. I topi Doxi-TGFα saranno anche un modello utile per studiare gli effetti della sovraespressione di TGFα in altri tessuti.
Introduzione
La malattia di Ménétrier (MD), nota anche come gastropatia ipertrofica proteino-disperdente, è una rara condizione precancerosa gastrica. Lo stomaco dei pazienti con MD mostra una massiccia iperplasia foveolare, che porta ad un aumento della secrezione di muco gastrico, e una diminuzione del numero di cellule parietali, che porta a una diminuzione della secrezione acida gastrica. Inoltre, le proteine vengono perse selettivamente attraverso la mucosa gastrica, il che porta a ipoalbuminemia ed edema periferico 1,2,3. La patogenesi della MD non era nota fino a quando non è stato riportato che i topi transgenici che sovraesprimevano TGFα sotto il controllo dell'enhancer/promotore del gene della metallotioneina (MT) ricapitolavano i fenotipi della MD nello stomaco 4,5. Gli stomaci dei pazienti con MD hanno anche mostrato un aumento dell'espressione di TGFα, un ligando del recettore EGF (EGFR). Cetuximab, un anticorpo anti-EGFR, è stato segnalato come il primo trattamento medico efficace per la MD, il che ha confermato che l'attivazione dell'EGFR da parte della sovraespressione del TGFα contribuisce alla patogenesi della MD 6,7.
Da allora, la linea di topi MT-TGFα è stata utilizzata come modello murino per la MD. Poiché l'espressione del TGFα è regolata dal gene della risposta ai metalli pesanti, l'enhancer/promotore della metallotioneina, il solfato di zinco (ZnSO4) nell'acqua potabile o le iniezioni intraperitoneali di solfato di cadmio (CdSO4) sono stati utilizzati per indurre l'espressione del TGFα 5,8. Il modello murino MT-TGFα è stato ulteriormente caratterizzato per i fenotipi di MD. Utilizzando questo modello murino, è stato dimostrato che il TGFα induce la differenziazione delle cellule foveolari superficiali secernenti mucina mentre inibisce la differenziazione in cellule parietali secernenti acido e linee cellulari principali secernenti pepsinogeno 9,10. E' stato anche dimostrato che il corpo gastrico/mucosa del fondo diventa antralizzato e che le cellule positive al fattore 2 del trifoglio (TFF2) sono presenti alla base delle ghiandole gastriche, suggerendo che la metaplasia spasmolitica che esprime polipeptidi (SPEM) si verifica in MD 8,11.
Nel presente studio, dimostriamo che i topi MT-TGFα sviluppano caratteristiche di MD senza trattamento con metalli pesanti. Questi fenotipi includono la perdita dell'espressione di Mist1, un fattore di trascrizione che è essenziale per la differenziazione delle cellule principali e viene perso in SPEM. A causa della perdita di Mist1, la linea di topi Mist1-CreERT212 non ha potuto essere utilizzata insieme alla linea di topi MT-TGFα per esaminare se SPEM nella MD deriva da cellule principali mediante tracciamento del lignaggio. Con l'obiettivo di superare la perdita del modello murino MT-TGFα, abbiamo sviluppato un nuovo modello murino MD (CMV-RTTA13; TetO-TGFα14) dove il TGFα è indotto dal trattamento con doxiciclina (Doxi-TGFα). Abbiamo confermato che questo modello di topo mostra anche le caratteristiche di MD. Utilizzando il modello murino Doxi-TGFα, dimostriamo che SPEM nasce dalle cellule principali mediante tracciamento del lignaggio utilizzando la linea murina Mist1-CreERT2. Introduciamo due modelli murini MD nel presente studio. Entrambi i modelli possono essere utilizzati per studiare la patogenesi e per la ricerca di potenziali bersagli terapeutici. Il nuovo topo Doxi-TGFα sarà particolarmente prezioso quando l'inizio dei fenotipi MD deve essere controllato con precisione o quando è richiesta la modificazione genetica nelle cellule principali utilizzando la linea di topi Mist1-CreERT2.
Protocollo
Tutte le procedure e l'allevamento degli animali sono state approvate dai comitati istituzionali per la cura e l'uso degli animali dell'Università di Yale e in conformità con i principi del governo degli Stati Uniti per l'utilizzo e la cura degli animali utilizzati nella ricerca, nell'insegnamento e nei test.
1. Esperimenti sui topi
- Trattamenti per topi
- Trattare topi MT-TGFα (sia maschi che femmine di età compresa tra 2 e 4 mesi) con 25 mM di ZnSO4 in acqua potabile per 2 settimane per indurre la sovraespressione di TGFα.
- Trattare CMV-rtTA/+; Topi TetO-TGFα/+ (Doxi-TGFα) (sia maschi che femmine di età compresa tra 2 e 4 mesi) con 2 mg/mL di doxiciclina in acqua potabile per 2 settimane per indurre la sovraespressione di TGFα.
- Aggiungere un Mist1-CreERT2/+; R26-LSL-mTmG/+ di topo maschio o femmina e aggiungere un topo Doxi-TGFα del sesso opposto nella gabbia di riproduzione per il tracciamento del lignaggio delle cellule principali in modelli murini MD.
- Iniettare Mist1-CreERT2/+; R26-LSL-mTmG/+; CMV-rtTA/+; Topi TetO-TGFα/+ (sia maschi che femmine di età compresa tra 2 e 4 mesi) con tamoxifene (37,5 mg/kg) per via intraperitoneale. Iniettare per 7 giorni consecutivi, alternando tra i quadranti inferiori destro e sinistro dell'addome ed evitando di colpire gli organi interni. Indurre l'espressione di TGFα mediante trattamento con doxiciclina (2 mg/mL) in acqua potabile per 2 settimane.
NOTA: Verificare che non vi siano lesioni indotte da tamoxifene nello stomaco15,16, come fatto qui contando le cellule parietali nei topi wild-type con e senza trattamento con tamoxifene (Figura supplementare 1).
- Fissazione del tessuto gastrico
- Eutanasia dei topi per sovradosaggio di isoflurano dopo 2 settimane di sovraespressione di TGFα. Utilizzando un barattolo essiccatore in una cappa chimica, posizionare i topi su una piattaforma perforata che impedisca il contatto diretto con l'anestetico liquido. Chiudere il coperchio e monitorare i topi fino a quando non mancano di respirazione per più di 60 secondi, seguiti da lussazione cervicale.
- Sezionare lo stomaco tagliando la giunzione gastroesofagea, tagliando il duodeno con 5 mm di duodeno attaccato allo stomaco e rimuovendo tutti i legamenti peritoneali intorno allo stomaco usando forbici e pinze (Figura 1A).
- Instillare soluzione salina tamponata con fosfato (PBS) utilizzando una siringa da 10 mL con un puntale per pipetta attaccato al lato duodenale. Stringilo con le dita per rimuovere il contenuto luminale. Ripetere 3 volte (Figura 1B).
- Gonfiare lo stomaco con 2 mL di formalina al 10% utilizzando un'altra siringa da 10 mL con un puntale per pipetta attaccato. Serrare saldamente con una pinza alla giunzione gastroduodenale per 5-10 s mentre si rimuove la punta dallo stomaco (Figura 1C).
- Immergere lo stomaco gonfio in formalina al 10% per una notte a 4 °C agitando (Figura 1D).
ATTENZIONE: Utilizzare dispositivi di protezione adeguati quando si lavora con sostanze tossiche come la formalina.
- Preparazione dello stomaco per l'inclusione della paraffina
- Tagliare il duodeno e il prestomaco usando una lama di rasoio (Figura 1E). Sciacquare il tessuto gastrico con PBS per 5 minuti, 3 volte agitando.
- Tagliare lo stomaco in 3-4 anelli dello stesso spessore (3-5 mm) utilizzando una lametta. Incorporare gli anelli dello stomaco in agarosio al 2% per mantenere l'orientamento. Posizionare gli anelli dello stomaco in sequenza da quelli prossimali a quelli distali posizionando il lato della curvatura minore nella stessa direzione (Figura 1F).
- Posizionare gli anelli dello stomaco incorporati nell'agarosio in una cassetta di tessuto (Figura 1G) e inviare i campioni alla struttura di base istologica per l'inclusione della paraffina17.
2. Colorazione immunofluorescente
- Preparazione dei vetrini
- Scaldare i vetrini con sezioni di paraffina su di essi in un forno asciutto o su un blocco termico impostato a 60 °C per un minimo di 1 ora o durante la notte. Lasciare raffreddare a temperatura ambiente e mettere in una griglia per vetrini.
- Deparaffinazione, reidratazione e recupero dell'antigene
- Etichettare due barattoli per vetrini, A e B, e riempire ciascuno con una quantità di soluzione Trilogy sufficiente a immergere completamente il tessuto.
- Posizionare la griglia scorrevole nel barattolo A e mettere entrambi i barattoli in una pentola a pressione. Impostare la pentola a pressione ad alta pressione per 15 minuti. Lasciare raffreddare la pentola a pressione prima di aprire e recuperare i vetrini.
- Posizionare immediatamente il rack per vetrini dal barattolo A al barattolo B per 2 minuti per assicurarsi che la paraffina venga rimossa dai vetrini. Rimuovere i vetrini dal barattolo B e metterli in acqua deionizzata (DI).
NOTA: Il barattolo A può essere riempito con Trilogy usato una volta. La Nuova Trilogia dovrebbe essere sempre utilizzata nel Barattolo B. - Posizionare i vetrini in soluzione salina tamponata Tris (TBS) per 5 minuti prima di procedere al blocco.
- Blocco della colorazione di fondo non specifica
- Rimuovere i vetrini dal rack per vetrini e picchiettarli lateralmente per rimuovere il TBS in eccesso.
- Disegna una scatola attorno al tessuto usando un pennarello idrofobico. Applicare un tampone bloccante per coprire completamente il tessuto e incubare per 30-60 minuti in una camera umidificata a temperatura ambiente.
- Incubazione con anticorpi primari
- Selezionare gli anticorpi primari delle proteine bersaglio allevate in diverse specie ospiti e diluirli in diluente anticorpale secondo le raccomandazioni del produttore. Per questo studio sono stati utilizzati i seguenti anticorpi: H+/K+-ATPasi, GIF, Mist118,19 e CD44v920,21. Informazioni dettagliate sugli anticorpi primari sono disponibili nella Tabella dei materiali.
- Rimuovere il tampone di bloccaggio, applicare gli anticorpi diluiti e riposizionare i vetrini nella camera umidificata. Incubare per una notte a 4 °C.
- Rimuovere gli anticorpi primari e lavare i vetrini 3 volte in TBS per 5 minuti per ogni lavaggio.
- Anticorpi secondari e lectine
- Scegliere gli anticorpi secondari in base alla specie ospite degli anticorpi primari. Le lectine possono essere miscelate con anticorpi secondari e applicate allo stesso tempo.
- Diluire gli anticorpi secondari e le lectine secondo le raccomandazioni del produttore nel diluente anticorpale. Informazioni dettagliate sugli anticorpi secondari e sulle lectine utilizzate in questo studio sono disponibili nella Tabella dei materiali.
- Applicare anticorpi secondari, lectine e DAPI (1 μg/mL) e riposizionare i vetrini nella camera umidificata. Incubare per 1 ora a temperatura ambiente al riparo dalla luce.
- Rimuovere i vetrini dalla camera umidificata e risciacquare 3 volte con TBS per 5 minuti per ogni lavaggio.
- Montaggio e preparazione al microscopio
- Rimuovere un vetrino dal TBS e rimuovere il liquido in eccesso picchiettando lateralmente il vetrino su un tovagliolo di carta.
- Aggiungere 15-20 μl di mezzo di montaggio. Tenere un vetrino coprioggetto pulito per i bordi e posizionare un bordo opposto al fazzoletto con il mezzo di montaggio in mezzo.
- Abbassare lentamente il vetrino coprioggetti in modo che il terreno si distribuisca uniformemente sul tessuto, facendo attenzione a non intrappolare le bolle.
- Utilizzare una salvietta per attività per assorbire una quantità eccessiva di materiale di montaggio attorno ai bordi. Asciugare il vetrino finito al buio a temperatura ambiente prima di procedere alla microscopia. Ripetere questa procedura per le diapositive rimanenti.
Risultati
I topi adulti wild-type (WT) e MT-TGFα hanno ricevuto solfato di zinco (25 mM ZnSO4) nell'acqua potabile per 2 settimane prima del sacrificio. Lo stomaco dei topi WT appariva normale, grossolanamente e istologicamente. In netto contrasto, gli stomaci di MT-TGFα erano grossolanamente ispessiti (Figura 2A). Microscopicamente, questi stomaci mostravano una massiccia iperplasia foveolare con perdita sia delle cellule parietali che di quelle principali (Figura 2B-D), ricapitolando le caratteristiche istologiche della malattia di Ménétrier (MD). La perdita delle cellule principali può avvenire in due modi diversi: morte delle cellule principali o metaplasia spasmolitica che esprime polipeptidi (SPEM) derivante dalle cellule principali. Per distinguere queste due possibilità, abbiamo eseguito il tracciamento del lignaggio delle cellule principali incrociando Mist1-CreERT2; Topi R26-LSL-mTmG con topi MT-TGFα. Questi topi sono stati trattati prima con tamoxifene a basso dosaggio (37,5 mg/kg per via intraperitoneale per 7 giorni consecutivi) per marcare le cellule principali con GFP e poi con ZnSO4 nell'acqua potabile per indurre la sovraespressione di TGFα. Abbiamo osservato rare cellule marcate con GFP nei topi MT-TGFα (dati non mostrati). Inoltre, non c'erano differenze macroscopiche e istologiche nei topi MT-TGFα in presenza o assenza di ZnSO4 (Figura 3A-C). Una possibile spiegazione per questa scoperta è che il TGFα potrebbe aver ridotto l'espressione di Mist1, un fattore di trascrizione essenziale per le cellule principali18, e sovvertito l'utilità dell'allele Mist1-CreERT2. Infatti, la colorazione immunoistochimica per Mist1 è andata persa nei topi MT-TGFα senza trattamento con ZnSO4 (Figura 3D).
Per superare la permeabilità del modello murino MT-TGFα, ci siamo rivolti a un modello transgenico Doxi-TGFa inducibile dalla doxiciclina. Ciò è stato ottenuto incrociando topi TetO-TGFα14 con una linea di topi CMV-rtTA13; è stato riportato in precedenza che l'rtTA è espresso nello stomaco. Abbiamo confermato che 2 settimane di trattamento con doxiciclina inducono iperplasia foveolare e diminuzione del numero di cellule parietali e principali in questo nuovo modello murino di MD (Figura 4A-C). Rispetto alle caratteristiche istomorfologiche nei topi MT-TGFα, i topi Doxi-TGFα hanno mostrato uno spessore della mucosa e un'iperplasia foveolare meno gravi, nonché una minore diminuzione delle cellule parietali (Figura 2 supplementare). Ciononostante, siamo stati in grado di tracciare le cellule principali utilizzando la linea murina Mist1-CreERT2 e abbiamo confermato che le linee cellulari principali sono marcate anche con GSII e CD44v920,21, confermando che la sovraespressione di TGFα induce SPEM dalle cellule principali (Figura 4D).
Il presente studio mostra che il modello murino MT-TGFα fenocopia le caratteristiche istopatologiche della MD in assenza di trattamento con metalli pesanti, probabilmente a causa della permeabilità intrinseca del promotore/potenziatore e/o dell'incapacità di evitare l'esposizione ai metalli pesanti (Figura 3 e Figura 2 supplementare). Poiché il TGFα sopprime l'espressione di Mist1, la linea murina Mist1-CreERT2 non può essere utilizzata nel modello murino MT-TGFα. Abbiamo generato un nuovo modello murino di MD in cui l'espressione di TGFα può essere indotta dal trattamento con doxiciclina. Utilizzando questo nuovo modello murino Doxi-TGFα MD, siamo stati in grado di confermare che la sovraespressione di TGFα induce SPEM derivato dalle cellule principali. Il modello murino Doxi-TGFα MD sarà utile quando è necessario un controllo preciso dell'espressione di TGFα e anche quando è richiesta l'alterazione genetica nelle cellule principali utilizzando la linea murina Mist1-CreERT2.
Disponibilità dei dati:
Tutti i dati grezzi sono disponibili come file supplementari.
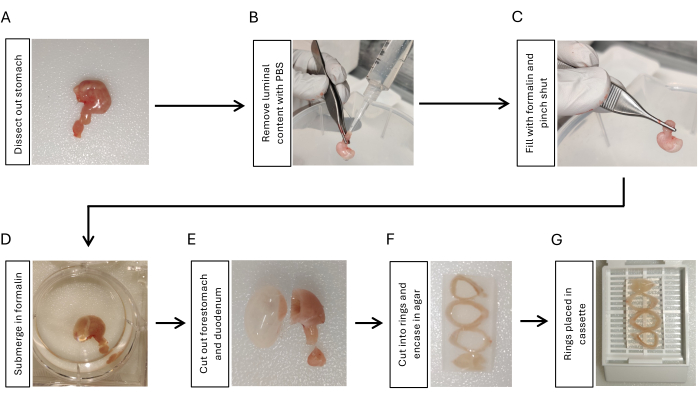
Figura 1: Flusso di lavoro per la fissazione e la preparazione dell'inclusione del tessuto gastrico. (A) Sezionare lo stomaco insieme a un segmento corto (3-5 mm) del duodeno. (B) Rimuovere il contenuto luminale instillando PBS dal duodeno usando una siringa con la punta di una pipetta e stringendolo con le dita 3 volte. (C) Gonfiare lo stomaco con formalina dal duodeno usando una siringa e pizzicare la giunzione gastroduodenale per trattenere la formalina. (D) Immergere lo stomaco in formalina e fissare per una notte a 4 °C agitando. (E) Rimuovere il prestomaco e il duodeno con una lametta e risciacquare con PBS. (F) Tagliare il corpo gastrico e l'antro in 3-4 anelli in sezione trasversale e incorporarli in agarosio al 2% per mantenere l'orientamento degli anelli del tessuto dello stomaco. (G) Posizionare il tessuto incorporato nell'agarosio in cassette. Clicca qui per visualizzare una versione più grande di questa figura.
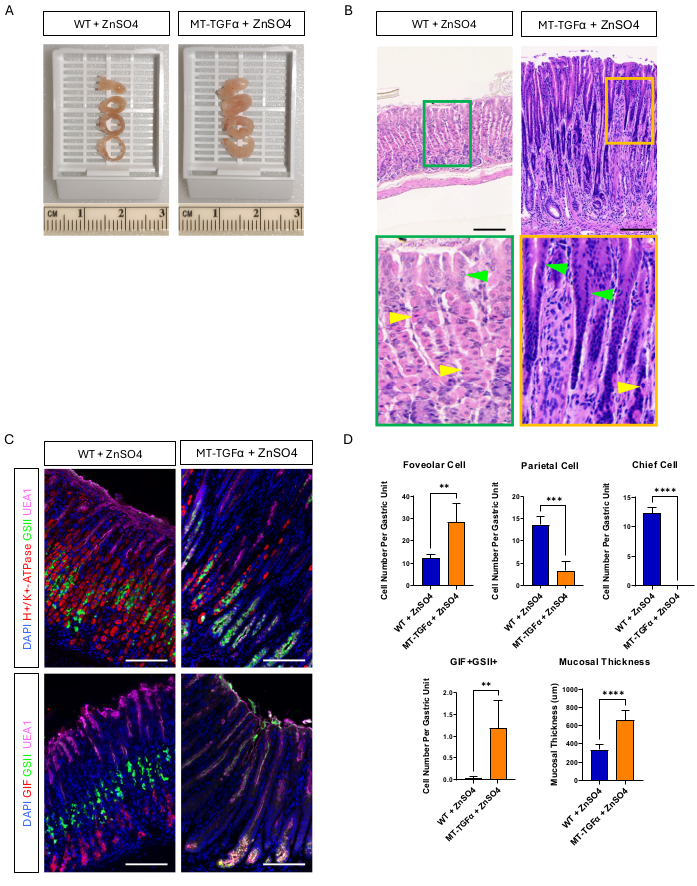
Figura 2: Fenotipi macroscopici e microscopici di topi MT-TGFα trattati con metallo pesante ZnSO4. (A) La parete gastrica è più spessa nei topi MT-TGFα (a destra) rispetto ai topi di controllo (a sinistra). (B) Lo stomaco dei topi MT-TGFα (a destra) mostra una massiccia iperplasia foveolare e perdita di cellule parietali. Le punte di freccia gialle indicano le cellule parietali e le punte di freccia verdi indicano le cellule foveolari. Le barre della scala rappresentano 100 μm. (C) La colorazione immunofluorescente conferma che lo stomaco del topo MT-TGFα (a destra) mostra un aumento del numero di cellule foveolari (UEA1 positive) e di cellule SPEM (GIF e GSII doppi positivi) e una diminuzione del numero di cellule parietali (H+/K+-ATPasi positive) e di cellule principali (GIF singolo positivo) rispetto allo stomaco del topo di controllo (a sinistra). Le barre della scala rappresentano 100 μm. (D) Quantificazione di diversi tipi di cellule epiteliali e dello spessore della mucosa in topi wild-type (WT) trattati con ZnSO4 (n = 5) e topi MT-TGFα con ZnSO4 (n = 3). Le barre di errore indicano la deviazione standard (**p < 0,01, ***p < 0,001, ****p < 0,0001). Clicca qui per visualizzare una versione più grande di questa figura.
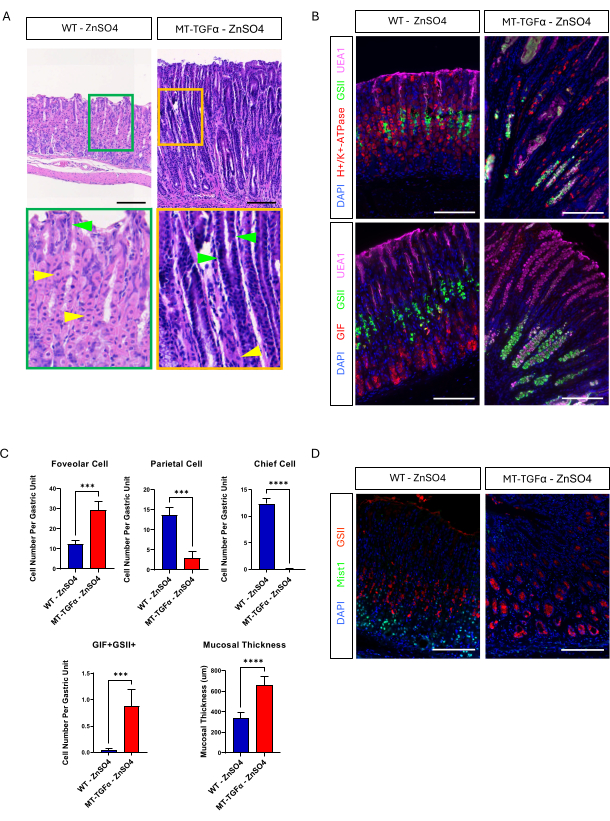
Figura 3: I topi MT-TGFα sviluppano fenotipi gastrici senza trattamento con metalli pesanti. (A) Lo stomaco di topi MT-TGFα (a destra) mostra una massiccia iperplasia foveolare e perdita di cellule parietali senza trattamento con metalli pesanti. Le punte di freccia gialle indicano le cellule parietali e le punte di freccia verdi indicano le cellule foveolari. Le barre della scala rappresentano 100 μm. (B) La colorazione immunofluorescente conferma che lo stomaco del topo MT-TGFα (a destra) senza trattamento con metalli pesanti mostra un aumento del numero di cellule foveolari (UEA1 positive) e cellule SPEM (GIF e GSII doppi positivi) e una diminuzione del numero di cellule parietali (H+/K+-ATPasi positiva) e cellule principali (GIF singolo positivo) rispetto allo stomaco del topo di controllo (a sinistra). Le barre della scala rappresentano 100 μm. (C) Quantificazione di diversi tipi di cellule epiteliali e dello spessore della mucosa in topi WT senza ZnSO4 (n = 5) e topi MT-TGFα ZnSO4 (n = 3). Le barre di errore indicano la deviazione standard (***p < 0,001, ****p < 0,0001). (D) Lo stomaco dei topi MT-TGFα (a destra) mostra la perdita dell'espressione di Mist1, che è normalmente espressa nelle cellule principali (a sinistra). Il GSII è un marcatore per le cellule mucose del collo. Le barre della scala rappresentano 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
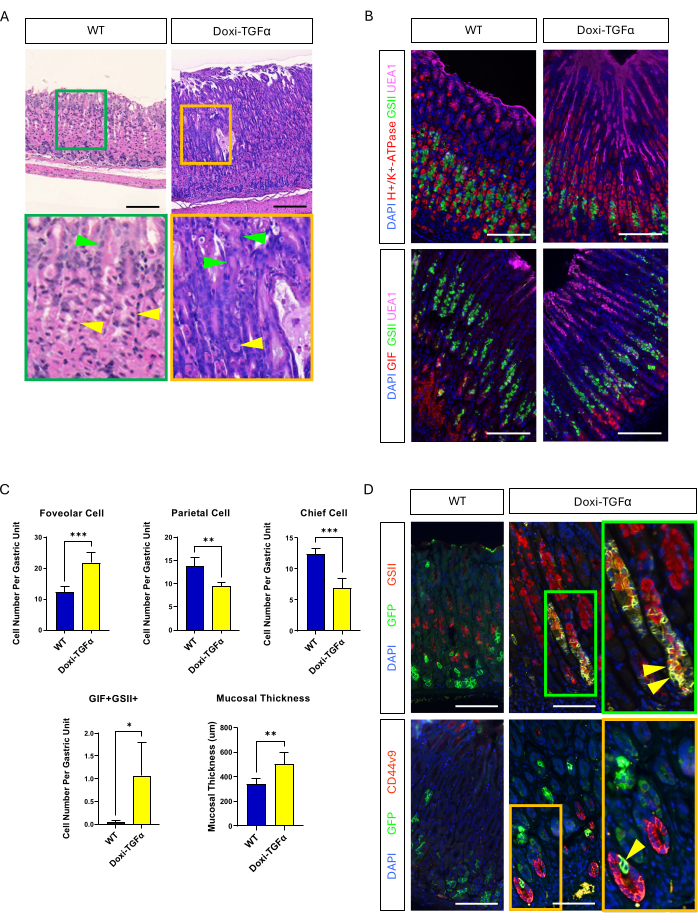
Figura 4: Il modello murino di TGFα inducibile con doxiciclina (Doxi-TGFα) ricapitola i fenotipi della malattia di Ménétrier e la formazione di SPEM è confermata in questo modello murino. (A) Stomaco da CMV-rtTA; I topi TetO-TGFα (Doxi-TGFα; a destra) mostrano una massiccia iperplasia foveolare e una diminuzione del numero di cellule parietali. Le punte di freccia gialle indicano le cellule parietali e le punte di freccia verdi indicano le cellule foveolari. Le barre della scala rappresentano 100 μm. (B) La colorazione immunofluorescente conferma che lo stomaco del topo Doxi-TGFα (a destra) mostra un aumento del numero di cellule foveolari (UEA1 positive) e di cellule SPEM (GIF e GSII doppi positivi) e una diminuzione del numero di cellule parietali (H+/K+-ATPasi positiva) e di cellule principali (GIF singolo positivo) rispetto allo stomaco del topo di controllo (a sinistra). Le barre della scala rappresentano 100 μm. (C) Quantificazione di diversi tipi di cellule epiteliali e spessore della mucosa nei topi WT (n = 5) e nei topi Doxi-TGFα (n = 5). Le barre di errore indicano la deviazione standard (*p < 0,05, **p < 0,01, ***p < 0,001). (D) Tracciamento del lignaggio delle cellule principali (GFP positivo) utilizzando Mist1-CreERT2; La linea murina R26-LSL-mTmG rivela che le cellule GFP positive sono positive anche per GSII e CD44v9 nello stomaco del topo Doxi-TGFα, confermando la formazione di SPEM derivata dalle cellule principali, mentre lo stomaco di controllo (a sinistra) mostra che quasi nessuna cellula GFP positiva è positiva anche per GSII o CD44v9. Le barre della scala rappresentano 100 μm. Clicca qui per visualizzare una versione più grande di questa figura.
Figura 1 supplementare: Il trattamento con tamoxifene a basso dosaggio (TMX) non induce danno della mucosa gastrica. Sette giorni consecutivi di trattamento con TMX a basso dosaggio (37,5 mg/kg) non inducono danno alla mucosa gastrica, esemplificato dal mantenimento del numero di cellule parietali. (A) Immagini H&E rappresentative senza trattamento TMX (pannello di sinistra) e con trattamento TMX (pannello di destra). Le barre della scala rappresentano 100 μm. (B) Quantificazione del numero di cellule parietali per unità gastrica nei topi WT (n = 5) e WT con trattamento TMX (n = 5). Clicca qui per scaricare questo file.
Figura 2 supplementare: Confronto dei fenotipi tra diversi modelli murini di malattia di Ménétrier (MD). (A) I modelli murini MT-TGFα con trattamento con ZnSO4, MT-TGFα senza trattamento con ZnSO4 e Doxi-TGFα MD mostrano iperplasia foveolare, perdita di cellule parietali e principali, aumento delle cellule spasmolitiche che esprimono metaplasia polipeptidica (SPEM) (cellule co-localizzate GIF e GSII) e mucosa ispessita. Non ci sono differenze fenotipiche tra i gruppi di trattamento con MT-TGFα con e senza ZnSO4. Il modello murino Doxi-TGFα mostra fenotipi meno gravi rispetto al modello murino MT-TGFα. Clicca qui per scaricare questo file.
Discussione
La malattia di Ménétrier (MD) è una rara malattia gastrica precancerosa causata dalla sovraespressione di TGFα 1,2,3. I topi transgenici che sovraesprimono TGFα sotto il controllo dell'enhancer/promoter genico della metallotioneina (MT-TGFα) sono stati l'unico modello murino per la MD fino ad oggi 4,5. Poiché il gene della metallotioneina è sensibile ai metalli pesanti, il solfato di zinco viene aggiunto all'acqua potabile o il solfato di cadmio viene iniettato per indurre il TGFα in questo modello murino 5,8. Uno dei fenotipi caratteristici della MD è la sostituzione delle cellule principali alla base delle ghiandole gastriche con cellule mucinose che sono positive per i marcatori presenti sia nelle cellule del collo che nelle cellule della mucina antrale. Ciò può avvenire sia per la morte delle cellule principali che per la riprogrammazione delle cellule principali in metaplasia spasmolitica che esprime polipeptidi (SPEM)8,11. Questo può essere testato tracciando il lignaggio delle cellule principali in un modello murino MD. Abbiamo cercato di tracciare il lignaggio delle cellule principali utilizzando Mist1-CreERT2; Topi R26-LSL-mTmG in cui le cellule principali positive per Mist1 sono marcate con GFP mirata alla membrana. Tuttavia, abbiamo osservato solo un numero limitato di cellule marcate con GFP nei topi MT-TGFα. Ciò suggerisce che la maggior parte delle cellule principali marcate con GFP è morta a causa della sovraespressione di TGFα o che l'efficienza della marcatura GFP nelle cellule principali era troppo bassa. Poiché è stato riportato che non vi è stato alcun aumento della morte cellulare a causa della sovraespressione diTGFα 8, abbiamo esaminato la possibilità di una perdita di espressione di Mist1 valutando topi MT-TGFα senza trattamento con metalli pesanti. Siamo rimasti sorpresi dai fenotipi completi nei topi MT-TGFα senza trattamento con metalli pesanti, tra cui l'iperplasia foveolare e la perdita di cellule parietali e principali. Abbiamo anche confermato che l'espressione di Mist1 è persa nei topi MT-TGFα anche senza trattamento con metalli pesanti. È stato precedentemente riportato che l'espressione del TGFα non era rigorosamente controllata nei topi MT-TGFα a causa dell'incapacità di eliminare l'esposizione ai metalli pesanti; tuttavia, l'espressione del TGFα è stata significativamente aumentata dal trattamento con metalli pesanti8. Una valutazione fenotipica completa non è stata precedentemente effettuata nei topi MT-TGFα senza trattamento con metalli pesanti. L'attuale studio mostra che i topi MT-TGFα sviluppano una manifestazione fenotipica completa senza trattamento con metalli pesanti.
Poiché l'espressione di Mist1 era persa nei topi MT-TGFα anche prima del trattamento con metalli pesanti, rimaneva la necessità di un altro modello murino in cui l'espressione di TGFα fosse specificamente controllata in modo che i fenotipi non si sviluppassero senza l'induzione della sovraespressione di TGFα. Abbiamo generato un nuovo modello murino di MD in cui l'espressione di TGFα è indotta dal trattamento con doxiciclina (Doxi-TGFα). Abbiamo confermato che questo modello murino induce iperplasia foveolare e perdita di cellule parietali e principali, che sono i principali fenotipi di MD. Siamo stati in grado di tracciare il lignaggio delle cellule principali utilizzando Mist1-CreERT2; I topi R26-LSL-mTmG in questo modello murino e hanno scoperto che alcune cellule marcate con GFP erano anche marcate con GSII e CD44v9, confermando che SPEM si verifica in questo nuovo modello murino MD. È il primo rapporto che conferma che la SPEM si sviluppa nello stomaco con sovraespressione di TGFα. La SPEM è una condizione gastrica premaligna più comune, che può essere la ragione per cui il cancro gastrico è aumentato nei pazienti con MD22,23.
Un avvertimento sull'utilizzo della linea di topi Mist1-CreERT2 è che è stato riportato che Mist1 può essere espresso anche nelle cellule staminali gastriche24. Abbiamo scoperto che una bassa dose (37,5 mg/kg) di trattamento con tamoxifene induce l'attivazione di Cre, più specificamente nelle cellule principali, con un'attivazione minima nella regione dell'istmo anche in momenti precedenti prima del trattamento con doxiciclina. Risultati simili sono stati precedentemente riportati25. Tracciamento del lignaggio utilizzando Mist1-CreERT2; I topi R26-LSL-mTmG mostrano cellule GFP positive vicino al marcatore GFP e SPEM (GSII e CD44v9) Le cellule doppie positive sono localizzate principalmente nella base dove si trovano le cellule principali (Figura 4C). Se le cellule doppie positive dei marcatori GFP e SPEM vengono tracciate dalle cellule staminali, ci dovrebbero essere state più cellule GFP-positive verso l'istmo dove si trovano le cellule staminali. In alternativa, la linea di topi GIF-rtTA inducibile con doxiciclina26 o la linea di topi GPR30-rtTA27 potrebbero essere utilizzati insieme ai topi MT-TGFα per modifiche genetiche o per il tracciamento del lignaggio delle cellule principali. Tuttavia, le cellule GIF-positive sono diminuite nei topi MT-TGFα senza trattamento con ZnSO4 (Figura 3B, C) e le cellule GPR30-positive sono perse in SPEM, che si verifica nei topi MT-TGFα senza trattamento con ZnSO4. Pertanto, saranno meno efficienti rispetto ai topi Doxi-TGFα incrociati con la linea di topi Mist1-CreERT2.
L'attuale studio mostra che i topi MT-TGFα sviluppano cambiamenti fenotipici completi nello stomaco senza trattamento con metalli pesanti. Mostriamo anche che uno dei fenotipi è la perdita di espressione di Mist1 e questo preclude l'uso di Mist1-CreERT2; Linea di topo R26-LSL-mTmG per tracciare le cellule principali del lignaggio. Abbiamo generato un nuovo modello murino di MD, Doxi-TGFα, e confermato per la prima volta che SPEM si sviluppa in MD utilizzando questo modello murino. Questo nuovo modello murino di MD sarà utile quando è necessario un controllo preciso dello sviluppo dei fenotipi di MD e quando sono necessarie modifiche genetiche nelle cellule principali utilizzando la linea murina Mist1-CreERT2. I fenotipi MD sono indotti dall'attivazione del segnale EGFR da parte della sovraespressione del TGFα. Tuttavia, non è nota l'attivazione dell'EGFR in quali tipi di cellule siano responsabili dei fenotipi osservati. Utilizzando il modello murino Doxi-TGFα, stiamo attualmente studiando il ruolo della segnalazione dell'EGFR in diversi tipi di cellule, comprese le cellule principali che utilizzano la linea murina Mist1-CreERT2.
Divulgazioni
Tutti gli autori non hanno conflitti di interesse da divulgare.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institute of Diabetes and Digestive and Kidney Diseases (K08 DK124686 to WJH). Ringraziamo Gina Della Porta e Sarah E. Glass per l'editing del manoscritto.
Contributo dell'autore:
TTG ha condotto esperimenti, generato figure, scritto il manoscritto e curato il manoscritto. JDP ha condotto esperimenti, generato figure, scritto il manoscritto e modificato il manoscritto. SKM ha fornito la linea di topi TetO-TGFα e ha curato il manoscritto. RJC concepì esperimenti e curò il manoscritto. WJH ha concepito esperimenti, condotto esperimenti, interpretato dati, cercato nella letteratura, scritto il manoscritto e curato il manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Mouse anti H+/K+-ATPase antibody | A gift from Dr. Eunyoung Choi | N/A | Dilution: 1:10000 |
| Antibody Diluent | Abcam | 559148 | |
| Anti-rabbit GFP | Life Technologies Corporation | A11122 | Dilution: 1:500 |
| Charged Glass Slides | Fisher | 22-178-277 | |
| Cover Slips | Globe Scientific | 1411-10 | |
| Donkey anti-mouse 594 | Invitrogen | A12102 | Dilution: 1:500 |
| Donkey anti-rabbit 488 | Invitrogen | A21206 | Dilution: 1:500 |
| Donkey anti-rabbit 594 | Invitrogen | A21207 | Dilution: 1:500 |
| Donkey anti-rat 594 | Invitrogen | A21209 | Dilution: 1:500 |
| Doxyclycine Hyclate | TCI | D4116 | |
| Flouromount-G | Thermo fischer | 00-4958-02 | |
| GSII 488 | Invitrogen | L21415 | Dilution: 1:500 |
| Hydrophobic Marker | Electron Microscopy Sciences | 71312 | |
| Incubator | Labnet | I 5110 | |
| MIST1/bHLHa15 (D7N4B) XP Rabbit mAb | Cell Signaling | 14896S | Dilution: 1:200 |
| Pressure Cooker (6QT) | Cuisinart | CPC-600N1 | |
| Protein Block | Abcam | AB64226 | |
| Rabbit anti-GIF antibody | MyBioSource | MBS2028736 | Dilution: 1:200 |
| Rat anti CD44v9 mAb | Cosmo Bio | LKG-M002 | Dilution: 1:20000 |
| Slide Jars | Simport | M906-12AS | |
| Tamoxifen | Sigma-Aldrich | T5648 | |
| Trilogy | Sigma | 922P-10-RUO | |
| UEA1 Dylight 649 | Vector Laboratories | DL-1068 | Dilution: 1:500 |
Riferimenti
- Huh, W. J., Coffey, R. J., Washington, M. K. Menetrier's disease: Its mimickers and pathogenesis. J Pathol Transl Med. 50 (1), 10-16 (2016).
- Tanksley, J. Jr, Tanksley, J. Pierre menetrier and his disease. Trans Am Clin Climatol Assoc. 123, discussion 133-124 126-133 (2012).
- Rich, A., et al. Distinguishing menetrier's disease from its mimics. Gut. 59 (12), 1617-1624 (2010).
- Takagi, H., Jhappan, C., Sharp, R., Merlino, G. Hypertrophic gastropathy resembling menetrier's disease in transgenic mice overexpressing transforming growth factor alpha in the stomach. J Clin Invest. 90 (3), 1161-1167 (1992).
- Dempsey, P. J., et al. Possible role of transforming growth factor alpha in the pathogenesis of menetrier's disease: Supportive evidence form humans and transgenic mice. Gastroenterology. 103 (6), 1950-1963 (1992).
- Fiske, W. H., et al. Efficacy of cetuximab in the treatment of menetrier's disease. Sci Transl Med. 1 (8), 8ra18(2009).
- Burdick, J. S., et al. Treatment of menetrier's disease with a monoclonal antibody against the epidermal growth factor receptor. N Engl J Med. 343 (23), 1697-1701 (2000).
- Goldenring, J. R., et al. Overexpression of transforming growth factor-alpha alters differentiation of gastric cell lineages. Dig Dis Sci. 41 (4), 773-784 (1996).
- Sharp, R., et al. Transforming growth factor alpha disrupts the normal program of cellular differentiation in the gastric mucosa of transgenic mice. Development. 121 (1), 149-161 (1995).
- Bockman, D. E., Sharp, R., Merlino, G. Regulation of terminal differentiation of zymogenic cells by transforming growth factor alpha in transgenic mice. Gastroenterology. 108 (2), 447-454 (1995).
- Nomura, S., et al. Evidence for repatterning of the gastric fundic epithelium associated with menetrier's disease and tgfalpha overexpression. Gastroenterology. 128 (5), 1292-1305 (2005).
- Shi, G., et al. Loss of the acinar-restricted transcription factor mist1 accelerates kras-induced pancreatic intraepithelial neoplasia. Gastroenterology. 136 (4), 1368-1378 (2009).
- Kistner, A., et al. Doxycycline-mediated quantitative and tissue-specific control of gene expression in transgenic mice. Proc Natl Acad Sci U S A. 93 (20), 10933-10938 (1996).
- Hardie, W. D., et al. Conditional expression of transforming growth factor-alpha in adult mouse lung causes pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 286 (4), L741-L749 (2004).
- Keeley, T. M., Horita, N., Samuelson, L. C. Tamoxifen-induced gastric injury: Effects of dose and method of administration. Cell Mol Gastroenterol Hepatol. 8 (3), 365-367 (2019).
- Huh, W. J., et al. Tamoxifen induces rapid, reversible atrophy, and metaplasia in mouse stomach. Gastroenterology. 142 (1), 21-24.e7 (2012).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods Enzymol. 533, 225-233 (2013).
- Ramsey, V. G., et al. The maturation of mucus-secreting gastric epithelial progenitors into digestive-enzyme secreting zymogenic cells requires mist1. Development. 134 (1), 211-222 (2007).
- Huh, W. J., et al. Xbp1 controls maturation of gastric zymogenic cells by induction of mist1 and expansion of the rough endoplasmic reticulum. Gastroenterology. 139 (6), 2038-2049 (2010).
- Engevik, A. C., et al. The development of spasmolytic polypeptide/tff2-expressing metaplasia (spem) during gastric repair is absent in the aged stomach. Cell Mol Gastroenterol Hepatol. 2 (5), 605-624 (2016).
- Wada, T., et al. Functional role of cd44v-xct system in the development of spasmolytic polypeptide-expressing metaplasia. Cancer Sci. 104 (10), 1323-1329 (2013).
- Halldorsdottir, A. M., et al. Spasmolytic polypeptide-expressing metaplasia (spem) associated with gastric cancer in iceland. Dig Dis Sci. 48 (3), 431-441 (2003).
- Yamaguchi, H., Goldenring, J. R., Kaminishi, M., Lee, J. R. Identification of spasmolytic polypeptide expressing metaplasia (spem) in remnant gastric cancer and surveillance postgastrectomy biopsies. Dig Dis Sci. 47 (3), 573-578 (2002).
- Hayakawa, Y., et al. Mist1 expressing gastric stem cells maintain the normal and neoplastic gastric epithelium and are supported by a perivascular stem cell niche. Cancer Cell. 28 (6), 800-814 (2015).
- Saenz, J. B., Vargas, N., Cho, C. J., Mills, J. C. Regulation of the double-stranded rna response through adar1 licenses metaplastic reprogramming in gastric epithelium. JCI Insight. 7 (3), e153511(2022).
- Caldwell, B., Meyer, A. R., Weis, J. A., Engevik, A. C., Choi, E. Chief cell plasticity is the origin of metaplasia following acute injury in the stomach mucosa. Gut. 71 (6), 1068-1077 (2022).
- Hata, M., et al. Gpr30-expressing gastric chief cells do not dedifferentiate but are eliminated via pdk-dependent cell competition during development of metaplasia. Gastroenterology. 158 (6), 1650-1666.e15 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon