Research Article
Ménétrier 病小鼠模型的开发
摘要
目前的研究表明,MT-TGFα 小鼠在胃中表现出痉挛性表达多肽的化生 (SPEM)。启动子的泄漏阻止了主要细胞谱系可追溯到 SPEM 的证明。因此,我们还开发了多西环素诱导小鼠模型 (Doxi-TGFα) 并证实 SPEM 来源于主细胞。
摘要
梅内特里尔病 (MD) 是一种罕见的获得性癌前胃病,其特征是巨大的皱褶、酸分泌减少和蛋白质丢失。MD 患者在胃中表现出 EGF 受体 (EGFR) 配体的表达增加,转化生长因子-α (TGFα)。EGFR 中和抗体西妥昔单抗可导致快速的临床改善和组织学缓解。除了这些发现之外,病因和潜在的分子机制尚不清楚。金属硫蛋白 (MT)-TGFα 转基因小鼠系是第一个概括 MD 组织病理学特征的 MD 小鼠模型,包括小凹增生和壁细胞丢失。在该小鼠模型中,TGFα 由重金属诱导型 MT 增强子/启动子驱动。先前的研究使用饮用水中的硫酸锌 (ZnSO4) 或腹膜内注射硫酸镉 (CdSO4) 来诱导 TGFα。然而,我们发现 MT-TGFα 小鼠在没有重金属处理的情况下产生表型,表明启动子泄漏。我们还发现,TGFα 的过表达抑制了 Mist1 表达,Mist1 表达是一种对主要细胞分化很重要的转录因子,从而阻碍了使用 Mist1-CreERT2 小鼠系在主要细胞中的遗传作。为了克服这个问题,我们开发了一种诱导小鼠模型 (Doxi-TGFα),其中 TGFα 由多西环素处理诱导 (CMV-rtTA;TetO-TGFα)。尽管 Doxi-TGFα 小鼠模型比 MT-TGFα 模型发展出更温和的表型,但它概括了 MD 的特征,包括小凹增生和壁细胞丢失。使用 Doxi-TGFα 小鼠模型,我们发现在 MD 中诱导痉挛性多肽表达化生 (SPEM),并且 SPEM 是使用 Mist1-CreERT2 小鼠系通过谱系追踪来源于主细胞。MT-TGFα 和 Doxi-TGFα 小鼠模型均提供 MD 的 体内 模型,可用于研究 MD 发病机制的分子机制和疾病的治疗方案。Doxi-TGFα 小鼠也将是研究 TGFα 在其他组织中过表达影响的有用模型。
引言
梅内特里尔病 (MD),也称为蛋白质丢失性肥厚性胃病,是一种罕见的胃癌前病变。MD 患者的胃表现出巨大的小凹增生,导致胃粘液分泌增加,壁细胞数量减少,导致胃酸分泌减少。此外,蛋白质选择性地通过胃粘膜丢失,导致低白蛋白血症和外周水肿 1,2,3。MD 的发病机制尚不清楚,直到据报道在金属硫蛋白 (MT) 基因增强子/启动子的控制下过表达 TGFα 的转基因小鼠概括了胃中 MD 的表型 4,5。MD 患者的胃也显示 EGF 受体 (EGFR) 配体 TGFα 的表达增加。据报道,西妥昔单抗是一种抗 EGFR 抗体,是治疗 MD 的第一种有效药物治疗,它证实了 TGFα 过表达激活 EGFR 有助于 MD 的发病机制 6,7。
从那时起,MT-TGFα 小鼠系一直被用作 MD 的小鼠模型。由于 TGFα 表达受重金属反应基因、金属硫蛋白增强子/启动子、饮用水中的硫酸锌 (ZnSO4) 或腹膜内注射硫酸镉 (CdSO4) 的调节,因此已用于诱导 TGFα 表达 5,8。MT-TGFα 小鼠模型已针对 MD 的表型进行了进一步表征。使用这种小鼠模型,已经表明 TGFα 诱导分泌粘蛋白的表面中心凹细胞分化,同时抑制分化为分泌酸的壁细胞和分泌胃蛋白酶原的主要细胞谱系 9,10。研究还表明,胃体/胃底粘膜变向胃酸酯化,并且三叶草因子 2 (TFF2) 阳性细胞存在于胃腺底部,表明溶痉挛性多肽表达化生 (SPEM) 发生在 MD 8,11 中。
在目前的研究中,我们显示 MT-TGFα 小鼠在没有重金属处理的情况下发展出 MD 的特征。这些表型包括 Mist1 表达缺失,Mist1 表达是一种对主要细胞分化至关重要的转录因子,在 SPEM 中丢失。由于 Mist1 的缺失,Mist1-CreERT212 小鼠系不能与 MT-TGFα 小鼠系一起用于检查谱系示踪 MD 中的 SPEM 是否来自主细胞。为了克服 MT-TGFα 小鼠模型的泄漏,我们开发了一种新的 MD 小鼠模型 (CMV-rtTA13;TetO-TGFα14),其中 TGFα 由多西环素处理 (Doxi-TGFα) 诱导。我们确认该小鼠模型也显示出 MD 的特征。使用 Doxi-TGFα 小鼠模型,我们通过使用 Mist1-CreERT2 小鼠系的谱系追踪表明 SPEM 来自主细胞。我们在目前的研究中介绍了两种 MD 小鼠模型。两种模型都可用于研究发病机制和寻找潜在的治疗靶点。当需要精确控制 MD 表型的起始或需要使用 Mist1-CreERT2 小鼠系对主细胞进行基因修饰时,新的 Doxi-TGFα 小鼠将特别有价值。
研究方案
所有畜牧业和程序均已获得耶鲁大学机构动物护理和使用委员会的批准,并符合美国政府关于研究、教学和测试中使用的动物的利用和护理原则。
1. 小鼠实验
- 小鼠治疗
- 在饮用水中用 25 mM ZnSO 4 处理 MT-TGFα 小鼠(2-4 个月大的雄性和雌性)2 周以诱导 TGFα 过表达。
- 治疗 CMV-rtTA /+;TetO-TGFα/+ (Doxi-TGFα) 小鼠(2-4 个月大的雄性和雌性)在饮用水中加入 2 mg/mL 多西环素 2 周以诱导 TGFα 过表达。
- 添加 1 个 Mist1-CreERT2/+;R26-LSL-mTmG/+ 雄性或雌性小鼠,并在繁殖笼中加入一只异性 Doxi-TGFα 小鼠,用于 MD 小鼠模型中主要细胞的谱系追踪。
- 注射 Mist1-CreERT2/+;R26-LSL-mTmG/+;CMV-rtTA/+;TetO-TGFα/+ 小鼠(2-4 个月大的雄性和雌性)腹膜内使用他莫昔芬 (37.5 mg/kg)。连续注射 7 天,在腹部左右下腹交替,避免撞击内脏。通过多西环素处理 (2 mg/mL) 在饮用水中诱导 TGFα 表达 2 周。
注:检查胃中是否有他莫昔芬诱导的损伤15,16,如此处通过计数有和没有他莫昔芬治疗的野生型小鼠的壁细胞来完成(补充图 1)。
- 胃组织固定术
- TGFα 过表达 2 周后,通过异氟醚过量对小鼠实施安乐死。在化学通风橱中使用干燥罐,将小鼠放在防止直接接触液体麻醉剂的多孔平台上。合上盖子并监测小鼠,直到它们缺乏呼吸超过 60 秒,然后颈椎脱位。
- 通过在胃食管交界处切开胃,切开附着在胃上的 5 毫米十二指肠的十二指肠,并使用剪刀和镊子去除胃周围的所有腹膜韧带来解剖胃(图 1A)。
- 使用 10 mL 注射器滴注磷酸盐缓冲盐水 (PBS),移液器吸头连接到十二指肠侧。用手指挤压它以去除管腔内容物。重复 3 次(图 1B)。
- 使用另一个装有移液器吸头的 2 mL 10 mL 注射器用 10% 福尔马林给胃充气。用镊子在胃十二指肠交界处紧紧夹住 5-10 秒,同时从胃中取出尖端(图 1C)。
- 将膨胀的胃浸入 10% 福尔马林中,在 4 °C 下摇动过夜(图 1D)。
注意: 使用福尔马林等有毒物质时,请使用适当的防护设备。
- 准备用于石蜡包埋的胃
- 使用剃须刀片切掉十二指肠和前胃(图 1E)。用 PBS 冲洗胃组织 5 分钟,摇动 3 次。
- 用剃须刀片将胃切成 3-4 个相同厚度(3-5 毫米)的环。将胃环嵌入 2% 琼脂糖中以保持方向。通过将较小的曲率侧定位在同一方向上,从近端到远端依次放置胃环(图 1F)。
- 将包埋在琼脂糖中的胃环放入组织盒中(图 1G),并将样品提交给组织学核心设施进行石蜡包埋17。
2. 免疫荧光染色
- 玻片制备
- 在干燥的烘箱或设置为 60 °C 的加热块上加热带有石蜡切片的载玻片至少 1 小时至过夜。冷却至室温,然后放入载玻片架中。
- 脱蜡、再水和抗原修复
- 标记两个载玻片罐 A 和 B,并在每个载玻片罐中填充足够的 Trilogy 溶液以完全浸没组织。
- 将载玻片架放入罐子 A 中,然后将两个罐子放入高压锅中。将压力锅置于高压 15 分钟。在打开和取回载玻片之前,让压力锅冷却。
- 立即将载玻片架从罐 A 放入罐 B 中 2 分钟,以确保从载玻片上去除石蜡。从罐 B 中取出载玻片,并将其放入去离子 (DI) 水中。
注意:Jar A 可以装满一次使用的 Trilogy。New Trilogy 应始终在 Jar B 中使用。 - 将载玻片放入 Tris 缓冲盐水 (TBS) 中 5 分钟,然后继续封闭。
- 阻断非特异性背景染色
- 从载玻片架上取下载玻片,然后侧向敲击它们以去除多余的 TBS。
- 使用疏水记号笔在组织周围画一个框。涂抹封闭缓冲液以完全覆盖组织,并在室温下在加湿室中孵育 30-60 分钟。
- 与一抗孵育
- 选择在不同宿主物种中产生的靶蛋白的一抗,并根据制造商的建议在抗体稀释剂中稀释。在本研究中,使用了以下抗体:H+/K+-ATP 酶、GIF、Mist1 18,19 和 CD44v920,21。有关一抗的详细信息,请参阅材料表。
- 去除封闭缓冲液,应用稀释的抗体,然后将玻片放回加湿室中。在 4 °C 下孵育过夜。
- 去除一抗,每次洗涤在 TBS 中洗涤玻片 3 次,每次洗涤 5 分钟。
- 二抗和凝集素
- 根据一抗的宿主物种选择二抗。凝集素可以与二抗混合并同时应用。
- 根据制造商在抗体稀释剂中的建议稀释二抗和凝集素。本研究中使用的二抗和凝集素的详细信息可在 材料表中找到。
- 应用二抗、凝集素和 DAPI (1 μg/mL),并将载玻片放回加湿室中。在室温下避光孵育 1 小时。
- 从加湿室中取出载玻片,每次洗涤用 TBS 冲洗 3 次,每次洗涤 5 分钟。
- 封片和显微镜准备
- 从 TBS 中取出载玻片,然后用纸巾侧向敲击载玻片以去除多余的液体。
- 添加 15-20 μL 封固剂。握住干净的盖玻片的边缘,将一个边缘放在组织对面,中间放有封固剂。
- 慢慢降低盖玻片,使培养基均匀地分布在组织上,小心避免捕获气泡。
- 使用任务擦拭剂吸收边缘周围过多的封固剂。在进行显微镜检查之前,在室温下在黑暗中干燥完成的载玻片。对其余幻灯片重复此过程。
结果
成年野生型 (WT) 和 MT-TGFα 小鼠在处死前在饮用水中接受硫酸锌 (25 mM ZnSO4) 2 周。WT 小鼠的胃看起来正常、肉眼和组织学。与此形成鲜明对比的是,MT-TGFα 的胃明显增厚(图 2A)。在显微镜下,这些胃显示巨大的中心凹增生,顶细胞和主细胞均丢失(图 2B-D),概括了梅内特里尔病 (MD) 的组织学特征。主细胞丢失可以以两种不同的方式发生:主细胞死亡或主细胞引起的痉挛性表达多肽的化生 (SPEM)。为了区分这两种可能性,我们通过杂交 Mist1-CreERT2 对主要细胞进行了谱系追踪;R26-LSL-mTmG 小鼠与 MT-TGFα 小鼠。这些小鼠首先用低剂量他莫昔芬 (37.5 mg/kg,腹膜内注射,连续 7 天) 用 GFP 标记主细胞,然后在饮用水中用 ZnSO4 诱导 TGFα 过表达。我们在 MT-TGFα 小鼠中观察到罕见的 GFP 标记细胞(数据未显示)。此外,在存在或不存在 ZnSO4 的情况下,MT-TGFα 小鼠没有大体和组织学差异(图 3A-C)。这一发现的一种可能解释是 TGFα 可能降低了 Mist1 的表达,Mist1 是主要细胞18 的重要转录因子,并破坏了 Mist1-CreERT2 等位基因的有用性。事实上,在未经 ZnSO4 处理的 MT-TGFα 小鼠中,Mist1 的免疫组织化学染色丢失(图 3D)。
为了克服 MT-TGFα 小鼠模型的泄漏,我们转向多西环素诱导的 Doxi-TGFa 转基因模型。这是通过将 TetO-TGFα 小鼠14 与 CMV-rtTA 小鼠系13 杂交来实现的;以前已经报道过 rtTA 在胃中表达。我们证实,在这种新的 MD 小鼠模型中,多西环素治疗 2 周会诱导中心凹增生并减少壁细胞和主细胞的数量(图 4A-C)。与 MT-TGFα 小鼠的组织形态学特征相比,Doxi-TGFα 小鼠表现出不太严重的粘膜厚度和小凹增生,以及壁细胞减少较少(补充图 2)。尽管如此,我们能够使用 Mist1-CreERT2 小鼠系追踪主要细胞,并证实主要细胞系也用 GSII 和 CD44v9 20,21 标记,证实 TGFα 过表达诱导来自主要细胞的 SPEM(图 4D)。
目前的研究表明,MT-TGFα 小鼠模型在没有重金属处理的情况下表型复制了 MD 的组织病理学特征,这可能是由于启动子/增强子的内在泄漏和/或无法避免重金属暴露(图 3 和 补充图 2)。由于 TGFα 抑制 Mist1 表达,因此 Mist1-CreERT2 小鼠系不能用于 MT-TGFα 小鼠模型。我们生成了一种新的 MD 小鼠模型,其中多西环素处理可以诱导 TGFα 表达。使用这种新的 Doxi-TGFα MD 小鼠模型,我们能够确认 TGFα 过表达诱导来自主细胞的 SPEM。当需要精确控制 TGFα 表达时,以及当需要使用 Mist1-CreERT2 小鼠系对主细胞进行遗传改变时,Doxi-TGFα MD 小鼠模型将非常有用。
数据可用性:
所有原始数据都作为补充文件提供。
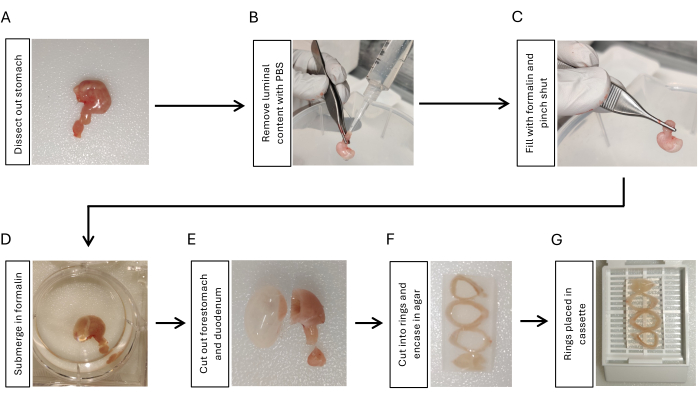
图 1:胃组织包埋的固定和准备工作流程。 (A) 解剖胃以及十二指肠的一小段 (3-5 mm)。(B) 使用带有移液管尖端的注射器从十二指肠滴入 PBS,并用手指挤压 3 次,以去除管腔内容物。(C) 使用注射器用十二指肠中的福尔马林给胃充气,并捏住胃十二指肠交界处以保留福尔马林。(D) 将胃浸入福尔马林中,并在 4 °C 下振荡固定过夜。(E) 用剃须刀片去除前胃和十二指肠,并用 PBS 冲洗。(F) 将胃体和胃窦以横截面方式切成 3-4 个环,并将它们嵌入 2% 琼脂糖中,以保持胃组织环的方向。(G) 将琼脂糖包埋的组织放入盒中。 请单击此处查看此图的较大版本。
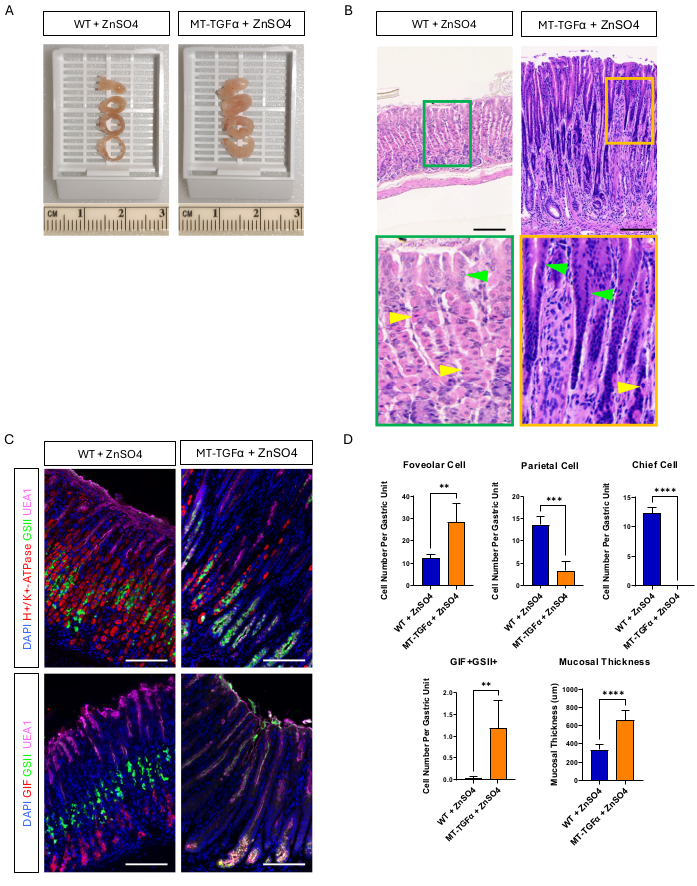
图 2:用重金属 ZnSO4 处理的 MT-TGFα 小鼠的大体和微观表型。 (A) 与对照小鼠(左)相比,MT-TGFα 小鼠(右)的胃壁更厚。(B) MT-TGFα 小鼠的胃(右)显示大面积的小凹增生和壁细胞丢失。黄色箭头表示顶细胞,绿色箭头表示小凹细胞。(C) 免疫荧光染色证实,与对照小鼠胃(左图)相比,MT-TGFα 小鼠胃(右)显示小凹细胞(UEA1 阳性)和 SPEM 细胞(GIF 和 GSII 双阳性)数量增加,壁细胞(H+/K+-ATP 酶阳性)和主要细胞(GIF 单阳性)数量减少。比例尺代表 100 μm。(D) 用 ZnSO4 (n = 5) 处理的野生型 (WT) 小鼠和用 ZnSO4 处理的 MT-TGFα 小鼠 (n = 3) 中不同上皮细胞类型和粘膜厚度的定量。误差线表示标准偏差(**p < 0.01,***p < 0.001,****p < 0.0001)。 请单击此处查看此图的较大版本。
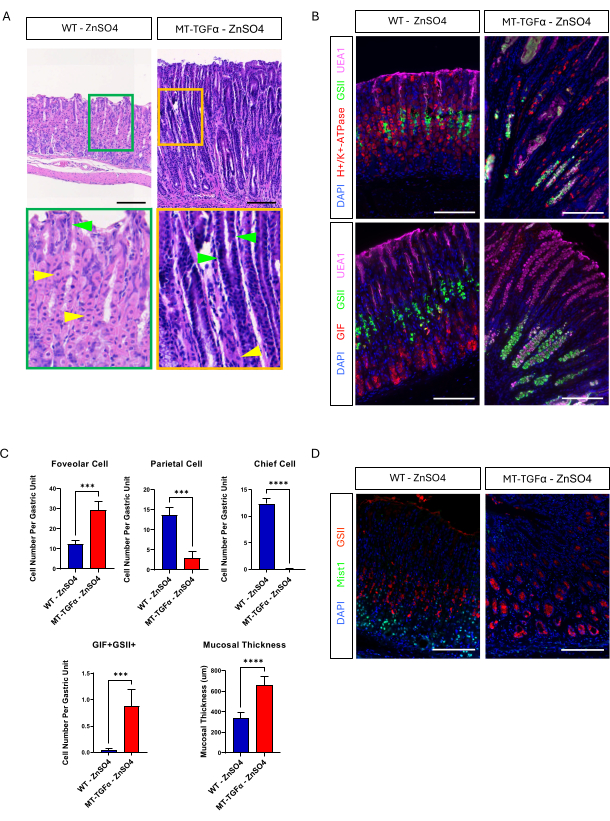
图 3:MT-TGFα 小鼠在未经重金属处理的情况下产生胃表型。 (A) MT-TGFα 小鼠的胃(右)在未进行重金属处理的情况下显示大面积小凹增生和壁细胞丢失。黄色箭头表示顶细胞,绿色箭头表示小凹细胞。(B) 免疫荧光染色证实,与对照小鼠胃(左)相比,未经重金属处理的 MT-TGFα 小鼠胃(右)显示小凹细胞(UEA1 阳性)和 SPEM 细胞(GIF 和 GSII 双阳性)数量增加,壁细胞(H+/K+-ATP 酶阳性)和主细胞(GIF 单阳性)数量减少。比例尺代表 100 μm。(C) 无 ZnSO4 (n = 5) 和 MT-TGFα 小鼠 ZnSO4 (n = 3) 中不同上皮细胞类型和粘膜厚度的定量。误差线表示标准差 (***p < 0.001, ****p < 0.0001)。(D) MT-TGFα 小鼠的胃(右)显示 Mist1 表达缺失,通常在主细胞中表达(左)。GSII 是粘液颈细胞的标志物。比例尺代表 100 μm。 请单击此处查看此图的较大版本。
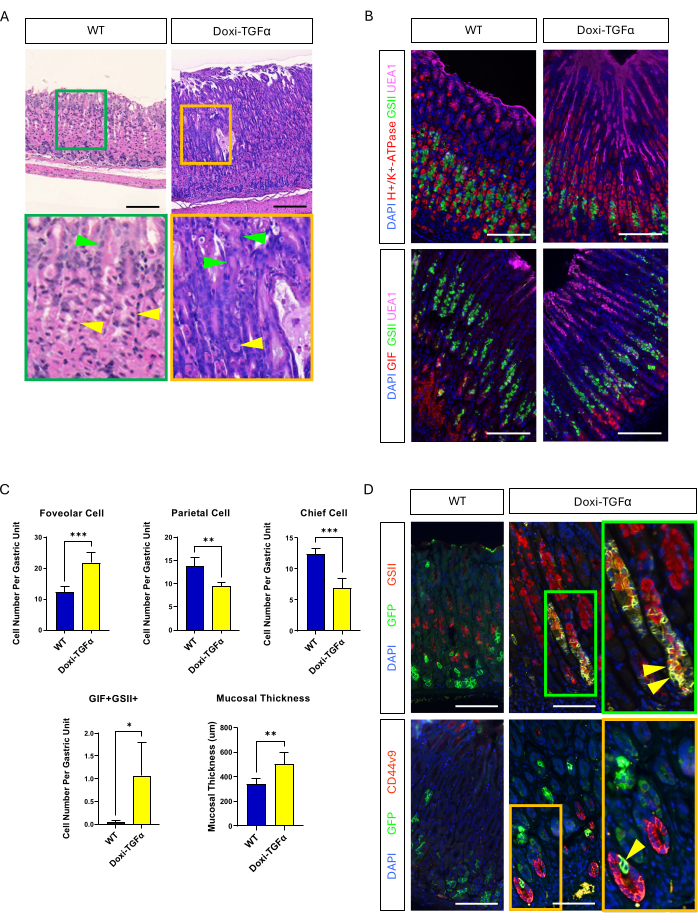
图 4:多西环素诱导型 TGFα 小鼠模型 (Doxi-TGFα) 概括了梅内特里尔病表型,在该小鼠模型中证实了 SPEM 的形成。 (A) 来自 CMV-rtTA 的胃;TetO-TGFα 小鼠 (Doxi-TGFα;右) 显示大面积中心凹增生和壁细胞数量减少。黄色箭头表示顶细胞,绿色箭头表示小凹细胞。(B) 免疫荧光染色证实,与对照小鼠胃(左)相比,Doxi-TGFα 小鼠胃(右)显示小凹细胞(UEA1 阳性)和 SPEM 细胞(GIF 和 GSII 双阳性)数量增加,壁细胞(H+/K+-ATP 酶阳性)和主细胞(GIF 单阳性)数量减少(左)。比例尺代表 100 μm。(C) WT 小鼠 (n = 5) 和 Doxi-TGFα 小鼠 (n = 5) 中不同上皮细胞类型和粘膜厚度的定量。误差线表示标准偏差(*p < 0.05,**p < 0.01,***p < 0.001)。(D) 使用 Mist1-CreERT2 对主要细胞 (GFP 阳性) 进行谱系追踪;R26-LSL-mTmG 小鼠细胞系显示 Doxi-TGFα 小鼠胃中的 GFP 阳性细胞对 GSII 和 CD44v9 也呈阳性,证实 SPEM 形成来源于主细胞,而对照胃(左)显示几乎没有 GFP 阳性细胞对 GSII 或 CD44v9 也呈阳性。比例尺代表 100 μm。 请点击此处查看此图的较大版本。
补充图 1:低剂量他莫昔芬 (TMX) 治疗不会诱发胃粘膜损伤。 连续 7 天的低剂量 TMX 治疗 (37.5 mg/kg) 不会诱导胃粘膜损伤,例如壁细胞数量的维持。(A) 未经 TMX 处理(左图)和经过 TMX 处理(右图)的代表性 H&E 图像。比例尺代表 100 μm。(B) WT 小鼠 (n = 5) 和 TMX 处理 (n = 5) 的 WT 中每个胃单位的壁细胞数的定量。 请点击此处下载此文件。
补充图 2:不同梅内特里氏病 (MD) 小鼠模型之间的表型比较。 (A) ZnSO4 处理的 MT-TGFα、未 ZnSO4 处理的 MT-TGFα 和 Doxi-TGFα MD 小鼠模型显示小凹增生、壁细胞和主细胞丢失、痉挛性表达多肽的化生 (SPEM) 细胞增加(GIF 和 GSII 共定位细胞)和粘膜增厚。有和没有 ZnSO4 处理组的 MT-TGFα 之间没有表型差异。Doxi-TGFα 小鼠模型显示比 MT-TGFα 小鼠模型更严重的表型。 请点击此处下载此文件。
讨论
梅内特里尔病 (MD) 是一种罕见的癌前病变胃病,由 TGFα 过表达引起 1,2,3。在金属硫蛋白基因增强子/启动子 (MT-TGFα) 的控制下过表达 TGFα 的转基因小鼠是迄今为止唯一的 MD 小鼠模型 4,5。由于金属硫蛋白基因对重金属敏感,因此在饮用水中加入硫酸锌,或注射硫酸镉以诱导该小鼠模型中的 TGFα 5,8。MD 的特征表型之一是胃腺基部的主要细胞被粘液细胞取代,这些粘液细胞对粘液颈细胞和胃窦粘蛋白细胞中存在的标志物呈阳性。这可能是由于主细胞死亡或主细胞重编程为痉挛性多肽表达化生 (SPEM) 而发生的8,11。这可以通过 MD 小鼠模型中主要细胞的谱系追踪来测试。我们尝试使用 Mist1-CreERT2 谱系追踪主要细胞;R26-LSL-mTmG 小鼠,其中 Mist1 阳性主细胞用膜靶向 GFP 标记。然而,我们在 MT-TGFα 小鼠中仅观察到有限数量的 GFP 标记细胞。这表明大多数 GFP 标记的宿主细胞由于 TGFα 过表达而死亡,或者宿主细胞中 GFP 标记的效率太低。由于据报道 TGFα 过表达8 没有增加细胞死亡,因此我们通过评估未进行重金属处理的 MT-TGFα 小鼠来检测 Mist1 表达丢失的可能性。我们对未经重金属治疗的 MT-TGFα 小鼠的完整表型感到惊讶,包括小凹增生和壁细胞和主细胞丢失。我们还证实,即使没有重金属处理,MT-TGFα 小鼠的 Mist1 表达也会丢失。先前已经报道,由于无法消除重金属暴露,TGFα 表达在 MT-TGFα 小鼠中没有得到严格控制;然而,重金属处理后 TGFα 表达显著增加8。以前未在未进行重金属处理的 MT-TGFα 小鼠中进行过全面的表型评估。目前的研究表明,MT-TGFα 小鼠在没有重金属处理的情况下会出现完整的表型表现。
由于 MT-TGFα 小鼠的 Mist1 表达甚至在重金属处理之前就已经丢失,因此仍然需要另一种小鼠模型,其中 TGFα 表达受到特异性控制,因此表型不会在不诱导 TGFα 过表达的情况下发展。我们生成了一种新的 MD 小鼠模型,其中 TGFα 表达由多西环素处理 (Doxi-TGFα) 诱导。我们证实这种小鼠模型诱导小凹增生和壁细胞和主细胞丢失,这是 MD 的主要表型。我们能够使用 Mist1-CreERT2 谱系追踪主要细胞;R26-LSL-mTmG 小鼠在该小鼠模型中发现一些 GFP 标记的细胞也用 GSII 和 CD44v9 标记,证实了 SPEM 发生在这种新型 MD 小鼠模型中。这是第一份证实 SPEM 在 TGFα 过表达的胃中发生的报告。SPEM 是一种更常见的胃癌前病变,这可能是 MD 患者胃癌增加的原因22,23。
使用 Mist1-CreERT2 小鼠细胞系的一个警告是,据报道 Mist1 也可以在胃干细胞中表达24。我们发现低剂量 (37.5 mg/kg) 他莫昔芬治疗诱导 Cre 激活,更具体地说是在主细胞中,即使在多西环素治疗前的早期时间点,峡部区域的激活也最小。类似的发现之前已经报道过25.使用 Mist1-CreERT2 进行谱系追踪;R26-LSL-mTmG 小鼠在 GFP 附近显示 GFP 阳性细胞,SPEM 标志物(GSII 和 CD44v9)双阳性细胞主要位于主要细胞所在的基底(图 4C)。如果从干细胞中追踪到 GFP 和 SPEM 标志物双阳性细胞,则应该有更多的 GFP 阳性细胞朝向干细胞所在的峡部。或者,多西环素诱导的 GIF-rtTA 小鼠系26 或 GPR30-rtTA 小鼠系27 可与 MT-TGFα 小鼠一起用于主细胞的遗传修饰或谱系追踪。然而,在没有 ZnSO 4 处理的 MT-TGFα 小鼠中,GIF 阳性细胞减少(图 3B,C),而 GPR30 阳性细胞在 SPEM 中丢失,这发生在没有 ZnSO4 处理的 MT-TGFα 小鼠中。因此,与与 Mist1-CreERT2 小鼠系杂交的 Doxi-TGFα 小鼠相比,它们的效率较低。
目前的研究表明,MT-TGFα 小鼠在没有重金属处理的情况下在胃中发生完全的表型变化。我们还表明,其中一种表型是 Mist1 表达的缺失,这排除了 Mist1-CreERT2 的使用;R26-LSL-mTmG 小鼠系到谱系追踪主要细胞。我们生成了一种新的 MD 小鼠模型 Doxi-TGFα,并首次证实了使用该小鼠模型在 MD 中发育。当需要精确控制 MD 表型的发育以及需要使用 Mist1-CreERT2 小鼠系对主细胞进行基因修饰时,这种新型 MD 小鼠模型将非常有用。MD 表型由 TGFα 过表达的 EGFR 信号激活诱导。然而,尚不清楚 EGFR 激活,其中细胞类型是导致观察到的表型的原因。使用 Doxi-TGFα 小鼠模型,我们目前正在研究 EGFR 信号转导在不同细胞类型中的作用,包括利用 Mist1-CreERT2 小鼠系的主要细胞。
披露声明
所有作者都没有需要披露的利益冲突。
致谢
这项工作得到了美国国家糖尿病、消化和肾脏疾病研究所 (K08 DK124686 WJH) 的支持。我们感谢 Gina Della Porta 和 Sarah E. Glass 编辑手稿。
作者贡献:
TTG 进行实验、生成图表、撰写手稿并编辑手稿。JDP 进行实验、生成图表、撰写手稿并编辑手稿。SKM 提供了 TetO-TGFα 小鼠系并编辑了手稿。RJC 构思实验并编辑了手稿。WJH 构思实验、进行实验、解释数据、搜索文献、撰写手稿和编辑手稿。
材料
| Name | Company | Catalog Number | Comments |
| Mouse anti H+/K+-ATPase antibody | A gift from Dr. Eunyoung Choi | N/A | Dilution: 1:10000 |
| Antibody Diluent | Abcam | 559148 | |
| Anti-rabbit GFP | Life Technologies Corporation | A11122 | Dilution: 1:500 |
| Charged Glass Slides | Fisher | 22-178-277 | |
| Cover Slips | Globe Scientific | 1411-10 | |
| Donkey anti-mouse 594 | Invitrogen | A12102 | Dilution: 1:500 |
| Donkey anti-rabbit 488 | Invitrogen | A21206 | Dilution: 1:500 |
| Donkey anti-rabbit 594 | Invitrogen | A21207 | Dilution: 1:500 |
| Donkey anti-rat 594 | Invitrogen | A21209 | Dilution: 1:500 |
| Doxyclycine Hyclate | TCI | D4116 | |
| Flouromount-G | Thermo fischer | 00-4958-02 | |
| GSII 488 | Invitrogen | L21415 | Dilution: 1:500 |
| Hydrophobic Marker | Electron Microscopy Sciences | 71312 | |
| Incubator | Labnet | I 5110 | |
| MIST1/bHLHa15 (D7N4B) XP Rabbit mAb | Cell Signaling | 14896S | Dilution: 1:200 |
| Pressure Cooker (6QT) | Cuisinart | CPC-600N1 | |
| Protein Block | Abcam | AB64226 | |
| Rabbit anti-GIF antibody | MyBioSource | MBS2028736 | Dilution: 1:200 |
| Rat anti CD44v9 mAb | Cosmo Bio | LKG-M002 | Dilution: 1:20000 |
| Slide Jars | Simport | M906-12AS | |
| Tamoxifen | Sigma-Aldrich | T5648 | |
| Trilogy | Sigma | 922P-10-RUO | |
| UEA1 Dylight 649 | Vector Laboratories | DL-1068 | Dilution: 1:500 |
参考文献
- Huh, W. J., Coffey, R. J., Washington, M. K. Menetrier's disease: Its mimickers and pathogenesis. J Pathol Transl Med. 50 (1), 10-16 (2016).
- Tanksley, J. Jr, Tanksley, J. Pierre menetrier and his disease. Trans Am Clin Climatol Assoc. 123, discussion 133-124 126-133 (2012).
- Rich, A., et al. Distinguishing menetrier's disease from its mimics. Gut. 59 (12), 1617-1624 (2010).
- Takagi, H., Jhappan, C., Sharp, R., Merlino, G. Hypertrophic gastropathy resembling menetrier's disease in transgenic mice overexpressing transforming growth factor alpha in the stomach. J Clin Invest. 90 (3), 1161-1167 (1992).
- Dempsey, P. J., et al. Possible role of transforming growth factor alpha in the pathogenesis of menetrier's disease: Supportive evidence form humans and transgenic mice. Gastroenterology. 103 (6), 1950-1963 (1992).
- Fiske, W. H., et al. Efficacy of cetuximab in the treatment of menetrier's disease. Sci Transl Med. 1 (8), 8ra18(2009).
- Burdick, J. S., et al. Treatment of menetrier's disease with a monoclonal antibody against the epidermal growth factor receptor. N Engl J Med. 343 (23), 1697-1701 (2000).
- Goldenring, J. R., et al. Overexpression of transforming growth factor-alpha alters differentiation of gastric cell lineages. Dig Dis Sci. 41 (4), 773-784 (1996).
- Sharp, R., et al. Transforming growth factor alpha disrupts the normal program of cellular differentiation in the gastric mucosa of transgenic mice. Development. 121 (1), 149-161 (1995).
- Bockman, D. E., Sharp, R., Merlino, G. Regulation of terminal differentiation of zymogenic cells by transforming growth factor alpha in transgenic mice. Gastroenterology. 108 (2), 447-454 (1995).
- Nomura, S., et al. Evidence for repatterning of the gastric fundic epithelium associated with menetrier's disease and tgfalpha overexpression. Gastroenterology. 128 (5), 1292-1305 (2005).
- Shi, G., et al. Loss of the acinar-restricted transcription factor mist1 accelerates kras-induced pancreatic intraepithelial neoplasia. Gastroenterology. 136 (4), 1368-1378 (2009).
- Kistner, A., et al. Doxycycline-mediated quantitative and tissue-specific control of gene expression in transgenic mice. Proc Natl Acad Sci U S A. 93 (20), 10933-10938 (1996).
- Hardie, W. D., et al. Conditional expression of transforming growth factor-alpha in adult mouse lung causes pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 286 (4), L741-L749 (2004).
- Keeley, T. M., Horita, N., Samuelson, L. C. Tamoxifen-induced gastric injury: Effects of dose and method of administration. Cell Mol Gastroenterol Hepatol. 8 (3), 365-367 (2019).
- Huh, W. J., et al. Tamoxifen induces rapid, reversible atrophy, and metaplasia in mouse stomach. Gastroenterology. 142 (1), 21-24.e7 (2012).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods Enzymol. 533, 225-233 (2013).
- Ramsey, V. G., et al. The maturation of mucus-secreting gastric epithelial progenitors into digestive-enzyme secreting zymogenic cells requires mist1. Development. 134 (1), 211-222 (2007).
- Huh, W. J., et al. Xbp1 controls maturation of gastric zymogenic cells by induction of mist1 and expansion of the rough endoplasmic reticulum. Gastroenterology. 139 (6), 2038-2049 (2010).
- Engevik, A. C., et al. The development of spasmolytic polypeptide/tff2-expressing metaplasia (spem) during gastric repair is absent in the aged stomach. Cell Mol Gastroenterol Hepatol. 2 (5), 605-624 (2016).
- Wada, T., et al. Functional role of cd44v-xct system in the development of spasmolytic polypeptide-expressing metaplasia. Cancer Sci. 104 (10), 1323-1329 (2013).
- Halldorsdottir, A. M., et al. Spasmolytic polypeptide-expressing metaplasia (spem) associated with gastric cancer in iceland. Dig Dis Sci. 48 (3), 431-441 (2003).
- Yamaguchi, H., Goldenring, J. R., Kaminishi, M., Lee, J. R. Identification of spasmolytic polypeptide expressing metaplasia (spem) in remnant gastric cancer and surveillance postgastrectomy biopsies. Dig Dis Sci. 47 (3), 573-578 (2002).
- Hayakawa, Y., et al. Mist1 expressing gastric stem cells maintain the normal and neoplastic gastric epithelium and are supported by a perivascular stem cell niche. Cancer Cell. 28 (6), 800-814 (2015).
- Saenz, J. B., Vargas, N., Cho, C. J., Mills, J. C. Regulation of the double-stranded rna response through adar1 licenses metaplastic reprogramming in gastric epithelium. JCI Insight. 7 (3), e153511(2022).
- Caldwell, B., Meyer, A. R., Weis, J. A., Engevik, A. C., Choi, E. Chief cell plasticity is the origin of metaplasia following acute injury in the stomach mucosa. Gut. 71 (6), 1068-1077 (2022).
- Hata, M., et al. Gpr30-expressing gastric chief cells do not dedifferentiate but are eliminated via pdk-dependent cell competition during development of metaplasia. Gastroenterology. 158 (6), 1650-1666.e15 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。