Research Article
메네트리에병에 대한 마우스 모델 개발
요약
이번 연구는 MT-TGFα 마우스가 위에서 경련성 폴리펩티드 발현 화생(SPEM)을 보인다는 것을 보여줍니다. promoter의 누출은 chief cell lineage가 SPEM으로 추적된다는 것을 입증하는 것을 방해했습니다. 이에 따라 독시사이클린 유도 마우스 모델(Doxi-TGFα)을 추가로 개발하여 SPEM이 주세포에서 유래함을 확인했습니다.
초록
메네트리에병(Ménétrier's disease, MD)은 희귀한 후천성 전악성 위질환으로, 거대한 주름, 위산 분비 감소, 단백질 손실을 특징으로 합니다. 다발라민성 경화증 환자는 EGF 수용체(EGFR) 리간드의 발현이 증가하여 위장에서 성장 인자 α(TGFα)을 변형시킵니다. EGFR 중화 항체인 세툭시맙(cetuximab)은 빠른 임상적 개선과 조직학적 관해를 가져옵니다. 이러한 발견 외에도 병인과 근본적인 분자 메커니즘은 잘 이해되지 않았습니다. 메탈로티오네인(MT)-TGFα 형질전환 마우스 라인은 치파포 증식 및 두정세포 소실을 포함한 MD의 조직병리학적 특징을 요약한 최초의 MD 마우스 모델입니다. 이 마우스 모델에서 TGFα는 중금속에 의해 유도되는 MT enhancer/promoter에 의해 구동됩니다. 이전 연구에서는 음용수에 황산아연(ZnSO4)을 사용하거나 황산카드뮴(CdSO4)을 복강내 주사하여 TGFα를 유도했습니다. 그러나 MT-TGFα 마우스는 중금속 처리 없이 표현형이 발생하는 것을 발견하여 프로모터의 누출을 나타냅니다. 또한 TGFα의 과발현은 주축 세포 분화에 중요한 전사 인자인 Mist1 발현을 억제하여 Mist1-CreERT2 마우스 라인을 사용하는 주세포의 유전자 조작을 방해한다는 것을 발견했습니다. 이를 극복하기 위해 독시사이클린 처리(CMV-rtTA; TetO-TGFα)입니다. Doxi-TGFα 마우스 모델은 MT-TGFα 모델보다 가벼운 표현형을 나타내지만, foveolar hyperplasia 및 parietal cell의 소실을 포함한 MD의 특징을 요약했습니다. Doxi-TGFα 마우스 모델을 사용하여 MD에서 경련성 폴리펩티드 발현 화생(SPEM)이 유도되고 SPEM이 Mist1-CreERT2 마우스 라인을 사용한 계통 추적을 통해 주세포에서 파생됨을 발견했습니다. MT-TGFα 및 Doxi-TGFα 마우스 모델은 모두 MD의 in vivo 모델을 제공하며 MD 발병의 기저에 있는 분자 메커니즘 및 질병에 대한 치료 옵션을 조사하는 데 유용합니다. Doxi-TGFα 마우스는 또한 다른 조직에서 TGFα의 과발현 효과를 연구하는 데 유용한 모델이 될 것입니다.
서문
단백질 소실 비후성 위병증(protein-loss hypertrophic gastropathy)으로도 알려진 메네트리에병(Ménétrier's disease, MD)은 희귀한 위 전악성 질환입니다. 다발성경 다발성 경화증 환자의 위에서는 대량의 치파포 증식증이 나타나 위 점액 분비가 증가하고, 두정세포 수가 감소하여 위산 분비가 감소합니다. 또한 단백질은 위 점막을 가로질러 선택적으로 손실되어 저알부민혈증과 말초 부종을 유발합니다 1,2,3. MD의 발병 기전은 메탈로티오네인(metallothionein, MT) 유전자 강화제/프로모터(gene enhancer/promoter)의 조절하에 TGFα를 과발현한 형질전환 마우스가 위에서 MD의 표현형을 재현했다는 보고가 있을 때까지 알려지지 않았습니다 4,5. MD 환자의 위는 또한 EGF 수용체(EGFR) 리간드인 TGFα의 발현이 증가한 것으로 나타났습니다. 항-EGFR 항체인 세툭시맙(Cetuximab)은 다발성 경화증에 대한 최초의 효과적인 치료법으로 보고되었으며, TGFα 과발현에 의한 EGFR 활성화가 MD 6,7의 발병에 기여하는 것을 확인했습니다.
이후 MT-TGFα 마우스 라인은 MD용 마우스 모델로 사용되어 왔습니다. TGFα 발현은 중금속 반응 유전자에 의해 조절되기 때문에 메탈로티오닌 인핸서/프로모터, 음용수 내 황산아연(ZnSO4) 또는 황산카드뮴(CdSO4)의 복강 내 주사를 사용하여 TGFα 발현을 유도했습니다 5,8. MT-TGFα 마우스 모델은 MD의 표현형에 대해 추가로 특성화되었습니다. 이 마우스 모델을 사용하여 TGFα는 산을 분비하는 두정엽 세포와 펩시노겐을 분비하는 주세포계로의 분화를 억제하는 동시에 점액 분비 표면 치파포 세포 분화를 유도하는 것으로 나타났습니다 9,10. 또한 위체/기저부 점막이 전방화되고 위샘 기저부에 트레포일 인자 2(TFF2) 양성 세포가 존재하는 것으로 나타났는데, 이는 MD 8,11에서 경련성 폴리펩티드 발현 화생(SPEM)이 발생함을 시사합니다.
본 연구에서는 MT-TGFα 마우스가 중금속 처리 없이 MD의 특징을 발달시키는 것을 보여주었다. 이러한 표현형에는 주축 세포 분화에 필수적이며 SPEM에서 손실되는 전사 인자인 Mist1 발현의 손실이 포함됩니다. Mist1의 손실로 인해 Mist1-CreERT212 마우스 라인은 계통 추적에 의해 MD의 SPEM이 주세포에서 발생하는지 검사하기 위해 MT-TGFα 마우스 라인과 함께 사용할 수 없었습니다. MT-TGFα 마우스 모델의 누수 현상을 극복하기 위해 새로운 MD 마우스 모델(CMV-rtTA13; TetO-TGFα14)에서 TGFα는 독시사이클린 처리(Doxi-TGFα)에 의해 유도됩니다. 이 마우스 모델에는 MD의 기능도 표시되는 것으로 확인되었습니다. Doxi-TGFα 마우스 모델을 사용하여 Mist1-CreERT2 마우스 계통을 사용한 계통 추적을 통해 SPEM이 주세포에서 발생한다는 것을 보여줍니다. 본 연구에서는 두 가지 MD 마우스 모델을 소개합니다. 두 모델 모두 발병 기전을 조사하고 잠재적인 치료 표적을 검색하는 데 사용할 수 있습니다. 새로운 Doxi-TGFα 마우스는 MD 표현형의 시작을 정밀하게 제어해야 하거나 Mist1-CreERT2 마우스 라인을 사용하여 주세포의 유전자 변형이 필요한 경우에 특히 유용합니다.
프로토콜
모든 축산 및 절차는 예일 대학교의 기관 동물 관리 및 사용 위원회의 승인을 받았으며 연구, 교육 및 테스트에 사용되는 동물의 활용 및 관리에 대한 미국 정부 원칙에 따라 승인되었습니다.
1. 마우스 실험
- 마우스 트리트먼트
- MT-TGFα 마우스(생후 2-4개월의 수컷 및 암컷 모두)를 2주 동안 음용수에 25mM ZnSO4로 처리하여 TGFα 과발현을 유도합니다.
- CMV-rtTA/+를 치료합니다. TetO-TGFα/+ (Doxi-TGFα) 마우스(생후 2-4개월 수컷 및 암컷 모두)를 2주 동안 음용수에 2mg/mL 독시사이클린을 투여하여 TGFα 과발현을 유도합니다.
- 하나의 Mist1-CreERT2/+를 추가합니다. R26-LSL-mTmG/+ 수컷 또는 암컷 마우스를 선택하고 MD 마우스 모델에서 주축 세포의 계통 추적을 위해 번식 케이지에 이성의 Doxi-TGFα 마우스 1마리를 추가합니다.
- Mist1-CreERT2/+를 주입하십시오. R26-LSL-mTmG/+; CMV-rtTA/+; TetO-TGFα/+ 생쥐(2-4개월령 수컷 및 암컷 모두)와 복강내 타목시펜(37.5mg/kg). 연속 7일 동안 복부의 오른쪽과 왼쪽 아래 사분면을 번갈아 가며 주입하고 내부 장기에 부딪히지 않도록 합니다. 2주간 음용수에서 독시사이클린 처리(2mg/mL)로 TGFα 발현을 유도합니다.
주: tamoxifen 처리의 유무에 관계없이 사나운 유형 쥐에 있는 정수리 세포를 세어서 여기에서 행해진 것과 같이 위15,16에 있는 tamoxifen 유도한 상해를 검사하십시오 (보충 숫자 1).
- 위 조직 고정
- TGFα 과발현 2주 후 이소플루란 과다 투여로 마우스를 안락사시킵니다. 화학 흄 후드에 있는 데시케이터 용기를 사용하여 액체 마취제와의 직접적인 접촉을 방지하는 구멍이 뚫린 플랫폼에 마우스를 놓습니다. 뚜껑을 닫고 60초 이상 호흡이 부족할 때까지 쥐를 모니터링한 다음 경추 탈구가 발생합니다.
- 위식도 접합부를 절개하고, 위에 부착된 5mm 십이지장으로 십이지장을 절단하고, 가위와 집게를 사용하여 위 주변의 모든 복막 인대를 제거하여 위를 절개합니다(그림 1A).
- 십이지장 쪽에 피펫 팁이 부착된 10mL 주사기를 사용하여 인산염 완충 식염수(PBS)를 주입합니다. 손가락으로 꽉 쥐면 발광 성분이 제거됩니다. 3번 반복합니다(그림 1B).
- 피펫 팁이 부착된 다른 10mL 주사기를 사용하여 10% 포르말린 2mL로 위를 팽창시킵니다. 위에서 팁을 제거하면서 5-10초 동안 위십이지장 접합부에서 집게로 단단히 고정합니다(그림 1C).
- 부풀어 오른 위를 10% 포르말린에 담그고 4°C에서 하룻밤 동안 흔들어 줍니다(그림 1D).
주의: 포르말린과 같은 독성 물질로 작업할 때는 적절한 보호 장비를 사용하십시오.
- 파라핀 포매를 위한 위 준비
- 면도날을 사용하여 십이지장과 포레스토마흐를 잘라냅니다(그림 1E). PBS로 위 조직을 5분 동안 헹구고, 3회 흔들어 헹굽니다.
- 면도날을 사용하여 위를 같은 두께(3-5mm)로 3-4개의 고리로 자릅니다. 방향을 유지하기 위해 2% 아가로스에 위 고리를 삽입합니다. 더 작은 곡률 쪽을 같은 방향으로 배치하여 위 고리를 근위부에서 원위부까지 순차적으로 배치합니다(그림 1F).
- 아가로스에 박혀 있는 위 고리를 조직 카세트에 넣고(그림 1G) 파라핀 포매를 위해 샘플을 조직학 핵심 시설에 제출합니다17.
2. 면역형광성 염색
- 슬라이드 준비
- 드라이 오븐 또는 60°C로 설정된 열 블록에서 파라핀 섹션이 있는 열 슬라이드를 최소 1시간에서 밤새 동안 가열합니다. 실온으로 식힌 후 슬라이드 랙에 보관합니다.
- 탈파라핀화(Deparaffinization), 재수화(rehydration) 및 항원 회수(antigen retrieval)
- 두 개의 슬라이드 용기에 A와 B라는 라벨을 붙이고 조직이 완전히 잠길 수 있을 만큼 충분한 Trilogy 용액을 각각 채웁니다.
- 항아리 A에 슬라이드 랙을 놓고 두 항아리를 모두 압력솥에 넣습니다. 압력솥을 15분 동안 고압으로 설정하세요. 슬라이드를 열고 꺼내기 전에 압력솥을 식히십시오.
- 즉시 용기 A의 슬라이드 랙을 용기 B에 2분 동안 놓아 슬라이드에서 파라핀이 제거되었는지 확인합니다. 항아리 B에서 슬라이드를 제거하고 탈이온수(DI)에 넣습니다.
참고: 항아리 A는 한 번 사용한 트릴로지로 채울 수 있습니다. 새로운 삼부작은 항상 항아리 B에서 사용해야 합니다. - 블로킹을 진행하기 전에 슬라이드를 Tris-buffered saline(TBS)에 5분 동안 놓습니다.
- 비특이적 배경 염색 차단
- 슬라이드 랙에서 슬라이드를 제거하고 옆으로 두드려 여분의 TBS를 제거합니다.
- 소수성 마커를 사용하여 조직 주위에 상자를 그립니다. 조직을 완전히 덮기 위해 차단 버퍼를 바르고 실온의 가습 챔버에서 30-60분 동안 배양합니다.
- 1차 항체를 이용한 배양
- 다른 숙주 종에서 배양된 표적 단백질의 1차 항체를 선택하고 제조업체의 권장 사항에 따라 항체 희석제로 희석합니다. 이 연구를 위해 H+/K+-ATPase, GIF, Mist118,19 및 CD44v920,21 항체를 사용했습니다. 1차 항체에 대한 자세한 정보는 Table of Materials(재료 표)에서 확인할 수 있습니다.
- 차단 버퍼를 제거하고 희석된 항체를 도포한 다음 슬라이드를 가습 챔버에 다시 놓습니다. 4 °C에서 밤새 배양하십시오.
- 1차 항체를 제거하고 TBS에서 3회 세척할 때마다 5분 동안 슬라이드를 세척합니다.
- 2차 항체 및 렉틴
- 1차 항체의 숙주 종에 따라 2차 항체를 선택합니다. 렉틴은 2차 항체와 혼합하여 동시에 적용할 수 있습니다.
- 2차 항체와 렉틴을 항체 희석제에 대한 제조업체의 권장 사항에 따라 희석합니다. 이 연구에 사용된 2차 항체 및 렉틴에 대한 자세한 정보는 Table of Materials에서 확인할 수 있습니다.
- 2차 항체, 렉틴 및 DAPI(1μg/mL)를 적용하고 슬라이드를 가습 챔버에 다시 놓습니다. 빛을 피해 실온에서 1시간 동안 배양합니다.
- 가습 챔버에서 슬라이드를 제거하고 세탁할 때마다 3분 동안 TBS로 5번 헹굽니다.
- 장착 및 현미경 검사 준비
- TBS에서 슬라이드를 제거하고 종이 타월로 슬라이드를 옆으로 두드려 과도한 액체를 제거합니다.
- 15-20 μL의 마운팅 매체를 추가합니다. 가장자리를 잡고 장착 매체를 사이에 두고 조직 반대편에 한쪽 가장자리를 놓습니다.
- 매체가 조직 전체에 고르게 퍼지도록 커버슬립을 천천히 내리고 기포가 갇히지 않도록 주의하십시오.
- 작업용 와이프를 사용하여 가장자리 주변의 과도한 장착 매체를 흡수합니다. 완성된 슬라이드를 실온의 어두운 곳에서 건조시킨 후 현미경 검사를 진행합니다. 나머지 슬라이드에 대해 이 과정을 반복합니다.
결과
성체 야생형(WT) 및 MT-TGFα 마우스는 희생 전 2주 동안 식수에 황산아연(25mM ZnSO4)을 투여했습니다. WT 쥐의 위는 정상적이고, 심하게, 조직학적으로 나타났다. 이와는 대조적으로, MT-TGFα의 위는 심하게 두꺼워졌습니다(그림 2A). 현미경으로 볼 때, 이 위는 두정세포와 주정세포(chief cell)가 모두 소실된 대량의 치파포 증식증을 보였는데(그림 2B-D), 이는 메네트리에병(Ménétrier's disease, MD)의 조직학적 특징을 요약한 것입니다. 주세포의 손실은 주세포의 사멸 또는 주세포에서 발생하는 경련성 폴리펩티드 발현 화생(SPEM)의 두 가지 방식으로 발생할 수 있습니다. 이 두 가지 가능성을 구별하기 위해 Mist1-CreERT2를 교차 하여 주세포의 계통 추적을 수행했습니다. MT-TGFα 마우스가 있는 R26-LSL-mTmG 마우스. 이 마우스는 먼저 저용량 타목시펜(7일 연속 복강내 37.5mg)으로 처리하여 주세포를 GFP로 표지한 다음 음용수에서 ZnSO4로 처리하여 TGFα 과발현을 유도했습니다. MT-TGFα 마우스에서 희귀한 GFP 표지 세포를 관찰했습니다(데이터는 표시되지 않음). 또한, ZnSO4 의 유무에 따라 MT-TGFα 마우스에는 총체적 및 조직학적 차이가 없었습니다(그림 3A-C). 이 발견에 대한 한 가지 가능한 설명은 TGFα가 주세포(chief cells 18)의 필수 전사 인자인 Mist1의 발현을 감소시키고 Mist1-CreERT2 대립유전자의 유용성을 무너뜨렸을 수 있다는 것입니다. 실제로, ZnSO4 처리를 하지 않은 MT-TGFα 마우스에서는 Mist1에 대한 면역조직화학적 염색이 손실되었습니다(그림 3D).
MT-TGFα 마우스 모델의 누수를 극복하기 위해 독시사이클린에 의해 유도되는 Doxi-TGFa 형질전환 모델로 전환했습니다. 이는 TetO-TGFα 마우스(14)를 CMV-rtTA 마우스 라인(13)에 교차 교배함으로써 달성되었다. rtTA는 위에서 발현된다는 것이 이전에 보고된 바 있습니다. 2주간의 독시사이클린 치료가 이 새로운 MD 마우스 모델에서 치파포 증식을 유도하고 두정엽 및 주정세포 수를 감소시키는 것을 확인했습니다(그림 4A-C). MT-TGFα 마우스의 조직형태학적 특징과 비교했을 때, Doxi-TGFα 마우스는 점막 두께와 치파포 증식이 덜 심할 뿐만 아니라 두정세포의 감소도 적었습니다(보충 그림 2). 그럼에도 불구하고 Mist1-CreERT2 마우스 라인을 사용하여 주축 세포를 계보할 수 있었고 주세포 계통도 GSII 및 CD44v9 20,21로 표지되어 TGFα 과발현이 주세포에서 SPEM을 유도한다는 것을 확인했습니다(그림 4D).
현재 연구에 따르면 MT-TGFα 마우스 모델은 중금속 처리가 없는 상태에서 MD의 조직병리학적 특징을 표현형으로 복사하는 것으로 나타나는데, 이는 promoter/enhancer의 내재적 누출 및/또는 중금속 노출을 피할 수 없기 때문일 수 있습니다(그림 3 및 보충 그림 2). TGFα는 Mist1 발현을 억제하기 때문에 MT-TGFα 마우스 모델에서는 Mist1-CreERT2 마우스 라인을 사용할 수 없습니다. 독시사이클린 처리에 의해 TGFα 발현이 유도될 수 있는 새로운 MD 마우스 모델을 생성했습니다. 이 새로운 Doxi-TGFα MD 마우스 모델을 사용하여 TGFα 과발현이 주세포에서 유래한 SPEM을 유도하는 것을 확인할 수 있었습니다. Doxi-TGFα MD 마우스 모델은 TGFα 발현의 정밀한 제어가 필요한 경우와 Mist1-CreERT2 마우스 라인을 사용하여 주세포의 유전적 변형이 필요한 경우에 유용합니다.
데이터 가용성:
모든 원시 데이터는 보조 파일로 사용할 수 있습니다.
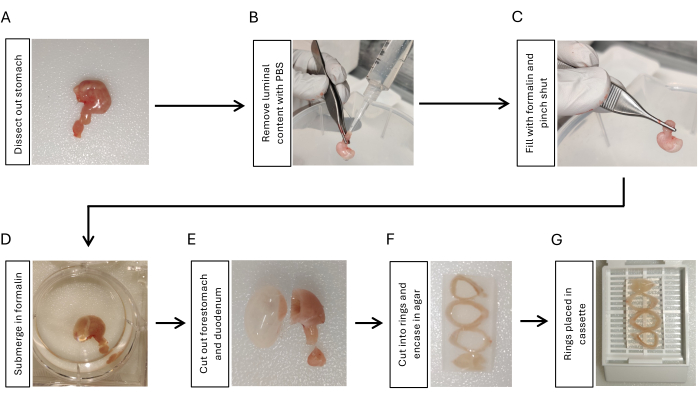
그림 1: 위 조직 매립의 고정 및 준비를 위한 작업 흐름. (A) 십이지장의 짧은 부분(3-5mm)과 함께 위를 절개합니다. (B) 피펫 팁이 있는 주사기를 사용하여 십이지장에서 PBS를 주입하고 손가락으로 3번 짜서 광속 함량을 제거합니다.(C) 주사기를 사용하여 십이지장에서 포르말린으로 위를 팽창시키고 위십이지장 접합부를 꼬집어 포르말린을 유지합니다. (D) 위를 포르말린에 담그고 흔들면서 4°C에서 밤새 고정합니다. (E) 면도날로 포레스토마흐와 십이지장을 제거하고 PBS로 헹굽니다. (F) 위체와 antrum을 단면적으로 3-4 개의 고리로 자르고 위 조직 고리의 방향을 유지하기 위해 2 % 아가로스에 삽입하십시오. (G) 아가로스가 포매된 조직을 카세트에 넣습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
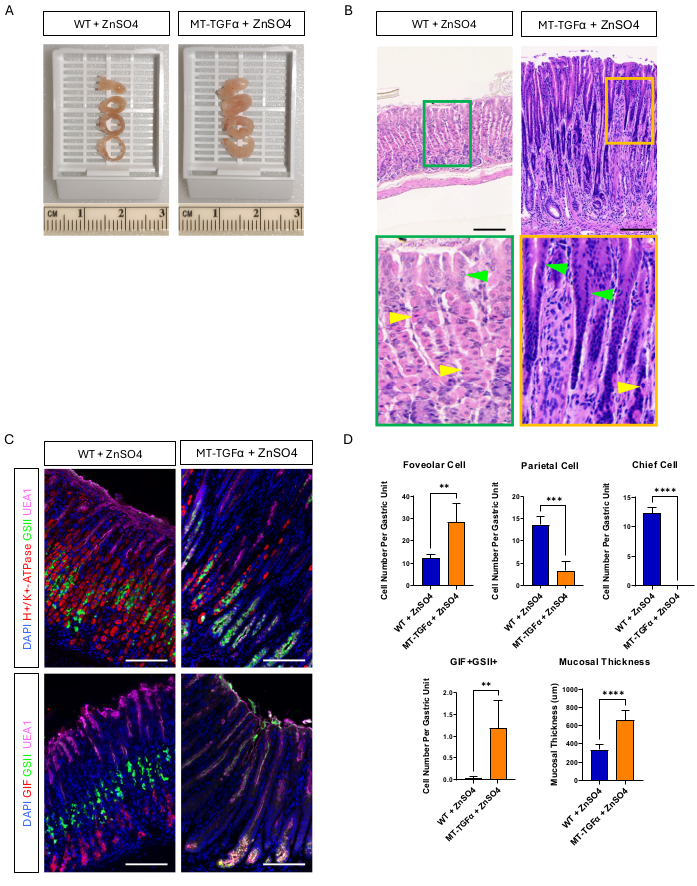
그림 2: 중금속 ZnSO4로 처리된 MT-TGFα 마우스의 총 및 현미경 표현형. (A) MT-TGFα 마우스(오른쪽)의 위벽은 대조군 마우스(왼쪽)에 비해 더 두껍습니다. (B) MT-TGFα 마우스(오른쪽)의 위는 다량의 foveolar 증식과 두정세포 소실을 보여줍니다. 노란색 화살촉은 두정세포를 나타내고 녹색 화살촉은 foveolar 세포를 나타냅니다. 눈금 막대는 100μm를 나타냅니다. (C) 면역형광 염색을 통해 MT-TGFα 마우스 위(오른쪽)가 대조군 마우스 위(왼쪽)에 비해 foveolar cell(UEA1 양성) 및 SPEM cell(GIF 및 GSII 이중 양성)의 수가 증가하고 두정세포 수(H+/K+-ATPase 양성) 및 chief cell(GIF 단일 양성)의 수가 감소함을 확인했습니다. 스케일 바는 100μm를 나타냅니다. (D) ZnSO4(n = 5)로 처리된 야생형(WT) 마우스 및 ZnSO4(n = 3)로 처리된 MT-TGFα 마우스에서 다양한 상피 세포 유형 및 점막 두께의 정량화. 오차 막대는 표준 편차를 나타냅니다(**p < 0.01, ***p < 0.001, ****p < 0.0001). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
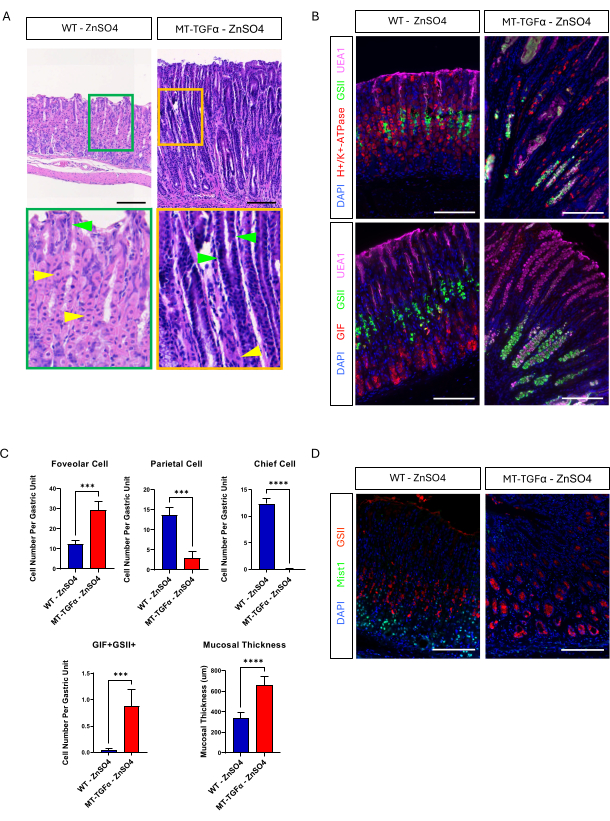
그림 3: MT-TGFα 마우스는 중금속 처리 없이 위 표현형이 발생합니다. (A) MT-TGFα 마우스(오른쪽)의 위는 중금속 처리 없이 다량의 foveolar hyperplasia와 두정세포 소실을 보여줍니다. 노란색 화살촉은 두정세포를 나타내고 녹색 화살촉은 foveolar 세포를 나타냅니다. 스케일 바는 100 μm를 나타냅니다. (B) 면역형광 염색을 통해 중금속 처리를 하지 않은 MT-TGFα 마우스의 위(오른쪽)를 확인한 결과, 대조군 마우스의 위(왼쪽)에 비해 foveolar cell(UEA1 양성) 및 SPEM cell(GIF 및 GSII 이중 양성)의 수가 증가하고, parietal cell(H+/K+-ATPase positive) 및 chief cell(GIF single positive)의 수가 감소한 것으로 나타났습니다. 스케일 바는 100 μm를 나타냅니다. (C) ZnSO4 (n = 5) 및 MT-TGFα 마우스 ZnSO4 (n = 3)가없는 WT 마우스에서 다양한 상피 세포 유형 및 점막 두께의 정량화. 오차 막대는 표준 편차를 나타냅니다(***p < 0.001, ****p < 0.0001). (D) MT-TGFα 마우스(오른쪽)의 위는 일반적으로 주세포(왼쪽)에서 발현되는 Mist1 발현의 소실을 보여줍니다. GSII는 점액 목 세포의 마커입니다. 스케일 바는 100μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
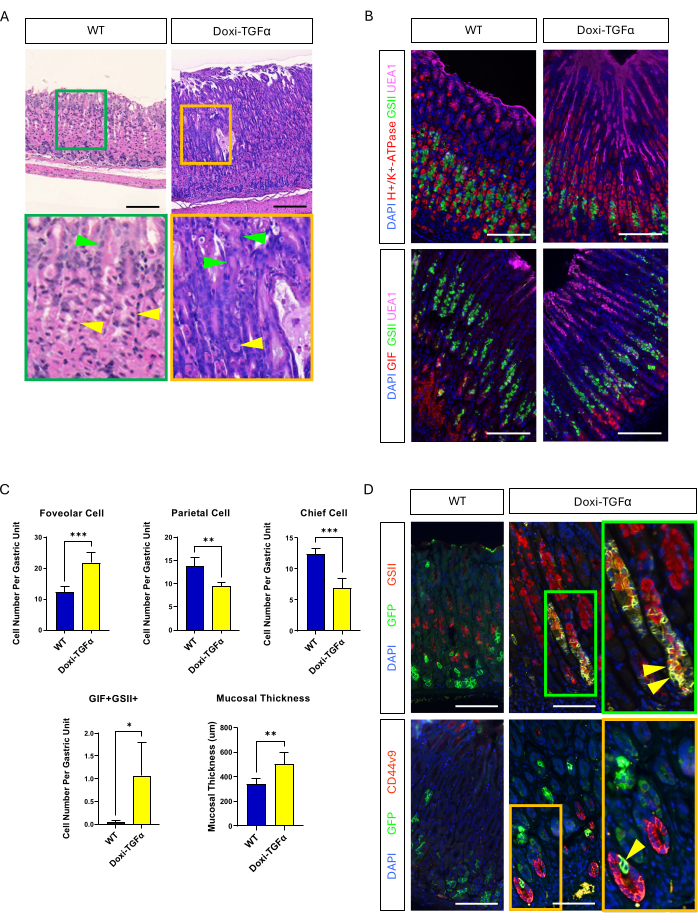
그림 4: 독시사이클린 유도성 TGFα 마우스 모델(Doxi-TGFα)은 메네트리에병 표현형을 재현하며, 이 마우스 모델에서 SPEM 형성이 확인되었습니다. (A) CMV-rtTA의 위; TetO-TGFα 마우스(Doxi-TGFα, 오른쪽)는 대량의 foveolar 증식과 두정세포 수 감소를 보여줍니다. 노란색 화살촉은 두정세포를 나타내고 녹색 화살촉은 foveolar 세포를 나타냅니다. 눈금 막대는 100μm를 나타냅니다. (B) 면역형광 염색을 통해 Doxi-TGFα 마우스 위(오른쪽)가 대조군 마우스 위(왼쪽)에 비해 foveolar cell(UEA1 양성) 및 SPEM cell(GIF 및 GSII 이중 양성)의 수가 증가하고, parietal cell(H+/K+-ATPase 양성) 및 chief cell(GIF single positive)의 수가 감소한 것으로 확인되었습니다. 스케일 바는 100μm를 나타냅니다. (C) WT 마우스(n = 5) 및 Doxi-TGFα 마우스(n = 5)에서 다양한 상피 세포 유형 및 점막 두께의 정량화. 오차 막대는 표준 편차를 나타냅니다(*p < 0.05, **p < 0.01, ***p < 0.001). (D) Mist1-CreERT2를 사용한 주세포(GFP 양성)의 계통 추적; R26-LSL-mTmG 마우스 라인은 Doxi-TGFα 마우스 위에서도 GFP 양성 세포가 GSII 및 CD44v9에 대해 양성임을 보여주며, 이는 주세포에서 유래한 SPEM 형성을 확인하는 반면, 대조 위(왼쪽)는 GSII 또는 CD44v9에 대해서도 GFP 양성 세포가 거의 없음을 보여줍니다. 스케일 바는 100μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 저용량 타목시펜(TMX) 치료는 위 점막 손상을 유발하지 않습니다. 7일 연속 저용량 TMX 치료(37.5mg/kg)는 위 점막 손상을 유발하지 않으며, 이는 두정세포 수 유지로 예시됩니다. (A) TMX 처리를 하지 않은 H&E 이미지(왼쪽 패널) 및 TMX 처리를 거친 이미지(오른쪽 패널). 스케일 바는 100μm를 나타냅니다. (B) WT 마우스(n = 5) 및 TMX 처리(n = 5)를 통한 WT의 위 단위당 두정세포 수 정량화. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2: 서로 다른 메네트리에병(MD) 마우스 모델 간의 표현형 비교. (A) ZnSO4 처리한 MT-TGFα, ZnSO4 처리하지 않은 MT-TGFα 및 Doxi-TGFα MD 마우스 모델은 치파포 증식, 두정세포 및 주세포의 손실, 경련성 폴리펩티드 발현 화생(SPEM) 세포(GIF 및 GSII 공동 국소화 세포) 증가 및 두꺼워진 점막을 보여줍니다. ZnSO4 처리군이 있는 경우와 없는 MT-TGFα 사이에는 표현형 차이가 없습니다. Doxi-TGFα 마우스 모델은 MT-TGFα 마우스 모델보다 덜 심각한 표현형을 보입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
메네트리에병(Ménétrier's disease, MD)은 TGFα 과발현에 의해 발생하는 희귀한 전악성 위질환입니다 1,2,3. 메탈로티오네인 유전자 강화제/프로모터(MT-TGFα)의 제어하에 TGFα를 과발현하는 형질전환 마우스는 현재까지 MD에 대한 유일한 마우스 모델이었습니다 4,5. 메탈로티오네인 유전자는 중금속에 반응하기 때문에 황산아연을 식수에 첨가하거나 황산카드뮴을 주입하여 이 마우스 모델에서 TGFα를 유도합니다 5,8. MD의 특징적인 표현형 중 하나는 위샘 기저부의 주축 세포가 점액 목 세포와 전방 점액 세포 모두에 존재하는 마커에 대해 양성인 점액 세포로 대체되는 것입니다. 이는 주세포(chief cell)의 사멸 또는 주세포(chief cell)의 경련성 폴리펩티드 발현 화생(SPEM)으로의 재프로그래밍에 의해 발생할 수 있습니다8,11. 이는 MD 마우스 모델에서 주축 세포의 계통 추적으로 테스트할 수 있습니다. 우리는 Mist1-CreERT2를 사용하여 주세포의 계보를 추적하려고 했습니다. Mist1 양성 주추 세포에 멤브레인 표적 GFP가 표지된 R26-LSL-mTmG 마우스. 그러나 MT-TGFα 마우스에서 제한된 수의 GFP 표지 세포만 관찰되었습니다. 이것은 GFP에 의하여 표한 주요한 세포의 대부분이 TGFα 과발현 때문에 죽었거나 주요한 세포에 있는 GFP 레테르를 붙이기의 효율성이 너무 낮았다는 것을 건의합니다. TGFα 과발현8에 의한 세포 사멸의 증가가 없었다는 보고가 있었기 때문에 중금속 처리를 하지 않은 MT-TGFα 마우스를 평가하여 Mist1 발현 상실 가능성을 조사했습니다. 우리는 중금속 처리를 하지 않은 MT-TGFα 마우스에서 foveolar hyperplasia 및 parietal 및 chief cell의 손실을 포함한 완전한 표현형에 놀랐습니다. 또한 중금속 처리를 하지 않아도 MT-TGFα 마우스에서 Mist1 발현이 손실되는 것을 확인했습니다. 이전에 TGFα 발현은 중금속 노출을 제거할 수 없기 때문에 MT-TGFα 마우스에서 엄격하게 제어되지 않았다고 보고되었습니다. 그러나, TGFα 발현은 중금속 처리에 의해 현저하게 증가하였다8. 포괄적인 표현형 평가는 이전에 중금속 처리 없이 MT-TGFα 마우스에서 수행된 적이 없습니다. 현재 연구는 MT-TGFα 마우스가 중금속 처리 없이 완전한 표현형 발현을 발달시킨다는 것을 보여줍니다.
MT-TGFα 마우스에서는 중금속 처리 전에도 Mist1 발현이 소실되었기 때문에 TGFα 과발현 유도 없이 표현형이 발생하지 않도록 TGFα 발현을 특이적으로 제어하는 다른 마우스 모델이 필요했습니다. 독시사이클린 처리(Doxi-TGFα)에 의해 TGFα 발현이 유도되는 새로운 MD 마우스 모델을 생성했습니다. 우리는 이 마우스 모델이 MD의 주요 표현형인 foveolar hyperplasia와 parietal 및 chief cell의 손실을 유도하는 것을 확인했습니다. 우리는 Mist1-CreERT2를 사용하여 추적 주축 세포를 계보할 수 있었습니다. 이 마우스 모델에서 R26-LSL-mTmG 마우스는 일부 GFP 표지 세포도 GSII 및 CD44v9로 표지된 것으로 확인되어 이 새로운 MD 마우스 모델에서 SPEM이 발생함을 확인했습니다. 이는 SPEM이 TGFα 과발현과 함께 위에서 발생한다는 것을 확인한 첫 번째 보고입니다. SPEM은 보다 흔한 전악성 위 질환으로, MD 환자에서 위암이 증가하는 이유일 수 있다22,23.
Mist1-CreERT2 마우스 라인을 사용할 때 한 가지 주의 사항은 Mist1이 위 줄기세포에서도 발현될 수 있다고 보고되었다는 것입니다24. 우리는 저용량(37.5mg/kg)의 타목시펜 치료가 독시사이클린 치료 전 더 이른 시점에서도 협부 영역에서 최소한의 활성화와 함께 더 구체적으로 주요 세포에서 Cre 활성화를 유도한다는 것을 발견했습니다. 이와 유사한 연구 결과가 이전에 보고된 바있다 25. Mist1-CreERT2를 사용한 계보 추적; R26-LSL-mTmG 마우스는 GFP 및 SPEM 마커(GSII 및 CD44v9) 근처에서 GFP 양성 세포를 보임: 이중 양성 세포는 주로 주축 세포가 위치한 베이스에 국한되어 있습니다(그림 4C). GFP 및 SPEM 마커 이중 양성 세포가 줄기 세포에서 추적되는 경우, 줄기 세포가 위치한 협부를 향해 더 많은 GFP 양성 세포가 있어야 합니다. 대안적으로, 독시사이클린 유도성 GIF-rtTA 마우스 라인26 또는 GPR30-rtTA 마우스 라인27 을 MT-TGFα 마우스와 함께 사용하여 주세포의 유전자 변형 또는 계통 추적을 수행할 수 있습니다. 그러나 ZnSO4 처리하지 않은 MT-TGFα 마우스에서는 GIF 양성 세포가 감소하고(그림 3B, C), GPR30 양성 세포는 SPEM에서 손실되며, 이는 ZnSO4 처리하지 않은 MT-TGFα 마우스에서 발생합니다. 따라서 Mist1-CreERT2 마우스 라인과 교차된 Doxi-TGFα 마우스에 비해 효율성이 떨어집니다.
현재 연구는 MT-TGFα 마우스가 중금속 처리 없이 위에서 완전한 표현형 변화를 일으킨다는 것을 보여줍니다. 우리는 또한 표현형 중 하나가 Mist1 발현의 손실이며 이는 Mist1-CreERT2의 사용을 배제한다는 것을 보여줍니다. R26-LSL-mTmG 마우스 라인에서 주임 세포를 추적합니다. 새로운 MD 마우스 모델인 Doxi-TGFα를 생성하고, 이 마우스 모델을 사용하여 SPEM이 MD에서 개발되는 것을 최초로 확인했습니다. 이 새로운 MD 마우스 모델은 MD 표현형의 발달을 정밀하게 제어해야 하고 Mist1-CreERT2 마우스 라인을 사용하여 주세포의 유전자 변형이 필요한 경우에 유용할 것입니다. MD 표현형은 TGFα 과발현에 의한 EGFR 신호 활성화에 의해 유도됩니다. 그러나 세포 유형이 관찰된 표현형을 담당하는 EGFR 활성화는 알려져 있지 않습니다. 현재 Doxi-TGFα 마우스 모델을 사용하여 Mist1-CreERT2 마우스 라인을 활용하는 주세포를 포함한 다양한 세포 유형에서 EGFR 신호전달의 역할을 조사하고 있습니다.
공개
모든 저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 미국 국립당뇨병·소화기·신장 질환 연구소(National Institute of Diabetes and Digestive and Kidney Diseases, K08 DK124686 to WJH)의 지원을 받았습니다. 원고를 편집해 준 지나 델라 포르타(Gina Della Porta)와 사라 E. 글래스(Sarah E. Glass)에게 감사의 뜻을 전한다.
작성자 기여:
TTG는 실험을 수행하고, 그림을 생성하고, 원고를 작성하고, 원고를 편집했습니다. JDP는 실험을 수행하고, 그림을 생성하고, 원고를 작성하고, 원고를 편집했습니다. SKM은 TetO-TGFα 마우스 라인을 제공하고 원고를 편집했습니다. RJC는 실험을 구상하고 원고를 편집했습니다. WJH는 실험을 구상하고, 실험을 수행하고, 데이터를 해석하고, 문헌을 검색하고, 원고를 작성하고, 원고를 편집했습니다.
자료
| Name | Company | Catalog Number | Comments |
| Mouse anti H+/K+-ATPase antibody | A gift from Dr. Eunyoung Choi | N/A | Dilution: 1:10000 |
| Antibody Diluent | Abcam | 559148 | |
| Anti-rabbit GFP | Life Technologies Corporation | A11122 | Dilution: 1:500 |
| Charged Glass Slides | Fisher | 22-178-277 | |
| Cover Slips | Globe Scientific | 1411-10 | |
| Donkey anti-mouse 594 | Invitrogen | A12102 | Dilution: 1:500 |
| Donkey anti-rabbit 488 | Invitrogen | A21206 | Dilution: 1:500 |
| Donkey anti-rabbit 594 | Invitrogen | A21207 | Dilution: 1:500 |
| Donkey anti-rat 594 | Invitrogen | A21209 | Dilution: 1:500 |
| Doxyclycine Hyclate | TCI | D4116 | |
| Flouromount-G | Thermo fischer | 00-4958-02 | |
| GSII 488 | Invitrogen | L21415 | Dilution: 1:500 |
| Hydrophobic Marker | Electron Microscopy Sciences | 71312 | |
| Incubator | Labnet | I 5110 | |
| MIST1/bHLHa15 (D7N4B) XP Rabbit mAb | Cell Signaling | 14896S | Dilution: 1:200 |
| Pressure Cooker (6QT) | Cuisinart | CPC-600N1 | |
| Protein Block | Abcam | AB64226 | |
| Rabbit anti-GIF antibody | MyBioSource | MBS2028736 | Dilution: 1:200 |
| Rat anti CD44v9 mAb | Cosmo Bio | LKG-M002 | Dilution: 1:20000 |
| Slide Jars | Simport | M906-12AS | |
| Tamoxifen | Sigma-Aldrich | T5648 | |
| Trilogy | Sigma | 922P-10-RUO | |
| UEA1 Dylight 649 | Vector Laboratories | DL-1068 | Dilution: 1:500 |
참고문헌
- Huh, W. J., Coffey, R. J., Washington, M. K. Menetrier's disease: Its mimickers and pathogenesis. J Pathol Transl Med. 50 (1), 10-16 (2016).
- Tanksley, J. Jr, Tanksley, J. Pierre menetrier and his disease. Trans Am Clin Climatol Assoc. 123, discussion 133-124 126-133 (2012).
- Rich, A., et al. Distinguishing menetrier's disease from its mimics. Gut. 59 (12), 1617-1624 (2010).
- Takagi, H., Jhappan, C., Sharp, R., Merlino, G. Hypertrophic gastropathy resembling menetrier's disease in transgenic mice overexpressing transforming growth factor alpha in the stomach. J Clin Invest. 90 (3), 1161-1167 (1992).
- Dempsey, P. J., et al. Possible role of transforming growth factor alpha in the pathogenesis of menetrier's disease: Supportive evidence form humans and transgenic mice. Gastroenterology. 103 (6), 1950-1963 (1992).
- Fiske, W. H., et al. Efficacy of cetuximab in the treatment of menetrier's disease. Sci Transl Med. 1 (8), 8ra18(2009).
- Burdick, J. S., et al. Treatment of menetrier's disease with a monoclonal antibody against the epidermal growth factor receptor. N Engl J Med. 343 (23), 1697-1701 (2000).
- Goldenring, J. R., et al. Overexpression of transforming growth factor-alpha alters differentiation of gastric cell lineages. Dig Dis Sci. 41 (4), 773-784 (1996).
- Sharp, R., et al. Transforming growth factor alpha disrupts the normal program of cellular differentiation in the gastric mucosa of transgenic mice. Development. 121 (1), 149-161 (1995).
- Bockman, D. E., Sharp, R., Merlino, G. Regulation of terminal differentiation of zymogenic cells by transforming growth factor alpha in transgenic mice. Gastroenterology. 108 (2), 447-454 (1995).
- Nomura, S., et al. Evidence for repatterning of the gastric fundic epithelium associated with menetrier's disease and tgfalpha overexpression. Gastroenterology. 128 (5), 1292-1305 (2005).
- Shi, G., et al. Loss of the acinar-restricted transcription factor mist1 accelerates kras-induced pancreatic intraepithelial neoplasia. Gastroenterology. 136 (4), 1368-1378 (2009).
- Kistner, A., et al. Doxycycline-mediated quantitative and tissue-specific control of gene expression in transgenic mice. Proc Natl Acad Sci U S A. 93 (20), 10933-10938 (1996).
- Hardie, W. D., et al. Conditional expression of transforming growth factor-alpha in adult mouse lung causes pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 286 (4), L741-L749 (2004).
- Keeley, T. M., Horita, N., Samuelson, L. C. Tamoxifen-induced gastric injury: Effects of dose and method of administration. Cell Mol Gastroenterol Hepatol. 8 (3), 365-367 (2019).
- Huh, W. J., et al. Tamoxifen induces rapid, reversible atrophy, and metaplasia in mouse stomach. Gastroenterology. 142 (1), 21-24.e7 (2012).
- Canene-Adams, K. Preparation of formalin-fixed paraffin-embedded tissue for immunohistochemistry. Methods Enzymol. 533, 225-233 (2013).
- Ramsey, V. G., et al. The maturation of mucus-secreting gastric epithelial progenitors into digestive-enzyme secreting zymogenic cells requires mist1. Development. 134 (1), 211-222 (2007).
- Huh, W. J., et al. Xbp1 controls maturation of gastric zymogenic cells by induction of mist1 and expansion of the rough endoplasmic reticulum. Gastroenterology. 139 (6), 2038-2049 (2010).
- Engevik, A. C., et al. The development of spasmolytic polypeptide/tff2-expressing metaplasia (spem) during gastric repair is absent in the aged stomach. Cell Mol Gastroenterol Hepatol. 2 (5), 605-624 (2016).
- Wada, T., et al. Functional role of cd44v-xct system in the development of spasmolytic polypeptide-expressing metaplasia. Cancer Sci. 104 (10), 1323-1329 (2013).
- Halldorsdottir, A. M., et al. Spasmolytic polypeptide-expressing metaplasia (spem) associated with gastric cancer in iceland. Dig Dis Sci. 48 (3), 431-441 (2003).
- Yamaguchi, H., Goldenring, J. R., Kaminishi, M., Lee, J. R. Identification of spasmolytic polypeptide expressing metaplasia (spem) in remnant gastric cancer and surveillance postgastrectomy biopsies. Dig Dis Sci. 47 (3), 573-578 (2002).
- Hayakawa, Y., et al. Mist1 expressing gastric stem cells maintain the normal and neoplastic gastric epithelium and are supported by a perivascular stem cell niche. Cancer Cell. 28 (6), 800-814 (2015).
- Saenz, J. B., Vargas, N., Cho, C. J., Mills, J. C. Regulation of the double-stranded rna response through adar1 licenses metaplastic reprogramming in gastric epithelium. JCI Insight. 7 (3), e153511(2022).
- Caldwell, B., Meyer, A. R., Weis, J. A., Engevik, A. C., Choi, E. Chief cell plasticity is the origin of metaplasia following acute injury in the stomach mucosa. Gut. 71 (6), 1068-1077 (2022).
- Hata, M., et al. Gpr30-expressing gastric chief cells do not dedifferentiate but are eliminated via pdk-dependent cell competition during development of metaplasia. Gastroenterology. 158 (6), 1650-1666.e15 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유