Method Article
Çiğ ve pişirmeye hazır tavuk ürünlerinde salmonella'yı ölçmek için modifiye edilmiş en olası sayı testi
Bu Makalede
Özet
Kümes hayvanlarında Salmonella'nın düşük seviyelerde doğru bir şekilde ölçülmesi, mevcut bir endüstriyel ve düzenleyici zorluktur. Bu protokol, çiğ ve pişirmeye hazır kümes hayvanı ürünlerinde Salmonella'nın miktar tayinini sağlayan bir MPN testini açıklar. Bu yöntem hızlı, hassastır ve FSIS yönergeleriyle uyumludur, gıda güvenliğini artırır ve halk sağlığı çabalarını destekler.
Özet
Salmonella , Amerika Birleşik Devletleri'nde, özellikle kümes hayvanı ürünlerinde, gıda kaynaklı hastalıkların önde gelen bir nedenidir. Salmonella'yı tespit etmek için kullanılan geleneksel yöntemler, kontaminasyon seviyelerini ve risklerini değerlendirmedeki faydalarını sınırlayan nicelikten ziyade yaygınlığa odaklanır. Bu çalışma, tavuk cordon bleu gibi pişirmeye hazır kümes hayvanı ürünlerinde Salmonella'yı ölçmek için tasarlanmış yeni bir en olası sayı (MPN) testini tanıtmaktadır. Yöntem, kümes hayvanı numunesinin yıkanmasını, durulamanın santrifüjleme yoluyla konsantre edilmesini ve 48 oyuklu bir blokta seri olarak seyreltilmesini içerir. MPN testi, mevcut Gıda Güvenliği ve Denetim Hizmeti (FSIS) protokolleriyle aynı zaman dilimi içinde Salmonella kontaminasyonunun hassas, doğru ve hızlı bir şekilde ölçülmesini sağlamak için döngü aracılı izotermal amplifikasyon (LAMP) yöntemiyle entegre edilmiştir. Sonuçlar, MPN-LAMP ölçümleri ile teorik aşılama seviyeleri arasında güçlü bir doğrusal korelasyon olduğunu göstermektedir (R² = 0.933). Bununla birlikte, daha düşük konsantrasyonlardaki değişkenlik, Salmonella'nın bu seviyelerde doğru bir şekilde tespit edilmesindeki zorlukları vurgulamaktadır ve pratik alt tespit limiti yaklaşık 300 CFU/g olarak tahmin edilmektedir. Protokolün uygulanabilirliğini iyileştirmeye yönelik potansiyel iyileştirmeler arasında, tespit sınırını daha da iyileştirmek için örneklenen miktarın artırılması, zenginleştirme ortamı formülasyonlarının optimize edilmesi ve birden fazla Salmonella serovarını hedeflemek için moleküler tespitin genişletilmesi yer alır. Genel olarak, bu çalışma, kümes hayvanı ürünlerinde Salmonella kontaminasyonunun güvenilir bir şekilde ölçülmesini sağlayan, gıda güvenliğinin ve halk sağlığının iyileştirilmesine katkıda bulunan gıda endüstrisi için pratik bir araç sunmaktadır.
Giriş
ABD'de gıda kaynaklı hastalıkların, hastaneye yatışların ve ölümlerin önde gelen bir nedeni olan Salmonella , önemli bir halk sağlığı ve ekonomik etkiye sahiptir. Patojenin yalnızca 2013 yılında tahmini ekonomik yükü 3,67 milyardolardı1. Son düzenleyici girişimler salmonellozu 2030 yılına kadar %25 oranında azaltmayı hedeflesede2, özellikle işleme tesisi gözetiminin halk sağlığı sonuçlarıyla uyumlu hale getirilmesinde mevcut tespit ve azaltma stratejilerindeki boşluklar belirgin olmaya devam etmektedir3 .
Birden fazla Salmonella salgınında rol oynayan dondurulmuş pişirmeye hazır kümes hayvanı ürünleri, halk sağlığı için önemli bir endişe kaynağıdır. Buna karşılık, Gıda Güvenliği ve Denetim Servisi (FSIS), Salmonella'yı bu ürünlerde bir katkı maddesi olarak sınıflandırdı. Şu anda, FSIS Mikrobiyoloji Laboratuvarı Rehberi (MLG) 4.15, yalnızca kanatlı ürünlerinde Salmonella prevalansının belirlenmesine odaklanmaktadır4. Bu kılavuz uyarınca, toplanan numuneler 18-24 saat boyunca zenginleştirilir ve daha sonra Salmonella'nın varlığını veya yokluğunu tanımlayan ancak kontaminasyon seviyesi hakkında bilgi sunmayan Moleküler Tespit Sistemi (MDS) kullanılarak taranır. Bu yaklaşım, patojenlerin varlığını tespit etmek için değerli olsa da, gıda işleyicilerinin kontaminasyon risklerini daha doğru bir şekilde değerlendirmesine ve hedefe yönelik düzeltici eylemler almasına yardımcı olabilecek nicel bilgiler sağlamada başarısız olur.
Bu çalışmada, mikrobiyal patojenlerin prevalansından niceliksel olarak belirlenmesini artırmak için bir yöntem geliştirdik. Mevcut FSIS protokollerinde minimum kesinti ile kümes hayvanı ürünlerinde Salmonella'yı tespit etmek için mevcut süreçlere sorunsuz entegrasyon için tasarlanmıştır. Yöntem, toplu numuneyi basitçe zenginleştirmek yerine, kümes hayvanı ürünlerini mevcut FSIS yöntemlerine uygun ortam kullanarak yıkayarak başlar. Durulama daha sonra 48 derinliğindeki bir kuyu bloğunun ilk sütununa dağıtılır. Kalan beş sütun boyunca seri seyreltmeler gerçekleştirilir ve blok, MLG 4.15 protokolü ile uyumlu olarak 18-24 saat inkübe edilir. İnkübasyondan sonra, kuyucuklar Salmonella için test edilir ve sonuçlar en olası sayıyı (MPN) hesaplamak için kullanılır5,6. Bu yaklaşım, mevcut FSIS süreciyle aynı zaman dilimi içinde kontaminasyonun ölçülmesine izin vererek, onu hem endüstri hem de düzenleyici kullanım için pratik bir seçenek haline getirir. Şekil 1, değiştirilmiş MPN testini özetleyen bir blok diyagramı göstermektedir. Şekil, belirli adımlarda çekilen fotoğrafları, kopyaların seyreltilmesi ve büyümesi için kullanılan 48 oyuklu bloğu ve öğütülmüş tavukta bulunan en olası Salmonella sayısını değerlendirmek için kıyaslama olarak kullanılan üç tekniği içerir. Bu çalışmanın ilk aşamasında, protokolü ışınlanmamış tavuk örneklerine uygulamadan önce arka plan mikroflorasının etkisini ve doğrulanmış aşılamaya göre ölçümlerin belirsizliğini en aza indirmek için ışınlanmış öğütülmüş tavuk kullandık.
Protokol
NOT: Bu protokolle ilişkili tüm çalışmalar bir Biyogüvenlik Seviye 2 (BSL-2) laboratuvarında yürütülmelidir. Uygun olduğunda, bu protokol aseptik koşulları korumak ve numune kontaminasyonu veya operatörün mikrobiyal patojenlere maruz kalma riskini en aza indirmek için bir biyolojik güvenlik kabini (BSC) içinde yürütülmelidir. Numuneleri BSC dışına aktarırken, numune bütünlüğünü korumak ve kazara düşme durumunda dökülmeyi önlemek için kapalı kaplar kullanın. Tercihen, çapraz kontaminasyon olasılığını azaltmak için prosedür boyunca tek kullanımlık bileşenler kullanılmalıdır. Tek kullanımlık malzemelerin mümkün olmadığı durumlarda, kullanmadan önce tüm ekipman ve malzemelerin steril olduğundan emin olun. Uygun atık yönetimi çok önemlidir; Kullanılan tüm tek kullanımlık bileşenler, biyolojik tehlike atığı olarak atılmalıdır. Potansiyel olarak tehlikeli maddelerin uygun şekilde sterilize edilmesini ve muhafaza edilmesini sağlamak için yeniden kullanılabilir malzemeleri yeniden kullanmadan önce otoklavlayın. Bu önlemlere bağlı kalmak yalnızca numune bütünlüğünü korumakla kalmaz, aynı zamanda operatörün mikrobiyal patojenlere maruz kalma riskini de en aza indirir.
1. Et numunelerinin hazırlanması
- Et numunelerinin alınması ve işlenmesi
- Taze et
- Yerel perakendecilerin taze et bölümünden kıyma tavuğu alın. Tüm numuneleri 4 °C'de depoya aktarın ve alındıktan sonra 24 saat içinde işleyin. Eti aseptik olarak 25 g'lık numunelere bölün.
- Numuneyi vakumla kapatın ve ışınlayın. Burada, Texas A&M AgriLife Ulusal Elektron Işını Araştırma Merkezi, ~ 25 kGy'lik bir doza tabi tutulan eti ışınladı.
NOT: Bu çalışmada ışınlama, arka plan mikroflorasının ortadan kaldırılmasını sağlamak için bir kontrol önlemi olarak kullanılmış olsa da, sonraki bölümde kullanılan ışınlanmamış pişirmeye hazır ürünlerin gösterdiği gibi pratik uygulamalarda protokol için bir ön koşul değildir. Saha ortamlarında, seçici ortam veya moleküler teşhisin özgüllüğü gibi alternatif yöntemler, hedef olmayan mikroorganizmalardan kaynaklanan potansiyel parazitleri ele alabilir.
- Pişirmeye hazır tavuk ürünleri
- Yerel perakendecilerin dondurulmuş gıda bölümünden pişirmeye hazır tavuk ürünleri edinin. Aseptik olarak 25 g numunelere bölün.
- Tüm malzemelerin (örn. ekmek ve peynir) dahil edildiğinden emin olmak için tek tek parçaların ortasından örnekler toplayın.
- Taze et
- Medya hazırlığı
- 25 g BPW tozunu 1 L nanosafH2O'daçözerek Tamponlu Pepton Suyu (BPW) hazırlayın.
- Beyin kalp infüzyonu (BHI) plakalarını hazırlayın. Bunu yapmak için, 37 g BHI tozunu 1 L nanosaf H2O içinde çözün ve BHI çözeltisine 15 g agar ekleyin. 121 °C'de 15 dakika otoklavlayarak tüm ortamları sterilize edin. Şeffaf Kapaklı Petri Kaplarına (100 mm x 15 mm) 20 ila 25 mL ortam dökün.
NOT: Aseptik koşulları korumak için plakaları biyolojik bir güvenlik kabinine dökmek en iyisidir.
2. Hücre kültürü
- Salmonella enterica serovar Typhimurium ATCC 14028'i bir BHI agar plakasına çizerek ilk kültürü hazırlayın ve gece boyunca 37 °C'de inkübe edin.
- 25 mL BHI suyunu bir koloni taze yetiştirilmiş Salmonella ile aşılayarak gece boyunca kültürler hazırlayın. Kültürleri gece boyunca 37 ° C'de 100 rpm'de çalkalayarak aerobik olarak büyütün.
3. Kanatlı hayvan örneklerinin aşılanması
- Kültür seyreltme ve kaplama
- Yaklaşık 1 x 108 ila 1 x 101 CFU / mL'lik nihai konsantrasyonları elde etmek için BPW'de gece boyunca kültürün bir dizi 10 kat seyreltmesini hazırlayın. Gece boyunca Salmonella kültürünün konsantrasyonunun 1 x 109 CFU/mL olduğunu varsayalım.
- Gece boyunca kültürün 0.5 mL'sini 4.5 mL BPW'ye aktarın, karıştırın, daha sonra her ilave seyreltme için 0.5 mL seyreltmeyi 4.5 mL BPW'ye aktarın.
- Gece boyunca kültür konsantrasyonunu hesaplamak için hücre sayımı için 1 x 103 CFU/mL seyreltmenin 10 μL'sini bir BHI agar plakasına üç nüsha halinde yayın.
- Et örneklerinin aşılanması
- 25 g ışınlanmış öğütülmüş tavuğu aseptik olarak iki kopya halinde steril bir mide torbasına aktarın. Çanta 7,5 x 12 inç boyutundadır ve 1,63 L olarak etiketlenmiştir. Torba, 330 μm delik çapına sahip bir filtre bölmesi içerir ve cm kare başına 285 tane vardır.
- Her numuneyi 1 mL hedef konsantrasyon seyreltmesi ile aşılayın. Örneğin, yaklaşık 1.000 hücre / 25 g tavukta bir kontaminasyon seviyesi elde etmek için 1 x 10³ CFU / mL seyreltmeden 1 mL kültür ekleyin. Sıvı aşıyı steril bir hücre yayıcı kullanarak tavuk numunelerinin yüzeyine nazikçe dağıtın ve 4 °C'de 1 saat bekletin.
- 1 mL steril BPW ekleyerek negatif kontrol numuneleri hazırlayın.
4. Numune işleme
- Her numuneye 225 mL BPW ekleyin. Hacmin ortama oranı, FSIS MLG 4.154 ile uyumlu olacak şekilde seçildi.
- Numuneleri Mide7'yi normal hızda ve 120 s sürede kullanarak homojenize edin.
- Santrifüjleme ve yeniden süspansiyon
- 50 mL'lik bir pipet kullanarak torbanın filtrelenmiş tarafındaki sıvıyı dikkatlice çıkarın. Sıvıyı iki steril santrifüj şişesine bölün.
- Eşit ağırlıkları sağlamak için şişeleri steril BPW ile dengeleyin. Numuneleri 10,000 x g'da 10 dakika santrifüjleyin. Süpernatanı atın. Hücre peletini steril bir spatula ile 3 mL BPW suyunda yeniden süspanse edin.
- 27 mL daha BPW suyu ekleyin ve bir spatula ile karıştırarak iyice karıştırın. Her iki santrifüj şişesinin içeriğini her numune için bir şişede birleştirin.
5. MPN blok kurulumu
NOT: Tablo 1 , 48 oyuklu bir bloktaki seyreltmelerin bir şemasını göstermektedir.
- 48 oyuklu bloğun (8 tekrar) 1. sütunundaki her bir oyuklu kuyucuğa 3 mL yeniden askıya alınmış numune ekleyin.
- Sekiz kanallı bir pipet kullanarak blok içindeki 10-1 numaralı sütunlar boyunca bir dizi 6 katlı seyreltme hazırlayın.
- Karıştırmak için 2,7 mL BPW pipete 0,3 mL numune ekleyin. Her seyreltme için tekrarlayın. Blokları gece boyunca (~ 18 saat) 37 ° C'de ~ 100 rpm'de çalkalayarak inkübe edin.
6. Kaplama ve numaralandırma
- Değiştirilmiş düşme plakası numaralandırması
- Çok kanallı bir pipet kullanılarak bir agar plakası üzerinde 4 x 6'lık bir ızgarada her seyreltmenin gece boyunca büyütülmüş numunesinin 7 μL'lik plakası (Şekil 2). İki plaka üzerinde 4 x 6'lık bir ızgara kullanmak, tipik 6 x 6 damlacıkızgarasının 8 aksine, 8 numuneyi daha iyi barındırır.
- İnkübasyondan önce plakaların 10 dakika kurumasını bekleyin. Agar plakalarını gece boyunca (~ 18-24 saat) 37 ° C'de inkübe edin. Kuluçka işleminden sonra, her plakadaki koloni sayısını sayın.
7. Salmonella'nın qPCR tespiti
- Ticari bir kit kullanarak DNA ekstraksiyonu
- 48 oyuklu blokta kültürleri birkaç kez yukarı ve aşağı pipetleyerek karıştırın. Her kültürden 200 μL'yi 96 oyuklu bir PCR plakasına pipetleyin.
- Plakayı kapatın ve ardından 10 dakika boyunca 6.600 x g'da santrifüjleyin. Süpernatanı çıkarın ve pelete 20 μL kit reaktifi ekleyin.
- Yukarı ve aşağı pipetleyerek peleti yeniden süspanse edin. Plakayı kapatın ve 99 °C'de 10 dakika ısıtın, ardından 20 °C'ye soğutun.
- 10 dakika boyunca 6.600 x g'da tekrar santrifüjleyin. qPCR analizi için 2 μL süpernatan kullanın.
- Plaka kurulumu
- qPCR reaksiyon karışımını belirlenen protokol9'a göre aşağıdaki gibi hazırlayın: 10 μL 2x Master Mix; Her bir astar ve probun 0,4 μL'si (10 μM çalışma solüsyonu): invA ileri: 5'-GTTGAGGATGTTATTCGCAAAGG-3', invA geri: 5'-GGAGGCTTCCGGGTCAAG-3', invA probu: 5'-CCGTCAGACCTCTGGCAGTACCTTCCTC-3' Cal Fluor Orange 560 floren boyası ile etiketlenmiştir; 0,2 μL dahili amplifikasyon kontrolü (IAC) şablonu (6 x 10,4 kopya/μL)9; Her IAC astarı ve probunun 0,4 μL'si (10 μM): IAC ileri: 5'-GGCGCGCCTAACACATCT-3', IAC geri: 5'-TGGAAGCAATGCCAAATGTA-3', IAC probu: 5'-TTACAACGGGAGAAGACAATGCCACCA-3' TAMRA boyası ile etiketlenmiştir. Hacmi ddH2O ile toplam 20 μL'ye ayarlayın.
- Aşağıdaki döngü koşullarıyla gerçek zamanlı PCR gerçekleştirin9: 10 dakika boyunca 95 °C (DNA'nın ilk denatürasyonu ve sıcak başlangıç polimerazın aktivasyonu), 15 saniye boyunca 95 °C'lik 40 döngü ve 1 dakika boyunca 60 °C, sonuçları analiz için dışa aktarmak için varsayılan Ct ayarlarını kullanın.
8. 3M MDS testi kullanılarak tespit
- Moleküler tespit testi Salmonella kit protokolünü takip edin. 48 oyuklu blokta kültürleri birkaç kez yukarı ve aşağı pipetleyerek karıştırın. Her numuneden 20 μL'yi kit tarafından sağlanan lizis tüpüne pipetleyin.
- Numuneleri 100 °C'de 15 dakika ısıtın. Çözelti pembeden sarıya dönecektir. Numuneleri oda sıcaklığında 10 dakika inkübe edin. Çözelti sarıdan pembeye değişecektir.
- 20 μL lizatı bir reaktif tüpüne aktarın ve reaktif tüplerini tutucuya yükleyin.
- Tutucuyu MDS cihazına ekleyin ve yazılımı, kit ve numune hakkındaki bilgileri iletecek şekilde yapılandırın. Cihaz, her bir kuyucuğun tahlil için lot numarası ve bir numune adı ile etiketlenmesini gerektirir. MDS yazılımını çalıştırın ve raporu dışa aktarın.
9. Veri analizi
- Olumlu ve olumsuz sonuçların sınıflandırılması.
- 4 x 6 damla kaplama için, en az 1 koloni pozitif olan agar plakalarındaki lekeleri ve negatif olarak büyüme olmayan agar plakalarındaki lekeleri değerlendirin.
- qPCR için, Ct'si 30'a eşit veya daha düşük olan kuyucukları pozitif olarak ve Ct'si 30'dan büyük olan kuyuları negatif olarak değerlendirin.
- MDS için, MDS sisteminden alınan ve pozitif veya negatif olarak bildirilen sonuçları kullanın.
- MPN hesaplaması
- Daha önce açıklanan basit maksimum olasılık çözünürlüğü (SMPR) yöntemini,6 veya alternatif doğrulanmış MPN hesaplayıcılarını kullanarak açıklamalı pozitifleri ve negatifleri analiz edin. 10
Sonuçlar
Işınlanmış et
Regresyon analizinde, 1'lik bir eğim, bağımsız değişkendeki (x ekseni) her birim artış için, bağımlı değişkenin (y ekseni) tam olarak 1 birim arttığını gösterir. Bu, iki değişken arasında orantılı bir ilişki olduğunu gösterir, yani bağımlı değişkendeki değişim, bağımsız değişkendeki değişikliği yansıtır. 0'lık bir kesişim, bağımsız değişken 0 olduğunda, bağımlı değişkenin de 0 olduğu anlamına gelir. Bu, iki değişken arasındaki ilişkide sabit bir sapma veya yanlılık olmadığını göstermektedir. Birlikte, 1'lik bir eğim ve 0'lık bir kesişim,11,12 değişkenleri arasındaki uyumu gösterir. Bu ideal senaryo, sistematik bir hata veya yanlılık olmadığını gösterir ve ölçümlerin tahminlerle mükemmel bir şekilde uyumlu olduğu iyi kalibre edilmiş bir sistemde beklenen sonuç olacaktır.
Şekil 3A , adım 3.1.1'deki notta tartışılan yayılmış plaka analizi ile doğrulanan teorik aşılamaya karşı çizilen MPN-LAMP testini (y ekseni) sunar. (X ekseni). R² değeri 0.978 olan regresyon çizgisi denklemi, y = -72.36 + 0.161x, MPN-LAMP sonuçları ile aşılanmış bakteri seviyeleri arasında güçlü bir doğrusal korelasyon olduğunu gösterir. Yüksek R² değeri, MPN-LAMP testinin bakteriyel kontaminasyonun kantitatif tahmininde oldukça güvenilir olduğunu göstermektedir. Bununla birlikte, 0.161'lik eğim, 1'lik ideal eğimden önemli ölçüde sapmaktadır, bu da MPN-LAMP yönteminin aşılamayı hafife aldığını ve teorik aşılamadaki bakteri konsantrasyonunun sadece% 16.1'ini tahmin ettiğini göstermektedir. Ek olarak, -72.36'lık negatif kesişme, daha düşük konsantrasyonlarda negatif bir yanlılığa işaret eder ve idealden daha da sapar.
Şekil 3B , teorik aşılamaya (x ekseni) karşı çizilen MPN-qPCR yöntemini (y ekseni) göstermektedir. R² değeri 0.978 olan regresyon çizgisi, y = -46.84 + 0.0395x, MPN-qPCR testi ile teorik aşılama arasında güçlü bir doğrusal ilişki olduğunu göstermektedir. Yüksek R² sağlam bir korelasyona işaret etse de, 0.0395'lik eğim MPN-LAMP sonuçlarından bile daha küçüktür, bu da MPN-qPCR ile bakteriyel kontaminasyonda daha büyük bir hafife alma derecesi olduğunu düşündürür. -46.84'lük negatif kesişme, daha düşük konsantrasyonlarda potansiyel bir aşağı yönlü eğilimi daha da gösterir.
Şekil 3C , y = -330.4 + 0.3138x'lik bir regresyon denklemi ve 0.944'lük bir R² değeri ile teorik aşılamaya (x ekseni) karşı çizilen MPN kaplama sonuçlarını (y ekseni) sunar. Bu R² değeri güçlü bir doğrusal ilişkiye işaret etse de, MPN-LAMP ve MPN-qPCR sonuçlarından biraz daha düşüktür ve bu da koloni nicelemesinde daha fazla değişkenlik olduğunu düşündürür. 0.3138'lik eğim, diğer yöntemlerde gözlemlenen eğimlerden daha yüksek olmasına rağmen, teorik aşılamaya göre bakteri konsantrasyonunun hala hafife alındığını göstermektedir. Ek olarak, -330.4'lük negatif kesişme, özellikle düşük konsantrasyonlarda, kaplama tekniklerinde veya numune işlemede potansiyel yanlışlıklara işaret edebilecek önemli sapmaya işaret eder. R²'deki bu hafif azalma ve gözlenen değişkenlik, geleneksel kaplama işleminin moleküler yöntemlerden daha değişken olduğunu gösterebilir.
Karşılaştırma yöntemleri
Her üç yöntem de (MPN-LAMP, MPN-kaplama ve MPN-qPCR), teorik aşılamaya göre bakteri seviyelerini hafife alma eğilimi gösterdi. Bu hafife alma, Salmonella'nın işleme sırasında tavuk yüzeyinden veya partikül maddeden tam olarak ayrılamadığı ve durulama veya tahlillere transferini azalttığı hücre geri kazanım sorunlarına bağlanabilir. Salmonella doğrudan tavuğa aşılandığından, bakteri hücrelerinin bir kısmı yüzeye güçlü bir şekilde bağlanabilir ve durulama adımındaki iyileşmeyi sınırlayabilir. Ek olarak, bazı hücreler santrifüjlemeden sonra peletteki partikül maddeye bağlı kalabilir ve bu da geri kazanımı daha da azaltır. Enzimatik tedaviler, mekanik işleme veya optimize edilmiş mide protokolleri gibi yaklaşımlar bakteri dekolmanını artırabilir. Bu stratejiler, geri kazanım oranlarını iyileştirme potansiyelleri vurgulanarak tartışma bölümünde daha ayrıntılı olarak tartışılmaktadır
Şekil 4A , x eksenindeki üç MPN yöntemine karşı y eksenindeki kurtarmayı sunar. MPN değerinin teorik aşılama seviyesine oranı olarak hesaplanan geri kazanım yüzdesi aşağıdaki sonuçları vermiştir: MPN-LAMP yöntemi, %10,04'lük bir standart sapma ile ortalama %15,19'luk bir geri kazanıma sahipti; MPN kaplama yöntemi, %11.45'lik bir standart sapma ile ortalama %13.13'lük bir iyileşmeye sahipti; MPN-qPCR yönteminde ise ortalama iyileşme %6.67 ve standart sapma %3.19 olarak ölçüldü. Bir Tukey-Kramer HSD testi, yöntemler arasında iyileşmede istatistiksel olarak anlamlı bir fark tanımlamadı (P > 0.1969), bu da Salmonella ile aşılanmış tavuğu işlerken her üç yöntemin de geri kazanım açısından benzer şekilde performans gösterdiğini düşündürdü.
Salmonella'yı tavuk matrisinden ayırmak için yöntemler arasında aynı tedaviye rağmen, MPN-LAMP, MPN-qPCR ve MPN kaplaması arasında tespitte farklılıklar gözlenmiştir. Bu, bakterilerin numuneden fiziksel olarak ayrılmasının ötesindeki faktörlerin algılamayı etkileyebileceğini düşündürmektedir. Numune matrisindeki inhibitörlerin varlığı, duyarlılıklarını ve genel performanslarını etkileyen moleküler yöntemlere (qPCR ve LAMP) müdahale edebilir. Ek olarak, bakteriyel canlılık, Salmonella'nın sıvı et suyuna (qPCR, LAMP) karşı katı agar plakaları (MPN kaplama) üzerinde büyüme yeteneğini etkilemiş olabilir ve bu da yöntemler arasında geri kazanımda farklılıklara yol açmış olabilir.
Yöntemlerin hassasiyetini daha fazla araştırmak için, önce yedi bağımsız çalışmada MPN-LAMP, MPN-qPCR ve MPN kaplama için her seyreltmede pozitif yanıtların sayısını inceledik (Tablo 2). Daha düşük seyreltmelerde (1 x 10-5 ve 1 x 10-4), MPN-LAMP, hem MPN kaplamasına hem de MPN-qPCR'ye kıyasla daha fazla sayıda pozitif yanıt gösterdi, bu da LAMP yönteminin düşük Salmonella konsantrasyonlarına karşı daha hassas olduğunu düşündürdü. Numuneler daha konsantre olduğunda (1 x 10-3'ten daha az seyreltmeler), her üç yöntem de pozitif tespitlerde bir artış gösterdi ve tüm yöntemlerin benzer sayıda pozitif numune tespit ettiği 1 x 10-2 seyreltme civarında yakınsama meydana geldi.
Şekil 4B , üç yöntem boyunca her bir seyreltmede pozitif ölçümlerin yüzdesini sunarak, Salmonella'yı tespit etmedeki duyarlılıklarının doğrudan bir karşılaştırmasını sağlar. Pozitif yanıtların yüzdesi, seyreltme serileri boyunca yöntem performansının daha net bir şekilde görselleştirilmesini sağlar ve %95'ten ± Clopper-Pearson güven aralıklarını (CI) temsil eden hata çubukları, her düzeydeki değişkenlik hakkında bilgi sağlar. Daha düşük seyreltmelerde, daha geniş güven aralıkları, her bir yöntemin algılama performansında daha fazla değişkenlik olduğunu gösterir. Ham pozitif tespit sayısıyla tutarlı olarak, MPN-LAMP, en seyreltik konsantrasyonlarda (1 x 10-5) daha yüksek bir pozitif numune yüzdesi tespit ederken, MPN-qPCR ve MPN kaplama daha az pozitif tespit eder. Bakteri konsantrasyonu arttıkça, yöntemler birleşir ve her üç yaklaşım da daha yüksek konsantrasyonlarda (örneğin, 1 x 10-2 ve üstü) %100'e yakın algılama gösterir. Bu yüksek konsantrasyonlarda güven aralıklarının daralması, tüm yöntemlerde daha fazla tutarlılık olduğunu gösterir ve bakteri seviyeleri daha yüksek olduğunda karşılaştırılabilir performanslarını vurgular.
Şekil 3'teki bulgular, her üç yöntemin de tutarlı bir şekilde eksik tahmin edilmesinin (nicel olarak), Salmonella'nın numune matrisinden eksik ayrılmasından kaynaklanabileceğini düşündürmektedir. Bununla birlikte, moleküler inhibitörler veya bakteriyel canlılık faktörleri, farklı seyreltmelerde (kalitatif olarak) ve farklı yöntemlerde (kalitatif ve kantitatif olarak) tespitte gözlenen varyasyonu yönlendiriyor olabilir. Şekil 4B'deki daha yüksek konsantrasyonlarda daha sıkı güven aralıkları, yöntemler arasında daha az değişkenlik ve daha tutarlı kalitatif performansı gösterirken, daha düşük konsantrasyonlardaki daha geniş aralıklar, kalitatif algılamada artan belirsizliğe işaret etmektedir.
Pişirmeye hazır tavukta tespit
Pişirmeye hazır tavukta Salmonella'nın tespiti için LAMP yöntemini, en düşük Salmonella seyreltmesinde test edilen diğer yöntemlerden daha fazla sayıda pozitif örnek (%14,3) gösterdiği için seçtik. En düşük Salmonella seyreltmesinde (1 x 10-5), numunelerin hiçbiri kurum içi qPCR yöntemi ile pozitif olarak tespit edilmedi. Öte yandan, bazı pozitifler kaplama ile tespit edildi (% 7.1, LAMP tarafından tespit edilen sayının yarısı). Bununla birlikte, bu kültür bazlı yöntemden elde edilen sonuçlar, numuneler ışınlanmadığı için arka plan mikroflorasının varlığının sonuçları çarpıtabileceği pişirmeye hazır tavuk gibi daha karmaşık ürünlere geçerken etkilenebilir. Bu nedenlerden dolayı, pişirmeye hazır tavuktan Salmonella'nın miktar tayini için MPN-LAMP yöntemini araştırmaya karar verdik.
Şekil 5 , aşılanmış, dondurulmuş, pişirmeye hazır tavuk cordon bleu örneklerinde Salmonella'yı ölçmek için kullanılan MPN-LAMP testinin sonuçlarını göstermektedir. Teorik aşılama seviyesi (CFU/g) x ekseninde çizilirken, karşılık gelen MPN-LAMP ölçümleri y ekseninde çizildi. Regresyon analizi, y = -15.04 + 0.3869x denklemini verdi ve 0.933'lük bir belirleme katsayısı (R²) ile teorik aşılama ile MPN-LAMP sonuçları arasında güçlü bir doğrusal korelasyon olduğunu gösterdi. Bu yüksek R² değeri, MPN-LAMP yönteminin bu numunelerde Salmonella'yı güvenilir bir şekilde ölçtüğünü göstermektedir, ancak 0.3869'luk eğim, yöntemin gerçek aşılama seviyesini hafife aldığını göstermektedir. Regresyon çizgisinin etrafındaki gölgeli alan %95 güven aralığını temsil eder.
MPN-LAMP'nin daha düşük aşılama seviyelerindeki performansını daha iyi göstermek için, Şekil 5'teki iç grafik, 300 CFU/g'nin altındaki veri noktalarını yakınlaştırır. Regresyon denklemine dayanarak, alt tespit limiti yaklaşık 40 CFU/g (38,9 CFU/g) olarak tahmin edilebilir. Bununla birlikte, %95 güven aralığı, herhangi bir negatif MPN-LAMP değerinin sıfır olarak yorumlanması gerektiğinden, pratik alt tespit sınırının 325 CFU/g'ye daha yakın olduğunu göstermektedir. Ekteki kırmızı çizgi sıfırı temsil eder ve hiçbir veri noktası bu çizginin altına düşmese de, özellikle düşük aşılama seviyelerinde değerlerin sıfırın altına düşme potansiyeli, yanlış negatif sonuç olasılığını ortaya çıkarır. Bu eğilim, Salmonella'yı düşük konsantrasyonlarda doğru bir şekilde ölçmenin zorluklarını vurgulamaktadır ve alt tespit sınırını kesin olarak belirlemek için ek veriler gerekli olacaktır.

Şekil 1: Salmonella tespiti için modifiye edilmiş MPN testinin blok diyagramı. Değiştirilmiş En Olası Sayı (MPN) testine şematik bir genel bakış. Işınlanmış öğütülmüş tavuk numunelerinin aşılanmasıyla başlayan, ardından numune homojenizasyonu, santrifüjleme, alikot dağıtımı ve belirtilen koşullar altında inkübasyon ile devam eden süreçteki temel adımları ana hatlarıyla belirtir. Şekil, Basit Maksimum Olasılık Çözünürlüğü (SMPR) hesaplaması için pozitif ve negatif sonuçlar üretmek için kullanılan üç teknikle birlikte seyreltme ve çoğaltma büyümesi için kullanılan 48 kuyulu bloğun fotoğraflarını içermektedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Damla plakası testinin şeması. 48 oyuklu bloktan belirli bir seyreltme (örneğin, seyreltilmemiş, 10-1, 10-2, vb.) için damla plakası tahlili kurulumu. Her numune, çok kanallı bir pipet kullanılarak bir agar plakası üzerinde 4 x 6 ızgara formatında kaplanır. Düzen, geleneksel 6 x 6 ızgaradan iki adet 4 x 6 ızgaraya değiştirildi ve sekiz seyreltmeden altı kopyanın yerleştirilebilmesini sağladı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Aşının MPN yöntemleri ile karşılaştırılması. (A) Kaplama (x ekseni) ile doğrulanan teorik aşılamaya karşı MPN-LAMP konsantrasyonunun (y ekseni) bir grafiği. Bir belirleme katsayısına (R² = 0.978) sahip uygun bir regresyon çizgisi (y = -72.36 + 0.161x) güçlü bir doğrusal ilişki gösterir. (B) Teorik inokuluma (x ekseni) karşı, uygun bir regresyon çizgisi (y = -46.84 + 0.0395x) ve R² = 0.978 ile MPN-qPCR konsantrasyonunun (y ekseni) bir grafiği, benzer şekilde güçlü bir korelasyon gösterir. (C) Bir regresyon çizgisi (y = -330.4 + 0.3138x) ve R² = 0.944 ile teorik aşılamaya (x ekseni) karşı MPN kaplama konsantrasyonunun (y ekseni) bir grafiği, LAMP ve qPCR'den daha güçlü ancak biraz daha düşük bir korelasyonu gösterir. Her şekil için regresyon denklemi ve belirleme katsayısı, grafiklerin sol üst köşesinde bir ek olarak sunulur. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: MPN yöntemlerinin karşılaştırılması. (A) Şekil, MPN değerinin MPN-LAMP, MPN-kaplama ve MPN-qPCR yöntemleri için teorik aşılama seviyesine oranı olarak hesaplanan geri kazanım yüzdesini göstermektedir. MPN-LAMP yönteminde ortalama iyileşme %15.19 (%±10.04), MPN-kaplama yönteminde ortalama %13.13 (%± %11.45) ve MPN-qPCR yönteminde ortalama %6.67 (%± %3.19) iyileşme saptandı. Kutu grafikleri, kurtarma verilerinin dağılımını vurgular ve aykırı değerler belirtilir. Hata çubukları, çeyrekler arası aralığın (IQR) 1,5 katı içindeki veri aralığını temsil eder. (B) Üç yöntemde her seyreltmede pozitif Salmonella tespitlerinin yüzdesi: MPN-LAMP (mavi), MPN-kaplama (kırmızı) ve MPN-qPCR (yeşil). X ekseni seyreltme seviyelerini (10-6 ila 10) temsil eder ve y ekseni pozitif ölçümlerin yüzdesini gösterir. Hata çubukları, her yöntem için algılamadaki değişkenliği yansıtan ± %95 Clopper-Pearson güven aralıklarını gösterir. MPN-LAMP, daha düşük seyreltmelerde diğer yöntemlere göre daha yüksek algılama yüzdeleri gösterirken, tüm yöntemler daha yüksek konsantrasyonlarda %100'e yakın algılamayı birleştirir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
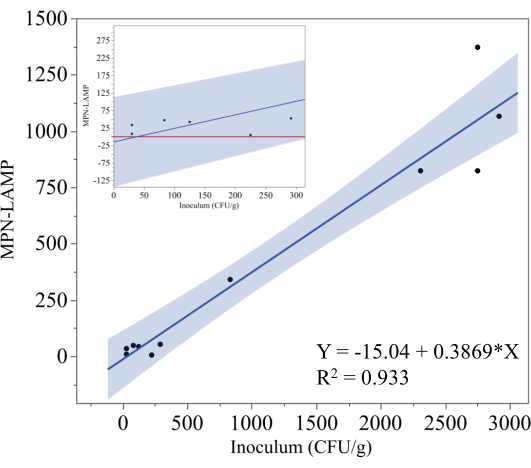
Şekil 5: Pişirmeye hazır tavuk için MPN yöntemi. MPN-LAMP sonuçlarının dondurulmuş, pişirmeye hazır tavuk cordon bleu örneklerinde Salmonella'nın teorik aşılama seviyesine karşı regresyon analizi. Regresyon çizgisi, 0.933'lük bir R² ile y = -15.04 + 0.3869x ile temsil edilir ve bu da güçlü bir doğrusal ilişkiyi gösterir. Gölgeli bölge %95 güven aralığını temsil eder. İç kısım, daha düşük aşılama seviyelerinde MPN-LAMP ölçümlerine odaklanır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| 1 | 2 | 3 | 4 | 5 | 6 | |
| A | n=1 olur | n=1 olur | n=1 olur | n=1 olur | n=1 olur | n=1 olur |
| B | 2 | 2 | 2 | 2 | 2 | 2 |
| C | 3 | 3 | 3 | 3 | 3 | 3 |
| D | 4 | 4 | 4 | 4 | 4 | 4 |
| E | 5 | 5 | 5 | 5 | 5 | 5 |
| F | 6 | 6 | 6 | 6 | 6 | 6 |
| G | 7 | 7 | 7 | 7 | 7 | 7 |
| H | 8 | 8 | 8 | 8 | 8 | 8 |
| 100 | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 |
Tablo 1: 48 oyuklu bir bloktaki replikasyonların ve seyreltmelerin şeması. Bu şekil, 48 oyuklu blok içindeki replikaların ve seri 10 katlı seyreltmelerin düzenini göstermektedir. Her sütun, 100 ile 10-5 arasında değişen belirli bir seyreltme faktörünü temsil eder ve her seyreltme için sekiz satıra dağıtılan teknik kopyalar bulunur.
| Seyreltme | ||||||
| 10-5 | 10-4 | 10-3 | 10-2 | 10-1 | 100 | |
| MPN-LAMBA | 8 | 16 | 31 | 3 | 56 | 56 |
| MPN kaplama | 4 | 11 | 32 | 55 | 56 | 56 |
| MPN-qPCR (MPN-qPCR) | 0 | 7 | 26 | 55 | 56 | 56 |
Tablo 2: Olumlu olayların sayısı. Tablo, pozitif reaksiyonların sayısını gösterir (toplam 56'dan fazla tekrar). Sonuçlar, sütunların seyreltmeyi temsil ettiği ve satırların yöntemi temsil ettiği bir tablo halinde düzenlenir.
Tartışmalar
Protokolün önemi
Salmonella, özellikle gıda kaynaklı hastalık salgınlarında sıklıkla rol oynayan kümes hayvanı ürünlerinde, gıda güvenliğinde önemli bir endişe kaynağı olmaya devam etmektedir13,14. Amerika Birleşik Devletleri'nde bakteriyel gıda kaynaklı hastalıkların önde gelen bir nedeni olarak, hem taze hem de pişirmeye hazır kümes hayvanı ürünlerinde Salmonella'yı tespit etmek için güvenilir yöntemler, gıda güvenliğini sağlamak için kritik öneme sahiptir15. Salmonella'yı düşük seviyelerde ölçme yeteneği, aksi takdirde tespit edilemeyecek kontaminasyonu belirlemek için hayati önem taşır. Yöntem hassasiyeti, mevzuata uygunluk ve halk sağlığı için özellikle önemlidir, çünkü düşük dozlarda Salmonella bile özellikle savunmasız popülasyonlarda hastalığa neden olabilir.
MPN-LAMP testi, kontaminasyon4 prevalansını belirlemek için şu anda FSIS tarafından MLG 4.15'te kullanılan MDS sistemini kullanır. Burada sunulan tahlil, düşük seviyelerde bile canlı Salmonella'yı ölçmek için mevcut FSIS yönteminin bir uzantısını sağlar ve kontaminasyon seviyesi hakkında daha kesin veriler sağlar. Bu çalışmadan elde edilen sonuçlar, MPN-LAMP yöntemi ile teorik aşılama değerleri arasında 0.933 R² ile güçlü bir korelasyon olduğunu göstermiştir (Şekil 5). Bu, yöntemin gıdalardaki Salmonella'yı ölçmek için güvenilir olduğunu düşündürmektedir, ancak daha düşük aşılama seviyelerinde bir miktar hafife alma meydana gelmiştir.
Kritik adımlar
Salmonella miktar tayini protokolü, numune hazırlama, aşılama ve moleküler analizde hassasiyet gerektirir. Uygun aseptik teknik, doğru seyreltmeler ve inkübasyon koşullarına bağlılık, Salmonella'nın güvenilir tespiti ve sayımı için çok önemlidir. Kanatlı numunelerinin ve ortamlarının transferi sırasında steril koşulların sağlanması, kontaminasyonu önlemek için çok önemlidir.
Aynı derecede önemli olan, mideleme sırasında numunelerin homojenizasyonu ve ardından bakterileri gıda matrisinden ayırmak için santrifüjlemeyi takiben peletin dikkatli bir şekilde yeniden süspansiyon edilmesidir. Bu adımlar sırasında uygun kullanım, canlı hücrelerin daha fazla analiz için geri kazanılmasını sağlar. MPN kurulumu için seri seyreltme prosesi sırasında doğru pipetleme, tutarlı inkübasyon koşullarıyla birleştiğinde, tekrarlanabilir sonuçlar elde etmek için çok önemlidir.
Son olarak, qPCR gibi moleküler tespit yöntemleri, yanlış negatifleri önlemek için DNA ekstraksiyonu ve qPCR döngüsünde hassasiyet ve tekrarlanabilirlik gerektirir. DNA ekstraksiyonu doğası gereği değişken olmasına rağmen, standartlaştırılmış reaktifler ve prosedürler, inhibitör girişimini en aza indirerek ve DNA geri kazanımını iyileştirerek tekrarlanabilirliği sağlar. Bu adımlar, Salmonella'nın varlığını doğrulamak ve geleneksel kaplama ve zenginleştirme yöntemlerindeki sınırlamaların üstesinden gelmeye yardımcı olabilecek spesifik genetik belirteçleri hedeflemek için temeldir.
Olası tuzaklar ve sınırlamalar
Bakteriyel canlılık
MPN kaplama gibi büyümeye dayalı bir tahlilin uygulanmasının başlıca zorluklarından biri bakteri canlılığıdır ve bu özellikle karmaşık pişirmeye hazır tavuk numuneleri için geçerlidir. Chicken cordon bleu gibi dondurulmuş, panelenmiş ve doldurulmuş tavuk ürünleri, her ikisi de Salmonella hücrelerini strese sokabilen ve büyüme bazlı tahlillerde patojenin tespit edilmesini zorlaştırabilen sıcaklık dalgalanmalarına ve uzun depolama sürelerine özellikle eğilimlidir. Ek olarak, tavuk olmayan bileşenlerin (örneğin peynir, ekmek, jambon, baharatlar, tereyağı) varlığı, gıda matrisinde daha fazla karmaşıklığa neden olur ve zenginleştirme aşamaları sırasında Salmonella'nın büyümesini engelleyerek doğru miktar tayinini zorlaştırabilir. Ek olarak, Salmonella , özellikle çiğ tavuğa göre mikrobiyotaya çeşitlilik katan birden fazla bileşen içeren pişirmeye hazır numuneler için geçerli olan kültür tabanlı yöntemlerde16 arka plan mikroplarına karşı rekabet etmelidir. Son olarak, antimikrobiyaller gibi stres faktörlerinin kullanılması ve işlenmesi Salmonella iyileşmesini etkileyebilir17.
Bakteriyel canlılık, bu çalışmada test edilen yöntemlerin performansını etkilemiş olabilir. Tüm yöntemler düşük seviyelerde Salmonella konsantrasyonlarını hafife almış ve daha düşük patojen konsantrasyonlarında daha yüksek tespit değişkenliğine sahip olmuştur (Şekil 4A,B). Bununla birlikte, moleküler bazlı MPN-LAMP yöntemi, daha düşük aşılama seviyelerinde kalitatif tespitte MPN kaplama ve MPN-qPCR'den daha iyi performans gösterdi. Sonuçlar, düşük patojen konsantrasyonlarında arıtma ihtiyacını vurgulamaktadır.
Örnek heterojenliği
Bir diğer önemli sınırlama, Salmonella tespit sonuçlarında değişkenliğe neden olabilen gıda numunelerinin heterojenliğini içerir. Protokol, 30 mL homojenize numuneyi dağıtmak için tasarlanmıştır ve 8 kopyanın blok boyunca 3 mL alikot (toplam 24 mL, 6 mL fazla) olarak dağıtılmasına izin verir. Bu muhafazakar yaklaşım (fazladan bir örneklemle sonuçlanır) potansiyel kayıpları hesaba katarken, tüm hacim test edilmediği için alt örneklemeyi devreye sokar.
Gıda numunesinin heterojenliği, numuneleri yeniden dağılmış karışımdan bloğa aktarırken ve seyreltmeler gerçekleştirirken ölçüm doğruluğunu etkileyebilir18,19. Numune Alma Teorisine (TOS) göre, temel numune alma hataları, numune kütlesinin arttırılması veya partikül boyutunun azaltılması yoluyla bileşim heterojenliğinin azaltılması yoluyla azaltılabilir20. Bununla birlikte, bazı çalışmalar, matrisin mide yoluyla parçalanmasının yüzey kontaminasyonundan bakteri geri kazanımını önemli ölçüde etkilemediğini gösterse de, gıda matrisinin partikül boyutunun azaltılmasının bazı durumlarda bakteri geri kazanımını azalttığı gösterilmiştir 21,22,23. Bu çalışmada, zenginleştirmeden önce mideye indirilerek partikül boyutu küçültüldü; Bu, numunelerdeki bileşim heterojenliğini azaltarak numune alma hatasını azaltabilirken, mide ve santrifüjleme bakteri geri kazanımını etkileyebilir.
Son olarak, gıdanın heterojen bileşimi ve morfolojisinin yanı sıra kontaminasyonun iç veya yüzeyde olup olmadığı, patojen geri kazanımında değişkenliğe yol açabilir. Önceki çalışmalar18,22, doku yüzeylerine güçlü bakteri bağlanmasının iyileşme oranlarını azaltabileceğini göstermiştir. Tripsin, kollajenaz ve endopeptidaz gibi enzimlerin et ve kümes hayvanı matrislerinden 24,25 ve pektinaz ve selülazın yapraklı yeşilliklere19 salınması için kullanıldığı çalışmalar, gıda matrislerinden Salmonella geri kazanımını iyileştirme potansiyelini göstermektedir.
Sorun giderme önerileri
Sorunları önlemek için tüm ortamların ve reaktiflerin taze hazırlanmış ve steril olduğundan emin olun. Son kullanma tarihi geçmiş veya uygun olmayan şekilde sterilize edilmiş malzemeler kontaminasyona yol açabilir veya Salmonella'nın büyümesini etkileyebilir. Kontaminasyon gözlenirse, aseptik tekniğin, özellikle numune aşılama, seyreltme, alikotasyon ve kaplama sırasında protokol boyunca tutarlı bir şekilde takip edildiğini doğrulayın.
Koloni sayıları beklenenden düşük olduğunda, seri seyreltmelerin ve aşı konsantrasyonlarının doğruluğunu doğrulamak hataların belirlenmesine yardımcı olabilir. Optimum Salmonella büyümesini desteklemek için sıcaklık, süre ve çalkalama dahil olmak üzere kuluçka koşulları dikkatle izlenmelidir. Büyümenin düşük olduğu veya hiç olmadığı durumlarda, yetersiz mide veya torbalardan sızıntı, bakterilerin eşit olmayan dağılımına katkıda bulunabilir.
Moleküler algılama tutarsız sonuçlar verirse, DNA ekstraksiyon prosedürlerini kontrol etmek ve primerlerin ve probların kalitesini doğrulamak kilit adımlardır. Ayrıca, gıda matrisleri arasındaki değişkenlik, dahili amplifikasyon kontrolü (IAC) kullanılarak izlenebilen farklı inhibisyon seviyeleri sunabilir. Ekstraksiyon reaktiflerinin uygun şekilde depolanması ve işlenmesi, bozunma veya kontaminasyon nedeniyle yanlış negatifleri önlemek için çok önemlidir. Daha verimli DNA ekstraksiyon yöntemleri de garanti edilebilir.
Mekanik, termal ve enzimatik eylemler kullanan GentleMACS sistemi26 gibi işlemlerin dahil edilmesi, gıdalardan bakteri geri kazanımını daha da optimize edebilir. Bu sistem, gıda matrisinin heterojenliğini azaltabilir, bu da tek tip numunelerin bloğa aktarılmasını ve doğru seri seyreltmelerin gerçekleştirilmesini kolaylaştırır.
Potansiyel iyileştirme ve genişletme
Bu protokolü iyileştirmek ve genişletmek için çeşitli fırsatlar vardır. Alternatif zenginleştirme ortamı formülasyonlarının araştırılması, özellikle tavuk cordon bleu gibi karmaşık gıda matrislerinden stresli veya ölümcül şekilde yaralanmış Salmonella hücrelerinin geri kazanımını iyileştirebilir. Seçici agar, Salmonella'yı hedeflemek için yaygın olarak kullanılırken, işleme ve saklama koşulları nedeniyle yaralanan veya strese giren hücreler bu tür ortamlarda yanlış negatiflere yol açabilir. Bu zorluğun üstesinden gelmek için, seçici basınç ve mikrobiyal geri kazanım arasındaki dengeyi optimize etmek, standart zenginleştirme koşulları altında daha az rekabetçi olan Salmonella serovarlarının tespitini artırabilir. Bu arıtma, özellikle mikrobiyal stresin yaygın olduğu zorlu gıda ürünlerinde genel tahlil hassasiyetini artırabilir. Kuluçka sürelerinin kısaltılması, sonuçlara ulaşma süresini hızlandırabilir, ancak bu, hassasiyeti azaltabilir ve algılamayı sınırlayabilir. Gelecekteki çalışmalar, hızlı bakteri replikasyonunu desteklemek için zenginleştirme ortamındaki gelişmeleri keşfetmeli ve paydaş gereksinimlerini karşılarken doğru miktar tayinini sağlamalıdır.
Ayrıca, MPN tahlili için farklı inkübasyon sıcaklıklarının ve sürelerinin araştırılması, çeşitli kümes hayvanı ürünlerinden Salmonella geri kazanımını optimize edebilir. Bu, protokolün farklı büyüme koşulları gerektiren diğer gıda kaynaklı patojenlere uygulanabilirliğini genişletebilir ve böylece gıda güvenliği testindeki faydasını genişletebilir. Otomasyon, alıntılama ve seyreltme adımları için robotik sıvı işleyicileri entegre ederek bu protokolün ölçeklenebilirliğini artırabilir. Sürekli akışlı santrifüjler veya yüksek kapasiteli santrifüj sistemleri, endüstriyel ortamlarda yüksek verimli uygulamalara olanak tanıyarak toplu işleme sınırlamalarını da ele alabilir.
Moleküler algılama yönünün multipleks PCR'yi içerecek şekilde genişletilmesi, birden fazla patojenin aynı anda tespit edilmesini sağlayarak gözetim ve test ortamlarındaki verimi artırabilir. Ek olarak, yeni nesil dizilemenin (NGS) dahil edilmesi, doğrudan MPN zenginleştirme kültürlerinden değerli serotip ve virülans bilgileri sağlayarak epidemiyolojik araştırmaları ve kaynak izleme çabalarını kolaylaştırabilir.
Son olarak, MPN'de kullanılan numunelerin miktarı artırılarak nicelleştirme/algılama sınırı genişletilebilir. Örneğin, et numunesinin ağırlığı 25 g'dan 325 g'a yükseltildiyse, tespit limiti doğrusal regresyon denklemi kullanılarak 4 CFU/g'ye tahmin edilebilir. Bununla birlikte, aynı nispi %95 güven aralığını varsayarsak, nicelemenin pratik alt sınırı >30 CFU/g'dir.
Son
Bu çalışmada MPN-LAMP testinin geliştirilmesi, kanatlı ürünlerinde Salmonella kontaminasyonunun miktarını belirlemek için değerli ve pratik bir araç sunmaktadır. Teorik aşılama seviyeleriyle (R² = 0.933) güçlü bir korelasyona sahip olan yöntem, gıda güvenliği ve mevzuata uygunluk için kritik olan düşük seviyelerde Salmonella'yı güvenilir bir şekilde tespit eder. Bu yetenek, aksi takdirde fark edilmeyebilecek kontaminasyonu tespit etmede özellikle önemlidir ve üreticilerin potansiyel riskleri proaktif olarak ele almasına olanak tanır. MPN-LAMP testi, geleneksel yaygınlığa dayalı yöntemlere nicel bir alternatif sunarak, daha karmaşık pişirmeye hazır ürünler de dahil olmak üzere çeşitli kümes hayvanı ürünlerinde bir düzeyde Salmonella kontaminasyonu sunar.
Bu yöntemin en güçlü yönlerinden biri, farklı gıda matrislerine, özellikle de ekmek ve peynir gibi ek bileşenlerin varlığı nedeniyle geleneksel yöntemlerin zorlanabileceği tavuk cordon bleu gibi dondurulmuş ve işlenmiş ürünlere uyarlanabilirliğinde yatmaktadır. LAMP ve qPCR gibi moleküler tekniklerin MPN testi ile entegrasyonu, arka plan mikroplarının ve işleme koşullarının yarattığı zorlukların üstesinden gelerek algılama için kapsamlı bir yaklaşım sağlar. Bu moleküler yöntemler, protokolün hassasiyetini artırarak, Salmonella ile ilgili salgın riskini azaltma potansiyeline sahip, rutin gıda güvenliği testlerinde ve kontaminasyon gözetiminde çok yönlü bir araç haline getirir.
Tek bir tespit yöntemi sınırsız olmasa da, MPN-LAMP testi, bir dizi aşı seviyesi ve gıda matrisinde tutarlı performans gösterir. Daha düşük aşılama seviyelerindeki değişkenlik, geri kazanımı en üst düzeye çıkarmak için numune hazırlama ve ortam formülasyonlarının optimize edilmesi gibi gelecekteki iyileştirmeler yoluyla ele alınabilir, ancak bu, protokolün genel sağlamlığını azaltmaz. MPN-LAMP yöntemi, zorlu koşullar altında bile Salmonella hücrelerinin doğru bir şekilde tespit edilmesini sağlayarak, gıda endüstrisini halk sağlığını korumak için paha biçilmez bir araçla donatır.
İleriye baktığımızda, tahlili daha fazla Salmonella serovarı içerecek şekilde genişletmek veya daha iyi patojen karakterizasyonu için yeni nesil dizilemeyi dahil etmek gibi daha fazla geliştirme için yer vardır. Bununla birlikte, bu protokol halihazırda Salmonella tespiti ve miktarının belirlenmesinde önemli bir ilerlemeyi temsil etmekte ve gıda güvenliği testinin artan taleplerini karşılayan pratik, verimli ve güvenilir bir yöntem sağlamaktadır.
Açıklamalar
Tüm yazarlar herhangi bir çıkar çatışması olmadığını beyan eder.
Teşekkürler
Bu araştırma, ABD Tarım Bakanlığı, Tarımsal Araştırma Servisi (USDA-ARS), Ulusal Program 108, Güncel Araştırma Bilgi Sistemi numaraları 8072-42000-093-000-D ve 8072-42000-094-000-D tarafından desteklenmiştir. Bu makalede ticari adlardan veya ticari ürünlerden bahsedilmesi, yalnızca belirli bilgiler sağlama amaçlıdır ve ABD Tarım Bakanlığı tarafından tavsiye veya onay verildiği anlamına gelmez. USDA, fırsat eşitliği sağlayıcısı ve işverenidir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 48 deep well block 4.6ml | Fisher Scientific International, Inc | NC1964628 | |
| Agar - Solidifying Agent (Difco) | Becton, Dickinson and Company (BD) | 281230 | |
| Analytical Balance | Mettler Toledo | JL602-G/L | Equipment |
| Analytical Balance | Mettler Toledo | AB54-S | Equipment |
| Autoclave - Amsco Lab250, Laboratory Steam Sterilizer | Steris plc | LV-250 | Equipment |
| Biological Safety Cabinet, Type A2, Purifier Logic+ | Labconco Corporation | 302411101 | Equipment |
| Brain Heart Infusion (BHI) Broth | Becton, Dickinson and Company (BD) | 237500 | |
| Buffered Peptone Water | Bio-Rad Laboratories Inc. | 3564684 | |
| Cell Spreader - L-shaped | VWR | 76208-438 | |
| Centrifuge Microcentrifuge 5424 | Eppendorf | 5424 | Equipment |
| Centrifuge, Avanti J-25 | Beckman Coulter, Inc. | Equipment | |
| DNA Extraction - PreMan Ultra Sample Preparation Reagent | Thermo Fisher Scientific Inc. | 4318930 | |
| Ground Chicken | Local retailers | ||
| IAC forward primer: 5'-GGCGCGCCTAACACATCT-3' | Integrated DNA Technologies | ||
| IAC probe: 5'-TTACAACGGGAGAAGACAATGC CACCA-3' labeled with 5' TAMRA/3' BHQ-2 | Biosearch Technologies | ||
| IAC reverse primer: 5'-TGGAAGCAATGCCAAATGTGTA-3' | Integrated DNA Technologies | ||
| Incubator - Inova 4230 incubator shaker | New Brunswick Scientific | 4230 | Equipment |
| Inoculating Loop - Combi Loop 10µL and 1µL | Fisher Scientific International, Inc | 22-363-602 | |
| invA forward primer: 5'-GTTGAGGATGTTATTCGCAAAG G-3' | Integrated DNA Technologies | ||
| invA probe: 5'-CCGTCAGACCTCTGGCAGTAC CTTCCTC-3' labeled with 5' Cal Fluor Orange 560/3' BHQ-1 | Biosearch Technologies | ||
| invA reverse primer: 5'-GGAGGCTTCCGGGTCAAG-3' | Integrated DNA Technologies | ||
| Irradiation Treatment | Texas A&M Agrilife Research National Center for Electron Beam Research | Service | |
| Luria Bertani (LB) Broth | Becton, Dickinson and Company (BD) | 244620 | |
| Manual pipette Pipet-Lite LTS Pipette L-1000XLS+ | Mettler Toledo | 17014382 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-100XLS+ | Mettler Toledo | 17014384 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-10XLS+ | Mettler Toledo | 17014388 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-200XLS+ | Mettler Toledo | 17014391 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-20XLS+ | Mettler Toledo | 17014392 | Equipment |
| Manual pipette Pipet-Lite Multi Pipette L8-200XLS+ | Mettler Toledo | 17013805 | Equipment |
| Manual pipette Pipet-Lite Multi Pipette L8-20XLS+ | Mettler Toledo | 17013803 | Equipment |
| Media Storage Bottle -PYREX 1L Square Glass Bottle, with GL45 Screw Cap | Corning Inc. | 1396-1L | Equipment |
| Media Storage Bottle -PYREX 2L Round Wide Mouth Bottle, with GLS80 Screw Cap | Corning Inc. | 1397-2L | Equipment |
| Microtiter plate, 96 well plate, flat bottom, polystyrene, 0.34cm2, sterile, 108/cs | MilliporeSigma | Z707902 | |
| Mixer - Vortex Genie 2 | Scientific Industries Inc. | SI-0236 | Equipment |
| Molecular Detection Assay 2-Salmonella kit | Neogen | MDA2SAL96 | |
| Molecular Detection Instrument | Neogen | MDS100 | Equipment |
| Motorized pipette controller, PIPETBOY2 | INTEGRA Biosciences Corp. | 155019 | Equipment |
| PCR Mastermix 2× TaqMan Gene Expression | Thermo Fisher Scientific Inc. | 4369542 | |
| Petri Dish Rotator - bioWORLD Inoculation Turntable | Fisher Scientific International, Inc | 3489E20 | Equipment |
| Petri Dishes with Clear Lid (100 mm x 15mm) | Fisher Scientific International, Inc | FB0875713 | |
| Pipette Tips GP LTS 1000µL S 768A/8 | Mettler Toledo | 30389273 | |
| Pipette Tips GP LTS 20µL 960A/10 | Mettler Toledo | 30389270 | |
| Pipette Tips GP LTS 200µL F 960A/10 | Mettler Toledo | 30389276 | |
| Ready to cook chicken products | Local retailers | ||
| Reagent Reservoir, 25 mL sterile reservoir used with multichannel pipettors | Thermo Fisher Scientific Inc. | 8093-11 | |
| Realtime PCR - 7500 Real-Time PCR system | (Applied Biosystems, Foster City, CA) | 2750036476 | Equipment |
| Serological Pipettes, Nunc Serological Pipettes (10 mL) | Thermo Fisher Scientific Inc. | 170356N | |
| Serological Pipettes, Nunc Serological Pipettes (2 mL) | Thermo Fisher Scientific Inc. | 170372N | |
| Serological Pipettes, Nunc Serological Pipettes (25 mL) | Thermo Fisher Scientific Inc. | 170357N | |
| Serological Pipettes, Nunc Serological Pipettes (50 mL) | Thermo Fisher Scientific Inc. | 170376N | |
| Spreader - Fisherbrand L-Shaped Cell Spreaders | Fisher Scientific International, Inc | 14-665-230 | |
| Stomacher bag, Nasco Whirl-Pak Write-On Homogenizer Blender Filter Bags | Thermo Fisher Scientific Inc. | 01-812 | |
| Stomacher 80 Biomaster Lab Blender | Seward | 30010019 | Equipment |
| Thermocycler (GeneAmp PCR system 9700) | Applied Biosystems | 535028293 | Equipment |
| Water Filtration - Elga Veolia Purelab Flex | Elga LabWater | PF2XXXXM1-US | Equipment |
| Whirlpak bags 1.63L | VWR | 11216-777 |
Referanslar
- Batz, M., Hoffmann, S., Morris, J. G. Disease-outcome trees, eq-5d scores, and estimated annual losses of quality-adjusted life years (qalys) for 14 foodborne pathogens in the united states. Foodborne Pathogens and Disease. 11 (5), 395-402 (2014).
- . The Grand Challenge: Salmonella Available from: https://tellus.ars.usda.gov/stories/articles/the-grand-challenge-salmonella (2024)
- National Advisory Committee on Microbiological Criteria in Foods (NACMCF). Response to questions posed by the food safety and inspection service: Enhancing Salmonella control in poultry products. J Food Prot. 82 (4), 645-668 (2019).
- Food Safety and Inspection Service. . 4.15 Isolation and identification of Salmonella from meat, poultry, pasteurized egg, siluriformes (Fish) products and carcass and environmental sponges. , (2024).
- Irwin, P., Reed, S., Brewster, J., Nguyen, L., He, Y. P. Non-stochastic sampling error in quantal analyses for campylobacter species on poultry products. Analytical and Bioanalytical Chemistry. 405 (7), 2353-2369 (2013).
- Irwin, P., Tu, S., Damert, W., Phillips, J. A modified gauss-newton algorithm and ninety-six well micro-technique for calculating mpn using excel spreadsheets. Journal of Rapid Methods & Automation in Microbiology. 8 (3), 171-191 (2000).
- Ravishankar, S., Ahmed, E. Y., Carlstrom, C. Food microbiology: A laboratory manual. Food Microbiology. 21, 489 (2004).
- Chen, C. Y., Nace, G. W., Irwin, P. L. A 6 x 6 drop plate method for simultaneous colony counting and mpn enumeration of campylobacter jejuni, listeria monocytogenes, and escherichia coli. J Microbiol Methods. 55 (2), 475-479 (2003).
- Suo, B., He, Y., Tu, S. I., Shi, X. A multiplex real-time polymerase chain reaction for simultaneous detection of salmonella spp., escherichia coli o157, and listeria monocytogenes in meat products. Foodborne Pathogens and Disease. 7 (6), 619-628 (2010).
- Jarvis, B., Wilrich, C., Wilrich, P. T. Reconsideration of the derivation of most probable numbers, their standard deviations, confidence bounds and rarity values. J Appl Microbiol. 109 (5), 1660-1667 (2010).
- Stevens, R., Poppe, K. Validation of clinical prediction models: What does the "calibration slope" really measure. Journal of Clinical Epidemiology. 118, (2019).
- Miller, M. E., Hui, S. L., Tierney, W. M. Validation techniques for logistic regression models. Statistics in Medicine. 10 (8), 1213-1226 (1991).
- Galán-Relaño, &. #. 1. 9. 3. ;., et al. Salmonella and salmonellosis: An update on public health implications and control strategies. Animals. 13 (23), 3666 (2023).
- Gorski, L., et al. Growth assessment of salmonella enterica multi-serovar populations in poultry rinsates with commonly used enrichment and plating media. Food Microbiology. 119, 104431 (2024).
- Schmidt, J. W., et al. Evaluation of methods for identifying poultry wing rinses with salmonella concentrations greater than or equal to 10 cfu/ml. J Food Prot. 87 (11), 100362 (2024).
- Gorski, A., Liang, L. S. Effect of enrichment medium on real-time detection of salmonella enterica from lettuce and tomato enrichment cultures. Journal of Food Protection. 73 (6), 1047-1056 (2010).
- Guillén, S., Nadal, L., Álvarez, I., Mañas, P., Cebrián, G. Impact of the resistance responses to stress conditions encountered in food and food processing environments on the virulence and growth fitness of non-typhoidal salmonellae. Foods. 10 (3), 617 (2021).
- Rohde, A., Hammerl, J. A., Appel, B., Dieckmann, R., Al Dahouk, S. Sampling and homogenization strategies significantly influence the detection of foodborne pathogens in meat. BioMed Research International. 2015, (2015).
- Wang, D., Wang, Z., He, F., Kinchla, A. J., Nugen, S. R. Enzymatic digestion for improved bacteria separation from leafy green vegetables. Journal of Food Protection. 79 (8), 1378-1386 (2016).
- Pitard, F. F. . Theory of sampling and sampling practice. , (2019).
- Sharpe, A. . in Detecting pathogens in food. , 52-68 (2003).
- Hannah, J., et al. Effect of stomaching on numbers of bacteria recovered from chicken skin. Poultry Science. 90 (2), 491-493 (2011).
- Mcmeekin, T., Thomas, C. Retention of bacteria on chicken skin after immersion in bacterial suspensions. Journal of Applied Bacteriology. 45 (3), 383-387 (1978).
- Rodrigues-Szulc, U., Ventoura, G., Mackey, B., Payne, M. Rapid physicochemical detachment, separation and concentration of bacteria from beef surfaces. Journal of Applied Bacteriology. 80 (6), 673-681 (1996).
- Vibbert, H. B., et al. Accelerating sample preparation through enzyme-assisted microfiltration of salmonella in chicken extract. Biotechnol Prog. 31 (6), 1551-1562 (2015).
- Armstrong, C. M., et al. Use of a commercial tissue dissociation system to detect salmonella-contaminated poultry products. Analytical and Bioanalytical Chemistry. 416 (3), 621-626 (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır