Method Article
生および調理済み鶏肉製品中の サルモネラ菌 を定量するための修正最確数アッセイ
要約
家禽中の サルモネラ 菌を低レベルで正確に定量することは、現在の産業および規制上の課題です。このプロトコルは、生および調理済み家禽製品中の サルモネラ 菌の定量を可能にするMPNアッセイについて説明しています。この方法は迅速で感度が高く、FSISガイドラインに準拠しているため、食品の安全性が向上し、公衆衛生の取り組みがサポートされます。
要約
サルモネラ菌 は、米国、特に家禽製品における食中毒の主な原因です。 従来のサルモネラ 菌検出法は、定量化よりも有病率に重点を置いているため、汚染レベルやリスクの評価における有用性は限られています。この研究では、チキンコルドンブルーなどの調理済み家禽製品中の サルモネラ菌 を定量するために設計された新しい最確数(MPN)アッセイを紹介します。この方法では、家禽サンプルを洗浄し、遠心分離によってリンスを濃縮し、48ウェルブロックで連続希釈します。MPNアッセイは、ループ媒介等温増幅(LAMP)法と統合されており、既存の食品安全検査サービス(FSIS)プロトコルと同じ時間枠内で サルモネラ 菌汚染の高感度、正確、迅速な定量を提供します。結果は、MPN-LAMP測定値と理論上の接種レベル(R² = 0.933)との間に強い線形相関があることを示しています。しかし、低濃度でのばらつきは、これらのレベルで サルモネラ菌 を正確に検出することの難しさを浮き彫りにしており、実際の検出下限は約300 CFU/gと推定されています。プロトコールの適用性を向上させるための潜在的な改良には、検出限界をさらに改善するためのサンプリング量の増加、濃縮培地の組成の最適化、および複数の サルモネラ 血清を標的とする分子検出の拡大が含まれます。全体として、この研究は食品業界にとって実用的なツールであり、家禽製品中の サルモネラ 菌汚染の信頼性の高い定量化を可能にし、食品の安全性と公衆衛生の向上に貢献しています。
概要
サル モネラ 菌は、米国における食中毒、入院、死亡の主な原因として、公衆衛生と経済に大きな影響を与えています。2013年だけでも、この病原体の推定経済的負担は36億7000万ドルでした1。最近の規制イニシアチブは、2030年までにサルモネラ症を25%削減することを目指していますが2、現在の検出および緩和戦略のギャップは依然として明らかであり、特に処理プラントの監視を公衆衛生上の成果 と一致させる点では3 。
冷凍調理済みの家禽製品は、複数のサルモネラ菌の発生に関与しており、公衆衛生にとって重大な懸念事項です。これを受けて、食品安全検査局(FSIS)は、サルモネラ菌をこれらの製品の混入物として分類しました。現在、FSIS Microbiology Laboratory Guidebook (MLG) 4.15は、家禽製品4におけるサルモネラ菌の有病率の決定にのみ焦点を当てています。このガイドラインでは、収集したサンプルを18〜24時間濃縮した後、サルモネラ菌の有無を特定する分子検出システム(MDS)を使用してスクリーニングしますが、汚染レベルに関する洞察は提供しません。このアプローチは、病原体の存在を検出するには価値がありますが、食品加工業者が汚染リスクをより正確に評価し、的を絞った是正措置を講じるのに役立つ定量的な情報を提供することはできません。
本研究では、微生物病原体の有病率から定量まで検出を増強する方法を開発しました。これは、現在のFSISプロトコルの中断を最小限に抑えて家禽製品中のサルモネラ菌を検出するための既存のプロセスにシームレスに統合するために設計されました。この方法は、単にバルクサンプルを濃縮する代わりに、現在のFSIS法と一致する培地を使用して家禽製品を洗浄することから始まります。その後、リンスは深さ 48 のウェルブロックの最初のカラムに分配されます。残りの5つのカラムで段階希釈を行い、MLG 4.15プロトコルに沿ってブロックを18〜24時間インキュベートします。インキュベーション後、ウェルはサルモネラ菌についてテストされ、その結果を使用して最も可能性の高い数(MPN)5,6が計算されます。このアプローチにより、現在のFSISプロセスと同じ時間枠内で汚染を定量化できるため、業界と規制当局の両方で使用できる実用的なオプションになります。図1は、修正されたMPNアッセイをまとめたブロック図を示しています。この図には、特定のステップで撮影された写真、反復の希釈と成長に利用される48ウェルブロック、および鶏ひき肉に存在する最も可能性の高いサルモネラ菌の数を評価するためのベンチマークとして使用される3つの手法が含まれています。この研究の第 1 段階では、放射線照射されていない鶏のサンプルにプロトコルを適用する前に、背景の微生物叢の影響と確認済みの接種物に対する測定値の不確実性を最小限に抑えるために、照射された鶏ひき肉を利用しました。
プロトコル
注:このプロトコルに関連するすべての作業は、バイオセーフティレベル2(BSL-2)ラボ内で実施する必要があります。適切な場合、このプロトコルは生物学的安全キャビネット(BSC)内で実施し、無菌状態を維持し、サンプル汚染や微生物病原体へのオペレーターの曝露のリスクを最小限に抑える必要があります。BSCの外部にサンプルを移す場合は、密閉容器を使用してサンプルの完全性を維持し、誤って落下した場合のこぼれを防ぎます。好ましくは、クロスコンタミネーションの可能性を軽減するために、手順全体を通して使い捨てコンポーネントを使用する必要があります。使い捨てが不可能な場合は、使用前にすべての機器と材料が無菌であることを確認してください。適切な廃棄物管理は非常に重要です。使用済みの使い捨て部品はすべてバイオハザード廃棄物として廃棄する必要があります。再利用する前に再利用可能な材料をオートクレーブにして、潜在的に危険な材料の適切な滅菌と封じ込めを確保します。これらの予防措置を順守することで、サンプルの完全性を保護するだけでなく、オペレーターが微生物病原体にさらされるリスクも最小限に抑えることができます。
1.肉サンプルの調製
- 食肉サンプルの採取と加工
- 新鮮な肉
- 地元の小売店の生肉売り場から鶏ひき肉を入手してください。すべてのサンプルを4°Cで保管し、受領後24時間以内に処理します。肉を無菌的に25gのサンプルに分割します。
- サンプルを真空シールして照射します。ここでは、テキサスA&Mアグリライフ国立電子ビーム研究センターが、~25kGyの線量を照射した肉を照射した。
注:この研究では、背景微生物叢の除去を確実にするための制御手段として照射が使用されましたが、次のセクションで使用される非照射の調理済み調理済み製品が示すように、実際のアプリケーションでのプロトコルの前提条件ではありません。現場では、選択培地や分子診断の特異性などの代替方法により、非標的微生物からの潜在的な干渉に対処できます。
- 調理済みチキン製品
- 地元の小売店の冷凍食品セクションから調理済みの鶏肉製品を入手してください。無菌的に25gのサンプルに分割します。
- 個々のピースの中央からサンプルを採取し、すべての材料(パン粉やチーズなど)が含まれていることを確認します。
- 新鮮な肉
- メディアの準備
- 緩衝ペプトン水(BPW)は、BPW粉末25gをナノピュアH2O1Lに溶解して調製します。
- 脳心点滴(BHI)プレートを準備します。これを行うには、37 gのBHI粉末を1 LのナノピュアH2Oに溶解し、15 gの寒天をBHI溶液に加えます。すべての培地を121°Cで15分間オートクレーブ滅菌します。20〜25 mLの培地を透明な蓋付きのシャーレ(100 mm x 15 mm)に注ぎます。
注:無菌状態を維持するために、生物学的安全キャビネット内にプレートを注ぐのが最善です。
2. 細胞培養
- Salmonella enterica serovar Typhimurium ATCC 14028をBHI寒天プレート上にストリーキングして初期培養物を調製し、37°Cで一晩インキュベートします。
- 25 mLのBHIブロスに、新たに栽培した サルモネラ菌 のコロニー1つを接種して、一晩培養します。100 rpmで振とうしながら、37°Cで一晩中培養します。
3.家禽サンプルの接種
- 培養希釈とプレーティング
- BPWで一晩培養した一連の10倍希釈液を調製し、最終濃度が約1 x 108 から1 x 101 CFU/mLになるようにします。 サルモネラ 菌の一晩培養液の濃度が 1 x 109 CFU/mL であると仮定します。
- 0.5 mLの一晩培養液を4.5 mLのBPWに移し、混合し、さらに希釈するごとに0.5 mLの希釈液を4.5 mLのBPWに移します。
- 希釈した1 x 103 CFU/mLをBHI寒天プレートに10 μLを3回に分けて広げ、細胞計数を行い、一晩の培養濃度を計算します。
- 食肉サンプルの接種
- 照射した鶏ひき肉25gを滅菌ストマッカーバッグに二重に無菌に移します。バッグは7.5 x 12インチで、1.63Lとラベル付けされています。袋には穴径330μmのフィルター仕切りが入っており、1平方cmあたり285個あります。
- 各サンプルに目標濃度希釈液1 mLを接種します。例えば、1 x 10³ CFU/mL希釈液から1 mLの培養液を添加すると、約1,000細胞/鶏肉25 gの汚染レベルが得られます。滅菌細胞スプレッダーを使用して、液体接種物をニワトリサンプルの表面に穏やかに分配し、4°Cで1時間放置します。
- ネガティブコントロールサンプルを調製するには、滅菌BPW1 mLを添加します。
4. サンプル処理
- 各サンプルに225 mLのBPWを加えます。メディアに対するボリュームの比率は、FSIS MLG 4.154 に合わせて選択されました。
- Stomacher7 を使用して、通常の速度と 120 秒の持続時間でサンプルを均質化します。
- 遠心分離と再懸濁
- 50 mLピペットを使用して、バッグのろ過面から液体を慎重に取り出します。液体を2つの滅菌遠心分離ボトルに分割します。
- ボトルを滅菌BPWでバランスを取り、重量が等しくなるようにします。サンプルを10,000 x g で10分間遠心分離します。上清を捨てます。滅菌スパチュラで細胞ペレットを3 mLのBPWブロスに再懸濁します。
- さらに27mLのBPWブロスを加え、へらで攪拌してよく混ぜます。両方の遠心分離ボトルの内容物を各サンプルごとに1つのボトルに組み合わせます。
5. MPNブロックのセットアップ
注: 表1 は、48ウェルブロックでの希釈液の概略図を示しています。
- 再懸濁したサンプルを 3 mL を 48 ウェルブロックのカラム 1 の各ウェルに加えます(8 回繰り返し)。
- 8チャンネルピペットを使用して、ブロック内のカラム1〜6に10倍希釈液を一連の調製します。
- 0.3 mLのサンプルを2.7 mLのBPWピペットに加えて混合します。希釈ごとに繰り返します。ブロックを 37 °C で一晩 (~18 時間) インキュベートし、~100 rpm で振とうします。
6. めっきと列挙
- 変更されたドロップ プレート列挙
- マルチチャンネルピペットを使用して、寒天プレート上の4 x 6グリッドで各希釈液の一晩成長したサンプル7 μLをプレートします(図2)。2つのプレートに4 x 6グリッドを使用すると、一般的な6 x 6グリッドの液滴8とは対照的に、8つのサンプルをより適切に収容できます。
- プレートを10分間風乾させてからインキュベーションします。寒天プレートを37°Cで一晩(~18-24時間)インキュベートします。 インキュベーション後、各プレート上のコロニーの数を数えます。
7. サルモネラ菌のqPCR検出
- 市販のキットを使用したDNA抽出
- 48ウェルブロックで培養物を数回ピペッティングして混合します。各培養物200μLを96ウェルPCRプレートにピペットで移します。
- プレートを密封し、6,600 x g で10分間遠心分離します。上清を取り除き、20 μLのキット試薬をペレットに加えます。
- ピペッティングを上下させてペレットを再懸濁します。プレートを密封して99°Cで10分間加熱した後、20°Cまで冷却します。
- 再度、6,600 x g で10分間遠心分離します。qPCR分析には2μLの上清を使用してください。
- プレートのセットアップ
- 確立されたプロトコル9 に従って、次のようにqPCR反応混合物を調製します:10μLの2xマスターミックス;各プライマーおよびプローブの0.4 μL(10 μM使用溶液):invAフォワード:5'-GTTGAGGATGTATTCGCAAAGG-3'、invAリバース:5'-GGAGGCTTCCGGGTCAAG-3'、invAプローブ:5'-CCGTCAGACCTCTGGCAGTACCTTCCTC-3'、Cal Fluor Orange 560フルオレン色素で標識。0.2 μL の内部増幅制御 (IAC) テンプレート (6 x 104 コピー/μL)9;各IACプライマーおよびプローブ(10μM)の0.4μL:IACフォワード:5'-GGCGCGCCTAACACATCT-3'、IACリバース:5'-TGGAAGCAATGCCAAATGTGTA-3'、IACプローブ:5'-TTACAACGGGAGAAGACAATGCCACCA-3'をTAMRA色素で標識。ddH2Oで合計20μLまで容量を調整します。
- 次のサイクリング条件9でリアルタイムPCRを実行します:95°Cで10分間(DNAの初期変性およびホットスタートポリメラーゼの活性化)、95°Cで15秒間の40サイクル、および60°Cで1分間、デフォルトのCt設定を使用して結果を分析用にエクスポートします。
8. 3M MDSアッセイを用いた検出
- 分子検出アッセイ サルモネラ キットのプロトコルに従ってください。48ウェルブロックで培養物を数回ピペッティングして混合します。各サンプルの20μLをキット付属の溶解チューブにピペットで移します。
- サンプルを100°Cで15分間加熱します。溶液はピンクから黄色に変わります。サンプルを室温で10分間インキュベートします。解決策が黄色からピンクに変わります。
- 20 μLのライセートを試薬チューブに移し、試薬チューブをホルダーにロードします。
- ホルダーをMDS装置に追加し、キットとサンプルに関する情報を伝達するようにソフトウェアを設定します。この装置では、各ウェルにアッセイのロット番号とサンプル名をラベル付けする必要があります。MDS ソフトウェアを実行し、レポートをエクスポートします。
9. データ分析
- 肯定的な結果と否定的な結果の分類。
- 4 x 6滴めっきの場合、少なくとも1つのコロニーを持つ寒天プレート上のスポットを陽性と評価し、成長していない寒天プレート上のスポットを陰性として評価します。
- qPCR では、Ct が 30 以下のウェルを陽性と評価し、Ct が 30 を超えるウェルを陰性と評価します。
- MDS の場合は、MDS システムからの結果 (陽性または陰性として報告された) を使用します。
- MPN の計算
- 前述の単純な最大確率分解能(SMPR)法6または代替の検証済みMPN計算機を使用して、注釈付きの陽性と陰性を分析します。10名
結果
照射肉
回帰分析では、傾き 1 は、独立変数 (x 軸) が単位増加するごとに、従属変数 (y 軸) が正確に 1 単位増加することを示します。これは、2 つの変数間の比例関係を示唆しており、従属変数の変化は独立変数の変化を反映していることを意味します。切片が 0 の場合、独立変数が 0 の場合、従属変数も 0 になります。これは、2つの変数間の関係に固定オフセットやバイアスがないことを示唆しています。傾き 1 と切片 0 を合わせると、変数11,12 が一致していることが示唆されます。この理想的なシナリオは、系統的なエラーやバイアスがないことを示しており、測定値が予測と完全に一致する、適切に調整されたシステムで期待される結果になります。
図3A は、ステップ3.1.1のノートで説明したスプレッドプレート分析によって検証された理論上の接種物に対してプロットされたMPN-LAMPアッセイ(y軸)を示しています。(X 軸)をクリックします。回帰直線方程式 y = -72.36 + 0.161x は、R² 値が 0.978 で、MPN-LAMP の結果と接種された細菌レベルとの間に強い線形相関があることを示しています。高いR²値は、MPN-LAMPアッセイが細菌汚染の定量的予測において高い信頼性を持っていることを示唆しています。ただし、0.161の傾きは理想的な傾きの1から大きく逸脱しており、MPN-LAMP法は接種物を過小評価し、理論上の接種物中の細菌濃度の16.1%しか予測していないことを示しています。さらに、-72.36 の負の切片は、低濃度での負のバイアスを示唆しており、理想からさらに逸脱しています。
図 3B は、理論上の接種物 (x 軸) に対してプロットされた MPN-qPCR 法 (y 軸) を示しています。回帰直線 y = -46.84 + 0.0395x は、R² 値が 0.978 で、MPN-qPCR アッセイと理論上の接種物との間に強い線形関係があることを示しています。高いR²は強固な相関を示していますが、0.0395という傾きはMPN-LAMPの結果よりもさらに小さく、MPN-qPCRによる細菌汚染の過小評価の度合いが高いことを示唆しています。-46.84 の負の切片は、低濃度での下方バイアスの可能性をさらに示しています。
図3C は、理論上の接種物(x軸)に対してプロットされたMPNめっきの結果(y軸)を示しており、回帰式はy = -330.4 + 0.3138x、R²値は0.944です。この R² 値は強い線形関係を示していますが、MPN-LAMP および MPN-qPCR の結果よりもわずかに低く、コロニー定量のばらつきが大きいことが示唆されています。0.3138 の傾きは、他の方法で観察された傾きよりも高いものの、理論上の接種物に対する細菌濃度の過小評価を示しています。さらに、-330.4 という負の切片は、特に低濃度でかなりのバイアスがあることを示しており、これはめっき技術やサンプルの取り扱いに不正確さがあることを示している可能性があります。このR²のわずかな減少と観察されたばらつきは、従来のめっきプロセスが分子法よりも変動しやすいことを示している可能性があります。
比較方法
3つの方法(MPN-LAMP、MPN-plating、およびMPN-qPCR)はすべて、理論上の接種と比較して細菌レベルを過小評価する傾向を示しました。この過小評価は、細胞回収の問題に起因する可能性があり、処理中に サルモネラ菌 が鶏肉の表面や粒子状物質から完全に分離せず、リンスまたはアッセイへのサルモネラ菌の移動が減少する可能性があります。 サルモネラ菌 は鶏肉に直接接種されたため、細菌細胞の一部が表面に強く結合し、すすぎステップでの回収が制限される可能性があります。さらに、一部の細胞は遠心分離後もペレット内の粒子状物質に付着したままになり、回収率がさらに低下する可能性があります。酵素治療、機械加工、最適化された胃治療プロトコルなどのアプローチは、細菌の除去を促進する可能性があります。これらの戦略については、ディスカッションセクションで詳しく説明し、回復率を向上させる可能性を強調しています
図4A は、x軸上の3つのMPN法に対するy軸方向の回復を示しています。理論上の接種レベルに対するMPN値の比率として計算された回収率は、次の結果をもたらしました:MPN-LAMP法の平均回収率は15.19%で、標準偏差は10.04%でした。MPNめっき法の平均回収率は13.13%、標準偏差は11.45%でした。MPN-qPCR法の平均回収率は6.67%で、標準偏差は3.19%でした。Tukey-Kramer HSD検定では、方法間の回収率に統計的に有意な差は認められず(P > 0.1969)、 サルモネラ菌を接種したニワトリを処理する際の回収率に関して、3つの方法すべてが同様の性能を発揮したことが示唆されました。
ニワトリマトリックスから サルモネラ 菌を分離する方法は同一であるにもかかわらず、MPN-LAMP、MPN-qPCR、および MPN めっきの検出にはばらつきが観察されました。このことは、サンプルからの細菌の物理的な分離以外の要因が検出に影響を与える可能性があることを示唆しています。サンプルマトリックス中に阻害剤が存在すると、分子法(qPCRおよびLAMP)が妨げられ、その感度と全体的な性能に影響を与える可能性があります。さらに、細菌の生存率が、 サルモネラ 菌が固体寒天プレート上で増殖する能力(MPNめっき)と液体ブロス(qPCR、LAMP)の増殖能力に影響を与えた可能性があり、分析法間で回収率にばらつきが生じています。
分析法の感度をさらに調査するために、まず、MPN-LAMP、MPN-qPCR、および MPN-plating の各希釈液での陽性反応の数を 7 つの独立した試験で調べました(表 2)。より低い希釈率(1 x 10-5 および 1 x 10-4)では、MPN-LAMP は MPN-plating と MPN-qPCR の両方と比較して高い陽性反応を示しました。これは、LAMP メソッドが低濃度の サルモネラ菌に対してより感度が高いことを示唆しています。サンプルがより濃縮されている場合(希釈率が 1 x 10-3 未満の場合)、3 つの方法すべてで陽性検出が増加し、1 x 10-2 希釈付近で収束が発生し、すべての分析法で同数の陽性サンプルが検出されました。
図4B は、3つの方法にわたる各希釈での陽性測定値の割合を示しており、 サルモネラ菌の検出における感度を直接比較しています。陽性反応の割合により、希釈系列全体の分析法性能がより明確に視覚化され、95% の Clopper-Pearson 信頼区間(CI)を表すエラーバー±、各レベルでのばらつきに関する洞察が得られます。希釈率が低いほど、信頼区間が広いほど、各分析法の検出性能のばらつきが大きいことを示します。陽性検出の生数と同様に、MPN-LAMPは最も希薄な濃度(1 x 10-5)で陽性サンプルをより高い割合で検出しますが、MPN-qPCRおよびMPNプレーティングは検出する陽性が少なくなります。細菌濃度が上昇すると、分析法は収束し、3つのアプローチすべてが高濃度(1 x 10-2 以上など)で100%に近い検出を示しています。これらの高濃度での信頼区間の狭小化は、すべての方法で一貫性が高いことを示しており、細菌レベルが高い場合に同等の性能を発揮することが強調されています。
図3の結果は、3つの方法すべての一貫した(定量的な)過小予測が、サンプルマトリックスからのサルモネラ菌の不完全な分離によって引き起こされる可能性があることを示唆しています。しかし、分子阻害剤や細菌の生存率因子が、異なる希釈率(定性的)や異なる方法(定性的および定量的)で観察された検出のばらつきを引き起こしている可能性があります。図 4B の高濃度での信頼区間が狭いほど、分析法間のばらつきが少なく、定性的性能が一貫していることを示していますが、低濃度での間隔が広いほど、定性的検出の不確実性が増大しています。
調理済み鶏肉の検出
調理済み鶏肉中の サルモネラ 菌の検出には、 サルモネラ 菌の希釈率が最も低い他の方法よりも陽性サンプル数が多い(14.3%)ため、LAMP法を選択しました。 サルモネラ 菌の希釈率が最も低い場合(1 x 10-5)、社内のqPCR法では、どのサンプルも陽性として検出されませんでした。一方、めっきによる陽性検出数(7.1%、LAMP検出数の半分)も検出されました。しかし、この培養ベースの方法の結果は、サンプルが照射されていないために背景の微生物叢の存在が結果を歪める可能性がある、調理済みの鶏肉などのより複雑な製品に移行するときに影響を受ける可能性があります。これらの理由から、私たちは、調理済み鶏肉からの サルモネラ 菌の定量のためにMPN-LAMP法を検討することにしました。
図5 は、接種済み、冷凍、調理済みチキンコルドンブルーサンプル中の サルモネラ菌 の定量に使用したMPN-LAMPアッセイの結果を示しています。理論的な接種レベル(CFU/g)をx軸にプロットし、対応するMPN-LAMPの測定値をy軸にプロットしました。回帰分析の結果、式 y = -15.04 + 0.3869x が得られ、決定係数 (R²) は 0.933 であり、理論上の接種物と MPN-LAMP の結果との間に強い線形相関があることを示しています。この高いR²値は、MPN-LAMP法がこれらのサンプル中の サルモネラ菌 を確実に定量することを示唆していますが、0.3869の傾きは、この方法が実際の接種レベルを過小評価していることを示しています。回帰直線の周りの影付きの領域は、95%信頼区間を表します。
より低い接種レベルでのMPN-LAMPの性能をよりよく示すために、 図5 の挿入グラフは300 CFU/g未満のデータポイントを拡大しています。回帰式に基づいて、検出の下限は約40 CFU/g(38.9 CFU/g)と見積もることができます。ただし、95%信頼区間は、負のMPN-LAMP値をゼロと解釈する必要があるため、検出の実質下限が325CFU/gに近いことを示唆しています。挿入図の赤い線はゼロを表しており、この線を下回ったデータポイントはありませんが、特に接種レベルが低い場合に値がゼロを下回る可能性があるため、偽陰性の結果が発生する可能性があります。この傾向は、低濃度でのサルモネラ菌の正確な定量が困難であることを強調しており、検出の下限を明確に確立するには追加のデータが必要になります。

図1:サルモネラ菌検出用の修正MPNアッセイのブロック図。 修正された最確数(MPN)アッセイの概略図の概要。これは、照射された鶏ひき肉サンプルの接種から始まり、サンプルの均質化、遠心分離、分注分配、および指定された条件下でのインキュベーションに続く、プロセスの主要なステップを概説しています。この図には、希釈と複製増殖に利用された 48 ウェルブロックの写真と、SMPR(Simple Maximum Probability Resolution)計算で正と負の結果を生成するために使用された 3 つの手法が含まれています。 この図の拡大版を表示するには、ここをクリックしてください。

図2:ドロッププレートアッセイの概略図。 48ウェルブロックからの特定の希釈(例:未希釈、10-1、10-2など)のドロッププレートアッセイセットアップ。各サンプルは、マルチチャンネルピペットを使用して寒天プレート上に4 x 6グリッド形式で播種されます。レイアウトは、従来の 6 x 6 グリッドから 2 つの 4 x 6 グリッドに変更され、8 つの希釈から 6 回の反復に対応できるようになりました。 この図の拡大版を表示するには、ここをクリックしてください。

図3:InoculumとMPN法の比較。(A) めっき(x軸)によって検証された理論接種物に対するMPN-LAMP濃度(y軸)のプロット。適合回帰直線 (y = -72.36 + 0.161x) と決定係数 (R² = 0.978) は、強い線形関係を示します。 (B) 理論上の接種物に対するMPN-qPCR濃度(y軸)のプロット(x軸)、適合回帰線(y = -46.84 + 0.0395x)およびR² = 0.978、同様に強い相関を示しています。 (C) 理論上の接種物(x軸)に対するMPNめっき濃度(y軸)のプロットで、回帰線(y = -330.4 + 0.3138x)およびR² = 0.944で、LAMPおよびqPCRよりも強いがわずかに低い相関を示しています。各図の回帰式と決定係数は、グラフの左上隅に挿入されています。 この図の拡大版を表示するには、ここをクリックしてください。

図4:MPN法の比較。(A) この図は、MPN-LAMP、MPN-plating、およびMPN-qPCR法の理論上の接種レベルに対するMPN値の比率として計算された回収率を示しています。MPN-LAMP法の平均回収率は15.19%(±10.04%)、MPNめっき法の平均回収率は13.13%(±11.45%)、MPN-qPCR法の平均回収率は6.67%(±3.19%)でした。箱ひげ図は、回復データの分布を強調表示し、外れ値を示します。エラーバーは、四分位範囲(IQR)の1.5倍以内のデータ範囲を表します。(B) MPN-LAMP(青)、MPN-めっき(赤)、MPN-qPCR(緑)の3つの方法における各希釈での サルモネラ 菌検出陽性の割合。x軸は希釈レベル(10-6 〜10)を表し、y軸は正の測定値の割合を示します。エラーバーは、各メソッドの検出のばらつきを反映する±95%Clopper-Pearson信頼区間を示します。MPN-LAMPは、低希釈で他の方法よりも高い検出率を示しますが、すべての方法は高濃度で100%付近の検出に収束します。 この図の拡大版を表示するには、ここをクリックしてください。
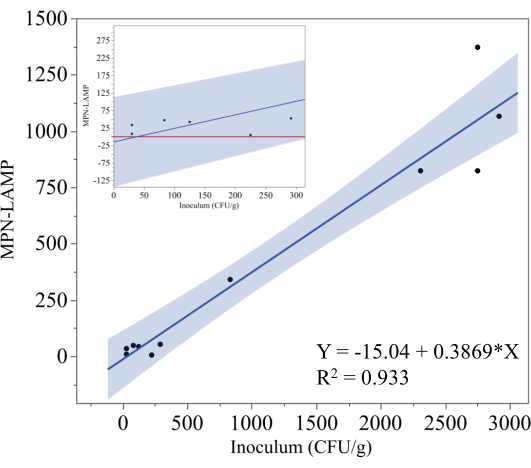
図5:調理済み鶏肉のMPN法。 冷凍調理済みチキンコルドンブルーサンプル中の サルモネラ菌 の理論接種レベルに対するMPN-LAMP結果の回帰分析。回帰直線は y = -15.04 + 0.3869x で表され、R² は 0.933 で表され、強い線形関係を示しています。網掛けされた領域は、95%信頼区間を表します。挿入図は、より低い接種レベルでのMPN-LAMP測定に焦点を当てています。 この図の拡大版を表示するには、ここをクリックしてください。
| 1 | 2 | 3 | 4 | 5 | 6 | |
| ある | n=1 | n=1 | n=1 | n=1 | n=1 | n=1 |
| B | 2 | 2 | 2 | 2 | 2 | 2 |
| C | 3 | 3 | 3 | 3 | 3 | 3 |
| D | 4 | 4 | 4 | 4 | 4 | 4 |
| E | 5 | 5 | 5 | 5 | 5 | 5 |
| F | 6 | 6 | 6 | 6 | 6 | 6 |
| G | 7 | 7 | 7 | 7 | 7 | 7 |
| H | 8 | 8 | 8 | 8 | 8 | 8 |
| 100 | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 |
表1:48ウェルブロックでの繰り返しと希釈の概略図。 この図は、48ウェルブロック内の反復と連続10倍希釈液の配置を示しています。各列は、100 から 10-5 の範囲の特定の希釈係数を表し、各希釈の技術的な反復は 8 行に分散されます。
| 希釈 | ||||||
| 10-5 | 10-4 | 10-3 | 10-2 | 10-1 | 100 | |
| MPNランプ | 8 | 16 | 31 | 3 | 56 | 56 |
| MPNめっき | 4 | 11 | 32 | 55 | 56 | 56 |
| MPN-qPCR検査 | 0 | 7 | 26 | 55 | 56 | 56 |
表 2: 陽性イベントの数。 この表には、陽性反応の数(合計56回の反復以上)が表示されます。結果は、列が希釈を表し、行が分析法を表す表に配置されます。
ディスカッション
プロトコルの意義
サルモネラ菌は、食品の安全性、特に家禽製品内で依然として主要な懸念事項であり、食中毒の発生にしばしば関与しています13,14。米国における細菌性食中毒の主な原因として、新鮮な家禽製品と調理済みの家禽製品の両方でサルモネラ菌を検出するための信頼性の高い方法は、食品の安全性を確保するために重要です15。サルモネラ菌を低レベルで定量する能力は、他の方法では検出されない可能性のある汚染を特定するために不可欠です。分析法の感度は、規制遵守や公衆衛生にとって特に重要であり、特に脆弱な集団では、低用量のサルモネラ菌でも病気を引き起こすことがあります。
MPN-LAMPアッセイは、現在FSISがMLG 4.15で使用しているMDSシステムを利用して、汚染4の有病率を決定します。ここで紹介するアッセイは、現在のFSIS法を拡張して、低レベルでも生存可能な サルモネラ菌を定量し、汚染レベルに関するより正確なデータを提供します。この研究の結果、MPN-LAMP法と理論上の接種値との間には強い相関関係があり、R²は0.933であることが示されました(図5)。このことは、この方法が食品中の サルモネラ 菌を定量するのに信頼性があることを示唆していますが、低い接種レベルでは若干の過小評価が見られました。
重要なステップ
サルモネラ菌定量のプロトコールでは、サンプル調製、接種、分子分析に精度が必要です。適切な無菌技術、正確な希釈、インキュベーション条件の遵守は、サルモネラ菌を確実に検出および計数するために極めて重要です。家禽のサンプルや培地の移送中に無菌状態を確保することは、汚染を防ぐために不可欠です。
同様に重要なのは、胃袋中のサンプルの均質化と、遠心分離後のペレットの慎重な再懸濁により、細菌を食品マトリックスから分離することです。これらのステップで適切に処理することで、生存可能な細胞がさらなる分析のために確実に回収されます。MPNセットアップの段階希釈プロセス中の正確なピペッティングと一貫したインキュベーション条件は、再現性のある結果を得るために非常に重要です。
最後に、qPCRなどの分子検出法では、偽陰性を避けるために、DNA抽出とqPCRサイクリングの精度と再現性が必要です。DNA抽出は本質的に変動しますが、標準化された試薬と手順により、阻害剤の干渉を最小限に抑え、DNA回収率を向上させることで再現性が確保されます。これらのステップは、 サルモネラ 菌の存在を確認し、従来のプレーティングおよび濃縮方法の限界を克服するのに役立つ特定の遺伝子マーカーを標的とするための基本です。
潜在的な落とし穴と制限
細菌の生存率
MPNプレーティングのような成長ベースのアッセイを実施する際の主な課題の1つは、細菌の生存率であり、これは特に複雑な調理済み鶏肉サンプルに関連しています。チキンコルドンブルーなどの冷凍鶏肉、パン粉詰め鶏肉、詰め物は、特に温度変動や長期保存の影響を受けやすく、どちらも サルモネラ 菌細胞にストレスを与え、成長ベースのアッセイで病原体を検出するのを困難にする可能性があります。さらに、鶏肉以外の成分(チーズ、パン粉、ハム、スパイス、バターなど)の存在は、食品マトリックスにさらなる複雑さをもたらし、濃縮段階で のサルモネラ菌 の増殖を阻害し、正確な定量を複雑にします。さらに、 サルモネラ菌 は培養ベースの方法でバックグラウンド微生物と競合する必要があり16、これは特に、生の鶏肉と比較して微生物叢に多様性を追加する複数の成分を含む調理済みサンプルに関連しています。最後に、抗菌剤などのストレッサーの取り扱いと処理は、 サルモネラ菌 の回復に影響を与える可能性があります17。
細菌の生存率が、この研究で試験された方法の性能に影響を与えた可能性があります。すべての方法では、低レベルで はサルモネラ 菌濃度を過小評価し、低濃度の病原体では検出変動が大きかった(図4A、B)。しかし、分子ベースのMPN-LAMP法は、低い接種レベルでの定性的な検出において、MPNプレーティングやMPN-qPCRよりも優れた性能を発揮しました。この結果は、低病原体濃度での精製の必要性を強調しています。
サンプルの不均一性
もう1つの重要な制限は、食品サンプルの不均一性であり、 サルモネラ 菌の検出結果にばらつきをもたらす可能性があります。このプロトコールは、30 mLの均質化されたサンプルを分散させるように設計されており、3 mLアリコート(合計24 mL、6 mL過剰)として8回の繰り返しをブロック全体に分散させることができます。この保守的なアプローチ(サンプルが増える)は潜在的な損失を考慮しますが、ボリューム全体がテストされないため、サブサンプリングが発生します。
食品サンプルの不均一性は、再分散した混合物からサンプルをブロックに移し、希釈18,19を行う際の測定精度に影響を与える可能性があります。サンプリング理論(TOS)によれば、基本的なサンプリング誤差は、サンプル質量を増加させるか、粒子サイズの縮小20を通じて組成の不均一性を減らすことによって減少させることができる。しかし、一部の研究では、胃袋でマトリックスを分解しても表面汚染による細菌の回復に大きな影響を与えないことが示されていますが、食品マトリックスの粒子サイズを小さくすると、場合によっては細菌の回復が減少することが示されています21,22,23。この研究では、濃縮前に胃袋によって粒子サイズを縮小しました。これにより、サンプルの組成の不均一性が減少するため、サンプリング誤差が減少する可能性がありますが、胃袋や遠心分離は細菌の回収に影響を与える可能性があります。
最後に、食品の不均一な組成と形態、および汚染が内部にあるか表面にあるかによって、病原体の回復にばらつきが生じる可能性があります。以前の研究18,22は、組織表面への強い細菌の結合が回復率を低下させる可能性があることを実証しました。トリプシン、コラゲナーゼ、エンドペプチダーゼなどの酵素を使用して、肉や家禽のマトリックス24,25から細菌を放出し、ペクチナーゼやセルラーゼを葉物野菜19に放出した研究では、食品マトリックスからのサルモネラ菌の回収を改善する可能性が実証されています。
トラブルシューティングの提案
問題を防ぐために、すべての培地と試薬が新たに調製され、無菌であることを確認してください。期限切れまたは不適切に滅菌された材料は、汚染を引き起こしたり、 サルモネラ菌の成長に影響を与えたりする可能性があります。汚染が観察された場合は、特にサンプルの接種、希釈、分注、およびめっき中に、プロトコール全体で無菌技術が一貫して守られていたことを確認します。
コロニー数が予想よりも少ない場合、段階希釈と接種濃度の精度を確認することで、エラーを特定するのに役立ちます。温度、時間、攪拌などのインキュベーション条件は、 最適なサルモネラ菌 の増殖をサポートするために注意深く監視する必要があります。増殖が遅いかまったくない場合、胃の浸かりが不十分であったり、袋から漏れたりすると、細菌の分布が不均一になる可能性があります。
分子検出で一貫性のない結果が得られる場合は、DNA抽出手順を確認し、プライマーとプローブの品質を確認することが重要なステップです。また、食品マトリックス間のばらつきは、内部増幅制御(IAC)を使用して監視できる阻害レベルが異なる場合があります。抽出試薬の適切な保管と取り扱いは、劣化や汚染による偽陰性を防ぐために重要です。より効率的なDNA抽出方法も保証される場合があります。
機械的、熱的、酵素的作用を採用したGentleMACSシステム26などの治療を組み込むことで、食品からの細菌の回収をさらに最適化できます。このシステムは、食品マトリックスの不均一性を減らすことができ、均一なサンプルをブロックに移し、正確な段階希釈を行うことが容易になります。
潜在的な改良と拡張
このプロトコルを洗練および拡張する機会はいくつかあります。代替の濃縮培地製剤を探求することで、ストレスを受けたサルモネラ細胞や亜致死的に損傷した サルモネラ 細胞、特にチキンコルドンブルーなどの複雑な食品マトリックスからの回収を改善することができます。選択的寒天培地は サルモネラ菌を標的とするために一般的に使用されますが、処理および保管条件により損傷またはストレスを受けた細胞は、そのような培地で偽陰性を引き起こす可能性があります。この課題を克服するために、選択圧と微生物回収のバランスを最適化することで、標準的な濃縮条件下では競争力の低い サルモネラ 血清型菌の検出を強化できる可能性があります。この改良により、特に微生物ストレスが一般的な困難な食品において、全体的なアッセイ感度が向上する可能性があります。インキュベーション時間を短縮すると、結果が得られるまでの時間が短縮される可能性がありますが、感度が低下し、検出が制限される可能性があります。今後の研究では、迅速な細菌の複製をサポートし、ステークホルダーの要件を満たしながら正確な定量を確保するための濃縮培地の進歩を探求する必要があります。
さらに、MPNアッセイのさまざまなインキュベーション温度と期間を調査することで、さまざまな家禽製品からの サルモネラ菌 の回収を最適化できます。これにより、このプロトコルの適用性が、明確な増殖条件を必要とする他の食品媒介病原体にも拡大し、食品安全性試験におけるその有用性が広がる可能性があります。自動化により、分注および希釈ステップ用のロボット液体ハンドラーを統合することにより、このプロトコルのスケーラビリティを向上させることができます。連続フロー遠心分離機または大容量遠心分離機システムもバッチ処理の制限に対処し、産業環境でのハイスループットアプリケーションを可能にします。
分子検出の側面をマルチプレックスPCRにまで拡大することで、複数の病原体の同時検出が可能になり、監視および試験環境でのスループットが向上する可能性があります。さらに、次世代シーケンシング(NGS)を組み込むことで、MPN濃縮培養から直接貴重な血清型および病原性情報を得ることができ、疫学調査やソース追跡の取り組みが容易になります。
最後に、MPNで使用するサンプルの量を増やすことで、定量/検出の限界を拡大することができます。たとえば、肉サンプルの重量を 25 g から 325 g に増やした場合、線形回帰式を使用して検出限界を 4 CFU/g に外挿できます。ただし、同じ相対95%信頼区間を仮定すると、定量の実用下限は>30 CFU/gです。
結論
この研究でのMPN-LAMPアッセイの開発は、家禽製品中の サルモネラ 菌汚染を定量化するための貴重で実用的なツールを提供します。理論上の接種レベル(R² = 0.933)と強い相関関係があるため、この分析法は、食品の安全性と規制遵守に重要な低レベルの サルモネラ 菌を確実に検出します。この機能は、他の方法では見過ごされがちな汚染を検出するために特に重要であり、生産者が潜在的なリスクに積極的に対処できるようにします。MPN-LAMPアッセイは、従来の有病率ベースの方法に代わる定量的な方法を提供し、より複雑な調理済みアイテムを含むさまざまな家禽製品にサル モネラ 菌汚染のレベルを提供します。
この方法の主な強みの1つは、さまざまな食品マトリックス、特にチキンコルドンブルーのような冷凍製品や加工製品への適応性にあります。従来の方法では、パン粉やチーズなどの追加の材料が存在するために困難になる可能性があります。LAMPやqPCRなどの分子技術をMPNアッセイと統合することで、バックグラウンド微生物や処理条件によってもたらされる課題を克服する、検出への包括的なアプローチが保証されます。これらの分子法は、プロトコールの感度を向上させ、日常的な食品安全性試験や汚染監視における汎用性の高いツールとなり、 サルモネラ菌関連の発生リスクを低減する可能性があります。
単一の検出方法に制限がないわけではありませんが、MPN-LAMPアッセイは、さまざまな接種レベルと食品マトリックスにわたって一貫した性能を示します。低い接種レベルでのばらつきは、回収率を最大化するためのサンプル調製や培地の処方の最適化など、将来の改良によって対処できますが、これはプロトコルの全体的な堅牢性を損なうものではありません。MPN-LAMP法は、困難な条件下でも サルモネラ 菌細胞を正確に検出することで、食品業界に公衆衛生を保護するための貴重なツールを提供します。
将来的には、より多くの サルモネラ 血清型を含むようにアッセイを拡大したり、病原体の特性評価を強化するための次世代シーケンシングを組み込んだりするなど、さらなる強化の余地があります。それにもかかわらず、このプロトコルはすでに サルモネラ 菌の検出と定量における大幅な進歩を示しており、食品安全性試験の高まる要求を満たす実用的で効率的かつ信頼性の高い方法を提供しています。
開示事項
すべての著者は、利益相反がないことを宣言します。
謝辞
この研究は、米国農務省、農業研究サービス(USDA-ARS)、国家プログラム108、現在の研究情報システム番号8072-42000-093-000-Dおよび8072-42000-094-000-Dによって支援されました。USDAは機会均等の提供者であり、雇用主です。
資料
| Name | Company | Catalog Number | Comments |
| 48 deep well block 4.6ml | Fisher Scientific International, Inc | NC1964628 | |
| Agar - Solidifying Agent (Difco) | Becton, Dickinson and Company (BD) | 281230 | |
| Analytical Balance | Mettler Toledo | JL602-G/L | Equipment |
| Analytical Balance | Mettler Toledo | AB54-S | Equipment |
| Autoclave - Amsco Lab250, Laboratory Steam Sterilizer | Steris plc | LV-250 | Equipment |
| Biological Safety Cabinet, Type A2, Purifier Logic+ | Labconco Corporation | 302411101 | Equipment |
| Brain Heart Infusion (BHI) Broth | Becton, Dickinson and Company (BD) | 237500 | |
| Buffered Peptone Water | Bio-Rad Laboratories Inc. | 3564684 | |
| Cell Spreader - L-shaped | VWR | 76208-438 | |
| Centrifuge Microcentrifuge 5424 | Eppendorf | 5424 | Equipment |
| Centrifuge, Avanti J-25 | Beckman Coulter, Inc. | Equipment | |
| DNA Extraction - PreMan Ultra Sample Preparation Reagent | Thermo Fisher Scientific Inc. | 4318930 | |
| Ground Chicken | Local retailers | ||
| IAC forward primer: 5'-GGCGCGCCTAACACATCT-3' | Integrated DNA Technologies | ||
| IAC probe: 5'-TTACAACGGGAGAAGACAATGC CACCA-3' labeled with 5' TAMRA/3' BHQ-2 | Biosearch Technologies | ||
| IAC reverse primer: 5'-TGGAAGCAATGCCAAATGTGTA-3' | Integrated DNA Technologies | ||
| Incubator - Inova 4230 incubator shaker | New Brunswick Scientific | 4230 | Equipment |
| Inoculating Loop - Combi Loop 10µL and 1µL | Fisher Scientific International, Inc | 22-363-602 | |
| invA forward primer: 5'-GTTGAGGATGTTATTCGCAAAG G-3' | Integrated DNA Technologies | ||
| invA probe: 5'-CCGTCAGACCTCTGGCAGTAC CTTCCTC-3' labeled with 5' Cal Fluor Orange 560/3' BHQ-1 | Biosearch Technologies | ||
| invA reverse primer: 5'-GGAGGCTTCCGGGTCAAG-3' | Integrated DNA Technologies | ||
| Irradiation Treatment | Texas A&M Agrilife Research National Center for Electron Beam Research | Service | |
| Luria Bertani (LB) Broth | Becton, Dickinson and Company (BD) | 244620 | |
| Manual pipette Pipet-Lite LTS Pipette L-1000XLS+ | Mettler Toledo | 17014382 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-100XLS+ | Mettler Toledo | 17014384 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-10XLS+ | Mettler Toledo | 17014388 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-200XLS+ | Mettler Toledo | 17014391 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-20XLS+ | Mettler Toledo | 17014392 | Equipment |
| Manual pipette Pipet-Lite Multi Pipette L8-200XLS+ | Mettler Toledo | 17013805 | Equipment |
| Manual pipette Pipet-Lite Multi Pipette L8-20XLS+ | Mettler Toledo | 17013803 | Equipment |
| Media Storage Bottle -PYREX 1L Square Glass Bottle, with GL45 Screw Cap | Corning Inc. | 1396-1L | Equipment |
| Media Storage Bottle -PYREX 2L Round Wide Mouth Bottle, with GLS80 Screw Cap | Corning Inc. | 1397-2L | Equipment |
| Microtiter plate, 96 well plate, flat bottom, polystyrene, 0.34cm2, sterile, 108/cs | MilliporeSigma | Z707902 | |
| Mixer - Vortex Genie 2 | Scientific Industries Inc. | SI-0236 | Equipment |
| Molecular Detection Assay 2-Salmonella kit | Neogen | MDA2SAL96 | |
| Molecular Detection Instrument | Neogen | MDS100 | Equipment |
| Motorized pipette controller, PIPETBOY2 | INTEGRA Biosciences Corp. | 155019 | Equipment |
| PCR Mastermix 2× TaqMan Gene Expression | Thermo Fisher Scientific Inc. | 4369542 | |
| Petri Dish Rotator - bioWORLD Inoculation Turntable | Fisher Scientific International, Inc | 3489E20 | Equipment |
| Petri Dishes with Clear Lid (100 mm x 15mm) | Fisher Scientific International, Inc | FB0875713 | |
| Pipette Tips GP LTS 1000µL S 768A/8 | Mettler Toledo | 30389273 | |
| Pipette Tips GP LTS 20µL 960A/10 | Mettler Toledo | 30389270 | |
| Pipette Tips GP LTS 200µL F 960A/10 | Mettler Toledo | 30389276 | |
| Ready to cook chicken products | Local retailers | ||
| Reagent Reservoir, 25 mL sterile reservoir used with multichannel pipettors | Thermo Fisher Scientific Inc. | 8093-11 | |
| Realtime PCR - 7500 Real-Time PCR system | (Applied Biosystems, Foster City, CA) | 2750036476 | Equipment |
| Serological Pipettes, Nunc Serological Pipettes (10 mL) | Thermo Fisher Scientific Inc. | 170356N | |
| Serological Pipettes, Nunc Serological Pipettes (2 mL) | Thermo Fisher Scientific Inc. | 170372N | |
| Serological Pipettes, Nunc Serological Pipettes (25 mL) | Thermo Fisher Scientific Inc. | 170357N | |
| Serological Pipettes, Nunc Serological Pipettes (50 mL) | Thermo Fisher Scientific Inc. | 170376N | |
| Spreader - Fisherbrand L-Shaped Cell Spreaders | Fisher Scientific International, Inc | 14-665-230 | |
| Stomacher bag, Nasco Whirl-Pak Write-On Homogenizer Blender Filter Bags | Thermo Fisher Scientific Inc. | 01-812 | |
| Stomacher 80 Biomaster Lab Blender | Seward | 30010019 | Equipment |
| Thermocycler (GeneAmp PCR system 9700) | Applied Biosystems | 535028293 | Equipment |
| Water Filtration - Elga Veolia Purelab Flex | Elga LabWater | PF2XXXXM1-US | Equipment |
| Whirlpak bags 1.63L | VWR | 11216-777 |
参考文献
- Batz, M., Hoffmann, S., Morris, J. G. Disease-outcome trees, eq-5d scores, and estimated annual losses of quality-adjusted life years (qalys) for 14 foodborne pathogens in the united states. Foodborne Pathogens and Disease. 11 (5), 395-402 (2014).
- . The Grand Challenge: Salmonella Available from: https://tellus.ars.usda.gov/stories/articles/the-grand-challenge-salmonella (2024)
- National Advisory Committee on Microbiological Criteria in Foods (NACMCF). Response to questions posed by the food safety and inspection service: Enhancing Salmonella control in poultry products. J Food Prot. 82 (4), 645-668 (2019).
- Food Safety and Inspection Service. . 4.15 Isolation and identification of Salmonella from meat, poultry, pasteurized egg, siluriformes (Fish) products and carcass and environmental sponges. , (2024).
- Irwin, P., Reed, S., Brewster, J., Nguyen, L., He, Y. P. Non-stochastic sampling error in quantal analyses for campylobacter species on poultry products. Analytical and Bioanalytical Chemistry. 405 (7), 2353-2369 (2013).
- Irwin, P., Tu, S., Damert, W., Phillips, J. A modified gauss-newton algorithm and ninety-six well micro-technique for calculating mpn using excel spreadsheets. Journal of Rapid Methods & Automation in Microbiology. 8 (3), 171-191 (2000).
- Ravishankar, S., Ahmed, E. Y., Carlstrom, C. Food microbiology: A laboratory manual. Food Microbiology. 21, 489 (2004).
- Chen, C. Y., Nace, G. W., Irwin, P. L. A 6 x 6 drop plate method for simultaneous colony counting and mpn enumeration of campylobacter jejuni, listeria monocytogenes, and escherichia coli. J Microbiol Methods. 55 (2), 475-479 (2003).
- Suo, B., He, Y., Tu, S. I., Shi, X. A multiplex real-time polymerase chain reaction for simultaneous detection of salmonella spp., escherichia coli o157, and listeria monocytogenes in meat products. Foodborne Pathogens and Disease. 7 (6), 619-628 (2010).
- Jarvis, B., Wilrich, C., Wilrich, P. T. Reconsideration of the derivation of most probable numbers, their standard deviations, confidence bounds and rarity values. J Appl Microbiol. 109 (5), 1660-1667 (2010).
- Stevens, R., Poppe, K. Validation of clinical prediction models: What does the "calibration slope" really measure. Journal of Clinical Epidemiology. 118, (2019).
- Miller, M. E., Hui, S. L., Tierney, W. M. Validation techniques for logistic regression models. Statistics in Medicine. 10 (8), 1213-1226 (1991).
- Galán-Relaño, &. #. 1. 9. 3. ;., et al. Salmonella and salmonellosis: An update on public health implications and control strategies. Animals. 13 (23), 3666 (2023).
- Gorski, L., et al. Growth assessment of salmonella enterica multi-serovar populations in poultry rinsates with commonly used enrichment and plating media. Food Microbiology. 119, 104431 (2024).
- Schmidt, J. W., et al. Evaluation of methods for identifying poultry wing rinses with salmonella concentrations greater than or equal to 10 cfu/ml. J Food Prot. 87 (11), 100362 (2024).
- Gorski, A., Liang, L. S. Effect of enrichment medium on real-time detection of salmonella enterica from lettuce and tomato enrichment cultures. Journal of Food Protection. 73 (6), 1047-1056 (2010).
- Guillén, S., Nadal, L., Álvarez, I., Mañas, P., Cebrián, G. Impact of the resistance responses to stress conditions encountered in food and food processing environments on the virulence and growth fitness of non-typhoidal salmonellae. Foods. 10 (3), 617 (2021).
- Rohde, A., Hammerl, J. A., Appel, B., Dieckmann, R., Al Dahouk, S. Sampling and homogenization strategies significantly influence the detection of foodborne pathogens in meat. BioMed Research International. 2015, (2015).
- Wang, D., Wang, Z., He, F., Kinchla, A. J., Nugen, S. R. Enzymatic digestion for improved bacteria separation from leafy green vegetables. Journal of Food Protection. 79 (8), 1378-1386 (2016).
- Pitard, F. F. . Theory of sampling and sampling practice. , (2019).
- Sharpe, A. . in Detecting pathogens in food. , 52-68 (2003).
- Hannah, J., et al. Effect of stomaching on numbers of bacteria recovered from chicken skin. Poultry Science. 90 (2), 491-493 (2011).
- Mcmeekin, T., Thomas, C. Retention of bacteria on chicken skin after immersion in bacterial suspensions. Journal of Applied Bacteriology. 45 (3), 383-387 (1978).
- Rodrigues-Szulc, U., Ventoura, G., Mackey, B., Payne, M. Rapid physicochemical detachment, separation and concentration of bacteria from beef surfaces. Journal of Applied Bacteriology. 80 (6), 673-681 (1996).
- Vibbert, H. B., et al. Accelerating sample preparation through enzyme-assisted microfiltration of salmonella in chicken extract. Biotechnol Prog. 31 (6), 1551-1562 (2015).
- Armstrong, C. M., et al. Use of a commercial tissue dissociation system to detect salmonella-contaminated poultry products. Analytical and Bioanalytical Chemistry. 416 (3), 621-626 (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved