Method Article
تم تعديل مقايسة الأرقام الأكثر احتمالا لتحديد كمية السالمونيلا في منتجات الدجاج النيئة والجاهزة للطهي
In This Article
Summary
يعد القياس الدقيق للسالمونيلا في الدواجن عند المستويات المنخفضة تحديا صناعيا وتنظيميا حاليا. يصف هذا البروتوكول اختبار MPN الذي يتيح القياس الكمي للسالمونيلا في منتجات الدواجن النيئة والجاهزة للطهي. هذه الطريقة سريعة وحساسة وتتوافق مع إرشادات FSIS ، وتعزز سلامة الأغذية وتدعم جهود الصحة العامة.
Abstract
السالمونيلا هي سبب رئيسي للأمراض المنقولة بالغذاء في الولايات المتحدة ، لا سيما في منتجات الدواجن. تركز الطرق التقليدية للكشف عن السالمونيلا على الانتشار بدلا من القياس الكمي ، مما يحد من فائدتها في تقييم مستويات التلوث ومخاطره. تقدم هذه الدراسة مقايسة جديدة للرقم الأكثر احتمالا (MPN) مصممة لتحديد كمية السالمونيلا في منتجات الدواجن الجاهزة للطهي ، مثل كوردون بلو الدجاج. تتضمن الطريقة غسل عينة الدواجن ، وتركيز الشطف من خلال الطرد المركزي ، وتخفيفها بشكل متسلسل في كتلة 48 بئرا. تم دمج مقايسة MPN مع طريقة التضخيم متساوي الحرارة بوساطة الحلقة (LAMP) لتوفير تقدير كمي حساس ودقيق وسريع لتلوث السالمونيلا في نفس الإطار الزمني مثل بروتوكولات خدمة سلامة الأغذية والتفتيش (FSIS) الحالية. أظهرت النتائج وجود ارتباط خطي قوي بين قياسات MPN-LAMP ومستويات التلقيح النظرية (R² = 0.933). ومع ذلك ، فإن التباين عند التركيزات المنخفضة يسلط الضوء على التحديات في الكشف الدقيق عن السالمونيلا عند هذه المستويات ، مع الحد الأدنى العملي للكشف المقدر بحوالي 300 CFU / g. تشمل التحسينات المحتملة لتحسين قابلية تطبيق البروتوكول زيادة الكمية المأخوذة من العينات لتحسين حد الكشف ، وتحسين تركيبات وسائط التخصيب ، وتوسيع الكشف الجزيئي لاستهداف العديد من مصلات السالمونيلا . بشكل عام ، تقدم هذه الدراسة أداة عملية لصناعة الأغذية ، مما يتيح القياس الكمي الموثوق به لتلوث السالمونيلا في منتجات الدواجن ، مما يساهم في تحسين سلامة الأغذية والصحة العامة.
Introduction
باعتبارها سببا رئيسيا للأمراض المنقولة بالغذاء والاستشفاء والوفاة في الولايات المتحدة ، فإن السالمونيلا لها تأثير كبير على الصحة العامة والاقتصاد. بلغ العبء الاقتصادي المقدر لمسببات الأمراض في عام 2013 وحده 3.67 مليار دولار1. على الرغم من أن المبادرات التنظيمية الأخيرة تهدف إلى الحد من داء السلمونيلات بنسبة 25٪ بحلول عام 20302 ، إلا أن الفجوات في استراتيجيات الكشف والتخفيف الحالية لا تزال واضحة ، لا سيما في مواءمة ترصد مصانع المعالجة مع نتائج الصحة العامة3 .
وتشكل منتجات الدواجن المجمدة الجاهزة للطهي، والتي تورطت في تفشي السالمونيلا المتعددة، مصدر قلق كبير للصحة العامة. ردا على ذلك ، صنفت خدمة سلامة الأغذية والتفتيش (FSIS) السالمونيلا على أنها مادة مغشوشة في هذه المنتجات. حاليا ، يركز دليل مختبر علم الأحياء الدقيقة FSIS (MLG) 4.15 فقط على تحديد انتشار السالمونيلا في منتجات الدواجن4. بموجب هذا المبدأ التوجيهي ، يتم إثراء العينات التي تم جمعها لمدة 18-24 ساعة ثم يتم فحصها باستخدام نظام الكشف الجزيئي (MDS) ، الذي يحدد وجود أو عدم وجود السالمونيلا ولكنه لا يقدم نظرة ثاقبة لمستوى التلوث. في حين أن هذا النهج ذو قيمة للكشف عن وجود مسببات الأمراض ، إلا أنه يفشل في توفير معلومات كمية يمكن أن تساعد معالجي الأغذية على تقييم مخاطر التلوث بشكل أكثر دقة واتخاذ إجراءات تصحيحية مستهدفة.
في هذه الدراسة ، قمنا بتطوير طريقة لزيادة الكشف من انتشار مسببات الأمراض الميكروبية إلى القياس الكمي. تم تصميمه للتكامل السلس في العمليات الحالية للكشف عن السالمونيلا في منتجات الدواجن مع الحد الأدنى من التعطيل لبروتوكولات FSIS الحالية. بدلا من مجرد إثراء العينة السائبة ، تبدأ الطريقة بغسل منتجات الدواجن باستخدام وسائط تتفق مع طرق FSIS الحالية. ثم يتم توزيع الشطف في العمود الأول من كتلة بئر بعمق 48. يتم إجراء التخفيفات التسلسلية عبر الأعمدة الخمسة المتبقية ، ويتم احتضان الكتلة لمدة 18-24 ساعة ، بما يتماشى مع بروتوكول MLG 4.15. بعد الحضانة ، يتم اختبار الآبار بحثا عن السالمونيلا ، وتستخدم النتائج لحساب الرقم الأكثر احتمالا (MPN) 5،6. يسمح هذا النهج بتحديد كمية التلوث في نفس الإطار الزمني لعملية FSIS الحالية ، مما يجعله خيارا عمليا للاستخدام الصناعي والتنظيمي على حد سواء. يوضح الشكل 1 مخططا كتليا يلخص مقايسة MPN المعدلة. يتضمن الشكل صورا تم التقاطها بخطوات محددة ، والكتلة المكونة من 48 بئرا المستخدمة في تخفيف ونمو التكرارات ، والتقنيات الثلاث المستخدمة كمقاييس لتقييم العدد الأكثر احتمالا من السالمونيلا الموجودة في الدجاج المفروم. في المرحلة الأولى من هذه الدراسة ، استخدمنا الدجاج المفروم المشع لتقليل تأثير البكتيريا الدقيقة في الخلفية وعدم اليقين في القياسات المتعلقة باللقاح الذي تم التحقق منه قبل تطبيق البروتوكول على عينات الدجاج غير المشععة.
Protocol
ملاحظة: يجب إجراء جميع الأعمال المرتبطة بهذا البروتوكول داخل مختبر السلامة البيولوجية المستوى 2 (BSL-2). عند الاقتضاء ، يجب إجراء هذا البروتوكول داخل خزانة السلامة البيولوجية (BSC) للحفاظ على الظروف المعقمة وتقليل مخاطر تلوث العينة أو تعرض المشغل لمسببات الأمراض الميكروبية. عند نقل العينات خارج BSC ، استخدم حاويات محكمة الغلق للحفاظ على سلامة العينة ومنع الانسكاب في حالة السقوط العرضي. يفضل استخدام المكونات التي تستخدم لمرة واحدة طوال الإجراء للتخفيف من احتمالية التلوث المتبادل. في الحالات التي لا تكون فيها المستهلكات ممكنة ، تأكد من أن جميع المعدات والمواد معقمة قبل الاستخدام. الإدارة السليمة للنفايات أمر بالغ الأهمية. يجب التخلص من جميع المكونات المستخدمة التي تستخدم لمرة واحدة كنفايات بيولوجية. الأوتوكلاف المواد القابلة لإعادة الاستخدام قبل إعادة استخدامها لضمان التعقيم المناسب واحتواء المواد التي يحتمل أن تكون خطرة. لا يؤدي الالتزام بهذه الاحتياطات إلى حماية سلامة العينة فحسب ، بل يقلل أيضا من مخاطر تعرض المشغل لمسببات الأمراض الميكروبية.
1. تحضير عينات اللحوم
- الحصول على عينات اللحوم ومعالجتها
- لحم طازج
- احصل على الدجاج المفروم من قسم اللحوم الطازجة لتجار التجزئة المحليين. انقل جميع العينات إلى التخزين عند 4 درجات مئوية وقم بمعالجتها في غضون 24 ساعة بعد الاستلام. قسم اللحم بشكل معقم إلى عينات 25 جم.
- ختم الفراغ وإشعاع العينة. هنا ، قام مركز تكساس إيه آند إم AgriLife الوطني لأبحاث شعاع الإلكترون بتشعيع اللحوم المعرضة لجرعة ~ 25 كيلو جراي.
ملاحظة: بينما تم استخدام التشعيع كإجراء للتحكم في هذه الدراسة لضمان القضاء على البكتيريا الدقيقة في الخلفية ، إلا أنه ليس شرطا مسبقا للبروتوكول في التطبيقات العملية كما هو موضح في المنتجات الجاهزة للطهي غير المشعة المستخدمة في القسم التالي. وفي السياقات الميدانية، يمكن للطرق البديلة مثل الوسائط الانتقائية أو خصوصية التشخيص الجزيئي أن تعالج التداخل المحتمل من الكائنات الحية الدقيقة غير المستهدفة.
- منتجات الدجاج الجاهزة للطهي
- احصل على منتجات الدجاج الجاهزة للطهي من قسم الأطعمة المجمدة لتجار التجزئة المحليين. تقسم بشكل معقم إلى عينات 25 جم.
- اجمع عينات من وسط القطع الفردية للتأكد من تضمين جميع المكونات (مثل الخبز والجبن).
- لحم طازج
- إعداد وسائل الإعلام
- تحضير ماء الببتون المخزن (BPW) عن طريق إذابة 25 جم من مسحوق BPW في 1 لتر من H2O نقي.
- تحضير لوحات تسريب القلب في الدماغ (BHI). للقيام بذلك ، قم بإذابة 37 جم من مسحوق BHI في 1 لتر من H2O النانوي وأضف 15 جم من الأجار إلى محلول BHI. تعقيم جميع الوسائط عن طريق التعقيم عند 121 درجة مئوية لمدة 15 دقيقة. صب 20 إلى 25 مل من الوسائط في أطباق بتري بغطاء شفاف (100 مم × 15 مم).
ملاحظة: من الأفضل صب الألواح داخل خزانة السلامة البيولوجية للحفاظ على الظروف المعقمة.
2. زراعة الخلايا
- قم بإعداد المزرعة الأولية عن طريق وضع خط السالمونيلا المعوية المصلية Typhimurium ATCC 14028 على صفيحة أجار BHI واحتضانها عند 37 درجة مئوية طوال الليل.
- قم بإعداد المزارع الليلية عن طريق تلقيح 25 مل من مرق BHI بمستعمرة واحدة من السالمونيلا المزروعة حديثا. تنمو الثقافات الهوائية بين عشية وضحاها عند 37 درجة مئوية مع الاهتزاز عند 100 دورة في الدقيقة.
3. تلقيح عينات الدواجن
- تخفيف الثقافة والطلاء
- إعداد سلسلة من التخفيفات بمقدار 10 أضعاف للاستزراع الليلي في BPW لتحقيق تركيزات نهائية تبلغ حوالي 1 × 108 إلى 1 × 101 CFU/mL. افترض أن تركيز ثقافة السالمونيلا بين عشية وضحاها هو 1 × 109 CFU / مل.
- انقل 0.5 مل من المزرعة الليلية إلى 4.5 مل من BPW ، واخلطها ، ثم انقل 0.5 مل من التخفيف إلى 4.5 مل من BPW لكل تخفيف إضافي.
- انشر 10 ميكرولتر من تخفيف 1 × 103 CFU / مل على صفيحة أجار BHI في ثلاث نسخ لتعداد الخلايا لحساب تركيز المزرعة الليلية.
- تلقيح عينات اللحوم
- انقل 25 جراما من الدجاج المفروم المشع بشكل معقم إلى كيس معقم في نسختين. يبلغ حجم الحقيبة 7.5 × 12 بوصة وتحمل علامة 1.63 لتر. تحتوي الحقيبة على قسم مرشح بقطر ثقب 330 ميكرومتر ، ويوجد 285 لكل سم مربع.
- تلقيح كل عينة ب 1 مل من تخفيف التركيز المستهدف. على سبيل المثال ، أضف 1 مل من المزرعة من تخفيف 1 × 10 درجة CFU / مل لتحقيق مستوى من التلوث يبلغ حوالي 1,000 خلية / 25 جم دجاج. قم بتوزيع اللقاح السائل برفق على سطح عينات الدجاج باستخدام موزع خلية معقم واتركه يقف لمدة ساعة واحدة عند 4 درجات مئوية.
- قم بإعداد عينات تحكم سلبية عن طريق إضافة 1 مل من BPW المعقم.
4. معالجة العينة
- أضف 225 مل من BPW إلى كل عينة. تم اختيار نسبة الحجم إلى الوسائط لتتماشى مع FSIS MLG 4.154.
- قم بتجانس العينات باستخدام Stomacher7 بالسرعة العادية ومدة 120 ثانية.
- الطرد المركزي وإعادة التعليق
- قم بإزالة السائل بعناية من الجانب المصفى من الكيس باستخدام ماصة سعة 50 مل. قسم السائل إلى زجاجتين معقمتين للطرد المركزي.
- قم بموازنة الزجاجات باستخدام BPW المعقم لضمان أوزان متساوية. الطرد المركزي للعينات عند 10,000 × جم لمدة 10 دقائق. تخلص من المادة الطافية. أعد تعليق حبيبات الخلية في 3 مل من مرق BPW باستخدام ملعقة معقمة.
- أضف 27 مل إضافيا من مرق BPW واخلطه جيدا عن طريق التقليب باستخدام ملعقة. اجمع محتويات زجاجتي الطرد المركزي في زجاجة واحدة لكل عينة.
5. إعداد كتلة MPN
ملاحظة: يصور الجدول 1 مخططا للتخفيفات في كتلة مكونة من 48 بئرا.
- أضف 3 مل من العينة المعلقة إلى كل بئر في العمود 1 من الكتلة المكونة من 48 بئرا (8 مكررات).
- قم بإعداد سلسلة من التخفيفات بمقدار 10 أضعاف عبر الأعمدة من 1 إلى 6 داخل الكتلة باستخدام ماصة ثماني القنوات.
- أضف 0.3 مل من العينة إلى 2.7 مل من ماصة BPW للخلط. كرر لكل تخفيف. احتضان الكتل بين عشية وضحاها (~ 18 ساعة) عند 37 درجة مئوية مع الاهتزاز عند ~ 100 دورة في الدقيقة.
6. الطلاء والتعداد
- تعداد لوحة الإسقاط المعدلة
- صفيحة 7 ميكرولتر من العينة المزروعة بين عشية وضحاها من كل مخفف في شبكة 4 × 6 على صفيحة أجار باستخدام ماصة متعددة القنوات (الشكل 2). إن استخدام شبكة 4 × 6 على لوحين يستوعب 8 عينات بشكل أفضل ، على عكس الشبكة النموذجية 6 × 6 من القطرات8.
- اترك الأطباق تجف في الهواء لمدة 10 دقائق قبل الحضانة. احتضان ألواح الأجار بين عشية وضحاها (~ 18-24 ساعة) عند 37 درجة مئوية. بعد الحضانة ، احسب عدد المستعمرات في كل لوحة.
7. الكشف عن qPCR للسالمونيلا
- استخراج الحمض النووي باستخدام مجموعة تجارية
- امزج الثقافات في كتلة 48 بئرا عن طريق سحب العينات لأعلى ولأسفل عدة مرات. ماصة 200 ميكرولتر من كل مزرعة في لوحة PCR سعة 96 بئر.
- قم بإغلاق اللوحة ثم طردها بجهاز الطرد المركزي عند 6,600 × جم لمدة 10 دقائق. قم بإزالة المادة الطافية وأضف 20 ميكرولتر من كاشف المجموعة إلى الحبيبات.
- أعد تعليق الحبيبات عن طريق سحب العينات لأعلى ولأسفل. أغلق الطبق وسخنه عند 99 درجة مئوية لمدة 10 دقائق ، متبوعا بالتبريد إلى 20 درجة مئوية.
- جهاز الطرد المركزي مرة أخرى عند 6,600 × جم لمدة 10 دقائق. استخدم 2 ميكرولتر من المادة الطافية لتحليل qPCR.
- إعداد اللوحة
- تحضير خليط تفاعل qPCR وفقا للبروتوكولالمعمول به 9 على النحو التالي: 10 ميكرولتر من 2x Master Mix ؛ 0.4 ميكرولتر من كل برايمر ومسبار (حل عمل 10 ميكرومتر): invA إلى الأمام: 5'-GTTGAGGATGTTATTCGCAAGG-3 '، invA عكس الحمل: 5'-GGAGGCTTCCGGGTCAAG-3' ، مسبار invA: 5'-CCGTCAGACCTCTGGCAGTACCTTCCTC-3 'المسمى بصبغة الفلورين Cal Fluor Orange 560 ؛ 0.2 ميكرولتر من قالب التحكم في التضخيم الداخلي (IAC) (6 × 104 نسخ/ميكرولتر)9؛ 0.4 ميكرولتر من كل برايمر ومسبار IAC (10 ميكرومتر): IAC للأمام: 5'-GGCGCCCTACTACACCT-3' ، عكس IAC: 5'-TGGAAGCAATGCCAAATGTTA-3 '، مسبار IAC: 5'-TTACAACGGGAAGAAGACAATGCCACCA-3' الموسوم بصبغة TAMRA. اضبط مستوى الصوت باستخدام ddH2O إلى 20 ميكرولتر إجمالا.
- قم بإجراء تفاعل البوليميراز المتسلسل في الوقت الفعلي مع ظروف التدوير التالية9: 95 درجة مئوية لمدة 10 دقائق (التمسخ الأولي للحمض النووي وتنشيط البوليميراز الساخن ، 40 دورة من 95 درجة مئوية لمدة 15 ثانية و 60 درجة مئوية لمدة دقيقة واحدة ، استخدم إعدادات Ct الافتراضية لتصدير النتائج للتحليل.
8. الكشف باستخدام اختبار 3M MDS
- اتبع بروتوكول مجموعة فحص الكشف الجزيئي للسالمونيلا . امزج الثقافات في كتلة 48 بئرا عن طريق سحب العينات لأعلى ولأسفل عدة مرات. الماصة 20 ميكرولتر من كل عينة في أنبوب التحلل المقدم من المجموعة.
- سخني العينات على حرارة 100 درجة مئوية لمدة 15 دقيقة. سوف يتحول الحل من اللون الوردي إلى الأصفر. احتضان العينات لمدة 10 دقائق في درجة حرارة الغرفة. سيتغير الحل من الأصفر إلى الوردي.
- انقل 20 ميكرولتر من المحللة إلى أنبوب كاشف وقم بتحميل أنابيب الكاشف في الحامل.
- أضف الحامل إلى أداة MDS وقم بتكوين البرنامج لتوصيل المعلومات حول المجموعة والعينة. تتطلب الأداة تسمية كل بئر برقم الدفعة للفحص واسم العينة. قم بتشغيل برنامج MDS وتصدير التقرير.
9. تحليل البيانات
- تصنيف النتائج الإيجابية والسلبية.
- بالنسبة للطلاء بالقطرات 4 × 6 ، قم بتقييم البقع الموجودة على ألواح الأجار التي تحتوي على مستعمرة واحدة على الأقل على أنها إيجابية والبقع على ألواح الأجار التي لا يوجد بها نمو على أنها سلبية.
- بالنسبة إلى qPCR ، قم بتقييم الآبار التي تحتوي على CT أقل من أو يساوي 30 على أنها إيجابية والآبار التي تحتوي على CT أكبر من 30 على أنها سالبة.
- بالنسبة لمتلازمات خلل التنسج النقوي، استخدم النتائج المستمدة من نظام متلازمات خلل التنسج النقوي التي تم الإبلاغ عنها على أنها إيجابية أو سلبية.
- حساب MPN
- قم بتحليل الإيجابيات والسلبيات المشروحة باستخدام طريقة دقة الاحتمالية القصوى البسيطة (SMPR) الموضحة سابقا6 أو حاسبات MPN البديلة التي تم التحقق منها. 10
النتائج
اللحوم المشعة
في تحليل الانحدار ، يشير ميل 1 إلى أنه مقابل كل زيادة في الوحدة في المتغير المستقل (المحور x) ، يزداد المتغير التابع (المحور y) بمقدار وحدة واحدة بالضبط. يشير هذا إلى وجود علاقة تناسبية بين المتغيرين ، مما يعني أن التغيير في المتغير التابع يعكس التغيير في المتغير المستقل. يعني تقاطع 0 أنه عندما يكون المتغير المستقل هو 0 ، فإن المتغير التابع هو 0 أيضا. يشير هذا إلى أنه لا يوجد إزاحة ثابتة أو تحيز في العلاقة بين المتغيرين. يشير ميل 1 وتقاطع 0 معا إلى الاتفاق بين المتغيرات11،12. يشير هذا السيناريو المثالي إلى عدم وجود خطأ أو تحيز منهجي وسيكون النتيجة المتوقعة في نظام جيد المعايرة حيث تتماشى القياسات تماما مع التنبؤات.
يعرض الشكل 3 أ مقايسة MPN-LAMP (المحور y) المرسومة مقابل اللقاح النظري الذي تم التحقق منه بواسطة تحليل لوحة الانتشار الذي تمت مناقشته في الملاحظة الواردة في الخطوة 3.1.1. (المحور السيني). تشير معادلة خط الانحدار ، y = -72.36 + 0.161x ، بقيمة R² 0.978 ، إلى وجود ارتباط خطي قوي بين نتائج MPN-LAMP ومستويات البكتيريا الملقحة. تشير قيمة R² العالية إلى أن اختبار MPN-LAMP موثوق به للغاية في التنبؤ الكمي بالتلوث البكتيري. ومع ذلك ، فإن الميل 0.161 ينحرف بشكل كبير عن المنحدر المثالي ل 1 ، مما يشير إلى أن طريقة MPN-LAMP تقلل من تقدير اللقاح ، وتتنبأ بنسبة 16.1٪ فقط من تركيز البكتيريا في اللقاح النظري. بالإضافة إلى ذلك ، يشير الاعتراض السلبي البالغ -72.36 إلى وجود تحيز سلبي عند تركيزات أقل ، مما يؤدي إلى مزيد من الانحراف عن المثالي.
يوضح الشكل 3 ب طريقة MPN-qPCR (المحور y) المرسومة مقابل اللقاح النظري (المحور السيني). يوضح خط الانحدار ، y = -46.84 + 0.0395x ، بقيمة R² 0.978 ، علاقة خطية قوية بين مقايسة MPN-qPCR واللقاح النظري. على الرغم من أن ارتفاع R² يشير إلى ارتباط قوي ، إلا أن ميل 0.0395 أصغر من ميل نتائج MPN-LAMP ، مما يشير إلى درجة أكبر من التقليل من التلوث البكتيري بواسطة MPN-qPCR. يشير الاعتراض السلبي البالغ -46.84 إلى تحيز هبوطي محتمل عند تركيزات أقل.
يعرض الشكل 3C نتائج طلاء MPN (المحور y) المرسومة مقابل اللقاح النظري (المحور x) ، مع معادلة انحدار y = -330.4 + 0.3138x وقيمة R² تبلغ 0.944. في حين أن قيمة R² هذه تشير إلى علاقة خطية قوية ، إلا أنها أقل قليلا من تلك الخاصة بنتائج MPN-LAMP و MPN-qPCR ، مما يشير إلى تباين أكبر في القياس الكمي للمستعمرة. لا يزال الميل البالغ 0.3138 ، على الرغم من أنه أعلى من المنحدرات التي لوحظت في الطرق الأخرى ، يشير إلى التقليل من تركيز البكتيريا بالنسبة للتلقيح النظري. بالإضافة إلى ذلك ، يشير الاعتراض السلبي البالغ -330.4 إلى تحيز كبير ، خاصة عند التركيزات المنخفضة ، مما قد يشير إلى عدم دقة محتملة في تقنيات الطلاء أو معالجة العينات. يمكن أن يشير هذا الانخفاض الطفيف في R² والتباين الذي لوحظ إلى أن عملية الطلاء التقليدية أكثر تغيرا من الطرق الجزيئية.
طرق المقارنة
أظهرت جميع الطرق الثلاث (MPN-LAMP ، MPN-plating ، و MPN-qPCR) ميلا إلى التقليل من مستويات البكتيريا بالنسبة للتلقيح النظري. يمكن أن يعزى هذا التقليل من التقدير إلى مشكلات استعادة الخلايا ، حيث قد لا تنفصل السالمونيلا تماما عن سطح الدجاج أو الجسيمات أثناء المعالجة ، مما يقلل من نقلها إلى الشطف أو الفحص. نظرا لأن السالمونيلا تم تلقيحها مباشرة على الدجاج ، فقد يرتبط جزء من الخلايا البكتيرية بقوة بالسطح ، مما يحد من التعافي في خطوة الشطف. بالإضافة إلى ذلك ، قد تظل بعض الخلايا مرتبطة بالجسيمات الموجودة في الحبيبات بعد الطرد المركزي ، مما يقلل من التعافي. يمكن لأساليب مثل العلاجات الأنزيمية أو المعالجة الميكانيكية أو بروتوكولات المعدة المحسنة أن تعزز الانفصال البكتيري. وتناقش هذه الاستراتيجيات بمزيد من التفصيل في قسم المناقشة، مع التأكيد على قدرتها على تحسين معدلات التعافي
يعرض الشكل 4 أ الاسترداد على المحور y مقابل ثلاث طرق MPN على المحور x. أسفرت النسبة المئوية للاسترداد ، المحسوبة كنسبة من قيمة MPN إلى مستوى التلقيح النظري ، عن النتائج التالية: كان متوسط استرداد طريقة MPN-LAMP 15.19٪ مع انحراف معياري قدره 10.04٪. كان متوسط استرداد طريقة طلاء MPN بنسبة 13.13٪ مع انحراف معياري قدره 11.45٪. وكان متوسط استرداد طريقة MPN-qPCR بنسبة 6.67٪ مع انحراف معياري قدره 3.19٪. لم يحدد اختبار Tukey-Kramer HSD فرقا ذا دلالة إحصائية في التعافي بين الطرق (P > 0.1969) ، مما يشير إلى أن جميع الطرق الثلاث كان أداؤها متشابها من حيث الاسترداد عند معالجة الدجاج الملقح بالسالمونيلا.
على الرغم من المعالجة المتطابقة عبر طرق فصل السالمونيلا عن مصفوفة الدجاج ، فقد لوحظت اختلافات في الكشف بين MPN-LAMP و MPN-qPCR و MPN-plating. يشير هذا إلى أن العوامل التي تتجاوز الفصل المادي للبكتيريا عن العينة قد تؤثر على الكشف. يمكن أن يتداخل وجود مثبطات في مصفوفة العينة مع الطرق الجزيئية - qPCR و LAMP - مما يؤثر على حساسيتها وأدائها العام. بالإضافة إلى ذلك ، قد تكون صلاحية البكتيريا قد أثرت على قدرة السالمونيلا على النمو على ألواح أجار الصلبة (طلاء MPN) مقابل المرق السائل (qPCR ، LAMP) ، مما يؤدي إلى اختلاف في التعافي بين الطرق.
لمزيد من استكشاف حساسية الطرق ، قمنا أولا بفحص عدد الاستجابات الإيجابية عند كل تخفيف ل MPN-LAMP ، MPN-qPCR ، و MPN-Plating عبر سبع تجارب مستقلة (الجدول 2). في التخفيفات المنخفضة (1 × 10-5 و 1 × 10-4) ، أظهر MPN-LAMP عددا أكبر من الاستجابات الإيجابية مقارنة بكل من طلاء MPN و MPN-qPCR ، مما يشير إلى أن طريقة LAMP أكثر حساسية للتركيزات المنخفضة من السالمونيلا. عندما كانت العينات أكثر تركيزا (التخفيفات أقل من 1 × 10-3) ، أظهرت الطرق الثلاث زيادة في الاكتشافات الإيجابية ، مع حدوث تقارب حول التخفيف 1 × 10-2 ، حيث اكتشفت جميع الطرق عددا مماثلا من العينات الموجبة.
يعرض الشكل 4 ب النسبة المئوية للقياسات الإيجابية عند كل تخفيف عبر الطرق الثلاث ، مما يوفر مقارنة مباشرة لحساسيتها في الكشف عن السالمونيلا. توفر النسبة المئوية للاستجابات الإيجابية تصورا أوضح لأداء الطريقة عبر سلسلة التخفيف ، وتوفر أشرطة الخطأ التي تمثل فترات ثقة Clopper-Pearson (CI) بنسبة 95٪ ± نظرة ثاقبة للتباين في كل مستوى. في التخفيفات المنخفضة ، تشير فترات الثقة الأوسع إلى تباين أكبر في أداء الكشف لكل طريقة. تماشيا مع العدد الخام للاكتشافات الإيجابية ، يكتشف MPN-LAMP نسبة أعلى من العينات الإيجابية بتركيزات أكثر تمييعا (1 × 10-5) ، بينما يكتشف MPN-qPCR و MPN-plating عددا أقل من الإيجابيات. مع زيادة تركيز البكتيريا ، تتقارب الطرق ، حيث تظهر جميع الأساليب الثلاثة ما يقرب من 100٪ اكتشافا بتركيزات أعلى (على سبيل المثال ، 1 × 10-2 وما فوق). يشير تضييق فترات الثقة عند هذه التركيزات الأعلى إلى اتساق أكبر عبر جميع الطرق ، مما يؤكد أدائها المماثل عندما تكون مستويات البكتيريا أعلى.
تشير النتائج الواردة في الشكل 3 إلى أن التنبؤ الناقص المتسق (كميا) لجميع الطرق الثلاث يمكن أن يكون مدفوعا بالفصل غير الكامل للسالمونيلا عن مصفوفة العينة. ومع ذلك ، يمكن أن تؤدي المثبطات الجزيئية أو عوامل الجدوى البكتيرية إلى التباين الملحوظ في الكشف عند التخفيفات المختلفة (نوعيا) وعبر طرق مختلفة (نوعيا وكميا). تشير فترات الثقة الأكثر إحكاما عند التركيزات الأعلى في الشكل 4 ب إلى تباين أقل وأداء نوعيا أكثر اتساقا عبر الطرائق ، بينما تشير الفواصل الأوسع عند التركيزات المنخفضة إلى زيادة عدم اليقين في الكشف النوعي.
الكشف في الدجاج الجاهز للطهي
اخترنا طريقة LAMP للكشف عن السالمونيلا في الدجاج الجاهز للطهي حيث أظهرت عددا أكبر من العينات الإيجابية (14.3٪) مقارنة بالطرق الأخرى التي تم اختبارها عند أدنى تخفيف للسالمونيلا . عند أدنى تخفيف للسالمونيلا (1 × 10-5) ، لم يتم اكتشاف أي من العينات على أنها إيجابية بواسطة طريقة qPCR الداخلية. من ناحية أخرى ، تم الكشف عن بعض الإيجابيات عن طريق الطلاء (7.1٪ ، نصف العدد الذي اكتشفه LAMP). ومع ذلك ، قد تتأثر نتائج هذه الطريقة القائمة على الثقافة عند الانتقال إلى منتجات أكثر تعقيدا مثل الدجاج الجاهز للطهي ، حيث يمكن أن يؤدي وجود البكتيريا الدقيقة في الخلفية إلى تحريف النتائج لأن العينات لا تتعرض للإشعاع. لهذه الأسباب ، قررنا التحقيق في طريقة MPN-LAMP لقياس السالمونيلا من الدجاج الجاهز للطهي.
يوضح الشكل 5 نتائج اختبار MPN-LAMP المستخدم لتحديد سمك السالمونيلا في عينات كوردون بلو الدجاج الملقحة والمجمدة والجاهزة للطهي. تم رسم المستوى النظري للتلقيح (CFU / g) على المحور x ، بينما تم رسم قياسات MPN-LAMP المقابلة على المحور y. أسفر تحليل الانحدار عن المعادلة y = -15.04 + 0.3869x ، مع معامل تحديد (R²) قدره 0.933 ، مما يشير إلى وجود ارتباط خطي قوي بين التلقيح النظري ونتائج MPN-LAMP تشير قيمة R² العالية هذه إلى أن طريقة MPN-LAMP تحدد بشكل موثوق السالمونيلا في هذه العينات ، على الرغم من أن الميل 0.3869 يشير إلى أن الطريقة تقلل من مستوى اللقاح الفعلي. تمثل المنطقة المظللة حول خط الانحدار فاصل الثقة بنسبة 95٪.
لتوضيح أداء MPN-LAMP بشكل أفضل عند مستويات التلقيح المنخفضة ، يقوم الرسم البياني الداخلي في الشكل 5 بتكبير نقاط البيانات التي تقل عن 300 CFU / g. بناء على معادلة الانحدار ، يمكن تقدير الحد الأدنى للكشف بحوالي 40 CFU / g (38.9 CFU / g). ومع ذلك ، فإن فاصل الثقة 95٪ يشير إلى أن الحد الأدنى العملي للكشف أقرب إلى 325 CFU / g ، حيث يجب تفسير أي قيم سالبة MPN-LAMP على أنها صفر. يمثل الخط الأحمر في الداخل صفرا ، وعلى الرغم من عدم وجود نقاط بيانات أسفل هذا الخط ، فإن احتمال انخفاض القيم إلى ما دون الصفر ، خاصة عند مستويات التلقيح المنخفضة ، يقدم إمكانية نتائج سلبية كاذبة. ويسلط هذا الاتجاه الضوء على صعوبات القياس الكمي الدقيق للسالمونيلا عند التركيزات المنخفضة، وستكون هناك حاجة إلى بيانات إضافية لتحديد الحد الأدنى للكشف بشكل نهائي.

الشكل 1: مخطط كتلة لمقايسة MPN المعدلة للكشف عن السالمونيلا. نظرة عامة تخطيطية على مقايسة الرقم الأكثر احتمالية المعدلة. يحدد الخطوات الرئيسية في العملية ، بدءا من تلقيح عينات الدجاج المفروم المشهد ، متبوعا بتجانس العينة ، والطرد المركزي ، وتوزيع الحصص ، والحضانة في ظل ظروف محددة. يتضمن الشكل صورا فوتوغرافية للكتلة المكونة من 48 بئرا المستخدمة في التخفيف وتكرار النمو ، إلى جانب ثلاث تقنيات تستخدم لإنتاج نتائج إيجابية وسلبية لحساب دقة الاحتمالية القصوى البسيطة (SMPR). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: تخطيطي لمقايسة لوحة الإسقاط. إعداد مقايسة لوحة الإسقاط لتخفيف معين (على سبيل المثال ، غير مخفف ، 10-1 ، 10-2 ، إلخ) من كتلة 48 بئرا. يتم طلاء كل عينة بتنسيق شبكي 4 × 6 على لوحة أجار باستخدام ماصة متعددة القنوات. تم تعديل التصميم من الشبكة التقليدية 6 × 6 إلى شبكتين 4 × 6 لضمان إمكانية استيعاب ستة مكررات من ثمانية تخفيفات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: مقارنة اللقاح مع طرق MPN. (أ) مخطط تركيز MPN-LAMP (المحور y) مقابل اللقاح النظري الذي تم التحقق منه عن طريق الطلاء (المحور x). يوضح خط الانحدار الملائم (y = -72.36 + 0.161x) مع معامل التحديد (R² = 0.978) علاقة خطية قوية. (ب) مخطط تركيز MPN-qPCR (المحور y) مقابل اللقاح النظري (المحور السيني) ، مع خط انحدار مناسب (y = -46.84 + 0.0395x) و R² = 0.978 ، مما يظهر ارتباطا قويا مماثلا. (ج) مخطط لتركيز طلاء MPN (المحور y) مقابل اللقاح النظري (المحور x) ، مع خط انحدار (y = -330.4 + 0.3138x) و R² = 0.944 ، مما يشير إلى ارتباط قوي ولكنه أقل قليلا من LAMP و qPCR. يتم عرض معادلة الانحدار ومعامل التحديد لكل شكل كملحق في الزاوية العلوية اليسرى من الرسوم البيانية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: مقارنة بين طرق MPN. (أ) يعرض الشكل النسبة المئوية للاسترداد ، محسوبة على أنها نسبة قيمة MPN إلى مستوى التلقيح النظري لطرق MPN-LAMP و MPN-Plating و MPN-qPCR. كان متوسط الاسترداد لطريقة MPN-LAMP 15.19٪ (±10.04٪) ، وكان متوسط استرداد طريقة MPN-PM 13.13٪ (± 11.45٪) ، وكان متوسط استرداد طريقة MPN-qPCR 6.67٪ (± 3.19٪). تسلط المخططات المربعة الضوء على توزيع بيانات الاسترداد ، مع الإشارة إلى القيم المتطرفة. تمثل أشرطة الخطأ نطاق البيانات في حدود 1.5 مرة من النطاق الربيعي (IQR). (ب) النسبة المئوية لاكتشاف السالمونيلا الإيجابية عند كل تخفيف عبر ثلاث طرق: MPN-LAMP (أزرق) ، طلاء MPN (أحمر) ، و MPN-qPCR (أخضر). يمثل المحور x مستويات التخفيف (10-6 إلى 10) ، ويظهر المحور y النسبة المئوية للقياسات الموجبة. تشير أشرطة الخطأ إلى فترات الثقة ± 95٪ من كلوبر-بيرسون ، والتي تعكس التباين في الكشف لكل طريقة. يظهر MPN-LAMP نسب مئوية أعلى من الاكتشافات مقارنة بالطرق الأخرى عند التخفيفات المنخفضة ، بينما تتقارب جميع الطرق بالقرب من 100٪ من الاكتشاف عند تركيزات أعلى. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
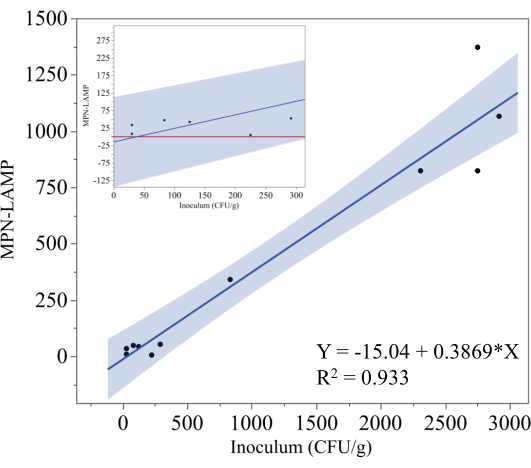
الشكل 5: طريقة MPN للدجاج الجاهز للطهي. ينتج تحليل الانحدار ل MPN-LAMP مقابل مستوى التلقيح النظري للسالمونيلا في عينات كوردون بلو الدجاج المجمدة والجاهزة للطهي. يتم تمثيل خط الانحدار ب y = -15.04 + 0.3869x مع R² قدره 0.933 ، مما يشير إلى وجود علاقة خطية قوية. تمثل المنطقة المظللة فاصل الثقة بنسبة 95٪. يركز الجزء الداخلي على قياسات MPN-LAMP عند مستويات التلقيح المنخفضة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| 1 | 2 | 3 | 4 | 5 | 6 | |
| A | ن = 1 | ن = 1 | ن = 1 | ن = 1 | ن = 1 | ن = 1 |
| B | 2 | 2 | 2 | 2 | 2 | 2 |
| C | 3 | 3 | 3 | 3 | 3 | 3 |
| D | 4 | 4 | 4 | 4 | 4 | 4 |
| E | 5 | 5 | 5 | 5 | 5 | 5 |
| F | 6 | 6 | 6 | 6 | 6 | 6 |
| G | 7 | 7 | 7 | 7 | 7 | 7 |
| H | 8 | 8 | 8 | 8 | 8 | 8 |
| 100 | 10-1 | 10-2 | 10-3 | 10-4 | 10-5 |
الجدول 1: تخطيطي للتكرارات والتخفيفات في كتلة 48 بئرا. يوضح هذا الشكل ترتيب التكرارات والتخفيفات التسلسلية 10 أضعاف داخل الكتلة المكونة من 48 بئرا. يمثل كل عمود عامل تخفيف محدد ، يتراوح من 100 إلى 10-5 مع تكرارات تقنية لكل تخفيف موزعة عبر الصفوف الثمانية.
| التخفيف | ||||||
| 10-5 | 10-4 | 10-3 | 10-2 | 10-1 | 100 | |
| مصباح MPN | 8 | 16 | 31 | 3 | 56 | 56 |
| طلاء MPN | 4 | 11 | 32 | 55 | 56 | 56 |
| MPN-qPCR | 0 | 7 | 26 | 55 | 56 | 56 |
الجدول 2: عدد الأحداث الإيجابية. يعرض الجدول عدد ردود الفعل الإيجابية (أكثر من 56 تكرارا إجماليا). يتم ترتيب النتائج في جدول حيث تمثل الأعمدة التخفيف ، وتمثل الصفوف الطريقة.
Discussion
أهمية البروتوكول
لا تزال السالمونيلا مصدر قلق كبير في سلامة الأغذية ، لا سيما في منتجات الدواجن ، والتي غالبا ما تكون متورطة في تفشي الأمراض المنقولة بالغذاء13،14. كسبب رئيسي للأمراض البكتيرية المنقولة بالغذاء في الولايات المتحدة ، فإن الطرق الموثوقة للكشف عن السالمونيلا في كل من منتجات الدواجن الطازجة والجاهزة للطهي ضرورية لضمان سلامةالأغذية 15. تعد القدرة على تحديد السالمونيلا عند المستويات المنخفضة أمرا حيويا لتحديد التلوث الذي قد لا يتم اكتشافه. تعتبر حساسية الطريقة مهمة بشكل خاص للامتثال التنظيمي والصحة العامة ، حيث يمكن أن تؤدي الجرعات المنخفضة من السالمونيلا إلى المرض ، خاصة في الفئات السكانية الضعيفة.
يستخدم مقايسة MPN-LAMP نظام MDS ، الذي يستخدمه حاليا FSIS في MLG 4.15 ، لتحديد انتشار التلوث4. يوفر الاختبار المقدم هنا امتدادا لطريقة FSIS الحالية لتحديد السالمونيلا القابلة للحياة ، حتى عند المستويات المنخفضة ، مما يوفر بيانات أكثر دقة عن مستوى التلوث. أظهرت نتائج هذه الدراسة وجود علاقة قوية بين طريقة MPN-LAMP وقيم التلقيح النظرية ، مع R² قدره 0.933 (الشكل 5). يشير هذا إلى أن الطريقة موثوقة لقياس السالمونيلا في الطعام ، على الرغم من حدوث بعض التقليل من التقدير عند مستويات التلقيح المنخفضة.
الخطوات الحاسمة
يتطلب بروتوكول القياس الكمي للسالمونيلا الدقة في تحضير العينة والتلقيح والتحليل الجزيئي. تعد تقنية التعقيم المناسبة والتخفيفات الدقيقة والالتزام بظروف الحضانة أمرا محوريا للكشف الموثوق به وتعداد السالمونيلا. يعد ضمان ظروف معقمة أثناء نقل عينات الدواجن ووسائط الدواجن أمرا ضروريا لمنع التلوث.
نفس القدر من الأهمية هو تجانس العينات أثناء المعدة ، متبوعا بإعادة تعليق الحبيبات بعناية بعد الطرد المركزي لفصل البكتيريا عن مصفوفة الطعام. يضمن التعامل السليم أثناء هذه الخطوات استعادة الخلايا القابلة للحياة لمزيد من التحليل. يعد سحب العينات الدقيق أثناء عملية التخفيف التسلسلي لإعداد MPN، إلى جانب ظروف الحضانة المتسقة، أمرا بالغ الأهمية للحصول على نتائج قابلة للتكرار.
أخيرا ، تتطلب طرق الكشف الجزيئي ، مثل qPCR ، الدقة وقابلية التكرار في استخراج الحمض النووي ودورة qPCR لتجنب السلبيات الكاذبة. على الرغم من أن استخراج الحمض النووي متغير بطبيعته ، إلا أن الكواشف والإجراءات الموحدة تضمن التكرار عن طريق تقليل تداخل المثبط وتحسين استعادة الحمض النووي. هذه الخطوات أساسية لتأكيد وجود السالمونيلا واستهداف علامات وراثية محددة يمكن أن تساعد في التغلب على القيود المفروضة على طرق الطلاء والتخصيب التقليدية.
المزالق والقيود المحتملة
الجدوى البكتيرية
أحد التحديات الأساسية لتنفيذ اختبار قائم على النمو مثل طلاء MPN هو الجدوى البكتيرية ، وهذا مناسب بشكل خاص لعينات الدجاج المعقدة الجاهزة للطهي. تعتبر منتجات الدجاج المجمدة والمغطاة بالبقسماط والمحشو ، مثل كوردون بلو الدجاج ، معرضة بشكل خاص لتقلبات درجات الحرارة وفترات التخزين الممتدة ، وكلاهما يمكن أن يضغط على خلايا السالمونيلا ويجعل اكتشاف العامل الممرض أكثر صعوبة في المقايسات القائمة على النمو. بالإضافة إلى ذلك ، فإن وجود مكونات غير دجاج (مثل الجبن ، والبقسماط ، ولحم الخنزير ، والتوابل ، والزبدة) يؤدي إلى مزيد من التعقيد في مصفوفة الطعام ويمكن أن يمنع نمو السالمونيلا خلال مراحل التخصيب ، مما يعقد القياس الكمي الدقيق. بالإضافة إلى ذلك ، يجب أن تتنافس السالمونيلا مع ميكروبات الخلفية بالطرق القائمة على الثقافة16 ، والتي تعتبر مناسبة بشكل خاص للعينات الجاهزة للطهي بمكونات متعددة مما يضيف تنوعا إلى الجراثيم بالنسبة للدجاج النيء. أخيرا ، يمكن أن تؤثر معالجة الضغوطات ومعالجتها ، مثل مضادات الميكروبات ، على تعافي السالمونيلا 17.
قد تكون صلاحية البكتيريا قد أثرت على أداء الطرق التي تم اختبارها في هذه الدراسة. قللت جميع الطرق من تقدير تركيزات السالمونيلا عند مستويات منخفضة وكان لها تباين أعلى في الكشف عند تركيزات أقل من مسببات الأمراض (الشكل 4 أ ، ب). ومع ذلك ، تفوقت طريقة MPN-LAMP الجزيئية على طلاء MPN و MPN-qPCR في الكشف النوعي عند مستويات التلقيح المنخفضة. تؤكد النتائج على الحاجة إلى التنقية عند تركيزات مسببات الأمراض المنخفضة.
عدم تجانس العينة
هناك قيد مهم آخر ينطوي على عدم تجانس عينات الطعام ، والتي يمكن أن تؤدي إلى تباين في نتائج الكشف عن السالمونيلا . تم تصميم البروتوكول لتفريق 30 مل من العينة المتجانسة ، مما يسمح بتوزيع 8 مكررات على شكل 3 مل من الحصص (إجمالي 24 مل ، 6 مل زائد) عبر الكتلة. في حين أن هذا النهج المحافظ (الذي ينتج عنه عينة إضافية) يفسر الخسائر المحتملة ، فإنه يقدم أخذ عينات فرعية حيث لم يتم اختبار الحجم بأكمله.
يمكن أن يؤثر عدم تجانس عينة الطعام على دقة القياس عند نقل العينات من الخليط المعاد تشتته إلى الكتلة وإجراء التخفيفات18،19. وفقا لنظرية أخذ العينات (TOS) ، يمكن تقليل أخطاء أخذ العينات الأساسية عن طريق زيادة كتلة العينة أو تقليل عدم التجانس التركيبي من خلال تقليل حجم الجسيمات20. ومع ذلك ، في حين تشير بعض الدراسات إلى أن تكسير المصفوفة عن طريق المعدة لا يؤثر بشكل كبير على التعافي البكتيري من تلوث السطح ، فقد ثبت أن تقليل حجم الجسيمات في مصفوفة الطعام يقلل من الانتعاش البكتيري في بعض الحالات21،22،23. في هذه الدراسة ، تم تقليل حجم الجسيمات عن طريق المعدة قبل التخصيب. في حين أن هذا قد يقلل من خطأ أخذ العينات عن طريق تقليل عدم التجانس التركيبي في العينات ، فإن التعدة والطرد المركزي قد يؤثران على التعافي البكتيري.
أخيرا ، قد يؤدي التركيب غير المتجانس ومورفولوجيا الطعام ، وكذلك ما إذا كان التلوث داخليا أو سطحيا ، إلى تباين في استعادة مسببات الأمراض. أظهر العمل السابق18،22 أن الارتباط البكتيري القوي بأسطح الأنسجة يمكن أن يقلل من معدلات الشفاء. تظهر الدراسات التي تم فيها استخدام إنزيمات مثل التربسين والكولاجيناز والإندوببتيداز لإطلاق البكتيريا من مصفوفات اللحوم والدواجن24،25 والبكتيناز والسيلولاز إلى الخضر الورقية19 القدرة على تحسين تعافي السالمونيلا من المصفوفات الغذائية.
اقتراحات لاستكشاف الأخطاء وإصلاحها
لمنع حدوث مشكلات ، تأكد من أن جميع الوسائط والكواشف معدة حديثا ومعقمة. قد تؤدي المواد منتهية الصلاحية أو المعقمة بشكل غير صحيح إلى التلوث أو التأثير على نمو السالمونيلا. إذا لوحظ تلوث ، فتحقق من اتباع تقنية التعقيم باستمرار طوال البروتوكول ، خاصة أثناء تلقيح العينة ، والتخفيف ، والاقتباس ، والطلاء.
عندما يكون عدد المستعمرات أقل من المتوقع ، يمكن أن يساعد التحقق من دقة التخفيفات التسلسلية وتركيزات اللقاح في تحديد الأخطاء. يجب مراقبة ظروف الحضانة ، بما في ذلك درجة الحرارة والوقت والتحريض ، بعناية لدعم النمو الأمثل للسالمونيلا . في حالات النمو المنخفض أو المعدوم ، يمكن أن يساهم عدم كفاية المعدة أو التسرب من الأكياس في التوزيع غير المتكافئ للبكتيريا.
إذا أدى الكشف الجزيئي إلى نتائج غير متسقة ، فإن التحقق من إجراءات استخراج الحمض النووي والتحقق من جودة البادئات والمجسات هي خطوات رئيسية. أيضا ، قد يؤدي التباين بين مصفوفات الطعام إلى مستويات مختلفة من التثبيط ، والتي يمكن مراقبتها باستخدام التحكم في التضخيم الداخلي (IAC). يعد التخزين السليم والتعامل مع كواشف الاستخراج أمرا بالغ الأهمية لمنع السلبيات الكاذبة بسبب التدهور أو التلوث. قد يكون هناك ما يبرر أيضا طرق أكثر كفاءة لاستخراج الحمض النووي.
يمكن أن يؤدي دمج علاجات مثل نظام GentleMACS26 ، الذي يستخدم الإجراءات الميكانيكية والحرارية والأنزيمية ، إلى تحسين تعافي البكتيريا من الطعام. يمكن لهذا النظام أن يقلل من عدم تجانس مصفوفة الطعام ، مما يسهل نقل عينات موحدة إلى الكتلة وإجراء تخفيفات تسلسلية دقيقة.
التحسين والتوسع المحتمل
هناك العديد من الفرص لتحسين هذا البروتوكول وتوسيعه. يمكن أن يؤدي استكشاف تركيبات وسائط التخصيب البديلة إلى تحسين تعافي خلايا السالمونيلا المجهدة أو المصابة تحت الدمال ، خاصة من المصفوفات الغذائية المعقدة مثل كوردون بلو الدجاج. في حين أن الأجار الانتقائي يستخدم بشكل شائع لاستهداف السالمونيلا ، فإن الخلايا المصابة أو المجهدة بسبب ظروف المعالجة والتخزين قد تؤدي إلى سلبيات خاطئة على هذه الوسائط. للتغلب على هذا التحدي ، يمكن أن يؤدي تحسين التوازن بين الضغط الانتقائي والاسترداد الميكروبي إلى تحسين الكشف عن السالمونيلا المصلية الأقل قدرة على المنافسة في ظل ظروف التخصيب القياسية. يمكن أن يؤدي هذا التحسين إلى تحسين حساسية الفحص الإجمالية ، لا سيما في المنتجات الغذائية الصعبة حيث يكون الإجهاد الميكروبي شائعا. يمكن أن يؤدي تقصير أوقات الحضانة إلى تسريع الوقت لتحقيق النتائج ، على الرغم من أن هذا قد يقلل من الحساسية ويحد من الكشف. يجب أن يستكشف العمل المستقبلي التطورات في وسائط التخصيب لدعم التكاثر السريع للبكتيريا ، مما يضمن القياس الكمي الدقيق مع تلبية متطلبات أصحاب المصلحة.
علاوة على ذلك ، يمكن أن يؤدي التحقيق في درجات حرارة ومدد الحضانة المختلفة لمقايسة MPN إلى تحسين استعادة السالمونيلا من منتجات الدواجن المختلفة. يمكن أن يؤدي ذلك إلى توسيع قابلية تطبيق البروتوكول على مسببات الأمراض الأخرى المنقولة بالغذاء والتي تتطلب ظروف نمو مميزة ، وبالتالي توسيع فائدته في اختبار سلامة الأغذية. يمكن أن تعزز الأتمتة قابلية التوسع لهذا البروتوكول من خلال دمج معالجات السوائل الروبوتية لخطوات الاقتباس والتخفيف. قد تعالج أجهزة الطرد المركزي ذات التدفق المستمر أو أنظمة الطرد المركزي عالية السعة أيضا قيود معالجة الدفعات ، مما يتيح التطبيقات عالية الإنتاجية في البيئات الصناعية.
يمكن أن يؤدي توسيع جانب الكشف الجزيئي ليشمل تفاعل البوليميراز المتسلسل متعدد الإرسال إلى الكشف المتزامن عن مسببات الأمراض المتعددة ، وتحسين الإنتاجية في بيئات المراقبة والاختبار. بالإضافة إلى ذلك ، يمكن أن يوفر دمج تسلسل الجيل التالي (NGS) معلومات قيمة عن النمط المصلي والضراوة مباشرة من ثقافات تخصيب MPN ، مما يسهل التحقيقات الوبائية وجهود تتبع المصدر.
وأخيرا، يمكن توسيع حد التقدير/الكشف عن طريق زيادة كمية العينات المستخدمة في الشبكة حسب القطعة حسب الطلب. على سبيل المثال ، إذا زاد وزن عينة اللحم من 25 جم إلى 325 جم ، فيمكن استقراء حد الكشف إلى 4 CFU / g باستخدام معادلة الانحدار الخطي. ومع ذلك ، بافتراض نفس فاصل الثقة النسبي 95٪ ، فإن الحد الأدنى العملي للقياس الكمي هو >30 CFU / g.
استنتاج
يوفر تطوير اختبار MPN-LAMP في هذه الدراسة أداة قيمة وعملية لقياس تلوث السالمونيلا في منتجات الدواجن. مع وجود ارتباط قوي بمستويات التلقيح النظرية (R² = 0.933) ، تكتشف الطريقة بشكل موثوق السالمونيلا عند مستويات منخفضة ، وهو أمر بالغ الأهمية لسلامة الأغذية والامتثال التنظيمي. هذه القدرة مهمة بشكل خاص في الكشف عن التلوث الذي قد يمر دون أن يلاحظه أحد ، مما يسمح للمنتجين بمعالجة المخاطر المحتملة بشكل استباقي. يوفر اختبار MPN-LAMP بديلا كميا للطرق التقليدية القائمة على الانتشار ، حيث يوفر مستوى من تلوث السالمونيلا في مجموعة متنوعة من منتجات الدواجن ، بما في ذلك العناصر الجاهزة للطهي الأكثر تعقيدا.
تكمن إحدى نقاط القوة الرئيسية لهذه الطريقة في قدرتها على التكيف مع مصفوفات الطعام المختلفة ، وخاصة المنتجات المجمدة والمعالجة مثل كوردون بلو الدجاج ، حيث قد تكافح الطرق التقليدية بسبب وجود مكونات إضافية مثل الخبز والجبن. يضمن دمج التقنيات الجزيئية ، مثل LAMP و qPCR ، مع مقايسة MPN نهجا شاملا للكشف ، والتغلب على التحديات التي تفرضها ميكروبات الخلفية وظروف المعالجة. تعزز هذه الطرق الجزيئية حساسية البروتوكول ، مما يجعله أداة متعددة الاستخدامات في الاختبارات الروتينية لسلامة الأغذية ومراقبة التلوث ، مع إمكانية تقليل مخاطر تفشي المرض المرتبط بالسالمونيلا.
على الرغم من عدم وجود طريقة كشف واحدة بدون قيود ، إلا أن اختبار MPN-LAMP يوضح أداء ثابتا عبر مجموعة من مستويات اللقاح ومصفوفات الطعام. يمكن معالجة التباين في مستويات التلقيح المنخفضة من خلال التحسينات المستقبلية ، مثل تحسين إعداد العينات وتركيبات الوسائط لتحقيق أقصى قدر من الاسترداد ، لكن هذا لا ينتقص من المتانة الإجمالية للبروتوكول. من خلال توفير الكشف الدقيق عن خلايا السالمونيلا ، حتى في ظل الظروف الصعبة ، تزود طريقة MPN-LAMP صناعة الأغذية بأداة لا تقدر بثمن لحماية الصحة العامة.
بالنظر إلى المستقبل ، هناك مجال لمزيد من التحسين ، مثل توسيع الاختبار ليشمل المزيد من مصل السالمونيلا أو دمج تسلسل الجيل التالي لتوصيف مسببات الأمراض بشكل أكبر. ومع ذلك ، يمثل هذا البروتوكول بالفعل تقدما كبيرا في الكشف عن السالمونيلا وقياسها كميا ، مما يوفر طريقة عملية وفعالة وموثوقة تلبي المتطلبات المتزايدة لاختبار سلامة الأغذية.
Disclosures
يعلن جميع المؤلفين أنه لا يوجد تضارب في المصالح.
Acknowledgements
تم دعم هذا البحث من قبل وزارة الزراعة الأمريكية ، وخدمة البحوث الزراعية (USDA-ARS) ، والبرنامج الوطني 108 ، وأرقام نظام معلومات البحث الحالي 8072-42000-093-000-D و 8072-42000-094-000-D. ذكر الأسماء التجارية أو المنتجات التجارية في هذه المقالة هو فقط لغرض توفير معلومات محددة ولا يعني توصية أو تأييد من قبل وزارة الزراعة الأمريكية. وزارة الزراعة الأمريكية هي مزود وصاحب عمل لتكافؤ الفرص.
Materials
| Name | Company | Catalog Number | Comments |
| 48 deep well block 4.6ml | Fisher Scientific International, Inc | NC1964628 | |
| Agar - Solidifying Agent (Difco) | Becton, Dickinson and Company (BD) | 281230 | |
| Analytical Balance | Mettler Toledo | JL602-G/L | Equipment |
| Analytical Balance | Mettler Toledo | AB54-S | Equipment |
| Autoclave - Amsco Lab250, Laboratory Steam Sterilizer | Steris plc | LV-250 | Equipment |
| Biological Safety Cabinet, Type A2, Purifier Logic+ | Labconco Corporation | 302411101 | Equipment |
| Brain Heart Infusion (BHI) Broth | Becton, Dickinson and Company (BD) | 237500 | |
| Buffered Peptone Water | Bio-Rad Laboratories Inc. | 3564684 | |
| Cell Spreader - L-shaped | VWR | 76208-438 | |
| Centrifuge Microcentrifuge 5424 | Eppendorf | 5424 | Equipment |
| Centrifuge, Avanti J-25 | Beckman Coulter, Inc. | Equipment | |
| DNA Extraction - PreMan Ultra Sample Preparation Reagent | Thermo Fisher Scientific Inc. | 4318930 | |
| Ground Chicken | Local retailers | ||
| IAC forward primer: 5'-GGCGCGCCTAACACATCT-3' | Integrated DNA Technologies | ||
| IAC probe: 5'-TTACAACGGGAGAAGACAATGC CACCA-3' labeled with 5' TAMRA/3' BHQ-2 | Biosearch Technologies | ||
| IAC reverse primer: 5'-TGGAAGCAATGCCAAATGTGTA-3' | Integrated DNA Technologies | ||
| Incubator - Inova 4230 incubator shaker | New Brunswick Scientific | 4230 | Equipment |
| Inoculating Loop - Combi Loop 10µL and 1µL | Fisher Scientific International, Inc | 22-363-602 | |
| invA forward primer: 5'-GTTGAGGATGTTATTCGCAAAG G-3' | Integrated DNA Technologies | ||
| invA probe: 5'-CCGTCAGACCTCTGGCAGTAC CTTCCTC-3' labeled with 5' Cal Fluor Orange 560/3' BHQ-1 | Biosearch Technologies | ||
| invA reverse primer: 5'-GGAGGCTTCCGGGTCAAG-3' | Integrated DNA Technologies | ||
| Irradiation Treatment | Texas A&M Agrilife Research National Center for Electron Beam Research | Service | |
| Luria Bertani (LB) Broth | Becton, Dickinson and Company (BD) | 244620 | |
| Manual pipette Pipet-Lite LTS Pipette L-1000XLS+ | Mettler Toledo | 17014382 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-100XLS+ | Mettler Toledo | 17014384 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-10XLS+ | Mettler Toledo | 17014388 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-200XLS+ | Mettler Toledo | 17014391 | Equipment |
| Manual pipette Pipet-Lite LTS Pipette L-20XLS+ | Mettler Toledo | 17014392 | Equipment |
| Manual pipette Pipet-Lite Multi Pipette L8-200XLS+ | Mettler Toledo | 17013805 | Equipment |
| Manual pipette Pipet-Lite Multi Pipette L8-20XLS+ | Mettler Toledo | 17013803 | Equipment |
| Media Storage Bottle -PYREX 1L Square Glass Bottle, with GL45 Screw Cap | Corning Inc. | 1396-1L | Equipment |
| Media Storage Bottle -PYREX 2L Round Wide Mouth Bottle, with GLS80 Screw Cap | Corning Inc. | 1397-2L | Equipment |
| Microtiter plate, 96 well plate, flat bottom, polystyrene, 0.34cm2, sterile, 108/cs | MilliporeSigma | Z707902 | |
| Mixer - Vortex Genie 2 | Scientific Industries Inc. | SI-0236 | Equipment |
| Molecular Detection Assay 2-Salmonella kit | Neogen | MDA2SAL96 | |
| Molecular Detection Instrument | Neogen | MDS100 | Equipment |
| Motorized pipette controller, PIPETBOY2 | INTEGRA Biosciences Corp. | 155019 | Equipment |
| PCR Mastermix 2× TaqMan Gene Expression | Thermo Fisher Scientific Inc. | 4369542 | |
| Petri Dish Rotator - bioWORLD Inoculation Turntable | Fisher Scientific International, Inc | 3489E20 | Equipment |
| Petri Dishes with Clear Lid (100 mm x 15mm) | Fisher Scientific International, Inc | FB0875713 | |
| Pipette Tips GP LTS 1000µL S 768A/8 | Mettler Toledo | 30389273 | |
| Pipette Tips GP LTS 20µL 960A/10 | Mettler Toledo | 30389270 | |
| Pipette Tips GP LTS 200µL F 960A/10 | Mettler Toledo | 30389276 | |
| Ready to cook chicken products | Local retailers | ||
| Reagent Reservoir, 25 mL sterile reservoir used with multichannel pipettors | Thermo Fisher Scientific Inc. | 8093-11 | |
| Realtime PCR - 7500 Real-Time PCR system | (Applied Biosystems, Foster City, CA) | 2750036476 | Equipment |
| Serological Pipettes, Nunc Serological Pipettes (10 mL) | Thermo Fisher Scientific Inc. | 170356N | |
| Serological Pipettes, Nunc Serological Pipettes (2 mL) | Thermo Fisher Scientific Inc. | 170372N | |
| Serological Pipettes, Nunc Serological Pipettes (25 mL) | Thermo Fisher Scientific Inc. | 170357N | |
| Serological Pipettes, Nunc Serological Pipettes (50 mL) | Thermo Fisher Scientific Inc. | 170376N | |
| Spreader - Fisherbrand L-Shaped Cell Spreaders | Fisher Scientific International, Inc | 14-665-230 | |
| Stomacher bag, Nasco Whirl-Pak Write-On Homogenizer Blender Filter Bags | Thermo Fisher Scientific Inc. | 01-812 | |
| Stomacher 80 Biomaster Lab Blender | Seward | 30010019 | Equipment |
| Thermocycler (GeneAmp PCR system 9700) | Applied Biosystems | 535028293 | Equipment |
| Water Filtration - Elga Veolia Purelab Flex | Elga LabWater | PF2XXXXM1-US | Equipment |
| Whirlpak bags 1.63L | VWR | 11216-777 |
References
- Batz, M., Hoffmann, S., Morris, J. G. Disease-outcome trees, eq-5d scores, and estimated annual losses of quality-adjusted life years (qalys) for 14 foodborne pathogens in the united states. Foodborne Pathogens and Disease. 11 (5), 395-402 (2014).
- . The Grand Challenge: Salmonella Available from: https://tellus.ars.usda.gov/stories/articles/the-grand-challenge-salmonella (2024)
- National Advisory Committee on Microbiological Criteria in Foods (NACMCF). Response to questions posed by the food safety and inspection service: Enhancing Salmonella control in poultry products. J Food Prot. 82 (4), 645-668 (2019).
- Food Safety and Inspection Service. . 4.15 Isolation and identification of Salmonella from meat, poultry, pasteurized egg, siluriformes (Fish) products and carcass and environmental sponges. , (2024).
- Irwin, P., Reed, S., Brewster, J., Nguyen, L., He, Y. P. Non-stochastic sampling error in quantal analyses for campylobacter species on poultry products. Analytical and Bioanalytical Chemistry. 405 (7), 2353-2369 (2013).
- Irwin, P., Tu, S., Damert, W., Phillips, J. A modified gauss-newton algorithm and ninety-six well micro-technique for calculating mpn using excel spreadsheets. Journal of Rapid Methods & Automation in Microbiology. 8 (3), 171-191 (2000).
- Ravishankar, S., Ahmed, E. Y., Carlstrom, C. Food microbiology: A laboratory manual. Food Microbiology. 21, 489 (2004).
- Chen, C. Y., Nace, G. W., Irwin, P. L. A 6 x 6 drop plate method for simultaneous colony counting and mpn enumeration of campylobacter jejuni, listeria monocytogenes, and escherichia coli. J Microbiol Methods. 55 (2), 475-479 (2003).
- Suo, B., He, Y., Tu, S. I., Shi, X. A multiplex real-time polymerase chain reaction for simultaneous detection of salmonella spp., escherichia coli o157, and listeria monocytogenes in meat products. Foodborne Pathogens and Disease. 7 (6), 619-628 (2010).
- Jarvis, B., Wilrich, C., Wilrich, P. T. Reconsideration of the derivation of most probable numbers, their standard deviations, confidence bounds and rarity values. J Appl Microbiol. 109 (5), 1660-1667 (2010).
- Stevens, R., Poppe, K. Validation of clinical prediction models: What does the "calibration slope" really measure. Journal of Clinical Epidemiology. 118, (2019).
- Miller, M. E., Hui, S. L., Tierney, W. M. Validation techniques for logistic regression models. Statistics in Medicine. 10 (8), 1213-1226 (1991).
- Galán-Relaño, &. #. 1. 9. 3. ;., et al. Salmonella and salmonellosis: An update on public health implications and control strategies. Animals. 13 (23), 3666 (2023).
- Gorski, L., et al. Growth assessment of salmonella enterica multi-serovar populations in poultry rinsates with commonly used enrichment and plating media. Food Microbiology. 119, 104431 (2024).
- Schmidt, J. W., et al. Evaluation of methods for identifying poultry wing rinses with salmonella concentrations greater than or equal to 10 cfu/ml. J Food Prot. 87 (11), 100362 (2024).
- Gorski, A., Liang, L. S. Effect of enrichment medium on real-time detection of salmonella enterica from lettuce and tomato enrichment cultures. Journal of Food Protection. 73 (6), 1047-1056 (2010).
- Guillén, S., Nadal, L., Álvarez, I., Mañas, P., Cebrián, G. Impact of the resistance responses to stress conditions encountered in food and food processing environments on the virulence and growth fitness of non-typhoidal salmonellae. Foods. 10 (3), 617 (2021).
- Rohde, A., Hammerl, J. A., Appel, B., Dieckmann, R., Al Dahouk, S. Sampling and homogenization strategies significantly influence the detection of foodborne pathogens in meat. BioMed Research International. 2015, (2015).
- Wang, D., Wang, Z., He, F., Kinchla, A. J., Nugen, S. R. Enzymatic digestion for improved bacteria separation from leafy green vegetables. Journal of Food Protection. 79 (8), 1378-1386 (2016).
- Pitard, F. F. . Theory of sampling and sampling practice. , (2019).
- Sharpe, A. . in Detecting pathogens in food. , 52-68 (2003).
- Hannah, J., et al. Effect of stomaching on numbers of bacteria recovered from chicken skin. Poultry Science. 90 (2), 491-493 (2011).
- Mcmeekin, T., Thomas, C. Retention of bacteria on chicken skin after immersion in bacterial suspensions. Journal of Applied Bacteriology. 45 (3), 383-387 (1978).
- Rodrigues-Szulc, U., Ventoura, G., Mackey, B., Payne, M. Rapid physicochemical detachment, separation and concentration of bacteria from beef surfaces. Journal of Applied Bacteriology. 80 (6), 673-681 (1996).
- Vibbert, H. B., et al. Accelerating sample preparation through enzyme-assisted microfiltration of salmonella in chicken extract. Biotechnol Prog. 31 (6), 1551-1562 (2015).
- Armstrong, C. M., et al. Use of a commercial tissue dissociation system to detect salmonella-contaminated poultry products. Analytical and Bioanalytical Chemistry. 416 (3), 621-626 (2024).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved