Method Article
In vivo (İn canlı) Kısmen Kısıtlanmış Larva Zebra Balıklarında Duyusal Stimülasyonla İndüklenen Nöral Aktivitenin Konfokal Floresan Görüntülemesi
Bu Makalede
Özet
Burada, konfokal mikroskopi kullanarak GCaMP kalsiyum göstergelerini eksprese eden transgenik zebra balıklarının beyin bölgelerindeki nöral aktiviteyi incelemek için ayrıntılı bir protokol sunuyoruz.
Özet
Zebra balığı larvaları, davranışın sinirsel mekanizmalarını incelemek için umut verici bir omurgalı model sistemidir. Yarı saydamlıkları ve nispeten basit nöral devreleri, davranışın hücresel analizlerinde optogenetik tekniklerin kullanılmasını kolaylaştırır. GCaMP6'lar gibi in vivo nöral aktivitenin floresan göstergeleri, larva zebra balıklarında basit davranışlarla ilişkili nöral aktiviteyi incelemek için yaygın olarak kullanılmaktadır. Burada, transgenik hat Tg(elav3:GCaMP6s) kullanarak yarı kısıtlı zebra balığı larvalarında duyusal kaynaklı aktiviteyi tespit etmek için bir protokol sunuyoruz. Özellikle, arka beyin ve omurilik sınırındaki bir beyin bölgesinde sağlam, tekrarlanabilir bir floresan tepkisi indüklemek için kimyasal ajan alil izotiyosiyanat kullanıyoruz. Bir dizi davranışsal paradigma sırasında nöral aktivitenin optik olarak izlenmesi için GCaMP6'ların potansiyel kullanımlarını ve bu tekniğin sınırlamalarını tartışıyoruz. Protokolümüz, larva zebra balığı beynindeki dinamik, davranışla ilgili in vivo nöral aktiviteyi izlemek için erişilebilir bir yaklaşımın ana hatlarını çizmektedir.
Giriş
Zebra balığı, ayrıntılı hücresel-moleküler nörobiyolojik araştırmalar için izlenebilirliğe sahip omurgalı bir hayvan modelini temsil eder. Larva zebra balığı, döllenmeden 5 gün sonra (dpf) ~ 100.000 nörona sahiptir, bu da memeli beyinlerinden önemli ölçüde daha azdır. Ayrıca, zebra balığı nispeten yarı saydamdır, bu da nöral yapı ve işlevin optik çalışmalarını kolaylaştıran bir özelliktir 1,2,3,4,5. Zebra balıklarında kullanılmak üzere, yüksek kaliteli kalsiyum göstergeleri6, voltaj sensörleri 7,8 ve nöral aktivitenin aktiviteye bağlı belirteçleri 9,10,11,12,13 dahil olmak üzere çeşitli optogenetik araçlar geliştirilmiştir. Bu araçlar, genetik modifikasyonlara 14,15,16,17 uygunluk ve zebra balığı larvalarının banyo solüsyonlarındabulunan kimyasalları emmeye hazır olma gibi bu modelin sahip olduğu diğer avantajları tamamlayıcı niteliktedir 18,19,20,21.
Zebra balığı optik fizyolojisi için, özellikle iki foton, ışık tabakası ve konfokal mikroskopi olmak üzere çeşitli yöntemler yararlıdır. Bu teknolojilerin her biri, birbiriyle ilişkili iki çözünürlük problemini dengelemelidir: çevreleyen doku tarafından ışık saçılımı dahil olmak üzere optik erişim ve özellikle milisaniyenin altındaki ölçekte aksiyon potansiyeli kinetiğini yakalamak içinörnekleme hızı 22. İki foton mikroskobu kullanılarak in vivo kalsiyum görüntülemede çarpıcı gelişmeler olmuştur, ancak bu yöntem genellikle <1mm2'lik bir görüş alanıyla sınırlıdır ve tipik olarak, yalnızca tek bir derinlik düzlemi elde edilebilir, böylece nöral devrenin geniş bölgelerinde aktivitenin yakalanmasını sınırlar22. Işık tabakası mikroskobu için, beyindeki hemen hemen tüm nöronların aktivitesini kaydetme potansiyeli, iki foton mikroskobunun görüş alanı sınırlamasını çözer, ancak mevcut kamera hızları, larva zebra balığında beyin hacmi başına 40 düzlemde yakalamayı fiziksel olarak saniyede kabaca üç beyin hacmiyle sınırlar 1,23. Konfokal mikroskopi, hem derinlik çözünürlüğü hem de yakalama hızı açısından iki foton ve ışık tabakası mikroskobuna göre daha düşüktür. Konfokal mikroskopi, dünya çapında laboratuvarlara yaygın erişilebilirlik ve cFos ve p-ERK9 gibi nöral aktivite raporlayıcılarını kullanarak nöral aktivitenin tüm beyin rekonstrüksiyonlarını gerçekleştirme kapasitesi avantajlarına sahiptir. Ayrıca, küçük beyin bölgeleri hedeflenirse, konfokal mikroskop nöral aktivitenin yeterli zamansal çözünürlüğünü sağlayabilir.
Bu makale, GCaMP6'ları pan-nöronal olarak eksprese eden transgenik zebra balıklarında nöral aktiviteyi kaydetmek için konfokal mikroskopi kullanan bir yöntemi açıklamaktadır. 24,25,26,27,28,29 nöral yollarının işlevini anlamak için zebra balığı larvalarını kullanan birkaç benzer protokol geliştirilmiştir. Hızlandırılmış görüntüleme, kalsiyum dinamiğinin floresan göstergeleri ve canlı görüntüleme gibi bu protokollerin birçoğunun temel özellikleri, caydırıcı bir kimyasal tahriş edici olan alil izotiyosiyanata (AITC) yanıt olarak zebra balığı merkezi sinir sistemindeki küçük bir nöron popülasyonundaki nöral aktiviteyi ölçmek için birleştirilmiştir 11,26,27,29,30,31. AITC, arka beyin bölgesine odaklanan beyin çapında bir yanıt ortaya çıkarır11. Arka beyne sadece kaudal olan bir nöron kümesi, harekette ve AITC'ye uzun süreli bir yanıtta rol oynar. Bu tepki, caydırıcı uyaranın30 kaldırılmasından daha uzun sürer. Görüş alanını kısıtlayarak, GCaMP6'ları ifade eden nöronlardaki floresan değişikliğinin yansıttığı gibi bu sinir kümesindeki sinirsel aktiviteyi tespit etmeyi başardık. Konfokal mikroskopi kullanarak yeterli uzay-zamansal çözünürlük elde etmek için teknikler, kılavuzlar ve en iyi uygulamalar sunuyoruz. Ek olarak, optik kayıt yöntemimizin sınırlamalarını tartışıyoruz. Bu sınırlamalara rağmen, yöntem, hafıza ve sensorimotor işleme dahil olmak üzere çeşitli nörobiyolojik olayların araştırılmasına izin vermelidir.
Protokol
Hayvanları kullanan tüm prosedürler, California Eyalet Üniversitesi, Fullerton'daki Kurumsal Hayvan Bakımı Kullanım Komitesi tarafından onaylanmıştır (Protokol # 2023-1310).
1. Larva zebra balığının düşük erime noktalı agarozda sahnelenmesi
- Pan-nöronal olarak Tg(elav3:GCaMP6s)6 eksprese eden yetişkin transgenik hayvanları, kurumsal hayvan bakımı yönergelerine uygun olarak iki erkek ila iki dişi ile yetiştirin. Yetişkinler özel üreme odalarına yerleştirilir, böylece serbest bırakılan yumurtalar, yetişkinlerin erişemeyeceği sahte bir tabana sahip daha düşük bir odada yakalanır. İlk ışıkta veya bir ayırma bölücü çıkarıldığında, dişiler yumurtaları serbest bırakır ve erkekler sahte dipte yakalanan yumurtaları döller.
- Yetişkinleri çıkarın ve bir yumurta süzgeci kullanarak döllenmiş yumurtaları toplayın ve embriyo (E3) ortamına yerleştirin (5 mM NaCl, 0.33 mM MgSO4, 0.33 mM CaCl2, 0.17 mM KCl, 1 mM HEPES, %0.00001 metilen mavisi, pH 7.0)30 14 saat ışık/28.5 °C'de 10 saat karanlık ile bir kuluçka makinesinin içine
NOT: Kullanılan E3 tarifi, floresansı etkilemeyen veya herhangi bir önemli otomatik floresan sinyaline yol açmayan düşük bir metilen mavisi konsantrasyonuna sahiptir. GCaMP6s transgenik hattının sağladığı doğal yarı saydamlık nedeniyle protokolde belirtilen gelişim yaşlarında 1-fenil 2-tiyoüre (PTU) kullanımına gerek yoktur. - Döllenmeden 2-7 gün sonra (dpf) E3 ortamında çözülmüş %3 düşük erime noktalı agaroz kullanarak hayvanları monte edin. Zebra balığının organizmaya zarar vermeden manipüle edilebileceği bir sıcaklığa kadar ısı agarozu. Düşük erime noktalı agaroz soğumadan ve katılaşmadan önce (<1 dakika), larvaları sırt tarafı yukarı bakacak şekilde cam tabanlı bir Petri kabına yerleştirin, böylece incelenecek beyin bölgesi Şekil 1'de gösterildiği gibi hedefe mümkün olduğunca yakın olur. Deneye bağlı olarak, tipik olarak, deney grubu başına 8 ila 10 zebra balığı yeterlidir.
NOT: Bu protokolde hayvanlara anestezi uygulanmamıştır. - Agaroz larva yerine oturduktan sonra (yaklaşık 2 ila 3 dakika), 5 mL E3 çözeltisi ekleyin. Ardından, agarozu deney protokolünün gerektirdiği şekilde bir neşter ile kesin.
NOT: Zebra balığının hangi kısımlarının kısıtlamadan kurtarılması ve/veya farklı türde bir uyaran alması gerektiğine bağlı olarak, agarın farklı kısımları kesilmelidir. - Zebra balığının bulunduğu Petri kabını konfokal mikroskop aşamasına getirin ve balığın 20 dakika boyunca alışmasına izin verin.
2. Uyaran uygulaması ile konfokal mikroskopi altında kurulum ve görüntüleme
- Alışma süresinden sonra, balığı bir ışık kaynağı (~ 475 nm) olan parlak bir alan kullanarak oda sıcaklığında 40x (NA 1.0) suya daldırma hedefinin altında ortalayın.
- Konfokal mikroskop edinim ayarları, floresan molekülünün niteliklerine ve ekspresyon seviyesine, dokunun derinliğine ve optik özelliklerine, görüş alanının boyutuna ve kayıt hızına bağlı olacaktır. Deneysel ihtiyaçlara göre yayılan ışığın en iyi şekilde yakalanmasını sağlamak için aralık göstergesini kullanarak uygun ayarları belirleyin.
- Floresan ışığı optimum aralıkta yakalamak için lazer gücünün ve ana kazancın uygun şekilde ayarlandığından emin olun, böylece GCaMP6'lara bağlı floresan sinyalinin gereksiz kaybını önleyin. Uygun ayarları belirlemek için aşağıda verilen temel konfokal ayarlar ve faktörler listesini kullanın.
- İğne deliği boyutu: Bunu kullanılan hedefe göre belirleyin ve diğer odak düzlemlerini kısıtlarken tek bir odak düzlemini kabul edecek şekilde ayarlayın. Bu protokol için 32 μm'lik bir iğne deliği kullanılır.
- Lazer gücü ve dalga boyu: Lazer gücünü, floresan molekülünün ifade seviyesine ve dokunun derinliğine ve optik özelliklerine göre ayarlayın. Lazerin fotodetektörün menzilini aşmadığından emin olmak için menzil göstergesini kullanın. Uyarma dalga boyunu, floresan molekülünü en iyi şekilde uyaran ışığın dalga boyuna ayarlayın. Bu deney için, balıklar GCaMP6s transgeni için heterozigot olduğundan ve ekspresyon seviyeleri düşük olduğundan, 488 nm dalga boyunda, 650 ana kazançta% 5 lazer gücü kullanın. Güçlü transgen ekspresyonu ile lazer gücü %1,5 ila %3 arasında değişir ve bu genellikle yeterlidir.
NOT: Lazer gücü çok düşük ayarlanırsa, bilgi (fotoçoğaltıcı tüp tarafından algılanan ışık) kaybolacaktır. Lazer gücü çok yükseğe ayarlanırsa, yayılan ışık dedektörün menzilini aşabilir veya örneğe zarar verebilir (foto ağartıcı). - Ana kazanç: Ana kazanç, fotodetektörün hassasiyetini belirler. Ana kazancın çok yüksek ayarlanmadığından ve böylece fotodetektörün menzilini aşmadığından emin olmak için aralık göstergesini kullanın. Bu deney için ana kazanç 650 olarak ayarlanmıştır.
- Görüş alanı: İlgilenilen dokuyu yakalamak için görüş alanının yeterince büyük olduğundan emin olun. Bu, genellikle konfokal mikroskoplar için önemli bir sınırlamadır, çünkü görüş alanının boyutu, Şekil 2'de gösterildiği gibi yakalama hızını sınırlayacaktır. AITC ile yapılan deneyler için görüş alanını 79.86μm2 olarak ayarlayın.
- Yakalama hızı: Yakalama hızı arttıkça, fotodetektör tarafından yakalanan ışık miktarı azalacaktır. Daha az ışık yakalandıkça, görüntü kalitesi düşecektir. Yakalama hızının, görüntünün kalitesini ve ilgilenilen fizyolojik olayı yakalamak için gereken hızı dengelediğinden emin olun. Burada çekim hızı 1.20 f/s olarak ayarlanmış.
- Omuriliğin rostral kısmındaki commissura infima Halleri'ye bir nöronal küme kaudal üzerinde görüş alanını ortalayın30. Bu küme ~2.5 dpf ile oldukça küçüktür, ancak daha sonra geliştirme aşamasında çok daha büyüktür (7 dpf).
NOT: Adım 1'deki agaroz montajı yetersiz ise, yani hayvan agarozun içinde belirli bir açıda veya çok derinde konumlandırılmışsa, görüntü kalitesi olumsuz etkilenecektir. İyi yerleştirilmiş bir hayvanda zebra balığı omuriliğinin bir görüntüsü ve optimal olmayan bir şekilde yerleştirilmiş bir zebra balığında omuriliğin zıt bir görüntüsü Şekil 3'te gösterilmektedir. - Piksel başına 0,119 μm2 uzamsal çözünürlükle sn başına 1,20 kare (fps) hızında 79,86 μm2 görüş alanı kullanarak bir zaman serisi taraması gerçekleştirin. İstenilen uygulamaya göre görüş alanının boyutunu ve görüntü alma hızını ayarlayın.
- Görüntülemenin başlamasından 2 dakika sonra, bir pipet ile tabağa 41.67 μL stok AITC çözeltisi (10 μM nihai konsantrasyon) veya E3 çözeltisi ekleyin. Hızlandırılmış görüntüleme ile ilgilenilen bölgedeki GCaMP6s aktivitesindeki herhangi bir değişikliği gözlemlemek için ~30 saniye boyunca kayda devam edin. Kayıt tamamlandıktan sonra, hayvanı agarozdan kurtarın ve kurumsal hayvan bakım yönergelerine göre ötenazi yapın.
NOT: GCaMP6s aktivitesini kaydederken, konfokal ışığın kendisi bir uyarıcı olabilir. Görüntüleme sonuçlarının analizinde bu dikkate alınmalıdır. Kayıt süresi, istenen süre için gerektiği gibi ayarlanabilen, kare sayısının ve her karenin yakalama hızının bir fonksiyonudur.
3. FIJI kullanarak GCaMP sinyalinin analizi
- Kayıttan sonra, çıktı aşağı akış FIJI analizi için .tif dosya biçiminde değilse, görüntü dosyalarını mikroskop yazılım paketinden .tif dosyaları olarak dışa aktarın.
- Nöral izlerin analizi için FIJI'yi indirin. FIJI'yi açın, .czi dosyalarını programa aktarın ve istendiğinde BioFormats eklentisindeki varsayılan ayarları kullanın.
- İlgili Simgelerine tıklayarak Circle veya Freehand araçlarını kullanarak ilgilendiğiniz bir alanı/nöronu vurgulayın. (Simgelerin üzerine gelindiğinde, programdaki aracın adı yanıp sönecektir.)
NOT: İlgi alanı büyüklük olarak değiştiği için sabit alanlar/daireler mümkün değildir. Thunder paketi32 gibi zaman içinde floresan değişikliklerinin voksel olarak kaydedilmesine izin veren yazılım, bireysel nöronların algılanmasına izin verebilir; Bununla birlikte, mevcut deneydeki ~ 20 nöron için, zar sınırlarının kör bir gözlemci tarafından tespit edilmesi, otomatik bir algılama sisteminden daha üstün olacaktır. - Bir ROI seçildikten sonra, FIJI araç çubuğunda ROI Yöneticisi'> Analiz > Araçları'na tıklayın. Bundan sonra, Ekle [t]'ye tıklayın ve seçilen ROI, ROI Yöneticisi penceresine eklenecektir.
- ROI Yöneticisi'nde Daha Fazla > Çoklu Ölçüm'e tıklayın. Ayarları varsayılan olarak bırakın ve Tamam'a tıklayın. FIJI, Python kullanılarak bir CSV dosyası olarak veya bir elektronik tabloda ham veri olarak manipüle edilebilecek ham veriler üretecektir.
- Ham verileri normalleştirmek ve belirli bir ilgi alanı için sinirsel bir iz olarak temsil etmek için, uyarandan önceki 2 dakikalık pencerenin son ~30 s değerlerinin ortalamasını alın ve tüm uyaran sonrası değerleri bu ortalama temel değere normalleştirin:
normalleştirilmiş floresan yoğunluğu = (uyaran sonrası belirli bir ilgilenilen bölgenin anlık floresansı)/(2 dakikalık aralıklı bir ön uyaranın ~30 s'lik ortalama floresansı) - Verileri Şekil 4'te gösterildiği gibi nöral izler olarak çizin.
NOT: Beynin bir hacminin kaydedildiği ışıklı levha mikroskobu gibi bazı mikroskop türlerinde, hareket artefaktları, bir referans beyin hacmine işlem sonrası uzamsal kayıt yoluyla ele alınır 1,11. Ancak, yalnızca tek bir düzlemden kayıt yaptığımız için, hareket artefaktları için herhangi bir ayarlama yapılamaz. Bu nedenle, burada gösterilen sonuçlar için hiçbir çerçeve kaldırılmamıştır. Bununla birlikte, hareket artefaktları sonuçları önemli ölçüde değiştirirse, otomatik sistemler hareket artefaktları1, 11 olan çerçeveleri tanımlayabilir ve düzeltebilir veya kör bir gözlemci bu tür çerçeveleri kaldırabilir.
Sonuçlar
Alil izotiyosiyanat uygulaması, larva zebra balıklarında kalsiyumla ilişkili bir nöral sinyale neden olur
AITC'nin uygulanması (adım 2.6), larva zebra balığınınbeyninde GCaMP6'larla ilişkili nöral aktivitede yaygın bir artışa neden olur 11,30. Şekil 4'te gösterildiği gibi, AITC'yi uyguladıktan sonra beynin küçük bir bölgesinde floresan sinyalinin arttığını gözlemledik.
Kalsiyumla ilişkili nöral sinyallerin çözünürlüğünü, yakalama hızını ve yakalama alanını dengeleme
Yakalama hızının arttırılması, deneysel tasarımda dikkate alınması gereken çözünürlüğü azaltır. Şekil 5'te ~ 2.5 dpf'de zebra balığı embriyolarını kullanarak çeşitli hızları ve bunlara karşılık gelen çözünürlükleri sunuyoruz. Nöral aktiviteyi kaydederken, yakalama hızının aktiviteyi kaydetmek için yeterince hızlı olması gerekir. Bir aksiyon potansiyeline bağlı voltaj değişimleri nispeten hızlı (1-2 ms) olmasına rağmen, GCaMP ile kalsiyum etkileşimleri, aksiyon potansiyeli sinyalinin süresini uzatacaktır. Burada kullanılan molekül olan GCaMP6'lar özellikle yavaş kinetiğe sahiptir. GCaMP moleküllerini kullanan tek aksiyon potansiyelleri, hücre kültürü6'da tespit edilebilir ve ilişkilendirilebilir, ancak bu sinyal algılama hassasiyetinin larva zebra balığı ile in vivo olarak meydana gelip gelmeyeceği açık değildir. Bununla birlikte, yakalama hızı ne kadar yüksek olursa, sinyal algılamanın daha yüksek yakalama hızları tarafından önemli ölçüde azaltılmadığı varsayılarak, nöral aktiviteyle ilgili zamansal bilgilerin yakalanması o kadar olasıdır. Ayrıca, gözlem alanının boyutu da standart bir konfokal mikroskopla yakalama hızlarını etkileyecektir. Görüş alanını azaltarak, yakalama hızı artar, ancak diğer beyin bölgelerindeki sinirsel aktivite hakkında bilgi kaybolur. GCaMP6 sinyallerini yakalamak için, konfokal mikroskopi kullanan uygulamalar küçük bir beyin alanıyla (50-150μm2) sınırlandırılmalıdır. Örtüşmeyi azaltmak için yakalama hızı, gözlemlenen sinyalden daha hızlı olmalıdır. Bununla birlikte, konfokal mikroskobun yakalama hızları, kaçınılmaz olarak yayılan ışık şeklinde bazı bilgilerin kaybına neden olacaktır. İstenen deneysel soruyu etkili bir şekilde ele almak için bu göreceli maliyetler ve faydalar her zaman göz önünde bulundurulmalıdır.

Şekil 1: Görüntüleme için kısmen kısıtlanmış bir larva zebra balığının pozisyonunun tasviri. Larva, düşük erime noktalı bir agarozun içine gömülür ve sırt tarafı yukarı doğru konumlandırılır. Zebra balığı derisinin AITC'ye maruz kalmasına izin vermek için agarozun rostral ve kaudal kısımları çıkarıldı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
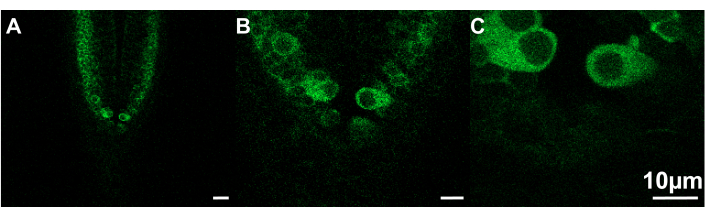
Şekil 2: Farklı çekim hızlarında görüntülenebilen farklı boyutlardaki görüntü örnekleri. (A) Çerçeve boyutu = 319,45 x 319,45 μm; Çekim hızı =.30 fps. (B) Çerçeve boyutu = 106.48 x 106.48 μm; Çekim hızı = 7.67 fps. (C) Çerçeve boyutu = 53,24 x 53,24 μm; Çekim hızı = 9.80 fps. Zebra balığı, ~2.5 dpf; ölçek çubuğu 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
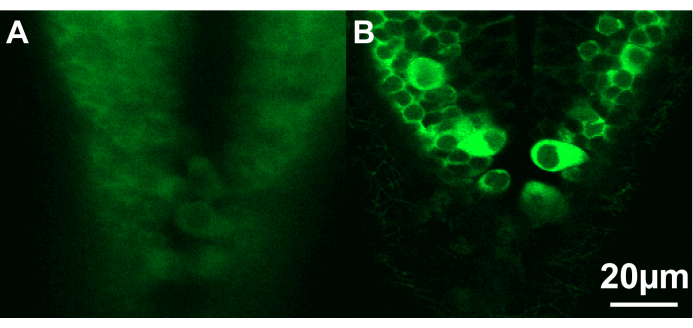
Şekil 3: İki zebra balığı larvasının arka beyninin kaudal kısmının konfokal görüntüleri. (A) Larva (~ 2.5 dpf) ideal olmayan bir açıda ve agarozun çok derininde konumlandırılmıştır, bu da nöronların net görüntülenmesini önler. (B) Burada, larva (~ 2.5 dpf) agarozun yüzeyine yakın uygun şekilde konumlandırılmıştır. Ölçek çubuğu 20 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
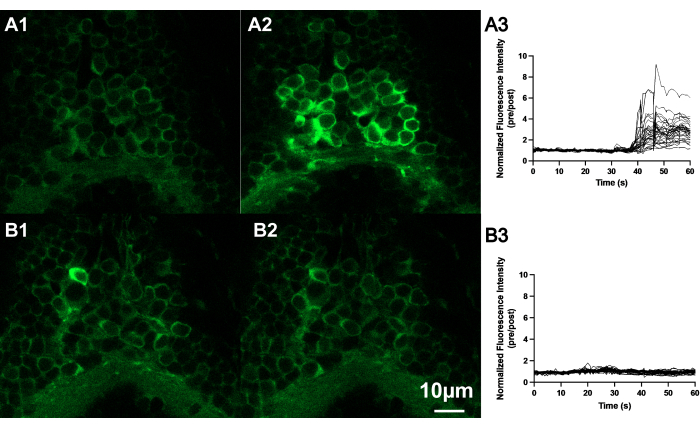
Şekil 4: AITC, zebra balığı beyninin arka beyin ve omurilik sınırında bulunan nöronların floresan yoğunluğunu arttırır. (A) AITC veya E3'e maruz kaldığında zebra balığı (7 dpf) nöronlarının temsili konfokal görüntüleri. AITC'nin uygulanmasından önce (A1) ve sonra (A2) nöronların görüntüleri, kontrol solüsyonunun (E3) uygulanmasından önce (B1) ve sonra (B2) nöronların görüntüleri ile karşılaştırıldığında. Ölçek çubuğu 10 μM. AITC (A3) veya E3'e (B3) maruz kalan embriyonik zebra balığının arka beyninde bulunan birkaç nöronun normalleştirilmiş floresan durumunun izleri. AITC'yi banyoya uyguladıktan sonra nöronların artmış floresan sergilediğini, E3 uygulandıktan sonra nöronlarda ise artmış floresan gözlenmediğini unutmayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: GCaMP6'ların yakalama hızı, yakalanan ışık miktarını ve görüntünün ortaya çıkan çözünürlüğünü belirler. (A) Her 10.13 saniyede bir (0.10 fps) yakalanan nöron görüntüleri, arka beyin ve omurilikteki nöronların nispeten yüksek çözünürlüğünü verir. Yakalama hızındaki artışla zamansal bilgi kazanılır, ancak uzamsal çözünürlük kaybolur: (B) yakalama hızı = 0,79 fps, (C) yakalama hızı = 3,16 fps ve (D) yakalama hızı = 7,67 fps. Zebra balığı, 2 dpf; ölçek çubuğu 20 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Konfokal mikroskopi ile birlikte GCaMP6'lar kullanılarak zebra balığı larvalarının beyinlerinde nöral aktivitenin kaydedilebileceğini gösterdik; GCaMP'lerin daha yavaş kinetiği nedeniyle gereken daha düşük yakalama hızları, gözlemlenen beyin alanını azaltarak telafi edilebilir6. Daha hızlı zamansal dinamiklere (yani GCaMP6f) sahip raportörler mevcuttur, ancak üstün zamansal çözünürlük genellikle azaltılmış floresan sinyali6 pahasına gelir. Konfokal mikroskop nispeten daha yavaş kayıt hızları22 ile sınırlıdır, bu nedenle raportör moleküller konfokal mikroskopinin zamansal sınırlamaları göz önünde bulundurularak seçilmelidir.
Protokol iki temel özellik ile sınırlıdır: 1) kayıt sırasında hayvanın agaroza yerleştirilmesi gerekliliği ve 2) konfokal mikroskobun nispeten yavaş yakalama hızı. Görüş alanını ve yakalama hızlarını dengelemek, belirli bir uygulama için yeterli çözünürlükle nöral aktiviteyi yakalamanın anahtarıdır. AITC'nin neden olduğu aktivite kesilir veya azalırsa, bu, larva zebra balığının uyaranı tespit edemeyebileceğini veya AITC'nin yeterince güçlü olmayabileceğini gösterebilir. İkinci durumda, stoğun tazelenmesi ve -20 °C'de donmuş halde tutulması etkinliğini artıracaktır. Balık uyaranı algılayamazsa, hayvan agarın içine çok derine implante edilmiş olabilir. Kritik bir adım, protokolün 1. adımı sırasında bir balığın konumlandırılmasıdır, çünkü bu, ilacın uygulanması sırasında optimum optik erişim için çok önemlidir.
Konfokal mikroskobun nispeten yavaş tarama hızları nedeniyle, tüm beyin kayıtları teknik olarak mümkün değildir. Önemli bir şekilde, burada özetlenen protokol, tamamlayıcı tekniklerle tanımlandıktan sonra küçük beyin alanlarını ölçmek için kullanılabilir. Özellikle, aktiviteye bağlı raportörler 9,11 ile nöral aktiviteyi işaretleyen moleküllerden yararlanan teknikleri kullanarak, deneyci bu makalede özetlenen yöntemlerin uygulanması için temel beyin ilgi alanlarını hedefleyebilir. Beyin ilgi alanları daha sonra açıklamalı zebra balığı beyin atlası, z beyin atlası11'e atıfta bulunulabilir.
Küçük ayarlamalarla, burada tartışılan teknikler ve kılavuzlar, sensorimotor işleme, öğrenme ve hafıza ve duyum ve algı dahil olmak üzere bir dizi beyin fonksiyonunu araştırmak için kullanılabilir.
Açıklamalar
Yazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişkinin yokluğunda yapıldığını beyan ederler.
Teşekkürler
Bu çalışma, Ulusal Sağlık Enstitüleri'nden (SC2GM1304854) ACR'ye bir hibe ve Ulusal Bilim Vakfı'ndan (2050850) DLG'ye bir hibe ile desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Low Melting Point Agarose | Invitrogen | 16520-100 | Diluted to 3% |
| Allyl Isothiocyanate (AITC) | Sigma Aldrich | 377430 | Chemical stimulant |
| E3 | N/A | N/A | Water-medium for zebrafish larvae |
| Glass Bottom Dishes | Thermo Fisher Scientific | 12-567-400 | Used to hold zebrafish during imaging experiments |
| Micropipette (10-100 uL) | Cole-Parmer | 21600-14 | Apparatus used for creating AITC dilutions |
| Microscope Slides | Fisherbrand | 12-550-A3 | Used to screen for phenotype |
| Mirror Finish Forceps | DUMONT | 11251-23 | Used to orient zebrafish in agarose |
| myTEMP Mini Digital Incubators | Benchmark | H2200-HC | Holding area for zebrafish; set to 28.5°C |
| Nitrile Gloves | MedPRIDE | MPR-50504 | Basic PPE |
| Petri Dishes | VWR | 89107-632 | Container for zebrafish |
| Posi-Click Tubes | DENVILLE | C-2171 | Used for AITC dilution |
| Samco Polyurethane Transfer Pipettes | Thermo Fisher Scientific | 225 | Apparatus used to select animal/administer diluted bolus of AITC |
| Stemi SV11 Apo Microscope | Zeiss | 1.25496E+11 | Used to stage zebrafish |
| Transgenic Larval Zebrafish (2 to 7 DPF) | N/A | N/A | Animal test subjects; Tg(elav3:GCaMP6s) strain |
| Zeiss Confocal Microscope (Model LSM9) | Zeiss | 3523004097 | Imaging of fish |
Referanslar
- Ahrens, M. B., Orger, M. B., Robson, D. N., Li, J. M., Keller, P. J. Whole-brain functional imaging at cellular resolution using light-sheet microscopy. Nat Method. 10 (5), 413-420 (2013).
- Meyer, M. P., Smith, S. J. Evidence from in vivo imaging that synaptogenesis guides the growth and branching of axonal arbors by two distinct mechanisms. J Neurosci. 26 (13), 3604-3614 (2006).
- Sagasti, A., Guido, M. R., Raible, D. W., Schier, A. F. Repulsive interactions shape the morphologies and functional arrangement of zebrafish peripheral sensory arbors. Curr Biol. 15 (9), 804-814 (2005).
- Son, J. H., et al. Transgenic FingRs for live mapping of synaptic dynamics in genetically-defined neurons. Sci Rep. 6, 18734 (2016).
- Zada, D., Tovin, A., Lerer-Goldshtein, T., Vatine, G. D., Appelbaum, L. Altered behavioral performance and live imaging of circuit-specific neural deficiencies in a zebrafish model for psychomotor retardation. PLoS Genet. 10 (9), e1004615 (2014).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Abdelfattah, A. S., et al. and photostable chemigenetic indicators for extended in vivo voltage imaging. Science. 365 (6454), 699-704 (2019).
- Abdelfattah, A. S., et al. Sensitivity optimization of a rhodopsin-based fluorescent voltage indicator. Neuron. 111 (10), 1547-1563.e9 (2023).
- Gao, Y. J., Ji, R. R. c-Fos and pERK, which is a better marker for neuronal activation and central sensitization after noxious stimulation and tissue injury. Open Pain J. 2, 11-17 (2009).
- Kawashima, T., Okuno, H., Bito, H. A new era for functional labeling of neurons: activity-dependent promoters have come of age. Front Neural Circuits. 8, 37 (2014).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nat Methods. 12, 1039-1046 (2015).
- Reijmers, L. G., Perkins, B. L., Matsuo, N., Mayford, M. Localization of a stable neural correlate of associative memory. Science. 317 (5842), 1230-1233 (2007).
- Mohr, M. A., Argast, P., Pantazis, P. Labeling cellular structures in vivo using confined primed conversion of photoconvertible fluorescent proteins. Nature Protoc. 11 (12), 2419-2431 (2016).
- Arrenberg, A. B., Del Bene, F., Baier, H. Optical control of zebrafish behavior with halorhodopsin. Proc Natl Acad Sci U S A. 106 (42), 17968-17973 (2009).
- Wyart, C., Del Bene, F. Let there be light: zebrafish neurobiology and the optogenetic revolution. Rev Neurosci. 22 (1), 121-130 (2011).
- Douglass, A. D., Kraves, S., Deisseroth, K., Schier, A. F., Engert, F. Escape behavior elicited by single, channelrhodopsin-2-evoked spikes in zebrafish somatosensory neurons. Curr Biol. 18 (15), 1133-1137 (2008).
- Portugues, R., Severi, K. E., Wyart, C., Ahrens, M. B. Optogenetics in a transparent animal: circuit function in the larval zebrafish. Curr Opinion Neurobiol. 23 (1), 119-126 (2013).
- Best, J. D., Alderton, W. K. Zebrafish: An in vivo. model for the study of neurological diseases. Neuropsychiat Dis Treatment. 4 (3), 567-576 (2008).
- Goldsmith, P. Zebrafish as a pharmacological tool: the how, why and when. Curr Opinion Pharmacol. 4 (5), 504-512 (2004).
- Roberts, A. C., et al. Habituation of the C-start response in larval zebrafish exhibits several distinct phases and sensitivity to NMDA receptor blockade. PloS One. 6 (12), e29132 (2011).
- Wolman, M. A., Jain, R. A., Liss, L., Granato, M. Chemical modulation of memory formation in larval zebrafish. Proc Natl Acad Sci U S A. 108 (37), 15468-15473 (2011).
- Ji, N., Freeman, J., Smith, S. L. Technologies for imaging neural activity in large volumes. Nat Neurosci. 19 (9), 1154-1164 (2016).
- Panier, T., et al. Fast functional imaging of multiple brain regions in intact zebrafish larvae using selective plane illumination microscopy. Front Neural Circuits. 7, 65 (2013).
- Distel, M., Köster, R. W. In vivo time-lapse imaging of zebrafish embryonic development. CSH Protoc. 2007, (2007).
- Liu, T. T., Hou, H., Du, J. L. A protocol for simultaneous Ca2+ and morphology imaging of brain endothelial tip cells in larval zebrafish. STAR Protoc. 2 (1), 100388 (2021).
- Wong, H. C., Drerup, C. M. Using fluorescent indicators for in vivo quantification of spontaneous or evoked motor neuron presynaptic activity in transgenic zebrafish. STAR Protoc. 3 (4), 101766 (2022).
- Graeden, E., Sive, H. Live imaging of the zebrafish embryonic brain by confocal microscopy. J Vis Exp. (26), e1217 (2009).
- Hirsinger, E., Steventon, B. A versatile mounting method for long term imaging of zebrafish development. J Vis Exp. (119), e55210 (2017).
- Renaud, O., Herbomel, P., Kissa, K. Studying cell behavior in whole zebrafish embryos by confocal live imaging: application to hematopoietic stem cells. Nat Protoc. 6 (12), 1897-1904 (2011).
- Roberts, A. C., et al. Induction of short-term sensitization by an aversive chemical stimulus in zebrafish larvae. eNeuro. 7 (6), (2020).
- Prober, D. A., et al. Zebrafish TRPA1 channels are required for chemosensation but not for thermosensation or mechanosensory hair cell function. J Neurosci. 28 (40), 10102-10110 (2008).
- Freeman, J., et al. Mapping brain activity at scale with cluster computing. Nat Methods. 11, 941-950 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır