Method Article
ב Vivo הדמיה פלואורסצנטית קונפוקלית של פעילות עצבית הנגרמת על ידי גירוי חושי בדג זברה זחל מרוסן חלקית
In This Article
Summary
כאן, אנו מציגים פרוטוקול מפורט לבחינת פעילות עצבית באזורי מוח של דגי זברה טרנסגניים המבטאים מדדי סידן GCaMP באמצעות מיקרוסקופיה קונפוקלית.
Abstract
זחלי דג הזברה הם מערכת מודל מבטיחה של בעלי חוליות לחקר המנגנונים העצביים של ההתנהגות. השקיפות והמעגלים העצביים הפשוטים יחסית שלהם מקלים על השימוש בטכניקות אופטוגנטיות בניתוחי התנהגות תאיים. אינדיקטורים פלואורסצנטיים של פעילות עצבית in vivo , כגון GCaMP6s, היו בשימוש נרחב כדי לחקור את הפעילות העצבית הקשורה להתנהגויות פשוטות בדג זברה זחל. כאן, אנו מציגים פרוטוקול לזיהוי פעילות הנגרמת על ידי חושים בזחלי דג זברה מרוסנים למחצה באמצעות הקו הטרנסגני Tg (elav3:GCaMP6s). בפרט, אנו משתמשים בחומר הכימי אליל איזותיוציאנט כדי לגרום לתגובה פלואורסצנטית חזקה וניתנת לשחזור באזור במוח בגבול המוח האחורי וחוט השדרה. אנו דנים בשימושים הפוטנציאליים של GCaMP6s לניטור אופטי של פעילות עצבית במהלך מגוון פרדיגמות התנהגותיות ובמגבלות של טכניקה זו. הפרוטוקול שלנו מתאר גישה נגישה לניטור פעילות עצבית דינמית הקשורה להתנהגות in vivo במוח דג הזברה הזחל.
Introduction
דג הזברה מייצג מודל של בעלי חוליות עם יכולת משיכה לחקירות נוירוביולוגיות תאיות-מולקולריות מפורטות. לדג הזברה הזחל יש ~100,000 נוירונים ב-5 ימים לאחר ההפריה (DPF), הרבה פחות ממוחות של יונקים. יתר על כן, דגי הזברה שקופים יחסית, תכונה המאפשרת מחקרים אופטיים של מבנה ותפקוד עצבי 1,2,3,4,5. מספר כלים אופטוגנטיים פותחו לשימוש בדגי זברה, כולל מחווני סידן בנאמנות גבוהה6, חיישני מתח 7,8 וסמנים תלויי פעילות של פעילות עצבית 9,10,11,12,13. כלים אלה משלימים יתרונות אחרים שיש למודל זה, כגון התאמה לשינויים גנטיים 14,15,16,17 והמוכנות שבה זחלי דג הזברה סופגים כימיקלים הקיימים בתמיסות רחצה 18,19,20,21.
מגוון שיטות שימושיות לפיזיולוגיה אופטית של דג הזברה, במיוחד שני פוטונים, יריעת אור ומיקרוסקופיה קונפוקלית. כל אחת מהטכנולוגיות הללו חייבת לאזן בין שתי בעיות קשורות של רזולוציה: גישה אופטית, כולל פיזור אור על ידי הרקמה הסובבת, ומהירות הדגימה, במיוחד ללכידת קינטיקה פוטנציאלית לפעולה בקנה מידה של תת-אלפית שנייה22. חלו שיפורים דרמטיים בהדמיית סידן in vivo באמצעות מיקרוסקופ דו-פוטוני, אך שיטה זו מוגבלת לרוב לשדה ראייה של <1 מ"מ2, ובדרך כלל, ניתן לרכוש רק מישור עומק אחד, ובכך להגביל את לכידת הפעילות על פני אזורים גדולים של מעגלים עצביים22. עבור מיקרוסקופ גיליון אור, הפוטנציאל לתעד את הפעילות של כמעט כל הנוירונים במוח פותר את מגבלת שדה הראייה של מיקרוסקופיה דו-פוטונית, אך מהירויות המצלמה הנוכחיות מגבילות פיזית את הלכידה לכשלושה נפחי מוח לשנייה ב-40 מטוסים לנפח מוח בדג הזברה הזחלי 1,23. מיקרוסקופיה קונפוקלית נחותה הן ברזולוציית העומק והן במהירות הלכידה ממיקרוסקופיה של שני פוטונים וגיליונות אור. למיקרוסקופיה קונפוקלית יש את היתרונות של נגישות נרחבת למעבדות ברחבי העולם והיכולת להשיג שחזורים מוחיים שלמים של פעילות עצבית באמצעות מדווחים על פעילות עצבית, כגון cFos ו-p-ERK9. יתר על כן, אם אזורי מוח קטנים ממוקדים, המיקרוסקופ הקונפוקלי יכול לספק רזולוציה זמנית נאותה של פעילות עצבית.
המאמר הנוכחי מתאר שיטה המשתמשת במיקרוסקופיה קונפוקלית כדי לתעד פעילות עצבית בדגי זברה טרנסגניים המבטאים GCaMP6s באופן פאן-עצבי. מספר פרוטוקולים דומים המשתמשים בזחלי דג הזברה פותחו כדי להבין את תפקודם של מסלולים עצביים 24,25,26,27,28,29. מאפיינים עיקריים של כמה מהפרוטוקולים הללו, כגון הדמיית זמן-lapse, אינדיקטורים פלואורסצנטיים של דינמיקת סידן והדמיה חיה, שולבו כדי למדוד פעילות עצבית באוכלוסייה קטנה של נוירונים במערכת העצבים המרכזית של דג הזברה בתגובה לאליל איזותיוציאנט (AITC), גירוי כימי מרתיע 11,26,27,29,30,31. AITC מעורר תגובה כלל-מוחית המתמקדת באזור המוח האחורי11. לאשכול אחד של נוירונים הקשורים למוח האחורי יש תפקיד בתנועה ובתגובה ממושכת ל-AITC. תגובה זו מחזיקה מעמד מעבר להסרת הגירוי המרתיע30. על ידי הגבלת שדה הראייה, הצלחנו לזהות פעילות עצבית באשכול עצבי זה כפי שהיא משתקפת בשינוי הקרינה בתאי עצב המבטאים GCaMP6s. אנו מספקים טכניקות, הנחיות ושיטות עבודה מומלצות להשגת רזולוציה מרחבית-זמנית מספקת באמצעות מיקרוסקופיה קונפוקלית. בנוסף, אנו דנים במגבלות שיטת ההקלטה האופטית שלנו. למרות מגבלות אלה, השיטה אמורה לאפשר חקירה של מגוון תופעות נוירוביולוגיות, כולל זיכרון ועיבוד סנסומוטורי.
Protocol
כל ההליכים המשתמשים בבעלי חיים אושרו על ידי הוועדה המוסדית לשימוש בבעלי חיים באוניברסיטת קליפורניה סטייט, פולרטון (פרוטוקול # 2023-1310).
1. בימוי דג זברה זחל באגרוז נקודת התכה נמוכה
- לגדל בעלי חיים טרנסגניים בוגרים בעלי ביטוי כלל-עצבי Tg (elav3:GCaMP6s)6 עם שני זכרים לשתי נקבות בהתאם להנחיות מוסדיות לטיפול בבעלי חיים. בוגרים ממוקמים בתאי רבייה מיוחדים כך שביצים משוחררות נלכדות בתא תחתון עם תחתית מזויפת שאינה נגישה למבוגרים. באור ראשון או כאשר מסירים את מפריד ההפרדה, הנקבות משחררות ביצים, והזכרים מפרים ביצים שנלכדו בתחתית הכוזבת.
- הסר בוגרים ואסוף ביציות מופרות באמצעות מסננת ביצים והניח בתווך עובר (E3) (5 מ"מ NaCl, 0.33 מ"מ MgSO4, 0.33 מ"מ CaCl2, 0.17 מ"מ KCl, 1 מ"מ HEPES, 0.00001% מתילן כחול, pH 7.0)30 עם 14 שעות אור / 10 שעות חושך ב-28.5 מעלות צלזיוס בתוך אינקובטור
הערה: למתכון E3 המשמש יש ריכוז נמוך של מתילן כחול שאינו משפיע על הקרינה או מוביל לאות פלואורסצנטי אוטומטי משמעותי. איננו דורשים שימוש ב-1-פניל 2-תיאוריאה (PTU) בגילאי ההתפתחות המפורטים בפרוטוקול בשל השקיפות הטבעית שמעניק הקו הטרנסגני GCaMP6s. - הר בעלי חיים 2-7 ימים לאחר ההפריה (dpf) באמצעות נקודת התכה נמוכה של 3% אגרוז מומס במדיום E3. החום הגיע לטמפרטורה שבה ניתן לתפעל את דג הזברה מבלי לפגוע באורגניזם. לפני שנקודת ההיתוך הנמוכה של האגרוז מתקררת ומתמצקת (<1 דקה), מקמו את הזחלים עם הצד הגבי כלפי מעלה בצלחת פטרי עם תחתית זכוכית כך שהאזור במוח שנבדק יהיה קרוב ככל האפשר למטרה, כפי שמוצג באיור 1. בהתאם לניסוי, בדרך כלל, 8 עד 10 דגי זברה לקבוצת ניסוי מספיקים.
הערה: בעלי חיים לא הורדמו בפרוטוקול זה. - לאחר שהאגרוז התייצב עם הזחל במקומו (כ -2 עד 3 דקות), הוסף 5 מ"ל של תמיסת E3. לאחר מכן, חותכים את האגרוז בעזרת אזמל כנדרש בפרוטוקול הניסוי.
הערה: יש לחתוך חלקים שונים של האגר, תלוי אילו חלקים של דג הזברה צריכים להשתחרר מריסון ו/או לקבל סוג אחר של גירוי. - העבירו את צלחת הפטרי המכילה את דג הזברה לשלב המיקרוסקופ הקונפוקלי ואפשרו לדג להתאקלם למשך 20 דקות.
2. הגדרה והדמיה במיקרוסקופיה קונפוקלית עם יישום גירוי
- לאחר תקופת ההתאקלמות, מרכז את הדגים מתחת ליעד הטבילה במים פי 40 (NA 1.0) בטמפרטורת החדר באמצעות שדה בהיר עם מקור אור (~475 ננומטר).
- הגדרות רכישת מיקרוסקופ קונפוקלי יהיו תלויות באיכויות וברמת הביטוי של המולקולה הפלואורסצנטית, בעומק ובתכונות האופטיות של הרקמה, בגודל שדה הראייה ובמהירות ההקלטה. קבע הגדרות מתאימות באמצעות מחוון הטווח כדי להבטיח לכידה אופטימלית של האור הנפלט בהתאם לצרכי הניסוי.
- ודא התאמה נכונה של עוצמת הלייזר ורווח המאסטר כדי ללכוד אור פלורסנט בטווח האופטימלי, ובכך למנוע אובדן מיותר של אות הקרינה התלוי ב-GCaMP6s. השתמש ברשימת ההגדרות והגורמים הקונפוקליים העיקריים המפורטים להלן כדי לקבוע את ההגדרות המתאימות.
- גודל חור סיכה: קבע זאת לפי המטרה המשמשת והגדר לקבל מישור מוקד יחיד תוך הגבלת מישורי מוקד אחרים. עבור פרוטוקול זה, נעשה שימוש בחור סיכה של 32 מיקרומטר.
- עוצמת לייזר ואורך גל: התאם את עוצמת הלייזר על סמך רמת הביטוי של המולקולה הפלואורסצנטית והעומק והתכונות האופטיות של הרקמה. השתמש במחוון הטווח כדי להבטיח שהלייזר אינו חורג מהטווח של גלאי הצילום. הגדר את אורך גל העירור לאורך הגל של האור שמעורר בצורה אופטימלית את המולקולה הפלואורסצנטית. לניסוי זה, מכיוון שהדגים היו הטרוזיגוטיים עבור הטרנסגן GCaMP6s ורמות הביטוי היו נמוכות, השתמשו בעוצמת לייזר של 5% באורך גל של 488 ננומטר, רווח מאסטר של 650. עם ביטוי טרנסגנים חזק, עוצמת הלייזר נעה בין 1.5% ל-3%, וזה בדרך כלל מספיק.
הערה: אם עוצמת הלייזר מוגדרת נמוכה מדי, מידע (אור שזוהה על ידי צינור מכפיל הפוטו) יאבד. אם עוצמת הלייזר מוגדרת גבוהה מדי, האור הנפלט עלול לחרוג מטווח הגלאי או לפגוע בדגימה (פוטו-אקונומיקה). - רווח מאסטר: הרווח הראשי קובע את הרגישות של גלאי הפוטו. השתמש במחוון הטווח כדי להבטיח שהרווח הראשי אינו מוגדר גבוה מדי, ובכך חורג מהטווח של גלאי הצילום. עבור ניסוי זה, הרווח הראשי מוגדר ל-650.
- שדה ראייה: ודא ששדה הראייה גדול מספיק כדי ללכוד את הרקמה המעניינת. זוהי מגבלה עיקרית עבור מיקרוסקופים קונפוקליים בדרך כלל מכיוון שגודל שדה הראייה יגביל את מהירות הלכידה, כפי שמוצג באיור 2. עבור הניסויים הכוללים AITC, הגדר את שדה הראייה ל-79.86 מיקרומטר2.
- מהירות הלכידה: ככל שמהירות הלכידה גדלה, כמות האור שנלכדת על ידי גלאי הצילום תפחת. ככל שנלכד פחות אור, איכות התמונה תיפגע. ודא שמהירות הצילום מאזנת בין איכות התמונה לבין המהירות הנדרשת כדי ללכוד את האירוע הפיזיולוגי המעניין. כאן, מהירות הלכידה מוגדרת ל-1.20 f/s.
- מרכז את שדה הראייה על אשכול עצבי זנב לקומיסורה אינפימה הלרי בחלק הרוסטרלי של חוט השדרה30. אשכול זה קטן למדי ב-~2.5 dpf אך הוא גדול בהרבה בהמשך הפיתוח (7 dpf).
הערה: אם הרכבת אגרוז בשלב 1 אינה אופטימלית, כלומר החיה ממוקמת בזווית או עמוק מדי באגרוז, איכות התמונה תושפע לרעה. תמונה של חוט השדרה של דג הזברה בחיה שממוקמת היטב ותמונה מנוגדת של חוט השדרה בדג זברה שממוקם בצורה לא אופטימלית מוצגות באיור 3. - בצע סריקת סדרות זמן באמצעות שדה ראייה של 79.86 מיקרומטר2 ב-1.20 פריימים לשנייה (fps) עם רזולוציה מרחבית של 0.119 מיקרומטר2 לפיקסל. התאם את גודל שדה הראייה ומהירות רכישת התמונה בהתאם ליישום הרצוי.
- 2 דקות לאחר תחילת ההדמיה, הוסף 41.67 מיקרוליטר של תמיסת מלאי של AITC (ריכוז סופי של 10 מיקרומטר) או תמיסת E3 לצלחת עם פיפטה. המשך להקליט במשך ~30 שניות כדי לצפות בכל שינוי בפעילות GCaMP6s באזור העניין עם הדמיית זמן-lapse. לאחר השלמת ההקלטה, שחרר את החיה מהאגרוז והמתת חסד בהתאם להנחיות המוסד לטיפול בבעלי חיים.
הערה: בזמן הקלטת פעילות GCaMP6s, האור הקונפוקלי עצמו יכול להוות גירוי. יש לקחת זאת בחשבון בניתוח תוצאות ההדמיה. זמן ההקלטה הוא פונקציה של מספר הפריימים וקצב הלכידה של כל פריים, אותו ניתן לכוונן לפי הצורך לזמן הרצוי.
3. ניתוח אות GCaMP באמצעות פיג'י
- לאחר ההקלטה, אם הפלט אינו בפורמט קובץ .tif לניתוח FIJI במורד הזרם, ייצא את קבצי התמונה כקבצי .tif מחבילת תוכנת המיקרוסקופ.
- הורד את פיג'י לניתוח עקבות עצביים. פתח את FIJI, ייבא את קבצי ה-.czi לתוך התוכנית, וכאשר תתבקש, השתמש בהגדרות ברירת המחדל בתוסף BioFormats.
- הדגש אזור/נוירון מעניין באמצעות הכלים Circle או Freehand על ידי לחיצה על הסמלים המתאימים שלהם. (ריחוף מעל הסמלים יהבהב את שם הכלי בתוכנית.)
הערה: מכיוון שאזור העניין משתנה בגודלו, אזורים / עיגולים קבועים אינם אפשריים. תוכנה המאפשרת רישום של שינויים פלואורסצנטיים לאורך זמן כ-voxels, כגון חבילת Thunder32, יכולה לאפשר זיהוי של נוירונים בודדים; עם זאת, עבור ~20 נוירונים בניסוי הנוכחי, זיהוי גבולות הממברנה על ידי צופה עיוור עשוי להיות עדיף על מערכת זיהוי אוטומטית. - לאחר בחירת החזר ROI, בסרגל הכלים של FIJI, לחץ על Analyze > Tools > ROI Manager. לאחר מכן, לחץ על הוסף [t], והחזר ה-ROI שנבחר יתווסף לחלון מנהל ה-ROI.
- בתוך מנהל ההחזר על ההשקעה, לחץ על עוד > Multi Measure. השאר את ההגדרות כברירת מחדל ולחץ על אישור. פיג'י תייצר נתונים גולמיים שניתן לתפעל כקובץ CSV באמצעות Python או כנתונים גולמיים בגיליון אלקטרוני.
- כדי לנרמל את הנתונים הגולמיים ולייצג אותם כעקבות עצביים עבור אזור עניין נתון, ממוצע את ערכי ~30 השניות האחרונים של חלון 2 הדקות לפני הגירוי, ונרמל את כל הערכים שלאחר הגירוי לערך הבסיס הממוצע הזה:
עוצמת הקרינה המנורמלת = (פלואורסצנציה מיידית של אזור עניין נתון לאחר הגירוי)/(פלואורסצנטיות ממוצעת של ~30 שניות של מרווח של 2 דקות לפני גירוי) - שרטט את הנתונים כעקבות עצביים, כפי שמוצג באיור 4.
הערה: בסוגים מסוימים של מיקרוסקופיות, כגון מיקרוסקופיה של גיליון אור, שבה נרשם נפח של המוח, חפצי תנועה מטופלים באמצעות רישום מרחבי לאחר עיבוד לנפח מוח ייחוס 1,11. עם זאת, מכיוון שאנו מקליטים רק ממישור אחד, לא ניתן לבצע התאמות עבור חפצי תנועה. לכן, עבור התוצאות המוצגות כאן, לא הוסרו מסגרות. עם זאת, אם חפצי תנועה ישנו באופן משמעותי את התוצאות, מערכות אוטומטיות יוכלו לזהות ולתקן מסגרות עם חפצי תנועה1, 11, או צופה עיוור יכול להסיר מסגרות כאלה.
תוצאות
מתן אליל איזותיוציאנט גורם לאות עצבי הקשור לסידן בזחל דג הזברה
מתן AITC (שלב 2.6) גורם לעלייה נרחבת בפעילות העצבית הקשורה ל-GCaMP6s על פני המוח של דג הזברה הזחל11,30. ראינו אות פלואורסצנטי מוגבר באזור קטן במוח אחרי יישום AITC, כפי שמוצג באיור 4.
איזון הרזולוציה של אותות עצביים הקשורים לסידן, מהירות לכידה ואזור לכידה
הגדלת מהירות הלכידה מפחיתה את הרזולוציה, שיש לקחת בחשבון בתכנון ניסיוני. אנו מציגים מגוון מהירויות והרזולוציות המתאימות שלהן באמצעות עוברי דג זברה ב-~2.5 dpf באיור 5. בעת רישום פעילות עצבית, מהירות הלכידה צריכה להיות מהירה מספיק כדי לתעד את הפעילות. למרות ששינויי המתח עקב פוטנציאל פעולה הם מהירים יחסית (1-2 אלפיות השנייה), אינטראקציות סידן עם GCaMP יאריכו את משך אות פוטנציאל הפעולה. ל-GCaMP6s, המולקולה המשמשת כאן, יש קינטיקה איטית במיוחד. ניתן לזהות ולתאם פוטנציאל פעולה בודד באמצעות מולקולות GCaMP בתרבית תאים6, אך לא ברור אם דיוק זה של זיהוי אותות יכול להתרחש in vivo עם דג זברה זחל. עם זאת, ככל שמהירות הלכידה גבוהה יותר, כך גדל הסיכוי שמידע זמני הקשור לפעילות עצבית יילכד, בהנחה שזיהוי האותות אינו מצטמצם משמעותית על ידי מהירויות הלכידה הגבוהות יותר. יתר על כן, גודל שדה התצפית ישפיע גם על מהירויות הלכידה במיקרוסקופ קונפוקלי סטנדרטי. על ידי הפחתת שדה הראייה, אדם מגביר את מהירות הלכידה אך מאבד מידע על פעילות עצבית באזורי מוח אחרים. כדי ללכוד אותות GCaMP6, יישומים המשתמשים במיקרוסקופיה קונפוקלית חייבים להיות מוגבלים לאזור מוח קטן (50-150 מיקרומטר2). מהירות הלכידה צריכה להיות מהירה יותר מהאות שנצפה כדי להפחית את הכינוי. עם זאת, מהירויות הלכידה של מיקרוסקופיה קונפוקלית יגרמו בהכרח לאובדן מידע מסוים בצורה של אור נפלט. יש לקחת בחשבון תמיד את העלויות והתועלת היחסיות הללו כדי לענות על שאלת הניסוי הרצויה ביעילות.

איור 1: תיאור המיקום של דג זברה זחל מרוסן חלקית להדמיה. הזחל משובץ בנקודת התכה נמוכה וממוקם בצד הגב כלפי מעלה. חלקים רוסטרליים וזנביים של האגרוז הוסרו כדי לאפשר לעור דג הזברה להיחשף ל-AITC. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
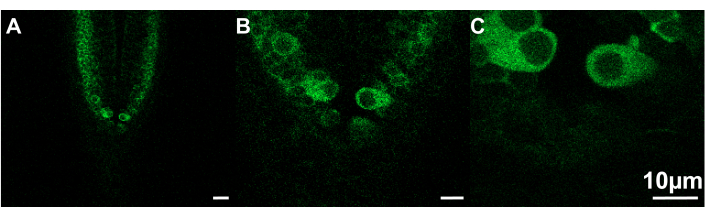
איור 2: דוגמאות לתמונות בגדלים שונים שניתן לצפות בהן במהירויות לכידה שונות. (A) גודל מסגרת = 319.45 x 319.45 מיקרומטר; מהירות לכידה = .30 פריימים לשנייה. (B) גודל מסגרת = 106.48 x 106.48 מיקרומטר; מהירות לכידה = 7.67 פריימים לשנייה. (C) גודל מסגרת = 53.24 x 53.24 מיקרומטר; מהירות לכידה = 9.80 פריימים לשנייה. דג זברה, ~2.5 dpf; סרגל קנה מידה 10 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
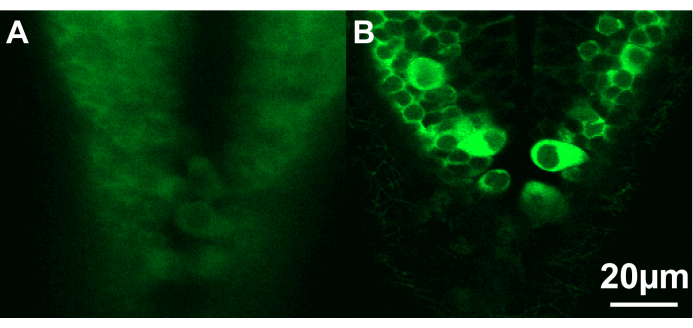
איור 3: תמונות קונפוקליות של החלק הזנבי של המוח האחורי של שני זחלי דג זברה. (A) הזחל (~2.5 dpf) ממוקם בזווית לא אידיאלית ועמוק מדי באגרוז, מה שמונע דימות חד של תאי העצב. (B) כאן, הזחל (~2.5 dpf) ממוקם כראוי ליד פני השטח של האגרוז. סרגל קנה מידה 20 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
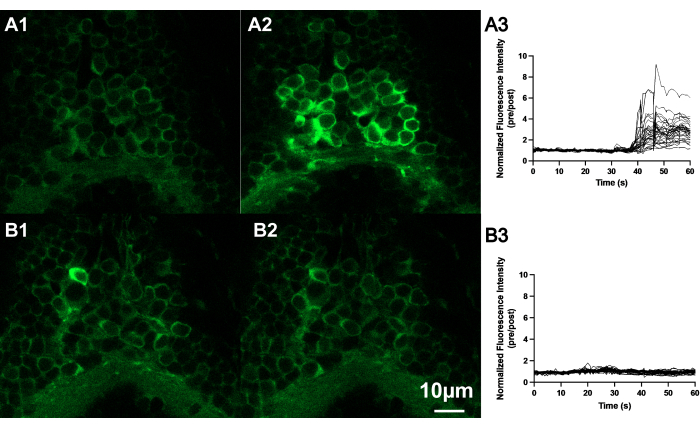
איור 4: AITC מגביר את עוצמת הקרינה של תאי עצב הממוקמים בגבול המוח האחורי וחוט השדרה של מוח דג הזברה. (A) תמונות קונפוקליות מייצגות של תאי עצב של דג הזברה (7 dpf) כאשר הם נחשפים ל-AITC או E3. תמונות של נוירונים לפני (A1) ואחרי (A2) יישום AITC בהשוואה ל-(B) תמונות של נוירונים לפני (B1) ואחרי (B2) יישום תמיסת הבקרה (E3). סרגל קנה מידה 10 מיקרומטר. עקבות של מצב פלואורסצנטי מנורמל של מספר נוירונים הממוקמים במוח האחורי של דג זברה עוברי שנחשף ל- AITC (A3) או E3 (B3). שימו לב שהנוירונים הפגינו פלואורסצנטיות מוגברת לאחר מריחת AITC על האמבטיה, בעוד שהפלואורסצנטיות המוגברת לא נצפתה בתאי העצב לאחר יישום E3. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: מהירות הלכידה של GCaMP6s קובעת את כמות האור שנלכדה ואת הרזולוציה המתקבלת של התמונה. (A) תמונות של תאי עצב שנלכדו כל 10.13 שניות (0.10 fps) נותנות רזולוציה גבוהה יחסית של נוירונים במוח האחורי ובחוט השדרה. עם עלייה במהירות הלכידה, מתקבל מידע זמני, אך הרזולוציה המרחבית הולכת לאיבוד: (B) מהירות לכידה = 0.79 fps, (C) מהירות לכידה = 3.16 fps, ו-(D) מהירות לכידה = 7.67 fps. דג זברה, 2 dpf; סרגל קנה מידה 20 מיקרומטר. אנא לחץ כאן לצפייה בגרסה מוגדלת של איור זה.
Discussion
הראינו שניתן לרשום פעילות עצבית במוחם של זחלי דג הזברה באמצעות GCaMP6s יחד עם מיקרוסקופיה קונפוקלית; ניתן לפצות על מהירויות הלכידה הנמוכות יותר הנדרשות עקב הקינטיקה האיטית יותר של GCaMPs על ידי הפחתת אזור המוח שנצפה6. מדווחים עם דינמיקה זמנית מהירה יותר (כלומר, GCaMP6f) זמינים, אך הרזולוציה הזמנית המעולה באה בדרך כלל במחיר של אות פלואורסצנטי מופחת6. המיקרוסקופ הקונפוקלי מוגבל למהירויות הקלטה איטיות יחסית22, ולכן יש לבחור מולקולות מדווחות תוך התחשבות במגבלות הזמן של מיקרוסקופיה קונפוקלית.
הפרוטוקול מוגבל על ידי שני מאפיינים עיקריים: 1) הדרישה למקם את החיה באגרוז במהלך ההקלטה ו-2) מהירות הלכידה האיטית יחסית של מיקרוסקופיה קונפוקלית. איזון שדה הראייה ומהירויות הלכידה הוא המפתח ללכידת פעילות עצבית ברזולוציה מספקת עבור יישום נתון. אם הפעילות הנגרמת על ידי AITC נחתכת או פוחתת, זה יכול להצביע על כך שייתכן שדג הזברה הזחל לא יוכל לזהות את הגירוי או שה-AITC עשוי להיות לא חזק מספיק. במקרה האחרון, רענון הציר ושמירתו קפואה ב-20 מעלות צלזיוס יאריך את יעילותו. אם הדג אינו יכול לזהות את הגירוי, ייתכן שהחיה הושתלה עמוק מדי באגר. שלב קריטי הוא מיקום הדג במהלך שלב 1 של הפרוטוקול, מכיוון שהוא חיוני לגישה אופטית אופטית במהלך יישום התרופה.
בשל מהירויות הסריקה האיטיות יחסית של המיקרוסקופיה הקונפוקלית, הקלטות של כל המוח אינן אפשריות מבחינה טכנית. באופן משמעותי, הפרוטוקול המתואר כאן יכול לשמש למדידת אזורים קטנים במוח לאחר זיהוי בטכניקות משלימות. בפרט, על ידי שימוש בטכניקות הממנפות מולקולות המסמנות פעילות עצבית עם מדווחים תלויי פעילות 9,11, הנסיין יכול להתמקד בתחומי עניין מרכזיים במוח ליישום השיטות המתוארות במאמר זה. לאחר מכן ניתן להתייחס לתחומי עניין במוח לאטלס המוח המבואר של דג הזברה, z אטלס מוח11.
עם התאמות קלות, ניתן להשתמש בטכניקות ובהנחיות שנדונו כאן כדי לחקור מגוון של תפקודי מוח, כולל עיבוד סנסומוטורי, למידה וזיכרון, ותחושה ותפיסה.
Disclosures
המחברים מצהירים כי המחקר נערך בהיעדר קשרים מסחריים או פיננסיים כלשהם שיכולים להתפרש כניגוד אינטרסים פוטנציאלי.
Acknowledgements
עבודה זו נתמכה על ידי מענק ל-ACR מהמכונים הלאומיים לבריאות (SC2GM1304854) ומענק ל-DLG מהקרן הלאומית למדע (2050850).
Materials
| Name | Company | Catalog Number | Comments |
| Low Melting Point Agarose | Invitrogen | 16520-100 | Diluted to 3% |
| Allyl Isothiocyanate (AITC) | Sigma Aldrich | 377430 | Chemical stimulant |
| E3 | N/A | N/A | Water-medium for zebrafish larvae |
| Glass Bottom Dishes | Thermo Fisher Scientific | 12-567-400 | Used to hold zebrafish during imaging experiments |
| Micropipette (10-100 uL) | Cole-Parmer | 21600-14 | Apparatus used for creating AITC dilutions |
| Microscope Slides | Fisherbrand | 12-550-A3 | Used to screen for phenotype |
| Mirror Finish Forceps | DUMONT | 11251-23 | Used to orient zebrafish in agarose |
| myTEMP Mini Digital Incubators | Benchmark | H2200-HC | Holding area for zebrafish; set to 28.5°C |
| Nitrile Gloves | MedPRIDE | MPR-50504 | Basic PPE |
| Petri Dishes | VWR | 89107-632 | Container for zebrafish |
| Posi-Click Tubes | DENVILLE | C-2171 | Used for AITC dilution |
| Samco Polyurethane Transfer Pipettes | Thermo Fisher Scientific | 225 | Apparatus used to select animal/administer diluted bolus of AITC |
| Stemi SV11 Apo Microscope | Zeiss | 1.25496E+11 | Used to stage zebrafish |
| Transgenic Larval Zebrafish (2 to 7 DPF) | N/A | N/A | Animal test subjects; Tg(elav3:GCaMP6s) strain |
| Zeiss Confocal Microscope (Model LSM9) | Zeiss | 3523004097 | Imaging of fish |
References
- Ahrens, M. B., Orger, M. B., Robson, D. N., Li, J. M., Keller, P. J. Whole-brain functional imaging at cellular resolution using light-sheet microscopy. Nat Method. 10 (5), 413-420 (2013).
- Meyer, M. P., Smith, S. J. Evidence from in vivo imaging that synaptogenesis guides the growth and branching of axonal arbors by two distinct mechanisms. J Neurosci. 26 (13), 3604-3614 (2006).
- Sagasti, A., Guido, M. R., Raible, D. W., Schier, A. F. Repulsive interactions shape the morphologies and functional arrangement of zebrafish peripheral sensory arbors. Curr Biol. 15 (9), 804-814 (2005).
- Son, J. H., et al. Transgenic FingRs for live mapping of synaptic dynamics in genetically-defined neurons. Sci Rep. 6, 18734 (2016).
- Zada, D., Tovin, A., Lerer-Goldshtein, T., Vatine, G. D., Appelbaum, L. Altered behavioral performance and live imaging of circuit-specific neural deficiencies in a zebrafish model for psychomotor retardation. PLoS Genet. 10 (9), e1004615 (2014).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Abdelfattah, A. S., et al. and photostable chemigenetic indicators for extended in vivo voltage imaging. Science. 365 (6454), 699-704 (2019).
- Abdelfattah, A. S., et al. Sensitivity optimization of a rhodopsin-based fluorescent voltage indicator. Neuron. 111 (10), 1547-1563.e9 (2023).
- Gao, Y. J., Ji, R. R. c-Fos and pERK, which is a better marker for neuronal activation and central sensitization after noxious stimulation and tissue injury. Open Pain J. 2, 11-17 (2009).
- Kawashima, T., Okuno, H., Bito, H. A new era for functional labeling of neurons: activity-dependent promoters have come of age. Front Neural Circuits. 8, 37 (2014).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nat Methods. 12, 1039-1046 (2015).
- Reijmers, L. G., Perkins, B. L., Matsuo, N., Mayford, M. Localization of a stable neural correlate of associative memory. Science. 317 (5842), 1230-1233 (2007).
- Mohr, M. A., Argast, P., Pantazis, P. Labeling cellular structures in vivo using confined primed conversion of photoconvertible fluorescent proteins. Nature Protoc. 11 (12), 2419-2431 (2016).
- Arrenberg, A. B., Del Bene, F., Baier, H. Optical control of zebrafish behavior with halorhodopsin. Proc Natl Acad Sci U S A. 106 (42), 17968-17973 (2009).
- Wyart, C., Del Bene, F. Let there be light: zebrafish neurobiology and the optogenetic revolution. Rev Neurosci. 22 (1), 121-130 (2011).
- Douglass, A. D., Kraves, S., Deisseroth, K., Schier, A. F., Engert, F. Escape behavior elicited by single, channelrhodopsin-2-evoked spikes in zebrafish somatosensory neurons. Curr Biol. 18 (15), 1133-1137 (2008).
- Portugues, R., Severi, K. E., Wyart, C., Ahrens, M. B. Optogenetics in a transparent animal: circuit function in the larval zebrafish. Curr Opinion Neurobiol. 23 (1), 119-126 (2013).
- Best, J. D., Alderton, W. K. Zebrafish: An in vivo. model for the study of neurological diseases. Neuropsychiat Dis Treatment. 4 (3), 567-576 (2008).
- Goldsmith, P. Zebrafish as a pharmacological tool: the how, why and when. Curr Opinion Pharmacol. 4 (5), 504-512 (2004).
- Roberts, A. C., et al. Habituation of the C-start response in larval zebrafish exhibits several distinct phases and sensitivity to NMDA receptor blockade. PloS One. 6 (12), e29132 (2011).
- Wolman, M. A., Jain, R. A., Liss, L., Granato, M. Chemical modulation of memory formation in larval zebrafish. Proc Natl Acad Sci U S A. 108 (37), 15468-15473 (2011).
- Ji, N., Freeman, J., Smith, S. L. Technologies for imaging neural activity in large volumes. Nat Neurosci. 19 (9), 1154-1164 (2016).
- Panier, T., et al. Fast functional imaging of multiple brain regions in intact zebrafish larvae using selective plane illumination microscopy. Front Neural Circuits. 7, 65 (2013).
- Distel, M., Köster, R. W. In vivo time-lapse imaging of zebrafish embryonic development. CSH Protoc. 2007, (2007).
- Liu, T. T., Hou, H., Du, J. L. A protocol for simultaneous Ca2+ and morphology imaging of brain endothelial tip cells in larval zebrafish. STAR Protoc. 2 (1), 100388 (2021).
- Wong, H. C., Drerup, C. M. Using fluorescent indicators for in vivo quantification of spontaneous or evoked motor neuron presynaptic activity in transgenic zebrafish. STAR Protoc. 3 (4), 101766 (2022).
- Graeden, E., Sive, H. Live imaging of the zebrafish embryonic brain by confocal microscopy. J Vis Exp. (26), e1217 (2009).
- Hirsinger, E., Steventon, B. A versatile mounting method for long term imaging of zebrafish development. J Vis Exp. (119), e55210 (2017).
- Renaud, O., Herbomel, P., Kissa, K. Studying cell behavior in whole zebrafish embryos by confocal live imaging: application to hematopoietic stem cells. Nat Protoc. 6 (12), 1897-1904 (2011).
- Roberts, A. C., et al. Induction of short-term sensitization by an aversive chemical stimulus in zebrafish larvae. eNeuro. 7 (6), (2020).
- Prober, D. A., et al. Zebrafish TRPA1 channels are required for chemosensation but not for thermosensation or mechanosensory hair cell function. J Neurosci. 28 (40), 10102-10110 (2008).
- Freeman, J., et al. Mapping brain activity at scale with cluster computing. Nat Methods. 11, 941-950 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved