Method Article
In vivo Imagem de fluorescência confocal da atividade neural induzida por estimulação sensorial em peixes-zebra larvais parcialmente contidos
Neste Artigo
Resumo
Aqui, apresentamos um protocolo detalhado para examinar a atividade neural em regiões cerebrais de peixes-zebra transgênicos que expressam indicadores de cálcio GCaMP usando microscopia confocal.
Resumo
As larvas de peixe-zebra são um sistema modelo de vertebrado promissor para estudar os mecanismos neurais do comportamento. Sua translucidez e circuitos neurais relativamente simples facilitam o uso de técnicas optogenéticas em análises celulares do comportamento. Indicadores fluorescentes de atividade neural in vivo , como GCaMP6s, têm sido amplamente utilizados para estudar a atividade neural associada a comportamentos simples em larvas de peixe-zebra. Aqui, apresentamos um protocolo para detecção de atividade induzida sensorial em larvas de peixe-zebra semi-contidas usando a linhagem transgênica Tg(elav3:GCaMP6s). Em particular, usamos o agente químico isotiocianato de alila para induzir uma resposta fluorescente robusta e reprodutível em uma região do cérebro na borda do rombencéfalo e da medula espinhal. Discutimos os usos potenciais de GCaMP6s para monitoramento óptico da atividade neural durante uma variedade de paradigmas comportamentais e as limitações dessa técnica. Nosso protocolo descreve uma abordagem acessível para monitorar a atividade neural in vivo dinâmica e relacionada ao comportamento no cérebro larval do peixe-zebra.
Introdução
O peixe-zebra representa um modelo animal vertebrado com tratabilidade para investigações neurobiológicas celulares-moleculares detalhadas. As larvas de peixe-zebra possuem ~ 100.000 neurônios 5 dias após a fertilização (dpf), significativamente menos do que os cérebros de mamíferos. Além disso, os peixes-zebra são relativamente translúcidos, uma propriedade que facilita os estudos ópticos da estrutura e função neural 1,2,3,4,5. Várias ferramentas optogenéticas foram desenvolvidas para uso em peixe-zebra, incluindo indicadores de cálcio de alta fidelidade6, sensores de voltagem 7,8 e marcadores dependentes de atividade neural 9,10,11,12,13. Essas ferramentas são complementares a outras vantagens possuídas por esse modelo, como a receptividade a modificações genéticas 14,15,16,17 e a prontidão com que as larvas de peixe-zebra absorvem substâncias químicas presentes nas soluções de banho 18,19,20,21.
Uma variedade de métodos é útil para a fisiologia óptica do peixe-zebra, particularmente microscopia de dois fótons, folha de luz e confocal. Cada uma dessas tecnologias deve equilibrar dois problemas relacionados de resolução: acesso óptico, incluindo dispersão de luz pelo tecido circundante, e velocidade de amostragem, especialmente para capturar a cinética do potencial de ação na escala submilissegundo22. Houve melhorias dramáticas na imagem de cálcio in vivo usando microscopia de dois fótons, mas esse método geralmente é restrito a um campo de visão de <1 mm2 e, normalmente, apenas um único plano de profundidade pode ser adquirido, limitando assim a captura de atividade em grandes regiões dos circuitos neurais22. Para a microscopia de folha de luz, o potencial de registrar a atividade de quase todos os neurônios no cérebro resolve a limitação do campo de visão da microscopia de dois fótons, mas as velocidades atuais da câmera limitam fisicamente a captura a cerca de três volumes cerebrais por segundo a 40 planos por volume cerebral nas larvas de peixe-zebra 1,23. A microscopia confocal é inferior em resolução de profundidade e velocidade de captura à microscopia de folha de luz e dois fótons. A microscopia confocal tem as vantagens de ampla acessibilidade a laboratórios em todo o mundo e a capacidade de realizar reconstruções cerebrais completas da atividade neural usando repórteres de atividade neural, como cFos e p-ERK9. Além disso, se pequenas regiões cerebrais forem direcionadas, o microscópio confocal pode fornecer resolução temporal adequada da atividade neural.
O presente artigo descreve um método que usa microscopia confocal para registrar a atividade neural em peixes-zebra transgênicos expressando GCaMP6s pan-neuronalmente. Vários protocolos semelhantes usando larvas de peixe-zebra foram desenvolvidos para entender a função das vias neurais 24,25,26,27,28,29. As principais características de vários desses protocolos, como imagens de lapso de tempo, indicadores fluorescentes da dinâmica do cálcio e imagens ao vivo, foram combinadas para medir a atividade neural em uma pequena população de neurônios no sistema nervoso central do peixe-zebra em resposta ao isotiocianato de alila (AITC), um irritante químico aversivo 11,26,27,29,30,31 . O AITC provoca uma resposta em todo o cérebro focada na área do rombencéfalo11. Um aglomerado de neurônios caudal ao rombencéfalo tem um papel na locomoção e uma resposta prolongada ao AITC. Essa resposta dura mais do que a remoção do estímulo aversivo30. Ao restringir o campo de visão, conseguimos detectar a atividade neural neste cluster neural, conforme refletido pela mudança de fluorescência nos neurônios que expressam GCaMP6s. Fornecemos técnicas, diretrizes e melhores práticas para obter resolução espaço-temporal suficiente usando microscopia confocal. Além disso, discutimos as limitações do nosso método de gravação óptica. Apesar dessas limitações, o método deve permitir a investigação de uma variedade de fenômenos neurobiológicos, incluindo memória e processamento sensório-motor.
Protocolo
Todos os procedimentos usando animais foram aprovados pelo Comitê Institucional de Uso de Cuidados com Animais da California State University, Fullerton (Protocolo # 2023-1310).
1. Estadiamento de larvas de peixe-zebra em agarose de baixo ponto de fusão
- Criar animais transgênicos adultos com expressão pan-neuronal de Tg(elav3:GCaMP6s)6 com dois machos para duas fêmeas, de acordo com as diretrizes institucionais de cuidados com animais. Os adultos são colocados em câmaras especiais de reprodução para que os ovos liberados sejam capturados em uma câmara inferior com fundo falso que não é acessível aos adultos. À primeira luz ou quando um divisor de separação é removido, as fêmeas liberam ovos e os machos fertilizam os ovos capturados no fundo falso.
- Remova os adultos e colete os ovos fertilizados usando um filtro de ovos e coloque em meio embrionário (E3) (5 mM NaCl, 0,33 mM MgSO4, 0,33 mM CaCl2, 0,17 mM KCl, 1 mM HEPES, 0,00001% azul de metileno, pH 7,0)30 com 14 h claro/10 h escuro a 28,5 °C dentro de uma incubadora
NOTA: A receita E3 usada tem uma baixa concentração de azul de metileno que não afeta a fluorescência nem leva a qualquer sinal de autofluorescência significativo. Não exigimos o uso de 1-fenil 2-tioureia (PTU) nas idades de desenvolvimento especificadas no protocolo devido à translucidez natural proporcionada pela linha transgênica GCaMP6s. - Monte os animais 2-7 dias após a fertilização (dpf) usando 3% de agarose de baixo ponto de fusão dissolvida em meio E3. Aqueça o agarose a uma temperatura na qual o peixe-zebra possa ser manipulado sem danificar o organismo. Antes que a agarose de baixo ponto de fusão esfrie e solidifique (<1 min), posicione as larvas com o lado dorsal voltado para cima em uma placa de Petri com fundo de vidro de modo que a região do cérebro a ser inspecionada fique o mais próximo possível da objetiva, conforme mostrado na Figura 1. Dependendo do experimento, normalmente, 8 a 10 peixes-zebra por grupo experimental são suficientes.
NOTA: Os animais não foram anestesiados neste protocolo. - Depois que a agarose endurecer com a larva no lugar (aproximadamente 2 a 3 min), adicione 5 mL de solução de E3. Em seguida, corte a agarose com bisturi conforme exigido pelo protocolo experimental.
NOTA: Diferentes partes do ágar devem ser cortadas, dependendo de quais partes do peixe-zebra precisam ser liberadas da restrição e / ou receber um tipo diferente de estímulo. - Mova a placa de Petri contendo o peixe-zebra para o estágio de microscópio confocal e deixe o peixe se aclimatar por 20 min.
2. Configuração e imagem sob microscopia confocal com aplicação de estímulo
- Após o período de aclimatação, centralize os peixes sob a objetiva de imersão em água de 40x (NA 1.0) à temperatura ambiente usando um campo claro com uma fonte de luz (~ 475 nm).
- As configurações de aquisição do microscópio confocal dependerão das qualidades e do nível de expressão da molécula fluorescente, da profundidade e das propriedades ópticas do tecido, do tamanho do campo de visão e da velocidade de gravação. Determine as configurações apropriadas usando o indicador de alcance para garantir a captura ideal da luz emitida de acordo com as necessidades experimentais.
- Garanta o ajuste adequado da potência do laser e do ganho mestre para capturar a luz fluorescente na faixa ideal, evitando assim a perda desnecessária do sinal de fluorescência dependente de GCaMP6s. Use a lista de principais configurações e fatores confocais fornecidos abaixo para determinar as configurações apropriadas.
- Tamanho do orifício: Determine isso pela objetiva usada e defina para aceitar um único plano focal enquanto restringe outros planos focais. Para este protocolo, é utilizado um orifício de 32 μm.
- Potência do laser e comprimento de onda: Ajuste a potência do laser com base no nível de expressão da molécula fluorescente e na profundidade e propriedades ópticas do tecido. Use o indicador de alcance para garantir que o laser não exceda o alcance do fotodetector. Defina o comprimento de onda de excitação para o comprimento de onda da luz que excita de maneira ideal a molécula fluorescente. Para este experimento, como os peixes eram heterozigotos para o transgene GCaMP6s e os níveis de expressão eram baixos, use 5% de potência do laser no comprimento de onda de 488 nm, ganho mestre de 650. Com forte expressão de transgenes, a potência do laser varia de 1,5% a 3%, o que geralmente é suficiente.
NOTA: Se a potência do laser estiver muito baixa, as informações (luz detectada pelo tubo fotomultiplicador) serão perdidas. Se a potência do laser estiver muito alta, a luz emitida pode exceder o alcance do detector ou danificar a amostra (fotoalvejante). - Ganho mestre: O ganho mestre determina a sensibilidade do fotodetector. Use o indicador de alcance para garantir que o ganho mestre não seja definido muito alto, excedendo assim o alcance do fotodetector. Para este experimento, o ganho mestre é definido como 650.
- Campo de visão: Certifique-se de que o campo de visão seja suficientemente grande para capturar o tecido de interesse. Esta é uma grande limitação para microscópios confocais geralmente porque o tamanho do campo de visão limitará a velocidade de captura, conforme mostrado na Figura 2. Para os experimentos envolvendo AITC, defina o campo de visão para 79,86 μm2.
- Velocidade de captura: À medida que a velocidade de captura é aumentada, a quantidade de luz capturada pelo fotodetector será reduzida. À medida que menos luz é capturada, a qualidade da imagem será degradada. Certifique-se de que a velocidade de captura equilibre a qualidade da imagem e a velocidade necessária para capturar o evento fisiológico de interesse. Aqui, a velocidade de captura é definida para 1,20 f/s.
- Centralize o campo de visão em um aglomerado neuronal caudal à comissura infima Halleri na porção rostral da medula espinhal30. Este cluster é muito pequeno em ~ 2,5 dpf, mas é muito maior mais tarde no desenvolvimento (7 dpf).
NOTA: Se a montagem da agarose na etapa 1 for abaixo do ideal, ou seja, o animal estiver posicionado em um ângulo ou muito profundamente na agarose, a qualidade da imagem será afetada negativamente. Uma imagem da medula espinhal do peixe-zebra em um animal bem posicionado e uma imagem contrastante da medula espinhal em um peixe-zebra subótimo são mostradas na Figura 3. - Realize uma varredura de série temporal usando um campo de visão de 79,86 μm2 a 1,20 quadros por s (fps) com uma resolução espacial de 0,119 μm2 por pixel. Ajuste o tamanho do campo de visão e a velocidade de aquisição da imagem de acordo com a aplicação desejada.
- 2 minutos após o início da imagem, adicione 41,67 μL de uma solução estoque de AITC (concentração final de 10 μM) ou solução E3 ao prato com uma pipeta. Continue gravando por ~ 30 s para observar quaisquer alterações na atividade do GCaMP6s na região de interesse com imagens de lapso de tempo. Após a conclusão da gravação, liberte o animal da agarose e sacrifina-o de acordo com as diretrizes institucionais de cuidados com os animais.
NOTA: Ao gravar a atividade do GCaMP6s, a própria luz confocal pode ser um estímulo. Isso deve ser considerado na análise dos resultados de imagem. O tempo de gravação é uma função do número de quadros e da taxa de captura de cada quadro, que pode ser ajustada conforme necessário para o tempo desejado.
3. Análise do sinal GCaMP usando FIJI
- Após a gravação, se a saída não estiver no formato de arquivo .tif para análise FIJI downstream, exporte os arquivos de imagem como arquivos .tif do pacote de software do microscópio.
- Baixe FIJI para análise de traços neurais. Abra o FIJI, importe os arquivos .czi para o programa e, quando solicitado, use as configurações padrão no plug-in BioFormats.
- Destaque uma área/neurônio de interesse usando as ferramentas Círculo ou Mão livre clicando em Seus respectivos ícones. (Passar o mouse sobre os ícones exibirá o nome da ferramenta no programa.)
NOTA: Como a área de interesse varia em tamanho, áreas/círculos fixos não são possíveis. Um software que permite o registro de alterações fluorescentes ao longo do tempo como voxels, como o pacote Thunder32, pode permitir a detecção de neurônios individuais; No entanto, para os ~ 20 neurônios no experimento atual, a detecção das bordas da membrana por um observador cego provavelmente seria superior a um sistema de detecção automatizado. - Depois que um ROI for selecionado, na barra de ferramentas FIJI, clique em Analisar Ferramentas > > Gerenciador de ROI. Depois disso, clique em Adicionar [t] e o ROI selecionado será adicionado à janela Gerenciador de ROI.
- No Gerenciador de ROI, clique em Mais > Medida Múltipla. Deixe as configurações padrão e clique em OK. A FIJI produzirá dados brutos que podem ser manipulados como um arquivo CSV usando Python ou como dados brutos em uma planilha.
- Para normalizar os dados brutos e representá-los como um traço neural para uma determinada região de interesse, calcule a média dos últimos ~ 30 s da janela de 2 minutos antes do estímulo e normalize todos os valores pós-estímulo para esse valor médio da linha de base:
Intensidade de fluorescência normalizada = (fluorescência instantânea de uma determinada região de interesse pós-estímulo)/(fluorescência média de ~30 s de um intervalo de 2 minutos pré-estímulo) - Plote os dados como traços neurais, conforme mostrado na Figura 4.
NOTA: Em alguns tipos de microscopias, como a microscopia de folha de luz, onde um volume do cérebro é registrado, os artefatos de movimento são endereçados por meio de registro espacial pós-processamento para um volume cerebral de referência 1,11. No entanto, como estamos gravando apenas de um único plano, nenhum ajuste pode ser feito para artefatos de movimento. Portanto, para os resultados mostrados aqui, nenhum quadro foi removido. No entanto, se os artefatos de movimento alterarem significativamente os resultados, os sistemas automatizados podem identificar e corrigir quadros com os artefatosde movimento 1, 11 ou um observador cego pode remover esses quadros.
Resultados
A administração de isotiocianato de alila causa um sinal neural associado ao cálcio em larvas de peixe-zebra
A administração de AITC (etapa 2.6) causa um aumento generalizado na atividade neural associada a GCaMP6s em todo o cérebro do peixe-zebra larval11,30. Observamos um aumento do sinal fluorescente em uma pequena região do cérebro após a aplicação do AITC, conforme mostrado na Figura 4.
Equilibrando a resolução dos sinais neurais associados ao cálcio, velocidade de captura e área de captura
O aumento da velocidade de captura reduz a resolução, que deve ser considerada no projeto experimental. Apresentamos uma variedade de velocidades e suas resoluções correspondentes usando embriões de peixe-zebra a ~ 2,5 dpf na Figura 5. Ao registrar a atividade neural, a velocidade de captura precisa ser suficientemente rápida para registrar a atividade. Embora as mudanças de tensão devido a um potencial de ação sejam relativamente rápidas (1-2 ms), as interações de cálcio com GCaMP prolongarão a duração do sinal do potencial de ação. GCaMP6s, a molécula usada aqui, tem uma cinética particularmente lenta. Potenciais de ação únicos usando moléculas de GCaMP podem ser detectados e correlacionados em cultura de células6, mas não está claro se essa precisão de detecção de sinal poderia ocorrer in vivo com larvas de peixe-zebra. No entanto, quanto maior a velocidade de captura, maior a probabilidade de que as informações temporais relacionadas à atividade neural sejam capturadas, supondo que a detecção do sinal não seja significativamente reduzida pelas velocidades de captura mais altas. Além disso, o tamanho do campo de observação também influenciará as velocidades de captura com um microscópio confocal padrão. Ao reduzir o campo de visão, aumenta-se a velocidade de captura, mas perde-se informações sobre a atividade neural em outras áreas do cérebro. Para capturar sinais GCaMP6, as aplicações que usam microscopia confocal devem ser limitadas a uma pequena área cerebral (50-150 μm2). A velocidade de captura deve ser mais rápida do que o sinal que está sendo observado para reduzir o aliasing. No entanto, as velocidades de captura da microscopia confocal resultarão inevitavelmente na perda de algumas informações na forma de luz emitida. Esses custos e benefícios relativos devem sempre ser considerados para abordar a questão experimental desejada de forma eficaz.

Figura 1: Representação da posição de uma larva de peixe-zebra parcialmente contida para imagens. A larva é incorporada em uma agarose de baixo ponto de fusão e posicionada com o lado dorsal para cima. As porções rostral e caudal da agarose foram removidas para permitir que a pele do peixe-zebra fosse exposta ao AITC. Clique aqui para ver uma versão maior desta figura.
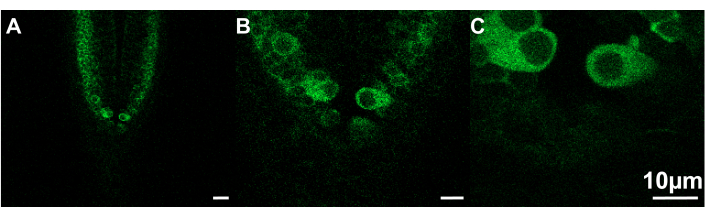
Figura 2: Exemplos de imagens de diferentes tamanhos que podem ser visualizadas em diferentes velocidades de captura. (A) Tamanho do quadro = 319,45 x 319,45 μm; Velocidade de captura = 30 fps. (B) Tamanho do quadro = 106,48 x 106,48 μm; Velocidade de captura = 7,67 fps. (C) Tamanho do quadro = 53,24 x 53,24 μm; Velocidade de captura = 9,80 fps. Peixe-zebra, ~ 2,5 dpf; barra de escala de 10 μm. Clique aqui para ver uma versão maior desta figura.
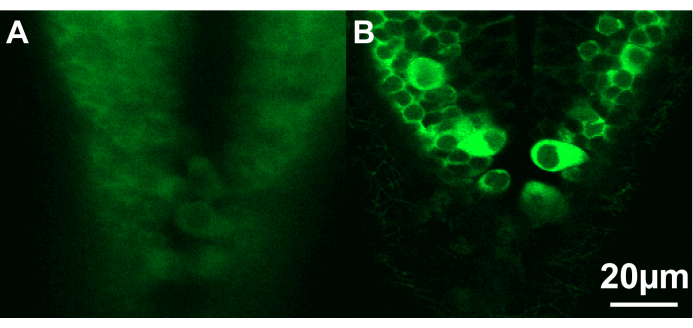
Figura 3: Imagens confocais da porção caudal do rombencéfalo de duas larvas de peixe-zebra. (A) A larva (~ 2,5 dpf) está posicionada em um ângulo não ideal e muito profundamente na agarose, impedindo imagens nítidas dos neurônios. (B) Aqui, a larva (~ 2,5 dpf) está posicionada corretamente perto da superfície da agarose. Barra de escala de 20 μm. Clique aqui para ver uma versão ampliada desta figura.
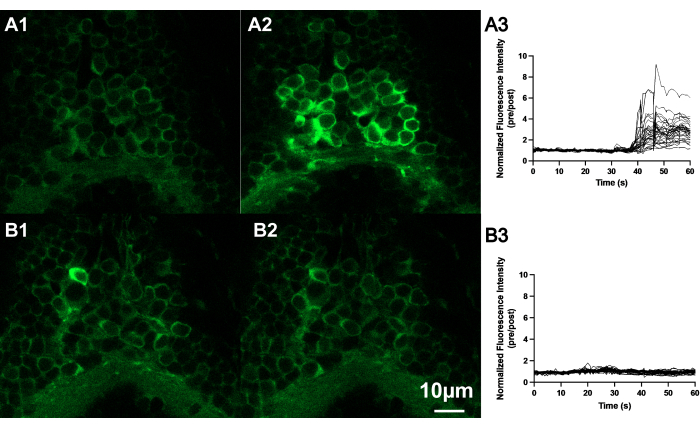
Figura 4: AITC aumenta a intensidade de fluorescência dos neurônios localizados na borda do rombencéfalo e da medula espinhal do cérebro do peixe-zebra. (A) Imagens confocais representativas de neurônios de peixe-zebra (7 dpf) quando expostos a AITC ou E3. Imagens de neurônios antes (A1) e depois (A2) da aplicação de AITC em comparação com (B) imagens de neurônios antes (B1) e depois (B2) da aplicação da solução controle (E3). Barra de escala 10 μM. Traços do estado fluorescente normalizado de vários neurônios localizados no rombencéfalo de peixes-zebra embrionários expostos a AITC (A3) ou E3 (B3). Observe que os neurônios exibiram aumento da fluorescência após a aplicação do AITC no banho, enquanto o aumento da fluorescência não foi observado nos neurônios após a aplicação do E3. Clique aqui para ver uma versão maior desta figura.

Figura 5: A velocidade de captura de GCaMP6s determina a quantidade de luz capturada e a resolução resultante da imagem. (A) Imagens de neurônios capturados a cada 10,13 s (0,10 fps) fornecem uma resolução relativamente alta de neurônios no rombencéfalo e na medula espinhal. Com um aumento na velocidade de captura, as informações temporais são obtidas, mas a resolução espacial é perdida: (B) velocidade de captura = 0,79 fps, (C) velocidade de captura = 3,16 fps e (D) velocidade de captura = 7,67 fps. Peixe-zebra, 2 dpf; barra de escala de 20 μm. Clique aqui para ver uma versão maior desta figura.
Discussão
Mostramos que a atividade neural pode ser registrada no cérebro de larvas de peixe-zebra usando GCaMP6s junto com microscopia confocal; as velocidades de captura mais baixas necessárias devido à cinética mais lenta dos GCaMPs podem ser compensadas pela redução da área cerebral observada6. Repórteres com dinâmica temporal mais rápida (ou seja, GCaMP6f) estão disponíveis, mas a resolução temporal superior geralmente vem ao custo de sinal de fluorescência reduzido6. O microscópio confocal é limitado a velocidades de registro relativamente mais lentas22, portanto, as moléculas repórteres devem ser selecionadas levando em consideração as limitações temporais da microscopia confocal.
O protocolo é limitado por duas características principais: 1) a exigência de que o animal seja colocado em agarose durante a gravação e 2) a velocidade de captura relativamente lenta da microscopia confocal. Equilibrar o campo de visão e as velocidades de captura é fundamental para capturar a atividade neural com resolução suficiente para uma determinada aplicação. Se a atividade induzida pelo AITC for truncada ou diminuída, isso pode indicar que o peixe-zebra larval pode não ser capaz de detectar o estímulo ou que o AITC pode ser insuficientemente potente. Neste último caso, refrescar o caldo e mantê-lo congelado a -20 °C aumentará sua eficácia. Se o peixe não conseguir detectar o estímulo, o animal pode ter sido implantado muito profundamente no ágar. Uma etapa crítica é o posicionamento de um peixe durante a Etapa 1 do protocolo, pois isso é crucial para o acesso óptico ideal durante a aplicação do medicamento.
Devido às velocidades de varredura relativamente lentas da microscopia confocal, as gravações de todo o cérebro não são tecnicamente possíveis. Significativamente, o protocolo descrito aqui pode ser usado para medir pequenas áreas cerebrais após a identificação com técnicas complementares. Em particular, usando técnicas que alavancam moléculas que marcam a atividade neural com repórteres dependentes da atividade 9,11, o experimentador pode direcionar as principais áreas cerebrais de interesse para a aplicação dos métodos descritos neste artigo. As áreas de interesse do cérebro podem então ser referenciadas ao atlas cerebral do peixe-zebra anotado, z brain atlas11.
Com pequenos ajustes, as técnicas e diretrizes discutidas aqui podem ser empregadas para investigar uma série de funções cerebrais, incluindo processamento sensório-motor, aprendizado e memória, sensação e percepção.
Divulgações
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Agradecimentos
Este trabalho foi apoiado por uma bolsa para o ACR do National Institutes of Health (SC2GM1304854) e uma bolsa para o DLG da National Science Foundation (2050850).
Materiais
| Name | Company | Catalog Number | Comments |
| Low Melting Point Agarose | Invitrogen | 16520-100 | Diluted to 3% |
| Allyl Isothiocyanate (AITC) | Sigma Aldrich | 377430 | Chemical stimulant |
| E3 | N/A | N/A | Water-medium for zebrafish larvae |
| Glass Bottom Dishes | Thermo Fisher Scientific | 12-567-400 | Used to hold zebrafish during imaging experiments |
| Micropipette (10-100 uL) | Cole-Parmer | 21600-14 | Apparatus used for creating AITC dilutions |
| Microscope Slides | Fisherbrand | 12-550-A3 | Used to screen for phenotype |
| Mirror Finish Forceps | DUMONT | 11251-23 | Used to orient zebrafish in agarose |
| myTEMP Mini Digital Incubators | Benchmark | H2200-HC | Holding area for zebrafish; set to 28.5°C |
| Nitrile Gloves | MedPRIDE | MPR-50504 | Basic PPE |
| Petri Dishes | VWR | 89107-632 | Container for zebrafish |
| Posi-Click Tubes | DENVILLE | C-2171 | Used for AITC dilution |
| Samco Polyurethane Transfer Pipettes | Thermo Fisher Scientific | 225 | Apparatus used to select animal/administer diluted bolus of AITC |
| Stemi SV11 Apo Microscope | Zeiss | 1.25496E+11 | Used to stage zebrafish |
| Transgenic Larval Zebrafish (2 to 7 DPF) | N/A | N/A | Animal test subjects; Tg(elav3:GCaMP6s) strain |
| Zeiss Confocal Microscope (Model LSM9) | Zeiss | 3523004097 | Imaging of fish |
Referências
- Ahrens, M. B., Orger, M. B., Robson, D. N., Li, J. M., Keller, P. J. Whole-brain functional imaging at cellular resolution using light-sheet microscopy. Nat Method. 10 (5), 413-420 (2013).
- Meyer, M. P., Smith, S. J. Evidence from in vivo imaging that synaptogenesis guides the growth and branching of axonal arbors by two distinct mechanisms. J Neurosci. 26 (13), 3604-3614 (2006).
- Sagasti, A., Guido, M. R., Raible, D. W., Schier, A. F. Repulsive interactions shape the morphologies and functional arrangement of zebrafish peripheral sensory arbors. Curr Biol. 15 (9), 804-814 (2005).
- Son, J. H., et al. Transgenic FingRs for live mapping of synaptic dynamics in genetically-defined neurons. Sci Rep. 6, 18734 (2016).
- Zada, D., Tovin, A., Lerer-Goldshtein, T., Vatine, G. D., Appelbaum, L. Altered behavioral performance and live imaging of circuit-specific neural deficiencies in a zebrafish model for psychomotor retardation. PLoS Genet. 10 (9), e1004615 (2014).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Abdelfattah, A. S., et al. and photostable chemigenetic indicators for extended in vivo voltage imaging. Science. 365 (6454), 699-704 (2019).
- Abdelfattah, A. S., et al. Sensitivity optimization of a rhodopsin-based fluorescent voltage indicator. Neuron. 111 (10), 1547-1563.e9 (2023).
- Gao, Y. J., Ji, R. R. c-Fos and pERK, which is a better marker for neuronal activation and central sensitization after noxious stimulation and tissue injury. Open Pain J. 2, 11-17 (2009).
- Kawashima, T., Okuno, H., Bito, H. A new era for functional labeling of neurons: activity-dependent promoters have come of age. Front Neural Circuits. 8, 37 (2014).
- Randlett, O., et al. Whole-brain activity mapping onto a zebrafish brain atlas. Nat Methods. 12, 1039-1046 (2015).
- Reijmers, L. G., Perkins, B. L., Matsuo, N., Mayford, M. Localization of a stable neural correlate of associative memory. Science. 317 (5842), 1230-1233 (2007).
- Mohr, M. A., Argast, P., Pantazis, P. Labeling cellular structures in vivo using confined primed conversion of photoconvertible fluorescent proteins. Nature Protoc. 11 (12), 2419-2431 (2016).
- Arrenberg, A. B., Del Bene, F., Baier, H. Optical control of zebrafish behavior with halorhodopsin. Proc Natl Acad Sci U S A. 106 (42), 17968-17973 (2009).
- Wyart, C., Del Bene, F. Let there be light: zebrafish neurobiology and the optogenetic revolution. Rev Neurosci. 22 (1), 121-130 (2011).
- Douglass, A. D., Kraves, S., Deisseroth, K., Schier, A. F., Engert, F. Escape behavior elicited by single, channelrhodopsin-2-evoked spikes in zebrafish somatosensory neurons. Curr Biol. 18 (15), 1133-1137 (2008).
- Portugues, R., Severi, K. E., Wyart, C., Ahrens, M. B. Optogenetics in a transparent animal: circuit function in the larval zebrafish. Curr Opinion Neurobiol. 23 (1), 119-126 (2013).
- Best, J. D., Alderton, W. K. Zebrafish: An in vivo. model for the study of neurological diseases. Neuropsychiat Dis Treatment. 4 (3), 567-576 (2008).
- Goldsmith, P. Zebrafish as a pharmacological tool: the how, why and when. Curr Opinion Pharmacol. 4 (5), 504-512 (2004).
- Roberts, A. C., et al. Habituation of the C-start response in larval zebrafish exhibits several distinct phases and sensitivity to NMDA receptor blockade. PloS One. 6 (12), e29132 (2011).
- Wolman, M. A., Jain, R. A., Liss, L., Granato, M. Chemical modulation of memory formation in larval zebrafish. Proc Natl Acad Sci U S A. 108 (37), 15468-15473 (2011).
- Ji, N., Freeman, J., Smith, S. L. Technologies for imaging neural activity in large volumes. Nat Neurosci. 19 (9), 1154-1164 (2016).
- Panier, T., et al. Fast functional imaging of multiple brain regions in intact zebrafish larvae using selective plane illumination microscopy. Front Neural Circuits. 7, 65 (2013).
- Distel, M., Köster, R. W. In vivo time-lapse imaging of zebrafish embryonic development. CSH Protoc. 2007, (2007).
- Liu, T. T., Hou, H., Du, J. L. A protocol for simultaneous Ca2+ and morphology imaging of brain endothelial tip cells in larval zebrafish. STAR Protoc. 2 (1), 100388 (2021).
- Wong, H. C., Drerup, C. M. Using fluorescent indicators for in vivo quantification of spontaneous or evoked motor neuron presynaptic activity in transgenic zebrafish. STAR Protoc. 3 (4), 101766 (2022).
- Graeden, E., Sive, H. Live imaging of the zebrafish embryonic brain by confocal microscopy. J Vis Exp. (26), e1217 (2009).
- Hirsinger, E., Steventon, B. A versatile mounting method for long term imaging of zebrafish development. J Vis Exp. (119), e55210 (2017).
- Renaud, O., Herbomel, P., Kissa, K. Studying cell behavior in whole zebrafish embryos by confocal live imaging: application to hematopoietic stem cells. Nat Protoc. 6 (12), 1897-1904 (2011).
- Roberts, A. C., et al. Induction of short-term sensitization by an aversive chemical stimulus in zebrafish larvae. eNeuro. 7 (6), (2020).
- Prober, D. A., et al. Zebrafish TRPA1 channels are required for chemosensation but not for thermosensation or mechanosensory hair cell function. J Neurosci. 28 (40), 10102-10110 (2008).
- Freeman, J., et al. Mapping brain activity at scale with cluster computing. Nat Methods. 11, 941-950 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados