Method Article
Kardiyojenik Şok için Veno-Arteriyel Ekstrakorporeal Membran Oksijenasyonu
Bu Makalede
Özet
Aşağıdaki makale, kardiyojenik şoklu hastalarda veno-arteriyel ekstrakorporeal membran oksijenasyonunun başlatılması ve sürdürülmesinde yer alan çeşitli adımları vurgulamaktadır.
Özet
Kardiyojenik şok (CS), düşük kardiyak debi durumunda yetersiz doku perfüzyonu ile karakterize klinik bir durumdur. CS, akut miyokard enfarktüsünden () sonra önde gelen ölüm nedenidir. CS'de hemodinamik destek için klinik iyileşme gerçekleşene veya daha kesin cerrahi prosedürler uygulanana kadar çeşitli geçici mekanik destek cihazları mevcuttur. Veno-arteriyel (VA) ekstrakorporeal membran oksijenasyonu (ECMO), refrakter CS'de kısa süreli dolaşım desteği için güçlü bir tedavi seçeneği olarak gelişmiştir. Randomize klinik çalışmaların yokluğunda, ECMO'nun kullanımı klinik deneyimlerle yönlendirilmiştir ve kayıtlardan ve gözlemsel çalışmalardan elde edilen verilere dayanmaktadır. VA-ECMO kullanımı ile hastaneden taburcu olana kadar sağkalım% 28-67 arasında değişmektedir. ECMO'nun başlatılması, perkütan veya cerrahi kesme ile gerçekleştirilebilen venöz ve arteriyel kanülasyon gerektirir. Bir ECMO devresinin bileşenleri, venöz sistemden kan çeken bir giriş kanülü, bir pompa, bir oksijenatör ve kanı arteriyel sisteme geri döndüren bir çıkış kanülü içerir. ECMO başlatıldıktan sonra yönetimde dikkat edilmesi gereken hususlar arasında trombozu önlemek için sistemik antikoagülasyon, miyokardiyal iyileşmeyi artırmak için sol ventrikül boşaltma stratejileri, femoral arteriyel kanülasyon vakalarında distal perfüzyon kateteri ile ekstremite iskemisinin önlenmesi ve hemoliz, hava embolisi ve Harlequin sendromu gibi diğer komplikasyonların önlenmesi yer alır. ECMO, kontrolsüz kanaması, onarılmamış aort diseksiyonu, şiddetli aort yetmezliği olan hastalarda ve ciddi nörolojik yaralanma veya metastatik maligniteler gibi boşuna durumlarda kontrendikedir. ECMO için hastalar düşünülürken multidisipliner bir şok ekibi yaklaşımı önerilmektedir. Devam eden çalışmalar, revaskülarizasyon geçiren CS'li hastalarında rutin ECMO ilavesinin sağkalımı iyileştirip iyileştirmediğini değerlendirecektir.
Giriş
Kardiyojenik şok (CS), düşük kardiyak debi durumunda yetersiz doku perfüzyonu ile karakterize klinik bir durumdur. Reperfüzyon tedavisindeki gelişmelere rağmen, akut miyokard infarktüsü (AMİ) CS'nin önde gelen nedeni olmaya devam etmektedir. Amerika Birleşik Devletleri'ndeki tüm hastaneye yatışların yaklaşık %20'sinden veri toplayan Ulusal Yatan Hasta Örneği (NIS) veritabanının analizine göre, 2005 ve 2014 yılları arasındaki 144.254 CS vakasının %55,4'ü1'e ikincildir. CS'nin diğer etiyolojileri arasında dekompanse kalp yetmezliği, fulminan miyokardit, kardiyotomi sonrası şok ve pulmoner emboli (PE) bulunur. CS, %45-65 arasında değişen yüksek hastane içi mortalite oranı ile ilişkilidir1,2. Bu nedenle, CS'nin hızlı bir şekilde tanımlanması ve geri dönüşümlü nedenlerin düzeltilmesi hasta sağkalımının iyileştirilmesinde kritik öneme sahiptir. Örneğin, Kardiyojenik Şok için Tıkalı Koronerleri Acil Olarak Revaskülarize Etmeli miyiz (SHOCK) çalışması, erken revaskülarizasyon stratejisinin,'yi komplike hale getiren CS'li hastalarda ilk tıbbi stabilizasyon stratejisine kıyasla 6 ay3 ve 1 yıl4'te daha iyi sağkalım ile ilişkili olduğunu göstermiştir.
Vazopresörler ve inotroplar, CS ile ilişkili hipotansiyonu düzeltmek için kullanılabilir, ancak hiçbirinin mortalite yararı olduğu gösterilmemiştir 5,6,7. Kısa süreli mekanik dolaşım desteği (MCS) cihazları ise refrakter CS'li hastalarda iyileşmeye köprü olarak veya daha kesin tedaviye köprü olarak hemodinamik destek sağlayabilir. MCS'nin kullanımı son on yılda bir artış gördü; bununla birlikte, CS hastaneye yatışlarının insidansı, MCS8'in kullanımını geride bırakmıştır. İntra-aortik balon pompalarının (IABP) kullanımındaki düşüş eğilimi, intravasküler mikroaksiyel sol ventrikül destek cihazlarının (LVAD) (örneğin, Impella ve TandemHeart) ve veno-arteriyel ekstrakorporeal membran oksijenasyonunun (VA-ECMO) uygulanmasında göreceli bir artışla karşılanmıştır.
VA-ECMO, 4-6 L/dk'ya kadar akış üretebilir ve CS'deki uygulaması önemli bir popülerlik kazanmıştır9. Ekstrakorporeal Yaşam Destek Organizasyonu (ELSO) tarafından tutulan küresel bir kayıt defterine göre, VA-ECMO kullanımı 2010'dan önce yılda 500'den az iken 2015'te 2.157 koşuya yükseldi10. Bununla birlikte, VA-ECMO kaynak yoğun bir yöntemdir ve özel ekipman ve eğitimli personelin günün her saati kullanılabilirliğini gerektirir. Bu nedenle, sonuçları iyileştirmek ve advers olayları en aza indirmek için ECMO'nun başlatılması ve sürdürülmesinden önce hasta seçimi kritik öneme sahiptir. Bu makale, VA-ECMO'nun başlatılmasında yer alan adımları, başlatma sonrası bakımı, kullanımının arkasındaki kanıtları ve ilişkili komplikasyonları tartışmaktadır.
Bir ECMO devresi, bir giriş kanülü, santrifüj pompa, oksijenatör ve çıkış kanülünden oluşur (Şekil 1)11. Giriş kanülü, boru aracılığıyla , dönen bir rotorun akış ve basınç ürettiği bir santrifüj pompaya bağlanır. Pompadan kan, gaz değişiminin gerçekleştiği bir membran oksijenatörüne akar12. Burada hemoglobin oksijenle doyurulur ve akış hızı değiştirilerek ve oksijenatöre verilen solunan oksijen (FiO2) fraksiyonu artırılarak veya azaltılarak oksijenasyon derecesi kontrol edilir. Karbondioksitin uzaklaştırılması, oksijenatörden geçen karşı akım gazının süpürme hızı ayarlanarak kontrol edilir. Oksijenatöre genellikle bir ısı eşanjörü takılır ve böylece vücuda geri dönen kanın sıcaklığı ayarlanabilir. Oksijenatörden kan, femoral arterde periferik olarak veya aortta merkezi olarak bir çıkış kanülü aracılığıyla hastaya geri verilir.
Protokol
Bu protokol, Nebraska Üniversitesi Tıp Merkezi'ndeki kurumsal insan araştırmaları etik komitesinin yönergelerini takip eder.
1. Hasta seçimi
- Refrakter CS'li hastalarda VA-ECMO'yu, ilk hakaretin ardından miyokard fonksiyonunun iyileşmesi beklendiğinde iyileşmeye bir köprü olarak, karar vermeye bir köprü olarak veya miyokard disfonksiyonunun geri dönüşümsüz olduğu durumlarda kalıcı LVAD veya kardiyak transplantasyon gibi daha kesin bir tedaviye bir köprü olarak düşünün.
NOT: Çeşitli endikasyonlar arasında AMİ'ye sekonder CS, son dönem kalp yetmezliği, fulminan miyokardit ve masif PE 13,14,15,16,17'ye bağlı kor pulmonale bulunur. Artan bir başka kullanım alanı, refrakter post kardiyotomi CS18 geliştiren kalp cerrahisi geçiren hastalardır. - Ekstrakorporeal kardiyopulmoner resüsitasyonun (ECPR) bir parçası olarak kardiyopulmoner destek için refrakter ventriküler fibrilasyon / ventriküler taşikardiye sekonder hastane dışı kardiyak arresti olan seçilmiş hastalarda VA-ECMO'yu kullanın.
NOT: Sınırlı kanıtlar, ECPR'nin daha iyi sağkalım ile ilişkili olduğunu ve şimdi CPR19,20 kılavuzlarına dahil edildiğini göstermektedir. - İleri malignite, beyin hasarı, aort diseksiyonu gibi sağkalımı sınırlayan ciddi geri dönüşü olmayan son organ yetmezliği içeren senaryolarda ve hastanın bakım hedefleri MCS21 kullanımıyla uyumlu olmadığında VA-ECMO'yu kullanmaktan kaçının.
NOT: Bazı göreceli kontrendikasyonlar arasında kanülasyonu engelleyen periferik vasküler hastalık, kontrolsüz kanama veya antikoagülan kullanımına kontrendikasyon bulunur. Yaşlılık (>70 yıl) mutlak bir kontrendikasyon değildir; Bununla birlikte, bu popülasyon tarihsel olarak genç yetişkinlere kıyasla hastanede sağkalımın zayıf olduğunu göstermiştir22.
2. VA-ECMO'nun kanülasyonu ve başlatılması
- VA-ECMO23'te CS hastalarını başlatmadan önce ileri kalp yetmezliği uzmanları, girişimsel kardiyologlar, kardiyo-göğüs cerrahları ve yoğun bakım uzmanlarından oluşan disiplinler arası bir ekip tabanlı tartışmayı kolaylaştırın.
- Kanülasyonu kardiyak kateterizasyon laboratuvarında, acil serviste veya yoğun bakım ünitesinde perkütan yaklaşım (periferik kanülasyon) için veya cerrahi yaklaşım (merkezi kanülasyon) için ameliyathanede gerçekleştirin24.
- Perkütan yaklaşım için, erişim bölgelerini klorheksidin gibi antiseptik bir solüsyon kullanarak temizleyin ve hazırlayın.
- Ultrason rehberliğinde, bir iğne ile modifiye edilmiş bir Seldinger tekniği kullanarak femoral venöz erişim elde edin ve 5 Fr mikro kılıf25 yerleştirin.
- Esnek bir J uçlu kılavuz teli (0.038 inç x 180 cm) femoral venden inferior vena kavaya (IVC) ilerletin ve sağ atriyuma yönlendirin.
- Kanül pasajını seri olarak genişletmek için sıralı dilatatörler kullanarak venöz erişim bölgesini genişletin, bir dilatör (2 Fr boyutunda) artırın. Ardından uygun boyutta bir venöz kanül (tek lümen) yerleştirin.
NOT: Kanülün boyutu, ultrasondaki damarın yaşına, cinsiyetine ve çapına ve ayrıca istenen akışlara göre belirlenir. Venöz kanül 21 Fr ila 25 Fr boyutlarında mevcuttur ve çoğu yetişkin için genellikle 25 Fr kanül yeterli olacaktır. - Venöz kanülün ucunun, IVC'nin intrahepatik kısmı ile sağ atriyumun birleştiği yerde olduğunu floroskopi veya düz röntgen ile doğrulayın.
- Modifiye Seldinger tekniğini kullanarak benzer şekilde, genellikle kontralateral femoral arterde arteriyel erişim sağlayın ve ardından bir mikro kılıf (5 Fr) yerleştirin.
- Esnek bir J uçlu kılavuz teli (0.038 inç X 180 cm) veya sert bir kılavuz teli ortak femoral artere ve ardından aort içine ilerletin.
- Deri ve deri altı dokusunun dilatatörlerle ilerleyici dilatasyonundan sonra uygun boyutta (15-21 Fr) bir arteriyel kanül yerleştirin.
NOT: Kanül boyutu, >2.4 L / dak/ m2'lik bir kardiyak indeks sağlayacak şekilde seçilmiştir. 19 Fr arteriyel kanül çoğu yetişkin için yeterli desteği sağlayacaktır; Bununla birlikte, daha küçük dişiler için daha küçük boyutlu bir kanül kullanılmalıdır. - Bir mikro delme iğnesi kullanarak modifiye Seldinger tekniği ile ipsilateral yüzeysel femoral artere antegrad perfüzyon için bir distal perfüzyon kateteri (DPC) yerleştirin. 5 Fr'lik bir DPC'yi tanıtın ve 6-7" uzatma borusu26 kullanarak arteriyel kanülün yan portuna takın.
NOT: Giderek daha büyük boyutlu arteriyel kanüller, özellikle altta yatan periferik vasküler hastalığı olan hastalarda, ipsilateral ekstremitede iskemik komplikasyon riskini artırır. - Hem venöz hem de arteriyel kanülleri, emilmeyen 2.0 ipek dikişlerle cilde dikerek yerinde sabitleyin.
NOT: Merkezi kanülasyon rutin olarak ameliyathanede yapılır ve tipik olarak sternotomi gerektirir. - Torakotomi sonrası sağ atriyum ve aortun direkt kanülasyonunu gerçekleştirin. Bunları çanta ipi 4.0 prolene sütürler, snuggers ve tıkaçlar kullanarak yerine sabitleyin.
- Ardından, birden fazla dikiş kullanarak kanülleri boşluğun içinden göğüs duvarına sabitleyin.
- Göğsü tıkayıcı bir pansumanla açık bırakın veya sonunda kapalı bırakın. Göğüs kapalıyken kanülleri deriden tünelleyin.
- Kanülleri (arteriyel ve venöz) ECMO devresine bağlayın ve solunum ve hemodinamik parametreler elde edilene kadar kan akışını artırın.
3. Başlatma sonrası yönetim
- Hasta izleme
- Sol ventrikül doldurma basınçları için bir vekil olarak pulmoner arter basıncının ve pulmoner kapiller kama basıncının periyodik ölçümleri ile klinik karar vermeye yardımcı olmak için 7.5 Fr'lik bir pulmoner arter kateteri yerleştirin.
NOT: VA-ECMO, sağ atriyumdan venöz kanı boşaltarak ve oksijenli kanı iliak arterlere/inen aorta geri döndürerek sağdan sola bir şant oluşturduğundan, bu, pulmoner ödem geliştirme riski taşıyan hastaların belirlenmesine yardımcı olur. Ön yük azalırken, VA-ECMO ile art yükteki bir artış, zaten altta yatan bir LV disfonksiyonu olan CS'li hastalarda pulmoner ödem riskini artırabilir. - Arteriyel çizgileri, kılavuz tel27 yardımıyla mikroponktur tekniğini kullanarak sağ radyal veya sol radyal arterlere yerleştirin.
NOT: Bu, havzanın yerini belirlemeye yardımcı olur (aort arkında, sol ventrikülden gelen antegrad akışın arteriyel kanülden gelen retrograd akışla buluştuğu alan)28. - Üst vücut (serebral ve sağ üst ekstremite) oksijenasyonunu değerlendirmek için sağ radyal arter bölgesinden oksijen satürasyonlarını izleyin. Yeterli oksijenasyonu sağlamak için her 8-12 saatte bir arteriyel kan gazı analizi yapın29.
- 2-60 mmHg PaO 100'yi korumak için oksijenatördeki FiO2'yi ayarlayın (düğmeyi yukarı çevirin).
NOT: FiO2 genellikle VA-ECMO'nun başlangıcında %100'e ayarlanır ve daha sonra oksijenasyon iyileştikçe titre edilir. - Herhangi bir solunum asidozunu düzeltmek için süpürme hızını 3-7 L/dk arasında ayarlayarak ventilasyonu ve dolayısıyla karbondioksit giderimini optimize edin.
- Venöz gaz analizi ile laktat, SvO2, transaminazlar ve kreatinin klerensi gibi son organ perfüzyonu belirteçlerini seri olarak izleyin30,31.
NOT: Hedef SvO2 %>70 olmalı ve laktat 2,2 mmol/L'den az olmalıdır.
- Sol ventrikül doldurma basınçları için bir vekil olarak pulmoner arter basıncının ve pulmoner kapiller kama basıncının periyodik ölçümleri ile klinik karar vermeye yardımcı olmak için 7.5 Fr'lik bir pulmoner arter kateteri yerleştirin.
- Venöz gevezeliğin akışını ve yönetimini ayarlama
- Yeterli uç organ perfüzyonuna izin vermek için devreden geçen akışı ayarlayın (hedef akış 60 cc / kg / dak). Pompanın hızını ayarlayarak akışı değiştirin. Kanülasyondan sonra başlangıçta 4-6 L / dk'lık bir akış sağlayın.
NOT: Pompanın daha yüksek hızları, hipovolemi ve yanlış konumlandırılmış venöz kanül, venöz kanülün32 emilmesi veya "tıkırdaması" olarak ortaya çıkan venöz gevezeliğe neden olabilir. Venöz gevezelik, pompadaki rotor dönmeye ve pompadaki kanı boşaltmaya devam ettikçe, pompa kafasında bir vakuma neden olarak hemolize yol açabilir. - Hipovolemi vakalarında sıvı resüsitasyonu ile venöz gevezeliği düzeltin. Yanlış konumlandırma veya bükülme durumunda venöz kanülü yeniden konumlandırın. Yüksek hız33,34 durumunda pompanın hızını azaltın.
- Giriş kanülüne bir venöz rezervuar veya katlanabilir bir mesane takarak venöz gevezeliği en aza indirin. Bu, pompaya hacim sağlayarak giriş kanülünün emişini azaltmaya izin verir.
- Yeterli uç organ perfüzyonuna izin vermek için devreden geçen akışı ayarlayın (hedef akış 60 cc / kg / dak). Pompanın hızını ayarlayarak akışı değiştirin. Kanülasyondan sonra başlangıçta 4-6 L / dk'lık bir akış sağlayın.
- Sol ventrikül boşaltma
NOT: Retrograd VA-ECMO akışından kaynaklanan art yükteki bir artış, daha yüksek bir LV diyastol sonu basıncına (LVEDP) yol açabilir ve böylece pulmoner ödemi kötüleştirebilir ve ciddi LV durması vakaları, durgun kandan trombüs oluşumuna yol açabilir35.- LV'yi boşaltmak ve art yükü azaltmak için dobutamin (1-2 μg/kg/dk başlangıç dozu) gibi inotroplar veya hidralazin veya nitratlar 36,37,38 gibi vazodilatörler kullanın.
NOT: Ancak bunlar genellikle yetersiz kalır ve AG'nin mekanik olarak boşaltılması gerekebilir. - LV'nin doğrudan boşaltılmasını gerçekleştirmek için bir ventriküler destek cihazı (örn., Impella) veya intra-aortik balon pompası (IABP) perkütan olarak yerleştirin. LV'nin dolaylı olarak boşaltılmasını gerçekleştirmek için, perkütan olarak bir pulmoner arter kanülü yerleştirin veya balon septostomi yapın.
NOT: Transseptal sol atriyal drenaj veya LV apeksin doğrudan kanülasyonu dahil olmak üzere cerrahi teknikler de LV boşaltmaiçin kullanılabilir 39.
- LV'yi boşaltmak ve art yükü azaltmak için dobutamin (1-2 μg/kg/dk başlangıç dozu) gibi inotroplar veya hidralazin veya nitratlar 36,37,38 gibi vazodilatörler kullanın.
- Antikoagülasyon
- Kanülasyon sırasında sistemik antikoagülasyonu başlatın. 50-100 IU / kg IV heparin (önerilir) bolusu ve ardından aşağıdaki gibi sürekli heparin kullanın.
- Laboratuvar kontrolleri sırasında (her 4-6 saatte bir) normalin üst sınırının en az 1,5 katı aktif parsiyel tromboplastin zamanını veya aktif pıhtılaşma süresini korumak için fraksiyone olmayan heparine devam edin.
- Heparin kaynaklı trombositopeni hastalarında, terapötik seviyelere ulaşmak için bivalirudin (başlangıç dozu 0.025-0.05 mg / kg / saat)40 veya argatroban (başlangıç dozu 0.05-2 μg / kg / dak)41 gibi doğrudan trombin inhibitörleri kullanın.
4. Komplikasyonların önlenmesi ve yönetimi
- Harlequin (Kuzey-Güney) sendromu
NOT: Üst gövdenin diferansiyel siyanozu, eşlik eden solunum yetmezliği durumunda havza (çıkış kanülünden oksijenli kan içeren retrograd akımın LV'den gelen antegrad kanla buluştuğu alan) aort ark dal damarlarının orijinine distal olduğunda ortaya çıkabilir. LV'den gelen oksijensiz kan, karotis ve subklavyen arterler yoluyla üst gövdeyi beslerken, alt vücut VA-ECMO'nun çıkış kanülünden gelen kan tarafından sağlanır. Bu fenomene Harlequin sendromu veya Kuzey-Güney sendromu denir (üst vücut mavidir ve alt vücut pembedir).- Bu diferansiyel siyanozu, hasta mekanik ventilasyonda ise FiO2'yi veya pozitif ekspirasyon sonu basıncını artırarak veya oksijenli kanı sağ atriyuma geri döndürerek, tipik olarak ECMO devresinin arteriyel ekstremitesine bağlı iç juguler ven (V-A-V ECMO) içine sokulan başka bir kanül yoluyla LV'ye dönen kanın oksijen satürasyonunu artırarak yönetin.
- Sağ radial arterden arteriyel gaz analizi (ABG) ile her 8-12 saatte bir üst vücut oksijenasyon satürasyonunu izleyin. ABG42 üzerinde 60-100 mmHg PaO2 ile yeterli doku oksijenasyonu sağlanır.
- Alt ekstremite iskemisi
NOT: Periferik arteriyel kanülasyonun en ciddi komplikasyonlarından biri, alt ekstremitede nadiren kompartman sendromuna yol açan ve aşırı durumlarda amputasyon gerektirebilen antegrad iskemidir43. Ekstremite iskemisi insidansı, farklı çalışmalarda bildirildiği gibi% 10 ila% 70 arasında değişmekle birlikte değişkendir44.- Ultrasondaki femoral arterlerin çapına göre uygun boyutta bir kanül seçin, böylece alt ekstremite iskemik komplikasyonlarını potansiyel olarak azaltın.
- Seri nabız doppler veya yakın kızılötesi spektroskopi (NIRS) kullanarak kanülasyonu takiben alt ekstremite dolaşımını izleyin44. NIRS, doku oksijeniyonuna erişmek için invaziv olmayan bir görüntüleme aracıdır45.
- NIRS kullanarak alt ekstremite dokusu oksijenasyonunun sürekli değerlendirmesini yapın. Perfüzyonun bir göstergesi olan doku oksijenasyonundaki herhangi bir değişikliği kolayca tespit etmek için sensör pedlerini bir oksimetreye bağlı baldır kaslarına yerleştirin.
- Alt ekstremitede iskemik komplikasyonları önlemek için ECMO kanülasyonu sırasında yüzeysel femoral artere bir antegrad perfüzyon kateteri (5-7 Fr) yerleştirin.
- Kanama ve hemoliz
NOT: VA-ECMO başlatıldıktan sonra küçük bir dereceye kadar hemoliz yaygındır. Önemli hemoliz nedenleri arasında pompa trombozu ve ECMO devresinde pıhtılaşma bulunur.- Klinik olarak anlamlı hemoliz için dikkatlice izleyin. Günlük olarak hemoglobin seviyelerini, laktat dehidrojenaz, bilirubin ve kreatinin ölçün.
- Şiddetli kanama ve trombositopeni olan hastalarda sistemik antikoagülasyonu kesmeyi düşünün46. Bununla birlikte, bu trombotik komplikasyon riskini artırabilir; Bu nedenle, antikoagülasyon uygulanmadan önce kanama ve trombotik risklerin dikkatli bir şekilde değerlendirilmesi gerekir.
- Hava embolisi
NOT: ECMO devresinde hava sıkışması, gevşek bağlantılardan, periferik veya merkezi venöz erişimden veya oksijenatör membranının47 yırtılmasından kaynaklanabilir. Hava kabarcıkları beyin dolaşımına girerse felce neden olabilecek hava embolisine yol açabilir.- Ventilasyon desteği üzerindeyken hastayı Trendelenburg pozisyonuna getirin ve hava embolisini yönetmek için ECMO devresini kelepçeleyin
- Hava embolisinden şüphelenildiğinde devrenin havasını alın ve yeniden doldurun. Bazen, tüm devrenin değiştirilmesi gerekebilir.
5. ECMO'dan ayırma
- Hastaları, VA-ECMO kullanımına neden olan ilk hakaretten kurtulduktan sonra sütten kesme açısından değerlendirin.
NOT: Eşlik eden solunum yetmezliği sütten kesmeden önce çözülmüş olmalıdır. - Kardiyak fonksiyondaki iyileşmeyi ve sütten kesmeye hazır olup olmadığını değerlendirmek için seri ekokardiyogramlar yapın.
- Bir hastayı VA-ECMO'dan ayırmadan önce hemodinamik stabiliteyi onaylayın.
NOT: Hastalar en az 24 saat boyunca geri kazanılmış pulsatil arteriyel dalga formuna sahip olmalı ve düşük doz vazopresör kullanımı > veya düşük doz vazopresör kullanımı durumunda ortalama arter basıncı 60 mmHg olmalıdır48. - Sütten kesme sırasında, ECMO akışının kademeli olarak minimum 1-1,5 L / dk'ya düşürüldüğü bir ekokardiyografik kapatma çalışması yapın. Hemodinamik stabiliteyi sağlayın ve ekokardiyogramda kardiyak fonksiyonu değerlendirin.
NOT: Turndown çalışması sırasında sol ventrikül (LV) ejeksiyon fraksiyonu %>20-%25, aort hız-zaman integrali >10 cm ve lateral mitral annulus tepe sistolik hızı >6 cm/sn başarılı sütten kesmenin belirleyicileridir49. - Hastalar sütten kesilirken laktat, SvO2 ve böbrek fonksiyonu gibi son organ perfüzyonunun laboratuvar parametrelerini izleyin.
- Sütten kesme işlemini kolaylaştırmak için, dekanülasyondan önce hasta ile ECMO devresi arasına basitleştirilmiş bir ayırma köprüsü50 yerleştirin (bu adım isteğe bağlıdır).
NOT: Sütten kesme köprüsü, hastaların ECMO desteği dışında gözlemlenmesine olanak tanır ve gerektiğinde birkaç dakika içinde ECMO devresini tekrar açma fırsatı sunar. Giriş ve çıkış kanüllerini birbirine bağlayan uzun bir borudan oluşur. - Sütten kesme köprüsünün proksimalinde hem giriş hem de çıkış kanüllerine hasta tarafına doğru kelepçeler yerleştirin, böylece hastayı ECMO devresinden ayırın ve kanın ECMO devresi içinde yeniden dolaşımına izin verin.
- Devreyi klempledikten sonra, dekanülasyondan önce hastaları 24 saate kadar gözlemleyin. Hemodinamik desteğin gerekli olması durumunda, boru kelepçelerini çıkararak ECMO akışını yeniden başlatın.
- Sütten kesmeyi daha da artırmak için, 5 L / dk'ya kadar akış sağlayabilen bir ventriküler destek cihazı (örneğin, Impella) kullanın. Ventriküler destek cihazından gelen akışı artırın ve hemodinamik stabiliteyi sağlarken VA-ECMO akışını sistematik olarak azaltın.
NOT: Ventriküler destek cihazının faydalarından biri, aksiller bir yaklaşım kullanılarak implante edilebilmesi ve böylece VA-ECMO51'in çıkarılmasından sonra erken ambulasyona izin vermesidir. - Hasta VA-ECMO'nun çıkarılması için aday olarak kabul edildiğinde, ameliyathanede veya kalp kateterizasyon laboratuvarında dekanülasyon yapın.
NOT: Periferik arteriyel kanülasyonu olan çoğu hasta bir dereceye kadar vasküler onarım gerektirecektir.
Sonuçlar
Refrakter CS'de VA-ECMO kullanımından sonra hastaneden taburcu olana kadar sağkalım, çeşitli gözlemsel çalışmalarla bildirildiği üzere %28-6713,15,52,53,54,55,56 arasında değişmektedir (Tablo 1). Sonuçlar CS'nin etiyolojisine bağlı olarak değişir. ELSO kayıt defterinde, 1990'dan 2015'e kadar 9.025 yetişkin ekstrakorporeal yaşam desteği (ECLS) ile desteklenmiştir. CS, ECLS kullanımı ile ilişkili en yaygın tanıydı ve taburcu olana kadar sağkalım oranı sadece %42'ydi10. Miyokarditli yetişkinler en iyi sağkalıma (%65) sahipken, konjenital kalp kusuru olan yetişkinler en kötü sağkalıma (%37) sahipti. Kardiyotomi sonrası CS, VA-ECMO'nun başlamasından sonra hastane içi sonuçları daha kötü olan ve hastane içi sağkalımı %30-40 arasında değişen başka bir popülasyonu temsil eder53,54. 17 çalışmanın meta-analizi, VA-ECMO'da LV boşaltmanın, boşaltma yapılmamasına kıyasla mortalitede bir azalma ile ilişkili olduğunu göstermiştir57. VA-ECMO'nun kendisinden kaynaklanan çeşitli komplikasyonlar CS ile ilişkili morbidite ve mortalitede artışa neden olabilir. Örneğin, ECMO 58,59'daki hastaların% 45-60'ında kanama olayları kaydedildi ve daha yüksek bir aktive parsiyel tromboplastin zamanı, hemorajik komplikasyon riskinin artmasıyla ilişkilendirildi. Refrakter CS'de VA-ECMO kullanımından sonra uzun süreli sağkalımı değerlendiren 44 çalışmanın60 yakın tarihli bir meta-analizi, 1 ve 5 yılda toplam sağkalımın sırasıyla% 36.7 ve% 29.9 olduğunu gösterdi. Bu nedenle, CS'li hastalarda VA-ECMO'nun bir kurtarma yöntemi olarak kullanılmasına rağmen, hem hastane içi hem de uzun dönem mortalite yüksek kalmaktadır. Ayrıca, bazı kanıtlar VA-ECMO'nun başarılı bir şekilde sütten kesilmesinin her zaman sağkalımı öngörmediğini göstermektedir48. VA-ECMO'dan başarılı bir şekilde ayrılan hastalarda hastane içi mortalite yaklaşık %25'tir61. 117 hastadan oluşan yakın tarihli çok merkezli randomize kontrollü ECMO-CS çalışması, evre D-E şoku için VA-ECMO'nun erken kullanımının, hemodinamiğin kötüleşmesi durumunda VA-ECMO'nun aşağı akış kullanımına izin veren erken konservatif bir yönetime kıyasla klinik sonuçları iyileştirmediğini göstermiştir62. Buna karşılık, tek merkezli bir randomize kontrol ARREST çalışması63, hastane dışı kardiyak arrest ve refrakter ventriküler fibrilasyon için erken ECMO kolaylaştırılmış resüsitasyonun, standart ileri kardiyovasküler yaşam desteği (ACLS) tedavisine kıyasla hastaneden taburcu olana kadar sağkalımı iyileştirdiğini göstermiştir. Gelecekteki araştırmalar, VA-ECMO'nun sütten kesilmesi ve deannülasyonunu takiben advers olay riski taşıyan hastaları belirlemeye odaklanmalıdır.
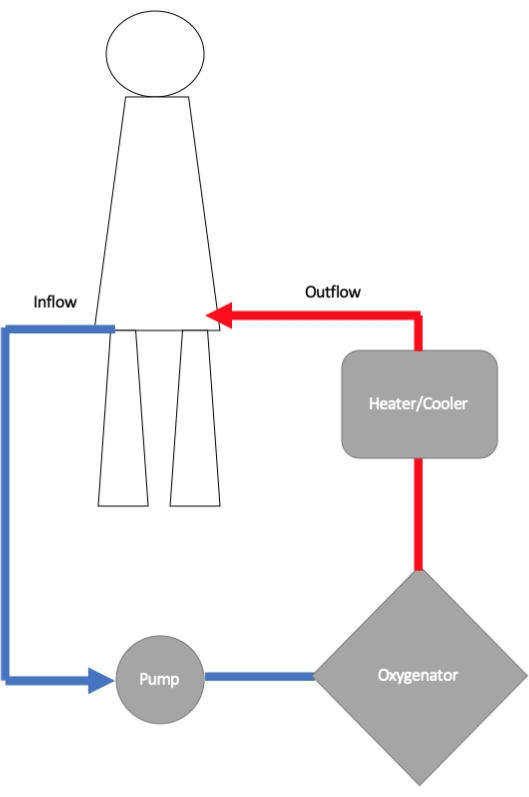
Şekil 1: Veno-arteriyel ekstrakorporeal membran oksijenasyonu (VA-ECMO) devresinin çeşitli bileşenlerini gösteren şematik diyagram. Giriş kanülü, kanı vücuttan ECMO pompasına getirir ve buradan kan oksijenasyon için bir oksijenatöre gönderilir. Kanın sıcaklığı, büyük delikli bir artere (en yaygın olarak femoral arterde) yerleştirilen bir çıkış kanülü yoluyla vücuda geri gönderilmeden önce optimize edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Yazar, yıl | Ülke | Tasarım | Toplam hasta sayısı (n) | Kardiyojenik şokun etiyolojisi | Hastanede sağkalım (%) | ||
| Aso, 201615 | Japonya | Retrospektif | 4658 | İskemik kalp hastalığı, kalp yetmezliği, kalp kapak hastalığı, miyokardit | 26.4 | ||
| Demirci, 201752 | Küresel | Retrospektif | 2699 | Miyokardit, koroner arter hastalığı, yapısal kalp hastalığı, kalp nakli sonrası, ventrikül sonrası destek cihazı | 41.4 | ||
| Chen, 201753 | Tayvan | Retrospektif | 1141 | Kardiyotomi sonrası şok | 38.3 | ||
| Thiagarajan, 201710 | ABD | Retrospektif | 9025 | çok faktörlü | 42 | ||
| Rastan, 201054 | Almanya | Retrospektif | 517 | Koroner arter baypas greftleme, kapak cerrahisi, koroner arter baypas greftleme artı kapak cerrahisi, torasik organ nakli, diğerleri | 24.8 | ||
Tablo 1: Veno-arteriyel ekstrakorporeal membran oksijenasyonu (VA-ECMO) uygulanan kardiyojenik şoklu (CS) hastalarda hastane içi sağkalımı bildiren seçilmiş gözlemsel çalışmalar. Bu çalışmalar, ECMO gereksinimi olan hastaların hastane içi sağkalımlarının %24.8-42 arasında değişerek düşük kaldığını vurgulamaktadır.
Tartışmalar
Bu protokolde, refrakter CS'li hastalarda VA-ECMO'nun başlatılması ve sürdürülmesinde yer alan çeşitli adımlar tanımlanmıştır. VA-ECMO kullanımı ile ilgili bazı önemli komplikasyonlar, sütten kesme parametreleri ve sonuçlar da tartışılmıştır.
VA-ECMO, CS'de diğer tedavi stratejilerinin yeterli hemodinamik destek sağlayamadığı durumlarda genellikle bir kurtarma tedavisi olarak kullanılır. Kanülasyon, vasküler yaralanma ve kanama riskini en aza indirmek için titizlikle yapılması gereken geniş çaplı vasküler erişimi içerir. VA-ECMO başlatıldıktan sonra, hastalar, ECMO devrelerini kullanma konusunda uzmanlık eğitimi almış perfüzyonistler ve hemşirelerle donatılmış kardiyovasküler yoğun bakım ünitesinde izlenmelidir. Hastalar günlük olarak sütten kesilme açısından değerlendirilmeli ve kardiyak iyileşme meydana geldiğinde veya komplikasyonları en aza indirmek için daha kesin tedaviler tanımlandığında dekannülasyon mümkün olduğunca erken yapılmalıdır.
VA-ECMO kullanımı, genişleyen bir endikasyon listesi ile son yirmi yılda muazzam bir şekilde artmıştır. Bulunabilirliği ve kullanım yaygınlığındaki artışa rağmen, CS'de mortalite yüksek olmaya devam etmektedir. Hasta seçimi, VA-ECMO ile ilişkili komplikasyonları azaltırken aynı zamanda kaynakların makul bir şekilde tahsis edilmesini sağlamada kritik öneme sahiptir. VA-ECMO uygulanan hastaların sağkalımını tahmin etmek için çeşitli skorlama sistemleri geliştirilmiştir. Veno-arteriyel-ECMO (SAVE) skoru61 sonrası sağkalım, ELSO kayıt defterinden alınan veriler kullanılarak oluşturulmuştur ve VA-ECMO başlamadan önce hastalarda sağkalımı tahmin etmede yararlıdır. Skorlama CS etiyolojisi, yaş, kilo, akut organ yetmezlikleri (böbrek, karaciğer ve/veya santral sinir sistemi), kronik böbrek yetmezliği, entübasyon süresi, pik inspiratuar basınç, diyastolik ve ortalama nabız basınçları, kardiyak arrest ve bikarbonat değerlerine göre yapılır. SAVE skoruna bağlı olarak, hastalar beş farklı risk sınıfına (Sınıf I ila V) risk sınıflandırmasına tabi tutulur. Daha düşük puanlar, daha yüksek bir risk sınıfı ve daha kötü hastanede sağkalım oranları ile ilişkilidir. Bu puanlama sistemi aynı zamanda 161 Avustralyalı hastada harici olarak doğrulandı ve 0.90'lık alıcı işletim özellikleri eğrisinin altındaki bir alanla mükemmel ayrımcılık gösterdi (0.85-0.95% 95 güven aralığı). Laktat içeren modifiye SAVE skoru64 daha sonra geliştirildi ve acil servise varıştan sonraki 24 saat içinde VA-ECMO başlatılan hastalarda mükemmel sonuç tahminine sahip olduğu gösterildi. 1, 6 ve 12 saatlerde bakım noktası biyobelirteç (laktat, pH ve bikarbonat konsantrasyonu) ölçümlerini kullanan PREDICT VA-ECMO skoru65 adı verilen başka bir basitleştirilmiş prognostikasyon aracı yakın zamanda geliştirilmiş ve doğrulanmıştır. VA-ECMO'dan sonra advers olay riski taşıyan hasta popülasyonlarının belirlenmesi ve daha sonra daha kesin tedavilerin kullanılması devam eden bir ilgi alanı olmaya devam etmektedir.
Sınırlı kanıtlar, CS tanısından sonra VA-ECMO'nun erken başlatılmasının sağkalımı artırabileceğini düşündürmektedir13. Ostadal ve ark. tarafından yapılan ECMO-CS çalışması, erken VA-ECMO tedavisi alan hastalarda konservatif stratejiye kıyasla herhangi bir nedenden mortalite açısından fark göstermemiştir62. Ancak, bu henüz rastgele bir şekilde doğrulanmamıştır. Kardiyojenik Şokta Kötü Sonuçları İyileştirmek için Yeni Stratejinin Değerinin ve Maliyet Etkinliğinin Test Edilmesi (EUROSHOCK) çalışması (ClinicalTrials.gov Tanımlayıcı: NCT03813134), CS'li hastalarında ECMO'nun erken başlatılmasının standart tedaviye kıyasla 30 günlük sağkalımı iyileştirip iyileştirmediğini değerlendirecek devam eden randomize bir klinik çalışmadır. Benzer şekilde, Kardiyojenik Şokta Ekstrakorporeal Yaşam Desteği (ECLS-SHOCK) çalışması (ClinicalTrials.gov Tanımlayıcı: NCT03637205), revaskülarizasyon ve medikal tedaviye ek olarak ECLS'nin, CS ile komplike olan'de ECLS kullanımının olmamasıyla karşılaştırıldığında faydalı olup olmadığını inceleyecektir. ECLS tercihen bu çalışmada revaskülarizasyondan önce başlatılacaktır.
VA-ECMO'nun başlatılması ve sürdürülmesi, yalnızca üçüncü basamak hastanelerde bulunabilecek önemli sağlık kaynakları gerektirir. Yerel topluluklar, sağlık sistemleriyle işbirliği içinde, periferik küçük hastanelerin CS'li hastaları tanıdan hemen sonra organize VA-ECMO ekiplerine sahip merkezi bir üçüncü basamak hastaneye sevk ettiği bir "konuşma ve merkez modeli"66 geliştirmeye odaklanmalıdır.
Açıklamalar
John Um, Abbott Laboratories için bir danışman ve Medtronic için bir danışmandır. Poonam Velagapudi, Abiomed, Medtronic, Opsens ve Shockwave Medical'den konuşma ücreti aldığını ve Abiomed ve Sanofi'deki danışma kurullarına katılma ücretini açıkladı. Diğer yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Hiç kimse.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Amplatz Super Stiff guidewire | Boston Scientific | 46-500, 46-501, 46-502. 46-503, 46-504, 46-517, 46-519, 46-520, 46-523, 46-525, 46-526, 46-563, 46-564, 46-509, 46-510, 46-518, 46-524 | Allows delivery of catheters across tortuous anatomies |
| Impella | Abiomed | Impella 2.5, Impella CP, Impella 5.0, Impella 5.5, Impella RP | Percutaneously inserted left ventricular assist device that provides hemodynamic support in cardiogenic shock |
| Inflow Cannula | Surge Cardiovascular | FEM-V1020, FEM-V1022, FEM-V1024, FEM-V1026,FEM-V1028 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus 96600-019,021,023,025,027,029 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus Femoral Venous 96670 - 017,019, 021, 023 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus Multi-Stage Femoral Venous 96880-019,021,025 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus NextGen 96600 - 115, 117, 119, 121, 123, 125, 127, 129 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Carmeda Biomedicus CB96605-015,017,019,021,023,025,29 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Cortiva Biomedicus Femoral Venous CB96670-015,017,019,021 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | DLP Carmeda Venous CB75008, CB66112, CB66114, CB66116, CB66118, CB66120, CB66122,CB66124 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | Avalon Elite Bicaval - 10013, 10016, 10019, 10020, 10023, 10027, 10031 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous Bioline - BE PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous Softline - BO PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous - PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Life Support Bio-Medicus Drainage Catheter and Introducers - LS96218 - 015, 017, 019, 021, 023, 025 ; LS96438 - 021, 023, 025, LS 96555 - 019, 021, 023, 025, LS 96355 - 021, LS96360 -023, 025, 027, 029 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Fresenius | Medos Femoral Cannula MEFKV 18,20,22,24,26,28 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Medtronic 2 stage venous - 91228, 91240, 91246, 91236,91251 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Senko/Mera | PCKC-V-24, PCKC-V2-18, PCKC-V-18, PCKC-V2-20, PCKC-V-20, PCKC-V-22, PCKC-V2-24, PCKC-V-24 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | TandemLife/Livanova | 29,31 Fr | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Freelife Medical | FLK V19 B18, FLK V19 B18R, FLK VV 19R, FLK V20 B20, FLK V20 B20R, FLK V19 B20, FLK V19 B20R, FLK V20 B22, FLK V20 B22R, FLK V10S B22, FLK V19 B22, FLK V19 B22R, FLK V10 B22, FLK V10 B22R, FLK V10S B22R, FLK VV 23R, FLK V10S B24, FLK V10S B24R, FLK V10 B24, FLK V10 B24R, FLK V10S B26, FLK V10S B26R, FLK V10 B26, FLK V10 B26R, FLK VV 27R, FLK VV 31R | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | LivaNova | Sorin right angle venous - 10, 12, 14, 16, 18, 20, 22, 24, 28 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Terumo | CX-EB18VLX, CX-EB21VLX | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus Arterial 96530 - 015,017, 019, 021, 023, 025, | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus Femoral Arterial 96570 - 015, 017, 019, 021 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus NextGen Arterial 96530 -115, 117, 119, 121, 123, 125, 96570 - 115, 117, 119, 121 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Carmeda Biomedicus CB96535 - 015, 017, 019, 021, 023 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Cortiva Biomedicus Femoral Arterial CB96570 -015, 017, 019, 021 | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | PAS 1315, PAS 1515, PAS 1523, PAS 1717, PAL 1723, PAL 1923, PAL 2115, PAL 2123, PAL 2315, PAL 2323 | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | Bioline BE PAS 1315, BE PAS 1515, BE PAL 1523, BE PAL 1723, BE PAS 1915, BE PAL 1923, BE PAS 2115, BE PAL 2123, BE PAS 2315, BE PAL 2323, | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | Softline BO PAS 1315, BO PAS 1515, BO PAL 1523, BO PAS 1715, BO PAL 1723, BO PAS 1915, BO PAL 1923, BO PAS 2115, BO PAL 2123, BO PAL 2323 | Returns oxygenated blood to the body |
| Outflow Cannula | Fresenius | Medos Femoral Arterial Cannula; MEFKA 16, 18, 20, 22,24 | Returns oxygenated blood to the body |
| Outflow Cannula | Senko/Mera | PCKC-A-20, PCKC-A-16, PCKC-A-18 | Returns oxygenated blood to the body |
| Outflow Cannula | Freelife Medical | FLK A18 D16, FLK A18L D16, FLK A18L D16R, FLK A18 D16R, FLK A44 D18, FLK A44 D18R, FLK A18 D18, FLK A18L D18, FLK A18L D18R, FLK A18 D18R, FLK A44 D20, FLK A44 D20R, FLK A18 D20, FLK A18L D20, FLK A18L D20R, FLK A18 D20R, FLK A18 D22, FLK A18L D22, FLK A18L D22R, FLK A18 D24, FLK A18L D24, FLK A18L D24R, FLK A18 D24R | Returns oxygenated blood to the body |
| Outflow Cannula | LivaNova | Sorin arterial - 14, 17, 19, 21, 23 Fr | Returns oxygenated blood to the body |
| Outlflow Cannula | Medtronic Cardiopulmonary | Life Support Bio-Medicus Return Catheter and Introducers - LS96010-009, LS96010-011, LS96010-013, LS96010-015, LS96218-015, LS96218-017, LS96218-019, LS96218-021, LS96218-023, LS96218-025 | Returns oxygenated blood to the body |
| Oxygenator | Abbott | Eurosets | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Oxygenator | Getinge | MaquetHLS Set Advanced v 5.0, v 7.0, Maquet Quadrox iD | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Oxygenator | Medtronic | Nautilus | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Pump | Abiomed | Breethe | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | Alcard ALC 250 | Generates force to deliver oxygenated blood back to the body |
| Pump | Baxter | Century Roller Pump | Generates force to deliver oxygenated blood back to the body |
| Pump | Medtronic Cardiopulmonary | Biomedicus BP50, BP80 Centrifugal | Generates force to deliver oxygenated blood back to the body |
| Pump | Braile Biomedica | Safyre | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | CiSet | Generates force to deliver oxygenated blood back to the body |
| Pump | Abbott | CentriMag | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | Cobe 6" Roller | Generates force to deliver oxygenated blood back to the body |
| Pump | Origen | FloPump 32 | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | HIT Set Advanced Softline 5.0 and 7.0 | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | LifeSPARC | Generates force to deliver oxygenated blood back to the body |
| Pump | Senko/Mera | Centrifugal pump head | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | HLS Set Advanced Bioline 5.0 and 7.0 | Generates force to deliver oxygenated blood back to the body |
| Tandem Heart | LivaNova | Tandem Heart LS | Percutaneously inserted left ventricular assist device |
Referanslar
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- Goldberg, R. J., Spencer, F. A., Gore, J. M., Lessard, D., Yarzebski, J. Thirty-year trends (1975 to 2005) in the magnitude of, management of, and hospital death rates associated with cardiogenic shock in patients with acute myocardial infarction: a population-based perspective. Circulation. 119 (9), 1211-1219 (2009).
- Hochman, J. S., et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. The New England Journal of Medicine. 341 (9), 625-634 (1999).
- Hochman, J. S., et al. One-year survival following early revascularization for cardiogenic shock. JAMA. 285 (2), 190-192 (2001).
- Schumann, J., et al. Inotropic agents and vasodilator strategies for the treatment of cardiogenic shock or low cardiac output syndrome. The Cochrane Database of Systematic Reviews. 1 (1), 009669 (2018).
- Léopold, V., et al. Epinephrine and short-term survival in cardiogenic shock: an individual data meta-analysis of 2583 patients. Intensive Care Medicine. 44 (6), 847-856 (2018).
- De Backer, D., et al. Comparison of dopamine and norepinephrine in the treatment of shock. The New England Journal of Medicine. 362 (9), 779-789 (2010).
- Strom, J. B., et al. National trends, predictors of use, and in-hospital outcomes in mechanical circulatory support for cardiogenic shock. EuroIntervention. 13 (18), 2152-2159 (2018).
- Stentz, M. J., et al. Trends in extracorporeal membrane oxygenation growth in the United States, 2011-2014. ASAIO Journal. 65 (7), 712-717 (2019).
- Thiagarajan, R. R., et al. Extracorporeal life support organization registry international report 2016. ASAIO Journal. 63 (1), 60-67 (2017).
- Lequier, L., Horton, S. B., McMullan, D. M., Bartlett, R. H. Extracorporeal membrane oxygenation circuitry. Pediatric Critical Care Medicine. 14 (5), 7-12 (2013).
- Schmidt, M., et al. Blood oxygenation and decarboxylation determinants during venovenous ECMO for respiratory failure in adults. Intensive Care Medicine. 39 (5), 838-846 (2013).
- Sheu, J. J., et al. Early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention improved 30-day clinical outcomes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Critical Care Medicine. 38 (9), 1810-1817 (2010).
- Belohlavek, J., et al. Veno-arterial ECMO in severe acute right ventricular failure with pulmonary obstructive hemodynamic pattern. The Journal of Invasive Cardiology. 22 (8), 365-369 (2010).
- Aso, S., Matsui, H., Fushimi, K., Yasunaga, H. In-hospital mortality and successful weaning from venoarterial extracorporeal membrane oxygenation: analysis of 5,263 patients using a national inpatient database in Japan. Critical Care. 20, 80 (2016).
- Asaumi, Y., et al. Favourable clinical outcome in patients with cardiogenic shock due to fulminant myocarditis supported by percutaneous extracorporeal membrane oxygenation. European Heart Journal. 26 (20), 2185-2192 (2005).
- Religa, G., Jasińska, M., Czyżewski, &. #. 3. 2. 1. ;., Torba, K., Różański, J. The effect of the sequential therapy in end-stage heart failure (ESHF)-from ECMO, through the use of implantable pump for a pneumatic heart assist system, Religa Heart EXT, as a bridge for orthotopic heart transplant (OHT). Case study. Annals of Transplantation. 19, 537-540 (2014).
- Meani, P., et al. Long-term survival and major outcomes in post-cardiotomy extracorporeal membrane oxygenation for adult patients in cardiogenic shock. Annals of Cardiothoracic Surgery. 8 (1), 116-122 (2019).
- Bartos, J. A., et al. Improved survival with extracorporeal cardiopulmonary resuscitation despite progressive metabolic derangement associated with prolonged resuscitation. Circulation. 141 (11), 877-886 (2020).
- Brooks, S. C., et al. Part 6: Alternative techniques and ancillary devices for cardiopulmonary resuscitation. Circulation. 132 (18), 436-443 (2015).
- Guglin, M., et al. Venoarterial ECMO for adults: JACC scientific expert panel. Journal of the American College of Cardiology. 73 (6), 698-716 (2019).
- Lorusso, R., et al. Venoarterial extracorporeal membrane oxygenation for refractory cardiogenic shock in elderly patients: Trends in application and outcome from the Extracorporeal Life Support Organization (ELSO) Registry. The Annals of Thoracic Surgery. 104 (1), 62-69 (2017).
- Tehrani, B. N., et al. Standardized team-based care for cardiogenic shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Pavlushkov, E., Berman, M., Valchanov, K. Cannulation techniques for extracorporeal life support. Annals of Translational Medicine. 5 (4), 70 (2017).
- Burrell, A. J. C., Ihle, J. F., Pellegrino, V. A., Sheldrake, J., Nixon, P. T. Cannulation technique: femoro-femoral. Journal of Thoracic Disease. 10, 616-623 (2018).
- Lamb, K. M., et al. Arterial protocol including prophylactic distal perfusion catheter decreases limb ischemia complications in patients undergoing extracorporeal membrane oxygenation. Journal of Vascular Surgery. 65 (4), 1074-1079 (2017).
- Pancholy, S. B., Shah, S., Patel, T. M. Radial artery access, hemostasis, and radial artery occlusion. Interventional Cardiology Clinics. 4 (2), 121-125 (2015).
- Hoeper, M. M., et al. Extracorporeal membrane oxygenation watershed. Circulation. 130 (10), 864-865 (2014).
- Chung, M., Shiloh, A. L., Carlese, A. Monitoring of the adult patient on venoarterial extracorporeal membrane oxygenation. The Scientific World Journal. 2014, 393258 (2014).
- Mungan, &. #. 3. 0. 4. ;., Kazancı, B. &. #. 3. 5. 0. ;., Ademoglu, D., Turan, S. Does lactate clearance prognosticates outcomes in ECMO therapy: a retrospective observational study. BMC Anesthesiology. 18 (1), 152 (2018).
- Su, Y., et al. Hemodynamic monitoring in patients with venoarterial extracorporeal membrane oxygenation. Annals of Translational Medicine. 8 (12), 792 (2020).
- Walter, J. M., Kurihara, C., Corbridge, T. C., Bharat, A. Chugging in patients on veno-venous extracorporeal membrane oxygenation: An under-recognized driver of intravenous fluid administration in patients with acute respiratory distress syndrome. Heart & Lung. 47 (4), 398-400 (2018).
- Kim, H., et al. Permissive fluid volume in adult patients undergoing extracorporeal membrane oxygenation treatment. Critical Care. 22 (1), 270 (2018).
- Kalbhenn, J., Maier, S., Heinrich, S., Schallner, N. Bedside repositioning of a dislocated Avalon-cannula in a running veno-venous ECMO. Journal of Artificial Organs. 20 (3), 285-288 (2017).
- Weber, C., et al. Left ventricular thrombus formation in patients undergoing femoral veno-arterial extracorporeal membrane oxygenation. Perfusion. 33 (4), 283-288 (2018).
- Tariq, S., Aronow, W. S. Use of inotropic agents in treatment of systolic heart failure. International Journal of Molecular Sciences. 16 (12), 29060-29068 (2015).
- Thiele, H., Ohman, E. M., Desch, S., Eitel, I., de Waha, S. Management of cardiogenic shock. European Heart Journal. 36 (20), 1223-1230 (2015).
- Mason, D. T. Afterload reduction in the treatment of cardiac failure. Schweizerische Medizinische Wochenschrift. 108 (44), 1695-1703 (1978).
- Meani, P., et al. Modalities and effects of left ventricle unloading on extracorporeal life support: A review of the current literature. European Journal of Heart Failure. 19, 84-91 (2017).
- Taylor, T., Campbell, C. T., Kelly, B. A review of bivalirudin for pediatric and adult mechanical circulatory support. American Journal of Cardiovascular Drugs. 21 (4), 395-409 (2021).
- Geli, J., Capoccia, M., Maybauer, D. M., Maybauer, M. O. Argatroban anticoagulation for adult extracorporeal membrane oxygenation: A systematic review. Journal of Intensive Care Medicine. 37 (4), 459-471 (2022).
- Patel, B., Arcaro, M., Chatterjee, S. Bedside troubleshooting during venovenous extracorporeal membrane oxygenation (ECMO). Journal of Thoracic Disease. 11, 1698-1707 (2019).
- Cheng, R., et al. Complications of extracorporeal membrane oxygenation for treatment of cardiogenic shock and cardiac arrest: a meta-analysis of 1,866 adult patients. The Annals of Thoracic Surgery. 97 (2), 610-616 (2014).
- Bonicolini, E., et al. Limb ischemia in peripheral veno-arterial extracorporeal membrane oxygenation: a narrative review of incidence, prevention, monitoring, and treatment. Critical Care. 23 (1), 266 (2019).
- Moerman, A., Wouters, P. Near-infrared spectroscopy (NIRS) monitoring in contemporary anesthesia and critical care. Acta Anaesthesiologica Belgica. 61 (4), 185-194 (2010).
- Chung, Y. S., et al. Is stopping heparin safe in patients on extracorporeal membrane oxygenation treatment. ASAIO Journal. 63 (1), 32-36 (2017).
- Kumar, A., Keshavamurthy, S., Abraham, J. G., Toyoda, Y. Massive air embolism caused by a central venous catheter during extracorporeal membrane oxygenation. The Journal of Extra-Corporeal Technology. 51 (1), 9-11 (2019).
- Ortuno, S., et al. Weaning from veno-arterial extracorporeal membrane oxygenation: which strategy to use. Annals of Cardiothoracic Surgery. 8 (1), 1-8 (2019).
- Aissaoui, N., et al. Predictors of successful extracorporeal membrane oxygenation (ECMO) weaning after assistance for refractory cardiogenic shock. Intensive Care Medicine. 37 (11), 1738-1745 (2011).
- Vida, V. L., et al. Extracorporeal membrane oxygenation: the simplified weaning bridge. The Journal of Thoracic and Cardiovascular Surgery. 143 (4), 27-28 (2012).
- Esposito, M. L., Jablonksi, J., Kras, A., Krasney, S., Kapur, N. K. Maximum level of mobility with axillary deployment of the Impella 5.0 is associated with improved survival. The International Journal of Artificial Organs. 41 (4), 236-239 (2018).
- Smith, M., et al. Duration of veno-arterial extracorporeal life support (VA ECMO) and outcome: an analysis of the Extracorporeal Life Support Organization (ELSO) registry. Critical Care. 21 (1), 45 (2017).
- Chen, S. W., et al. Long-term outcomes of extracorporeal membrane oxygenation support for postcardiotomy shock. The Journal of Thoracic and Cardiovascular Surgery. 154 (2), 469-477 (2017).
- Rastan, A. J., et al. Early and late outcomes of 517 consecutive adult patients treated with extracorporeal membrane oxygenation for refractory postcardiotomy cardiogenic shock. The Journal of Thoracic and Cardiovascular Surgery. 139 (2), 302-311 (2010).
- Tsao, N. W., et al. Extracorporeal membrane oxygenation-assisted primary percutaneous coronary intervention may improve survival of patients with acute myocardial infarction complicated by profound cardiogenic shock. Journal of Critical Care. 27 (5), 1-11 (2012).
- Sakamoto, S., Taniguchi, N., Nakajima, S., Takahashi, A. Extracorporeal life support for cardiogenic shock or cardiac arrest due to acute coronary syndrome. The Annals of Thoracic Surgery. 94 (1), 1-7 (2012).
- Russo, J. J., et al. Left ventricular unloading during extracorporeal membrane oxygenation in patients with cardiogenic shock. Journal of the American College of Cardiology. 73 (6), 654-662 (2019).
- Ou de Lansink-Hartgring, A., de Vries, A. J., Droogh, J. H., vanden Bergh, W. M. Hemorrhagic complications during extracorporeal membrane oxygenation-The role of anticoagulation and platelets. Journal of Critical Care. 54, 239-243 (2019).
- Aubron, C., et al. Predictive factors of bleeding events in adults undergoing extracorporeal membrane oxygenation. Annals of Intensive Care. 6 (1), 97 (2016).
- Chang, W. W., et al. Predictors of mortality in patients successfully weaned from extracorporeal membrane oxygenation. PLoS One. 7 (8), 42687 (2012).
- Schmidt, M., et al. Predicting survival after ECMO for refractory cardiogenic shock: the survival after veno-arterial-ECMO (SAVE)-score. European Heart Journal. 36 (33), 2246-2256 (2015).
- Ostadal, P., et al. Extracorporeal Membrane Oxygenation in the Therapy of Cardiogenic Shock: Results of the ECMO-CS Randomized Clinical Trial. Circulation. , (2022).
- Yannopoulos, D., et al. Advanced reperfusion strategies for patients with out-of-hospital cardiac arrest and refractory ventricular fibrillation (ARREST): a phase 2, single centre, open-label, randomised controlled trial. Lancet. 396 (10265), 1807-1816 (2020).
- Chen, W. C., et al. The modified SAVE score: predicting survival using urgent veno-arterial extracorporeal membrane oxygenation within 24 hours of arrival at the emergency department. Critical Care. 20 (1), 336 (2016).
- Wengenmayer, T., et al. Development and validation of a prognostic model for survival in patients treated with venoarterial extracorporeal membrane oxygenation: the PREDICT VA-ECMO score. European Heart Journal. Acute Cardiovascular Care. 8 (4), 350-359 (2019).
- Huitema, A. A., Harkness, K., Heckman, G. A., McKelvie, R. S. The spoke-hub-and-node model of integrated heart failure care. The Canadian Journal of Cardiology. 34 (7), 863-870 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır