Method Article
心原性ショックに対する静脈動脈体外式膜酸素化
要約
次の記事では、心原性ショック患者における静脈動脈体外膜型酸素化の開始と維持に関連するさまざまな手順に焦点を当てています。
要約
心原性ショック (CS) は、心拍出量が少ない状況での不十分な組織灌流を特徴とする臨床状態です。CSは、急性心筋梗塞(AMI)後の死因の第1位です。臨床的回復が続くまで、またはより決定的な外科的処置が行われるまで、CSの血行動態サポートのために、いくつかの一時的な機械的支持装置が利用可能です。静脈動脈(VA)体外式膜型人工肺(ECMO)は、難治性CSの短期循環サポートの強力な治療選択肢として進化してきました。無作為化臨床試験がない場合、ECMOの利用は臨床経験に基づいており、レジストリや観察研究からのデータに基づいています。VA-ECMOの使用による退院までの生存率は28〜67%の範囲です。ECMOの開始には静脈カニューレ挿入と動脈カニューレ挿入が必要ですが、これは経皮的または外科的カットダウンによって行うことができます。ECMO回路の構成要素には、静脈系から血液を採取する流入カニューレ、ポンプ、酸素供給器、および血液を動脈系に戻す流出カニューレが含まれます。ECMO開始後の管理上の考慮事項には、血栓症を予防するための全身抗凝固療法、心筋の回復を促進するための左心室アンロード戦略、大腿動脈カニューレ挿入の場合の遠位灌流カテーテルによる四肢虚血の予防、溶血、空気塞栓症、ハーレクイン症候群などの他の合併症の予防が含まれます。ECMOは、制御不能な出血、修復されていない大動脈解離、重度の大動脈弁閉鎖不全の患者、および重度の神経学的損傷や転移性悪性腫瘍などの無益な症例には禁 ?? です。.ECMOの患者を検討する際には、学際的なショックチームアプローチが推奨されます。進行中の研究では、定期的なECMOの追加が、血行再建術を受けるAMI患者の生存率を改善するかどうかを評価します。
概要
心原性ショック (CS) は、心拍出量が少ない状況での不十分な組織灌流を特徴とする臨床状態です。再灌流療法の進歩にもかかわらず、急性心筋梗塞(AMI)は依然としてCSの主な原因です。全米入院患者サンプル(NIS)データベースの分析によると、2005年から2014年の間に144,254人のCS症例のうち55.4%がAMI1に続発していました。CSの他の病因には、非代償性心不全、劇症性心筋炎、心切開後のショック、および肺塞栓症(PE)が含まれます。CSは、45〜65%の範囲の高い院内死亡率と関連しています1,2。したがって、CSの迅速な特定と可逆的な原因の修正は、患者の生存率を向上させる上で重要です。例えば、心原性ショック(SHOCK)試験では、早期血行再建術の戦略が、AMIを複雑とするCS患者における初期医学的安定化の戦略と比較して、6ヶ月3年および1年4時の生存率の向上と関連していることが示されました。
昇圧剤と強心薬は、CSに関連する低血圧を矯正するために使用できますが、どちらも死亡率の利益があることは示されていません5,6,7。一方、短期の機械的循環サポート(MCS)デバイスは、難治性CSの患者に血行動態サポートを提供し、回復への架け橋として、またはより根治的な治療への架け橋として提供できます。MCSの使用は、ここ10年間で増加しています。ただし、CS入院の発生率はMCS8の利用を上回っています。大動脈内バルーンポンプ(IABP)の利用率の低下傾向は、血管内マイクロアクシャル左心室補助装置(LVAD)(ImpellaやTandemHeartなど)と静脈動脈体外式膜型人工肺(VA-ECMO)の適用が相対的に増加することで対抗しています。
VA-ECMOは最大4〜6 L / minの流量を生成でき、CSでのそのアプリケーションは大きな人気を得ています9。体外生命維持機構(ELSO)が管理するグローバルレジストリによると、VA-ECMOの使用は、2010年以前は年間500回未満だったのが、2015年には2,157回に増加しました10。それにもかかわらず、VA-ECMOはリソースを大量に消費するモダリティであり、専門の機器と訓練を受けたスタッフを24時間体制で利用する必要があります。したがって、ECMOの開始と維持に先立って患者を選択することは、転帰を改善し、有害事象を最小限に抑えるために非常に重要です。この記事では、VA-ECMOの開始に関連する手順、開始後のメンテナンス、その使用の背後にある証拠、および関連する合併症について説明します。
ECMO回路は、流入カニューレ、遠心ポンプ、酸素供給器、および流出カニューレで構成されています(図1)11。流入カニューレはチューブ を介して 遠心ポンプに接続され、遠心ポンプでは回転するローターが流れと圧力を生成します。ポンプから、血液は膜型人工肺に流れ、そこでガス交換が行われます12。ここでは、ヘモグロビンを酸素で飽和させ、流量を変化させ、酸素化装置に供給される吸気酸素(FiO2)の割合を増減させることで、酸素化の度合いを制御しています。二酸化炭素の除去は、酸素供給器を通過する向流ガスの掃引速度を調整することによって制御されます。通常、酸素供給器には熱交換器が取り付けられており、体に戻る血液の温度を調整できます。酸素供給器から、血液は大腿動脈の末梢または大動脈の中央にある流出カニューレを介して患者に戻されます。
プロトコル
このプロトコルは、ネブラスカ大学医療センターの機関であるヒト研究倫理委員会のガイドラインに従っています。
1. 患者様の選択
- 難治性CS患者におけるVA-ECMOは、最初の傷害後に心筋機能の改善が予想される場合の回復への架け橋、意思決定への架け橋、または心筋機能障害が不可逆的な場合の持続性LVADや心臓移植などのより決定的な治療法への架け橋と考えてください。
注:さまざまな適応症には、AMIに続発するCS、末期心不全、劇症性心筋炎、および大量のPEによる肺心性13,14,15,16,17が含まれます。また、心臓手術を受けている患者で、心臓切開後に難治性のCS18を発症する患者にも使用されています。 - 難治性心室細動/心室頻拍に続発する院外心停止の選択された患者にVA-ECMOを利用し、体外心肺蘇生法(ECPR)の一部として心肺サポートを行います。
注:ECPRが生存率の改善と関連していることを示唆する証拠は限られており、現在、CPR19,20のガイドラインに組み込まれています。 - 進行性悪性腫瘍、脳損傷、大動脈解離など、生存を制限する重度の不可逆的な末端臓器不全を伴うシナリオや、患者のケアの目標がMCS21の使用と一致しない場合は、VA-ECMOの使用を控えてください。
注:いくつかの相対的な禁忌には、カニューレ挿入を妨げる末梢血管疾患、制御されていない出血、または抗凝固薬の使用に対する禁忌が含まれます。老齢(>70歳)は絶対的な禁忌ではありません。しかし、この集団は歴史的に、若年成人と比較して院内生存率が低いことを示してきました22。
2. VA-ECMOのカニューレ挿入と開始
- VA-ECMO23でCS患者を開始する前に、高度な心不全専門医、インターベンショナル心臓専門医、心臓胸部外科医、およびクリティカルケア集中治療医で構成される学際的なチームベースのディスカッションを促進します。
- 経皮的アプローチ(末梢カニューレ挿入)の場合は心臓カテーテル検査室、救急科、または集中治療室でカニューレ挿入を行い、外科的アプローチ(中枢カニューレ挿入)の場合は手術室でカニューレ挿入を行います24。
- 経皮的アプローチでは、クロルヘキシジンなどの消毒液を使用してアクセス部位を清掃し、準備します。
- 超音波ガイド下で、針で修正されたセルディンガー技術を使用して大腿静脈アクセスを取得し、5 Fr マイクロシース25 を配置します。
- 柔軟なJチップガイドワイヤー(0.038インチ×180cm)を大腿静脈から下大静脈(IVC)に進め、右心房に向けます。
- シーケンシャル拡張器を使用して静脈アクセス部位を拡張し、カニューレ通路を連続的に拡張し、1つの拡張器(2 Frサイズ)ずつステップアップします。次に、適切なサイズの静脈カニューレ(シングルルーメン)を配置します。
注:カニューレのサイズは、超音波検査の血管の年齢、性別、直径、および目的の流量に基づいて決定されます。静脈カニューレは21 Frから25 Frのサイズで利用でき、25 Frカニューレは通常、ほとんどの成人で十分です。 - 静脈カニューレの先端がIVCの肝内部分と右心房の接合部にあることを、透視法または単純なX線で確認します。
- 通常は反対側の大腿動脈に、修正されたセルディンガー技術を使用して同様の方法で動脈アクセスを取得し、次にマイクロシース(5 Fr)を配置します。
- 柔軟なJチップガイドワイヤー(0.038インチX 180cm)または硬いガイドワイヤーを総大腿動脈に進め、次に大動脈に進めます。
- 拡張器による皮膚および皮下組織の進行性拡張後に、適切なサイズ(15-21 Fr)の動脈カニューレを留置する。
注:カニューレのサイズは、心臓指数が>2.4 L / min / m2になるように選択されます。19 Fr動脈カニューレは、ほとんどの成人に十分なサポートを提供します。ただし、小柄な女性の場合は、小さいサイズのカニューレを使用する必要があります。 - 同側の表在性大腿動脈に順行性灌流のための遠位灌流カテーテル (DPC) を、マイクロパンク針を使用して修正されたセルディンガー法で留置します。5 Fr DPCを導入し、6-7 "延長チューブ26を使用して動脈カニューレのサイドポートに取り付けます。
注:動脈カニューレのサイズが徐々に大きくなると、特に基礎のある末梢血管疾患のある患者において、同側肢の虚血性合併症のリスクが高まります。 - 静脈カニューレと動脈カニューレの両方を、非吸収性の2.0シルク縫合糸で皮膚に縫合することにより、所定の位置に固定します。
注:中央カニューレ挿入は手術室で日常的に行われ、通常は胸骨切開術が必要です。 - 開胸術後に右心房と大動脈の直接カニューレ挿入を行います。巾着紐4.0プロレン縫合糸、スナッガー、スピゴットを使用してこれらを所定の位置に固定します。
- 次に、複数の縫合糸を使用して、キャビティ内からカニューレを胸壁に固定します。
- 閉塞性包帯で胸を開いたままにするか、結論として閉じたままにします。胸部が閉じているときにカニューレを皮膚にトンネルします。
- カニューレ(動脈および静脈)をECMO回路に接続し、呼吸および血行動態のパラメータが達成されるまで血流を増加させます。
3. 開始後の管理
- 患者モニタリング
- 7.5 Fr肺動脈カテーテルを配置して、左心室充填圧の代用として肺動脈圧と肺毛細血管楔圧を定期的に測定することで、臨床上の意思決定を支援します。
注:VA-ECMOは、右心房から静脈血を排出し、酸素化された血液を腸骨動脈/下行大動脈に戻すことにより、右から左へのシャントを作成するため、これは肺水腫を発症するリスクのある患者を特定するのに役立ちます。プリロードは減少しますが、VA-ECMOによるアフターロードの増加は、すでに根本的なLV機能障害があるCS患者の肺水腫のリスクを高める可能性があります。 - ガイドワイヤー27の助けを借りて、マイクロパンクチャー技術を使用して、右橈骨動脈または左橈骨動脈に動脈線を配置します。
注:これは、流域(左心室からの順行性の流れが動脈カニューレからの逆行性の流れと出会う大動脈弓の領域)の位置を決定するのに役立ちます28。 - 右橈骨動脈部位からの酸素飽和度を監視して、上半身(脳および右上肢)の酸素化を評価します。適切な酸素化を確保するために、8〜12時間ごとに動脈血ガス分析を実行します29。
- 酸素供給器でFiO2 を調整し(ノブをダイヤルアップして)、60〜100 mmHg PaO2を維持します。
注:FiO2 は通常、VA-ECMOの開始時に100%に設定され、その後、酸素化が改善するにつれて滴定されます。 - 換気を最適化し、したがって、掃引速度を3〜7 L / minに調整して、呼吸性アシドーシスを補正することにより、二酸化炭素の除去を最適化します。
- 静脈ガス分析30,31により、乳酸、SvO2、トランスアミナーゼ、クレアチニンクリアランスなどの末端臓器灌流のマーカーを連続的に監視する。
注:目標SvO2 は>70%で、乳酸は2.2 mmol / L未満である必要があります。
- 7.5 Fr肺動脈カテーテルを配置して、左心室充填圧の代用として肺動脈圧と肺毛細血管楔圧を定期的に測定することで、臨床上の意思決定を支援します。
- 静脈チャタリングの流れの調整と管理
- 回路を通る流れを調整して、適切な末端器官灌流を可能にします(目標流量は60 cc/kg/min)。ポンプの速度を調整して流れを変えます。カニューレ挿入後、最初は4〜6 L / minの流れを維持します。
注:ポンプの速度が速い、血液量減少、および静脈カニューレの位置がずれていると、静脈のチャタリングが引き起こされ、静脈カニューレの吸引または「一気飲み」として現れます32。静脈のチャタリングは、ポンプのローターが回転し続け、ポンプから血液を排出し続けるため、ポンプヘッドに真空を引き起こし、溶血を引き起こす可能性があります。 - 血液量減少症の場合は、輸液蘇生法により静脈のチャタリングを修正します。.位置がずれたりねじれたりした場合に備えて、静脈カニューレの位置を変えます。高速33,34の場合は、ポンプの速度を下げます。
- 静脈リザーバーまたは折りたたみ式膀胱を流入カニューレに取り付けることにより、静脈のチャタリングを最小限に抑えます。これにより、ポンプに容量を提供することにより、流入カニューレの吸引を減らすことができます。
- 回路を通る流れを調整して、適切な末端器官灌流を可能にします(目標流量は60 cc/kg/min)。ポンプの速度を調整して流れを変えます。カニューレ挿入後、最初は4〜6 L / minの流れを維持します。
- 左心室アンロード
注:逆行性VA-ECMOの流れによる後負荷の増加は、LV拡張末期圧(LVEDP)の上昇につながり、肺水腫を悪化させる可能性があり、LV停止の重症例は停滞した血液からの血栓形成につながる可能性があります35。- LVをアンロードし、アフターロードを減らすには、ドブタミン(開始用量1〜2μg / kg / min)などの強心薬またはヒドララジンや硝酸塩などの血管拡張薬を利用します36,37,38。
注:ただし、これらは通常不十分であり、LVの機械的な荷降ろしが必要になる場合があります。 - 心室支持装置(Impellaなど)または大動脈内バルーンポンプ(IABP)を経皮的に配置して、LVの直接アンロードを実現します。.LVの間接的なアンロードを達成するには、肺動脈カニューレを経皮的に留置するか、バルーン中隔瘻造設術を行います。
注:経中隔左心房ドレナージまたはLV頂点の直接カニューレ挿入を含む外科的技術も、LVアンロード39に採用することができる。
- LVをアンロードし、アフターロードを減らすには、ドブタミン(開始用量1〜2μg / kg / min)などの強心薬またはヒドララジンや硝酸塩などの血管拡張薬を利用します36,37,38。
- 抗 凝固
- カニューレ挿入時に全身性抗凝固療法を開始します。50〜100 IU / kgのIVヘパリン(推奨)のボーラスを使用し、続いて以下のように連続ヘパリンを使用します。.
- 未分画ヘパリンを継続して、活性化部分トロンボプラスチン時間または活性化凝固時間を、検査中(4〜6時間ごと)正常上限の少なくとも1.5倍に維持します。
- ヘパリン誘発性血小板減少症の患者では、ビバリルジン(開始用量0.025-0.05 mg / kg / h)40 またはアルガトロバン(開始用量0.05-2μg / kg / min)41 などの直接トロンビン阻害剤を使用して治療レベルに到達します。.
4. 合併症の予防と管理
- ハーレクイン(南北)症候群
注:上半身の鑑別チアノーゼは、流域(流出カニューレからの酸素化された血液を含む逆行性の流れがLVからの順行性血液と出会う領域)が、付随する呼吸不全の設定で大動脈弓枝血管の起源から遠位にある場合に発生する可能性があります。LVからの脱酸素化された血液は、頸動脈と鎖骨下動脈を介して上半身に供給され、下半身はVA-ECMOの流出カニューレからの血液によって供給されます。この現象は、ハーレクイン症候群または南北症候群(上半身は青、下半身はピンク)と呼ばれます。- この差動チアノーゼは、FiO2 または患者が人工呼吸器を使用している場合は呼気終末陽圧を上げるか、通常は ECMO 回路 (V-A-V ECMO) の動脈肢に接続された内頸静脈に導入された別のカニューレを介して、酸素化された血液を右心房に戻すことにより、LV に戻る血液の酸素飽和度を増加させることによって管理します。
- 右橈骨動脈からの動脈ガス分析(ABG)を使用して、8〜12時間ごとに上半身の酸素化飽和を監視します。ABG42 では 60-100 mmHg の PaO2 で十分な組織酸素化が保証されます。
- 下肢虚血
注:末梢動脈カニューレ挿入の最も深刻な合併症の1つは、下肢の順行性虚血であり、これはまれにコンパートメント症候群を引き起こし、極端な状況では切断が必要になる場合があります43。四肢虚血の発生率は変動し、10%から70%の範囲であり、さまざまな研究によって報告されている44。- 超音波検査で大腿動脈の直径に基づいて適切なサイズのカニューレを選択することで、下肢の虚血性合併症を減少させる可能性があります。
- シリアルパルスドップラーまたは近赤外分光法(NIRS)44を使用して、カニューレ挿入後の下肢循環をモニターします。NIRSは、組織酸素にアクセスするための非侵襲的なイメージングツールです45。
- NIRSを使用して、下肢組織の酸素化の継続的な評価を実行します。酸素濃度計に接続されたふくらはぎの筋肉にセンサーパッドを置くと、灌流の指標である組織の酸素化の変化を簡単に検出できます。
- ECMOカニューレ挿入時に表在性大腿動脈に順行性灌流カテーテル(5-7 Fr)を挿入して、下肢の虚血性合併症を予防します。
- 出血と溶血
注:VA-ECMO開始後には、少量の溶血が一般的です。重大な溶血の原因には、ポンプ血栓症やECMO回路の凝固などがあります。- 臨床的に重要な溶血がないか注意深く監視します。.ヘモグロビンレベル、乳酸デヒドロゲナーゼ、ビリルビン、クレアチニンを毎日測定します。
- 重度の出血と血小板減少症の患者では、全身性抗凝固療法を中断することを検討する46。ただし、これにより血栓性合併症のリスクが高まる可能性があります。したがって、抗凝固薬を投与する前に、出血と血栓症のリスクを慎重に評価する必要があります。.
- 空気塞栓症
注:ECMO回路への空気の閉じ込めは、接続の緩み、末梢静脈または中心静脈へのアクセス、または人工肺膜47の破裂から発生する可能性があります。気泡が脳循環に入ると脳卒中を引き起こす可能性のある空気塞栓症を引き起こす可能性があります。- 換気サポートを受けている間、患者をトレンデレンブルグの位置に置き、ECMO回路をクランプして空気塞栓症を管理します
- 空気塞栓症が疑われる場合は、回路を空気抜きして再プライミングします。場合によっては、回路全体の交換が必要になることがあります。
5. ECMOからの離脱
- VA-ECMOの使用を促した最初の侮辱から回復したら、患者の離乳を評価します。
注:付随する呼吸不全は、離乳前に解決されている必要があります。. - 連続心エコー図を実施して、心機能の改善と離乳の準備を評価します。
- VA-ECMOから患者を引き離す前に、血行動態の安定性を確認してください。
注: 患者は少なくとも 24 時間脈動性動脈波形を回復している必要があり、平均動脈圧は、低用量昇圧剤が48 を使用しない場合、または低用量の昇圧剤を使用する場合で >60 mmHg である必要があります。 - 離乳中に、ECMOの流れが最小1〜1.5 L / minまで徐々に減少する心エコーターンダウン研究を実施します。.血行動態の安定性を確保し、心エコー図で心機能を評価します。
注: 左心室 (LV) 駆出率 >20%-25%、大動脈速度-時間積分 >10 cm、ターンダウン研究中の側僧帽弁輪の最大収縮期速度 >6 cm/s は、離乳成功の予測因子です49。 - 患者が離乳している間、乳酸、SvO2、腎機能などの末端臓器灌流の検査パラメータを監視します。
- 離脱プロセスを容易にするために、抜管前に患者とECMO回路との間に簡略化された離脱ブリッジ50 を配置する(このステップはオプションである)。
注:ウィーニングブリッジにより、患者はECMOサポートから離れて観察でき、必要なときに数分でECMO回路を再びオンにする機会を提供します。これは、流入カニューレと流出カニューレを接続する長いチューブで構成されています。 - 離乳ブリッジの近位にある流入カニューレと流出カニューレの両方にクランプを配置し、患者をECMO回路から分離し、血液がECMO回路内で再循環できるようにします。
- 回路をクランプした後、カニューレ挿入の最大24時間前に患者を観察します。血行動態のサポートが必要な場合は、チューブクランプを取り外すだけでECMOの流れを再開します。
- 離乳をさらに強化するには、最大5 L / minの流量を提供できる心室支持装置(Impellaなど)を使用します。.心室支持装置からの流量を増やし、血行動態の安定性を確保しながら、VA-ECMOの流れを体系的に下げます。
注:心室支持装置の利点の1つは、腋窩アプローチを使用して埋め込むことができるため、VA-ECMO51の除去後の早期歩行が可能になることです。 - 患者がVA-ECMOの除去の候補と見なされたら、手術室または心臓カテーテル検査室で抜管術を行います。
注: 末梢動脈カニューレ挿入術を受けたほとんどの患者は、ある程度の血管修復が必要になります。
結果
難治性CSにおけるVA-ECMOの使用後の退院までの生存率は、さまざまな観察研究によって報告されているように、28〜67%13,15,52,53,54,55,56の範囲です(表1)。結果は、CSの病因によって異なります。ELSO登録では、1990年から2015年にかけて、9,025人の成人が体外生命維持法(ECLS)で支援されました。CSはECLSの使用に関連する最も一般的な診断であり、退院までの生存率はわずか42%でした10。心筋炎の成人の生存率が最も高く(65%)、先天性心疾患の成人の生存率が最も低かった(37%)。心切開後のCSは、VA-ECMOの開始後に院内転帰が悪化した別の集団を表しており、院内生存率は30〜40%の範囲です53,54。17件の研究のメタアナリシスでは、VA-ECMOにおける左室除荷は、除雪がない場合と比較して死亡率の低下と関連していることが示された57。VA-ECMO自体によるさまざまな合併症は、CSに関連する罹患率と死亡率の増加につながる可能性があります。たとえば、ECMO58,59 の患者の 45-60% で出血イベントが認められ、活性化部分トロンボプラスチン時間が長いほど出血性合併症のリスクが高くなります。難治性CSにおけるVA-ECMO使用後の長期生存を評価した44件の研究60件の最近のメタアナリシスでは、1年および5年での生存期間の合計がそれぞれ36.7%および29.9%であることが示された。したがって、CS 患者のレスキュー モダリティとして VA-ECMO を使用しているにもかかわらず、院内および長期の死亡率は依然として高いままです。さらに、VA-ECMOの離脱が成功すると必ずしも生存が予測されるとは限らないことを示唆する証拠もあります48。VA-ECMOからの離脱に成功した患者の院内死亡率は約25%61です。117人の患者を対象とした最近の多施設無作為化比較ECMO-CS試験では、ステージD-Eショックに対するVA-ECMOの早期使用は、血行動態が悪化した場合にVA-ECMOの下流使用を許可した早期の保存的管理と比較して、臨床転帰を改善しないことが示されました62。対照的に、単一施設のランダム化比較ARREST試験63では、院外心停止および難治性心室細動に対する早期ECMO促進蘇生法が、標準的な進行性心血管生命維持法(ACLS)治療と比較して退院までの生存率を改善したことが示された。今後の研究では、VA-ECMOの離脱および抜管後に有害事象のリスクがある患者を特定することに焦点を当てるべきです。
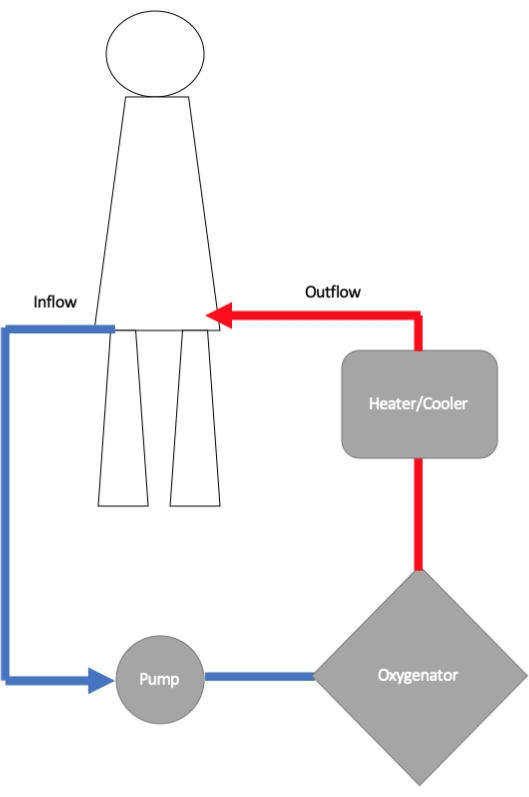
図1:静脈動脈体外式膜型人工肺(VA-ECMO)回路のさまざまなコンポーネントを示す概略図。 流入カニューレは、体から血液をECMOポンプに運び、そこから血液は酸素化のために酸素供給器に送られます。血液の温度は、大口径動脈(最も一般的には大腿動脈)に挿入された流出カニューレを介して体に戻される前に最適化されます。この図の拡大版を表示するには、ここをクリックしてください。
| 著者、年 | 国 | 設計 | 総患者数(n) | 心原性ショックの病因 | 院内生存率(%) | ||
| 阿蘇, 201615 | 日本 | 回顧 展 | 4658 | 虚血性心疾患、心不全、心臓弁膜症、心筋炎 | 26.4 | ||
| スミス、201752 | グローバル | 回顧 展 | 2699 | 心筋炎、冠動脈疾患、構造的心疾患、心臓移植後、心室補助装置など | 41.4 | ||
| 陳, 201753 | 台湾 | 回顧 展 | 1141 | 心切開後のショック | 38.3 | ||
| チアガラジャン、201710 | 米国 | 回顧 展 | 9025 | 多因子 | 42 | ||
| ラスタン、201054 | ドイツ | 回顧 展 | 517 | 冠動脈バイパス術、弁手術、冠動脈バイパス術と弁手術、胸部臓器移植、その他 | 24.8 | ||
表1:静脈動脈体外式膜型人工肺(VA-ECMO)を受けた心原性ショック(CS)患者における院内生存を報告する観察研究を選択。 これらの研究は、ECMOを必要とする患者の院内生存率が24.8〜42%の範囲であると低いままであることを強調しています。
ディスカッション
このプロトコルでは、難治性 CS 患者における VA-ECMO の開始と維持に関与するさまざまな手順について説明します。VA-ECMOの使用による主要な合併症、離脱パラメータ、および転帰のいくつかについても議論されています。
VA-ECMOは通常、他の管理戦略がCSで適切な血行動態サポートを提供できない場合のレスキュー療法として使用されます。カニューレ挿入には、血管損傷と出血リスクを最小限に抑えるために細心の注意を払って実施する必要がある大口径の血管アクセスが含まれます。VA-ECMOが開始されたら、ECMO回路の取り扱いに関する専門的なトレーニングを受けた灌流医と看護師を備えた心血管集中治療室で患者を監視する必要があります。患者は毎日離乳について評価されるべきであり、心臓の回復が起こったら、または合併症を最小限に抑えるためにより決定的な治療法が特定されたときに、できるだけ早く抜管を行う必要があります。.
VA-ECMOの利用は、過去20年間で大幅に増加し、適応症のリストは拡大しています。利用可能性と使用率の増加にもかかわらず、CSの死亡率は依然として高いままです。患者の選択は、VA-ECMOに関連する合併症を軽減しながら、リソースの賢明な配分を確保するために重要です。VA-ECMOを受けている患者の生存を予測するために、いくつかのスコアリングシステムが開発されています。静脈動脈-ECMO(SAVE)スコア61 後の生存率は、ELSOレジストリからのデータを使用して作成され、VA-ECMO開始前の患者の生存を予測するのに役立ちます。スコアリングは、CS、年齢、体重、急性臓器不全 (腎臓、肝臓、および/または中枢神経系)、慢性腎不全、挿管期間、ピーク吸気圧、拡張期および平均脈圧、心停止、および重炭酸塩値の病因に基づいて行われます。SAVEスコアに基づいて、患者は5つの異なるリスククラス(クラスIからV)にリスク層別化されます。スコアが低いほど、リスククラスが高く、院内生存率が低くなります。このスコアリングシステムは、161人のオーストラリアの患者でも外部から検証され、投与操作特性曲線の下の面積が0.90(95%信頼区間が0.85〜0.95)で優れた識別を示しました。その後、乳酸を組み込んだ修正 SAVE スコア64 が開発され、救急科に到着してから 24 時間以内に VA-ECMO 開始を受ける患者において優れた転帰予測を示すことが示されました。1時間、6時間、12時間でのポイントオブケアバイオマーカー(乳酸、pH、および重炭酸塩濃度)測定を利用したPREDICT VA-ECMO score65 と呼ばれる別の簡略化された予後診断ツールが最近開発され、検証されました。VA-ECMO後に有害事象のリスクがある患者集団を特定し、その後のより決定的な治療法の利用は、引き続き関心のある分野です。
CS の診断後に VA-ECMO を早期に開始すると、生存率が向上する可能性があることを示唆する証拠は限られています13。Ostadal et al.によるECMO-CS試験では、早期のVA-ECMO療法を受けた患者と保守的戦略を受けた患者では、いかなる原因による死亡率にも差は示されなかった62。ただし、これはまだランダム化された方法で検証されていません。心原性ショックにおける不良な転帰を改善するための新規戦略の価値とその費用対効果のテスト (EUROSHOCK) 試験 (ClinicalTrials.gov 識別子: NCT03813134) は、進行中の無作為化臨床試験であり、CS 患者における ECMO の早期開始が標準治療と比較して 30 日間の生存率を改善するかどうかを評価します。同様に、心原性ショックにおける体外生命維持 (ECLS-SHOCK) 試験 (ClinicalTrials.gov 識別子: NCT03637205) では、血行再建術と内科療法に加えて ECLS が有益であるかどうかを調べます。これは、CS によって複雑化された AMI での ECLS を使用しない場合と比較して、血行再建術と治療に加えて有益です。
開示事項
John Um は、Abbott Laboratories のコンサルタントであり、Medtronic のコンサルタントです。Poonam Velagapudiは、Abiomed、Medtronic、Opsens、Shockwave Medicalからの講演料の受け取りと、AbiomedとSanofiの諮問委員会への参加料を開示しています。他の著者は何も開示していません。
謝辞
何一つ。
資料
| Name | Company | Catalog Number | Comments |
| Amplatz Super Stiff guidewire | Boston Scientific | 46-500, 46-501, 46-502. 46-503, 46-504, 46-517, 46-519, 46-520, 46-523, 46-525, 46-526, 46-563, 46-564, 46-509, 46-510, 46-518, 46-524 | Allows delivery of catheters across tortuous anatomies |
| Impella | Abiomed | Impella 2.5, Impella CP, Impella 5.0, Impella 5.5, Impella RP | Percutaneously inserted left ventricular assist device that provides hemodynamic support in cardiogenic shock |
| Inflow Cannula | Surge Cardiovascular | FEM-V1020, FEM-V1022, FEM-V1024, FEM-V1026,FEM-V1028 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus 96600-019,021,023,025,027,029 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus Femoral Venous 96670 - 017,019, 021, 023 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus Multi-Stage Femoral Venous 96880-019,021,025 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus NextGen 96600 - 115, 117, 119, 121, 123, 125, 127, 129 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Carmeda Biomedicus CB96605-015,017,019,021,023,025,29 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Cortiva Biomedicus Femoral Venous CB96670-015,017,019,021 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | DLP Carmeda Venous CB75008, CB66112, CB66114, CB66116, CB66118, CB66120, CB66122,CB66124 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | Avalon Elite Bicaval - 10013, 10016, 10019, 10020, 10023, 10027, 10031 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous Bioline - BE PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous Softline - BO PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous - PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Life Support Bio-Medicus Drainage Catheter and Introducers - LS96218 - 015, 017, 019, 021, 023, 025 ; LS96438 - 021, 023, 025, LS 96555 - 019, 021, 023, 025, LS 96355 - 021, LS96360 -023, 025, 027, 029 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Fresenius | Medos Femoral Cannula MEFKV 18,20,22,24,26,28 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Medtronic 2 stage venous - 91228, 91240, 91246, 91236,91251 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Senko/Mera | PCKC-V-24, PCKC-V2-18, PCKC-V-18, PCKC-V2-20, PCKC-V-20, PCKC-V-22, PCKC-V2-24, PCKC-V-24 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | TandemLife/Livanova | 29,31 Fr | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Freelife Medical | FLK V19 B18, FLK V19 B18R, FLK VV 19R, FLK V20 B20, FLK V20 B20R, FLK V19 B20, FLK V19 B20R, FLK V20 B22, FLK V20 B22R, FLK V10S B22, FLK V19 B22, FLK V19 B22R, FLK V10 B22, FLK V10 B22R, FLK V10S B22R, FLK VV 23R, FLK V10S B24, FLK V10S B24R, FLK V10 B24, FLK V10 B24R, FLK V10S B26, FLK V10S B26R, FLK V10 B26, FLK V10 B26R, FLK VV 27R, FLK VV 31R | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | LivaNova | Sorin right angle venous - 10, 12, 14, 16, 18, 20, 22, 24, 28 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Terumo | CX-EB18VLX, CX-EB21VLX | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus Arterial 96530 - 015,017, 019, 021, 023, 025, | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus Femoral Arterial 96570 - 015, 017, 019, 021 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus NextGen Arterial 96530 -115, 117, 119, 121, 123, 125, 96570 - 115, 117, 119, 121 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Carmeda Biomedicus CB96535 - 015, 017, 019, 021, 023 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Cortiva Biomedicus Femoral Arterial CB96570 -015, 017, 019, 021 | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | PAS 1315, PAS 1515, PAS 1523, PAS 1717, PAL 1723, PAL 1923, PAL 2115, PAL 2123, PAL 2315, PAL 2323 | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | Bioline BE PAS 1315, BE PAS 1515, BE PAL 1523, BE PAL 1723, BE PAS 1915, BE PAL 1923, BE PAS 2115, BE PAL 2123, BE PAS 2315, BE PAL 2323, | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | Softline BO PAS 1315, BO PAS 1515, BO PAL 1523, BO PAS 1715, BO PAL 1723, BO PAS 1915, BO PAL 1923, BO PAS 2115, BO PAL 2123, BO PAL 2323 | Returns oxygenated blood to the body |
| Outflow Cannula | Fresenius | Medos Femoral Arterial Cannula; MEFKA 16, 18, 20, 22,24 | Returns oxygenated blood to the body |
| Outflow Cannula | Senko/Mera | PCKC-A-20, PCKC-A-16, PCKC-A-18 | Returns oxygenated blood to the body |
| Outflow Cannula | Freelife Medical | FLK A18 D16, FLK A18L D16, FLK A18L D16R, FLK A18 D16R, FLK A44 D18, FLK A44 D18R, FLK A18 D18, FLK A18L D18, FLK A18L D18R, FLK A18 D18R, FLK A44 D20, FLK A44 D20R, FLK A18 D20, FLK A18L D20, FLK A18L D20R, FLK A18 D20R, FLK A18 D22, FLK A18L D22, FLK A18L D22R, FLK A18 D24, FLK A18L D24, FLK A18L D24R, FLK A18 D24R | Returns oxygenated blood to the body |
| Outflow Cannula | LivaNova | Sorin arterial - 14, 17, 19, 21, 23 Fr | Returns oxygenated blood to the body |
| Outlflow Cannula | Medtronic Cardiopulmonary | Life Support Bio-Medicus Return Catheter and Introducers - LS96010-009, LS96010-011, LS96010-013, LS96010-015, LS96218-015, LS96218-017, LS96218-019, LS96218-021, LS96218-023, LS96218-025 | Returns oxygenated blood to the body |
| Oxygenator | Abbott | Eurosets | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Oxygenator | Getinge | MaquetHLS Set Advanced v 5.0, v 7.0, Maquet Quadrox iD | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Oxygenator | Medtronic | Nautilus | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Pump | Abiomed | Breethe | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | Alcard ALC 250 | Generates force to deliver oxygenated blood back to the body |
| Pump | Baxter | Century Roller Pump | Generates force to deliver oxygenated blood back to the body |
| Pump | Medtronic Cardiopulmonary | Biomedicus BP50, BP80 Centrifugal | Generates force to deliver oxygenated blood back to the body |
| Pump | Braile Biomedica | Safyre | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | CiSet | Generates force to deliver oxygenated blood back to the body |
| Pump | Abbott | CentriMag | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | Cobe 6" Roller | Generates force to deliver oxygenated blood back to the body |
| Pump | Origen | FloPump 32 | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | HIT Set Advanced Softline 5.0 and 7.0 | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | LifeSPARC | Generates force to deliver oxygenated blood back to the body |
| Pump | Senko/Mera | Centrifugal pump head | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | HLS Set Advanced Bioline 5.0 and 7.0 | Generates force to deliver oxygenated blood back to the body |
| Tandem Heart | LivaNova | Tandem Heart LS | Percutaneously inserted left ventricular assist device |
参考文献
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- Goldberg, R. J., Spencer, F. A., Gore, J. M., Lessard, D., Yarzebski, J. Thirty-year trends (1975 to 2005) in the magnitude of, management of, and hospital death rates associated with cardiogenic shock in patients with acute myocardial infarction: a population-based perspective. Circulation. 119 (9), 1211-1219 (2009).
- Hochman, J. S., et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. The New England Journal of Medicine. 341 (9), 625-634 (1999).
- Hochman, J. S., et al. One-year survival following early revascularization for cardiogenic shock. JAMA. 285 (2), 190-192 (2001).
- Schumann, J., et al. Inotropic agents and vasodilator strategies for the treatment of cardiogenic shock or low cardiac output syndrome. The Cochrane Database of Systematic Reviews. 1 (1), 009669 (2018).
- Léopold, V., et al. Epinephrine and short-term survival in cardiogenic shock: an individual data meta-analysis of 2583 patients. Intensive Care Medicine. 44 (6), 847-856 (2018).
- De Backer, D., et al. Comparison of dopamine and norepinephrine in the treatment of shock. The New England Journal of Medicine. 362 (9), 779-789 (2010).
- Strom, J. B., et al. National trends, predictors of use, and in-hospital outcomes in mechanical circulatory support for cardiogenic shock. EuroIntervention. 13 (18), 2152-2159 (2018).
- Stentz, M. J., et al. Trends in extracorporeal membrane oxygenation growth in the United States, 2011-2014. ASAIO Journal. 65 (7), 712-717 (2019).
- Thiagarajan, R. R., et al. Extracorporeal life support organization registry international report 2016. ASAIO Journal. 63 (1), 60-67 (2017).
- Lequier, L., Horton, S. B., McMullan, D. M., Bartlett, R. H. Extracorporeal membrane oxygenation circuitry. Pediatric Critical Care Medicine. 14 (5), 7-12 (2013).
- Schmidt, M., et al. Blood oxygenation and decarboxylation determinants during venovenous ECMO for respiratory failure in adults. Intensive Care Medicine. 39 (5), 838-846 (2013).
- Sheu, J. J., et al. Early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention improved 30-day clinical outcomes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Critical Care Medicine. 38 (9), 1810-1817 (2010).
- Belohlavek, J., et al. Veno-arterial ECMO in severe acute right ventricular failure with pulmonary obstructive hemodynamic pattern. The Journal of Invasive Cardiology. 22 (8), 365-369 (2010).
- Aso, S., Matsui, H., Fushimi, K., Yasunaga, H. In-hospital mortality and successful weaning from venoarterial extracorporeal membrane oxygenation: analysis of 5,263 patients using a national inpatient database in Japan. Critical Care. 20, 80 (2016).
- Asaumi, Y., et al. Favourable clinical outcome in patients with cardiogenic shock due to fulminant myocarditis supported by percutaneous extracorporeal membrane oxygenation. European Heart Journal. 26 (20), 2185-2192 (2005).
- Religa, G., Jasińska, M., Czyżewski, &. #. 3. 2. 1. ;., Torba, K., Różański, J. The effect of the sequential therapy in end-stage heart failure (ESHF)-from ECMO, through the use of implantable pump for a pneumatic heart assist system, Religa Heart EXT, as a bridge for orthotopic heart transplant (OHT). Case study. Annals of Transplantation. 19, 537-540 (2014).
- Meani, P., et al. Long-term survival and major outcomes in post-cardiotomy extracorporeal membrane oxygenation for adult patients in cardiogenic shock. Annals of Cardiothoracic Surgery. 8 (1), 116-122 (2019).
- Bartos, J. A., et al. Improved survival with extracorporeal cardiopulmonary resuscitation despite progressive metabolic derangement associated with prolonged resuscitation. Circulation. 141 (11), 877-886 (2020).
- Brooks, S. C., et al. Part 6: Alternative techniques and ancillary devices for cardiopulmonary resuscitation. Circulation. 132 (18), 436-443 (2015).
- Guglin, M., et al. Venoarterial ECMO for adults: JACC scientific expert panel. Journal of the American College of Cardiology. 73 (6), 698-716 (2019).
- Lorusso, R., et al. Venoarterial extracorporeal membrane oxygenation for refractory cardiogenic shock in elderly patients: Trends in application and outcome from the Extracorporeal Life Support Organization (ELSO) Registry. The Annals of Thoracic Surgery. 104 (1), 62-69 (2017).
- Tehrani, B. N., et al. Standardized team-based care for cardiogenic shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Pavlushkov, E., Berman, M., Valchanov, K. Cannulation techniques for extracorporeal life support. Annals of Translational Medicine. 5 (4), 70 (2017).
- Burrell, A. J. C., Ihle, J. F., Pellegrino, V. A., Sheldrake, J., Nixon, P. T. Cannulation technique: femoro-femoral. Journal of Thoracic Disease. 10, 616-623 (2018).
- Lamb, K. M., et al. Arterial protocol including prophylactic distal perfusion catheter decreases limb ischemia complications in patients undergoing extracorporeal membrane oxygenation. Journal of Vascular Surgery. 65 (4), 1074-1079 (2017).
- Pancholy, S. B., Shah, S., Patel, T. M. Radial artery access, hemostasis, and radial artery occlusion. Interventional Cardiology Clinics. 4 (2), 121-125 (2015).
- Hoeper, M. M., et al. Extracorporeal membrane oxygenation watershed. Circulation. 130 (10), 864-865 (2014).
- Chung, M., Shiloh, A. L., Carlese, A. Monitoring of the adult patient on venoarterial extracorporeal membrane oxygenation. The Scientific World Journal. 2014, 393258 (2014).
- Mungan, &. #. 3. 0. 4. ;., Kazancı, B. &. #. 3. 5. 0. ;., Ademoglu, D., Turan, S. Does lactate clearance prognosticates outcomes in ECMO therapy: a retrospective observational study. BMC Anesthesiology. 18 (1), 152 (2018).
- Su, Y., et al. Hemodynamic monitoring in patients with venoarterial extracorporeal membrane oxygenation. Annals of Translational Medicine. 8 (12), 792 (2020).
- Walter, J. M., Kurihara, C., Corbridge, T. C., Bharat, A. Chugging in patients on veno-venous extracorporeal membrane oxygenation: An under-recognized driver of intravenous fluid administration in patients with acute respiratory distress syndrome. Heart & Lung. 47 (4), 398-400 (2018).
- Kim, H., et al. Permissive fluid volume in adult patients undergoing extracorporeal membrane oxygenation treatment. Critical Care. 22 (1), 270 (2018).
- Kalbhenn, J., Maier, S., Heinrich, S., Schallner, N. Bedside repositioning of a dislocated Avalon-cannula in a running veno-venous ECMO. Journal of Artificial Organs. 20 (3), 285-288 (2017).
- Weber, C., et al. Left ventricular thrombus formation in patients undergoing femoral veno-arterial extracorporeal membrane oxygenation. Perfusion. 33 (4), 283-288 (2018).
- Tariq, S., Aronow, W. S. Use of inotropic agents in treatment of systolic heart failure. International Journal of Molecular Sciences. 16 (12), 29060-29068 (2015).
- Thiele, H., Ohman, E. M., Desch, S., Eitel, I., de Waha, S. Management of cardiogenic shock. European Heart Journal. 36 (20), 1223-1230 (2015).
- Mason, D. T. Afterload reduction in the treatment of cardiac failure. Schweizerische Medizinische Wochenschrift. 108 (44), 1695-1703 (1978).
- Meani, P., et al. Modalities and effects of left ventricle unloading on extracorporeal life support: A review of the current literature. European Journal of Heart Failure. 19, 84-91 (2017).
- Taylor, T., Campbell, C. T., Kelly, B. A review of bivalirudin for pediatric and adult mechanical circulatory support. American Journal of Cardiovascular Drugs. 21 (4), 395-409 (2021).
- Geli, J., Capoccia, M., Maybauer, D. M., Maybauer, M. O. Argatroban anticoagulation for adult extracorporeal membrane oxygenation: A systematic review. Journal of Intensive Care Medicine. 37 (4), 459-471 (2022).
- Patel, B., Arcaro, M., Chatterjee, S. Bedside troubleshooting during venovenous extracorporeal membrane oxygenation (ECMO). Journal of Thoracic Disease. 11, 1698-1707 (2019).
- Cheng, R., et al. Complications of extracorporeal membrane oxygenation for treatment of cardiogenic shock and cardiac arrest: a meta-analysis of 1,866 adult patients. The Annals of Thoracic Surgery. 97 (2), 610-616 (2014).
- Bonicolini, E., et al. Limb ischemia in peripheral veno-arterial extracorporeal membrane oxygenation: a narrative review of incidence, prevention, monitoring, and treatment. Critical Care. 23 (1), 266 (2019).
- Moerman, A., Wouters, P. Near-infrared spectroscopy (NIRS) monitoring in contemporary anesthesia and critical care. Acta Anaesthesiologica Belgica. 61 (4), 185-194 (2010).
- Chung, Y. S., et al. Is stopping heparin safe in patients on extracorporeal membrane oxygenation treatment. ASAIO Journal. 63 (1), 32-36 (2017).
- Kumar, A., Keshavamurthy, S., Abraham, J. G., Toyoda, Y. Massive air embolism caused by a central venous catheter during extracorporeal membrane oxygenation. The Journal of Extra-Corporeal Technology. 51 (1), 9-11 (2019).
- Ortuno, S., et al. Weaning from veno-arterial extracorporeal membrane oxygenation: which strategy to use. Annals of Cardiothoracic Surgery. 8 (1), 1-8 (2019).
- Aissaoui, N., et al. Predictors of successful extracorporeal membrane oxygenation (ECMO) weaning after assistance for refractory cardiogenic shock. Intensive Care Medicine. 37 (11), 1738-1745 (2011).
- Vida, V. L., et al. Extracorporeal membrane oxygenation: the simplified weaning bridge. The Journal of Thoracic and Cardiovascular Surgery. 143 (4), 27-28 (2012).
- Esposito, M. L., Jablonksi, J., Kras, A., Krasney, S., Kapur, N. K. Maximum level of mobility with axillary deployment of the Impella 5.0 is associated with improved survival. The International Journal of Artificial Organs. 41 (4), 236-239 (2018).
- Smith, M., et al. Duration of veno-arterial extracorporeal life support (VA ECMO) and outcome: an analysis of the Extracorporeal Life Support Organization (ELSO) registry. Critical Care. 21 (1), 45 (2017).
- Chen, S. W., et al. Long-term outcomes of extracorporeal membrane oxygenation support for postcardiotomy shock. The Journal of Thoracic and Cardiovascular Surgery. 154 (2), 469-477 (2017).
- Rastan, A. J., et al. Early and late outcomes of 517 consecutive adult patients treated with extracorporeal membrane oxygenation for refractory postcardiotomy cardiogenic shock. The Journal of Thoracic and Cardiovascular Surgery. 139 (2), 302-311 (2010).
- Tsao, N. W., et al. Extracorporeal membrane oxygenation-assisted primary percutaneous coronary intervention may improve survival of patients with acute myocardial infarction complicated by profound cardiogenic shock. Journal of Critical Care. 27 (5), 1-11 (2012).
- Sakamoto, S., Taniguchi, N., Nakajima, S., Takahashi, A. Extracorporeal life support for cardiogenic shock or cardiac arrest due to acute coronary syndrome. The Annals of Thoracic Surgery. 94 (1), 1-7 (2012).
- Russo, J. J., et al. Left ventricular unloading during extracorporeal membrane oxygenation in patients with cardiogenic shock. Journal of the American College of Cardiology. 73 (6), 654-662 (2019).
- Ou de Lansink-Hartgring, A., de Vries, A. J., Droogh, J. H., vanden Bergh, W. M. Hemorrhagic complications during extracorporeal membrane oxygenation-The role of anticoagulation and platelets. Journal of Critical Care. 54, 239-243 (2019).
- Aubron, C., et al. Predictive factors of bleeding events in adults undergoing extracorporeal membrane oxygenation. Annals of Intensive Care. 6 (1), 97 (2016).
- Chang, W. W., et al. Predictors of mortality in patients successfully weaned from extracorporeal membrane oxygenation. PLoS One. 7 (8), 42687 (2012).
- Schmidt, M., et al. Predicting survival after ECMO for refractory cardiogenic shock: the survival after veno-arterial-ECMO (SAVE)-score. European Heart Journal. 36 (33), 2246-2256 (2015).
- Ostadal, P., et al. Extracorporeal Membrane Oxygenation in the Therapy of Cardiogenic Shock: Results of the ECMO-CS Randomized Clinical Trial. Circulation. , (2022).
- Yannopoulos, D., et al. Advanced reperfusion strategies for patients with out-of-hospital cardiac arrest and refractory ventricular fibrillation (ARREST): a phase 2, single centre, open-label, randomised controlled trial. Lancet. 396 (10265), 1807-1816 (2020).
- Chen, W. C., et al. The modified SAVE score: predicting survival using urgent veno-arterial extracorporeal membrane oxygenation within 24 hours of arrival at the emergency department. Critical Care. 20 (1), 336 (2016).
- Wengenmayer, T., et al. Development and validation of a prognostic model for survival in patients treated with venoarterial extracorporeal membrane oxygenation: the PREDICT VA-ECMO score. European Heart Journal. Acute Cardiovascular Care. 8 (4), 350-359 (2019).
- Huitema, A. A., Harkness, K., Heckman, G. A., McKelvie, R. S. The spoke-hub-and-node model of integrated heart failure care. The Canadian Journal of Cardiology. 34 (7), 863-870 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved