Method Article
Веноартериальная экстракорпоральная мембранная оксигенация при кардиогенном шоке
В этой статье
Резюме
В следующей статье освещаются различные этапы, связанные с инициацией и поддержанием веноартериальной экстракорпоральной мембранной оксигенации у пациентов с кардиогенным шоком.
Аннотация
Кардиогенный шок (КС) – это клиническое состояние, характеризующееся недостаточной перфузией тканей на фоне низкого сердечного выброса. КС является основной причиной смерти после острого инфаркта миокарда (ОИМ). Для гемодинамической поддержки при КС доступно несколько временных механических вспомогательных устройств до тех пор, пока не наступит клиническое выздоровление или пока не будут выполнены более точные хирургические процедуры. Веноартериальная (ВА) экстракорпоральная мембранная оксигенация (ЭКМО) превратилась в мощный вариант лечения для краткосрочной поддержки кровообращения при рефрактерной ХС. В отсутствие рандомизированных клинических испытаний использование ЭКМО основывалось на клиническом опыте и на данных регистров и обсервационных исследований. Выживаемость до выписки из больницы с применением ВА-ЭКМО колеблется в пределах 28-67%. Для начала ЭКМО требуется канюляция вен и артерий, которая может быть выполнена либо чрескожно, либо хирургическим путем. Компоненты контура ЭКМО включают входную канюлю, которая забирает кровь из венозной системы, насос, оксигенатор и выходную канюлю, которая возвращает кровь в артериальную систему. Рекомендации по лечению после начала ЭКМО включают системную антикоагулянтную терапию для предотвращения тромбоза, стратегии разгрузки левого желудочка для ускорения восстановления миокарда, профилактику ишемии конечностей с помощью дистального перфузионного катетера в случаях канюляции бедренной артерии и профилактику других осложнений, таких как гемолиз, воздушная эмболия и синдром Арлекина. ЭКМО противопоказана пациентам с неконтролируемым кровотечением, неисправленным расслоением аорты, тяжелой аортальной недостаточностью, а также в бесполезных случаях, таких как тяжелая неврологические травмы или метастатические злокачественные новообразования. При рассмотрении пациентов для проведения ЭКМО рекомендуется использовать мультидисциплинарный подход ударной бригады. В текущих исследованиях будет оцениваться, улучшает ли добавление рутинной ЭКМО выживаемость у пациентов с ОИМ с КС, перенесших реваскуляризацию.
Введение
Кардиогенный шок (КС) – это клиническое состояние, характеризующееся недостаточной перфузией тканей на фоне низкого сердечного выброса. Несмотря на достижения в области реперфузионной терапии, острый инфаркт миокарда (ОИМ) остается основной причиной ХС. Согласно анализу Национальной выборки стационарных пациентов (NIS), которая собирает данные примерно о 20% всех госпитализаций в Соединенных Штатах, 55,4% из 144 254 случаев КС в период с 2005 по 2014 год были вторичными по отношению к ОИМ1. Другие этиологии КС включают декомпенсированную сердечную недостаточность, фульминантный миокардит, посткардиотомический шок и тромбоэмболию легочной артерии (ТЭЛА). КС ассоциирован с высоким уровнем госпитальной смертности, колеблющимся в пределах 45-65%1,2. Таким образом, быстрая идентификация КС и коррекция обратимых причин имеет решающее значение для улучшения выживаемости пациентов. Например, исследование «Должны ли мы в срочном порядке реваскуляризировать окклюзированные коронарные артерии для кардиогенного шока» (SHOCK) показало, что стратегия ранней реваскуляризации была связана с лучшей выживаемостью через 6 месяцев3 и 1 год4 по сравнению со стратегией начальной медицинской стабилизации у пациентов с осложнением ОИМ КС.
Вазопрессоры и инотропы могут быть использованы для коррекции гипотензии, связанной с КС, но ни один из них непоказал никакой пользы для смертности. С другой стороны, устройства краткосрочной механической поддержки кровообращения (MCS) могут обеспечить гемодинамическую поддержку у пациентов с рефрактерным КС в качестве моста к выздоровлению или в качестве моста к более определенной терапии. В последнее десятилетие использование MCS увеличилось; тем не менее, частота госпитализаций по поводу КС опережает использование MCS8. Тенденция к снижению использования внутриаортальных баллонных насосов (IABP) была компенсирована относительным увеличением применения внутрисосудистых микроаксиальных вспомогательных устройств левого желудочка (LVAD) (например, Impella и TandemHeart) и веноартериальной экстракорпоральной мембранной оксигенации (VA-ECMO).
ВА-ЭКМО может генерировать потоки до 4-6 л/мин и его применение в КС приобрело значительную популярность9. Согласно глобальному реестру, который ведет Организация экстракорпорального жизнеобеспечения (ELSO), использование ВА-ЭКМО увеличилось с менее чем 500 пробежек в год до 2010 года до 2157 пробежек в 2015 году. Тем не менее, ВА-ЭКМО является ресурсоемким методом и требует круглосуточного наличия специализированного оборудования и обученного персонала. Таким образом, отбор пациентов имеет решающее значение до начала и поддержания ЭКМО с целью улучшения исходов и минимизации нежелательных явлений. В этой статье обсуждаются этапы, связанные с началом ВА-ЭКМО, поддержание после начала, доказательства его использования и связанные с этим осложнения.
Контур ЭКМО состоит из входной канюли, центробежного насоса, оксигенатора и выпускной канюли (Рисунок 1)11. Впускная канюля соединена с помощью трубки с центробежным насосом, в котором вращающийся ротор создает поток и давление. Из насоса кровь поступает в мембранный оксигенатор, где происходит газообмен12. При этом гемоглобин насыщается кислородом, а степень насыщения кислородом контролируется путем изменения скорости потока и увеличения или уменьшения доли вдыхаемого кислорода (FiO2), подаваемого в оксигенатор. Удаление углекислого газа контролируется путем регулировки скорости развертки противоточного газа, проходящего через оксигенатор. К оксигенатору обычно подключается теплообменник, и таким образом можно регулировать температуру крови, возвращающейся в организм. Из оксигенатора кровь возвращается к пациенту через отток канюли, либо периферически в бедренной артерии, либо централизованно в аорте.
протокол
Этот протокол соответствует рекомендациям институционального комитета по этике исследований человека в Медицинском центре Университета Небраски.
1. Отбор пациентов
- Рассматривайте ВА-ЭКМО у пациентов с рефрактерным КС как мост к выздоровлению, когда ожидается улучшение функции миокарда после первоначального инсульта, как мост к принятию решения или как мост к более определенной терапии, такой как длительная LVAD или трансплантация сердца, когда дисфункция миокарда необратима.
Различные показания включают КС на фоне ОИМ, терминальную стадию сердечной недостаточности, фульминантный миокардит и легочный кор из-за массивной ТЭЛА 13,14,15,16,17. Еще одной областью растущего использования является лечение пациентов, перенесших кардиохирургическое вмешательство, у которых развивается рефрактерный после кардиотомии CS18. - Используйте ВА-ЭКМО у отдельных пациентов с внебольничной остановкой сердца, вторичной по отношению к рефрактерной фибрилляции желудочков/желудочковой тахикардии, для поддержки сердечно-легочной системы в рамках экстракорпоральной сердечно-легочной реанимации (ЭКПР).
ПРИМЕЧАНИЕ: Ограниченные данные свидетельствуют о том, что ECPR связан с улучшением выживаемости и в настоящее время включен в рекомендации по CPR19,20. - Воздержитесь от использования ВА-ЭКМО в сценариях, связанных с тяжелой необратимой отказом органов-мишеней, ограничивающей выживаемость, таких как прогрессирующее злокачественное новообразование, черепно-мозговая травма, расслоение аорты, а также когда цели лечения пациента не совпадают с использованием MCS21.
ПРИМЕЧАНИЕ: Некоторые относительные противопоказания включают заболевание периферических сосудов, препятствующее канюляции, неконтролируемое кровотечение или противопоказание к применению антикоагулянтов. Пожилой возраст (>70 лет) не является абсолютным противопоказанием; Тем не менее, эта популяция исторически демонстрировала низкую выживаемость в больнице по сравнению с более молодыми людьми22 года.
2. Канюляция и начало ВА-ЭКМО
- Содействие междисциплинарному обсуждению в команде, состоящему из продвинутых специалистов по сердечной недостаточности, интервенционных кардиологов, кардиоторакальных хирургов и реаниматологов перед началом приема пациентов с КС на ВА-ЭКМО23.
- Проводите канюляцию в лаборатории катетеризации сердца, в отделении неотложной помощи или отделении интенсивной терапии для чрескожного доступа (периферическая канюляция) или в операционной для хирургического доступа (центральная канюляция)24.
- Для чрескожного доступа очистите и подготовьте места доступа, используя антисептический раствор, такой как хлоргексидин.
- Под ультразвуковым контролем получить бедренный венозный доступ по модифицированной методике Сельдингера с помощью иглы и установить микрооболочку 5 Fr25.
- Проведите гибкий проводник с J-образным наконечником (0,038 дюйма x 180 см) через бедренную вену в нижнюю полую вену (IVC) и направьте ее в правое предсердие.
- Расширяйте место венозного доступа с помощью последовательных расширителей для последовательного расширения канюльного прохода, увеличивая его на один расширитель (2 размера Fr). Затем установите венозную канюлю соответствующего размера (одинарный просвет).
ПРИМЕЧАНИЕ: Размер канюли определяется исходя из возраста, пола и диаметра сосуда на УЗИ, а также желаемых потоков. Венозная канюля доступна в размерах от 21 Fr до 25 Fr, и канюли 25 Fr обычно достаточно для большинства взрослых. - Подтвердите, что кончик венозной канюли находится на стыке внутрипеченочного отдела НПВ и правого предсердия, с помощью рентгеноскопии или обычного рентгена.
- Получите артериальный доступ, обычно в контралатеральной бедренной артерии, аналогичным образом с использованием модифицированной техники Сельдингера, а затем установите микрооболочку (5 Fr).
- Проведите гибкий проводник с J-образным наконечником (0,038 дюйма X 180 см) или жесткий проводник в общую бедренную артерию, а затем в аорту.
- Установите артериальную канюлю соответствующего размера (15-21 Fr) после прогрессирующего расширения кожи и подкожной клетчатки с помощью расширителей.
ПРИМЕЧАНИЕ: Размер канюли подбирается таким образом, чтобы обеспечить сердечный индекс >2,4 л/мин/м2. Артериальная канюля 19 Fr обеспечит достаточную поддержку для большинства взрослых; Однако для более мелких самок следует использовать канюлю меньшего размера. - Установите дистальный перфузионный катетер (ДПК) для антеградной перфузии в ипсилатеральную поверхностную бедренную артерию по модифицированной методике Сельдингера с использованием иглы для микропрокола. Введите 5 Fr DPC и прикрепите его к боковому порту артериальной канюли с помощью удлинительной трубки6-7 дюймов 26.
Примечание: Прогрессивно увеличивающиеся размеры артериальных канюль увеличивают риск ишемических осложнений в ипсилатеральной конечности, особенно у пациентов с основным заболеванием периферических сосудов. - Закрепите венозные и артериальные канюли на месте, приложив их к коже нерассасывающимися шелковыми нитями 2.0.
ПРИМЕЧАНИЕ: Центральная канюляция обычно проводится в операционной и обычно требует стернотомии. - Проводят прямую канюляцию правого предсердия и аорты после торакотомии. Закрепите их на месте с помощью проленовых швов 4.0 в виде кошельков, плотников и патрубков.
- Затем зафиксируйте канюли к стенке грудной клетки изнутри полости с помощью множественных швов.
- Оставьте грудную клетку открытой с окклюзионной повязкой или закрытой в заключении. Проведите канюли через кожу, когда грудная клетка закрыта.
- Подключите канюли (артериальную и венозную) к контуру ЭКМО и увеличивайте кровоток до тех пор, пока не будут достигнуты дыхательные и гемодинамические показатели.
3. Управление после начала
- Мониторинг пациента
- Установите катетер легочной артерии 7,5 Fr, чтобы помочь в принятии клинических решений с периодическими измерениями давления в легочной артерии и давления в легочном капиллярном клине в качестве суррогата давления наполнения левого желудочка.
ПРИМЕЧАНИЕ: Это помогает в выявлении пациентов с риском развития отека легких, поскольку ВА-ЭКМО создает шунт справа налево, дренируя венозную кровь из правого предсердия и возвращая насыщенную кислородом кровь в подвздошные артерии/нисходящую аорту. В то время как преднагрузка снижается, увеличение постнагрузки при использовании ВА-ЭКМО может увеличить риск отека легких у пациентов с КС, которые уже имеют основную дисфункцию ЛЖ. - Поместите артериальные катетеры в правую лучевую или левую лучевую артерию с помощью техники микропунктуры с помощью проводника27.
ПРИМЕЧАНИЕ: Это помогает определить местоположение водораздела (область дуги аорты, где антеградный поток из левого желудочка встречается с ретроградным потоком из артериальной канюли)28. - Контролируйте насыщение кислородом правой лучевой артерии, чтобы оценить оксигенацию верхней части тела (головного мозга и правой верхней конечности). Проводите анализ газов артериальной крови каждые 8-12 ч для обеспечения адекватного насыщения кислородом29.
- Отрегулируйте FiO2 на оксигенаторе (наберите ручку вверх) так, чтобы поддерживать 60-100 мм рт.ст. PaO2.
ПРИМЕЧАНИЕ: FiO2 обычно устанавливается на 100% в начале ВА-ЭКМО и впоследствии титруется вниз по мере улучшения оксигенации. - Оптимизируйте вентиляцию и, следовательно, удаление углекислого газа, регулируя скорость подметания до 3-7 л/мин для коррекции любого респираторного ацидоза.
- Последовательный мониторинг маркеров перфузии органов-мишеней, таких как лактат, SvO2, трансаминазы и клиренс креатинина, с помощью анализа венозных газов30,31.
ПРИМЕЧАНИЕ: Целевой SvO2 должен составлять >70% и лактат менее 2,2 ммоль/л.
- Установите катетер легочной артерии 7,5 Fr, чтобы помочь в принятии клинических решений с периодическими измерениями давления в легочной артерии и давления в легочном капиллярном клине в качестве суррогата давления наполнения левого желудочка.
- Регулировка кровотока и управление венозной болтовней
- Отрегулируйте поток через контур таким образом, чтобы обеспечить достаточную перфузию конечного органа (целевой расход 60 куб. см/кг/мин). Изменяйте расход, регулируя частоту вращения насоса. Поддерживайте расход 4-6 л/мин первоначально после канюляции.
ПРИМЕЧАНИЕ: Более высокая скорость насоса, гиповолемия и неправильное положение венозной канюли могут привести к венозной болтовне, которая проявляется в виде отсасывания или «пыхтения» венозной канюли32. Венозная болтовня может привести к гемолизу, вызывая разрежение в головке насоса, поскольку ротор в насосе продолжает вращаться и откачивать кровь из насоса. - Корректируют венозную болтовню с помощью инфузионной терапии в случаях гиповолемии. Измените положение венозной канюли в случае неправильного положения или перегиба. Уменьшите частоту вращения насоса в случае высоких оборотов33,34.
- Сведите к минимуму венозную болтовню, присоединив венозный резервуар или складной мочевой пузырь к входной канюле. Это позволяет уменьшить всасывание входной канюли за счет подачи объема насосу.
- Отрегулируйте поток через контур таким образом, чтобы обеспечить достаточную перфузию конечного органа (целевой расход 60 куб. см/кг/мин). Изменяйте расход, регулируя частоту вращения насоса. Поддерживайте расход 4-6 л/мин первоначально после канюляции.
- Разгрузка левого желудочка
ПРИМЕЧАНИЕ: Увеличение постнагрузки от ретроградного потока ВА-ЭКМО может привести к повышению конечного диастолического давления ЛЖ (ЛЖП) и, таким образом, ухудшить отек легких, а тяжелые случаи остановки ЛЖ могут привести к образованию тромба из застоявшейся крови35.- Чтобы разгрузить ЛЖ и уменьшить постнагрузку, используйте инотропные препараты, такие как добутамин (начальная доза 1-2 г/кг/мин) или сосудорасширяющие средства, такие как гидралазин или нитраты 36,37,38.
ПРИМЕЧАНИЕ: Однако, как правило, этого недостаточно, и может потребоваться механическая разгрузка низкого напряжения. - Установите устройство для поддержки желудочков (например, Impella) или внутриаортальный баллонный насос (IABP) чрескожно для выполнения прямой разгрузки ЛЖ. Чтобы выполнить непрямую разгрузку ЛЖ, необходимо чрескожно установить канюлю легочной артерии или выполнить баллонную септостомию.
ПРИМЕЧАНИЕ: Хирургические методы, включая транссептальное дренирование левого предсердия или прямую канюляцию верхушки ЛЖ, также могут быть использованы для разгрузки ЛЖ39.
- Чтобы разгрузить ЛЖ и уменьшить постнагрузку, используйте инотропные препараты, такие как добутамин (начальная доза 1-2 г/кг/мин) или сосудорасширяющие средства, такие как гидралазин или нитраты 36,37,38.
- Антикоагулянтная терапия
- Начните системную антикоагулянтную терапию в момент канюляции. Используйте болюсно 50-100 МЕ/кг гепарина внутривенно (рекомендуется) с последующим непрерывным приемом гепарина, как показано ниже.
- Продолжайте принимать нефракционированный гепарин для поддержания активированного частичного тромбопластинового времени или активированного времени свертывания крови не менее чем в 1,5 раза выше верхней границы нормы во время лабораторных проверок (каждые 4-6 часов).
- У пациентов с гепарин-индуцированной тромбоцитопенией для достижения терапевтических уровней применяют прямые ингибиторы тромбина, такие как бивалирудин (начальная доза 0,025-0,05 мг/кг/ч)40 или аргатробан (начальная доза 0,05-2 г/кг/мин)41 .
4. Профилактика и лечение осложнений
- Синдром Арлекина (Север-Юг)
ПРИМЕЧАНИЕ: Дифференциальный цианоз верхней части тела может возникнуть, когда водораздел (область, где ретроградный поток, содержащий насыщенную кислородом кровь из исходящей канюли, встречается с антеградной кровью из ЛЖ) находится дистальнее истока сосудов дуги аорты на фоне сопутствующей дыхательной недостаточности. Дезоксигенированная кровь из ЛЖ снабжает верхнюю часть тела через сонные и подключичные артерии, в то время как нижняя часть тела снабжается кровью из канюли оттока ВА-ЭКМО. Это явление называется синдромом Арлекина или синдромом Север-Юг (верхняя часть тела голубая, а нижняя – розовая).- Лечите этот дифференциальный цианоз путем увеличения насыщения крови кислородом, возвращающейся в ЛЖ, либо путем увеличенияFiO2 или положительного давления в конце выдоха, если пациент находится на искусственной вентиляции легких, либо путем возврата насыщенной кислородом крови в правое предсердие, как правило, через другую канюлю, введенную во внутреннюю яремную вену, соединенную с артериальной конечностью контура ЭКМО (V-A-V ECMO).
- Контролируйте насыщение кислородом верхней части тела каждые 8-12 ч с помощью анализа артериальных газов (АБГ) из правой лучевой артерии. Адекватное насыщение тканей кислородом обеспечивается 60-100 мм рт.ст. PaO2 на ABG42.
- Ишемия нижних конечностей
Примечание: Одним из наиболее серьезных осложнений канюляции периферических артерий является антеградная ишемия нижней конечности, которая редко приводит к компартмент-синдрому и, в крайних случаях, может потребовать ампутации. Частота ишемии конечностей варьирует и колеблется от 10% до 70%, о чем свидетельствуют различные исследования44.- Выберите канюлю подходящего размера в зависимости от диаметра бедренных артерий на ультразвуковом исследовании, что потенциально снижает вероятность осложнений ишемии нижних конечностей.
- Контролируйте циркуляцию нижних конечностей после канюляции с помощью последовательной импульсной допплерографии или ближней инфракрасной спектроскопии (NIRS)44. NIRS является неинвазивным инструментом визуализации для доступа к тканевому кислороду45.
- Выполняйте непрерывную оценку оксигенации тканей нижних конечностей с помощью NIRS. Поместите сенсорные прокладки на икроножные мышцы, подключенные к оксиметру, чтобы легко обнаружить любые изменения оксигенации тканей, которые являются индикатором перфузии.
- Введите антеградный перфузионный катетер (5-7 Шр) в поверхностную бедренную артерию во время канюляции ЭКМО для предотвращения ишемических осложнений в нижней конечности.
- Кровотечения и гемолиз
ПРИМЕЧАНИЕ: Небольшая степень гемолиза часто наблюдается после начала ВА-ЭКМО. К причинам значительного гемолиза относят тромбоз помпы и свертывание крови в контуре ЭКМО.- Тщательно контролируйте клинически значимый гемолиз. Ежедневно измеряйте уровень гемоглобина, лактатдегидрогеназы, билирубина и креатинина.
- Рассмотрите возможность прерывания системной антикоагулянтной терапии у пациентов с тяжелым кровотечением и тромбоцитопенией46. Однако это может увеличить риск тромботических осложнений; Таким образом, перед проведением антикоагулянтной терапии следует провести тщательную оценку кровотечений и тромботических рисков.
- Воздушная эмболия
Примечание: Попадание воздуха в контур ЭКМО может произойти из-за ослабления соединений, периферического или центрального венозного доступа или разрыва мембраны оксигенатора47. Это может привести к воздушной эмболии, которая может вызвать инсульт, если пузырьки воздуха попадают в мозговое кровообращение.- Уложите пациента в положение Тренделенбурга во время искусственной вентиляции легких и зажмите контур ЭКМО для управления воздушной эмболией
- Обеспылите воздух и повторно заправьте цепь при подозрении на воздушную эмболию. Иногда может потребоваться замена всей цепи.
5. Отлучение от ЭКМО
- Оцените пациентов на предмет отлучения от груди после того, как они оправятся от первоначального повреждения, послужившего поводом для использования ВА-ЭКМО.
ПРИМЕЧАНИЕ: Сопутствующая дыхательная недостаточность должна быть устранена до отлучения от груди. - Выполняйте серийные эхокардиограммы для оценки улучшения сердечной функции и готовности к отлучению от груди.
- Подтвердите стабильность гемодинамики перед отлучением пациента от ВА-ЭКМО.
Примечание: У пациентов должна восстановиться пульсирующая артериальная кривая в течение как минимум 24 ч, а среднее артериальное давление должно составлять >60 мм рт.ст. при отсутствии или при использовании низких доз вазопрессоров48. - Во время отлучения от груди проводят эхокардиографическое исследование по отлучению, при котором поток ЭКМО постепенно снижается до минимума 1-1,5 л/мин. Обеспечьте гемодинамическую стабильность и оцените сердечную функцию на эхокардиограмме.
ПРИМЕЧАНИЕ: Фракция выброса левого желудочка (ЛЖ) >20%-25%, интеграл скорости аорты по времени >10 см и пиковая систолическая скорость латерального митрального кольца >6 см/с во время исследования сворачивания являются предикторами успешного отлученияот груди 49. - Контролируйте лабораторные параметры перфузии органов-мишеней, такие как лактат, SvO2 и функция почек, во время отлучения пациентов от груди.
- Чтобы облегчить процесс отлучения от груди, перед деканюляцией необходимо установить упрощенный мост50 между пациентом и контуром ЭКМО (этот шаг является необязательным).
ПРИМЕЧАНИЕ: Мост отлучения позволяет наблюдать за пациентами без поддержки ЭКМО и дает возможность снова включить цепь ЭКМО, когда это необходимо, в течение нескольких минут. Он состоит из длинной трубки, которая соединяет входные и выходные канюли. - Поместите зажимы на входной и выходной канюли проксимальнее мостика отъема, со стороны пациента, тем самым отделяя пациента от контура ЭКМО и позволяя крови рециркулировать в контуре ЭКМО.
- После пережатия контура наблюдайте за пациентами в течение 24 часов до деканюляции. В случае, если требуется гемодинамическая поддержка, возобновите подачу ЭКМО, просто сняв зажимы для трубок.
- Чтобы еще больше ускорить отлучение от груди, используйте устройство для поддержки желудочков (например, Impella), которое может обеспечить до 5 л/мин потока. Увеличьте поток из устройства поддержки желудочков и систематически уменьшайте поток ВА-ЭКМО, обеспечивая при этом стабильность гемодинамики.
ПРИМЕЧАНИЕ: Одним из преимуществ устройства поддержки желудочков является то, что оно может быть имплантировано с использованием подмышечного доступа, что позволяет быстро передвигаться после удаления VA-ECMO51. - После того, как пациент будет признан кандидатом на удаление ВА-ЭКМО, проведите деканюляцию в операционной или лаборатории катетеризации сердца.
ПРИМЕЧАНИЕ: Большинству пациентов с канюляцией периферических артерий потребуется некоторая степень восстановления сосудов.
Результаты
Выживаемость до выписки из больницы после применения ВА-ЭКМО при рефрактерном ХС колеблется от 28 до 67%13,15,52,53,54,55,56, как сообщается в различных обсервационных исследованиях (Таблица 1). Исходы варьируются в зависимости от этиологии КС. В регистре ELSO 9 025 взрослых получали поддержку с помощью экстракорпорального жизнеобеспечения (ECLS) с 1990 по 2015 год. КС был наиболее распространенным диагнозом, связанным с использованием ECLS, с выживаемостью до выписки всего 42%10. Взрослые с миокардитом имели лучшую выживаемость (65%), тогда как взрослые с врожденным пороком сердца имели худшую выживаемость (37%). Посткардиотомия КС представляет собой еще одну популяцию с худшими внутрибольничными исходами после начала ВА-ЭКМО с внутрибольничной выживаемостью в пределах 30-40%53,54. Метаанализ 17 исследований показал, что разгрузка ЛЖ при ВА-ЭКМО была связана со снижением смертности по сравнению с отсутствием разгрузки57. Различные осложнения от самой ВА-ЭКМО могут привести к росту заболеваемости и смертности, связанных с КС. Например, кровотечения отмечались у 45-60% пациентов, получавших ЭКМО58,59, а более высокое время активации частичного тромбопластина ассоциировалось с повышенным риском геморрагических осложнений. Недавний метаанализ 44исследований60, оценивающих долгосрочную выживаемость после использования ВА-ЭКМО при рефрактерном КС, показал, что агрегированная выживаемость через 1 и 5 лет составила 36,7% и 29,9% соответственно. Таким образом, несмотря на использование ВА-ЭКМО в качестве средства спасения у пациентов с КС, как внутрибольничная, так и долгосрочная смертность остается высокой. Кроме того, некоторые данные свидетельствуют о том, что успешное отлучение от ВА-ЭКМО не всегда предсказывает выживаемость48. Внутрибольничная смертность у пациентов, успешно отлученных от ВА-ЭКМО, составляет около 25%61. Недавнее многоцентровое рандомизированное контролируемое исследование ЭКМО-ХС с участием 117 пациентов показало, что раннее использование ВА-ЭКМО при стадии D-E шока не улучшило клинические исходы по сравнению с ранним консервативным лечением, которое позволило использовать ВА-ЭКМО в случае ухудшения гемодинамики62. Напротив, одноцентровое рандомизированное контрольное исследование ARREST63 продемонстрировало, что ранняя реанимация с помощью ЭКМО при внебольничной остановке сердца и рефрактерной фибрилляции желудочков улучшила выживаемость до выписки из больницы по сравнению со стандартным расширенным лечением сердечно-сосудистой системы жизнеобеспечения (ACLS). Будущие исследования должны быть сосредоточены на выявлении пациентов с риском нежелательных явлений после отлучения от практики и деканюляции ВА-ЭКМО.
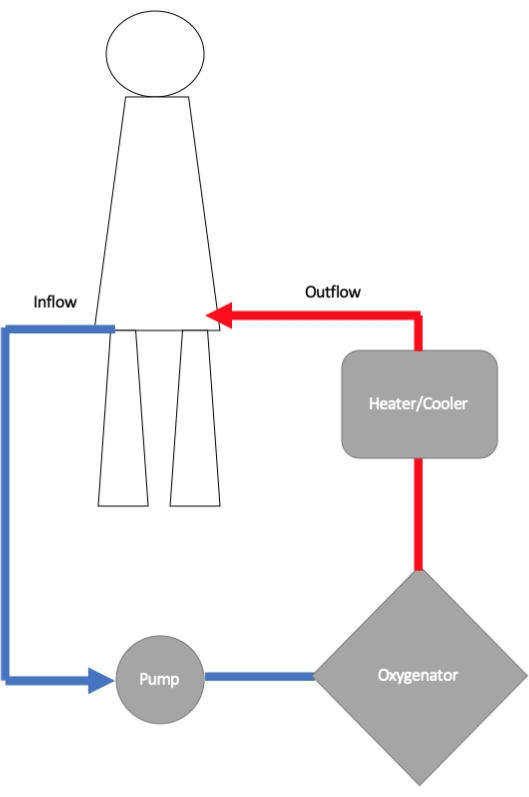
Рисунок 1: Принципиальная схема, показывающая различные компоненты веноартериальной экстракорпоральной мембранной оксигенации (ВА-ЭКМО). Входная канюля подает кровь из организма в насос ЭКМО, откуда кровь направляется в оксигенатор для насыщения кислородом. Температура крови оптимизируется перед тем, как она будет отправлена обратно в организм через выходную канюлю, вставленную в артерию с большим отверстием (чаще всего в бедренную артерию). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Автор, год | Страна | Проектировать | Общее количество пациентов (n) | Этиология кардиогенного шока | Госпитальная выживаемость (%) | ||
| Асо, 201615 | Япония | Ретроспектива | 4658 | Ишемическая болезнь сердца, сердечная недостаточность, порок клапанов сердца, миокардит | 26.4 | ||
| Смит, 201752 | Глобальный | Ретроспектива | 2699 | Миокардит, ишемическая болезнь сердца, структурные заболевания сердца, посттрансплантация сердца, постжелудочковое вспомогательное устройство | 41.4 | ||
| Чэнь, 201753 | Тайвань | Ретроспектива | 1141 | Шок после кардиотомии | 38.3 | ||
| Тиагараджан, 201710 | США | Ретроспектива | 9025 | многофакторный | 42 | ||
| Растан, 201054 | Германия | Ретроспектива | 517 | Аортокоронарное шунтирование, Хирургия клапанов, Аортокоронарное шунтирование плюс Хирургия клапанов, Трансплантация органов грудной клетки, Другие | 24.8 | ||
Таблица 1: Избранные обсервационные исследования, в которых сообщали о выживаемости в больнице у пациентов с кардиогенным шоком (КС), которым была проведена веноартериальная экстракорпоральная мембранная оксигенация (ВА-ЭКМО). Эти исследования показывают, что внутрибольничная выживаемость пациентов, нуждающихся в ЭКМО, остается низкой и составляет от 24,8 до 42%.
Обсуждение
В этом протоколе описаны различные этапы, связанные с началом и поддержанием ВА-ЭКМО у пациентов с рефрактерным КС. Также были обсуждены некоторые из основных осложнений, параметры отлучения от груди и исходы при использовании ВА-ЭКМО.
ВА-ЭКМО обычно используется в качестве спасательной терапии, когда другие стратегии лечения не обеспечивают адекватной гемодинамической поддержки при КС. Канюляция включает в себя доступ к сосудам большого диаметра, который должен быть выполнен тщательно, чтобы свести к минимуму повреждение сосудов и риск кровотечения. После начала ВА-ЭКМО пациенты должны находиться под наблюдением в отделении интенсивной терапии сердечно-сосудистых заболеваний, укомплектованном перфузиологами и медсестрами, прошедшими специализированную подготовку по работе с цепями ЭКМО. Пациентов следует ежедневно оценивать на предмет отлучения от груди, а деканюляцию следует проводить как можно раньше, как только произойдет восстановление сердца или когда будут определены более эффективные методы лечения с целью минимизации осложнений.
Использование ВА-ЭКМО значительно возросло за последние два десятилетия, и список показаний постоянно расширяется. Несмотря на увеличение доступности и распространенности использования, смертность при КС остается высокой. Отбор пациентов имеет решающее значение для обеспечения разумного распределения ресурсов, а также для смягчения осложнений, связанных с ВА-ЭКМО. Было разработано несколько систем оценки для прогнозирования выживаемости пациентов, проходящих ВА-ЭКМО. Показатель выживаемости после веноартериальной ЭКМО (SAVE)61 балл был создан с использованием данных регистра ELSO и полезен для прогнозирования выживаемости пациентов до начала ВА-ЭКМО. Оценка производится на основе этиологии КС, возраста, веса, острой органной недостаточности (почек, печени и/или центральной нервной системы), хронической почечной недостаточности, продолжительности интубации, пикового давления на вдохе, диастолического и среднего пульсового давления, остановки сердца и показателей бикарбоната. На основе шкалы SAVE пациенты стратифицированы по пяти различным классам риска (от класса I до V). Более низкие баллы связаны с более высоким классом риска и худшими показателями внутрибольничной выживаемости. Эта система оценки также была проверена на 161 австралийском пациенте и показала отличную дискриминацию с площадью ниже кривой операционных характеристик приема 0,90 (95% доверительный интервал 0,85-0,95). Впоследствии была разработана модифицированная шкала SAVE64 с включением лактата, которая показала отличное прогнозирование исхода у пациентов, перенесших начало ВА-ЭКМО в течение 24 часов после прибытия в отделение неотложной помощи. Недавно был разработан и валидирован еще один упрощенный инструмент прогнозирования под названием PREDICT VA-ECMO score65 с использованием измерений биомаркеров в месте оказания медицинской помощи (лактата, pH и концентрации бикарбоната) через 1, 6 и 12 часов. Выявление популяций пациентов с риском нежелательных явлений после ВА-ЭКМО и последующее использование более точных методов лечения остается областью постоянного интереса.
Ограниченные данные свидетельствуют о том, что раннее начало ВА-ЭКМО после постановки диагноза КС может улучшить выживаемость13. Исследование ЭКМО-КС Ostadal et al. не показало различий в смертности от любой причины у пациентов, получавших раннюю терапию ВА-ЭКМО, по сравнению с консервативной стратегией62. Тем не менее, это еще не было подтверждено рандомизированным образом. Исследование «Проверка ценности новой стратегии и ее экономической эффективности для улучшения плохих исходов при кардиогенном шоке» (EUROSHOCK) (ClinicalTrials.gov Идентификатор: NCT03813134) — это продолжающееся рандомизированное клиническое исследование, в котором будет оцениваться, улучшает ли раннее начало ЭКМО у пациентов с ОИМ с КС 30-дневную выживаемость по сравнению со стандартным лечением. Аналогичным образом, в исследовании «Экстракорпоральное жизнеобеспечение при кардиогенном шоке» (ECLS-SHOCK) (ClinicalTrials.gov идентификатор: NCT03637205) будет изучено, является ли ECLS в дополнение к реваскуляризации и медикаментозной терапии полезной по сравнению с отсутствием использования ECLS при ОИМ, осложненном CS. В этом исследовании ECLS будет преимущественно начинаться до реваскуляризации.
Начало и поддержание ВА-ЭКМО требует значительных ресурсов здравоохранения, которые могут быть доступны только в больницах третичного уровня. Местные сообщества в сотрудничестве с системами здравоохранения должны сосредоточиться на разработке «модели «спицы и концентратора»66, при этом небольшие периферийные больницы сразу после постановки диагноза направляют пациентов с ХС в центральную больницу третичного уровня с организованными бригадами ВА-ЭКМО.
Раскрытие информации
Джон Ум является консультантом в Abbott Laboratories и консультантом в Medtronic. Пунам Велагапуди сообщила о получении гонорара за выступление от Abiomed, Medtronic, Opsens и Shockwave Medical, а также гонорара за участие в консультативных советах в Abiomed и Sanofi. Остальным авторам нечего раскрывать.
Благодарности
Никакой.
Материалы
| Name | Company | Catalog Number | Comments |
| Amplatz Super Stiff guidewire | Boston Scientific | 46-500, 46-501, 46-502. 46-503, 46-504, 46-517, 46-519, 46-520, 46-523, 46-525, 46-526, 46-563, 46-564, 46-509, 46-510, 46-518, 46-524 | Allows delivery of catheters across tortuous anatomies |
| Impella | Abiomed | Impella 2.5, Impella CP, Impella 5.0, Impella 5.5, Impella RP | Percutaneously inserted left ventricular assist device that provides hemodynamic support in cardiogenic shock |
| Inflow Cannula | Surge Cardiovascular | FEM-V1020, FEM-V1022, FEM-V1024, FEM-V1026,FEM-V1028 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus 96600-019,021,023,025,027,029 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus Femoral Venous 96670 - 017,019, 021, 023 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus Multi-Stage Femoral Venous 96880-019,021,025 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus NextGen 96600 - 115, 117, 119, 121, 123, 125, 127, 129 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Carmeda Biomedicus CB96605-015,017,019,021,023,025,29 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Cortiva Biomedicus Femoral Venous CB96670-015,017,019,021 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | DLP Carmeda Venous CB75008, CB66112, CB66114, CB66116, CB66118, CB66120, CB66122,CB66124 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | Avalon Elite Bicaval - 10013, 10016, 10019, 10020, 10023, 10027, 10031 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous Bioline - BE PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous Softline - BO PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous - PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Life Support Bio-Medicus Drainage Catheter and Introducers - LS96218 - 015, 017, 019, 021, 023, 025 ; LS96438 - 021, 023, 025, LS 96555 - 019, 021, 023, 025, LS 96355 - 021, LS96360 -023, 025, 027, 029 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Fresenius | Medos Femoral Cannula MEFKV 18,20,22,24,26,28 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Medtronic 2 stage venous - 91228, 91240, 91246, 91236,91251 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Senko/Mera | PCKC-V-24, PCKC-V2-18, PCKC-V-18, PCKC-V2-20, PCKC-V-20, PCKC-V-22, PCKC-V2-24, PCKC-V-24 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | TandemLife/Livanova | 29,31 Fr | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Freelife Medical | FLK V19 B18, FLK V19 B18R, FLK VV 19R, FLK V20 B20, FLK V20 B20R, FLK V19 B20, FLK V19 B20R, FLK V20 B22, FLK V20 B22R, FLK V10S B22, FLK V19 B22, FLK V19 B22R, FLK V10 B22, FLK V10 B22R, FLK V10S B22R, FLK VV 23R, FLK V10S B24, FLK V10S B24R, FLK V10 B24, FLK V10 B24R, FLK V10S B26, FLK V10S B26R, FLK V10 B26, FLK V10 B26R, FLK VV 27R, FLK VV 31R | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | LivaNova | Sorin right angle venous - 10, 12, 14, 16, 18, 20, 22, 24, 28 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Terumo | CX-EB18VLX, CX-EB21VLX | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus Arterial 96530 - 015,017, 019, 021, 023, 025, | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus Femoral Arterial 96570 - 015, 017, 019, 021 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus NextGen Arterial 96530 -115, 117, 119, 121, 123, 125, 96570 - 115, 117, 119, 121 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Carmeda Biomedicus CB96535 - 015, 017, 019, 021, 023 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Cortiva Biomedicus Femoral Arterial CB96570 -015, 017, 019, 021 | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | PAS 1315, PAS 1515, PAS 1523, PAS 1717, PAL 1723, PAL 1923, PAL 2115, PAL 2123, PAL 2315, PAL 2323 | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | Bioline BE PAS 1315, BE PAS 1515, BE PAL 1523, BE PAL 1723, BE PAS 1915, BE PAL 1923, BE PAS 2115, BE PAL 2123, BE PAS 2315, BE PAL 2323, | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | Softline BO PAS 1315, BO PAS 1515, BO PAL 1523, BO PAS 1715, BO PAL 1723, BO PAS 1915, BO PAL 1923, BO PAS 2115, BO PAL 2123, BO PAL 2323 | Returns oxygenated blood to the body |
| Outflow Cannula | Fresenius | Medos Femoral Arterial Cannula; MEFKA 16, 18, 20, 22,24 | Returns oxygenated blood to the body |
| Outflow Cannula | Senko/Mera | PCKC-A-20, PCKC-A-16, PCKC-A-18 | Returns oxygenated blood to the body |
| Outflow Cannula | Freelife Medical | FLK A18 D16, FLK A18L D16, FLK A18L D16R, FLK A18 D16R, FLK A44 D18, FLK A44 D18R, FLK A18 D18, FLK A18L D18, FLK A18L D18R, FLK A18 D18R, FLK A44 D20, FLK A44 D20R, FLK A18 D20, FLK A18L D20, FLK A18L D20R, FLK A18 D20R, FLK A18 D22, FLK A18L D22, FLK A18L D22R, FLK A18 D24, FLK A18L D24, FLK A18L D24R, FLK A18 D24R | Returns oxygenated blood to the body |
| Outflow Cannula | LivaNova | Sorin arterial - 14, 17, 19, 21, 23 Fr | Returns oxygenated blood to the body |
| Outlflow Cannula | Medtronic Cardiopulmonary | Life Support Bio-Medicus Return Catheter and Introducers - LS96010-009, LS96010-011, LS96010-013, LS96010-015, LS96218-015, LS96218-017, LS96218-019, LS96218-021, LS96218-023, LS96218-025 | Returns oxygenated blood to the body |
| Oxygenator | Abbott | Eurosets | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Oxygenator | Getinge | MaquetHLS Set Advanced v 5.0, v 7.0, Maquet Quadrox iD | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Oxygenator | Medtronic | Nautilus | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Pump | Abiomed | Breethe | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | Alcard ALC 250 | Generates force to deliver oxygenated blood back to the body |
| Pump | Baxter | Century Roller Pump | Generates force to deliver oxygenated blood back to the body |
| Pump | Medtronic Cardiopulmonary | Biomedicus BP50, BP80 Centrifugal | Generates force to deliver oxygenated blood back to the body |
| Pump | Braile Biomedica | Safyre | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | CiSet | Generates force to deliver oxygenated blood back to the body |
| Pump | Abbott | CentriMag | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | Cobe 6" Roller | Generates force to deliver oxygenated blood back to the body |
| Pump | Origen | FloPump 32 | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | HIT Set Advanced Softline 5.0 and 7.0 | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | LifeSPARC | Generates force to deliver oxygenated blood back to the body |
| Pump | Senko/Mera | Centrifugal pump head | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | HLS Set Advanced Bioline 5.0 and 7.0 | Generates force to deliver oxygenated blood back to the body |
| Tandem Heart | LivaNova | Tandem Heart LS | Percutaneously inserted left ventricular assist device |
Ссылки
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- Goldberg, R. J., Spencer, F. A., Gore, J. M., Lessard, D., Yarzebski, J. Thirty-year trends (1975 to 2005) in the magnitude of, management of, and hospital death rates associated with cardiogenic shock in patients with acute myocardial infarction: a population-based perspective. Circulation. 119 (9), 1211-1219 (2009).
- Hochman, J. S., et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. The New England Journal of Medicine. 341 (9), 625-634 (1999).
- Hochman, J. S., et al. One-year survival following early revascularization for cardiogenic shock. JAMA. 285 (2), 190-192 (2001).
- Schumann, J., et al. Inotropic agents and vasodilator strategies for the treatment of cardiogenic shock or low cardiac output syndrome. The Cochrane Database of Systematic Reviews. 1 (1), 009669 (2018).
- Léopold, V., et al. Epinephrine and short-term survival in cardiogenic shock: an individual data meta-analysis of 2583 patients. Intensive Care Medicine. 44 (6), 847-856 (2018).
- De Backer, D., et al. Comparison of dopamine and norepinephrine in the treatment of shock. The New England Journal of Medicine. 362 (9), 779-789 (2010).
- Strom, J. B., et al. National trends, predictors of use, and in-hospital outcomes in mechanical circulatory support for cardiogenic shock. EuroIntervention. 13 (18), 2152-2159 (2018).
- Stentz, M. J., et al. Trends in extracorporeal membrane oxygenation growth in the United States, 2011-2014. ASAIO Journal. 65 (7), 712-717 (2019).
- Thiagarajan, R. R., et al. Extracorporeal life support organization registry international report 2016. ASAIO Journal. 63 (1), 60-67 (2017).
- Lequier, L., Horton, S. B., McMullan, D. M., Bartlett, R. H. Extracorporeal membrane oxygenation circuitry. Pediatric Critical Care Medicine. 14 (5), 7-12 (2013).
- Schmidt, M., et al. Blood oxygenation and decarboxylation determinants during venovenous ECMO for respiratory failure in adults. Intensive Care Medicine. 39 (5), 838-846 (2013).
- Sheu, J. J., et al. Early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention improved 30-day clinical outcomes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Critical Care Medicine. 38 (9), 1810-1817 (2010).
- Belohlavek, J., et al. Veno-arterial ECMO in severe acute right ventricular failure with pulmonary obstructive hemodynamic pattern. The Journal of Invasive Cardiology. 22 (8), 365-369 (2010).
- Aso, S., Matsui, H., Fushimi, K., Yasunaga, H. In-hospital mortality and successful weaning from venoarterial extracorporeal membrane oxygenation: analysis of 5,263 patients using a national inpatient database in Japan. Critical Care. 20, 80 (2016).
- Asaumi, Y., et al. Favourable clinical outcome in patients with cardiogenic shock due to fulminant myocarditis supported by percutaneous extracorporeal membrane oxygenation. European Heart Journal. 26 (20), 2185-2192 (2005).
- Religa, G., Jasińska, M., Czyżewski, &. #. 3. 2. 1. ;., Torba, K., Różański, J. The effect of the sequential therapy in end-stage heart failure (ESHF)-from ECMO, through the use of implantable pump for a pneumatic heart assist system, Religa Heart EXT, as a bridge for orthotopic heart transplant (OHT). Case study. Annals of Transplantation. 19, 537-540 (2014).
- Meani, P., et al. Long-term survival and major outcomes in post-cardiotomy extracorporeal membrane oxygenation for adult patients in cardiogenic shock. Annals of Cardiothoracic Surgery. 8 (1), 116-122 (2019).
- Bartos, J. A., et al. Improved survival with extracorporeal cardiopulmonary resuscitation despite progressive metabolic derangement associated with prolonged resuscitation. Circulation. 141 (11), 877-886 (2020).
- Brooks, S. C., et al. Part 6: Alternative techniques and ancillary devices for cardiopulmonary resuscitation. Circulation. 132 (18), 436-443 (2015).
- Guglin, M., et al. Venoarterial ECMO for adults: JACC scientific expert panel. Journal of the American College of Cardiology. 73 (6), 698-716 (2019).
- Lorusso, R., et al. Venoarterial extracorporeal membrane oxygenation for refractory cardiogenic shock in elderly patients: Trends in application and outcome from the Extracorporeal Life Support Organization (ELSO) Registry. The Annals of Thoracic Surgery. 104 (1), 62-69 (2017).
- Tehrani, B. N., et al. Standardized team-based care for cardiogenic shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Pavlushkov, E., Berman, M., Valchanov, K. Cannulation techniques for extracorporeal life support. Annals of Translational Medicine. 5 (4), 70 (2017).
- Burrell, A. J. C., Ihle, J. F., Pellegrino, V. A., Sheldrake, J., Nixon, P. T. Cannulation technique: femoro-femoral. Journal of Thoracic Disease. 10, 616-623 (2018).
- Lamb, K. M., et al. Arterial protocol including prophylactic distal perfusion catheter decreases limb ischemia complications in patients undergoing extracorporeal membrane oxygenation. Journal of Vascular Surgery. 65 (4), 1074-1079 (2017).
- Pancholy, S. B., Shah, S., Patel, T. M. Radial artery access, hemostasis, and radial artery occlusion. Interventional Cardiology Clinics. 4 (2), 121-125 (2015).
- Hoeper, M. M., et al. Extracorporeal membrane oxygenation watershed. Circulation. 130 (10), 864-865 (2014).
- Chung, M., Shiloh, A. L., Carlese, A. Monitoring of the adult patient on venoarterial extracorporeal membrane oxygenation. The Scientific World Journal. 2014, 393258 (2014).
- Mungan, &. #. 3. 0. 4. ;., Kazancı, B. &. #. 3. 5. 0. ;., Ademoglu, D., Turan, S. Does lactate clearance prognosticates outcomes in ECMO therapy: a retrospective observational study. BMC Anesthesiology. 18 (1), 152 (2018).
- Su, Y., et al. Hemodynamic monitoring in patients with venoarterial extracorporeal membrane oxygenation. Annals of Translational Medicine. 8 (12), 792 (2020).
- Walter, J. M., Kurihara, C., Corbridge, T. C., Bharat, A. Chugging in patients on veno-venous extracorporeal membrane oxygenation: An under-recognized driver of intravenous fluid administration in patients with acute respiratory distress syndrome. Heart & Lung. 47 (4), 398-400 (2018).
- Kim, H., et al. Permissive fluid volume in adult patients undergoing extracorporeal membrane oxygenation treatment. Critical Care. 22 (1), 270 (2018).
- Kalbhenn, J., Maier, S., Heinrich, S., Schallner, N. Bedside repositioning of a dislocated Avalon-cannula in a running veno-venous ECMO. Journal of Artificial Organs. 20 (3), 285-288 (2017).
- Weber, C., et al. Left ventricular thrombus formation in patients undergoing femoral veno-arterial extracorporeal membrane oxygenation. Perfusion. 33 (4), 283-288 (2018).
- Tariq, S., Aronow, W. S. Use of inotropic agents in treatment of systolic heart failure. International Journal of Molecular Sciences. 16 (12), 29060-29068 (2015).
- Thiele, H., Ohman, E. M., Desch, S., Eitel, I., de Waha, S. Management of cardiogenic shock. European Heart Journal. 36 (20), 1223-1230 (2015).
- Mason, D. T. Afterload reduction in the treatment of cardiac failure. Schweizerische Medizinische Wochenschrift. 108 (44), 1695-1703 (1978).
- Meani, P., et al. Modalities and effects of left ventricle unloading on extracorporeal life support: A review of the current literature. European Journal of Heart Failure. 19, 84-91 (2017).
- Taylor, T., Campbell, C. T., Kelly, B. A review of bivalirudin for pediatric and adult mechanical circulatory support. American Journal of Cardiovascular Drugs. 21 (4), 395-409 (2021).
- Geli, J., Capoccia, M., Maybauer, D. M., Maybauer, M. O. Argatroban anticoagulation for adult extracorporeal membrane oxygenation: A systematic review. Journal of Intensive Care Medicine. 37 (4), 459-471 (2022).
- Patel, B., Arcaro, M., Chatterjee, S. Bedside troubleshooting during venovenous extracorporeal membrane oxygenation (ECMO). Journal of Thoracic Disease. 11, 1698-1707 (2019).
- Cheng, R., et al. Complications of extracorporeal membrane oxygenation for treatment of cardiogenic shock and cardiac arrest: a meta-analysis of 1,866 adult patients. The Annals of Thoracic Surgery. 97 (2), 610-616 (2014).
- Bonicolini, E., et al. Limb ischemia in peripheral veno-arterial extracorporeal membrane oxygenation: a narrative review of incidence, prevention, monitoring, and treatment. Critical Care. 23 (1), 266 (2019).
- Moerman, A., Wouters, P. Near-infrared spectroscopy (NIRS) monitoring in contemporary anesthesia and critical care. Acta Anaesthesiologica Belgica. 61 (4), 185-194 (2010).
- Chung, Y. S., et al. Is stopping heparin safe in patients on extracorporeal membrane oxygenation treatment. ASAIO Journal. 63 (1), 32-36 (2017).
- Kumar, A., Keshavamurthy, S., Abraham, J. G., Toyoda, Y. Massive air embolism caused by a central venous catheter during extracorporeal membrane oxygenation. The Journal of Extra-Corporeal Technology. 51 (1), 9-11 (2019).
- Ortuno, S., et al. Weaning from veno-arterial extracorporeal membrane oxygenation: which strategy to use. Annals of Cardiothoracic Surgery. 8 (1), 1-8 (2019).
- Aissaoui, N., et al. Predictors of successful extracorporeal membrane oxygenation (ECMO) weaning after assistance for refractory cardiogenic shock. Intensive Care Medicine. 37 (11), 1738-1745 (2011).
- Vida, V. L., et al. Extracorporeal membrane oxygenation: the simplified weaning bridge. The Journal of Thoracic and Cardiovascular Surgery. 143 (4), 27-28 (2012).
- Esposito, M. L., Jablonksi, J., Kras, A., Krasney, S., Kapur, N. K. Maximum level of mobility with axillary deployment of the Impella 5.0 is associated with improved survival. The International Journal of Artificial Organs. 41 (4), 236-239 (2018).
- Smith, M., et al. Duration of veno-arterial extracorporeal life support (VA ECMO) and outcome: an analysis of the Extracorporeal Life Support Organization (ELSO) registry. Critical Care. 21 (1), 45 (2017).
- Chen, S. W., et al. Long-term outcomes of extracorporeal membrane oxygenation support for postcardiotomy shock. The Journal of Thoracic and Cardiovascular Surgery. 154 (2), 469-477 (2017).
- Rastan, A. J., et al. Early and late outcomes of 517 consecutive adult patients treated with extracorporeal membrane oxygenation for refractory postcardiotomy cardiogenic shock. The Journal of Thoracic and Cardiovascular Surgery. 139 (2), 302-311 (2010).
- Tsao, N. W., et al. Extracorporeal membrane oxygenation-assisted primary percutaneous coronary intervention may improve survival of patients with acute myocardial infarction complicated by profound cardiogenic shock. Journal of Critical Care. 27 (5), 1-11 (2012).
- Sakamoto, S., Taniguchi, N., Nakajima, S., Takahashi, A. Extracorporeal life support for cardiogenic shock or cardiac arrest due to acute coronary syndrome. The Annals of Thoracic Surgery. 94 (1), 1-7 (2012).
- Russo, J. J., et al. Left ventricular unloading during extracorporeal membrane oxygenation in patients with cardiogenic shock. Journal of the American College of Cardiology. 73 (6), 654-662 (2019).
- Ou de Lansink-Hartgring, A., de Vries, A. J., Droogh, J. H., vanden Bergh, W. M. Hemorrhagic complications during extracorporeal membrane oxygenation-The role of anticoagulation and platelets. Journal of Critical Care. 54, 239-243 (2019).
- Aubron, C., et al. Predictive factors of bleeding events in adults undergoing extracorporeal membrane oxygenation. Annals of Intensive Care. 6 (1), 97 (2016).
- Chang, W. W., et al. Predictors of mortality in patients successfully weaned from extracorporeal membrane oxygenation. PLoS One. 7 (8), 42687 (2012).
- Schmidt, M., et al. Predicting survival after ECMO for refractory cardiogenic shock: the survival after veno-arterial-ECMO (SAVE)-score. European Heart Journal. 36 (33), 2246-2256 (2015).
- Ostadal, P., et al. Extracorporeal Membrane Oxygenation in the Therapy of Cardiogenic Shock: Results of the ECMO-CS Randomized Clinical Trial. Circulation. , (2022).
- Yannopoulos, D., et al. Advanced reperfusion strategies for patients with out-of-hospital cardiac arrest and refractory ventricular fibrillation (ARREST): a phase 2, single centre, open-label, randomised controlled trial. Lancet. 396 (10265), 1807-1816 (2020).
- Chen, W. C., et al. The modified SAVE score: predicting survival using urgent veno-arterial extracorporeal membrane oxygenation within 24 hours of arrival at the emergency department. Critical Care. 20 (1), 336 (2016).
- Wengenmayer, T., et al. Development and validation of a prognostic model for survival in patients treated with venoarterial extracorporeal membrane oxygenation: the PREDICT VA-ECMO score. European Heart Journal. Acute Cardiovascular Care. 8 (4), 350-359 (2019).
- Huitema, A. A., Harkness, K., Heckman, G. A., McKelvie, R. S. The spoke-hub-and-node model of integrated heart failure care. The Canadian Journal of Cardiology. 34 (7), 863-870 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены