Method Article
Veno-arterielle extrakorporale Membranoxygenierung bei kardiogenem Schock
In diesem Artikel
Zusammenfassung
Der folgende Artikel beleuchtet verschiedene Schritte, die an der Initiierung und Aufrechterhaltung der veno-arteriellen extrakorporalen Membranoxygenierung bei Patienten mit kardiogenem Schock beteiligt sind.
Zusammenfassung
Der kardiogene Schock (CS) ist eine klinische Erkrankung, die durch eine unzureichende Gewebeperfusion bei niedrigem Herzzeitvolumen gekennzeichnet ist. CS ist die häufigste Todesursache nach akutem Myokardinfarkt (AMI). Für die hämodynamische Unterstützung bei CS stehen mehrere temporäre mechanische Unterstützungsvorrichtungen zur Verfügung, bis die klinische Genesung eintritt oder bis endgültigere chirurgische Eingriffe durchgeführt wurden. Die veno-arterielle (VA) extrakorporale Membranoxygenierung (ECMO) hat sich zu einer leistungsstarken Behandlungsoption für die kurzfristige Durchblutungsunterstützung bei refraktärem CS entwickelt. In Ermangelung randomisierter klinischer Studien wurde die Anwendung von ECMO auf klinische Erfahrungen gestützt und auf Daten aus Registern und Beobachtungsstudien basieren. Die Überlebensrate bis zur Entlassung aus dem Krankenhaus unter Verwendung von VA-ECMO liegt zwischen 28 und 67 %. Die Einleitung der ECMO erfordert eine venöse und arterielle Kanülierung, die entweder perkutan oder durch chirurgischen Cutdown durchgeführt werden kann. Zu den Komponenten eines ECMO-Kreislaufs gehören eine Zuflusskanüle, die Blut aus dem Venensystem entnimmt, eine Pumpe, ein Oxygenator und eine Abflusskanüle, die das Blut in das arterielle System zurückführt. Zu den Behandlungsüberlegungen nach Beginn der ECMO gehören eine systemische Antikoagulation zur Vorbeugung von Thrombosen, Strategien zur Entlastung des linken Ventrikels zur Verbesserung der Myokarderholung, die Prävention von Ischämie der Gliedmaßen mit einem distalen Perfusionskatheter bei einer venmoralen arteriellen Kanülierung und die Vorbeugung anderer Komplikationen wie Hämolyse, Luftembolie und Harlekin-Syndrom. ECMO ist kontraindiziert bei Patienten mit unkontrollierten Blutungen, nicht reparierter Aortendissektion, schwerer Aorteninsuffizienz und in vergeblichen Fällen wie schweren neurologischen Verletzungen oder metastasierenden Malignomen. Ein multidisziplinärer Schockteamansatz wird empfohlen, wenn Patienten für eine ECMO in Betracht gezogen werden. In laufenden Studien wird untersucht, ob die Zugabe von routinemäßiger ECMO das Überleben von AMI-Patienten mit CS verbessert, die sich einer Revaskularisation unterziehen.
Einleitung
Der kardiogene Schock (CS) ist eine klinische Erkrankung, die durch eine unzureichende Gewebeperfusion bei niedrigem Herzzeitvolumen gekennzeichnet ist. Trotz Fortschritten in der Reperfusionstherapie bleibt der akute Myokardinfarkt (AMI) die Hauptursache für CS. Laut einer Analyse der Datenbank National Inpatient Sample (NIS), in der Daten von etwa 20 % aller Krankenhausaufenthalte in den Vereinigten Staaten gesammelt werden, waren 55,4 % der 144.254 CS-Fälle zwischen 2005 und 2014 sekundär zu AMI1. Andere Ätiologien der CS sind dekompensierte Herzinsuffizienz, fulminante Myokarditis, Schock nach Kardiotomie und Lungenembolie (LE). CS ist mit einer hohen Sterblichkeitsrate im Krankenhaus verbunden, die zwischen 45 und 65 % liegt1,2. Daher ist die schnelle Identifizierung von CS und die Korrektur reversibler Ursachen entscheidend für die Verbesserung des Überlebens der Patienten. Zum Beispiel zeigte die Studie "Should We Emergent Revascularize Occluded Coronaaries for Cardiogenic Shock" (SHOCK), dass eine Strategie der frühen Revaskularisierung mit einem besseren Überleben nach 6 Monaten3 und 1 Jahr4 verbunden war, verglichen mit einer Strategie der anfänglichen medizinischen Stabilisierung bei Patienten mit CS-komplizierender AMI.
Vasopressoren und Inotropika können zur Korrektur von Hypotonie im Zusammenhang mit CS eingesetzt werden, aber es wurde nicht gezeigt, dass sie einen Mortalitätsvorteil haben 5,6,7. Kurzzeitgeräte zur mechanischen Kreislaufunterstützung (MCS) hingegen können bei Patienten mit refraktärem CS eine hämodynamische Unterstützung als Brücke zur Genesung oder als Brücke zu einer definitiveren Therapie bieten. Der Einsatz von MCS hat in den letzten zehn Jahren zugenommen; Die Inzidenz von CS-Krankenhausaufenthalten hat jedoch die Nutzung von MCS8 übertroffen. Einem rückläufigen Trend bei der Nutzung von intraaortalen Ballonpumpen (IABP) wurde durch eine relative Zunahme der Anwendung von intravaskulären mikroaxialen linksventrikulären Unterstützungssystemen (LVAD) (z. B. Impella und TandemHeart) und der veno-arteriellen extrakorporalen Membranoxygenierung (VA-ECMO) entgegengewirkt.
VA-ECMO kann Durchflüsse von bis zu 4-6 l/min erzeugen und seine Anwendung in CS hat erheblich an Popularität gewonnen9. Laut einem globalen Register, das von der Extracorporeal Life Support Organization (ELSO) geführt wird, stieg die Nutzung von VA-ECMO von weniger als 500 Läufen pro Jahr vor 2010 auf 2.157 Läufe im Jahr 201510. Nichtsdestotrotz ist VA-ECMO eine ressourcenintensive Modalität und erfordert rund um die Uhr die Verfügbarkeit von Spezialgeräten und geschultem Personal. Daher ist die Patientenauswahl vor Beginn und Aufrechterhaltung der ECMO von entscheidender Bedeutung, um die Ergebnisse zu verbessern und unerwünschte Ereignisse zu minimieren. In diesem Artikel werden die Schritte zu Beginn der VA-ECMO, die Aufrechterhaltung nach der Initiierung, die Evidenz für die Verwendung und die damit verbundenen Komplikationen erläutert.
Ein ECMO-Kreislauf besteht aus einer Zuflusskanüle, einer Kreiselpumpe, einem Oxygenator und einer Ausflusskanüle (Abbildung 1)11. Die Zulaufkanüle ist über einen Schlauch mit einer Kreiselpumpe verbunden, in der ein rotierender Rotor Strömung und Druck erzeugt. Von der Pumpe fließt Blut zu einem Membranoxygenator, wo der Gasaustausch stattfindet12. Hier wird das Hämoglobin mit Sauerstoff gesättigt, und der Grad der Sauerstoffversorgung wird durch Ändern der Flussrate und Erhöhen oder Verringern des Anteils des eingeatmeten Sauerstoffs (FiO2), der dem Oxygenator zugeführt wird, gesteuert. Die Entfernung von Kohlendioxid wird durch Einstellen der Sweep-Geschwindigkeit des Gegenstromgases gesteuert, das durch den Oxygenator strömt. An den Oxygenator ist in der Regel ein Wärmetauscher angeschlossen, und die Temperatur des Blutes, das in den Körper zurückkehrt, kann so eingestellt werden. Vom Oxygenator wird das Blut über eine Abflusskanüle entweder peripher in der Oberschenkelarterie oder zentral in der Aorta zum Patienten zurückgeführt.
Protokoll
Dieses Protokoll folgt den Richtlinien der institutionellen Ethikkommission für die Humanforschung am University of Nebraska Medical Center.
1. Auswahl des Patienten
- Betrachten Sie VA-ECMO bei Patienten mit refraktärer CS als Brücke zur Genesung, wenn eine Verbesserung der Myokardfunktion nach dem ersten Insult erwartet wird, als Brücke zur Entscheidungsfindung oder als Brücke zu einer definitiveren Therapie wie einer dauerhaften LVAD oder einer Herztransplantation, wenn die myokardiale Dysfunktion irreversibel ist.
HINWEIS: Zu den verschiedenen Indikationen gehören CS als Folge von AMI, Herzinsuffizienz im Endstadium, fulminante Myokarditis und Cor pulmonale aufgrund einer massiven PE 13,14,15,16,17. Ein weiterer Bereich mit wachsendem Einsatz ist bei Patienten, die sich einer Herzoperation unterziehen und eine refraktäre Postkardiotomie CS18 entwickeln. - Einsatz von VA-ECMO bei ausgewählten Patienten mit außerklinischem Herzstillstand infolge von refraktärem Kammerflimmern/ventrikulärer Tachykardie zur kardiopulmonalen Unterstützung im Rahmen der extrakorporalen Herz-Lungen-Wiederbelebung (ECPR).
HINWEIS: Begrenzte Evidenz deutet darauf hin, dass die ECPR mit einem verbesserten Überleben verbunden ist und nun in die Leitlinien für CPR19,20 aufgenommen wurde. - Verzichten Sie auf die Anwendung von VA-ECMO in Szenarien mit schwerem irreversiblem Endorganversagen, das das Überleben einschränkt, wie z. B. fortgeschrittene Malignität, Hirnverletzungen, Aortendissektion und wenn die Behandlungsziele des Patienten nicht mit der Anwendung von MCS21 übereinstimmen.
HINWEIS: Zu den relativen Kontraindikationen gehören periphere Gefäßerkrankungen, die die Kanülierung behindern, unkontrollierte Blutungen oder eine Kontraindikation für die Anwendung von Antikoagulanzien. Das Alter (>70 Jahre) ist keine absolute Kontraindikation; Diese Bevölkerungsgruppe hat jedoch in der Vergangenheit im Vergleich zu jüngeren Erwachsenen eine schlechte Überlebensrate im Krankenhaus gezeigt22.
2. Kanülierung und Einleitung der VA-ECMO
- Ermöglichen Sie eine interdisziplinäre teambasierte Diskussion mit fortgeschrittenen Herzinsuffizienzspezialisten, interventionellen Kardiologen, Herz-Thorax-Chirurgen und Intensivmedizinern vor der Einleitung von CS-Patienten mit VA-ECMO23.
- Führen Sie die Kanülierung im Herzkatheterlabor, in der Notaufnahme oder auf der Intensivstation für einen perkutanen Zugang (periphere Kanüle) oder im Operationssaal für einen chirurgischen Zugang (zentrale Kanülierung) durch24.
- Für den perkutanen Zugang reinigen und bereiten Sie die Zugangsstellen mit einer antiseptischen Lösung wie Chlorhexidin vor.
- Unter Ultraschallkontrolle wird mit einer modifizierten Seldinger-Technik mit einer Nadel ein femoraler Venenzugang erhalten und eine 5 Fr Mikroschleuse25 gelegt.
- Schieben Sie einen flexiblen Führungsdraht mit J-Spitze (0,038 Zoll x 180 cm) durch die Oberschenkelvene in die untere Hohlvene (IVC) und richten Sie ihn in den rechten Vorhof.
- Erweitern Sie die venöse Zugangsstelle mit sequentiellen Dilatatoren, um den Kanülendurchgang seriell zu erweitern, wobei Sie sich um einen Dilatator (2 Fr-Größen) erhöhen. Legen Sie dann eine Venenkanüle in geeigneter Größe (Einzellumen) an.
HINWEIS: Die Größe der Kanüle wird anhand des Alters, des Geschlechts und des Durchmessers des Gefäßes im Ultraschall sowie der gewünschten Flüsse bestimmt. Die Venenkanüle ist in den Größen 21 Fr bis 25 Fr erhältlich, und für die meisten Erwachsenen reicht in der Regel eine Kanüle von 25 Fr aus. - Vergewissern Sie sich, dass sich die Spitze der Venenkanüle an der Verbindung zwischen dem intrahepatischen Teil der IVC und dem rechten Vorhof befindet, mit Durchleuchtung oder einfachem Röntgen.
- Verschaffen Sie sich einen arteriellen Zugang, in der Regel in der kontralateralen Oberschenkelarterie, auf ähnliche Weise mit der modifizierten Seldinger-Technik und legen Sie dann eine Mikroschleuse (5 Fr) an.
- Schieben Sie einen flexiblen Führungsdraht mit J-Spitze (0,038 Zoll x 180 cm) oder einen steifen Führungsdraht in die Arteria femoralis communis und dann in die Aorta vor.
- Platzieren Sie eine arterielle Kanüle in geeigneter Größe (15-21 Fr) nach der fortschreitenden Dilatation der Haut und des Unterhautgewebes mit Dilatatoren.
HINWEIS: Die Kanülengröße ist so gewählt, dass sie einen Herzindex von >2,4 l/min/m2 bietet. Eine arterielle Kanüle 19 Fr bietet für die meisten Erwachsenen ausreichenden Halt; Bei kleineren Frauen sollte jedoch eine kleinere Kanüle verwendet werden. - Platzieren Sie einen distalen Perfusionskatheter (DPC) für die antegrade Perfusion in der ipsilateralen oberflächlichen Oberschenkelarterie mit der modifizierten Seldinger-Technik unter Verwendung einer Mikropunktionsnadel. Führen Sie einen 5 Fr DPC ein und befestigen Sie ihn mit einem 6-7" Verlängerungsschlauch26 an der Seitenöffnung der Arterienkanüle.
HINWEIS: Zunehmend größere arterielle Kanülen erhöhen das Risiko ischämischer Komplikationen in der ipsilateralen Extremität, insbesondere bei Patienten mit zugrunde liegender peripherer Gefäßerkrankung. - Befestigen Sie sowohl venöse als auch arterielle Kanülen, indem Sie sie mit nicht resorbierbaren 2.0-Seidennähten an die Haut nähen.
HINWEIS: Die zentrale Kanülierung wird routinemäßig im Operationssaal durchgeführt und erfordert in der Regel eine Sternotomie. - Führen Sie nach der Thorakotomie eine direkte Kanülierung des rechten Vorhofs und der Aorta durch. Befestigen Sie diese mit Nahtnähten, Kuscheln und Zapfen aus Purse-String 4.0 Prolene.
- Befestigen Sie dann die Kanülen aus der Kavität heraus mit mehreren Nähten an der Brustwand.
- Lassen Sie die Brust mit einem Okklusivverband offen oder am Schluss geschlossen. Tunneln Sie die Kanülen durch die Haut, wenn die Brust geschlossen ist.
- Verbinden Sie die Kanülen (arteriell und venös) mit dem ECMO-Kreislauf und erhöhen Sie den Blutfluss, bis die respiratorischen und hämodynamischen Parameter erreicht sind.
3. Management nach der Initiierung
- Patientenüberwachung
- Legen Sie einen 7,5 Fr Pulmonalarterienkatheter an, um die klinische Entscheidungsfindung mit regelmäßigen Messungen des Lungenarteriendrucks und des Lungenkapillarkeildrucks als Surrogat für den linksventrikulären Füllungsdruck zu unterstützen.
HINWEIS: Dies hilft bei der Identifizierung von Patienten, bei denen das Risiko besteht, ein Lungenödem zu entwickeln, da VA-ECMO einen Rechts-Links-Shunt erzeugt, indem venöses Blut aus dem rechten Vorhof abgeleitet und sauerstoffreiches Blut in die Beckenarterien/absteigende Aorta zurückgeführt wird. Während die Vorlast reduziert wird, kann eine Erhöhung der Nachlast mit VA-ECMO das Risiko für Lungenödeme bei Patienten mit CS erhöhen, die bereits eine zugrunde liegende LV-Dysfunktion haben. - Platzieren Sie die arteriellen Leitungen in der rechten radialen oder linken radialen Arteria mit Hilfe der Mikropunktionstechnik mit Hilfe des Führungsdrahtes27.
HINWEIS: Dies hilft bei der Bestimmung der Lage der Wasserscheide (Bereich im Aortenbogen, an dem der antegrade Fluss aus dem linken Ventrikel auf den retrograden Fluss aus der arteriellen Kanüle trifft)28. - Überwachen Sie die Sauerstoffsättigung an der Stelle der rechten Arteria radialis, um die Sauerstoffversorgung des Oberkörpers (zerebral und rechte obere Extremität) zu beurteilen. Führen Sie alle 8-12 Stunden eine arterielle Blutgasanalyse durch, um eine ausreichende Sauerstoffversorgung sicherzustellen29.
- Stellen Sie FiO2 am Oxygenator ein (drehen Sie den Knopf hoch), um 60-100 mmHg PaO2 zu halten.
HINWEIS: FiO2 wird in der Regel zu Beginn der VA-ECMO auf 100 % eingestellt und anschließend mit zunehmender Sauerstoffversorgung nach unten titriert. - Optimieren Sie die Belüftung und damit die Entfernung von Kohlendioxid, indem Sie die Kehrgeschwindigkeit auf 3-7 l/min einstellen, um eine respiratorische Azidose zu korrigieren.
- Serielle Überwachung von Markern der Endorganperfusion wie Laktat, SvO2, Transaminasen und Kreatinin-Clearance durch venöse Gasanalyse30,31.
HINWEIS: Das Ziel SvO2 sollte >70% betragen und weniger als 2,2 mmol/l laktat enthalten.
- Legen Sie einen 7,5 Fr Pulmonalarterienkatheter an, um die klinische Entscheidungsfindung mit regelmäßigen Messungen des Lungenarteriendrucks und des Lungenkapillarkeildrucks als Surrogat für den linksventrikulären Füllungsdruck zu unterstützen.
- Anpassen des Flusses und des Managements von venösem Rattern
- Passen Sie den Fluss durch den Kreislauf an, um eine angemessene Perfusion der Endorgane zu ermöglichen (Zielfluss von 60 cm³/kg/min). Ändern Sie den Durchfluss, indem Sie die Drehzahl der Pumpe einstellen. Halten Sie zunächst nach der Kanülierung einen Durchfluss von 4-6 l/min aufrecht.
HINWEIS: Höhere Drehzahlen der Pumpe, Hypovolämie und falsch positionierte Venenkanüle können zu venösem Rattern führen, das sich als Saugen oder "Tuckern" der Venenkanülemanifestiert 32. Venöses Rattern kann zu einer Hämolyse führen, indem es ein Vakuum im Pumpenkopf verursacht, da sich der Rotor in der Pumpe weiter dreht und Blut aus der Pumpe ableitet. - Korrigieren Sie das venöse Rattern durch Flüssigkeitswiederbelebung bei Hypovolämie. Positionieren Sie die Venenkanüle bei Fehlstellungen oder Knicken neu. Reduzieren Sie die Drehzahl der Pumpe bei hoher Drehzahl33,34.
- Minimieren Sie das venöse Rattern, indem Sie ein venöses Reservoir oder eine zusammenklappbare Blase an der Zuflusskanüle befestigen. Dies ermöglicht es, das Ansaugen der Zulaufkanüle zu reduzieren, indem der Pumpe Volumen zur Verfügung gestellt wird.
- Passen Sie den Fluss durch den Kreislauf an, um eine angemessene Perfusion der Endorgane zu ermöglichen (Zielfluss von 60 cm³/kg/min). Ändern Sie den Durchfluss, indem Sie die Drehzahl der Pumpe einstellen. Halten Sie zunächst nach der Kanülierung einen Durchfluss von 4-6 l/min aufrecht.
- Linksventrikuläre Entlastung
HINWEIS: Ein Anstieg der Nachlast durch den retrograden VA-ECMO-Fluss kann zu einem höheren enddiastolischen LV-Druck (LVEDP) führen und somit das Lungenödem verschlimmern, und schwere Fälle von LV-Stillstand können zur Thrombusbildung aus stagniertem Blut führen35.- Um die LV zu entlasten und die Nachlast zu verringern, verwenden Sie Inotrope wie Dobutamin (Anfangsdosis von 1-2 μg/kg/min) oder Vasodilatatoren wie Hydralazin oder Nitrate 36,37,38.
HINWEIS: Diese sind jedoch in der Regel unzureichend, und es kann eine mechanische Entladung von LV erforderlich sein. - Platzieren Sie eine ventrikuläre Unterstützung (z. B. Impella) oder eine intraaortale Ballonpumpe (IABP) perkutan, um eine direkte Entlastung des LV zu erreichen. Um eine indirekte Entlastung des LV zu erreichen, wird eine Lungenarterienkanüle perkutan platziert oder eine Ballonseptostomie durchgeführt.
HINWEIS: Chirurgische Techniken, einschließlich der transseptalen linksatrialen Drainage oder der direkten Kanülierung des LV-Apex, können auch für die LV-Entlastung eingesetzt werden39.
- Um die LV zu entlasten und die Nachlast zu verringern, verwenden Sie Inotrope wie Dobutamin (Anfangsdosis von 1-2 μg/kg/min) oder Vasodilatatoren wie Hydralazin oder Nitrate 36,37,38.
- Antikoagulation
- Initiieren Sie die systemische Antikoagulation zum Zeitpunkt der Kanülierung. Verwenden Sie einen Bolus von 50-100 I.E./kg i.v. Heparin (empfohlen), gefolgt von kontinuierlichem Heparin wie unten.
- Fahren Sie mit unfraktioniertem Heparin fort, um eine aktivierte partielle Thromboplastinzeit oder aktivierte Gerinnungszeit von mindestens dem 1,5-fachen der Obergrenze des Normalwerts während der Laborkontrollen (alle 4-6 Stunden) aufrechtzuerhalten.
- Bei Patienten mit Heparin-induzierter Thrombozytopenie sind direkte Thrombinhemmer wie Bivalirudin (Anfangsdosis von 0,025-0,05 mg/kg/h)40 oder Argatroban (Anfangsdosis von 0,05-2 μg/kg/min)41 zu verwenden, um therapeutische Werte zu erreichen.
4. Vorbeugung und Behandlung von Komplikationen
- Harlekin-Syndrom (Nord-Süd-Syndrom)
HINWEIS: Eine differentielle Zyanose des Oberkörpers kann auftreten, wenn die Wasserscheide (der Bereich, in dem der retrograde Fluss mit sauerstoffreichem Blut aus der Abflusskanüle auf das antegrade Blut aus der LV-Kanüle trifft) distal zum Ursprung der Aortenbogenastgefäße bei gleichzeitiger Ateminsuffizienz liegt. Sauerstoffarmes Blut aus dem LV versorgt den Oberkörper über die Halsschlagader und die Arteria subclavia, während der Unterkörper durch das Blut aus der Abflusskanüle von VA-ECMO versorgt wird. Dieses Phänomen wird als Harlekin-Syndrom oder Nord-Süd-Syndrom bezeichnet (der Oberkörper ist blau und der Unterkörper rosa).- Behandeln Sie diese differentielle Zyanose durch Erhöhung der Sauerstoffsättigung des Blutes, das in die LV zurückkehrt, entweder durch Erhöhung des FiO2 oder des positiven endexspiratorischen Drucks, wenn der Patient beatmet wird, oder durch Rückführung von sauerstoffreichem Blut in den rechten Vorhof, typischerweise durch eine andere Kanüle, die in die Vena jugularis interna eingeführt wird, die mit dem arteriellen Glied des ECMO-Kreislaufs verbunden ist (V-A-V ECMO).
- Überwachen Sie die Sättigung der Sauerstoffversorgung des Oberkörpers alle 8-12 Stunden mit einer arteriellen Gasanalyse (ABG) aus der rechten Arteria radialis. Eine ausreichende Sauerstoffversorgung des Gewebes wird mit 60-100 mmHg PaO2 auf ABG42 gewährleistet.
- Ischämie der unteren Gliedmaßen
HINWEIS: Eine der schwerwiegendsten Komplikationen der peripheren arteriellen Kanülierung ist die antegrade Ischämie in der unteren Extremität, die selten zu einem Kompartmentsyndrom führt und in Extremsituationen eine Amputation erforderlich machen kann43. Die Inzidenz von Ischämie der Gliedmaßen ist variabel und reicht von 10 % bis 70 %, wie in verschiedenen Studien berichtetwurde 44.- Wählen Sie eine Kanüle in geeigneter Größe basierend auf dem Durchmesser der Oberschenkelarterien im Ultraschall, wodurch möglicherweise ischämische Komplikationen der unteren Gliedmaßen verringert werden.
- Überwachen Sie die Durchblutung der unteren Gliedmaßen nach einer Kanülierung mit seriellem Pulsdoppler oder Nahinfrarotspektroskopie (NIRS)44. NIRS ist ein nicht-invasives bildgebendes Instrument für den Zugang zur Gewebeoxygenität45.
- Führen Sie eine kontinuierliche Beurteilung der Sauerstoffversorgung des Gewebes der unteren Extremitäten mit NIRS durch. Platzieren Sie die Sensorpads auf den Wadenmuskeln, die mit einem Oximeter verbunden sind, um jede Veränderung der Sauerstoffversorgung des Gewebes, die ein Indikator für die Durchblutung ist, leicht zu erkennen.
- Legen Sie zum Zeitpunkt der ECMO-Kanülierung einen antegraden Perfusionskatheter (5-7 Fr) in die oberflächliche Oberschenkelarterie ein, um ischämische Komplikationen in der unteren Extremität zu vermeiden.
- Blutungen und Hämolyse
HINWEIS: Ein geringer Grad an Hämolyse ist nach Beginn der VA-ECMO üblich. Ursachen für eine signifikante Hämolyse sind Pumpenthrombosen und Gerinnsel im ECMO-Kreislauf.- Überwachen Sie sorgfältig auf klinisch signifikante Hämolyse. Messen Sie täglich den Hämoglobinspiegel, die Laktatdehydrogenase, das Bilirubin und das Kreatinin.
- Erwägen Sie eine Unterbrechung der systemischen Antikoagulation bei Patienten mit schweren Blutungen und Thrombozytopenie46. Dies kann jedoch das Risiko thrombotischer Komplikationen erhöhen; Daher sollte vor dem Halten einer Antikoagulation eine sorgfältige Beurteilung des Blutungs- und Thromboserisikos erfolgen.
- Luftembolie
HINWEIS: Lufteinschlüsse im ECMO-Kreislauf können durch lose Verbindungen, periphere oder zentrale venöse Zugänge oder einen Bruch der Oxygenatormembran47 auftreten. Es kann zu einer Luftembolie führen, die einen Schlaganfall verursachen kann, wenn Luftblasen in den Hirnkreislauf gelangen.- Legen Sie den Patienten in die Trendelenburg-Position, während Sie auf der Beatmungsunterstützung sitzen, und klemmen Sie den ECMO-Kreislauf ein, um die Luftembolie zu behandeln
- Entlüften Sie den Kreislauf und entlüften Sie ihn neu, wenn der Verdacht auf eine Luftembolie besteht. Gelegentlich kann es vorkommen, dass die gesamte Schaltung ausgetauscht werden muss.
5. Entwöhnung von ECMO
- Untersuchen Sie die Patienten für die Entwöhnung, sobald sie sich von der ersten Beleidigung erholt haben, die zur Verwendung von VA-ECMO geführt hat.
HINWEIS: Die gleichzeitige Ateminsuffizienz muss vor der Entwöhnung behoben worden sein. - Führen Sie serielle Echokardiogramme durch, um die Verbesserung der Herzfunktion und die Bereitschaft zur Entwöhnung zu beurteilen.
- Bestätigung der hämodynamischen Stabilität vor der Entwöhnung eines Patienten von VA-ECMO.
HINWEIS: Die Patienten müssen mindestens 24 h lang eine pulsierende arterielle Wellenform wiedererlangt haben, und der mittlere arterielle Druck sollte >60 mmHg betragen, wenn kein Vasopressor verwendet wirdoder wenn 48 niedrig dosiert wird. - Führen Sie während der Entwöhnung eine echokardiographische Turndown-Studie durch, bei der der ECMO-Fluss allmählich auf ein Minimum von 1-1,5 l/min verringert wird. Stellen Sie die hämodynamische Stabilität sicher und beurteilen Sie die Herzfunktion anhand eines Echokardiogramms.
HINWEIS: Eine linksventrikuläre (LV) Ejektionsfraktion von >20 %-25 %, ein Aortengeschwindigkeits-Zeit-Integral von >10 cm und eine systolische Spitzengeschwindigkeit des lateralen Mitralanulus von >6 cm/s während der Turndown-Studie sind Prädiktoren für eine erfolgreiche Entwöhnung49. - Überwachen Sie Laborparameter der Endorganperfusion wie Laktat, SvO2 und Nierenfunktion, während die Patienten entwöhnt werden.
- Um den Entwöhnungsprozess zu erleichtern, wird vor der Dekanülierung eine vereinfachte Entwöhnungsbrücke50 zwischen dem Patienten und dem ECMO-Kreislauf platziert (dieser Schritt ist fakultativ).
HINWEIS: Die Entwöhnungsbrücke ermöglicht es, Patienten ohne ECMO-Unterstützung zu beobachten und bietet die Möglichkeit, den ECMO-Kreislauf bei Bedarf in wenigen Minuten wieder einzuschalten. Es besteht aus einem langen Schlauch, der Zu- und Abflusskanülen verbindet. - Platzieren Sie Klemmen sowohl an den Zu- als auch an den Abflusskanülen proximal der Entwöhnungsbrücke zur Patientenseite, wodurch der Patient vom ECMO-Kreislauf getrennt wird und das Blut innerhalb des ECMO-Kreislaufs zirkulieren kann.
- Nach dem Einklemmen des Kreislaufs ist der Patient vor der Dekanülierung bis zu 24 h zu beobachten. Falls eine hämodynamische Unterstützung erforderlich ist, können Sie den ECMO-Fluss wieder initiieren, indem Sie einfach die Schlauchschellen entfernen.
- Um die Entwöhnung weiter zu verbessern, verwenden Sie ein ventrikuläres Unterstützungsgerät (z. B. Impella), das einen Fluss von bis zu 5 l/min liefern kann. Erhöhen Sie den Fluss aus dem ventrikulären Unterstützungsgerät und verringern Sie den VA-ECMO-Fluss systematisch, während Sie die hämodynamische Stabilität gewährleisten.
HINWEIS: Einer der Vorteile der ventrikulären Unterstützung besteht darin, dass sie mit einem axillären Zugang implantiert werden kann, was eine frühe Gehfähigkeit nach der Entfernung von VA-ECMO51 ermöglicht. - Sobald der Patient als Kandidat für die Entfernung von VA-ECMO eingestuft wird, führen Sie die Dekanülierung im Operationssaal oder im Herzkatheterlabor durch.
HINWEIS: Die meisten Patienten mit peripherer arterieller Kanülierung benötigen ein gewisses Maß an Gefäßreparatur.
Ergebnisse
Die Überlebensrate bis zur Entlassung aus dem Krankenhaus nach der Anwendung von VA-ECMO bei refraktärer CS liegt zwischen 28 und 67 %13,15,52,53,54,55,56, wie in verschiedenen Beobachtungsstudien berichtet wurde (Tabelle 1). Die Ergebnisse variieren je nach Ätiologie der CS. Im ELSO-Register wurden von 1990 bis 2015 9.025 Erwachsene mit extrakorporaler Lebenserhaltung (ECLS) unterstützt. CS war die häufigste Diagnose im Zusammenhang mit der Anwendung von ECLS, mit einer Überlebensrate von nur 42 %10. Erwachsene mit Myokarditis hatten das beste Überleben (65 %), während Erwachsene mit einem angeborenen Herzfehler das schlechteste Überleben hatten (37 %). Die CS nach Kardiotomie stellt eine weitere Population mit schlechteren Ergebnissen im Krankenhaus nach Beginn der VA-ECMO dar, wobei das Überleben im Krankenhaus zwischen 30 und 40 % liegt53,54. Eine Metaanalyse von 17 Studien zeigte, dass die LV-Entladung bei VA-ECMO mit einer Abnahme der Mortalität im Vergleich zu keiner Entladung verbunden war57. Verschiedene Komplikationen durch VA-ECMO selbst können zu einem Anstieg der Morbidität und Mortalität im Zusammenhang mit CS führen. Zum Beispiel wurden Blutungsereignisse bei 45-60% der Patienten unter ECMO58,59 festgestellt, und eine höhere aktivierte partielle Thromboplastinzeit war mit einem erhöhten Risiko für hämorrhagische Komplikationen verbunden. Eine kürzlich durchgeführte Metaanalyse von 44 Studien60 zur Bewertung des Langzeitüberlebens nach der Anwendung von VA-ECMO bei refraktärem CS zeigte, dass das aggregierte Überleben nach 1 und 5 Jahren 36,7 % bzw. 29,9 % betrug. Trotz des Einsatzes von VA-ECMO als Rettungsmodalität bei Patienten mit CS bleiben sowohl die Krankenhaus- als auch die Langzeitmortalität hoch. Darüber hinaus deuten einige Hinweise darauf hin, dass eine erfolgreiche Entwöhnung von VA-ECMO nicht immer das Überleben vorhersagt48. Die Mortalität im Krankenhaus bei Patienten, die erfolgreich von der VA-ECMO entwöhnt wurden, liegt bei etwa 25 %61. Eine kürzlich durchgeführte multizentrische, randomisierte, kontrollierte ECMO-CS-Studie mit 117 Patienten zeigte, dass die frühe Anwendung von VA-ECMO bei Schock im Stadium D-E die klinischen Ergebnisse im Vergleich zu einer frühen konservativen Behandlung, die eine nachgelagerte Anwendung von VA-ECMO im Falle einer Verschlechterung der Hämodynamik erlaubte, nicht verbesserte62. Im Gegensatz dazu zeigte eine monozentrische randomisierte Kontroll-ARREST-Studie63, dass eine frühe ECMO-gestützte Wiederbelebung bei Herzstillstand außerhalb des Krankenhauses und refraktärem Kammerflimmern das Überleben bis zur Entlassung aus dem Krankenhaus im Vergleich zur Standardbehandlung mit Advanced Cardiovascular Life Support (ACLS) verbesserte. Zukünftige Forschungsarbeiten sollten sich auf die Identifizierung von Patienten konzentrieren, bei denen das Risiko unerwünschter Ereignisse nach der Entwöhnung und Dekanülierung von VA-ECMO besteht.
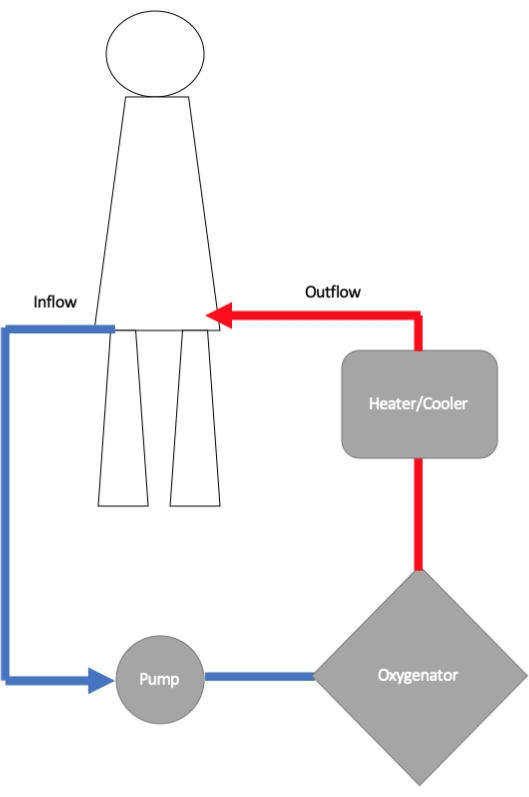
Abbildung 1: Schematische Darstellung verschiedener Komponenten des veno-arteriellen extrakorporalen Membranoxygenierungskreislaufs (VA-ECMO). Die Zuflusskanüle bringt Blut aus dem Körper in die ECMO-Pumpe, von wo aus das Blut zur Sauerstoffversorgung zu einem Oxygenator geleitet wird. Die Temperatur des Blutes wird optimiert, bevor es über eine Abflusskanüle, die in eine Arterie mit großer Bohrung (am häufigsten in der Oberschenkelarterie) eingeführt wird, in den Körper zurückgeleitet wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Autor, Jahr | Land | Entwurf | Gesamtzahl der Patienten (n) | Ätiologie des kardiogenen Schocks | Überleben im Krankenhaus (%) | ||
| Aso, 201615 | Japan | Rückblickend | 4658 | Ischämische Herzkrankheit, Herzinsuffizienz, Herzklappenerkrankung, Myokarditis | 26.4 | ||
| Smith, 201752 | Global | Rückblickend | 2699 | Myokarditis, koronare Herzkrankheit, strukturelle Herzkrankheit, nach Herztransplantation, postventrikuläres Unterstützungssystem | 41.4 | ||
| Chen, 201753 | Taiwan | Rückblickend | 1141 | Schock nach Kardiotomie | 38.3 | ||
| Thiagarajan, 201710 | USA | Rückblickend | 9025 | multifaktoriell | 42 | ||
| Rastan, 201054 | Deutschland | Rückblickend | 517 | Bypass-Transplantation der Koronararterien, Klappenchirurgie, Bypass-Transplantation der Koronararterien plus Klappenchirurgie, Thoraxorgantransplantation, andere | 24.8 | ||
Tabelle 1: Ausgewählte Beobachtungsstudien, die über das Überleben im Krankenhaus bei Patienten mit kardiogenem Schock (CS) berichteten, die sich einer veno-arteriellen extrakorporalen Membranoxygenierung (VA-ECMO) unterzogen hatten. Diese Studien zeigen, dass das Überleben von Patienten, die eine ECMO benötigen, im Krankenhaus mit 24,8 bis 42 % niedrig bleibt.
Diskussion
In diesem Protokoll werden verschiedene Schritte beschrieben, die an der Einleitung und Aufrechterhaltung der VA-ECMO bei Patienten mit refraktärer CS beteiligt sind. Einige der wichtigsten Komplikationen, Entwöhnungsparameter und Ergebnisse bei der Anwendung von VA-ECMO wurden ebenfalls diskutiert.
VA-ECMO wird in der Regel als Rettungstherapie eingesetzt, wenn andere Behandlungsstrategien keine angemessene hämodynamische Unterstützung bei CS bieten. Die Kanülierung beinhaltet einen Gefäßzugang mit großer Bohrung, der sorgfältig durchgeführt werden sollte, um das Risiko von Gefäßverletzungen und Blutungen zu minimieren. Sobald die VA-ECMO eingeleitet wurde, sollten die Patienten auf der kardiovaskulären Intensivstation überwacht werden, die mit Kardiotechnikern und Krankenschwestern ausgestattet ist, die eine spezielle Schulung im Umgang mit ECMO-Schaltkreisen erhalten haben. Die Patienten sollten täglich auf eine Entwöhnung untersucht werden, und die Dekanülierung sollte so früh wie möglich durchgeführt werden, sobald eine kardiale Genesung eintritt oder wenn definitivere Therapien identifiziert wurden, um Komplikationen zu minimieren.
Die Nutzung von VA-ECMO hat in den letzten zwei Jahrzehnten enorm zugenommen, mit einer wachsenden Liste von Indikationen. Trotz einer Zunahme der Verfügbarkeit und Prävalenz des Konsums bleibt die Mortalität bei CS hoch. Die Patientenauswahl ist entscheidend, um eine vernünftige Ressourcenallokation sicherzustellen und gleichzeitig Komplikationen im Zusammenhang mit VA-ECMO zu mildern. Es wurden mehrere Scoring-Systeme entwickelt, um das Überleben von Patienten vorherzusagen, die sich einer VA-ECMO unterziehen. Der Überleben nach veno-arterieller ECMO (SAVE) Score61 wurde anhand von Daten aus dem ELSO-Register erstellt und ist nützlich für die Vorhersage des Überlebens bei Patienten vor Beginn der VA-ECMO. Die Bewertung erfolgt auf der Grundlage der Ätiologie von CS, Alter, Gewicht, akutem Organversagen (Nieren-, Leber- und/oder Zentralnervensystem), chronischem Nierenversagen, Dauer der Intubation, inspiratorischem Spitzendruck, diastolischem und mittlerem Pulsdruck, Herzstillstand und Bikarbonatwerten. Basierend auf dem SAVE-Score werden die Patienten in fünf verschiedene Risikoklassen (Klasse I bis V) eingeteilt. Niedrigere Werte sind mit einer höheren Risikoklasse und schlechteren Überlebensraten im Krankenhaus verbunden. Dieses Bewertungssystem wurde auch extern an 161 australischen Patienten validiert und zeigte eine ausgezeichnete Unterscheidung mit einer Fläche unterhalb der Kurve der empfangenden Operationsmerkmale von 0,90 (95 % Konfidenzintervall von 0,85-0,95). Der modifizierte SAVE-Score64 unter Einbeziehung von Laktat wurde anschließend entwickelt und zeigte eine hervorragende Ergebnisvorhersage bei Patienten, die sich innerhalb von 24 Stunden nach der Ankunft in der Notaufnahme einer VA-ECMO-Einleitung unterzogen. Ein weiteres vereinfachtes Prognosetool namens PREDICT VA-ECMO Score65 unter Verwendung von Point-of-Care-Biomarker-Messungen (Laktat, pH-Wert und Bikarbonatkonzentration) nach 1, 6 und 12 Stunden wurde kürzlich entwickelt und validiert. Die Identifizierung von Patientenpopulationen, bei denen das Risiko unerwünschter Ereignisse nach VA-ECMO besteht, und die anschließende Anwendung definitiverer Therapien ist nach wie vor ein Bereich von anhaltendem Interesse.
Begrenzte Evidenz deutet darauf hin, dass ein früher Beginn der VA-ECMO nach der Diagnose von CS das Überleben verbessern kann13. Die ECMO-CS-Studie von Ostadal et al. zeigte keinen Unterschied in der Mortalität aus irgendeinem Grund bei Patienten, die eine frühe VA-ECMO-Therapie erhielten, im Vergleich zur konservativen Strategie62. Dies wurde jedoch noch nicht randomisiert validiert. Die Studie "Testing the Value of Novel Strategy and its Cost Efficacy to Improve the Poor Outcomes in Cardiogenic Shock" (EUROSHOCK) (ClinicalTrials.gov Identifier: NCT03813134) ist eine laufende randomisierte klinische Studie, in der untersucht wird, ob der frühe Beginn der ECMO bei AMI-Patienten mit CS das 30-Tage-Überleben im Vergleich zur Standardbehandlung verbessert. In ähnlicher Weise wird in der Studie Extracorporeal Life Support in Cardiogenic Shock (ECLS-SHOCK) (ClinicalTrials.gov Identifier: NCT03637205) untersucht, ob ECLS zusätzlich zur Revaskularisierung und medikamentösen Therapie im Vergleich zu keiner Anwendung von ECLS bei durch CS komplizierten AMI von Vorteil ist. ECLS wird in dieser Studie bevorzugt vor der Revaskularisation eingeleitet.
Die Initiierung und Aufrechterhaltung von VA-ECMO erfordert erhebliche Ressourcen im Gesundheitswesen, die möglicherweise nur in Krankenhäusern der tertiären Versorgung zur Verfügung stehen. Lokale Gemeinschaften sollten sich in Zusammenarbeit mit den Gesundheitssystemen auf die Entwicklung eines "Speichen- und Hub-Modells"66 konzentrieren, bei dem kleinere Krankenhäuser in der Peripherie Patienten mit CS unmittelbar nach der Diagnose an ein zentrales tertiäres Krankenhaus mit organisierten VA-ECMO-Teams überweisen.
Offenlegungen
John Um ist Berater für Abbott Laboratories und Berater für Medtronic. Poonam Velagapudi gibt bekannt, dass sie ein Honorar für Vorträge von Abiomed, Medtronic, Opsens und Shockwave Medical sowie ein Honorar für die Teilnahme an Beiräten von Abiomed und Sanofi erhalten hat. Die anderen Autoren haben nichts offenzulegen.
Danksagungen
Nichts.
Materialien
| Name | Company | Catalog Number | Comments |
| Amplatz Super Stiff guidewire | Boston Scientific | 46-500, 46-501, 46-502. 46-503, 46-504, 46-517, 46-519, 46-520, 46-523, 46-525, 46-526, 46-563, 46-564, 46-509, 46-510, 46-518, 46-524 | Allows delivery of catheters across tortuous anatomies |
| Impella | Abiomed | Impella 2.5, Impella CP, Impella 5.0, Impella 5.5, Impella RP | Percutaneously inserted left ventricular assist device that provides hemodynamic support in cardiogenic shock |
| Inflow Cannula | Surge Cardiovascular | FEM-V1020, FEM-V1022, FEM-V1024, FEM-V1026,FEM-V1028 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus 96600-019,021,023,025,027,029 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus Femoral Venous 96670 - 017,019, 021, 023 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus Multi-Stage Femoral Venous 96880-019,021,025 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus NextGen 96600 - 115, 117, 119, 121, 123, 125, 127, 129 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Carmeda Biomedicus CB96605-015,017,019,021,023,025,29 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Cortiva Biomedicus Femoral Venous CB96670-015,017,019,021 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | DLP Carmeda Venous CB75008, CB66112, CB66114, CB66116, CB66118, CB66120, CB66122,CB66124 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | Avalon Elite Bicaval - 10013, 10016, 10019, 10020, 10023, 10027, 10031 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous Bioline - BE PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous Softline - BO PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous - PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Life Support Bio-Medicus Drainage Catheter and Introducers - LS96218 - 015, 017, 019, 021, 023, 025 ; LS96438 - 021, 023, 025, LS 96555 - 019, 021, 023, 025, LS 96355 - 021, LS96360 -023, 025, 027, 029 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Fresenius | Medos Femoral Cannula MEFKV 18,20,22,24,26,28 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Medtronic 2 stage venous - 91228, 91240, 91246, 91236,91251 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Senko/Mera | PCKC-V-24, PCKC-V2-18, PCKC-V-18, PCKC-V2-20, PCKC-V-20, PCKC-V-22, PCKC-V2-24, PCKC-V-24 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | TandemLife/Livanova | 29,31 Fr | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Freelife Medical | FLK V19 B18, FLK V19 B18R, FLK VV 19R, FLK V20 B20, FLK V20 B20R, FLK V19 B20, FLK V19 B20R, FLK V20 B22, FLK V20 B22R, FLK V10S B22, FLK V19 B22, FLK V19 B22R, FLK V10 B22, FLK V10 B22R, FLK V10S B22R, FLK VV 23R, FLK V10S B24, FLK V10S B24R, FLK V10 B24, FLK V10 B24R, FLK V10S B26, FLK V10S B26R, FLK V10 B26, FLK V10 B26R, FLK VV 27R, FLK VV 31R | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | LivaNova | Sorin right angle venous - 10, 12, 14, 16, 18, 20, 22, 24, 28 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Terumo | CX-EB18VLX, CX-EB21VLX | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus Arterial 96530 - 015,017, 019, 021, 023, 025, | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus Femoral Arterial 96570 - 015, 017, 019, 021 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus NextGen Arterial 96530 -115, 117, 119, 121, 123, 125, 96570 - 115, 117, 119, 121 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Carmeda Biomedicus CB96535 - 015, 017, 019, 021, 023 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Cortiva Biomedicus Femoral Arterial CB96570 -015, 017, 019, 021 | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | PAS 1315, PAS 1515, PAS 1523, PAS 1717, PAL 1723, PAL 1923, PAL 2115, PAL 2123, PAL 2315, PAL 2323 | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | Bioline BE PAS 1315, BE PAS 1515, BE PAL 1523, BE PAL 1723, BE PAS 1915, BE PAL 1923, BE PAS 2115, BE PAL 2123, BE PAS 2315, BE PAL 2323, | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | Softline BO PAS 1315, BO PAS 1515, BO PAL 1523, BO PAS 1715, BO PAL 1723, BO PAS 1915, BO PAL 1923, BO PAS 2115, BO PAL 2123, BO PAL 2323 | Returns oxygenated blood to the body |
| Outflow Cannula | Fresenius | Medos Femoral Arterial Cannula; MEFKA 16, 18, 20, 22,24 | Returns oxygenated blood to the body |
| Outflow Cannula | Senko/Mera | PCKC-A-20, PCKC-A-16, PCKC-A-18 | Returns oxygenated blood to the body |
| Outflow Cannula | Freelife Medical | FLK A18 D16, FLK A18L D16, FLK A18L D16R, FLK A18 D16R, FLK A44 D18, FLK A44 D18R, FLK A18 D18, FLK A18L D18, FLK A18L D18R, FLK A18 D18R, FLK A44 D20, FLK A44 D20R, FLK A18 D20, FLK A18L D20, FLK A18L D20R, FLK A18 D20R, FLK A18 D22, FLK A18L D22, FLK A18L D22R, FLK A18 D24, FLK A18L D24, FLK A18L D24R, FLK A18 D24R | Returns oxygenated blood to the body |
| Outflow Cannula | LivaNova | Sorin arterial - 14, 17, 19, 21, 23 Fr | Returns oxygenated blood to the body |
| Outlflow Cannula | Medtronic Cardiopulmonary | Life Support Bio-Medicus Return Catheter and Introducers - LS96010-009, LS96010-011, LS96010-013, LS96010-015, LS96218-015, LS96218-017, LS96218-019, LS96218-021, LS96218-023, LS96218-025 | Returns oxygenated blood to the body |
| Oxygenator | Abbott | Eurosets | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Oxygenator | Getinge | MaquetHLS Set Advanced v 5.0, v 7.0, Maquet Quadrox iD | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Oxygenator | Medtronic | Nautilus | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Pump | Abiomed | Breethe | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | Alcard ALC 250 | Generates force to deliver oxygenated blood back to the body |
| Pump | Baxter | Century Roller Pump | Generates force to deliver oxygenated blood back to the body |
| Pump | Medtronic Cardiopulmonary | Biomedicus BP50, BP80 Centrifugal | Generates force to deliver oxygenated blood back to the body |
| Pump | Braile Biomedica | Safyre | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | CiSet | Generates force to deliver oxygenated blood back to the body |
| Pump | Abbott | CentriMag | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | Cobe 6" Roller | Generates force to deliver oxygenated blood back to the body |
| Pump | Origen | FloPump 32 | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | HIT Set Advanced Softline 5.0 and 7.0 | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | LifeSPARC | Generates force to deliver oxygenated blood back to the body |
| Pump | Senko/Mera | Centrifugal pump head | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | HLS Set Advanced Bioline 5.0 and 7.0 | Generates force to deliver oxygenated blood back to the body |
| Tandem Heart | LivaNova | Tandem Heart LS | Percutaneously inserted left ventricular assist device |
Referenzen
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- Goldberg, R. J., Spencer, F. A., Gore, J. M., Lessard, D., Yarzebski, J. Thirty-year trends (1975 to 2005) in the magnitude of, management of, and hospital death rates associated with cardiogenic shock in patients with acute myocardial infarction: a population-based perspective. Circulation. 119 (9), 1211-1219 (2009).
- Hochman, J. S., et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. The New England Journal of Medicine. 341 (9), 625-634 (1999).
- Hochman, J. S., et al. One-year survival following early revascularization for cardiogenic shock. JAMA. 285 (2), 190-192 (2001).
- Schumann, J., et al. Inotropic agents and vasodilator strategies for the treatment of cardiogenic shock or low cardiac output syndrome. The Cochrane Database of Systematic Reviews. 1 (1), 009669(2018).
- Léopold, V., et al. Epinephrine and short-term survival in cardiogenic shock: an individual data meta-analysis of 2583 patients. Intensive Care Medicine. 44 (6), 847-856 (2018).
- De Backer, D., et al. Comparison of dopamine and norepinephrine in the treatment of shock. The New England Journal of Medicine. 362 (9), 779-789 (2010).
- Strom, J. B., et al. National trends, predictors of use, and in-hospital outcomes in mechanical circulatory support for cardiogenic shock. EuroIntervention. 13 (18), 2152-2159 (2018).
- Stentz, M. J., et al. Trends in extracorporeal membrane oxygenation growth in the United States, 2011-2014. ASAIO Journal. 65 (7), 712-717 (2019).
- Thiagarajan, R. R., et al. Extracorporeal life support organization registry international report 2016. ASAIO Journal. 63 (1), 60-67 (2017).
- Lequier, L., Horton, S. B., McMullan, D. M., Bartlett, R. H. Extracorporeal membrane oxygenation circuitry. Pediatric Critical Care Medicine. 14 (5), 7-12 (2013).
- Schmidt, M., et al. Blood oxygenation and decarboxylation determinants during venovenous ECMO for respiratory failure in adults. Intensive Care Medicine. 39 (5), 838-846 (2013).
- Sheu, J. J., et al. Early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention improved 30-day clinical outcomes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Critical Care Medicine. 38 (9), 1810-1817 (2010).
- Belohlavek, J., et al. Veno-arterial ECMO in severe acute right ventricular failure with pulmonary obstructive hemodynamic pattern. The Journal of Invasive Cardiology. 22 (8), 365-369 (2010).
- Aso, S., Matsui, H., Fushimi, K., Yasunaga, H. In-hospital mortality and successful weaning from venoarterial extracorporeal membrane oxygenation: analysis of 5,263 patients using a national inpatient database in Japan. Critical Care. 20, 80(2016).
- Asaumi, Y., et al. Favourable clinical outcome in patients with cardiogenic shock due to fulminant myocarditis supported by percutaneous extracorporeal membrane oxygenation. European Heart Journal. 26 (20), 2185-2192 (2005).
- Religa, G., Jasińska, M., Czyżewski, Ł, Torba, K., Różański, J. The effect of the sequential therapy in end-stage heart failure (ESHF)-from ECMO, through the use of implantable pump for a pneumatic heart assist system, Religa Heart EXT, as a bridge for orthotopic heart transplant (OHT). Case study. Annals of Transplantation. 19, 537-540 (2014).
- Meani, P., et al. Long-term survival and major outcomes in post-cardiotomy extracorporeal membrane oxygenation for adult patients in cardiogenic shock. Annals of Cardiothoracic Surgery. 8 (1), 116-122 (2019).
- Bartos, J. A., et al. Improved survival with extracorporeal cardiopulmonary resuscitation despite progressive metabolic derangement associated with prolonged resuscitation. Circulation. 141 (11), 877-886 (2020).
- Brooks, S. C., et al. Part 6: Alternative techniques and ancillary devices for cardiopulmonary resuscitation. Circulation. 132 (18), suppl 2 436-443 (2015).
- Guglin, M., et al. Venoarterial ECMO for adults: JACC scientific expert panel. Journal of the American College of Cardiology. 73 (6), 698-716 (2019).
- Lorusso, R., et al. Venoarterial extracorporeal membrane oxygenation for refractory cardiogenic shock in elderly patients: Trends in application and outcome from the Extracorporeal Life Support Organization (ELSO) Registry. The Annals of Thoracic Surgery. 104 (1), 62-69 (2017).
- Tehrani, B. N., et al. Standardized team-based care for cardiogenic shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Pavlushkov, E., Berman, M., Valchanov, K. Cannulation techniques for extracorporeal life support. Annals of Translational Medicine. 5 (4), 70(2017).
- Burrell, A. J. C., Ihle, J. F., Pellegrino, V. A., Sheldrake, J., Nixon, P. T. Cannulation technique: femoro-femoral. Journal of Thoracic Disease. 10, Suppl 5 616-623 (2018).
- Lamb, K. M., et al. Arterial protocol including prophylactic distal perfusion catheter decreases limb ischemia complications in patients undergoing extracorporeal membrane oxygenation. Journal of Vascular Surgery. 65 (4), 1074-1079 (2017).
- Pancholy, S. B., Shah, S., Patel, T. M. Radial artery access, hemostasis, and radial artery occlusion. Interventional Cardiology Clinics. 4 (2), 121-125 (2015).
- Hoeper, M. M., et al. Extracorporeal membrane oxygenation watershed. Circulation. 130 (10), 864-865 (2014).
- Chung, M., Shiloh, A. L., Carlese, A. Monitoring of the adult patient on venoarterial extracorporeal membrane oxygenation. The Scientific World Journal. 2014, 393258(2014).
- Mungan, İ, Kazancı, B. Ş, Ademoglu, D., Turan, S. Does lactate clearance prognosticates outcomes in ECMO therapy: a retrospective observational study. BMC Anesthesiology. 18 (1), 152(2018).
- Su, Y., et al. Hemodynamic monitoring in patients with venoarterial extracorporeal membrane oxygenation. Annals of Translational Medicine. 8 (12), 792(2020).
- Walter, J. M., Kurihara, C., Corbridge, T. C., Bharat, A. Chugging in patients on veno-venous extracorporeal membrane oxygenation: An under-recognized driver of intravenous fluid administration in patients with acute respiratory distress syndrome. Heart & Lung. 47 (4), 398-400 (2018).
- Kim, H., et al. Permissive fluid volume in adult patients undergoing extracorporeal membrane oxygenation treatment. Critical Care. 22 (1), 270(2018).
- Kalbhenn, J., Maier, S., Heinrich, S., Schallner, N. Bedside repositioning of a dislocated Avalon-cannula in a running veno-venous ECMO. Journal of Artificial Organs. 20 (3), 285-288 (2017).
- Weber, C., et al. Left ventricular thrombus formation in patients undergoing femoral veno-arterial extracorporeal membrane oxygenation. Perfusion. 33 (4), 283-288 (2018).
- Tariq, S., Aronow, W. S. Use of inotropic agents in treatment of systolic heart failure. International Journal of Molecular Sciences. 16 (12), 29060-29068 (2015).
- Thiele, H., Ohman, E. M., Desch, S., Eitel, I., de Waha, S. Management of cardiogenic shock. European Heart Journal. 36 (20), 1223-1230 (2015).
- Mason, D. T. Afterload reduction in the treatment of cardiac failure. Schweizerische Medizinische Wochenschrift. 108 (44), 1695-1703 (1978).
- Meani, P., et al. Modalities and effects of left ventricle unloading on extracorporeal life support: A review of the current literature. European Journal of Heart Failure. 19, Suppl 2 84-91 (2017).
- Taylor, T., Campbell, C. T., Kelly, B. A review of bivalirudin for pediatric and adult mechanical circulatory support. American Journal of Cardiovascular Drugs. 21 (4), 395-409 (2021).
- Geli, J., Capoccia, M., Maybauer, D. M., Maybauer, M. O. Argatroban anticoagulation for adult extracorporeal membrane oxygenation: A systematic review. Journal of Intensive Care Medicine. 37 (4), 459-471 (2022).
- Patel, B., Arcaro, M., Chatterjee, S. Bedside troubleshooting during venovenous extracorporeal membrane oxygenation (ECMO). Journal of Thoracic Disease. 11, Suppl 14 1698-1707 (2019).
- Cheng, R., et al. Complications of extracorporeal membrane oxygenation for treatment of cardiogenic shock and cardiac arrest: a meta-analysis of 1,866 adult patients. The Annals of Thoracic Surgery. 97 (2), 610-616 (2014).
- Bonicolini, E., et al. Limb ischemia in peripheral veno-arterial extracorporeal membrane oxygenation: a narrative review of incidence, prevention, monitoring, and treatment. Critical Care. 23 (1), 266(2019).
- Moerman, A., Wouters, P. Near-infrared spectroscopy (NIRS) monitoring in contemporary anesthesia and critical care. Acta Anaesthesiologica Belgica. 61 (4), 185-194 (2010).
- Chung, Y. S., et al. Is stopping heparin safe in patients on extracorporeal membrane oxygenation treatment. ASAIO Journal. 63 (1), 32-36 (2017).
- Kumar, A., Keshavamurthy, S., Abraham, J. G., Toyoda, Y. Massive air embolism caused by a central venous catheter during extracorporeal membrane oxygenation. The Journal of Extra-Corporeal Technology. 51 (1), 9-11 (2019).
- Ortuno, S., et al. Weaning from veno-arterial extracorporeal membrane oxygenation: which strategy to use. Annals of Cardiothoracic Surgery. 8 (1), 1-8 (2019).
- Aissaoui, N., et al. Predictors of successful extracorporeal membrane oxygenation (ECMO) weaning after assistance for refractory cardiogenic shock. Intensive Care Medicine. 37 (11), 1738-1745 (2011).
- Vida, V. L., et al. Extracorporeal membrane oxygenation: the simplified weaning bridge. The Journal of Thoracic and Cardiovascular Surgery. 143 (4), 27-28 (2012).
- Esposito, M. L., Jablonksi, J., Kras, A., Krasney, S., Kapur, N. K. Maximum level of mobility with axillary deployment of the Impella 5.0 is associated with improved survival. The International Journal of Artificial Organs. 41 (4), 236-239 (2018).
- Smith, M., et al. Duration of veno-arterial extracorporeal life support (VA ECMO) and outcome: an analysis of the Extracorporeal Life Support Organization (ELSO) registry. Critical Care. 21 (1), 45(2017).
- Chen, S. W., et al. Long-term outcomes of extracorporeal membrane oxygenation support for postcardiotomy shock. The Journal of Thoracic and Cardiovascular Surgery. 154 (2), 469-477 (2017).
- Rastan, A. J., et al. Early and late outcomes of 517 consecutive adult patients treated with extracorporeal membrane oxygenation for refractory postcardiotomy cardiogenic shock. The Journal of Thoracic and Cardiovascular Surgery. 139 (2), 302-311 (2010).
- Tsao, N. W., et al. Extracorporeal membrane oxygenation-assisted primary percutaneous coronary intervention may improve survival of patients with acute myocardial infarction complicated by profound cardiogenic shock. Journal of Critical Care. 27 (5), 1-11 (2012).
- Sakamoto, S., Taniguchi, N., Nakajima, S., Takahashi, A. Extracorporeal life support for cardiogenic shock or cardiac arrest due to acute coronary syndrome. The Annals of Thoracic Surgery. 94 (1), 1-7 (2012).
- Russo, J. J., et al. Left ventricular unloading during extracorporeal membrane oxygenation in patients with cardiogenic shock. Journal of the American College of Cardiology. 73 (6), 654-662 (2019).
- Ou de Lansink-Hartgring, A., de Vries, A. J., Droogh, J. H., vanden Bergh, W. M. Hemorrhagic complications during extracorporeal membrane oxygenation-The role of anticoagulation and platelets. Journal of Critical Care. 54, 239-243 (2019).
- Aubron, C., et al. Predictive factors of bleeding events in adults undergoing extracorporeal membrane oxygenation. Annals of Intensive Care. 6 (1), 97(2016).
- Chang, W. W., et al. Predictors of mortality in patients successfully weaned from extracorporeal membrane oxygenation. PLoS One. 7 (8), 42687(2012).
- Schmidt, M., et al. Predicting survival after ECMO for refractory cardiogenic shock: the survival after veno-arterial-ECMO (SAVE)-score. European Heart Journal. 36 (33), 2246-2256 (2015).
- Ostadal, P., et al. Extracorporeal Membrane Oxygenation in the Therapy of Cardiogenic Shock: Results of the ECMO-CS Randomized Clinical Trial. Circulation. , (2022).
- Yannopoulos, D., et al. Advanced reperfusion strategies for patients with out-of-hospital cardiac arrest and refractory ventricular fibrillation (ARREST): a phase 2, single centre, open-label, randomised controlled trial. Lancet. 396 (10265), 1807-1816 (2020).
- Chen, W. C., et al. The modified SAVE score: predicting survival using urgent veno-arterial extracorporeal membrane oxygenation within 24 hours of arrival at the emergency department. Critical Care. 20 (1), 336(2016).
- Wengenmayer, T., et al. Development and validation of a prognostic model for survival in patients treated with venoarterial extracorporeal membrane oxygenation: the PREDICT VA-ECMO score. European Heart Journal. Acute Cardiovascular Care. 8 (4), 350-359 (2019).
- Huitema, A. A., Harkness, K., Heckman, G. A., McKelvie, R. S. The spoke-hub-and-node model of integrated heart failure care. The Canadian Journal of Cardiology. 34 (7), 863-870 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten