Method Article
أكسجة الغشاء الوريدي خارج الجسم للصدمة القلبية
In This Article
Summary
تسلط المقالة التالية الضوء على الخطوات المختلفة المتبعة في بدء والحفاظ على أكسجة الغشاء الوريدي خارج الجسم في المرضى الذين يعانون من صدمة قلبية.
Abstract
الصدمة القلبية (CS) هي حالة سريرية تتميز بعدم كفاية نضح الأنسجة في وضع انخفاض النتاج القلبي. CS هو السبب الرئيسي للوفاة بعد احتشاء عضلة القلب الحاد (AMI). تتوفر العديد من أجهزة الدعم الميكانيكي المؤقتة لدعم ديناميكية الدم في CS حتى يتبع ذلك الشفاء السريري أو حتى يتم إجراء إجراءات جراحية أكثر تحديدا. تطورت الأكسجة الغشائية خارج الجسم الشريانية الوريدية (VA) كخيار علاجي قوي لدعم الدورة الدموية على المدى القصير في CS المقاوم للحرارة. في غياب التجارب السريرية العشوائية ، تم توجيه استخدام ECMO بالخبرة السريرية واستنادا إلى بيانات من السجلات والدراسات القائمة على الملاحظة. تتراوح نسبة البقاء على قيد الحياة حتى الخروج من المستشفى باستخدام VA-ECMO من 28-67٪. يتطلب بدء المعالجة الكريهة خارج الجسم القنية الوريدية والشريانية ، والتي يمكن إجراؤها إما عن طريق الجلد أو عن طريق القطع الجراحي. تشتمل مكونات دائرة ECMO على قنية التدفق التي تسحب الدم من الجهاز الوريدي ، ومضخة ، ومؤكسجين ، وقنية التدفق التي تعيد الدم إلى الجهاز الشرياني. تشمل اعتبارات الإدارة بعد بدء ECMO مضادات التخثر الجهازية لمنع تجلط الدم ، واستراتيجيات تفريغ البطين الأيسر لزيادة تعافي عضلة القلب ، والوقاية من نقص تروية الأطراف باستخدام قسطرة التروية البعيدة في حالات قنية الشرايين الفخذية ، والوقاية من المضاعفات الأخرى مثل انحلال الدم والانسداد الهوائي ومتلازمة Harlequin. يمنع استخدام ECMO في المرضى الذين يعانون من نزيف غير منضبط ، وتسلخ الأبهر غير القابل للإصلاح ، وقصور الأبهر الحاد ، وفي الحالات غير المجدية مثل الإصابة العصبية الشديدة أو الأورام الخبيثة النقيلية. يوصى باتباع نهج فريق الصدمات متعدد التخصصات أثناء النظر في المرضى للخضع للخيول الكهربائية. ستقوم الدراسات الجارية بتقييم ما إذا كانت إضافة ECMO الروتيني يحسن البقاء على قيد الحياة لدى مرضى AMI المصابين ب CS الذين يخضعون لعملية إعادة التوعية.
Introduction
الصدمة القلبية (CS) هي حالة سريرية تتميز بعدم كفاية نضح الأنسجة في وضع انخفاض النتاج القلبي. على الرغم من التقدم في علاج إعادة التروية ، لا يزال احتشاء عضلة القلب الحاد (AMI) هو السبب الرئيسي لاحتشاء عضلة القلب الحاد. وفقا لتحليل قاعدة البيانات الوطنية لعينة المرضى الداخليين (NIS) ، والتي تجمع البيانات من حوالي 20٪ من جميع حالات الاستشفاء في الولايات المتحدة ، فإن 55.4٪ من 144،254 حالة CS بين عامي 2005 و 2014 كانت ثانوية ل AMI1. تشمل المسببات الأخرى لمرض CS قصور القلب اللاتعويضي ، والتهاب عضلة القلب الخاطف ، وصدمة ما بعد بضع القلب ، والانسداد الرئوي (PE). يرتبط CS بمعدل وفيات مرتفع في المستشفى ، يتراوح بين 45-65٪ 1،2. وبالتالي ، فإن التحديد السريع ل CS وتصحيح الأسباب القابلة للعكس أمر بالغ الأهمية في تحسين بقاء المريض. على سبيل المثال ، أظهرت تجربة "يجب أن نرجع إعواء الزهور التاجي المسدودة للصدمة القلبية" (SHOCK) أن استراتيجية إعادة التوعي المبكرة ارتبطت ببقاء أفضل على قيد الحياة في 6 أشهر3 و 1 سنة4 مقارنة باستراتيجية الاستقرار الطبي الأولي في المرضى الذين يعانون من CS مما يعقد AMI.
يمكن استخدام مثبطات الأوعية الدموية وتقلبات الأوعية الدموية لتصحيح انخفاض ضغط الدم المرتبط ب CS ، ولكن لم يثبت أن أيا منهما له أي فائدة للوفيات5،6،7. من ناحية أخرى ، يمكن لأجهزة دعم الدورة الدموية الميكانيكية قصيرة المدى (MCS) أن توفر دعما ديناميكيا للدم في المرضى الذين يعانون من CS المقاوم للحرارة كجسر للتعافي أو كجسر لعلاج أكثر تحديدا. شهد استخدام MCS زيادة في العقد الأخير. ومع ذلك ، فقد تجاوز معدل الاستشفاء في CS استخدام MCS8. تمت مواجهة الاتجاه الهبوطي في استخدام مضخات البالون داخل الأبهر (IABP) من خلال زيادة نسبية في تطبيق أجهزة مساعدة البطين الأيسر المحورية الدقيقة داخل الأوعية الدموية (LVAD) (على سبيل المثال ، Impella و TandemHeart) والأكسجين الغشائي الوريدي خارج الجسم (VA-ECMO).
يمكن أن يولد VA-ECMO تدفقات تصل إلى 4-6 لتر / دقيقة وقد اكتسب تطبيقه في CS شعبية كبيرة9. وفقا لسجل عالمي تحتفظ به منظمة دعم الحياة خارج الجسم (ELSO) ، زاد استخدام VA-ECMO من أقل من 500 جولة سنويا قبل عام 2010 إلى 2,157 جولة في عام 201510. ومع ذلك ، فإن VA-ECMO هي طريقة كثيفة الاستخدام للموارد وتتطلب توفرا على مدار الساعة للمعدات المتخصصة والموظفين المدربين. لذلك ، يعد اختيار المريض أمرا بالغ الأهمية قبل بدء ECMO والحفاظ عليه من أجل تحسين النتائج وتقليل الأحداث الضارة. تناقش هذه المقالة الخطوات المتبعة في بدء VA-ECMO ، وصيانة ما بعد البدء ، والأدلة الكامنة وراء استخدامه ، والمضاعفات المرتبطة بها.
تتكون دائرة ECMO من قنية التدفق ، ومضخة الطرد المركزي ، وجهاز الأكسجين ، وقنية التدفق الخارج (الشكل 1) 11. يتم توصيل قنية التدفق عبر أنابيب بمضخة طرد مركزي ، حيث يولد الدوار الدوار التدفق والضغط. من المضخة ، يتدفق الدم إلى جهاز أكسجين غشائي حيث يحدث تبادل الغازات12. هنا ، يتم تشبع الهيموجلوبين بالأكسجين ، ويتم التحكم في درجة الأكسجين عن طريق تغيير معدل التدفق وزيادة أو تقليل جزء الأكسجين المستوحى (FiO2) الذي يتم توفيره لجهاز الأكسجين. يتم التحكم في إزالة ثاني أكسيد الكربون عن طريق ضبط سرعة اجتياح غاز التيار المعاكس الذي يمر عبر الأكسجين. عادة ما يتم توصيل مبادل حراري بالأكسجين ، وبالتالي يمكن تعديل درجة حرارة الدم العائد إلى الجسم. من المؤكسجين ، يتم إرجاع الدم إلى المريض من خلال قنية التدفق ، إما محيطيا في الشريان الفخذي أو مركزيا في الشريان الأورطي.
Protocol
يتبع هذا البروتوكول إرشادات لجنة أخلاقيات البحث البشري المؤسسية في المركز الطبي بجامعة نبراسكا.
1. اختيار المريض
- ضع في اعتبارك VA-ECMO في المرضى الذين يعانون من CS المقاوم للحرارة كجسر للتعافي عندما يتوقع أن تتحسن وظيفة عضلة القلب بعد الإهانة الأولية ، أو كجسر لاتخاذ القرار ، أو كجسر لعلاج أكثر تحديدا مثل LVAD الدائم أو زرع القلب عندما يكون ضعف عضلة القلب لا رجعة فيه.
ملاحظة: تشمل المؤشرات المختلفة CS الثانوي ل AMI ، وفشل القلب في المرحلة النهائية ، والتهاب عضلة القلب الخاطف ، والكور الرئوي بسبب PEالهائل 13،14،15،16،17. مجال آخر للاستخدام المتزايد هو المرضى الذين يخضعون لجراحة القلب والذين يصابون بمقاومة بعد بضع القلب CS18. - استخدام VA-ECMO في مرضى مختارين يعانون من السكتة القلبية خارج المستشفى الثانوية للرجفان البطيني المقاوم للحرارة / تسرع القلب البطيني لدعم القلب والرئة كجزء من الإنعاش القلبي الرئوي خارج الجسم (ECPR).
ملاحظة: تشير الأدلة المحدودة إلى أن ECPR مرتبط بتحسين البقاء على قيد الحياة ويتم تضمينه الآن في المبادئ التوجيهية للإنعاشالقلبي الرئوي 19،20. - الامتناع عن استخدام VA-ECMO في السيناريوهات التي تنطوي على فشل شديد لا رجعة فيه في الأعضاء النهائية يحد من البقاء على قيد الحياة ، مثل الأورام الخبيثة المتقدمة ، وإصابات الدماغ ، وتسلخ الأبهر ، وعندما لا تتوافق أهداف رعاية المريض مع استخدام MCS21.
ملاحظة: تشمل بعض موانع الاستعمال النسبية أمراض الأوعية الدموية الطرفية التي تعيق القنية أو النزيف غير المنضبط أو موانع استخدام مضادات التخثر. الشيخوخة (>70 سنة) ليست موانع مطلقة. ومع ذلك ، فقد أظهر هؤلاء السكان تاريخيا ضعف البقاء على قيد الحياة في المستشفى مقارنة بالبالغين الأصغرسنا 22.
2. قنية وبدء VA-ECMO
- قم بتسهيل مناقشة متعددة التخصصات قائمة على الفريق تضم أخصائيين متقدمين في قصور القلب وأطباء القلب التداخلي وجراحي القلب والصدر وأخصائيي العناية المركزة قبل بدء مرضى CS على VA-ECMO23.
- إجراء القنية في مختبر القسطرة القلبية أو قسم الطوارئ أو وحدة العناية المركزة لاتباع نهج عن طريق الجلد (القنية المحيطية) ، أو في غرفة العمليات لاتباع نهج جراحي (القنية المركزية) 24.
- بالنسبة للنهج عن طريق الجلد ، قم بتنظيف وإعداد مواقع الوصول باستخدام محلول مطهر مثل الكلورهيكسيدين.
- تحت إشراف الموجات فوق الصوتية ، احصل على وصول وريدي الفخذ باستخدام تقنية Seldinger المعدلة بإبرة وضع غمد صغير 5 Fr25.
- قم بدفع سلك توجيه مرن بطرف J (0.038 بوصة × 180 سم) عبر الوريد الفخذي إلى الوريد الأجوف السفلي (IVC) وقم بتوجيهه إلى الأذين الأيمن.
- قم بتوسيع موقع الوصول الوريدي باستخدام موسعات متسلسلة لتوسيع ممر القنية بشكل متسلسل ، مع تصعيد بواسطة موسع واحد (أحجام 2 Fr). ثم ضع قنية وريدية بحجم مناسب (تجويف واحد).
ملاحظة: يتم تحديد حجم القنية بناء على عمر وجنس وقطر الوعاء على الموجات فوق الصوتية ، بالإضافة إلى التدفقات المرغوبة. تتوفر القنية الوريدية بأحجام 21 فردا إلى 25 فرها ، وعادة ما تكفي قنية 25 فرنسا لمعظم البالغين. - تأكد من أن طرف القنية الوريدية عند تقاطع الجزء داخل الكبد من IVC والأذين الأيمن باستخدام التنظير الفلوري أو الأشعة السينية العادية.
- احصل على وصول الشرايين ، عادة في الشريان الفخذي المقابل ، بطريقة مماثلة باستخدام تقنية Seldinger المعدلة ثم ضع غمدا دقيقا (5 Fr).
- قم بإدخال سلك توجيه مرن على شكل حرف J (0.038 بوصة × 180 سم) أو سلك توجيه صلب في الشريان الفخذي المشترك ثم في الشريان الأورطي.
- ضع قنية شريانية بحجم مناسب (15-21 فرنسا) بعد التمدد التدريجي للجلد والأنسجة تحت الجلد باستخدام الموسسات.
ملاحظة: يتم تحديد حجم القنية لتوفير مؤشر قلبي يبلغ >2.4 لتر / دقيقة /م 2. ستوفر قنية الشرياني 19 Fr دعما كافيا لمعظم البالغين. ومع ذلك ، بالنسبة للإناث الأصغر حجما ، يجب استخدام قنية أصغر حجما. - ضع قسطرة التروية البعيدة (DPC) للتروية القبلية في الشريان الفخذي السطحي المماثل بتقنية Seldinger المعدلة باستخدام إبرة ثقب دقيقة. أدخل DPC 5 Fr وقم بتثبيته بالمنفذ الجانبي للقنية الشريانية باستخدام أنابيب تمديد 6-7بوصة 26.
ملاحظة: تزيد القنيات الشريانية الأكبر حجما تدريجيا من خطر حدوث مضاعفات إقفارية في الطرف المماثل ، خاصة في المرضى الذين يعانون من أمراض الأوعية الدموية الطرفية الأساسية. - قم بتثبيت كل من القنيات الوريدية والشرايين في مكانها عن طريق خياطتها على الجلد بخيوط حريرية 2.0 غير قابلة للامتصاص.
ملاحظة: يتم إجراء القنية المركزية بشكل روتيني في غرفة العمليات وعادة ما تتطلب بضع القص. - إجراء قنية مباشرة للأذين الأيمن والشريان الأورطي بعد بضع الصدر. قم بتثبيتها في مكانها باستخدام خيوط البرولين ذات سلسلة المحفظة 4.0 ، والعنايات ، والحنفيات.
- بعد ذلك ، قم بتثبيت القنيات على جدار الصدر من داخل التجويف باستخدام خيوط متعددة.
- اترك الصدر مفتوحا بضمادة مسدودة أو مغلقا في النهاية. نفق القنيات عبر الجلد عند إغلاق الصدر.
- قم بتوصيل القنيات (الشريانية والوريدية) بدائرة ECMO وزيادة تدفق الدم حتى يتم تحقيق معلمات الجهاز التنفسي والديناميكية الدموية.
3. إدارة ما بعد البدء
- مراقبة المريض
- ضع قسطرة الشريان الرئوي 7.5 فرن فرن للمساعدة في اتخاذ القرار السريري من خلال القياسات الدورية لضغط الشريان الرئوي وضغط إسفين الشعيرات الدموية الرئوية كبديل لضغوط ملء البطين الأيسر.
ملاحظة: يساعد هذا في تحديد المرضى المعرضين لخطر الإصابة بالوذمة الرئوية ، حيث أن VA-ECMO يخلق تحويلة من اليمين إلى اليسار عن طريق تصريف الدم الوريدي من الأذين الأيمن وإعادة الدم المؤكسج إلى الشرايين الحرقفية / الشريان الأورطي الهابط. بينما يتم تقليل الحمل المسبق ، فإن الزيادة في الحمل اللاحق باستخدام VA-ECMO يمكن أن تزيد من خطر الإصابة بالوذمة الرئوية لدى المرضى الذين يعانون من CS والذين يعانون بالفعل من خلل وظيفي أساسي في LV. - ضع الخطوط الشريانية في الشرايين الشعاعية اليمنى أو الشعاعية اليسرى باستخدام تقنية البزل الدقيق بمساعدة سلك التوجيه27.
ملاحظة: يساعد هذا في تحديد موقع مستجمعات المياه (المنطقة الموجودة في القوس الأبهري حيث يلتقي التدفق الأمامي من البطين الأيسر بالتدفق المرتجع من قنية الشريان)28. - مراقبة تشبع الأكسجين من موقع الشريان الكعبري الأيمن لتقييم أكسجة الجزء العلوي من الجسم (الطرف العلوي الدماغي والأمين العلوي). إجراء تحليل غازات الدم الشرياني كل 8-12 ساعة لضمان الأكسجين الكافي29.
- اضبط FiO2 على جهاز الأكسجين (اطلب المقبض) للحفاظ على 60-100 مم زئبق PaO2.
ملاحظة: عادة ما يتم ضبط FiO2 على 100٪ عند بدء VA-ECMO ويتم معايرته لاحقا مع تحسن الأكسجين. - قم بتحسين التهوية ، وبالتالي إزالة ثاني أكسيد الكربون عن طريق ضبط سرعة المسح إلى ما بين 3-7 لتر / دقيقة لتصحيح أي حماض تنفسي.
- مراقبة علامات التروية الطرفية بشكل متسلسل مثل اللاكتات ، SvO2 ، الترانسامينازات ، وإزالة الكرياتينين عن طريق تحليل الغازات الوريدية30،31.
ملاحظة: يجب أن يكون الهدف SvO2 >70٪ واللاكتات أقل من 2.2 مليمول / لتر.
- ضع قسطرة الشريان الرئوي 7.5 فرن فرن للمساعدة في اتخاذ القرار السريري من خلال القياسات الدورية لضغط الشريان الرئوي وضغط إسفين الشعيرات الدموية الرئوية كبديل لضغوط ملء البطين الأيسر.
- ضبط تدفق وإدارة الثرثرة الوريدية
- اضبط التدفق عبر الدائرة للسماح بنضح الجهاز النهائي الكافي (التدفق المستهدف 60 سم مكعب / كجم / دقيقة). قم بتغيير التدفق عن طريق ضبط سرعة المضخة. حافظ على تدفق 4-6 لتر / دقيقة في البداية بعد القنية.
ملاحظة: يمكن أن تؤدي السرعات العالية للمضخة ، ونقص حجم الدم ، والقنية الوريدية غير الصحيحة إلى الثرثرة الوريدية ، والتي تتجلى في شكل شفط أو "صراخ" للقنية الوريدية32. يمكن أن تؤدي الثرثرة الوريدية إلى انحلال الدم عن طريق التسبب في فراغ في رأس المضخة ، حيث يستمر الدوار في المضخة في الدوران وإخلاء الدم من المضخة. - تصحيح الثرثرة الوريدية عن طريق الإنعاش السائل في حالات نقص حجم الدم. أعد وضع القنية الوريدية في حالة سوء الوضع أو الالتواء. تقليل سرعة المضخة في حالة السرعة العالية33,34.
- قلل من الثرثرة الوريدية عن طريق ربط خزان وريدي أو مثانة قابلة للطي بقنية التدفق. هذا يسمح بتقليل شفط قنية التدفق من خلال توفير حجم للمضخة.
- اضبط التدفق عبر الدائرة للسماح بنضح الجهاز النهائي الكافي (التدفق المستهدف 60 سم مكعب / كجم / دقيقة). قم بتغيير التدفق عن طريق ضبط سرعة المضخة. حافظ على تدفق 4-6 لتر / دقيقة في البداية بعد القنية.
- تفريغ البطين الأيسر
ملاحظة: يمكن أن تؤدي الزيادة في الحمل اللاحق من تدفق VA-ECMO الرجعي إلى ارتفاع الضغط الانبساطي المنخفض (LVEDP) وبالتالي تفاقم الوذمة الرئوية ، وقد تؤدي الحالات الشديدة من توقف الجهد المنخفض إلى تكوين الجلطة من ركودالدم 35.- لتفريغ الجهد المنخفض وتقليل الحمل اللاحق ، استخدم التقلص مثل الدوبوتامين (جرعة البداية من 1-2 ميكروغرام / كجم / دقيقة) أو موسعات الأوعية مثل الهيدرالازين أو النترات36،37،38.
ملاحظة: ومع ذلك ، عادة ما تكون هذه غير كافية ، وقد تكون هناك حاجة إلى التفريغ الميكانيكي للجهد المنخفض. - ضع جهاز دعم البطين (على سبيل المثال ، Impella) أو مضخة بالون داخل الأبهر (IABP) عن طريق الجلد لإنجاز التفريغ المباشر ل LV. لإنجاز التفريغ غير المباشر للشفط الرئوي، ضع قنية الشريان الرئوي عن طريق الجلد أو قم بإجراء فغر الحاجز الأنفي بالبالون.
ملاحظة: يمكن أيضا استخدام التقنيات الجراحية ، بما في ذلك التصريف الأذيني الأيسر عبر الحاجز أو القنية المباشرة لقمة LV ، لتفريغ LV39.
- لتفريغ الجهد المنخفض وتقليل الحمل اللاحق ، استخدم التقلص مثل الدوبوتامين (جرعة البداية من 1-2 ميكروغرام / كجم / دقيقة) أو موسعات الأوعية مثل الهيدرالازين أو النترات36،37،38.
- مضاد للتخثر
- بدء مضادات التخثر الجهازية في وقت القنية. استخدم جرعة من 50-100 وحدة دولية / كجم من الهيبارين الوريدي (موصى به) متبوعا بالهيبارين المستمر على النحو التالي.
- استمر في الهيبارين غير المجزأ للحفاظ على وقت الخثرة الجزئي المنشط أو وقت التخثر المنشط بما لا يقل عن 1.5 مرة من الحد الأعلى للحد الطبيعي أثناء الفحوصات المعملية (كل 4-6 ساعات).
- في المرضى الذين يعانون من قلة الصفيحات الناجم عن الهيبارين ، استخدم مثبطات الثرومبين المباشرة مثل بيفاليرودين (جرعة تبدأ من 0.025-0.05 مجم / كجم / ساعة) 40 أو أرجاتروبان (جرعة تبدأ من 0.05-2 ميكروغرام / كجم / دقيقة) 41 للوصول إلى المستويات العلاجية.
4. الوقاية من المضاعفات وإدارتها
- متلازمة Harlequin (الشمال والجنوب)
ملاحظة: يمكن أن يحدث الزرقة التفاضلية في الجزء العلوي من الجسم عندما يكون مستجمعات المياه (المنطقة التي يلتقي فيها التدفق الرجعي الذي يحتوي على دم مؤكسج من قنية التدفق الخارجة بالدم المسبق من LV) بعيدا عن أصل الأوعية الفرعية القوسية الأبهرية في مكان الفشل التنفسي المصاحب. يزود الدم غير المؤكسج من LV الجزء العلوي من الجسم من خلال الشرايين السباتية وتحت الترقوة ، بينما يتم توفير الجزء السفلي من الجسم عن طريق الدم من قنية التدفق الخارجي ل VA-ECMO. تسمى هذه الظاهرة متلازمة Harlequin أو متلازمة الشمال والجنوب (الجزء العلوي من الجسم أزرق ، والجزء السفلي من الجسم وردي).- إدارة هذا الزرقة التفاضلية عن طريق زيادة تشبع الأكسجين للدم العائد إلى LV إما عن طريق زيادة FiO2 أو ضغط الزفير الإيجابي إذا كان المريض في حالة تهوية ميكانيكية أو عن طريق إعادة الدم المؤكسج إلى الأذين الأيمن ، عادة من خلال قنية أخرى يتم إدخالها في الوريد الوداجي الداخلي المتصل بالطرف الشرياني لدائرة ECMO (V-A-V ECMO).
- راقب تشبع أكسجة الجزء العلوي من الجسم كل 8-12 ساعة باستخدام تحليل الغازات الشريانية (ABG) من الشريان الكعبري الأيمن. يتم ضمان أكسجة الأنسجة الكافية مع 60-100 مم زئبق من PaO2 على ABG42.
- نقص تروية الأطراف السفلية
ملاحظة: واحدة من أخطر مضاعفات قنية الشرايين المحيطية هي نقص التروية الأمامية في الطرف السفلي الذي نادرا ما يؤدي إلى متلازمة الحيز ، وفي الحالات القصوى ، قد يتطلب البتر43. معدل حدوث نقص تروية الأطراف متغير ، يتراوح من 10٪ إلى 70٪ ، كما ذكرت دراسات مختلفة44.- اختر قنية ذات حجم مناسب بناء على قطر الشرايين الفخذية في الموجات فوق الصوتية ، وبالتالي من المحتمل تقليل المضاعفات الإقفارية للأطراف السفلية.
- مراقبة الدورة الدموية للأطراف السفلية بعد القنية باستخدام دوبلر النبضي التسلسلي أو التحليل الطيفي للأشعة تحت الحمراء القريبة (NIRS) 44. NIRS هي أداة تصوير غير جراحية للوصول إلى أنسجة الأكسجين45.
- إجراء تقييم مستمر لأكسجة أنسجة الأطراف السفلية باستخدام NIRS. ضع وسادات المستشعر على عضلات الساق المتصلة بمقياس التأكسج للكشف بسهولة عن أي تغيير في أكسجة الأنسجة ، وهو مؤشر على التروية.
- إدخال قسطرة التروية المسبقة (5-7 فرن) في الشريان الفخذي السطحي في وقت قنية الأكسجين خارج الجسم لمنع المضاعفات الإقفارية في الطرف السفلي.
- النزيف وانحلال الدم
ملاحظة: درجة صغيرة من انحلال الدم شائعة بعد بدء VA-ECMO. تشمل أسباب انحلال الدم الكبير تجلط المضخة والتخثر في دائرة ECMO.- راقب بعناية انحلال الدم المهم سريريا. قياس مستويات الهيموجلوبين ونازعة هيدروجين اللاكتات والبيليروبين والكرياتينين يوميا.
- ضع في اعتبارك مقاطعة مضادات التخثر الجهازية في المرضى الذين يعانون من نزيف حاد وقلة الصفيحات46. ومع ذلك, هذا قد يزيد من خطر المضاعفات الخثارية; وبالتالي ، يجب إجراء تقييم دقيق لمخاطر النزيف والتخثر قبل تناول مضادات التخثر.
- انسداد الهواء
ملاحظة: يمكن أن يحدث انحباس الهواء في دائرة ECMO من التوصيلات المفكوكة أو الوصول الوريدي المحيطي أو المركزي أو تمزق غشاء الأكسجين47. يمكن أن يؤدي إلى انسداد الهواء ، والذي يمكن أن يسبب سكتة دماغية إذا دخلت فقاعات الهواء في الدورة الدماغية.- ضع المريض في وضع Trendelenburg أثناء استخدام دعامة التهوية وقم بتثبيت دائرة ECMO لإدارة انسداد الهواء
- قم بإزالة الهواء وإعادة تجهيز الدائرة عند الاشتباه في انسداد الهواء. في بعض الأحيان ، قد تحتاج الدائرة بأكملها إلى الاستبدال.
5. الفطام من ECMO
- تقييم المرضى للفطام بمجرد تعافيهم من الإهانة الأولية التي دفعت إلى استخدام VA-ECMO.
ملاحظة: يجب أن يكون قد تم حل الفشل التنفسي المصاحب قبل الفطام. - إجراء مخطط صدى القلب التسلسلي لتقييم التحسن في وظائف القلب والاستعداد للفطام.
- تأكد من استقرار الدورة الدموية قبل فطام المريض من VA-ECMO.
ملاحظة: يجب أن يكون المرضى قد تعافوا من شكل الموجة الشريانية النابضة لمدة 24 ساعة على الأقل ، ويجب أن يكون متوسط الضغط الشرياني >60 مم زئبق في حالة عدم وجود أو مع استخدام جرعة منخفضة من الضاغطاتالوعائية 48. - أثناء الفطام ، قم بإجراء دراسة تخطيط صدى القلب ، حيث يتم تقليل تدفق ECMO تدريجيا إلى 1-1.5 لتر / دقيقة كحد أدنى. ضمان استقرار الدورة الدموية وتقييم وظائف القلب في مخطط صدى القلب.
ملاحظة: الجزء القذفي للبطين الأيسر (LV) من >20٪ -25٪، وتكامل سرعة الأبهر والوقت >10 سم، وذروة سرعة الانقباضية للحلقة التاجية الجانبية البالغة >6 سم / ثانية أثناء دراسة الترتيب هي تنبؤات بنجاح الفطام49. - مراقبة المعلمات المختبرية لنضح الأعضاء الطرفية مثل اللاكتات و SvO2 ووظيفة الكلى أثناء فطام المرضى.
- لتسهيل عملية الفطام ، ضع جسر فطاممبسط 50 بين المريض ودائرة ECMO قبل الإزالة (هذه الخطوة اختيارية).
ملاحظة: يسمح جسر الفطام بمراقبة المرضى بعيدا عن دعم ECMO ويوفر فرصة للعودة إلى دائرة ECMO كلما لزم الأمر في بضع دقائق. يتكون من أنبوب طويل يربط قنيات التدفق والخارج. - ضع المشابك على كل من قنيات التدفق والتدفق القريبة من جسر الفطام ، باتجاه جانب المريض ، وبالتالي فصل المريض عن دائرة ECMO والسماح للدم بإعادة الدوران داخل دائرة ECMO.
- بعد تثبيت الدائرة ، راقب المرضى لمدة تصل إلى 24 ساعة قبل التفريغ. في حالة الحاجة إلى دعم ديناميكي الدم ، أعد بدء تدفق ECMO ببساطة عن طريق إزالة مشابك الأنابيب.
- لزيادة الفطام ، استخدم جهاز دعم البطين (على سبيل المثال ، Impella) والذي يمكن أن يوفر ما يصل إلى 5 لتر / دقيقة من التدفق. قم بزيادة التدفق من جهاز دعم البطين وخفض تدفق VA-ECMO بشكل منهجي مع ضمان الاستقرار الديناميكي للدم.
ملاحظة: تتمثل إحدى مزايا جهاز الدعم البطيني في أنه يمكن زراعته باستخدام نهج إبطي ، مما يسمح بالتنزه المبكر بعد إزالة VA-ECMO51. - بمجرد اعتبار المريض مرشحا لإزالة VA-ECMO ، قم بإجراء عملية إزالة الأقمص في غرفة العمليات أو مختبر قسطرة القلب.
ملاحظة: سيحتاج معظم المرضى الذين يعانون من قنية الشرايين الطرفية إلى درجة معينة من إصلاح الأوعية الدموية.
النتائج
يتراوح البقاء على قيد الحياة حتى الخروج من المستشفى بعد استخدام VA-ECMO في CS المقاوم للحرارة من 28-67٪ 13،15،52،53،54،55،56 ، كما ذكرت دراسات الملاحظة المختلفة (الجدول 1). تختلف النتائج بناء على مسببات CS. في سجل ELSO ، تم دعم 9,025 بالغا بدعم الحياة خارج الجسم (ECLS) من عام 1990 إلى عام 2015. كان CS هو التشخيص الأكثر شيوعا المرتبط باستخدام ECLS ، حيث بلغ معدل البقاء على قيد الحياة حتى الخروج 42٪ فقط 10. كان لدى البالغين المصابين بالتهاب عضلة القلب أفضل بقاء على قيد الحياة (65٪) ، في حين أن البالغين الذين يعانون من عيب خلقي في القلب لديهم أسوأ بقاء على قيد الحياة (37٪). يمثل CS بعد بضع القلب مجموعة سكانية أخرى ذات نتائج أسوأ في المستشفى بعد بدء VA-ECMO مع بقاء على قيد الحياة في المستشفى تتراوح بين 30-40٪ 53،54. أظهر التحليل التلوي ل 17 دراسة أن تفريغ الجهد المنخفض في VA-ECMO كان مرتبطا بانخفاض في معدل الوفيات مقارنة بعدم التفريغ57. يمكن أن تؤدي المضاعفات المختلفة من VA-ECMO نفسه إلى زيادة في المراضة والوفيات المرتبطة ب CS. على سبيل المثال ، لوحظت أحداث النزيف في 45-60٪ من المرضى الذين يخضعون ل ECMO58،59، وقد ارتبط وقت الثرومبوبلاستين الجزئي المنشط المرتفع بزيادة خطر الإصابة بمضاعفات نزفية. أظهر تحليل تلوي حديث ل 44 دراسة60 لتقييم البقاء على قيد الحياة على المدى الطويل بعد استخدام VA-ECMO في CS المقاوم للحرارة أن البقاء على قيد الحياة الإجمالي في 1 و 5 سنوات كان 36.7٪ و 29.9٪ على التوالي. وبالتالي ، على الرغم من استخدام VA-ECMO كطريقة إنقاذ في المرضى الذين يعانون من CS ، لا يزال معدل الوفيات داخل المستشفى وطويل الأمد مرتفعا. علاوة على ذلك ، تشير بعض الأدلة إلى أن الفطام الناجح ل VA-ECMO لا يتنبأ دائما بالبقاء على قيدالحياة 48. يبلغ معدل الوفيات في المستشفى لدى المرضى الذين تم فطمهم بنجاح من VA-ECMO حوالي 25٪ 61. أظهرت تجربة حديثة متعددة المراكز عشوائية مضبوطة ECMO-CS على 117 مريضا أن الاستخدام المبكر ل VA-ECMO لصدمة المرحلة D-E لم يحسن النتائج السريرية مقارنة بالإدارة المحافظة المبكرة التي سمحت باستخدام VA-ECMO في حالة تفاقم ديناميكا الدم62. في المقابل ، أظهرت تجربة ARREST العشوائية ذات المراقبةالعشوائية لمركز واحد 63 أن الإنعاش المبكر الذي يسهله ECMO للسكتة القلبية خارج المستشفى والرجفان البطيني المقاوم للحرارة يحسن البقاء على قيد الحياة حتى الخروج من المستشفى مقارنة بالعلاج القياسي المتقدم لدعم الحياة القلبي الوعائي (ACLS). يجب أن تركز الأبحاث المستقبلية على تحديد المرضى المعرضين لخطر الأحداث الضائرة بعد الفطام وإزالة الوقود من VA-ECMO.
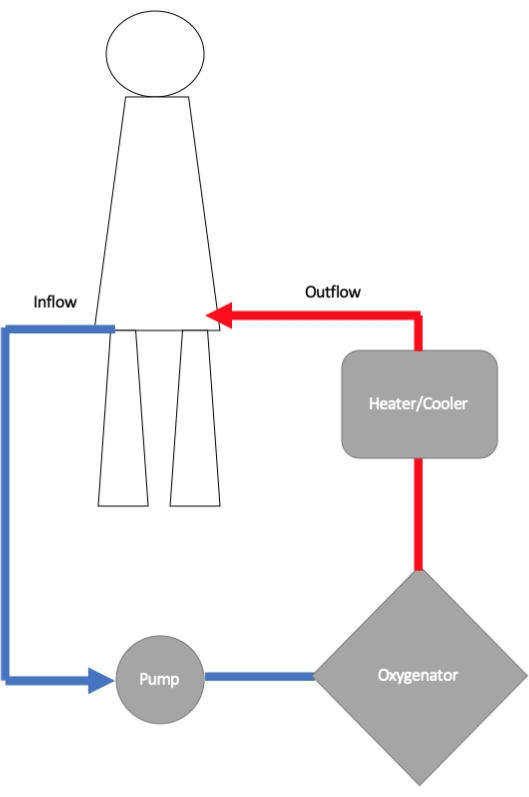
الشكل 1: رسم تخطيطي يوضح مكونات مختلفة لدائرة الأكسجين الغشائي الوريدي خارج الجسم (VA-ECMO). تجلب قنية التدفق الدم من الجسم إلى مضخة ECMO حيث يتم إرسال الدم إلى جهاز الأكسجين للأكسجين. يتم تحسين درجة حرارة الدم قبل إعادته إلى الجسم عن طريق قنية التدفق التي يتم إدخالها في شريان تجويف كبير (الأكثر شيوعا في الشريان الفخذي). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| المؤلف ، السنة | بلد | تصميم | إجمالي عدد المرضى (ن) | مسببات الصدمة القلبية | البقاء على قيد الحياة في المستشفى (٪) | ||
| أسو, 201615 | اليابان | اثر رجعي | 4658 | أمراض القلب الإقفارية ، قصور القلب ، أمراض صمامات القلب ، التهاب عضلة القلب | 26.4 | ||
| سميث ، 201752 | عالمي | اثر رجعي | 2699 | التهاب عضلة القلب، مرض الشريان التاجي، أمراض القلب الهيكلية، ما بعد زراعة القلب، جهاز المساعدة بعد البطين | 41.4 | ||
| تشين, 201753 | تايوان | اثر رجعي | 1141 | صدمة ما بعد بضع القلب | 38.3 | ||
| Thiagarajan ، 201710 | الولايات المتحدة الأمريكية | اثر رجعي | 9025 | متعدد العوامل | 42 | ||
| الرستن, 201054 | ألمانيا | اثر رجعي | 517 | تطعيم مجازة الشريان التاجي ، جراحة الصمام ، تطعيم مجازة الشريان التاجي بالإضافة إلى جراحة الصمام ، زرع الأعضاء الصدرية ، أخرى | 24.8 | ||
الجدول 1: دراسات قائمة على الملاحظة المختارة التي أبلغت عن البقاء على قيد الحياة في المستشفى في المرضى الذين يعانون من الصدمة القلبية (CS) الذين خضعوا للأكسجين الغشائي الوريدي خارج الجسم (VA-ECMO). تسلط هذه الدراسات الضوء على أن بقاء المرضى الذين يحتاجون إلى ECMO في المستشفى لا يزال منخفضا ، ويتراوح بين 24.8-42٪.
Discussion
في هذا البروتوكول ، يتم وصف الخطوات المختلفة التي ينطوي عليها بدء وصيانة VA-ECMO في المرضى الذين يعانون من CS المقاوم للحرارة. تمت أيضا مناقشة بعض المضاعفات الرئيسية ومعلمات الفطام والنتائج مع استخدام VA-ECMO.
عادة ما يتم استخدام VA-ECMO كعلاج إنقاذ عندما تفشل استراتيجيات الإدارة الأخرى في توفير الدعم الديناميكي الدموي الكافي في CS. يتضمن القنية وصولا للأوعية الدموية ذات التجويف الكبير والذي يجب إجراؤه بدقة لتقليل إصابة الأوعية الدموية ومخاطر النزيف. بمجرد بدء VA-ECMO ، يجب مراقبة المرضى في وحدة العناية المركزة للقلب والأوعية الدموية المجهزة بأخصائيي التروية والممرضات الذين تلقوا تدريبا متخصصا في التعامل مع دوائر ECMO. يجب تقييم المرضى للفطام يوميا ويجب إجراء عملية الفطام في أقرب وقت ممكن بمجرد حدوث الشفاء القلبي أو عند تحديد علاجات أكثر تحديدا في محاولة لتقليل المضاعفات.
زاد استخدام VA-ECMO بشكل كبير على مدى العقدين الماضيين مع وجود قائمة موسعة من المؤشرات. على الرغم من الزيادة في توافر وانتشار الاستخدام ، لا يزال معدل الوفيات في CS مرتفعا. يعد اختيار المريض أمرا بالغ الأهمية لضمان التخصيص الحكيم للموارد مع التخفيف أيضا من المضاعفات المرتبطة ب VA-ECMO. تم تطوير العديد من أنظمة التسجيل للتنبؤ ببقاء المرضى الذين يخضعون لعلاج VA-ECMO. تم إنشاء البقاء على قيد الحياة بعد الوريد الشرياني ECMO (حفظ) الدرجة61 باستخدام بيانات من سجل ELSO وهو مفيد في التنبؤ بالبقاء على قيد الحياة لدى المرضى قبل بدء VA-ECMO. يتم التسجيل بناء على مسببات CS ، والعمر ، والوزن ، وفشل الأعضاء الحاد (الكلوي ، والكبد ، و / أو الجهاز العصبي المركزي) ، والفشل الكلوي المزمن ، ومدة التنبيب ، وذروة ضغط الشهيق ، وضغط الانبساطي ومتوسط النبض ، والسكتة القلبية ، وقيم البيكربونات. بناء على درجة SAVE ، يتم تقسيم المخاطر إلى خمس فئات مخاطر مختلفة (الفئة الأولى إلى الخامسة). ترتبط الدرجات المنخفضة بفئة مخاطر أعلى ومعدلات بقاء أسوأ في المستشفى. تم التحقق من صحة نظام التسجيل هذا أيضا خارجيا في 161 مريضا أستراليا وأظهر تمييزا ممتازا مع منطقة تحت منحنى خصائص التشغيل المستقبلة 0.90 (فاصل ثقة 95٪ من 0.85-0.95). تم تطوير درجة SAVEالمعدلة 64 التي تتضمن اللاكتات لاحقا وثبت أن لديها تنبؤا ممتازا بالنتائج في المرضى الذين يخضعون لبدء VA-ECMO في غضون 24 ساعة من الوصول إلى قسم الطوارئ. تم مؤخرا تطوير والتحقق من صحة أداة تنبؤ مبسطة أخرى تسمى PREDICT VA-ECMOSCORE 65 باستخدام قياسات المؤشرات الحيوية في نقطة الرعاية (اللاكتات والأس الهيدروجيني وتركيز البيكربونات) في 1 و 6 و 12 ساعة. لا يزال تحديد مجموعات المرضى المعرضين لخطر الأحداث الضائرة بعد VA-ECMO والاستخدام اللاحق للعلاجات الأكثر تحديدا مجالا ذا أهمية مستمرة.
تشير البينات المحدودة إلى أن البدء المبكر ب VA-ECMO بعد تشخيص CS قد يحسن البقاء على قيدالحياة 13. لم تظهر تجربة ECMO-CS التي أجراها Ostadal et al. اختلافا في معدل الوفيات من أي سبب في المرضى الذين يتلقون العلاج المبكر ب VA-ECMO مقابل الإستراتيجيةالتحفظية 62. ومع ذلك ، لم يتم التحقق من صحة هذا بطريقة عشوائية. اختبار قيمة الاستراتيجية الجديدة وفعاليتها من حيث التكلفة من أجل تحسين النتائج السيئة في تجربة الصدمة القلبية (EUROSHOCK) (معرف ClinicalTrials.gov: NCT03813134) هي تجربة سريرية عشوائية مستمرة ستقيم ما إذا كان البدء المبكر للصدمة القلبية خارج الجسم في مرضى الصدمة القلبية المنشأة المصابين ب CS يحسن البقاء على قيد الحياة لمدة 30 يوما عند مقارنته بالعلاج القياسي. وبالمثل ، فإن تجربة دعم الحياة خارج الجسم في الصدمة القلبية (ECLS-SHOCK) (معرف ClinicalTrials.gov: NCT03637205) ستفحص ما إذا كان ECLS بالإضافة إلى إعادة التوعي والعلاج الطبي مفيدا عند مقارنته بعدم استخدام ECLS في AMI المعقد بسبب CS.
يتطلب بدء وصيانة VA-ECMO موارد رعاية صحية كبيرة قد تكون متاحة فقط في مستشفيات الرعاية الثالثة. يجب على المجتمعات المحلية بالتعاون مع أنظمة الرعاية الصحية التركيز على تطوير "نموذج محطم ومحوري"66 مع المستشفيات الطرفية الصغيرة التي تحيل المرضى المصابين ب CS فور التشخيص إلى مستشفى مركزي من الدرجة الثالثة مع فرق منظمة VA-ECMO.
Disclosures
جون أم هو مستشار في مختبرات أبوت ومستشار لشركة ميدترونيك. يكشف بونام فيلاجابودي عن تلقي رسوم التحدث من Abiomed و Medtronic و Opsens و Shockwave Medical ورسوم المشاركة في المجالس الاستشارية في Abiomed و Sanofi. المؤلفون الآخرون ليس لديهم ما يكشفون عنه.
Acknowledgements
اي.
Materials
| Name | Company | Catalog Number | Comments |
| Amplatz Super Stiff guidewire | Boston Scientific | 46-500, 46-501, 46-502. 46-503, 46-504, 46-517, 46-519, 46-520, 46-523, 46-525, 46-526, 46-563, 46-564, 46-509, 46-510, 46-518, 46-524 | Allows delivery of catheters across tortuous anatomies |
| Impella | Abiomed | Impella 2.5, Impella CP, Impella 5.0, Impella 5.5, Impella RP | Percutaneously inserted left ventricular assist device that provides hemodynamic support in cardiogenic shock |
| Inflow Cannula | Surge Cardiovascular | FEM-V1020, FEM-V1022, FEM-V1024, FEM-V1026,FEM-V1028 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus 96600-019,021,023,025,027,029 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus Femoral Venous 96670 - 017,019, 021, 023 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus Multi-Stage Femoral Venous 96880-019,021,025 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Biomedicus NextGen 96600 - 115, 117, 119, 121, 123, 125, 127, 129 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Carmeda Biomedicus CB96605-015,017,019,021,023,025,29 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Cortiva Biomedicus Femoral Venous CB96670-015,017,019,021 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | DLP Carmeda Venous CB75008, CB66112, CB66114, CB66116, CB66118, CB66120, CB66122,CB66124 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | Avalon Elite Bicaval - 10013, 10016, 10019, 10020, 10023, 10027, 10031 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous Bioline - BE PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous Softline - BO PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Getinge | HLS Cannula Venous - PVS 1938, 2138, 2155, 2338, 2355, 2538, 2555, 2955 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Life Support Bio-Medicus Drainage Catheter and Introducers - LS96218 - 015, 017, 019, 021, 023, 025 ; LS96438 - 021, 023, 025, LS 96555 - 019, 021, 023, 025, LS 96355 - 021, LS96360 -023, 025, 027, 029 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Fresenius | Medos Femoral Cannula MEFKV 18,20,22,24,26,28 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Medtronic Cardiopulmonary | Medtronic 2 stage venous - 91228, 91240, 91246, 91236,91251 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Senko/Mera | PCKC-V-24, PCKC-V2-18, PCKC-V-18, PCKC-V2-20, PCKC-V-20, PCKC-V-22, PCKC-V2-24, PCKC-V-24 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | TandemLife/Livanova | 29,31 Fr | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Freelife Medical | FLK V19 B18, FLK V19 B18R, FLK VV 19R, FLK V20 B20, FLK V20 B20R, FLK V19 B20, FLK V19 B20R, FLK V20 B22, FLK V20 B22R, FLK V10S B22, FLK V19 B22, FLK V19 B22R, FLK V10 B22, FLK V10 B22R, FLK V10S B22R, FLK VV 23R, FLK V10S B24, FLK V10S B24R, FLK V10 B24, FLK V10 B24R, FLK V10S B26, FLK V10S B26R, FLK V10 B26, FLK V10 B26R, FLK VV 27R, FLK VV 31R | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | LivaNova | Sorin right angle venous - 10, 12, 14, 16, 18, 20, 22, 24, 28 | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Inflow Cannula | Terumo | CX-EB18VLX, CX-EB21VLX | Removes deoxygenated blood from the central venous circulation into the ECMO circuit |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus Arterial 96530 - 015,017, 019, 021, 023, 025, | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus Femoral Arterial 96570 - 015, 017, 019, 021 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Biomedicus NextGen Arterial 96530 -115, 117, 119, 121, 123, 125, 96570 - 115, 117, 119, 121 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Carmeda Biomedicus CB96535 - 015, 017, 019, 021, 023 | Returns oxygenated blood to the body |
| Outflow Cannula | Medtronic Cardiopulmonary | Cortiva Biomedicus Femoral Arterial CB96570 -015, 017, 019, 021 | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | PAS 1315, PAS 1515, PAS 1523, PAS 1717, PAL 1723, PAL 1923, PAL 2115, PAL 2123, PAL 2315, PAL 2323 | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | Bioline BE PAS 1315, BE PAS 1515, BE PAL 1523, BE PAL 1723, BE PAS 1915, BE PAL 1923, BE PAS 2115, BE PAL 2123, BE PAS 2315, BE PAL 2323, | Returns oxygenated blood to the body |
| Outflow Cannula | Getinge | Softline BO PAS 1315, BO PAS 1515, BO PAL 1523, BO PAS 1715, BO PAL 1723, BO PAS 1915, BO PAL 1923, BO PAS 2115, BO PAL 2123, BO PAL 2323 | Returns oxygenated blood to the body |
| Outflow Cannula | Fresenius | Medos Femoral Arterial Cannula; MEFKA 16, 18, 20, 22,24 | Returns oxygenated blood to the body |
| Outflow Cannula | Senko/Mera | PCKC-A-20, PCKC-A-16, PCKC-A-18 | Returns oxygenated blood to the body |
| Outflow Cannula | Freelife Medical | FLK A18 D16, FLK A18L D16, FLK A18L D16R, FLK A18 D16R, FLK A44 D18, FLK A44 D18R, FLK A18 D18, FLK A18L D18, FLK A18L D18R, FLK A18 D18R, FLK A44 D20, FLK A44 D20R, FLK A18 D20, FLK A18L D20, FLK A18L D20R, FLK A18 D20R, FLK A18 D22, FLK A18L D22, FLK A18L D22R, FLK A18 D24, FLK A18L D24, FLK A18L D24R, FLK A18 D24R | Returns oxygenated blood to the body |
| Outflow Cannula | LivaNova | Sorin arterial - 14, 17, 19, 21, 23 Fr | Returns oxygenated blood to the body |
| Outlflow Cannula | Medtronic Cardiopulmonary | Life Support Bio-Medicus Return Catheter and Introducers - LS96010-009, LS96010-011, LS96010-013, LS96010-015, LS96218-015, LS96218-017, LS96218-019, LS96218-021, LS96218-023, LS96218-025 | Returns oxygenated blood to the body |
| Oxygenator | Abbott | Eurosets | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Oxygenator | Getinge | MaquetHLS Set Advanced v 5.0, v 7.0, Maquet Quadrox iD | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Oxygenator | Medtronic | Nautilus | Deoxygenated blood from the inflow cannula is saturated with oxygen |
| Pump | Abiomed | Breethe | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | Alcard ALC 250 | Generates force to deliver oxygenated blood back to the body |
| Pump | Baxter | Century Roller Pump | Generates force to deliver oxygenated blood back to the body |
| Pump | Medtronic Cardiopulmonary | Biomedicus BP50, BP80 Centrifugal | Generates force to deliver oxygenated blood back to the body |
| Pump | Braile Biomedica | Safyre | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | CiSet | Generates force to deliver oxygenated blood back to the body |
| Pump | Abbott | CentriMag | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | Cobe 6" Roller | Generates force to deliver oxygenated blood back to the body |
| Pump | Origen | FloPump 32 | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | HIT Set Advanced Softline 5.0 and 7.0 | Generates force to deliver oxygenated blood back to the body |
| Pump | LivaNova | LifeSPARC | Generates force to deliver oxygenated blood back to the body |
| Pump | Senko/Mera | Centrifugal pump head | Generates force to deliver oxygenated blood back to the body |
| Pump | Getinge | HLS Set Advanced Bioline 5.0 and 7.0 | Generates force to deliver oxygenated blood back to the body |
| Tandem Heart | LivaNova | Tandem Heart LS | Percutaneously inserted left ventricular assist device |
References
- Shah, M., et al. Trends in mechanical circulatory support use and hospital mortality among patients with acute myocardial infarction and non-infarction related cardiogenic shock in the United States. Clinical Research in Cardiology. 107 (4), 287-303 (2018).
- Goldberg, R. J., Spencer, F. A., Gore, J. M., Lessard, D., Yarzebski, J. Thirty-year trends (1975 to 2005) in the magnitude of, management of, and hospital death rates associated with cardiogenic shock in patients with acute myocardial infarction: a population-based perspective. Circulation. 119 (9), 1211-1219 (2009).
- Hochman, J. S., et al. Early revascularization in acute myocardial infarction complicated by cardiogenic shock. SHOCK Investigators. Should We Emergently Revascularize Occluded Coronaries for Cardiogenic Shock. The New England Journal of Medicine. 341 (9), 625-634 (1999).
- Hochman, J. S., et al. One-year survival following early revascularization for cardiogenic shock. JAMA. 285 (2), 190-192 (2001).
- Schumann, J., et al. Inotropic agents and vasodilator strategies for the treatment of cardiogenic shock or low cardiac output syndrome. The Cochrane Database of Systematic Reviews. 1 (1), 009669 (2018).
- Léopold, V., et al. Epinephrine and short-term survival in cardiogenic shock: an individual data meta-analysis of 2583 patients. Intensive Care Medicine. 44 (6), 847-856 (2018).
- De Backer, D., et al. Comparison of dopamine and norepinephrine in the treatment of shock. The New England Journal of Medicine. 362 (9), 779-789 (2010).
- Strom, J. B., et al. National trends, predictors of use, and in-hospital outcomes in mechanical circulatory support for cardiogenic shock. EuroIntervention. 13 (18), 2152-2159 (2018).
- Stentz, M. J., et al. Trends in extracorporeal membrane oxygenation growth in the United States, 2011-2014. ASAIO Journal. 65 (7), 712-717 (2019).
- Thiagarajan, R. R., et al. Extracorporeal life support organization registry international report 2016. ASAIO Journal. 63 (1), 60-67 (2017).
- Lequier, L., Horton, S. B., McMullan, D. M., Bartlett, R. H. Extracorporeal membrane oxygenation circuitry. Pediatric Critical Care Medicine. 14 (5), 7-12 (2013).
- Schmidt, M., et al. Blood oxygenation and decarboxylation determinants during venovenous ECMO for respiratory failure in adults. Intensive Care Medicine. 39 (5), 838-846 (2013).
- Sheu, J. J., et al. Early extracorporeal membrane oxygenator-assisted primary percutaneous coronary intervention improved 30-day clinical outcomes in patients with ST-segment elevation myocardial infarction complicated with profound cardiogenic shock. Critical Care Medicine. 38 (9), 1810-1817 (2010).
- Belohlavek, J., et al. Veno-arterial ECMO in severe acute right ventricular failure with pulmonary obstructive hemodynamic pattern. The Journal of Invasive Cardiology. 22 (8), 365-369 (2010).
- Aso, S., Matsui, H., Fushimi, K., Yasunaga, H. In-hospital mortality and successful weaning from venoarterial extracorporeal membrane oxygenation: analysis of 5,263 patients using a national inpatient database in Japan. Critical Care. 20, 80 (2016).
- Asaumi, Y., et al. Favourable clinical outcome in patients with cardiogenic shock due to fulminant myocarditis supported by percutaneous extracorporeal membrane oxygenation. European Heart Journal. 26 (20), 2185-2192 (2005).
- Religa, G., Jasińska, M., Czyżewski, &. #. 3. 2. 1. ;., Torba, K., Różański, J. The effect of the sequential therapy in end-stage heart failure (ESHF)-from ECMO, through the use of implantable pump for a pneumatic heart assist system, Religa Heart EXT, as a bridge for orthotopic heart transplant (OHT). Case study. Annals of Transplantation. 19, 537-540 (2014).
- Meani, P., et al. Long-term survival and major outcomes in post-cardiotomy extracorporeal membrane oxygenation for adult patients in cardiogenic shock. Annals of Cardiothoracic Surgery. 8 (1), 116-122 (2019).
- Bartos, J. A., et al. Improved survival with extracorporeal cardiopulmonary resuscitation despite progressive metabolic derangement associated with prolonged resuscitation. Circulation. 141 (11), 877-886 (2020).
- Brooks, S. C., et al. Part 6: Alternative techniques and ancillary devices for cardiopulmonary resuscitation. Circulation. 132 (18), 436-443 (2015).
- Guglin, M., et al. Venoarterial ECMO for adults: JACC scientific expert panel. Journal of the American College of Cardiology. 73 (6), 698-716 (2019).
- Lorusso, R., et al. Venoarterial extracorporeal membrane oxygenation for refractory cardiogenic shock in elderly patients: Trends in application and outcome from the Extracorporeal Life Support Organization (ELSO) Registry. The Annals of Thoracic Surgery. 104 (1), 62-69 (2017).
- Tehrani, B. N., et al. Standardized team-based care for cardiogenic shock. Journal of the American College of Cardiology. 73 (13), 1659-1669 (2019).
- Pavlushkov, E., Berman, M., Valchanov, K. Cannulation techniques for extracorporeal life support. Annals of Translational Medicine. 5 (4), 70 (2017).
- Burrell, A. J. C., Ihle, J. F., Pellegrino, V. A., Sheldrake, J., Nixon, P. T. Cannulation technique: femoro-femoral. Journal of Thoracic Disease. 10, 616-623 (2018).
- Lamb, K. M., et al. Arterial protocol including prophylactic distal perfusion catheter decreases limb ischemia complications in patients undergoing extracorporeal membrane oxygenation. Journal of Vascular Surgery. 65 (4), 1074-1079 (2017).
- Pancholy, S. B., Shah, S., Patel, T. M. Radial artery access, hemostasis, and radial artery occlusion. Interventional Cardiology Clinics. 4 (2), 121-125 (2015).
- Hoeper, M. M., et al. Extracorporeal membrane oxygenation watershed. Circulation. 130 (10), 864-865 (2014).
- Chung, M., Shiloh, A. L., Carlese, A. Monitoring of the adult patient on venoarterial extracorporeal membrane oxygenation. The Scientific World Journal. 2014, 393258 (2014).
- Mungan, &. #. 3. 0. 4. ;., Kazancı, B. &. #. 3. 5. 0. ;., Ademoglu, D., Turan, S. Does lactate clearance prognosticates outcomes in ECMO therapy: a retrospective observational study. BMC Anesthesiology. 18 (1), 152 (2018).
- Su, Y., et al. Hemodynamic monitoring in patients with venoarterial extracorporeal membrane oxygenation. Annals of Translational Medicine. 8 (12), 792 (2020).
- Walter, J. M., Kurihara, C., Corbridge, T. C., Bharat, A. Chugging in patients on veno-venous extracorporeal membrane oxygenation: An under-recognized driver of intravenous fluid administration in patients with acute respiratory distress syndrome. Heart & Lung. 47 (4), 398-400 (2018).
- Kim, H., et al. Permissive fluid volume in adult patients undergoing extracorporeal membrane oxygenation treatment. Critical Care. 22 (1), 270 (2018).
- Kalbhenn, J., Maier, S., Heinrich, S., Schallner, N. Bedside repositioning of a dislocated Avalon-cannula in a running veno-venous ECMO. Journal of Artificial Organs. 20 (3), 285-288 (2017).
- Weber, C., et al. Left ventricular thrombus formation in patients undergoing femoral veno-arterial extracorporeal membrane oxygenation. Perfusion. 33 (4), 283-288 (2018).
- Tariq, S., Aronow, W. S. Use of inotropic agents in treatment of systolic heart failure. International Journal of Molecular Sciences. 16 (12), 29060-29068 (2015).
- Thiele, H., Ohman, E. M., Desch, S., Eitel, I., de Waha, S. Management of cardiogenic shock. European Heart Journal. 36 (20), 1223-1230 (2015).
- Mason, D. T. Afterload reduction in the treatment of cardiac failure. Schweizerische Medizinische Wochenschrift. 108 (44), 1695-1703 (1978).
- Meani, P., et al. Modalities and effects of left ventricle unloading on extracorporeal life support: A review of the current literature. European Journal of Heart Failure. 19, 84-91 (2017).
- Taylor, T., Campbell, C. T., Kelly, B. A review of bivalirudin for pediatric and adult mechanical circulatory support. American Journal of Cardiovascular Drugs. 21 (4), 395-409 (2021).
- Geli, J., Capoccia, M., Maybauer, D. M., Maybauer, M. O. Argatroban anticoagulation for adult extracorporeal membrane oxygenation: A systematic review. Journal of Intensive Care Medicine. 37 (4), 459-471 (2022).
- Patel, B., Arcaro, M., Chatterjee, S. Bedside troubleshooting during venovenous extracorporeal membrane oxygenation (ECMO). Journal of Thoracic Disease. 11, 1698-1707 (2019).
- Cheng, R., et al. Complications of extracorporeal membrane oxygenation for treatment of cardiogenic shock and cardiac arrest: a meta-analysis of 1,866 adult patients. The Annals of Thoracic Surgery. 97 (2), 610-616 (2014).
- Bonicolini, E., et al. Limb ischemia in peripheral veno-arterial extracorporeal membrane oxygenation: a narrative review of incidence, prevention, monitoring, and treatment. Critical Care. 23 (1), 266 (2019).
- Moerman, A., Wouters, P. Near-infrared spectroscopy (NIRS) monitoring in contemporary anesthesia and critical care. Acta Anaesthesiologica Belgica. 61 (4), 185-194 (2010).
- Chung, Y. S., et al. Is stopping heparin safe in patients on extracorporeal membrane oxygenation treatment. ASAIO Journal. 63 (1), 32-36 (2017).
- Kumar, A., Keshavamurthy, S., Abraham, J. G., Toyoda, Y. Massive air embolism caused by a central venous catheter during extracorporeal membrane oxygenation. The Journal of Extra-Corporeal Technology. 51 (1), 9-11 (2019).
- Ortuno, S., et al. Weaning from veno-arterial extracorporeal membrane oxygenation: which strategy to use. Annals of Cardiothoracic Surgery. 8 (1), 1-8 (2019).
- Aissaoui, N., et al. Predictors of successful extracorporeal membrane oxygenation (ECMO) weaning after assistance for refractory cardiogenic shock. Intensive Care Medicine. 37 (11), 1738-1745 (2011).
- Vida, V. L., et al. Extracorporeal membrane oxygenation: the simplified weaning bridge. The Journal of Thoracic and Cardiovascular Surgery. 143 (4), 27-28 (2012).
- Esposito, M. L., Jablonksi, J., Kras, A., Krasney, S., Kapur, N. K. Maximum level of mobility with axillary deployment of the Impella 5.0 is associated with improved survival. The International Journal of Artificial Organs. 41 (4), 236-239 (2018).
- Smith, M., et al. Duration of veno-arterial extracorporeal life support (VA ECMO) and outcome: an analysis of the Extracorporeal Life Support Organization (ELSO) registry. Critical Care. 21 (1), 45 (2017).
- Chen, S. W., et al. Long-term outcomes of extracorporeal membrane oxygenation support for postcardiotomy shock. The Journal of Thoracic and Cardiovascular Surgery. 154 (2), 469-477 (2017).
- Rastan, A. J., et al. Early and late outcomes of 517 consecutive adult patients treated with extracorporeal membrane oxygenation for refractory postcardiotomy cardiogenic shock. The Journal of Thoracic and Cardiovascular Surgery. 139 (2), 302-311 (2010).
- Tsao, N. W., et al. Extracorporeal membrane oxygenation-assisted primary percutaneous coronary intervention may improve survival of patients with acute myocardial infarction complicated by profound cardiogenic shock. Journal of Critical Care. 27 (5), 1-11 (2012).
- Sakamoto, S., Taniguchi, N., Nakajima, S., Takahashi, A. Extracorporeal life support for cardiogenic shock or cardiac arrest due to acute coronary syndrome. The Annals of Thoracic Surgery. 94 (1), 1-7 (2012).
- Russo, J. J., et al. Left ventricular unloading during extracorporeal membrane oxygenation in patients with cardiogenic shock. Journal of the American College of Cardiology. 73 (6), 654-662 (2019).
- Ou de Lansink-Hartgring, A., de Vries, A. J., Droogh, J. H., vanden Bergh, W. M. Hemorrhagic complications during extracorporeal membrane oxygenation-The role of anticoagulation and platelets. Journal of Critical Care. 54, 239-243 (2019).
- Aubron, C., et al. Predictive factors of bleeding events in adults undergoing extracorporeal membrane oxygenation. Annals of Intensive Care. 6 (1), 97 (2016).
- Chang, W. W., et al. Predictors of mortality in patients successfully weaned from extracorporeal membrane oxygenation. PLoS One. 7 (8), 42687 (2012).
- Schmidt, M., et al. Predicting survival after ECMO for refractory cardiogenic shock: the survival after veno-arterial-ECMO (SAVE)-score. European Heart Journal. 36 (33), 2246-2256 (2015).
- Ostadal, P., et al. Extracorporeal Membrane Oxygenation in the Therapy of Cardiogenic Shock: Results of the ECMO-CS Randomized Clinical Trial. Circulation. , (2022).
- Yannopoulos, D., et al. Advanced reperfusion strategies for patients with out-of-hospital cardiac arrest and refractory ventricular fibrillation (ARREST): a phase 2, single centre, open-label, randomised controlled trial. Lancet. 396 (10265), 1807-1816 (2020).
- Chen, W. C., et al. The modified SAVE score: predicting survival using urgent veno-arterial extracorporeal membrane oxygenation within 24 hours of arrival at the emergency department. Critical Care. 20 (1), 336 (2016).
- Wengenmayer, T., et al. Development and validation of a prognostic model for survival in patients treated with venoarterial extracorporeal membrane oxygenation: the PREDICT VA-ECMO score. European Heart Journal. Acute Cardiovascular Care. 8 (4), 350-359 (2019).
- Huitema, A. A., Harkness, K., Heckman, G. A., McKelvie, R. S. The spoke-hub-and-node model of integrated heart failure care. The Canadian Journal of Cardiology. 34 (7), 863-870 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved