Method Article
Измерение сердцебиения без анестезии у свободно движущихся рыбок данио
В этой статье
Резюме
Исследование направлено на разработку технологии измерения сердцебиения без анестезии у движущихся рыбок данио. Наш подход сочетает в себе коротковолновую инфракрасную визуализацию и отслеживание сердца на основе машинного обучения. Это неинвазивный, не требующий меток и удобный для пользователя метод, который подходит для широкого спектра исследований на модели рыбок данио.
Аннотация
Рыбка данио (Danio rerio) является широко используемым модельным организмом в физиологических, фармакологических и токсикологических исследованиях благодаря своему генетическому сходству с человеком и прозрачной эмбриональной стадии, что облегчает неинвазивные исследования сердечно-сосудистой системы. Тем не менее, современные методы оценки частоты сердечных сокращений у рыбок данио часто полагаются на анестезию для иммобилизации субъекта, внося физиологические изменения, которые ставят под угрозу точность и воспроизводимость данных. В этом исследовании представлена новая, не требующая анестезии методика измерения сердцебиения у свободно движущихся личинок данио-рерио, устраняющая критическое ограничение в исследованиях сердечно-сосудистой системы. Предлагаемый подход объединяет коротковолновую инфракрасную визуализацию с отслеживанием сердца на основе машинного обучения, что позволяет осуществлять точный и непрерывный мониторинг сердечной деятельности у неиммобилизованных образцов. Сверточная нейронная сеть была обучена для обнаружения области сердца, а фотоплетизмографический сигнал был извлечен из последовательностей изображений для определения частоты сердечных сокращений. Экспериментальная валидация продемонстрировала надежность и согласованность метода в различных условиях испытаний. Ключевым преимуществом методики является ее способность сохранять естественное физиологическое состояние рыбок данио, сводя к минимуму артефакты, вызванные стрессом. Этот неинвазивный, не требующий меток метод предлагает значительные преимущества для изучения физиологии сердечно-сосудистой системы, кардиотоксичности лекарств и токсикологии окружающей среды, расширяя потенциальное применение рыбок данио в качестве модели для биомедицинских исследований.
Введение
Данио рерио (Danio rerio), маленькая карповая рыба, стала важным модельным организмом из-за своего небольшого размера, высокой репродуктивной способности и простоты генетических манипуляций 1,2,3. Оценка частоты сердечных сокращений у прозрачных эмбрионов рыбок данио все чаще используется в физиологии, эмбриологии, токсикологии и других областях 4,5,6,7,8. С одной стороны, эта полезность обусловлена тем, что геном рыбки данио включает гены, связанные с сердечно-сосудистыми заболеваниями человека9, а сердце Danio rerio имеет схожие структуры и сигнальные пути с человеком10,11. Это делает рыбок данио бесценной моделью для изучения развития сердца и болезней 11,12,13. С другой стороны, частота сердечных сокращений рыбок данио чувствительна к внешним воздействиям, что делает ее отличной моделью для физиологических и токсикологических исследований путем сравнения сердечной функции у обработанных и необработанных рыб 7,8,14.
Значительный прогресс достигнут в разработке неинвазивных оптических методов оценки частоты сердечных сокращений у прозрачных эмбрионов рыб 15,16. Преимущество этих методов заключается в быстром сборе данных из больших объемов выборки. В связи с этим были разработаны полностью автоматизированные подходы к оценке частоты сердечных сокращений у эмбрионов рыб 4,5,6,17.
Тем не менее, некоторые ограничения в настоящее время ограничивают использование этих методов периодом в 3-4 dpf. Первое ограничение – потеря прозрачности из-за пигментации тела рыбы. Во-вторых, это увеличение подвижности эмбрионов с течением времени. Продление периода раннего развития данио-рерио, в течение которого можно использовать оптические подходы, повысит их полезность, что позволит в долгосрочных экспериментальных проектах изучать кардиомиопатию, врожденные пороки сердца и различные воздействия на сердечно-сосудистую систему, включая отслеживание динамики эффектов с течением времени. Недавно наша группа обратилась к проблеме потери прозрачности, используя визуализацию в коротковолновом инфракрасном диапазоне 900-1700 нм18. В данной статье основное внимание уделяется рассмотрению вопроса подвижности эмбрионов.
Как правило, анестетики, такие как трикаин метансульфонат (MS-222), используются для иммобилизации свободно плавающих эмбрионов и личинок рыб перед визуализацией 14,19,20. Тем не менее, MS-222 значительно снижает частоту сердечных сокращений21,22, как и другие анестетики23. Становится трудно определить, являются ли наблюдаемые изменения в работе сердца результатом экспериментального лечения, анестезии или взаимодействия между ними. Еще одним способом продления периода низкой подвижности эмбриона является снижение температуры наранних стадиях развития. Однако такой подход не всегда совместим с целями исследования и лишь минимально продлевает срок регистрации.
В этом исследовании мы представляем новый метод решения проблемы подвижности эмбриона во время регистрации частоты сердечных сокращений. Мы обучили сверточную нейронную сеть для идентификации интересующей области сердца в записях свободно плавающих эмбрионов данио-рерио. Периодическое изменение интенсивности пикселей в этой области используется для получения фотоплетизмограммы (ФПГ), которая впоследствии используется для расчета частоты сердечных сокращений. Разработанное настольное приложение AutoHR использовало как обучение нейронной сети, так и обработку стека изображений, обеспечивая простоту использования и воспроизводимость протокола.
протокол
Данио-рерио были выведены и выращены в соответствии с установленными протоколами ZFIN24. Все процедуры утверждены Комитетом по биоэтике Научно-технологического центра уникального приборостроения Российской академии наук (НТЦ УИ РАН), протокол #3/24 от 21.08.2024 г., и соответствуют рекомендациям НТЦ УИ РАН по уходу за рыбками данио-рерио. Инструкции для отдельных версий предоставляются по запросу.
1. Подготовка оборудования к измерениям
- Подбор оборудования
- Выберите источник света: Выберите светодиодный источник света, который излучает в ближнем инфракрасном диапазоне, а именно от 800 нм, с минимальной выходной мощностью 3 Вт. В этом исследовании использовался светодиод с центральной длиной волны 940 нм и полосой пропускания 40 нм.
- Выберите видеокамеру: выберите камеру, оснащенную сенсором, чувствительным к диапазону длин волн, излучаемых источником света, и имеющую частоту кадров не менее 60 кадров в секунду. Обратитесь к техническому описанию камеры, чтобы определить шаг пикселя p, размер сенсора вдоль его короткой стороны h и частоту кадров. В данном исследовании камера имеет шаг пикселя p = 5 μm и ширину сенсора h = 5,12 мм.
- Выбирайте размер агарозной формы, который как минимум в 1,5 раза больше длины личинки В. Вычислите минимальное и максимально допустимое увеличение оптической системы с помощью предоставленных выражений. Убедитесь, что Mmax ≤ Mmin. Если это условие не выполняется, выберите камеру с большим h и/или меньшим и/или меньшим S.
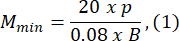
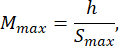
где Smax — длина самой большой агарозной формы из набора форм. Может быть подготовлен набор формочек различных размеров. В этом исследовании использовался S = 10 мм.
ПРИМЕЧАНИЕ: Уравнения выведены на основе геометрии оптической схемы и пропорций тела рыбок данио. Подробные пояснения приведены в разделе «Обсуждение». - Выберите объектив: В этом исследовании использовалась оптическая система с переменным увеличением в диапазоне от MOSmin = 0,4x до MOSmax = 1,5x, максимальным фокусным расстоянием fmax = 150 мм и рабочим расстоянием мм.
ПРИМЕЧАНИЕ: Символ x обозначает коэффициент увеличения оптической системы.- Выбирайте систему микроскопа с переменным увеличением с диапазоном увеличения (MOSmin - MOSmax), который остается в пределах допустимого диапазона (Mmin - Mmax). Обратитесь к техническому описанию объектива, чтобы определить максимальное фокусное расстояние fmax и соответствующее рабочее расстояние L для MOSmax.
- Убедитесь, что условие fmax ≤ Mmax • L выполнено. Если это условие не выполняется, выберите объектив с другими значениями fmax и/или L. Убедитесь, что тип крепления камеры и объектива совместим.
- Выберите тестовый объект (линейку или сетку) с известным шагом и общей длиной не менее . Выберите тестовый объект в виде линейки или сетки с известным шагом и общим размером не менее Smax.
- Сборка стенда для получения изображения (рисунок 1).
- Установите круглый стержень на устойчивое основание. Соберите систему обработки изображений, прикрепив объектив к камере. Установите канал изображения на стержень входным окном вверх.
- Установите фокусировочный механизм на стержень. Прикрепите к фокусировочному механизму столик со стеклянной рабочей поверхностью диаметром не менее 30 мм.
- Соберите осветитель: поместите светодиод на металлическую подложку, чтобы обеспечить эффективный отвод тепла. Поместите выпуклую плоскую линзу коллиматора диаметром 23 мм и фокусным расстоянием 30 мм на расстоянии 30 мм от светодиода.
- Установите осветитель на сцене с помощью регулируемого по трем осям кронштейна, расположив его над рабочей поверхностью линзой вниз.
- Отрегулируйте осветитель и систему формирования изображения. Расположите осветитель соосно с системой формирования изображения. Включите осветитель и подключите фотокамеру к компьютеру.
- Запустите приложение камеры и активируйте режим предварительного просмотра, следуя инструкциям в руководстве к камере. Поместите тестовый объект на рабочую область. Отрегулируйте рабочее расстояние и увеличение микроскопа, чтобы размер полностью вписывался в поле зрения.
ПРИМЕЧАНИЕ: Размер должен полностью соответствовать короткой стороне рамы, чтобы обеспечить полную визуализацию агарозной формы. - Отрегулируйте положение предметного столика относительно системы формирования изображения, чтобы убедиться, что изображение сфокусировано, а положение осветителя освещено равномерно.
- Приготовление агарозной плесени
- Смешайте 20 мл дистиллированной воды с 0,4 г малоплавкой агарозы и нагрейте смесь до полного растворения агарозы. Например, в микроволновке в течение 20 с при мощности 700 Вт.
- Придайте форму агарозе (Способ 1): Налейте нагретый раствор в чашку Петри, обеспечив высоту раствора 1,5-2 мм. Остудите чашку Петри до тех пор, пока раствор агарозы не застынет. При температуре 17 °C этот процесс занимает около 5 минут. Вырежьте квадрат со стороной длины с помощью канцелярского ножа и аккуратно удалите слой агарозы в пределах намеченного участка.
- Придайте форму агарозе (Способ 2): Создайте (S)× (S) × 10 мм, формы из пластика. Поместите распечатанную форму квадратной стороной в чашку Петри и заполните ее подогретым раствором, обеспечив высоту раствора 1,5-2 мм. Остудите чашку Петри до тех пор, пока раствор агарозы не застынет, и аккуратно выньте форму из застывшего раствора.
ПРИМЕЧАНИЕ: Формы можно легко распечатать с помощью 3D-принтера.
2. Получение изображения
- Отрегулируйте параметры захвата изображений.
- Подключите фотокамеру к компьютеру. Запустите приложение камеры и включите режим предварительного просмотра. Включите осветитель.
ПРИМЕЧАНИЕ: Если размер используемой агарозной формы отличается от указанного в шаге 1.3.3, повторите шаг 1.3.3 и после этого удалите испытуемый объект из этапа. - Поместите личинку данио-рерио в агарозную форму с помощью пастеровской пипетки. Поставьте на сцену форму из агарозы. Обеспечьте почти полное освещение головы личинки, регулируя комбинацию времени экспозиции и мощности осветителя (рис. 2A-C). Время экспозиции не должно превышать 1,5 мс.
ПРИМЕЧАНИЕ: В этом исследовании мы представляем данные о личинках дикого типа данио-рерио в возрасте от 12 до 21 дня после оплодотворения (dpf).
- Подключите фотокамеру к компьютеру. Запустите приложение камеры и включите режим предварительного просмотра. Включите осветитель.
- Получение изображений
- Установите частоту кадров не менее 60 кадров в секунду. Установите битовую глубину изображения на 12 бит. Получайте изображения в течение не менее 10 секунд. Установите формат именования кадров на yyyy_mm_dd_hh_ss_mm_mss, а тип файла должен быть PNG или TIFF, а не BMP.
3. Обучение нейронной сети маркировке
- Подготовка данных для маркировки
ПРИМЕЧАНИЕ: Описан процесс маркировки в приложении Image Labeler, MATLAB.- Соберите не менее 256 полученных изображений в отдельную директорию. Запустите приложение. Импортируйте изображения, перейдя в раздел «Импорт > из файла » и выбрав все изображения из указанного каталога.
- Создание классов для маркировки сети. На вкладке Метки ROI нажмите Метка, введите тело в поле Название метки, выберите Метка пикселя в раскрывающемся меню для типа метки и нажмите кнопку ОК. На вкладке «Метки ROI» нажмите «Метка», введите глаз в поле «Название этикетки», выберите «Метка пикселя» в раскрывающемся меню для типа метки и нажмите «ОК». На вкладке Метки ROI нажмите Метка, введите рыбу в поле Имя метки, выберите Прямоугольник в раскрывающемся меню для типа метки и нажмите кнопку ОК.
- Маркировка рам
- На вкладке Метки ROI выберите ранее созданный класс аннотаций, глаз. Наметьте один глаз образца, разместив точки по его периметру с помощью левой кнопки мыши. Чтобы завершить аннотацию глаза, нажмите на начальную точку контура (рисунок 3B).
- Обведите контуром другой глаз образца таким же образом, как описано в шаге 3.1.2.
- На вкладке Метки ROI выберите созданный класс аннотации, тело. Наметьте тело образца, исключив глаза, расставив точки по его периметру с помощью левой кнопки мыши. Чтобы завершить аннотацию глаза, нажмите на Начальную точку контура.
- На вкладке ROI Labels выберите ранее созданный класс аннотаций, fish. Обведите контуром все тело образца, нарисовав прямоугольную ограничивающую рамку (рисунок 4). Для этого кликните левой кнопкой мыши по One Corner предполагаемого прямоугольника, затем перетащите курсор, удерживая кнопку нажатой, пока прямоугольник полностью не закроет рыбу.
- Сохраните контуры в новом каталоге с именем images, нажав кнопку «Экспортировать > в файл » на вкладке «МЕТКА».
- Подготовка наборов данных для обучения нейронной сети
- Запустите MATLAB. Откройте файл скрипта DatasetsPreparation.m (Дополнительный файл 1), выбрав Открыть > Открыть.
- Запустите скрипт, нажав кнопку Выполнить. Во всплывающем окне выберите директорию, содержащую обведенные изображения, папку PixelLabelData и файл gTruth.mat, который был экспортирован на шаге 3.2.5.
ПРИМЕЧАНИЕ: По завершении выполнения скрипта будут автоматически сгенерированы две папки - RPN Training и CNN Training. Они необходимы для последующего обучения нейронной сети. Не изменяйте содержимое этих папок.
4. Обучение нейронных сетей для детектирования сердца
ПРИМЕЧАНИЕ: Этот шаг выполняется один раз для определенного возраста и состояния визуализации. Для тренировки настоятельно рекомендуется использовать графический процессор NVIDIA, так как он значительно ускоряет обработку.
- Запустите приложение AutoHR. Перейдите на вкладку Обучение сети региональных предложений. Нажмите «Выбрать каталог » и выберите папку RPN Training , созданную на шаге 3.3.2. Нажмите «Начать обучение».
ПРИМЕЧАНИЕ: После завершения обучения файл модели с именем rpn_model.pt будет сгенерирован в том же каталоге, что и файл AutoHR.exe. Этот файл необходим для дальнейшей обработки стека изображений. - Чтобы обучить сверточную нейронную сеть, перейдите на вкладку Обучение сверточной нейронной сети. Нажмите «Выбрать каталог » и выберите папку «Обучение CNN», созданную на шаге 3.3.2. Нажмите «Начать обучение».
ПРИМЕЧАНИЕ: После завершения обучения файл модели с именем model.pt будет сгенерирован в том же каталоге, что и файл AutoHR.exe. Этот файл необходим для дальнейшей обработки стека изображений.
5. Количественная оценка частоты сердечных сокращений
- Запишите последовательность изображений, как описано в шаге 2. Убедитесь, что условия визуализации, такие как увеличение, время экспозиции и освещенность, идентичны тем, которые используются для обучения нейронной сети.
- Запустите приложение AutoHR. Перейдите на вкладку Обработка. Выберите каталог с обученными моделями нейронных сетей, нажав кнопку Выбрать модели. Нажмите «Выбрать папку », чтобы импортировать полученные изображения для анализа. Путь экспорта будет указан автоматически, но вы можете изменить его, нажав « Выбрать путь экспорта». Нажмите кнопку Обработать , чтобы начать анализ.
ПРИМЕЧАНИЕ: После завершения значение частоты сердечных сокращений появится в поле «Частота сердечных сокращений» в интерфейсе AutoHR. Экспортированная папка будет содержать значения частоты сердечных сокращений (.xlsx), PPG (.xlsx), первый кадр последовательности, а также маски тела и глаз для первого кадра (.png).
6. Проверка результатов алгоритма
- Проведите тест с неподвижной рыбой, как описано ниже.
- Обезболить личинок раствором MS-222 в дозе 0,168 мг/л в течение 1 мин. Получите стек изображений образца, находящегося под наркозом, как описано в шаге 2. Выполните подсчет частоты сердечных сокращений с помощью визуального наблюдения.
- Используйте программное обеспечение для управления персоналом, как описано в шаге 5. Повторите шаги для нескольких экземпляров. Проверьте, согласуются ли полученные значения частоты сердечных сокращений для всех людей с желаемой точностью.
- Проведите тест с мобильным человеком и провокационный тест, как описано ниже.
- Соберите стек изображений образца без анестезии, как описано в шаге 2. Проведите провокационный тест с человеком, для которого была записана последовательность, с использованием известного стимула, влияющего на частоту сердечных сокращений. В исследовании представлены результаты по засолению воды до концентраций 5 мг/л.
- Получите стек изображений того же образца, как описано в шаге 2, после провокационного теста. Определите частоту сердечных сокращений в обоих экспериментах с помощью программного обеспечения для измерения ЧСС, как описано в шаге 5. Проверьте, согласуются ли наблюдаемые изменения частоты сердечных сокращений с известными эффектами провокационного теста.
Результаты
Частоту сердечных сокращений рыбок данио рерио при 12 dpf определяли с помощью описанного выше протокола (Дополнительное видео 1). Видео включают в себя последовательность изображений свободно плавающих личинок данио-рерио, фотоплетизмограмму, полученную из этих последовательностей с использованием предложенного протокола, и соответствующую частоту сердечных сокращений, рассчитанную на основе фотоплетизмограммы.
Размеченные данные были случайным образом разделены на наборы для обучения, тестирования и проверки в соотношении 3:2:1 во время обучения. Затем функция потерь была реализована в соответствии со следующим выражением:

где x — входные логиты, y — цель, размер пакета — количество изображений, обрабатываемых одновременно,

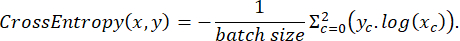
Для оценки производительности модели во время обучения была использована функция точности прогнозирования, определяемая следующими параметрами:


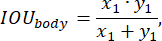
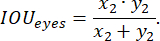
Мы применили стандартные подходы к построению функции потерь, подробно описанные, например, в25. В качестве кодировщика и выходного слоя softmax была использована многомасштабная сеть внимания с архитектурой модели EfficientNet-B0. Нейронная сеть обучалась на тестовой выборке в течение 50 эпох с использованием экспоненциально затухающей скорости обучения, которая начиналась с 0,02 и имела коэффициент затухания 0,99.
Обученная нейронная сеть использовалась для получения маски тела и маски глаза (рис. 5С) индивидуума в каждом кадре произвольной последовательности. Затем был рассчитан центр масс для маски для глаз, а на маску для тела была применена скелетизация (рисунок 5D). На образовавшейся рыбьей хорде Р была идентифицирована точка М, расположенная ближе всего к центру масс маски глаза (рисунок 5F). На расстоянии d от точки М, равном расстоянию между глазами, точка N была идентифицирована по хорде PPP в сторону хвоста. Эта точка соответствует центру области сердца. Эта область была очерчена окружностью с радиусом r = d x 0,3 с центром в этой точке (рисунок 5F).
Необработанный сигнал PPG рассчитывался как среднее количество пикселей в области сердца по всем записанным кадрам (рис. 5G). Затем этот необработанный сигнал нормализовался до его среднего значения. В дальнейшем сигнал фильтровали с помощью фильтра Чебышева II типа второго порядка с конструкцией4-го порядка, затуханием полосы задержки 25 дБ и частотой фронта полосы задержки 12 Гц, что согласуется со стандартными алгоритмами обработки26,27 (рис. 6А). Частоту сердечных сокращений определяли путем определения частоты в диапазоне 1-4 Гц, которая соответствует пиковой мощности в квадрате модуля преобразования Фурье отфильтрованного сигнала (рис. 6А).
Уравнение (1) гарантирует, что изображение сердца имеет размеры примерно 20 x 20 пикселей. Предполагается, что продольный размер сердца составляет примерно 8% от общей длины тела рыбки данио. Когда изображение сердца меньше, результирующий сигнал часто содержит значительную шумовую составляющую, которая превосходит полезный сигнал, что делает его непригодным для расчета частоты сердечных сокращений, как показано на рисунке 6B.
Результаты применения протокола в значительной степени зависят от стабильности сегментации сердца у каждого человека. Крайне важно провести контрольные эксперименты, чтобы продемонстрировать, что шаги 2-5 были выполнены успешно, а полученные данные отражают реальные физиологические процессы, а не случайные результаты. Валидация протокола проводилась в соответствии с процедурой, описанной в шаге 6. В тесте, описанном на шаге 6.2, соль добавляли в воду в концентрации 5 мг/л в качестве провоцирующего стимула. В каждый тест было включено пять личинок данио-рерио (12 pdf). Температуру воды в агарозной форме поддерживали на уровне 23-25 °С. Полученные результаты свидетельствуют о том, что разница между визуальной оценкой и предложенным методом не превышала 3% в первом тесте. Во втором тесте частота сердечных сокращений, измеренная с помощью метода, увеличилась, как и ожидалось (Рисунок 7).

Рисунок 1: Схематический рабочий процесс. (A) Схема и (B) внешний вид экспериментальной установки Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Изображения личинок данио-рерио. Примерами (A) высококачественных и (B-D) низкокачественных изображений личинок данио-рерио являются (B) недоэкспонированный кадр, (С) переэкспонированный кадр и (D) размытый кадр. Изображения были обрезаны, чтобы выделить личинку. Масштабная линейка составляет 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.

Рисунок 3: Репрезентативные изображения. Примеры (А) исходных изображений и (Б) с метками. Масштабная линейка составляет 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
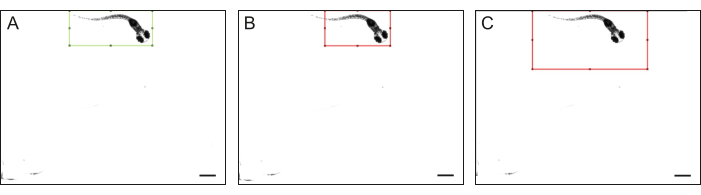
Рисунок 4: Контуры тела данио-рерио. Примеры (А) высококачественных и (В-В) некачественных контуров всего тела данио-рерио: данио-рерио не полностью помещается в прямоугольник, а размер прямоугольника заметно больше, чем у данио-рерио. Масштабная линейка составляет 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.

Рисунок 5: Конвейер обработки изображений, иллюстрирующий основные этапы обработки и соответствующие им промежуточные результаты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Кадры, показывающие частоту сердечных сокращений личинок. Примеры (А) высококачественных и (В) некачественных кадров с площадью сердца личинки диаметром 20 пикселей и 14 пикселей соответственно и соответствующими спектрами PPG и Фурье PPG. Масштабная линейка составляет 1 мм. Сокращения: ППГ = фотоплетизмография. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
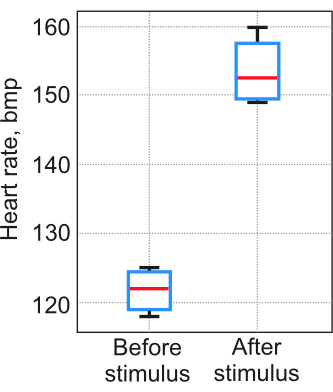
Рисунок 7: Измерения частоты сердечных сокращений. Измерения были получены с помощью предложенного метода в тесте с провоцирующим стимулом. Номер образца . Рамка охватывает25-й и75-й процентили, горизонтальная линия - медиана, черные усы указывают на самые крайние точки данных, не считающиеся выбросами Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительное видео 1: Иллюстрация предложенного нейросетевого алгоритма для обнаружения и вычисления частоты сердечных сокращений. В видео представлены свободно движущиеся личинки данио-рерио, фотоплетизмограмма, полученная по предложенному протоколу и рассчитанная по частоте сердечных сокращений личинок фотоплетизмограммы.
Дополнительный файл 1: Функция MATLAB, выполняющая увеличение изображения. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В этом исследовании мы представляем экспериментальный протокол измерения сердцебиения свободно плавающих личинок данио-рерио. Мы оценили этот подход с помощью нескольких экспериментов, продемонстрировав его эффективность. Ключевыми компонентами предлагаемого метода являются как аппаратные, так и программные решения. Во-первых, мы использовали инфракрасное освещение для визуализации, которое, как было продемонстрировано ранее, позволяет избежать проблем, связанных с пигментацией, и повышает прозрачность тканей, способствуя точномуопределению сердцебиения. Во-вторых, мы предлагаем визуализировать рыбу снизу. Под наркозом личинки данио-рерио обычно лежат на боку из-за положения плавательного пузыря, в результате чего разница в ориентации между стандартной и инвертированной конфигурациями микроскопа незначительна. Однако, поскольку сердце плавающей рыбы всегда расположено вентрально, расположение канала визуализации внизу и канала освещения выше увеличивает соотношение сигнал/шум. Наконец, мы значительно улучшили производительность обработки, используя нейронную сеть для определения местоположения образца на изображении и идентификации отдельных органов. Используя как предварительные знания, так и эмпирические данные, мы разработали методы точного определения сердца в теле личинки данио-рерио, обнаруженного нейронной сетью.
К другим преимуществам подхода можно отнести использование светодиодного источника света, который, в отличие от галогенных ламп, не выделяет тепла. Фиксация светового канала на сцене позволяет один раз выровнять его относительно размера пресс-формы, что устраняет необходимость в дополнительной регулировке освещения при перефокусировке. Алгоритм также может быть применен для генерации больших наборов данных для последующего обучения нейронной сети для сегментации сердца. Он ускоряет обработку данных и сводит к минимуму ошибки при определении положения сердца. Прямая маркировка сердца на изображениях представляет собой значительную проблему из-за его небольшого размера и трудностей с точным определением его границ и положения в пределах одного кадра.
Для достижения оптимальных результатов при реализации этого протокола необходимо учитывать несколько критических факторов. Во-первых, время экспозиции не должно превышать 1,5 мс, так как более длительное время экспозиции может привести к размытию изображения, особенно при быстрых движениях людей. Такое размытие затруднит точный расчет фотоплетизмограммы в определенные моменты времени (рис. 6B). Во-вторых, силы поверхностного натяжения приведут к искривлению поверхности воды в кювете, что приведет к рассеянию света и искажению получаемых изображений во время видеосъемки. Чтобы смягчить этот эффект, следует нанести тонкий ровный слой воды на поверхность агарозы, чтобы обеспечить ровный и постоянный уровень воды по всей чашке Петри. Поскольку агароза постепенно впитывает воду, мы рекомендуем добавлять воду примерно каждые 10 минут для поддержания стабильного уровня. Наконец, выбор увеличения объектива должен быть адаптирован к стадии разработки и конкретным требованиям эксперимента. Фиксированное увеличение в соответствующем диапазоне достаточно для последовательных измерений в пределах одной и той же возрастной группы и при одинаковых условиях. Тем не менее, объектив с переменным увеличением больше подходит для исследований, связанных с различными стадиями развития или задачами.
Если тестирование показывает, что алгоритм не работает, шаги 2 и 3 должны быть пересмотрены и реализованы заново. Шаг 3 часто сопряжен с трудностями, особенно при маркировке изображений. Обеспечьте тщательную аннотацию глаз и тела, избегая любого дублирования между этими двумя классами. Используйте изображения, на которых запечатлен человек в различных положениях, особенно с выраженным изгибом тела, чтобы повысить точность маркировки. Шаг 2 следует повторить в тех случаях, когда выявлены проблемы с интенсивностью освещения, временем экспозиции или увеличением. Неправильные настройки могут снизить соотношение сигнал/шум, что позволит шуму подавлять сигнал (рис. 6B). Кроме того, сбой алгоритма может возникнуть, если обучающие и экспериментальные данные получены в разных условиях.
В предлагаемой аппаратной установке используется инфракрасная камера с диапазоном чувствительности 900-1700 нм. Тем не менее, камеры с высоким разрешением, работающие в этом спектральном диапазоне, часто являются непомерно дорогими. Чтобы обойти это ограничение, после снятия инфракрасных фильтров можно использовать промышленные видеокамеры видимого спектра с чувствительностью сенсора в ближнем инфракрасном диапазоне в качестве экономичной альтернативы инфракрасным камерам. В дополнение к использованию инфракрасного излучения, эффекты пигментации также могут быть сведены к минимуму путем применения химических веществ, удаляющих пигментацию, или использования рыб из определенных генетических линий, у которых отсутствует пигментация28,29. Текущая версия программного обеспечения предназначена исключительно для измерения частоты сердечных сокращений. Тем не менее, другие параметры пульсовой волны не менее важны для всесторонних исследований. Будущие обновления программного обеспечения будут сосредоточены на включении анализа вариабельности сердечного ритма, ключевого показателя различных заболеваний. Более детальные измерения, такие как интервал Q-T, являются предметом дальнейших исследований. Для разработки универсальной модели нейронной сети, способной оперировать данными разного возраста и условий получения изображений, обучающий набор данных должен включать в себя разнородные выборки, содержащие не менее 128 размеченных изображений каждого типа.
Ранее было разработано несколько подходов для автоматического обнаружения области сердца и мониторинга сердечного ритма у эмбрионов данио-рерио 4,6 и медаки 6,17. Флуоресцентное мечение сердца у рыбок данио было предложено для определения площади сердца30. Однако все ранее опубликованные методы ограничиваются работой с неподвижными, прозрачными эмбрионами в течение короткого постоплодотворительного периода до начала подвижности эмбриона. Это существенное ограничение, которое снижает применимость данных методик. Еще одна проблема, описанная в литературе и дополнительных материалах, связана с резким движением эмбрионов во время регистрации частоты сердечныхсокращений 6,17. Такое движение может сместить сердечную область, на которую нацелено программное обеспечение для расчета частоты сердечных сокращений. Подход, описанный в данном исследовании, устраняет эти недостатки, позволяя проводить мониторинг подвижных рыбок данио до 30 dpf.
Преимущества такого подхода значительно расширяют возможности его потенциального применения. В последние годы Danio rerio стал широко распространенной моделью для изучения сердечно-сосудистых патологий и кардиотоксичности 11,12,31. Способность этого метода неинвазивно регистрировать частоту сердечных сокращений на различных ранних стадиях развития без анестезии открывает новые возможности для изучения динамики индуцированных пороков развития сердца и терапевтических эффектов. В настоящее время мониторинг сердечного ритма у эмбрионов рыбок данио используется для скрининга лекарств в доклинических исследованиях 32. Описанные преимущества предложенного метода дают дополнительный инструментарий для оценки отсроченных эффектов и фармакодинамики лекарственных препаратов. Наконец, использование сердечных сокращений рыбок данио постоянно увеличивается в экотоксикологическом мониторинге33,34. В этой области предлагаемый подход позволяет оценить хроническое токсическое воздействие загрязнителей при низких концентрациях в течение длительных периодов воздействия и эффекты, связанные с биоаккумуляцией.
Раскрытие информации
Все авторы раскрыли любые конфликты интересов.
Благодарности
Исследование выполнено при поддержке Федеральной государственной целевой программы НТЦ УИ РАН (FFNS-2025-0008). Данная работа выполнена с использованием оборудования Центра коллективного пользования НТЦ УИ РАН [http:// https://ckp.ntcup.ru/en/].
Материалы
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Low melting agarose | Biozym | 850111 | |
| Table salt | Pegasus | N/A | |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10505 | MS-222 |
| Equipment | |||
| Base with rod | Altami | SM-U1 | |
| Collimator lens | JLLSCMGGX | Focal length 30 mm | |
| Focusing mechanism | Altami | SM-12 | D=76 mm |
| LED | Cree | TR-3535IR-3W | |
| Lens | SFK Security | C-Mount, F1.6, 1/3”, | |
| Near infrared camera | ToupTek | SWIR1300KMA | |
| Pasteur pipette | PE-LD | 149293 | |
| Petri Dish 35 x 15 mm | BD Falcon | 351008 | |
| Plastic forms | N/A | N/A | Made by 3D printing |
| Power supply | Unit-T | UTP3300TFL-II | |
| Stage | N/A | N/A | Made by 3D printing |
| Stationery knife | ErichKrause | 19145 | |
| Test object | Wally Sky | MS-1-EB | |
| Software | |||
| EfficientDet | N/A | N/A | https://github.com/rwightman/efficientdet-pytorch |
| EfficientNet-b0 model | N/A | N/A | https://arxiv.org/abs/1905.11946 |
| Google API Client | N/A | Google API Client is a Python client library for Google's discovery-based APIs. https://github.com/googleapis/google-api-python-client | |
| Hardware | |||
| Multi-scale attention network | N/A | N/A | https://arxiv.org/abs/2209.14145 |
| NVIDIA DIGITS | NVIDIA | N/A | NVIDIA DIGITS is a wrapper for Caffe that provides a graphical web interface. https://developer.nvidia.com/digits |
| NVIDIA GPU | NVIDIA | N/A | An NVIDIA GPU is needed as some of the software frameworks below will not work otherwise. https://www.nvidia.com |
| OpenCV | Intel | N/A | OpenCV is a library for computer vision. https://opencv.org |
| Python | Python Software Foundation | N/A | Python is a programming language. https://www.python.org |
Ссылки
- Fontana, B. D., Mezzomo, N. J., Kalueff, A. V., Rosemberg, D. B. The developing utility of zebrafish models of neurological and neuropsychiatric disorders: A critical review. Exp Neurol. 299 (Pt A), 157-171 (2018).
- Chen, X., Li, Y., Yao, T., Jia, R. Benefits of zebrafish xenograft models in cancer research. Front Cell Dev Biol. 9, 616551(2021).
- Lai, K. P., Gong, Z., Tse, W. K. F. Zebrafish as the toxicant screening model: Transgenic and omics approaches. Aquat Toxicol. 234, 105813(2021).
- Pylatiuk, C., et al. Automatic zebrafish heartbeat detection and analysis for zebrafish embryos. Zebrafish. 11 (4), 379-383 (2014).
- Krishna, S., Chatti, K., Galigekere, R. R. Automatic and robust estimation of heart rate in zebrafish larvae. IEEE Trans Auto Sci Eng. 15 (3), 1041-1052 (2018).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Sci Rep. 10 (1), 2046(2020).
- Meng, H., Liang, J., Zheng, X., Zhang, K., Zhao, Y. Using a high-throughput zebrafish embryo screening approach to support environmental hazard ranking for cardiovascular agents. Sci Total Environ. 702, 134703(2020).
- Krylov, V., et al. Influence of hypomagnetic field on the heartbeat in zebrafish embryos. Front Physiol. 13, 1040083(2022).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Staudt, D., Stainier, D. Uncovering the molecular and cellular mechanisms of heart development using the zebrafish. Ann Rev Gene. 46, 397-418 (2012).
- Bowley, G., et al. Zebrafish as a tractable model of human cardiovascular disease. Br J Pharmacol. 179 (5), 900-917 (2022).
- Brown, D. R., Samsa, L. A., Qian, L., Liu, J. Advances in the study of heart development and disease using zebrafish. J Cardiovas Dev Dis. 3 (2), 13(2016).
- Dhillon, S. S., et al. Optimisation of embryonic and larval ECG measurement in Zebrafish for quantifying the effect of QT prolonging drugs. PLoS One. 8 (4), e60552(2013).
- Bedrossiantz, J., et al. Heart rate and behavioral responses in three phylogenetically distant aquatic model organisms exposed to environmental concentrations of carbaryl and fenitrothion. Sci Total Environ. 865, 161268(2023).
- Santoso, F., et al. An overview of methods for cardiac rhythm detection in zebrafish. Biomedicines. 8 (9), 329(2020).
- Ling, D., Chen, H., Chan, G., Lee, S. M. Y. Quantitative measurements of zebrafish heartrate and heart rate variability: A survey between 1990-2020. Comp Biol Med. 142, 105045(2022).
- Ferreira, M. S., et al. FEHAT: Efficient, large scale and automated heartbeat detection in medaka fish embryos. Bioinformatics. 40 (12), btae664(2024).
- Volkov, M., et al. Optical transparency and label-free vessel imaging of zebrafish larvae in shortwave infrared range as a tool for prolonged studying of cardiovascular system development. Sci Rep. 12 (1), 20884(2022).
- Machikhin, A., et al. Microscopic photoplethysmography-based evaluation of cardiotoxicity in whitefish larvae induced by acute exposure to cadmium and phenol. J Biophoton. 17 (9), e202400111(2024).
- Machikhin, A. S., Burlakov, A. B., Volkov, M. V., Khokhlov, D. D. Imaging photoplethysmography and videocapillaroscopy enable noninvasive study of zebrafish cardiovascular system functioning. J Biophoton. 13 (7), e202000061(2020).
- Denvir, M. A., Tucker, C. S., Mullins, J. J. Systolic and diastolic ventricular function in zebrafish embryos: Influence of norepenephrine, MS-222 and temperature. BMC Biotechnol. 8 (1), 1-8 (2008).
- Santoso, F., et al. Development of a simple ImageJ-based method for dynamic blood flow tracking in zebrafish embryos and its application in drug toxicity evaluation. Inventions. 4 (4), 65(2019).
- Vieira, R. S. F., Sousa, D., Félix, L. M., Venâncio, C. A. S. Anaesthetic profile of thymol and menthol in zebrafish larvae model. Aquaculture and Fisheries. , (2024).
- Westerfield, M. The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , 4th ed, Univ. of Oregon Press. Eugene. (2000).
- Azad, R., et al. Loss functions in the era of semantic segmentation: A survey and outlook. ArXiv. , (2023).
- Machikhin, A. S., et al. Combined optical and acoustic microscopy for non-invasive cardiovascular studies using zebrafish model. IEEE Trans Instrument Measurement. 74, 1-13 (2025).
- Wavelet analysis of Photoplethysmogram in zebrafish larvaе cardiovascular system Study. Slavin, A. E., Guryleva, A. V., Bukova, V. I., Shuman, L. A., Burlakov, A. B. 2024 26th Int Conf Digital Signal Proc Appl DSPA 2024, , 1-5 (2024).
- Kumari, S., Singh, D. Phenylthiourea-mediated experimental depigmentation reduces seizurogenic response of pentylenetetrazol in zebrafish larva. J Pharm Toxicol Methods. 128, 107532(2024).
- Xu, Y., et al. Highly sensitive response to the toxicity of environmental chemicals in transparent casper zebrafish. Sci Total Environ. 948, 174865(2024).
- Vedder, V. L., et al. pyHeart4Fish: Chamber-specific heart phenotype quantification of zebrafish in high-content screens. Front Cell Dev Biol. 11, 1143852(2023).
- Lane, S., More, L. A., Asnani, A. Zebrafish models of cancer therapy-induced cardiovascular toxicity. J Cardiovas Dev Dis. (2), 8(2021).
- Maciag, M., Wnorowski, A., Mierzejewska, M., Plazinska, A. Pharmacological assessment of zebrafish-based cardiotoxicity models. Biomed pharmacother. 148, 112695(2022).
- Krylov, V. V., et al. Non-invasive recording of heartbeats in Danio rerio and Daphnia magna to assess the toxicity of imidacloprid and glyphosate. Comp Biochem Physiol C Toxicol Pharmacol. 288, 110075(2025).
- Meng, H., Liang, J., Zheng, X., Zhang, K., Zhao, Y. Using a high-throughput zebrafish embryo screening approach to support environmental hazard ranking for cardiovascular agents. Sci Total Environ. 702, 134703(2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены