Method Article
Mesures du rythme cardiaque sans anesthésie chez le poisson-zèbre en mouvement libre
Dans cet article
Résumé
L’étude vise à développer une technologie permettant de mesurer le rythme cardiaque sans anesthésie chez les poissons-zèbres en mouvement. Notre approche combine l’imagerie infrarouge à ondes courtes et le suivi du cœur basé sur l’apprentissage automatique. Il s’agit d’une technique non invasive, sans marquage et conviviale qui convient à un large éventail d’études sur le modèle du poisson zèbre.
Résumé
Le poisson-zèbre (Danio rerio) est un organisme modèle largement utilisé dans la recherche physiologique, pharmacologique et toxicologique en raison de sa similitude génétique avec l’homme et de son stade embryonnaire transparent, qui facilite les études cardiovasculaires non invasives. Cependant, les méthodes actuelles d’évaluation de la fréquence cardiaque chez le poisson-zèbre reposent souvent sur l’anesthésie pour immobiliser le sujet, introduisant des altérations physiologiques qui compromettent l’exactitude et la reproductibilité des données. Cette étude présente une nouvelle technique sans anesthésie pour mesurer le rythme cardiaque chez les larves de poisson-zèbre se déplaçant librement, répondant ainsi à une limitation critique de la recherche cardiovasculaire. L’approche proposée intègre l’imagerie infrarouge à ondes courtes avec un suivi cardiaque basé sur l’apprentissage automatique, permettant une surveillance précise et continue de l’activité cardiaque dans les échantillons non immobilisés. Un réseau neuronal convolutif a été formé pour détecter la région cardiaque, et un signal photopléthysmographique a été extrait de séquences d’images pour déterminer la fréquence cardiaque. La validation expérimentale a démontré la fiabilité et la cohérence de la méthode dans de multiples conditions de test. L’un des principaux avantages de la méthodologie est sa capacité à préserver l’état physiologique naturel du poisson zèbre, en minimisant les artefacts induits par le stress. Cette technique non invasive et sans marquage offre des avantages significatifs pour l’étude de la physiologie cardiovasculaire, de la cardiotoxicité des médicaments et de la toxicologie environnementale, élargissant ainsi les applications potentielles du poisson-zèbre en tant que modèle pour la recherche biomédicale.
Introduction
Le poisson-zèbre (Danio rerio), un petit poisson cyprinidae, est devenu un organisme modèle essentiel en raison de sa petite taille, de son taux de reproduction élevé et de sa facilité de manipulation génétique 1,2,3. L’évaluation de la fréquence cardiaque chez les embryons de poisson-zèbre transparent est de plus en plus utilisée en physiologie, en embryologie, en toxicologie et dans d’autres domaines 4,5,6,7,8. D’une part, cette utilité est due au fait que le génome du poisson-zèbre comprend des gènes associés aux maladies cardiovasculaires humaines9, et que le cœur de Danio rerio partage des structures et des voies de signalisation similaires à celles des humains10,11. Cela fait du poisson-zèbre un modèle inestimable pour l’étude du développement cardiaque et des maladies 11,12,13. D’autre part, la fréquence cardiaque du poisson zèbre est sensible aux influences extérieures, ce qui en fait un excellent modèle pour les études physiologiques et toxicologiques en comparant la fonction cardiaque chez les poissons traités et non traités 7,8,14.
Des progrès significatifs ont été accomplis dans la mise au point de méthodes optiques non invasives pour évaluer la fréquence cardiaque chez les embryons de poissons transparents15,16. Ces techniques offrent l’avantage d’une collecte rapide de données à partir d’échantillons de grande taille. Par conséquent, des approches entièrement automatisées pour l’évaluation de la fréquence cardiaque chez les embryons de poisson ont été développées 4,5,6,17.
Cependant, certaines limitations limitent actuellement l’utilisation de ces techniques à la période de 3-4 dpf. La première limitation est une perte de transparence due à la pigmentation du corps du poisson. Le second est la mobilité croissante des embryons au fil du temps. Prolonger la période de développement précoce du poisson-zèbre au cours de laquelle les approches optiques peuvent être utilisées augmenterait leur utilité, permettant des conceptions expérimentales à long terme pour étudier la cardiomyopathie, les malformations cardiaques congénitales et divers impacts sur le système cardiovasculaire, y compris le suivi de la dynamique des effets au fil du temps. Notre groupe s’est récemment penché sur la question de la perte de transparence en utilisant l’imagerie dans la gamme infrarouge à ondes courtes de 900 à 1700 nm18. Cet article se concentre sur la question de la mobilité embryonnaire.
En règle générale, des anesthésiques comme le méthanesulfonate de tricaïne (MS-222) sont utilisés pour immobiliser les embryons et les larves de poissons nageant librement avant l’imagerie 14,19,20. Cependant, le MS-222 réduit considérablement la fréquence cardiaque21,22, tout comme les autres anesthésiques23. Il devient difficile de discerner si les changements observés dans la fonction cardiaque sont dus au traitement expérimental, à l’anesthésique ou à une interaction entre les deux. Une autre façon de prolonger la période de faible mobilité de l’embryon est de réduire la température au début du développement8. Cependant, cette approche n’est pas toujours compatible avec les objectifs de la recherche et n’allonge que très peu la période d’enregistrement.
Dans cette étude, nous présentons une nouvelle méthode pour traiter la mobilité embryonnaire lors de l’enregistrement de la fréquence cardiaque. Nous avons entraîné un réseau de neurones convolutifs pour identifier la région d’intérêt du cœur dans des enregistrements d’embryons de poissons-zèbres nageant librement. La variation périodique de l’intensité des pixels dans cette zone est utilisée pour calculer le photopléthysmogramme (PPG), qui est ensuite utilisé pour calculer la fréquence cardiaque. L’application de bureau développée, AutoHR, a utilisé à la fois l’entraînement par réseau neuronal et le traitement de la pile d’images, garantissant ainsi une facilité d’utilisation et une reproductibilité du protocole.
Protocole
Les poissons-zèbres ont été élevés selon les protocoles ZFIN24 établis. Toutes les procédures ont été approuvées par le Comité de bioéthique du Centre scientifique et technologique d’instrumentation unique de l’Académie des sciences de Russie (STC UI RAS), protocole #3/24, daté du 21/08/2024, et suivent les directives de soins du poisson zèbre de STC UI RAS. Des manuels pour les versions individuelles sont disponibles sur demande.
1. Préparation de l’équipement pour la mesure
- Sélection de l’équipement
- Choisissez une source lumineuse : Choisissez une source lumineuse LED qui émet dans le proche infrarouge, plus précisément à partir de 800 nm, avec une puissance de sortie minimale de 3 W. Cette étude a utilisé des LED avec une longueur d’onde centrale de 940 nm et une bande passante de 40 nm.
- Choisissez une caméra vidéo : choisissez une caméra équipée d’un capteur sensible à la plage de longueurs d’onde émise par la source lumineuse et dotée d’une fréquence d’images d’au moins 60 ips. Reportez-vous à la fiche technique de l’appareil photo pour déterminer le pas de pixel p, la taille du capteur le long de son côté le plus court h et la fréquence d’images. Dans cette étude, la caméra a un pas de pixel de p = 5 μm et une largeur de capteur h = 5,12 mm.
- Choisissez une taille de moule d’agarose qui est au moins 1,5 fois supérieure à la longueur de la larve B. Calculez les grossissements minimum et maximum admissibles du système optique à l’aide des expressions fournies. Assurez-vous que Mmax ≤ Mmin. Si cette condition n’est pas remplie, sélectionnez un appareil photo avec un h plus grand et/ou un S plus petit et/ou plus petit.
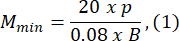
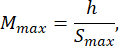
où Smax est la longueur du plus grand moule d’agarose de l’ensemble de moules. Un ensemble de moules de différentes tailles peut être préparé. Cette étude a utilisé S = 10 mm.
REMARQUE : Les équations sont dérivées de la géométrie du schéma optique et des proportions corporelles du poisson-zèbre. Des explications détaillées sont fournies dans la section Discussion. - Choisissez un objectif : Cette étude a utilisé un système optique avec des grossissements variables allant de MOSmin = 0,4x à MOSmax = 1,5x, une distance focale maximale de fmax = 150 mm et une distance de travail de mm.
REMARQUE : Le symbole x indique le facteur de grossissement du système optique.- Choisissez un système de type microscope à grossissement variable avec une plage de grossissement (MOSmin - MOSmax) qui reste dans la plage admissible (Mmin - Mmax). Reportez-vous à la fiche technique de l’objectif pour déterminer la distance focale maximale fmax et la distance de travail correspondante L pour MOSmax.
- Assurez-vous que la condition fmax ≤ Mmax • L est satisfaite. Si cette condition n’est pas remplie, sélectionnez un objectif avec un fmax et/ou un L différent. Assurez-vous que le type de monture de l’appareil photo et de l’objectif est compatible.
- Choisissez un objet de test (une règle ou une grille) avec une hauteur connue et une longueur totale d’au moins . Choisissez un objet de test sous la forme d’une règle ou d’une grille avec un pas connu et une taille totale d’au moins Smax.
- Assemblage d’un support pour l’acquisition d’images (Figure 1).
- Montez la tige ronde sur une base stable. Assemblez le système d’imagerie en fixant l’objectif à l’appareil photo. Montez le canal d’imagerie sur la tige avec la fenêtre d’entrée vers le haut.
- Montez le mécanisme de mise au point sur la tige. Fixez une platine avec une surface de travail en verre d’un diamètre minimum de 30 mm au mécanisme de mise au point.
- Assemblez l’illuminateur : Placez la LED sur un substrat métallique pour assurer une dissipation efficace de la chaleur. Placez une lentille collimatrice plate convexe d’un diamètre de 23 mm et d’une distance focale de 30 mm à une distance de 30 mm de la LED.
- Montez l’illuminateur sur la scène à l’aide d’un support réglable sur trois axes, en le positionnant au-dessus de la surface de travail avec l’objectif vers le bas.
- Réglez l’illuminateur et le système d’imagerie. Positionnez l’illuminateur de manière coaxiale avec le système d’imagerie. Allumez l’illuminateur et connectez l’appareil photo à l’ordinateur.
- Lancez l’application appareil photo et activez le mode de prévisualisation en suivant les instructions du manuel de l’appareil photo. Placez l’objet de test sur la scène. Ajustez la distance de travail et le grossissement du microscope pour vous assurer que la taille s’adapte parfaitement au champ de vision.
REMARQUE : La taille doit s’adapter entièrement le long du côté court du cadre pour assurer une visualisation complète du moule d’agarose. - Ajustez la position de la platine par rapport au système d’imagerie pour vous assurer que l’image est mise au point et que la position de l’illuminateur est uniformément éclairée.
- Préparation du moule à agarose
- Mélangez 20 ml d’eau distillée avec 0,4 g d’agarose à bas point de fusion et chauffez le mélange jusqu’à ce que l’agarose se dissolve complètement. Par exemple, dans un micro-ondes pendant 20 s à une puissance de 700 W.
- Façonnez le moule à agarose (méthode 1) : Versez la solution chauffée dans la boîte de Pétri, en veillant à une hauteur de solution de 1,5 à 2 mm. Refroidissez la boîte de Pétri jusqu’à ce que la solution d’agarose se soit solidifiée. À une température de 17 °C, ce processus dure environ 5 min. Coupez un carré d’une longueur latérale à l’aide d’un couteau de papeterie et retirez soigneusement la couche d’agarose dans la zone délimitée.
- Façonnez le moule à agarose (Méthode 2) : Créez (S) × (S) × 10 mm, formes en plastique. Placez le formulaire imprimé avec le côté carré dans une boîte de Pétri et remplissez-le avec la solution chauffée, en assurant une hauteur de solution de 1,5 à 2 mm. Refroidissez la boîte de Pétri jusqu’à ce que la solution d’agarose se soit solidifiée et retirez soigneusement la forme de la solution solidifiée.
REMARQUE : Les formulaires peuvent être facilement imprimés à l’aide d’une imprimante 3D.
2. Acquisition d’images
- Ajustez les paramètres de capture d’image.
- Connectez l’appareil photo à l’ordinateur. Lancez l’application appareil photo et activez le mode de prévisualisation. Allumez l’illuminateur.
REMARQUE : Si la taille du moule à agarose à utiliser diffère de celle de l’étape 1.3.3, répétez l’étape 1.3.3 et retirez l’objet d’essai de l’étape par la suite. - Placez la larve de poisson-zèbre dans un moule à agarose à l’aide d’une pipette Pasteur. Placez un moule à agarose sur la scène. Assurez-vous que la tête de la larve est presque complètement éclairée en ajustant la combinaison du temps d’exposition et de la puissance de l’illuminateur (figure 2A-C). Le temps d’exposition ne doit pas dépasser 1,5 ms.
REMARQUE : Dans cette étude, nous présentons des données pour des larves de poisson-zèbre de type sauvage âgées de 12 à 21 jours après la fécondation (dpf).
- Connectez l’appareil photo à l’ordinateur. Lancez l’application appareil photo et activez le mode de prévisualisation. Allumez l’illuminateur.
- Effectuer l’acquisition d’images
- Réglez la fréquence d’images sur au moins 60 ips. Réglez la profondeur de l’image sur 12 bits. Acquérir des images pendant au moins 10 s. Définissez le format de dénomination de cadre sur yyyy_mm_dd_hh_ss_mm_mss et le type de fichier doit être PNG ou TIFF, et non BMP.
3. Entraînement du réseau neuronal pour l’étiquetage
- Préparation des données pour l’étiquetage
REMARQUE : le processus d’étiquetage dans l’application Image Labeler, MATLAB, est décrit.- Rassemblez au moins 256 images acquises dans un répertoire séparé. Exécutez l’application. Importez les images en accédant à Importer > à partir du fichier et en sélectionnant toutes les images dans le répertoire spécifié.
- Créez des classes pour l’étiquetage du réseau. Dans l’onglet Étiquettes de retour d’intérêt, cliquez sur Étiquette, entrez le corps dans le champ Nom de l’étiquette, sélectionnez Étiquette de pixel dans le menu déroulant du type d’étiquette, puis cliquez sur OK. Dans l’onglet Étiquettes de retour sur investissement, cliquez sur Étiquette, entrez œil dans le champ Nom de l’étiquette, sélectionnez Étiquette de pixel dans le menu déroulant du type d’étiquette, puis cliquez sur OK. Dans l’onglet Étiquettes de retour sur investissement, cliquez sur Étiquette, entrez poisson dans le champ Nom de l’étiquette, sélectionnez Rectangle dans le menu déroulant du type d’étiquette, puis cliquez sur OK.
- Étiquetage des cadres
- Dans l’onglet Étiquettes de retour sur investissement, sélectionnez la classe d’annotation précédemment créée, œil. Délimitez un œil de l’échantillon en plaçant des points le long de son périmètre à l’aide du bouton gauche de la souris. Pour terminer l’annotation de l’œil, cliquez sur le point de départ du contour (Figure 3B).
- Tracez le contour d’un autre œil de l’échantillon de la même manière que celle décrite à l’étape 3.1.2.
- Dans l’onglet Étiquettes de retour sur investissement, sélectionnez la classe d’annotation créée, body. Délimitez le corps de l’échantillon, à l’exclusion des yeux, en plaçant des points le long de son périmètre à l’aide du bouton gauche de la souris. Pour terminer l’annotation de l’œil, cliquez sur le point de départ du contour.
- Dans l’onglet Étiquettes de retour d’intérêt, sélectionnez la classe d’annotation créée précédemment, fish. Délimitez tout le corps de l’échantillon en dessinant une boîte englobante rectangulaire (Figure 4). Pour ce faire, cliquez sur un coin du rectangle prévu avec le bouton gauche de la souris, puis faites glisser le curseur tout en maintenant le bouton enfoncé jusqu’à ce que le rectangle entoure complètement le poisson.
- Enregistrez les contours dans un nouveau répertoire nommé images en cliquant sur Exporter > vers un fichier dans l’onglet ÉTIQUETTE.
- Préparation des ensembles de données pour l’entraînement des réseaux neuronaux
- Lancez MATLAB. Ouvrez le fichier de script DatasetsPreparation.m (Fichier supplémentaire 1) en sélectionnant Ouvrir > Ouvrir.
- Exécutez le script en cliquant sur Exécuter. Dans la fenêtre contextuelle, sélectionnez le répertoire contenant les images présentées, le dossier PixelLabelData et le fichier gTruth.mat, qui a été exporté à l’étape 3.2.5.
REMARQUE : Une fois l’exécution du script terminée, deux dossiers - Formation RPN et Formation CNN - seront automatiquement générés. Ils sont nécessaires pour l’entraînement ultérieur du réseau neuronal. Ne modifiez pas le contenu de ces dossiers.
4. Entraînement des réseaux neuronaux pour la détection cardiaque
REMARQUE : Cette étape est effectuée une fois pour un âge et une condition d’imagerie spécifiques. Le GPU NVIDIA est fortement recommandé pour l’entraînement car il accélère considérablement le traitement.
- Lancez l’application AutoHR. Accédez à l’onglet Formation du réseau de propositions de région. Cliquez sur Choisir un répertoire et sélectionnez le dossier Formation RPN créé à l’étape 3.3.2. Cliquez sur Démarrer la formation.
REMARQUE : À la fin de la formation, un fichier de modèle nommé rpn_model.pt sera généré dans le même répertoire que le fichier AutoHR.exe. Ce fichier est nécessaire pour le traitement ultérieur de la pile d’images. - Pour entraîner le réseau neuronal convolutif, accédez à l’onglet Entraînement du réseau neuronal convolutif. Cliquez sur Choisir un répertoire et sélectionnez le dossier CNN Training créé à l’étape 3.3.2. Cliquez sur Démarrer la formation.
REMARQUE : À la fin de la formation, un fichier de modèle nommé model.pt sera généré dans le même répertoire que le fichier AutoHR.exe. Ce fichier est nécessaire pour le traitement ultérieur de la pile d’images.
5. Quantification de la fréquence cardiaque
- Enregistrez une séquence d’images comme décrit à l’étape 2. Assurez-vous que les conditions d’imagerie, telles que le grossissement, le temps d’exposition et l’éclairage, sont identiques à celles utilisées pour l’entraînement du réseau neuronal.
- Lancez l’application AutoHR. Accédez à l’onglet Traitement. Sélectionnez le répertoire contenant les modèles de réseaux neuronaux entraînés en cliquant sur Choisir des modèles. Cliquez sur Choisir un dossier pour importer les images acquises à des fins d’analyse. Le chemin d’exportation sera spécifié automatiquement, mais vous pouvez le modifier en cliquant sur Choisir le chemin d’exportation. Cliquez sur Traiter pour commencer l’analyse.
REMARQUE : Une fois l’opération terminée, la valeur de la fréquence cardiaque apparaîtra dans le champ Fréquence cardiaque de l’interface AutoHR. Le dossier exporté comprendra les valeurs de fréquence cardiaque (.xlsx), PPG (.xlsx), la première image de la séquence et les masques pour le corps et les yeux de la première image (.png).
6. Vérification des résultats de l’algorithme
- Effectuez l’essai avec un poisson immobile comme décrit ci-dessous.
- Anesthésier les larves avec une solution de MS-222 à 0,168 mg/L pendant 1 min. Acquérez une pile d’images d’un échantillon anesthésié comme décrit à l’étape 2. Effectuez un comptage de la fréquence cardiaque par observation visuelle.
- Utilisez le logiciel RH comme décrit à l’étape 5. Répétez les étapes pour plusieurs échantillons. Vérifiez si les valeurs de fréquence cardiaque obtenues sont cohérentes pour tous les individus avec la précision souhaitée.
- Effectuez le test avec un individu mobile et le test de provocation comme décrit ci-dessous.
- Acquérir une pile d’images d’un échantillon non anesthésié comme décrit à l’étape 2. Effectuez un test de provocation avec la personne pour laquelle la séquence a été enregistrée, en utilisant un stimulus connu qui affecte la fréquence cardiaque. L’étude présente des résultats pour la salinisation de l’eau à des concentrations de 5 mg/L.
- Acquérir une pile d’images du même échantillon que celui décrit à l’étape 2 après l’essai de provocation. Déterminez la fréquence cardiaque dans les deux expériences avec le logiciel de fréquence cardiaque, comme décrit à l’étape 5. Vérifiez si les changements observés dans la fréquence cardiaque correspondent aux effets connus du test de provocation.
Résultats
La fréquence cardiaque du poisson-zèbre à 12 dpf a été déterminée à l’aide du protocole décrit ci-dessus (vidéo supplémentaire 1). Les vidéos comprennent une séquence d’images de larves de poisson-zèbre nageant librement, un photopléthysmogramme dérivé de ces séquences à l’aide du protocole proposé, et la fréquence cardiaque correspondante calculée à partir du photopléthysmogramme.
Les données étiquetées ont été divisées de manière aléatoire en ensembles d’entraînement, de test et de validation dans un rapport de 3:2:1 pendant l’entraînement. La fonction de perte a ensuite été implémentée selon l’expression suivante :

où x est le logit d’entrée, y est une cible, la taille du lot est le nombre d’images traitées simultanément,

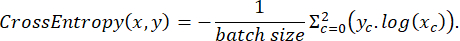
Pour évaluer les performances du modèle pendant l’entraînement, la fonction de précision de prédiction a été utilisée, définie comme suit :


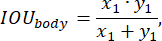
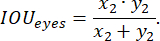
Nous avons appliqué des approches standard pour le développement de la fonction de perte, comme nous l’avons détaillé, par exemple, aupoint 25. Le réseau d’attention multi-échelle avec l’architecture du modèle EfficientNet-B0 a été utilisé comme couche de sortie de l’encodeur et de softmax. Le réseau neuronal a été entraîné sur un échantillon de test pendant 50 époques, en utilisant un taux d’apprentissage décroissant exponentiellement qui commençait à 0,02 et avait un facteur de décroissance de 0,99.
Le réseau neuronal entraîné a été utilisé pour obtenir le masque corporel et le masque oculaire (Figure 5C) de l’individu dans chaque image d’une séquence arbitraire. Le centre de masse du masque oculaire a ensuite été calculé, et la squelettisation a été appliquée au masque corporel (Figure 5D). Sur la corde de poisson P résultante, le point M, situé le plus près du centre de masse du masque oculaire, a été identifié (Figure 5F). À une distance d du point M, égale à la distance entre les yeux, le point N a été identifié le long de la corde PPP vers la queue. Ce point correspond au centre de la zone du cœur. Cette aire était délimitée par un cercle de rayon r = d x 0,3, centré en ce point (figure 5F).
Le signal PPG brut a été calculé comme le nombre moyen de pixels dans la zone du cœur sur toutes les images enregistrées (Figure 5G). Ce signal brut a ensuite été normalisé à sa valeur moyenne. Par la suite, le signal a été filtré à l’aide d’un filtre de type II de Tchebychev de second ordre avec une conception de 4e ordre, une atténuation de la bande d’arrêt de 25 dB et une fréquence de bord de bande d’arrêt de 12 Hz, conformément aux algorithmes de traitement standard26,27 (Figure 6A). La fréquence cardiaque a été déterminée en identifiant la fréquence dans la gamme 1-4 Hz qui correspond à la puissance de crête dans le module carré de la transformée de Fourier du signal filtré (Figure 6A).
L’équation (1) garantit que l’image du cœur est d’environ 20 pixels x 20 pixels. On suppose que la dimension longitudinale du cœur représente environ 8 % de la longueur totale du corps du poisson zèbre. Lorsque l’image du cœur est plus petite, le signal résultant contient souvent une composante de bruit importante qui dépasse le signal utile, ce qui le rend impropre au calcul de la fréquence cardiaque, comme le montre la figure 6B.
Les résultats de l’application du protocole dépendent de manière significative de la stabilité de la segmentation cardiaque pour chaque individu. Il est crucial de mener des expériences de contrôle pour démontrer que les étapes 2 à 5 ont été menées à bien et que les données obtenues reflètent des processus physiologiques réels plutôt que des résultats aléatoires. La validation du protocole a été effectuée selon la procédure détaillée à l’étape 6. Dans l’essai décrit à l’étape 6.2, du sel a été ajouté à l’eau à une concentration de 5 mg/L comme stimulus provocateur. Cinq larves de poisson-zèbre (12 pdf) ont été incluses dans chaque test. La température de l’eau dans un moule à agarose a été maintenue à 23-25 °C. Les résultats indiquent que la différence entre l’évaluation visuelle et la méthode proposée ne dépassait pas 3 % lors du premier essai. Dans le deuxième test, la fréquence cardiaque mesurée par la méthode a augmenté, comme prévu (Figure 7).

Figure 1 : Flux de travail schématique. (A) Schéma et (B) Apparence de la configuration expérimentale Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Images de larves de poisson-zèbre. Des exemples d’images de larves de poisson-zèbre de haute qualité (A) et de (B-D) de faible qualité sont (B) image sous-exposée, (C) image surexposée et (D) image floue. Les images ont été recadrées pour mettre en valeur la larve. La barre d’échelle est de 1 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 3 : Images représentatives. Exemples d’images initiales (A) et (B) d’images étiquetées. La barre d’échelle est de 1 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
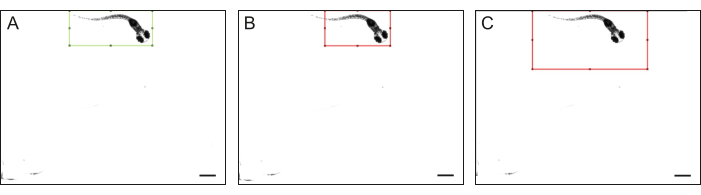
Figure 4 : Contours du corps du poisson-zèbre. Exemples de contours (A) de haute qualité et (B-C) de faible qualité de l’ensemble du corps du poisson-zèbre : un poisson-zèbre ne rentre pas entièrement dans le rectangle, et la taille du rectangle est nettement plus grande que celle du poisson-zèbre. La barre d’échelle est de 1 mm. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 5 : Pipeline de traitement d’images illustrant les étapes de traitement primaires et leurs résultats intermédiaires correspondants. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Images montrant la fréquence cardiaque des larves. Exemples d’images (A) de haute qualité et (B) de basse qualité avec la zone du cœur larvaire avec des diamètres de 20 pixels et 14 pixels, respectivement, et les spectres correspondants de PPG et de Fourier de PPG. La barre d’échelle est de 1 mm. Abréviations : PPG = photopléthysmographie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
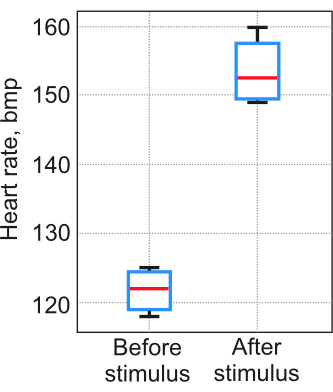
Figure 7 : Mesures de la fréquence cardiaque. Les mesures ont été obtenues à l’aide de la méthode proposée dans un test avec un stimulus de provocation. Numéro d’échantillon . La boîte couvre les 25e et 75e centiles, la ligne horizontale est la médiane, les moustaches noires indiquent les points de données les plus extrêmes qui ne sont pas considérés comme des valeurs aberrantes. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Vidéo supplémentaire 1 : Illustration de l’algorithme de réseau neuronal proposé pour la détection et le calcul de la fréquence cardiaque. La vidéo présente des larves de poisson-zèbre se déplaçant librement, un photopléthysmogramme dérivé du protocole proposé et calculé à partir de la fréquence cardiaque des larves du photopléthysmogramme. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 1 : Fonction MATLAB qui effectue l’augmentation d’image. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Dans cette étude, nous présentons un protocole expérimental pour mesurer le rythme cardiaque de larves de poisson-zèbre nageant librement. Nous avons évalué cette approche à travers plusieurs expériences, démontrant son efficacité. Les éléments clés de la méthode proposée comprennent à la fois des solutions matérielles et logicielles. Tout d’abord, nous avons utilisé l’éclairage infrarouge pour l’imagerie, ce qui, comme démontré précédemment, évite les problèmes liés à la pigmentation et améliore la transparence des tissus, facilitant ainsi la détermination précise du rythme cardiaque18. Deuxièmement, nous proposons d’imager le poisson d’en bas. Lorsqu’elles sont anesthésiées, les larves de poisson-zèbre se couchent généralement sur le côté en raison de la position de la vessie natatoire, ce qui fait que la différence d’orientation entre les configurations de microscope standard et inversé est négligeable. Cependant, comme le cœur d’un poisson nageur est toujours situé ventralement, le positionnement du canal d’imagerie en dessous et du canal d’éclairage au-dessus améliore le rapport signal/bruit. Enfin, nous avons considérablement amélioré les performances de traitement en utilisant un réseau neuronal pour localiser l’échantillon dans l’image et identifier les organes individuels. En utilisant à la fois des connaissances préalables et des données empiriques, nous avons développé des méthodes pour localiser le cœur dans le corps de la larve de poisson-zèbre tel que détecté par le réseau neuronal.
Parmi les autres avantages de l’approche, citons l’utilisation d’une source lumineuse LED qui, contrairement aux lampes halogènes, ne génère pas de chaleur. La fixation du canal d’éclairage sur la scène permet un alignement par rapport à la taille du moule, éliminant ainsi le besoin de réglages de lumière supplémentaires lors de la remise au point. L’algorithme peut également être appliqué pour générer de grands ensembles de données pour l’entraînement ultérieur d’un réseau neuronal pour la segmentation cardiaque. Il accélère le traitement des données et minimise les erreurs dans la détermination de la position cardiaque. L’étiquetage direct du cœur sur les images présente un défi important en raison de sa petite taille et des difficultés à déterminer avec précision ses limites et sa position dans un seul cadre.
Plusieurs facteurs critiques doivent être pris en compte pour obtenir des résultats optimaux lors de la mise en œuvre de ce protocole. Tout d’abord, le temps d’exposition ne doit pas dépasser 1,5 ms, car des temps d’exposition plus longs peuvent entraîner un flou de l’image, en particulier lors des mouvements rapides d’individus. Un tel flou entraverait le calcul précis du photopléthysmogramme à des points temporels spécifiques (Figure 6B). Deuxièmement, les forces de tension superficielle provoqueront la courbure de la surface de l’eau dans la cuvette, entraînant une diffusion de la lumière et une distorsion des images résultantes lors de la capture vidéo. Pour atténuer cet effet, une couche mince et uniforme d’eau doit être appliquée sur la surface de l’agarose pour assurer un niveau d’eau plat et constant dans toute la boîte de Pétri. Étant donné que l’agarose absorbe progressivement l’eau, nous recommandons d’ajouter de l’eau environ toutes les 10 minutes pour maintenir un niveau stable. Enfin, le choix du grossissement de l’objectif doit être adapté au stade de développement et aux exigences spécifiques de l’expérience. Un grossissement fixe dans une plage appropriée est suffisant pour des mesures cohérentes au sein d’un même groupe d’âge et dans des conditions uniformes. Cependant, une lentille à grossissement variable est plus adaptée aux études impliquant différents stades de développement ou tâches.
Si les tests révèlent que l’algorithme échoue, les étapes 2 et 3 doivent être réexaminées et réimplémentées. L’étape 3 présente souvent des défis, en particulier lors de l’étiquetage d’images. Assurez-vous d’une annotation soigneuse des yeux et du corps, en évitant tout chevauchement entre ces deux classes. Utilisez des images qui capturent l’individu dans différentes positions, en particulier celles qui présentent une flexion prononcée du corps, afin d’améliorer la précision de l’étiquetage. L’étape 2 doit être répétée dans les cas où des problèmes d’intensité d’éclairage, de temps d’exposition ou de grossissement sont identifiés. Des réglages incorrects peuvent réduire le rapport signal/bruit, ce qui permet au bruit de submerger le signal (Figure 6B). De plus, une défaillance de l’algorithme peut survenir si les données d’entraînement et expérimentales sont obtenues dans des paramètres différents.
La configuration matérielle proposée utilise une caméra infrarouge avec une plage de sensibilité de 900 à 1700 nm. Cependant, les caméras haute résolution fonctionnant dans cette gamme spectrale sont souvent d’un coût prohibitif. Pour remédier à cette limitation, des caméras vidéo industrielles à spectre visible dont la sensibilité s’étend dans le proche infrarouge peuvent être utilisées après avoir retiré leurs filtres infrarouges comme alternative rentable aux caméras infrarouges. En plus d’utiliser le rayonnement infrarouge, les effets de la pigmentation peuvent également être minimisés en appliquant des produits chimiques dépigmentants ou en utilisant des poissons de lignées génétiques spécifiques qui manquent de pigmentation28,29. La version actuelle du logiciel est conçue uniquement pour la mesure de la fréquence cardiaque. Cependant, d’autres paramètres d’ondes de pouls sont tout aussi essentiels pour une recherche approfondie. Les futures mises à niveau logicielles se concentreront sur l’intégration de l’analyse de la variabilité de la fréquence cardiaque, un indicateur clé de diverses maladies. Des mesures plus détaillées, telles que l’intervalle Q-T, font l’objet d’une étude plus approfondie. Pour développer un modèle de réseau neuronal universel capable de fonctionner avec des données d’âges et de conditions d’acquisition d’images différents, l’ensemble de données d’entraînement doit inclure divers échantillons avec au moins 128 images étiquetées de chaque type.
Plusieurs approches ont déjà été développées pour la détection automatisée de la zone cardiaque et le suivi de la fréquence cardiaque chez les embryons de poisson-zèbre 4,6 et de medaka 6,17. Le marquage fluorescent du cœur chez le poisson-zèbre a été proposé pour la détermination de la surface cardiaque30. Cependant, toutes les méthodes publiées précédemment se limitent à travailler avec des embryons immobiles et transparents pendant la brève période post-fécondation précédant le début de la motilité de l’embryon. Il s’agit d’une limitation importante qui réduit l’applicabilité de ces techniques. Un autre problème décrit dans la littérature et les documents supplémentaires concerne le mouvement soudain des embryons pendant l’enregistrement de la fréquence cardiaque 6,17. Un tel mouvement peut déplacer la zone cardiaque ciblée par le logiciel pour le calcul de la fréquence cardiaque. L’approche décrite dans cette étude remédie à ces lacunes, permettant le suivi de poissons-zèbres mobiles jusqu’à 30 dpf.
Les avantages de cette approche élargissent considérablement les possibilités de son application potentielle. Ces dernières années, Danio rerio est devenu un modèle répandu pour l’étude des pathologies cardiovasculaires et de la cardiotoxicité 11,12,31. La capacité de cette méthode à enregistrer de manière non invasive la fréquence cardiaque à différents stades précoces du développement sans anesthésie offre de nouvelles opportunités pour étudier la dynamique des malformations cardiaques induites et les effets thérapeutiques. De nos jours, la surveillance de la fréquence cardiaque chez les embryons de poisson-zèbre est utilisée pour le dépistage de médicaments dans les études précliniques 32. Les avantages décrits de la méthode proposée fournissent des outils supplémentaires pour l’évaluation des effets retardés et de la pharmacodynamique des médicaments. Enfin, l’utilisation de la fréquence cardiaque du poisson-zèbre augmente constamment dans la surveillance écotoxicologique33,34. Dans ce domaine, l’approche proposée permet d’évaluer les effets toxiques chroniques des polluants à de faibles concentrations sur des périodes d’exposition prolongées et les effets associés à la bioaccumulation.
Déclarations de divulgation
Tous les auteurs ont divulgué tout conflit d’intérêts.
Remerciements
Cette étude a été soutenue par le programme de travail de l’État fédéral de STC UI RAS (FFNS-2025-0008). Ce travail a été réalisé à l’aide de l’équipement du Centre d’Utilisation Collective de STC UI RAS [http:// https://ckp.ntcup.ru/en/].
matériels
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Low melting agarose | Biozym | 850111 | |
| Table salt | Pegasus | N/A | |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10505 | MS-222 |
| Equipment | |||
| Base with rod | Altami | SM-U1 | |
| Collimator lens | JLLSCMGGX | Focal length 30 mm | |
| Focusing mechanism | Altami | SM-12 | D=76 mm |
| LED | Cree | TR-3535IR-3W | |
| Lens | SFK Security | C-Mount, F1.6, 1/3”, | |
| Near infrared camera | ToupTek | SWIR1300KMA | |
| Pasteur pipette | PE-LD | 149293 | |
| Petri Dish 35 x 15 mm | BD Falcon | 351008 | |
| Plastic forms | N/A | N/A | Made by 3D printing |
| Power supply | Unit-T | UTP3300TFL-II | |
| Stage | N/A | N/A | Made by 3D printing |
| Stationery knife | ErichKrause | 19145 | |
| Test object | Wally Sky | MS-1-EB | |
| Software | |||
| EfficientDet | N/A | N/A | https://github.com/rwightman/efficientdet-pytorch |
| EfficientNet-b0 model | N/A | N/A | https://arxiv.org/abs/1905.11946 |
| Google API Client | N/A | Google API Client is a Python client library for Google's discovery-based APIs. https://github.com/googleapis/google-api-python-client | |
| Hardware | |||
| Multi-scale attention network | N/A | N/A | https://arxiv.org/abs/2209.14145 |
| NVIDIA DIGITS | NVIDIA | N/A | NVIDIA DIGITS is a wrapper for Caffe that provides a graphical web interface. https://developer.nvidia.com/digits |
| NVIDIA GPU | NVIDIA | N/A | An NVIDIA GPU is needed as some of the software frameworks below will not work otherwise. https://www.nvidia.com |
| OpenCV | Intel | N/A | OpenCV is a library for computer vision. https://opencv.org |
| Python | Python Software Foundation | N/A | Python is a programming language. https://www.python.org |
Références
- Fontana, B. D., Mezzomo, N. J., Kalueff, A. V., Rosemberg, D. B. The developing utility of zebrafish models of neurological and neuropsychiatric disorders: A critical review. Exp Neurol. 299 (Pt A), 157-171 (2018).
- Chen, X., Li, Y., Yao, T., Jia, R. Benefits of zebrafish xenograft models in cancer research. Front Cell Dev Biol. 9, 616551 (2021).
- Lai, K. P., Gong, Z., Tse, W. K. F. Zebrafish as the toxicant screening model: Transgenic and omics approaches. Aquat Toxicol. 234, 105813 (2021).
- Pylatiuk, C., et al. Automatic zebrafish heartbeat detection and analysis for zebrafish embryos. Zebrafish. 11 (4), 379-383 (2014).
- Krishna, S., Chatti, K., Galigekere, R. R. Automatic and robust estimation of heart rate in zebrafish larvae. IEEE Trans Auto Sci Eng. 15 (3), 1041-1052 (2018).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Sci Rep. 10 (1), 2046 (2020).
- Meng, H., Liang, J., Zheng, X., Zhang, K., Zhao, Y. Using a high-throughput zebrafish embryo screening approach to support environmental hazard ranking for cardiovascular agents. Sci Total Environ. 702, 134703 (2020).
- Krylov, V., et al. Influence of hypomagnetic field on the heartbeat in zebrafish embryos. Front Physiol. 13, 1040083 (2022).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Staudt, D., Stainier, D. Uncovering the molecular and cellular mechanisms of heart development using the zebrafish. Ann Rev Gene. 46, 397-418 (2012).
- Bowley, G., et al. Zebrafish as a tractable model of human cardiovascular disease. Br J Pharmacol. 179 (5), 900-917 (2022).
- Brown, D. R., Samsa, L. A., Qian, L., Liu, J. Advances in the study of heart development and disease using zebrafish. J Cardiovas Dev Dis. 3 (2), 13 (2016).
- Dhillon, S. S., et al. Optimisation of embryonic and larval ECG measurement in Zebrafish for quantifying the effect of QT prolonging drugs. PLoS One. 8 (4), e60552 (2013).
- Bedrossiantz, J., et al. Heart rate and behavioral responses in three phylogenetically distant aquatic model organisms exposed to environmental concentrations of carbaryl and fenitrothion. Sci Total Environ. 865, 161268 (2023).
- Santoso, F., et al. An overview of methods for cardiac rhythm detection in zebrafish. Biomedicines. 8 (9), 329 (2020).
- Ling, D., Chen, H., Chan, G., Lee, S. M. Y. Quantitative measurements of zebrafish heartrate and heart rate variability: A survey between 1990-2020. Comp Biol Med. 142, 105045 (2022).
- Ferreira, M. S., et al. FEHAT: Efficient, large scale and automated heartbeat detection in medaka fish embryos. Bioinformatics. 40 (12), btae664 (2024).
- Volkov, M., et al. Optical transparency and label-free vessel imaging of zebrafish larvae in shortwave infrared range as a tool for prolonged studying of cardiovascular system development. Sci Rep. 12 (1), 20884 (2022).
- Machikhin, A., et al. Microscopic photoplethysmography-based evaluation of cardiotoxicity in whitefish larvae induced by acute exposure to cadmium and phenol. J Biophoton. 17 (9), e202400111 (2024).
- Machikhin, A. S., Burlakov, A. B., Volkov, M. V., Khokhlov, D. D. Imaging photoplethysmography and videocapillaroscopy enable noninvasive study of zebrafish cardiovascular system functioning. J Biophoton. 13 (7), e202000061 (2020).
- Denvir, M. A., Tucker, C. S., Mullins, J. J. Systolic and diastolic ventricular function in zebrafish embryos: Influence of norepenephrine, MS-222 and temperature. BMC Biotechnol. 8 (1), 1-8 (2008).
- Santoso, F., et al. Development of a simple ImageJ-based method for dynamic blood flow tracking in zebrafish embryos and its application in drug toxicity evaluation. Inventions. 4 (4), 65 (2019).
- Vieira, R. S. F., Sousa, D., Félix, L. M., Venâncio, C. A. S. Anaesthetic profile of thymol and menthol in zebrafish larvae model. Aquaculture and Fisheries. , (2024).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Azad, R., et al. Loss functions in the era of semantic segmentation: A survey and outlook. ArXiv. , (2023).
- Machikhin, A. S., et al. Combined optical and acoustic microscopy for non-invasive cardiovascular studies using zebrafish model. IEEE Trans Instrument Measurement. 74, 1-13 (2025).
- Slavin, A. E., Guryleva, A. V., Bukova, V. I., Shuman, L. A., Burlakov, A. B. Wavelet analysis of Photoplethysmogram in zebrafish larvaе cardiovascular system Study. , 1-5 (2024).
- Kumari, S., Singh, D. Phenylthiourea-mediated experimental depigmentation reduces seizurogenic response of pentylenetetrazol in zebrafish larva. J Pharm Toxicol Methods. 128, 107532 (2024).
- Xu, Y., et al. Highly sensitive response to the toxicity of environmental chemicals in transparent casper zebrafish. Sci Total Environ. 948, 174865 (2024).
- Vedder, V. L., et al. pyHeart4Fish: Chamber-specific heart phenotype quantification of zebrafish in high-content screens. Front Cell Dev Biol. 11, 1143852 (2023).
- Lane, S., More, L. A., Asnani, A. Zebrafish models of cancer therapy-induced cardiovascular toxicity. J Cardiovas Dev Dis. (2), 8 (2021).
- Maciag, M., Wnorowski, A., Mierzejewska, M., Plazinska, A. Pharmacological assessment of zebrafish-based cardiotoxicity models. Biomed pharmacother. 148, 112695 (2022).
- Krylov, V. V., et al. Non-invasive recording of heartbeats in Danio rerio and Daphnia magna to assess the toxicity of imidacloprid and glyphosate. Comp Biochem Physiol C Toxicol Pharmacol. 288, 110075 (2025).
- Meng, H., Liang, J., Zheng, X., Zhang, K., Zhao, Y. Using a high-throughput zebrafish embryo screening approach to support environmental hazard ranking for cardiovascular agents. Sci Total Environ. 702, 134703 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon