Method Article
מדידות דופק ללא הרדמה בדג זברה הנע בחופשיות
In This Article
Summary
המחקר נועד לפתח טכנולוגיה למדידות פעימות לב ללא הרדמה בדגי זברה נעים. הגישה שלנו משלבת הדמיית אינפרא אדום בגלים קצרים ומעקב מבוסס למידת מכונה של הלב. זוהי טכניקה לא פולשנית, נטולת תוויות וידידותית למשתמש המתאימה למגוון רחב של מחקרים על דגם דג הזברה.
Abstract
דג הזברה (Danio rerio) הוא אורגניזם מודל בשימוש נרחב במחקר פיזיולוגי, פרמקולוגי וטוקסיקולוגי בשל הדמיון הגנטי שלו לבני אדם והשלב העוברי השקוף, המאפשר מחקרים קרדיווסקולריים לא פולשניים. עם זאת, השיטות הנוכחיות להערכת דופק בדגי זברה מסתמכות לעתים קרובות על הרדמה כדי לשתק את הנבדק, ומציגות שינויים פיזיולוגיים הפוגעים בדיוק הנתונים וביכולת השחזור. מחקר זה מציג טכניקה חדשה ונטולת הרדמה למדידת פעימות לב בזחלי דג זברה הנעים בחופשיות, תוך התייחסות למגבלה קריטית במחקר הלב וכלי הדם. הגישה המוצעת משלבת הדמיית אינפרא אדום בגלים קצרים עם מעקב לב מבוסס למידת מכונה, המאפשרת ניטור מדויק ורציף של פעילות הלב בדגימות שאינן משותקות. רשת עצבית קונבולוציונית הוכשרה לזהות את אזור הלב, ואות פוטו-פלתיסמוגרפי חולץ מרצפי תמונה כדי לקבוע את קצב הלב. אימות ניסיוני הוכיח את האמינות והעקביות של השיטה על פני תנאי בדיקה מרובים. יתרון מרכזי של המתודולוגיה הוא יכולתה לשמר את המצב הפיזיולוגי הטבעי של דג הזברה, ולמזער חפצים הנגרמים על ידי לחץ. טכניקה לא פולשנית ונטולת תוויות זו מציעה יתרונות משמעותיים לחקר פיזיולוגיה של הלב וכלי הדם, רעילות לב תרופתית וטוקסיקולוגיה סביבתית, ומרחיבה את היישומים הפוטנציאליים של דג הזברה כמודל למחקר ביו-רפואי.
Introduction
דג הזברה (Danio rerio), דג סיפריני קטן, הפך לאורגניזם מודל חיוני בשל גודלו הקטן, קצב הרבייה הגבוה וקלות המניפולציה הגנטיתשלו 1,2,3. הערכת קצב הלב בעוברי דג זברה שקופים משמשת יותר ויותר בפיזיולוגיה, אמבריולוגיה, טוקסיקולוגיה ותחומים אחרים 4,5,6,7,8. מצד אחד, תועלת זו נובעת מהעובדה שהגנום של דג הזברה כולל גנים הקשורים למחלות לב וכלי דם אנושיות9, ולב Danio rerio חולק מבנים ומסלולי איתות דומים עם בני אדם10,11. זה הופך את דג הזברה למודל שלא יסולא בפז לחקר התפתחות הלבומחלות 11,12,13. מצד שני, קצב הלב של דג הזברה רגיש להשפעות חיצוניות, מה שהופך אותו למודל מצוין למחקרים פיזיולוגיים וטוקסיקולוגיים על ידי השוואת תפקוד הלב בדגים מטופליםולא מטופלים 7,8,14.
התקדמות משמעותית נעשתה בפיתוח שיטות אופטיות לא פולשניות להערכת קצב הלב בעוברי דגים שקופים15,16. טכניקות אלו מציעות את היתרון של איסוף נתונים מהיר מגדלי מדגם גדולים. כתוצאה מכך, פותחו גישות אוטומטיות לחלוטין להערכת קצב הלב בעוברי דגים 4,5,6,17.
עם זאת, מגבלות מסוימות מגבילות כיום את השימוש בטכניקות אלה לתקופה של 3-4 dpf. המגבלה הראשונה היא אובדן שקיפות עקב פיגמנטציה של גוף הדג. השני הוא יכולת התנועה הגוברת של העוברים לאורך זמן. הארכת תקופת ההתפתחות המוקדמת של דג הזברה שבמהלכה ניתן להשתמש בגישות האופטיות תשפר את התועלת שלהן, ותאפשר עיצובים ניסויים ארוכי טווח לחקור קרדיומיופתיה, מומי לב מולדים והשפעות שונות על מערכת הלב וכלי הדם, כולל מעקב אחר הדינמיקה של ההשפעות לאורך זמן. הקבוצה שלנו התייחסה לאחרונה לנושא אובדן השקיפות על ידי שימוש בהדמיה בתחום האינפרא אדום הקצר של 900-1700 ננומטר18. מאמר זה מתמקד בהתייחסות לנושא ניידות העובר.
בדרך כלל, חומרי הרדמה כמו טריקאין מתאן סולפונאט (MS-222) משמשים לשיתוק עוברים וזחלים של דגים שוחים חופשיים לפני הדמיה 14,19,20. עם זאת, MS-222 מפחית משמעותית את קצב הלב21,22, וכך גם חומרי הרדמה אחרים23. זה הופך להיות מאתגר להבחין אם שינויים שנצפו בתפקוד הלב נובעים מטיפול ניסיוני, הרדמה או אינטראקציה בין השניים. דרך נוספת להאריך את תקופת הניידות הנמוכה של העובר היא על ידי הפחתת הטמפרטורה במהלך ההתפתחות המוקדמת8. עם זאת, גישה זו לא תמיד תואמת את מטרות המחקר ומאריכה את תקופת ההרשמה באופן מזערי בלבד.
במחקר זה, אנו מציגים שיטה חדשה לטיפול בניידות העובר במהלך רישום דופק. אימנו רשת עצבית קונבולוציונית לזהות את אזור העניין של הלב בהקלטות של עוברי דג זברה שוחים חופשי. השונות המחזורית בעוצמת הפיקסלים באזור זה מנוצלת כדי לגזור את הפוטו-פלתיסמוגרמה (PPG), המשמשת לאחר מכן לחישוב הדופק. אפליקציית שולחן העבודה שפותחה, AutoHR, השתמשה הן באימון רשת עצבית והן בעיבוד ערימת תמונות, מה שמבטיח קלות שימוש ושחזור פרוטוקולים.
Protocol
דגי הזברה גודלו וגודלו על פי פרוטוקולי ZFIN24 שנקבעו. כל ההליכים אושרו על ידי הוועדה הביו-אתית של המרכז המדעי והטכנולוגי למכשור ייחודי של האקדמיה הרוסית למדעים (STC UI RAS), פרוטוקול #3/24, מתאריך 21/08/2024, ועוקבים אחר הנחיות הטיפול בדגי הזברה של STC UI RAS. מדריכים לגרסאות בודדות זמינים לפי בקשה.
1. הכנת ציוד למדידה
- בחירת ציוד
- בחר מקור אור: בחר מקור אור LED הפולט בתחום האינפרא-אדום הקרוב, במיוחד מ-800 ננומטר, עם הספק מינימלי של 3 ואט. מחקר זה השתמש ב-LED עם אורך גל מרכזי של 940 ננומטר ורוחב פס של 40 ננומטר.
- בחירת מצלמת וידאו: בחר/י מצלמה המצוידת בחיישן רגיש לטווח אורכי הגל הנפלט ממקור האור ובעלת קצב פריימים של 60 פריימים לשנייה לפחות. עיין בגיליון הנתונים של המצלמה כדי לקבוע את גובה הפיקסלים p, את גודל החיישן לאורך הצד הקצר יותר h ואת קצב הפריימים. במחקר זה, למצלמה יש גובה פיקסלים של p = 5 מיקרומטר ורוחב חיישן h = 5.12 מ"מ.
- בחר גודל תבנית אגרוז הגדול לפחות פי 1.5 מאורך הזחל B. חשב את ההגדלות המינימליות והמקסימליות המותרות של המערכת האופטית באמצעות הביטויים שסופקו. ודא ש-Mמקסימום ≤ Mדקות. אם תנאי זה אינו מתקיים, בחר מצלמה עם h גדול יותר ו/או S קטן יותר ו/או קטן יותר.
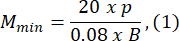
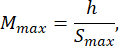
כאשר Smax הוא אורך תבנית האגרוז הגדולה ביותר של ערכת התבניות. ניתן להכין סט תבניות בגדלים שונים. במחקר זה השתמשו ב-S = 10 מ"מ.
הערה: המשוואות נגזרות על סמך גיאומטריית הסכימה האופטית ופרופורציות הגוף של דג הזברה. הסברים מפורטים ניתנים בסעיף הדיון. - בחר עדשה: מחקר זה השתמש במערכת אופטית עם הגדלות משתנות הנעות בין MOSmin = 0.4x ל - MOSmax = 1.5x, אורך מוקד מקסימלי של fmax = 150 מ"מ ומרחק עבודה של מ"מ.
הערה: הסמל x מציין את גורם ההגדלה של המערכת האופטית.- בחר מערכת מסוג מיקרוסקופ הגדלה משתנה עם טווח הגדלה (MOSmin - MOSmax) שנשאר בטווח המותר (Mmin - Mmax). עיין בגיליון הנתונים של העדשה כדי לקבוע את אורך המוקד המרבי fmax ואת מרחק העבודה המתאים L עבור MOSmax.
- ודא שהתנאי fמקסימום ≤ Mmax • L מתקיים. אם תנאי זה אינו מתקיים, בחר עדשה עם fmax ו/או L שונים. ודא שסוג התושבת של המצלמה והעדשה תואמים.
- בחר אובייקט בדיקה (סרגל או רשת) עם גובה ידוע ואורך כולל של לפחות . בחר אובייקט בדיקה בצורת סרגל או רשת עם גובה ידוע וגודל כולל של Sמקסימום לפחות.
- הרכבת מעמד לרכישת תמונות (איור 1).
- הרכיב את המוט העגול על בסיס יציב. הרכיב את מערכת ההדמיה על-ידי הצמדת העדשה למצלמה. התקן את תעלת ההדמיה על המוט כאשר חלון הקלט פונה כלפי מעלה.
- התקן את מנגנון המיקוד על המוט. חבר שלב עם משטח עבודה מזכוכית בקוטר מינימלי של 30 מ"מ למנגנון המיקוד.
- הרכיבו את התאורה: הנח LED על מצע מתכת כדי להבטיח פיזור חום יעיל. הנח עדשת קולימטור שטוחה קמורה בקוטר 23 מ"מ ואורך מוקד של 30 מ"מ במרחק של 30 מ"מ מה-LED.
- התקן את התאורה על ה-stagבאמצעות סוגר מתכוונן בעל שלושה צירים, ומקם אותו מעל משטח העבודה כשהעדשה פונה כלפי מטה.
- כוונן את התאורה ואת מערכת ההדמיה. מקם את התאורה בצורה קואקסיאלית עם מערכת ההדמיה. הפעל את התאורה וחבר את המצלמה למחשב.
- הפעל את יישום המצלמה והפעל תצוגה מקדימה מצב בהתאם להוראות במדריך המצלמה. הנח את אובייקט הבדיקה על הבמה. התאם את מרחק העבודה וההגדלה של המיקרוסקופ כדי להבטיח שהגודל מתאים לחלוטין לשדה הראייה.
הערה: הגודל צריך להתאים לחלוטין לאורך הצד הקצר של המסגרת כדי להבטיח הדמיה מלאה של תבנית האגרוז. - התאם את מיקום ה-stagביחס למערכת ההדמיה כדי להבטיח שהתמונה ממוקדת, ומיקום התאורה מואר באופן אחיד.
- הכנת תבנית אגרוז
- מערבבים 20 מ"ל מים מזוקקים עם 0.4 גרם אגרוז נמס נמוך ומחממים את התערובת עד שהאגרוז נמס לחלוטין. לדוגמא, במיקרוגל למשך 20 שניות בהספק של 700 וואט.
- מעצבים את תבנית האגרוז (שיטה 1): יוצקים את התמיסה המחוממת לתוך צלחת הפטרי, ומבטיחים גובה תמיסה של 1.5-2 מ"מ. מצננים את צלחת הפטרי עד שתמיסת האגרוז מתמצקת. בטמפרטורה של 17 מעלות צלזיוס, תהליך זה אורך כ -5 דקות. חותכים ריבוע באורך צדדי של שימוש בסכין נייר מכתבים ומסירים בזהירות את שכבת האגרוז בתוך האזור המתואר.
- מעצבים את תבנית האגרוז (שיטה 2): יוצרים (S) × (S) × 10 מ"מ, צורות מפלסטיק. מניחים את הטופס המודפס עם הצד המרובע בצלחת פטרי וממלאים אותו בתמיסה המחוממת, ומבטיחים גובה תמיסה של 1.5-2 מ"מ. מצננים את צלחת הפטרי עד שתמיסת האגרוז מתמצקת, ומסירים בזהירות את הטופס מהתמיסה המוצקה.
הערה: ניתן להדפיס טפסים בקלות באמצעות מדפסת תלת מימד.
2. רכישת תמונות
- התאם את הגדרות לכידת התמונה.
- חבר את המצלמה למחשב. הפעל את יישום המצלמה והפעל את מצב התצוגה המקדימה. הפעל את התאורה.
הערה: אם גודל תבנית האגרוז לשימוש שונה מזה שבשלב 1.3.3, חזור על שלב 1.3.3 והסר את אובייקט הבדיקה מהשלב שלאחר מכן. - מניחים את זחל דג הזברה בתבנית אגרוז על ידי פיפטה פסטר. מניחים תבנית אגרוז על הבמה. הבטח תאורה כמעט מלאה של ראש הזחל על ידי התאמת שילוב של זמן חשיפה ועוצמת תאורה (איור 2A-C). זמן החשיפה לא יעלה על 1.5 אלפיות השנייה.
הערה: במחקר זה, אנו מציגים נתונים עבור זחלי דג זברה מסוג בר בגילאי 12 עד 21 יום לאחר ההפריה (dpf).
- חבר את המצלמה למחשב. הפעל את יישום המצלמה והפעל את מצב התצוגה המקדימה. הפעל את התאורה.
- ביצוע רכישת תמונות
- הגדר את קצב הפריימים ל-60 פריימים לשנייה לפחות. קבעו את עומק הסיביות של התמונה ל- 12 סיביות. רכוש תמונות למשך 10 שניות לפחות. הגדר את תבנית מתן השמות למסגרת על yyyy_mm_dd_hh_ss_mm_mss, וסוג הקובץ חייב להיות PNG או TIFF, ולא BMP.
3. אימון הרשת הנוירונית לתיוג
- הכנת נתונים לתיוג
הערה: מתואר תהליך התיוג באפליקציית תווית התמונות, MATLAB.- אסוף לפחות 256 תמונות שנרכשו בספרייה נפרדת. הפעל את היישום. ייבא את התמונות על-ידי ניווט אל קובץ Import > From ובחירת כל התמונות מהספרייה שצוינה.
- צור מחלקות לתיוג רשת. בכרטיסיה תוויות החזר ROI, לחץ על תווית, הזן גוף בשדה שם תווית , בחר תווית פיקסל מהתפריט הנפתח עבור סוג התווית ולחץ על אישור. בכרטיסיה תוויות החזר ROI, לחץ על תווית, הזן עין בשדה שם תווית , בחר תווית פיקסל מהתפריט הנפתח עבור סוג התווית ולחץ על אישור. בכרטיסיה תוויות החזר ROI, לחץ על תווית, הזן דג בשדה שם תווית , בחר מלבן מהתפריט הנפתח עבור סוג התווית ולחץ על אישור.
- תיוג המסגרות
- בכרטיסייה תוויות החזר ROI, בחר את מחלקת הביאור שנוצרה קודם לכן, עין. מתאר עין אחת של הדגימה על ידי הצבת נקודות לאורך ההיקף שלה באמצעות כפתור העכבר השמאלי. כדי להשלים את ביאור העין, לחצו על נקודת ההתחלה של קווי המתאר (איור 3B).
- תאר עין נוספת של הדגימה באותו אופן כמתואר בשלב 3.1.2.
- בכרטיסייה תוויות החזר ROI, בחר את מחלקת ההערות שנוצרה, גוף. מתאר את גוף הדגימה, למעט העיניים, על ידי הצבת נקודות לאורך ההיקף שלה באמצעות לחצן העכבר השמאלי. להשלמת ביאור העין, לחץ על נקודת ההתחלה של המתאר.
- בכרטיסייה תוויות ROI, בחר את מחלקת הביאור שנוצרה קודם לכן, דג. מתאר את כל גוף הדגימה על ידי ציור תיבה תוחמת מלבנית (איור 4). לשם כך, לחץ על פינה אחת של המלבן המיועד עם לחצן העכבר השמאלי, ולאחר מכן גרור את הסמן תוך כדי לחיצה ממושכת על הכפתור עד שהמלבן סוגר את הדג במלואו.
- שמור את קווי המתאר בספרייה חדשה בשם תמונות על-ידי לחיצה על Export > To File בכרטיסייה LABEL.
- הכנת מערכי נתונים לאימון רשתות עצביות
- הפעל את MATLAB. פתח את קובץ ה- Script DatasetsPreparation.m (קובץ משלים 1) על-ידי בחירה באפשרות פתח > פתח.
- הפעל את קובץ ה- Script על-ידי לחיצה על הפעל. בחלון המוקפץ, בחר את הספרייה המכילה את התמונות המתוארות, את התיקייה PixelLabelData ואת הקובץ gTruth.mat, שיוצא בשלב 3.2.5.
הערה: עם השלמת ביצוע קובץ ה- Script, שתי תיקיות - RPN Training ו- CNN Training - ייווצרו באופן אוטומטי. הם נדרשים לאימון רשת עצבית לאחר מכן. אל תשנה את התוכן של תיקיות אלה.
4. אימון הרשתות העצביות לגילוי לב
הערה: שלב זה מבוצע פעם אחת עבור גיל ומצב הדמיה ספציפיים. NVIDIA GPU מומלץ בחום לאימון מכיוון שהוא מאיץ משמעותית את העיבוד.
- הפעל את היישום AutoHR. נווט אל הכרטיסיה הדרכת רשת הצעות אזור. לחץ על בחר ספרייה ובחר את תיקיית הדרכה RPN שנוצרה בשלב 3.3.2. לחץ על התחל הדרכה.
הערה: עם השלמת ההדרכה, קובץ מודל בשם rpn_model.pt ייווצר באותה ספריה כמו קובץ AutoHR.exe. קובץ זה נדרש להמשך עיבוד אוסף התמונות. - כדי לאמן את הרשת העצבית הקונבולוציונית, נווט אל הכרטיסייה אימון רשת עצבית קונבולוציונית. לחץ על בחר ספרייה ובחר את תיקיית ההדרכה של CNN שנוצרה בשלב 3.3.2. לחץ על התחל הדרכה.
הערה: עם השלמת ההדרכה, קובץ מודל בשם model.pt ייווצר באותה ספריה כמו קובץ AutoHR.exe. קובץ זה נדרש להמשך עיבוד אוסף התמונות.
5. כימות דופק
- הקלט רצף של תמונות כמתואר בשלב 2. ודא שתנאי ההדמיה, כגון הגדלה, זמן חשיפה ותאורה, זהים לאלה המשמשים לאימון הרשת העצבית.
- הפעל את היישום AutoHR. נווט אל הכרטיסיה עיבוד. בחר את הספרייה המכילה מודלים מאומנים של רשת עצבית על-ידי לחיצה על בחר מודלים. לחץ על בחר תיקייה כדי לייבא תמונות שנרכשו לניתוח. נתיב הייצוא יצוין אוטומטית, אך ניתן לשנות אותו בלחיצה על 'בחר נתיב ייצוא'. לחץ על תהליך כדי להתחיל בניתוח.
הערה: בסיום, ערך הדופק יופיע בשדה דופק בממשק AutoHR. התיקייה המיוצאת תכלול את ערכי הדופק (.xlsx), PPG (.xlsx), המסגרת הראשונה ברצף ומסכות הגוף והעיניים עבור המסגרת הראשונה (.png).
6. אימות תוצאות האלגוריתם
- בצע בדיקה עם דג ללא תנועה כמתואר להלן.
- להרדים את הזחלים עם תמיסת MS-222 של 0.168 מ"ג/ליטר למשך דקה אחת. רכוש ערימת תמונות של דגימה מורדמת כמתואר בשלב 2. בצע ספירת דופק באמצעות תצפית חזותית.
- השתמש בתוכנת משאבי אנוש כמתואר בשלב 5. חזור על השלבים עבור מספר דגימות. בדוק אם ערכי הדופק המתקבלים עקביים עבור כל האנשים ברמת הדיוק הרצויה.
- בצע את הבדיקה עם אדם נייד ומבחן פרובוקציה כמתואר להלן.
- רכוש ערימת תמונות של דגימה שאינה מורדמת כמתואר בשלב 2. ערכו בדיקת פרובוקציה עם האדם שעבורו נרשם הרצף, באמצעות גירוי ידוע המשפיע על קצב הלב. המחקר מציג תוצאות של המלחת מים לריכוזים של 5 מ"ג/ליטר.
- רכוש ערימת תמונות מאותה דגימה כמתואר בשלב 2 לאחר מבחן הפרובוקציה. קבע את הדופק בשני הניסויים עם תוכנת HR כמתואר בשלב 5. בדוק אם השינויים שנצפו בקצב הלב תואמים את ההשפעות הידועות של בדיקת הפרובוקציה.
תוצאות
קצב הלב של דג הזברה ב-12 dpf נקבע באמצעות הפרוטוקול שתואר לעיל (סרטון משלים 1). הסרטונים כוללים רצף של תמונות של זחלי דג זברה שוחים חופשי, פוטופלתיסמוגרמה הנגזרת מרצפים אלה באמצעות הפרוטוקול המוצע, וקצב הלב המתאים המחושב מהפוטופלתיסמוגרמה.
הנתונים המסומנים חולקו באופן אקראי לערכות אימון, בדיקה ואימות ביחס של 3:2:1 במהלך האימון. פונקציית ההפסד יושמה לאחר מכן על פי הביטוי הבא:

כאשר x הוא לוגיט קלט, y הוא יעד, גודל אצווה הוא מספר התמונות המעובדות בו זמנית,

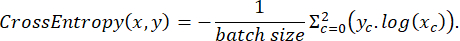
כדי להעריך את ביצועי המודל במהלך האימון, נעשה שימוש בפונקציית דיוק החיזוי, המוגדרת על ידי הדברים הבאים:


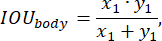
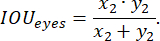
יישמנו גישות סטנדרטיות לפיתוח פונקציית ההפסד, כמפורט, למשל,ב-25. רשת הקשב הרב-קנה מידה עם ארכיטקטורת מודל EfficientNet-B0 שימשה כמקודד ושכבת פלט softmax. הרשת העצבית אומנה על מדגם מבחן במשך 50 תקופות, תוך שימוש בקצב למידה דועך באופן אקספוננציאלי שהתחיל ב-0.02 והיה לו מקדם דעיכה של 0.99.
הרשת העצבית המאומנת שימשה להשגת מסכת הגוף ומסכת העיניים (איור 5С) של הפרט בכל מסגרת של רצף שרירותי. לאחר מכן חושב מרכז המסה של מסכת העיניים, והשלד הוחל על מסכת הגוף (איור 5D). על אקורד הדג שנוצר P, זוהתה הנקודה M, הממוקמת הכי קרוב למרכז המסה של מסיכת העיניים (איור 5F). במרחק d מנקודה M, השווה למרחק בין העיניים, זוהתה נקודה N לאורך האקורד PPP לכיוון הזנב. נקודה זו תואמת את מרכז אזור הלב. אזור זה תחום על ידי מעגל ברדיוס של r = d x 0.3, שמרכזו בנקודה זו (איור 5F).
אות ה-PPG הגולמי חושב כמספר הממוצע של פיקסלים בתוך אזור הלב בכל הפריימים המוקלטים (איור 5G). האות הגולמי הזה נורמל לאחר מכן לערכו הממוצע. לאחר מכן, האות סונן באמצעות מסנן Chebyshev Type II מסדר שני עם תכןמסדר 4, הנחתת פס-עצירה של 25 dB ותדר קצה פס-עצירה של 12 הרץ, התואם את אלגוריתמי העיבוד הסטנדרטיים 26,27 (איור 6A). הדופק נקבע על ידי זיהוי התדר בתחום של 1-4 הרץ המתאים לשיא ההספק במודול הריבועי של התמרת פורייה של האות המסונן (איור 6A).
משוואה (1) מבטיחה שתמונת הלב תהיה בגודל של כ- 20 פיקסלים x 20 פיקסלים. ההנחה היא שממד האורך של הלב מהווה כ-8% מאורך הגוף הכולל של דג הזברה. כאשר תמונת הלב קטנה יותר, האות המתקבל מכיל לרוב רכיב רעש משמעותי העולה על האות השימושי, מה שהופך אותו לבלתי מתאים לחישוב דופק, כפי שמוצג באיור 6B.
תוצאות יישום הפרוטוקול תלויות באופן משמעותי ביציבות פילוח הלב עבור כל אדם. חיוני לערוך ניסויי בקרה כדי להוכיח ששלבים 2-5 הושלמו בהצלחה, והנתונים שהתקבלו משקפים תהליכים פיזיולוגיים אמיתיים ולא תוצאות אקראיות. אימות הפרוטוקול בוצע בהתאם לנוהל המפורט בשלב 6. בבדיקה המתוארת בשלב 6.2 הוסיפו מלח למים בריכוז של 5 מ"ג/ליטר כגירוי פרובוקטיבי. חמישה זחלי דג זברה (12 pdf) נכללו בכל בדיקה. טמפרטורת המים בתבנית אגרוז נשמרה על 23-25 מעלות צלזיוס. התוצאות מצביעות על כך שההבדל בין הערכה חזותית לשיטה המוצעת לא עלה על 3% במבחן הראשון. בבדיקה השנייה קצב הלב שנמדד בשיטה עלה, כצפוי (איור 7).

איור 1: זרימת עבודה סכמטית. (A) סכימה ו-(B) המראה של המערך הניסיוני אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: תמונות של זחלי דג הזברה. דוגמאות לתמונות זחל דג הזברה באיכות גבוהה ובאיכות נמוכה (B-D) הן (B) מסגרת לא חשופה, (С) מסגרת עם חשיפת יתר ו-(D) מסגרת מטושטשת. התמונות נחתכו כדי להדגיש את הזחל. סרגל קנה המידה הוא 1 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: תמונות מייצגות. דוגמאות לתמונות (A) ראשיות ו-(B) עם תוויות. סרגל קנה המידה הוא 1 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
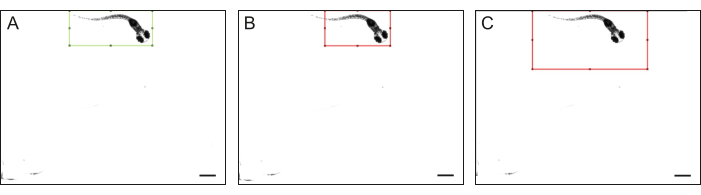
איור 4: קווי מתאר של גוף דג הזברה. דוגמאות לקווי מתאר איכותיים ו-(B-C) באיכות נמוכה של כל גוף דג הזברה: דג זברה אינו מתאים לחלוטין למלבן, וגודל המלבן גדול באופן ניכר מדג הזברה. סרגל קנה המידה הוא 1 מ"מ. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: צינור עיבוד תמונה הממחיש את שלבי העיבוד העיקריים ואת תוצאות הביניים המתאימות להם. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 6: מסגרות המציגות את קצב הלב של הזחל. דוגמאות ל-(A) מסגרות באיכות גבוהה ו-(B) באיכות נמוכה עם אזור לב הזחל בקוטר של 20 פיקסלים ו-14 פיקסלים, בהתאמה, וספקטרום PPG ופורייה תואם של PPG. סרגל קנה המידה הוא 1 מ"מ. קיצורים: PPG = פוטופלתיסמוגרפיה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
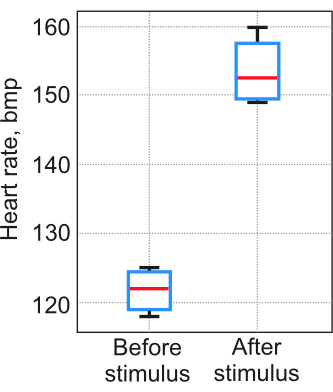
איור 7: מדידות דופק. המדידות התקבלו בשיטה המוצעת בבדיקה עם גירוי פרובוקציה. מספר מדגם . הקופסה משתרעת על פניהאחוזונים ה-25 וה-75, הקו האופקי הוא החציון, השפם השחור מציין את נקודות הנתונים הקיצוניות ביותר שאינן נחשבות חריגות אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
סרטון משלים 1: איור של אלגוריתם הרשת העצבית המוצע לזיהוי וחישוב דופק. הסרטון מציג זחלי דג זברה הנעים בחופשיות, פוטופלתיסמוגרמה הנגזרת על ידי הפרוטוקול המוצע ומחושבת מקצב הלב של זחלי הפוטופלתיסמוגרמה אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 1: פונקציית MATLAB המבצעת הגדלת תמונה. אנא לחץ כאן להורדת קובץ זה.
Discussion
במחקר הזה אנו מציגים פרוטוקול ניסיוני למדידת פעימות הלב של זחלי דג זברה ששוחים חופשית. הערכנו גישה זו באמצעות מספר ניסויים, והדגמנו את יעילותה. מרכיבי המפתח של השיטה המוצעת כוללים פתרונות חומרה ותוכנה כאחד. ראשית, השתמשנו בתאורת אינפרא אדום להדמיה, אשר, כפי שהודגם קודם לכן, נמנעת מבעיות הקשורות לפיגמנטציה ומשפרת את שקיפות הרקמות, ומאפשרת קביעת דופק מדויקת18. שנית, אנו מציעים לדמות את הדגים מלמטה. כאשר הם מורדמים, זחלי דג הזברה שוכבים בדרך כלל על צידם בשל מיקום שלפוחית השחייה, וכתוצאה מכך הפרש הכיוון בין תצורות מיקרוסקופ סטנדרטיות והפוכות הוא זניח. עם זאת, מכיוון שליבו של דג שוחה ממוקם תמיד בגחון, מיקום תעלת ההדמיה למטה ותעלת התאורה למעלה משפר את יחס האות לרעש. לבסוף, שיפרנו משמעותית את ביצועי העיבוד על ידי שימוש ברשת עצבית כדי לאתר את הדגימה בתוך התמונה ולזהות איברים בודדים. באמצעות ידע קודם ונתונים אמפיריים, פיתחנו שיטות לאתר את הלב בגוף הזחל של דג הזברה כפי שזוהה על ידי הרשת העצבית.
יתרונות נוספים של הגישה כוללים שימוש במקור אור LED, שבניגוד למנורות הלוגן, אינו מייצר חום. קיבוע תעלת התאורה על הבמה מאפשר יישור ביחס לגודל התבנית פעם אחת, ומבטל את הצורך בהתאמות אור נוספות בעת מיקוד מחדש. ניתן ליישם את האלגוריתם גם כדי ליצור מערכי נתונים גדולים לאימון הבא של רשת עצבית לפילוח לב. זה מאיץ את עיבוד הנתונים וממזער שגיאות בקביעת מיקום הלב. תיוג ישיר של הלב על תמונות מהווה אתגר משמעותי בשל גודלו הקטן והקושי לקבוע במדויק את גבולותיו ומיקומו בתוך מסגרת אחת.
יש להתייחס למספר גורמים קריטיים כדי להשיג תוצאות מיטביות בעת יישום פרוטוקול זה. ראשית, זמן החשיפה לא יעלה על 1.5 אלפיות השנייה, מכיוון שזמני חשיפה ארוכים יותר עלולים להוביל לטשטוש תמונה, במיוחד במהלך תנועות מהירות של אנשים. טשטוש כזה יעכב חישוב פוטו-פלתיסמוגרמה מדויק בנקודות זמן ספציפיות (איור 6B). שנית, כוחות מתח פנים יגרמו למשטח המים בקובט להתעקם, מה שיוביל לפיזור אור ועיוות בתמונות המתקבלות במהלך צילום וידאו. כדי להפחית השפעה זו, יש למרוח שכבה דקה ואחידה של מים על פני האגרוז כדי להבטיח מפלס מים שטוח ועקבי על פני צלחת הפטרי. מכיוון שאגרוז סופג מים בהדרגה, אנו ממליצים להוסיף מים בערך כל 10 דקות כדי לשמור על רמה יציבה. לבסוף, יש להתאים את בחירת הגדלת העדשה לשלב הפיתוח ולדרישות הספציפיות של הניסוי. הגדלה קבועה בטווח מתאים מספיקה למדידות עקביות באותה קבוצת גיל ובתנאים אחידים. עם זאת, עדשת הגדלה משתנה מתאימה יותר למחקרים הכוללים שלבי התפתחות או משימות שונות.
אם הבדיקה מגלה שהאלגוריתם נכשל, יש לבחון מחדש את שלבים 2 ו-3 וליישם אותם מחדש. שלב 3 מציב לעתים קרובות אתגרים, במיוחד במהלך תיוג תמונה. הקפד על הערות זהירות של העיניים והגוף, הימנע מכל חפיפה בין שתי המחלקות הללו. השתמש בתמונות הלוכדות את האדם בתנוחות שונות, במיוחד אלה המציגות כיפוף גוף בולט, כדי לשפר את דיוק התיוג. יש לחזור על שלב 2 במקרים שבהם מזוהים בעיות בעוצמת התאורה, זמן החשיפה או ההגדלה. הגדרות שגויות יכולות להפחית את יחס האות לרעש, ולאפשר לרעש להציף את האות (איור 6B). בנוסף, כשל באלגוריתם עלול להיווצר אם מתקבלים נתוני אימון וניסוי בהגדרות שונות.
מערך החומרה המוצע משתמש במצלמת אינפרא אדום עם טווח רגישות של 900-1700 ננומטר. עם זאת, מצלמות ברזולוציה גבוהה הפועלות בטווח ספקטרלי זה הן לרוב חסכוניות. כדי להתמודד עם מגבלה זו, ניתן להשתמש במצלמות וידאו תעשייתיות בספקטרום נראה עם רגישות חיישן המשתרעת לטווח האינפרא אדום הקרוב לאחר הסרת מסנני האינפרא אדום שלהן כחלופה חסכונית למצלמות אינפרא אדום. בנוסף לשימוש בקרינת אינפרא אדום, ניתן למזער את השפעות הפיגמנטציה גם על ידי מריחת כימיקלים להסרת פיגמנטים או על ידי שימוש בדגים מקווים גנטיים ספציפיים חסרי פיגמנטציה28,29. גרסת התוכנה הנוכחית מיועדת אך ורק למדידת דופק. עם זאת, פרמטרים אחרים של גלי דופק חיוניים באותה מידה למחקר מקיף. שדרוגי תוכנה עתידיים יתמקדו בשילוב ניתוח שונות קצב הלב, אינדיקטור מרכזי למחלות שונות. מדידות מפורטות יותר, כגון מרווח Q-T, הן נושא לחקירה נוספת. כדי לפתח מודל רשת עצבית אוניברסלי המסוגל לפעול עם נתונים מגילאים שונים ותנאי רכישת תמונות, מערך נתוני האימון צריך לכלול דגימות מגוונות עם לפחות 128 תמונות מתויגות מכל סוג.
מספר גישות פותחו בעבר לזיהוי אוטומטי של אזור הלב וניטור דופק בדג זברה 4,6 ובעוברי מדקה 6,17. תיוג פלואורסצנטי של הלב בדגי זברה הוצע לקביעת אזור הלב30. עם זאת, כל השיטות שפורסמו בעבר מוגבלות לעבודה עם עוברים שקופים וחסרי תנועה במהלך התקופה הקצרה שלאחר ההפריה לפני תחילת תנועתיות העוברים. זוהי מגבלה משמעותית המפחיתה את הישימות של טכניקות אלה. נושא נוסף המתואר בספרות ובחומרים משלימים קשור לתנועה פתאומית של עוברים במהלך רישום דופק 6,17. תנועה כזו יכולה לעקור את אזור הלב הממוקד על ידי התוכנה לחישוב דופק. הגישה המתוארת במחקר זה מתייחסת לחסרונות אלה, ומאפשרת ניטור של דגי זברה ניידים עד 30 dpf.
היתרונות של גישה זו מרחיבים משמעותית את אפשרויות היישום הפוטנציאלי שלה. בשנים האחרונות, Danio rerio הפך למודל נפוץ לחקר פתולוגיות לב וכלי דם ורעילות לב 11,12,31. היכולת של שיטה זו לרשום דופק באופן לא פולשני בשלבי התפתחות מוקדמים שונים ללא חומרי הרדמה מציעה הזדמנויות חדשות לחקר הדינמיקה של מומים לבביים מושרים והשפעות טיפוליות. כיום, ניטור דופק בעוברי דג זברה משמש לבדיקת תרופות במחקרים פרה-קליניים 32. היתרונות המתוארים של השיטה המוצעת מספקים כלים נוספים להערכת השפעות מושהות ופרמקודינמיקה של תרופות. לבסוף, השימוש בקצב הלב של דג הזברה עולה ללא הרף בניטור אקוטוקסיקולוגי33,34. בתחום זה, הגישה המוצעת מאפשרת להעריך את ההשפעות הרעילות הכרוניות של מזהמים בריכוזים נמוכים לאורך תקופות חשיפה ממושכות ואת ההשפעות הקשורות להצטברות ביולוגית.
Disclosures
כל המחברים חשפו כל ניגוד אינטרסים.
Acknowledgements
מחקר זה נתמך על ידי תוכנית המשימות של המדינה הפדרלית של STC UI RAS (FFNS-2025-0008). עבודה זו בוצעה באמצעות הציוד של המרכז לשימוש קולקטיבי ב-STC UI RAS [http:// https://ckp.ntcup.ru/en/].
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Low melting agarose | Biozym | 850111 | |
| Table salt | Pegasus | N/A | |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma-Aldrich | E10505 | MS-222 |
| Equipment | |||
| Base with rod | Altami | SM-U1 | |
| Collimator lens | JLLSCMGGX | Focal length 30 mm | |
| Focusing mechanism | Altami | SM-12 | D=76 mm |
| LED | Cree | TR-3535IR-3W | |
| Lens | SFK Security | C-Mount, F1.6, 1/3”, | |
| Near infrared camera | ToupTek | SWIR1300KMA | |
| Pasteur pipette | PE-LD | 149293 | |
| Petri Dish 35 x 15 mm | BD Falcon | 351008 | |
| Plastic forms | N/A | N/A | Made by 3D printing |
| Power supply | Unit-T | UTP3300TFL-II | |
| Stage | N/A | N/A | Made by 3D printing |
| Stationery knife | ErichKrause | 19145 | |
| Test object | Wally Sky | MS-1-EB | |
| Software | |||
| EfficientDet | N/A | N/A | https://github.com/rwightman/efficientdet-pytorch |
| EfficientNet-b0 model | N/A | N/A | https://arxiv.org/abs/1905.11946 |
| Google API Client | N/A | Google API Client is a Python client library for Google's discovery-based APIs. https://github.com/googleapis/google-api-python-client | |
| Hardware | |||
| Multi-scale attention network | N/A | N/A | https://arxiv.org/abs/2209.14145 |
| NVIDIA DIGITS | NVIDIA | N/A | NVIDIA DIGITS is a wrapper for Caffe that provides a graphical web interface. https://developer.nvidia.com/digits |
| NVIDIA GPU | NVIDIA | N/A | An NVIDIA GPU is needed as some of the software frameworks below will not work otherwise. https://www.nvidia.com |
| OpenCV | Intel | N/A | OpenCV is a library for computer vision. https://opencv.org |
| Python | Python Software Foundation | N/A | Python is a programming language. https://www.python.org |
References
- Fontana, B. D., Mezzomo, N. J., Kalueff, A. V., Rosemberg, D. B. The developing utility of zebrafish models of neurological and neuropsychiatric disorders: A critical review. Exp Neurol. 299 (Pt A), 157-171 (2018).
- Chen, X., Li, Y., Yao, T., Jia, R. Benefits of zebrafish xenograft models in cancer research. Front Cell Dev Biol. 9, 616551 (2021).
- Lai, K. P., Gong, Z., Tse, W. K. F. Zebrafish as the toxicant screening model: Transgenic and omics approaches. Aquat Toxicol. 234, 105813 (2021).
- Pylatiuk, C., et al. Automatic zebrafish heartbeat detection and analysis for zebrafish embryos. Zebrafish. 11 (4), 379-383 (2014).
- Krishna, S., Chatti, K., Galigekere, R. R. Automatic and robust estimation of heart rate in zebrafish larvae. IEEE Trans Auto Sci Eng. 15 (3), 1041-1052 (2018).
- Gierten, J., et al. Automated high-throughput heartbeat quantification in medaka and zebrafish embryos under physiological conditions. Sci Rep. 10 (1), 2046 (2020).
- Meng, H., Liang, J., Zheng, X., Zhang, K., Zhao, Y. Using a high-throughput zebrafish embryo screening approach to support environmental hazard ranking for cardiovascular agents. Sci Total Environ. 702, 134703 (2020).
- Krylov, V., et al. Influence of hypomagnetic field on the heartbeat in zebrafish embryos. Front Physiol. 13, 1040083 (2022).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Staudt, D., Stainier, D. Uncovering the molecular and cellular mechanisms of heart development using the zebrafish. Ann Rev Gene. 46, 397-418 (2012).
- Bowley, G., et al. Zebrafish as a tractable model of human cardiovascular disease. Br J Pharmacol. 179 (5), 900-917 (2022).
- Brown, D. R., Samsa, L. A., Qian, L., Liu, J. Advances in the study of heart development and disease using zebrafish. J Cardiovas Dev Dis. 3 (2), 13 (2016).
- Dhillon, S. S., et al. Optimisation of embryonic and larval ECG measurement in Zebrafish for quantifying the effect of QT prolonging drugs. PLoS One. 8 (4), e60552 (2013).
- Bedrossiantz, J., et al. Heart rate and behavioral responses in three phylogenetically distant aquatic model organisms exposed to environmental concentrations of carbaryl and fenitrothion. Sci Total Environ. 865, 161268 (2023).
- Santoso, F., et al. An overview of methods for cardiac rhythm detection in zebrafish. Biomedicines. 8 (9), 329 (2020).
- Ling, D., Chen, H., Chan, G., Lee, S. M. Y. Quantitative measurements of zebrafish heartrate and heart rate variability: A survey between 1990-2020. Comp Biol Med. 142, 105045 (2022).
- Ferreira, M. S., et al. FEHAT: Efficient, large scale and automated heartbeat detection in medaka fish embryos. Bioinformatics. 40 (12), btae664 (2024).
- Volkov, M., et al. Optical transparency and label-free vessel imaging of zebrafish larvae in shortwave infrared range as a tool for prolonged studying of cardiovascular system development. Sci Rep. 12 (1), 20884 (2022).
- Machikhin, A., et al. Microscopic photoplethysmography-based evaluation of cardiotoxicity in whitefish larvae induced by acute exposure to cadmium and phenol. J Biophoton. 17 (9), e202400111 (2024).
- Machikhin, A. S., Burlakov, A. B., Volkov, M. V., Khokhlov, D. D. Imaging photoplethysmography and videocapillaroscopy enable noninvasive study of zebrafish cardiovascular system functioning. J Biophoton. 13 (7), e202000061 (2020).
- Denvir, M. A., Tucker, C. S., Mullins, J. J. Systolic and diastolic ventricular function in zebrafish embryos: Influence of norepenephrine, MS-222 and temperature. BMC Biotechnol. 8 (1), 1-8 (2008).
- Santoso, F., et al. Development of a simple ImageJ-based method for dynamic blood flow tracking in zebrafish embryos and its application in drug toxicity evaluation. Inventions. 4 (4), 65 (2019).
- Vieira, R. S. F., Sousa, D., Félix, L. M., Venâncio, C. A. S. Anaesthetic profile of thymol and menthol in zebrafish larvae model. Aquaculture and Fisheries. , (2024).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2000).
- Azad, R., et al. Loss functions in the era of semantic segmentation: A survey and outlook. ArXiv. , (2023).
- Machikhin, A. S., et al. Combined optical and acoustic microscopy for non-invasive cardiovascular studies using zebrafish model. IEEE Trans Instrument Measurement. 74, 1-13 (2025).
- Slavin, A. E., Guryleva, A. V., Bukova, V. I., Shuman, L. A., Burlakov, A. B. Wavelet analysis of Photoplethysmogram in zebrafish larvaе cardiovascular system Study. , 1-5 (2024).
- Kumari, S., Singh, D. Phenylthiourea-mediated experimental depigmentation reduces seizurogenic response of pentylenetetrazol in zebrafish larva. J Pharm Toxicol Methods. 128, 107532 (2024).
- Xu, Y., et al. Highly sensitive response to the toxicity of environmental chemicals in transparent casper zebrafish. Sci Total Environ. 948, 174865 (2024).
- Vedder, V. L., et al. pyHeart4Fish: Chamber-specific heart phenotype quantification of zebrafish in high-content screens. Front Cell Dev Biol. 11, 1143852 (2023).
- Lane, S., More, L. A., Asnani, A. Zebrafish models of cancer therapy-induced cardiovascular toxicity. J Cardiovas Dev Dis. (2), 8 (2021).
- Maciag, M., Wnorowski, A., Mierzejewska, M., Plazinska, A. Pharmacological assessment of zebrafish-based cardiotoxicity models. Biomed pharmacother. 148, 112695 (2022).
- Krylov, V. V., et al. Non-invasive recording of heartbeats in Danio rerio and Daphnia magna to assess the toxicity of imidacloprid and glyphosate. Comp Biochem Physiol C Toxicol Pharmacol. 288, 110075 (2025).
- Meng, H., Liang, J., Zheng, X., Zhang, K., Zhao, Y. Using a high-throughput zebrafish embryo screening approach to support environmental hazard ranking for cardiovascular agents. Sci Total Environ. 702, 134703 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved