Method Article
Стандартизированный стент-перитонит толстой кишки у крыс - простая, но осуществимая животная модель для индуцирования септического острого повреждения почек
В этой статье
Резюме
Острое повреждение почек (ОПП) является тяжелым осложнением у пациентов в критическом состоянии и связано с повышенной смертностью. В данной работе мы представляем надежную и воспроизводимую in vivo модель для имитации ОПП в воспалительных условиях, которая может способствовать пониманию патогенеза септического ОПП.
Аннотация
ОПП у пациентов с сепсисом связано с повышенной смертностью и плохим исходом, несмотря на значительные усилия по уточнению понимания его патофизиологии. Здесь представлена модель in vivo , которая сочетает в себе стандартизированный септический очаг для индукции ОПП и установку интенсивной терапии (ОИТ) для обеспечения расширенного гемодинамического мониторинга и терапии, сравнимой с сепсисом человека. Сепсис вызывается стандартизированным стент-перитонитом восходящей толстой кишки (sCASP). ОПП исследуется функционально путем измерения образцов крови и мочи, а также гистологически путем оценки гистопатологических показателей. Кроме того, усовершенствованный гемодинамический мониторинг и возможность повторного отбора проб газов крови позволяют проводить дифференцированный анализ тяжести индуцированного сепсиса.
Метод sCASP является стандартизированным, надежным и воспроизводимым методом индуцирования септического ОПП. Преимуществами этой установки являются интенсивная терапия, непрерывный мониторинг гемодинамики и газообмена, низкий уровень смертности, а также возможность детального анализа функции почек и нарушений. Таким образом, описанный метод может служить новым стандартом для экспериментальных исследований септического ОПП.
Введение
Сепсис по-прежнему остается основной причиной смерти в отделениях интенсивной терапии (ОИТ), не относящихся к кардиологии, со смертностью ≈ 30 - 50%1,2,3. Отличительной чертой тяжелого сепсиса и септического шока является острое повреждение почек, которое вызывает дальнейшее увеличение смертности, когда оно связано с дисфункцией отдаленных органов, такой как сердечная и дыхательная недостаточность 4,5,6. Общая частота ОПП у пациентов ОРИТ варьирует от 20 до 50%7. Несмотря на ключевую роль ОПП в отношении исхода и смертности при сепсисе, лежащий в его основе патомеханизм до сих пор плохо изучен.
В целом, существует 3 основных компонента: воспаление, токсическое повреждение и гемодинамические изменения, которыеспособствуют развитию ОПП. Гемодинамические изменения включают снижение почечного кровотока (RBF) и глобальную или регионарную ишемию почек. При этом следует учитывать, что сепсис также может вызывать нарушение почечной микроциркуляции из-за системной гипотензии и/или нарушения эндотелиального барьера8. Поэтому исследование септического ОПП всегда должно включать в себя мониторинг гемодинамики. В недавних исследованиях in vivo об ОПП использовались в основном животные модели, такие как ишемия-реперфузионное повреждение почек или двусторонняя нефрэктомия. Эти исследования обычно показывали отсутствие гемодинамического мониторинга и интенсивной терапии.
Исследование потенциальных новых патомеханизмов и методов лечения септического ОПП требует модели in vivo с определенным септическим очагом, организацией интенсивной терапии, предсказуемым исходом и повреждением органов 9,10,11,12. Здесь мы опишем инновационную модель грызуна для септического ОПП, которая соответствует требованиям, упомянутым ранее. Септическое ОПП индуцируется стандартизированным стент-перитонитом восходящей толстой кишки (sCASP). Используемая модель sCASP вызывает абдоминальный сепсис за счет утечки кала из кишечника, что приводит к бактериальной инвазии и полиорганной недостаточности13. Было показано, что патофизиологические изменения после CASP аналогичны таковым при сепсисе человека, и, таким образом, CASP представляет собой клинически значимую модель в исследованиях сепсиса11,14.
Кроме того, в экспериментальном протоколе предусмотрена система интенсивной терапии (ОИТ), которая включает в себя расширенный гемодинамический мониторинг и терапию ОИТ. Система интенсивной терапии позволяет проводить реанимацию жидкости, внутривенное введение анальгезии и повторный анализ газов крови. Функция почек оценивается путем измерения стандартных значений, таких как креатинин, и клиренса инулина и-аминогиппуриновой кислоты (ПАУ). Дополнительная информация предоставляется патогистологическими показателями собранных тканей и органов в конце эксперимента. Модель sCASP для индуцирования септического ОПП уже оценена и позволила получить новые сведения о почечной патологии15. Дальнейшее применение данного протокола, представленного ниже, может помочь уточнить понимание септического ОПП.
протокол
Все процедуры на животных были одобрены Комитетом по уходу за лабораторными животными и их использованию округа Унтерфранкен, Германия, и проводились в соответствии с Хельсинкской декларацией.
1. Хирургическая подготовка и установка инвазивного мониторинга и непрерывного приема лекарств
- Обезболите крыс Спрэг-Доули с помощью изофлурана, доставляемого прецизионным испарителем в концентрации и скорости потока, утвержденных органом по надзору за исследованиями на животных и/или ветеринарной командой местного учреждения. Подтвердите достаточную глубину анестезии, наблюдая за частотой дыхания, которая становится медленнее и глубже, и убедитесь в отсутствии реакции после защемления хвоста/пальца ноги. Побрейте горло и живот бритвой.
Заметка: Массивное снижение частоты дыхания может быть индикатором передозировки анестезии и привести к брадипно, гипотензии и в конечном итоге к смерти. - Положите крысу в лежачем положении на грелку. Наносите ветеринарную мазь на глаза, чтобы избежать пересыхания глаз. Поддерживайте надлежащую глубину анестезии с использованием концентрации изофлурана и скорости потока на основе интраоперационного мониторинга крыс и/или рекомендаций органа по надзору за исследованиями на животных и/или ветеринарной бригады местного учреждения. Поместите крысу в лежачем положении на автоматизированную грелку.
Примечание: Гипотермия и термическая травма влияют на макро- и микрогемодинамические показатели, и их следует избегать для получения надежного результата. Рекомендуется использовать грелку с механизмом управления, которая связана с крысой через гибкий ректальный зонд для поддержания температуры тела в физиологическом диапазоне. - После дезинфекции шеи и горла соответствующим дезинфицирующим раствором надрезайте скальпелем кожу на горле медиально и сделайте надрез около 2 см. Переверните крысу и выполните разрез около 1 см хирургическими ножницами на шее примерно в 1 см дистальнее затылка.
- Верните крысу обратно в лежачее положение. Аккуратно рассеките правую яремную вену и левую сонную артерию ножницами и ватными палочками. Отделите сосуды от соседних конструкций. Избегайте слишком большого сопротивления и готовьтесь дальше, осторожно распределяя движения.
Заметка: Поддерживайте сосуды всегда влажными с помощью предварительно подогретого стерильного физиологического раствора. - Аккуратно и раскидистыми движениями подкожно рассекайте от сосудов к шее, чтобы получить соединение между двумя разрезами. Вставьте хомуты в каждый сформированный тоннель.
- Промойте вертлюг и катетеры, поступающие из вертлюжного устройства, 0,9% NaCl. Вставьте катетеры в пружину из нержавеющей стали.
Заметка: Перед введением катетеры должны быть промыты хлоридом натрия, так как минимальное применение воздуха может привести к внезапной смерти из-за воздушной эмболии. - Переверните крысу и зажмите катетеры с помощью вставленных зажимов. Сдвиньте катетеры с горловины на горло. Зафиксируйте пружину пластиковым кнопочным ремнем примерно на 1 см дистальнее затылка 6 одиночными швами (например, 4/0) на шее.
- Снова поставьте крысу в положение лежа на спине. Проложите хлопчатобумажные нити примерно на 4 см дистальнее и проксимальнее каждого подготовленного сосуда. Клипируйте артерию проксимальнее с помощью микроклипса, обычно используемого для клипирования субарахноидальных аневризм. В качестве альтернативы можно оставить зажим и остановить артериальный кровоток, затянув одну из нитей.
- Надрежьте артерию хирургическими микроножницами, держите разрез открытым с помощью крючка в одной руке и введите артериальный катетер в сосуд с помощью щипцов другой рукой. Откройте зажим или натянутую нить, протолкните катетер примерно на 1 см вперед в сосуд по направлению к сердцу и зафиксируйте его хирургическими узлами с помощью проложенных хлопчатобумажных нитей.
- Повторите шаг 1.8 на яремной вене и оставьте зажим, так как вена не такая твердая, как артерия.
- Зафиксировав оба катетера по прямой линии в сосудах, закройте рану на горле швами.
2. Процедура sCASP
- Держите крысу в лежачем положении, побрейте живот и продезинфицируйте брюшную область соответствующими дезинфицирующими растворами.
Заметка: Всегда используйте асептическую технику. - Хирургическими ножницами выполните разрез кожи по средней линии живота длиной около 2 см, а затем снова по белой линии, чтобы открыть брюшинную каверну.
- Определите полюс слепой кишки и аккуратно вытяните слепую кишку с помощью ватных палочек.
- Проколите восходящую ободочную кишку примерно на 2 см дистальнее илеоцекального клапана швом (6/0) [шов 1] на противобрыжеечной стороне и зафиксируйте его двумя хирургическими узлами. Избегайте поражения любых сосудов толстой кишки.
- Отрежьте дистальный конец - около 1,5 см - отсасывающего катетера 10 FR. Отрежьте этот кусочек катетера ножницами так, чтобы получился прямоугольный лоскут длиной около 0,5 см. Подготовьте лоскут с помощью шва (6/0) [шов 2] в середине лоскута.
- Наденьте лоскут на иглу 14G и проколите восходящую ободочную кишку иглой, где был зафиксирован шов15.
- Вставьте подготовленную пластиковую трубку в толстую кишку над иглой. Одновременно аккуратно извлеките иглу. Расположите трубку таким образом, чтобы лоскут находился снаружи толстой кишки, а остальная часть трубки — внутри толстой кишки.
- После точного позиционирования пластиковой трубки зафиксируйте лоскут уже имеющимся швом 2 путем сшивания стенки толстой кишки и хирургических узлов. Избегайте повторного поражения сосудов толстой кишки. Наложите свободные концы шовной нити 1 вокруг остальной части пластиковой трубки, которая выходит из толстой кишки, и выполните 2 хирургических узла.
- Молочный стул из слепой кишки по направлению к стенту толстой кишки с помощью ватных палочек до тех пор, пока стул не появится на выходе из стента.
- Поместите тонкую кишку и толстую кишку обратно в брюшную каверну. При этом пластиковая трубка со стулом должна соприкасаться с брюшиной. Промойте стент 2 мл 0,9% NaCl, чтобы распределить кал в брюшинной каверне.
- Закройте брюшную каверну непрерывным швом (4/0) брюшины, а затем непрерывным швом (4/0) кожи.
3. Послеоперационная процедура
- Прекратите вдыхание изофлурана и посадите крысу обратно в клетку.
- Начните внутривенное обезболивание через венозную капельницу с использованием фентанила (2,0 мкг/100 г массы тела/час).
4. Подготовка мерок на второй день
- Через 24 ч после процедуры sCASP введите 0,5-1,0 мг мидазолама внутривенно. Поддерживайте надлежащую глубину анестезии с использованием концентрации изофлурана и скорости потока на основе интраоперационного мониторинга крыс и/или рекомендаций органа по надзору за исследованиями на животных и/или ветеринарной бригады местного учреждения.
- Снова продезинфицировав спиртом и раствором, выполните трахеотомию пластиковой трубкой венозной канюли 14 G для обеспечения достаточного насыщения кислородом и вентиляции.
- Поэтому раскройте шов на горле хирургическими ножницами и аккуратно раскройте от средней линии к трахее. Надрежьте трахею вертикально между двумя хрящами длиной около 2 мм хирургическими ножницами – как раз достаточно ввести хирургические ножницы. Ширьте разрез тупо примерно до половины диаметра трахеи с помощью ножниц. Вставьте 1 см пластиковой трубки 14 г и зафиксируйте ее 2 швами. 16
Заметка: Если разрез трахеи превышает половину окружности, сосуды, идущие вдоль трахеи, могут быть повреждены, что приведет к сильному кровотечению, аспирации крови или летальной брадикардии. - Начать искусственную вентиляцию легких с помощью аппарата искусственной вентиляции легких для грызунов с FiO2 0,28 и 0,7 об.% изофлурана и начать внутривенную анестезию мидазоламом (0,7 мг/100 г массы тела/ч) и фентанилом (7 мкг/100 г массы тела/ч). Проведите анализ газов крови, чтобы обеспечить достаточную вентиляцию и насыщение кислородом. Поэтому извлеките около 0,7 мл крови через артериальный катетер и измерьте его с помощью анализатора газов крови.
Заметка: Внутривенная анестезия должна начинаться только в том случае, если установлена искусственно контролируемая вентиляция.
- Поэтому раскройте шов на горле хирургическими ножницами и аккуратно раскройте от средней линии к трахее. Надрежьте трахею вертикально между двумя хрящами длиной около 2 мм хирургическими ножницами – как раз достаточно ввести хирургические ножницы. Ширьте разрез тупо примерно до половины диаметра трахеи с помощью ножниц. Вставьте 1 см пластиковой трубки 14 г и зафиксируйте ее 2 швами. 16
- После бритья и дезинфекции таким же образом, как и при 2,1, выполняют продольный разрез кожи правой ноги на 1 см проксимальнее колена на 0,5 см. Рассеките артерию от соседних структур с помощью хирургических ножниц и ватных палочек тупым ходом.
Заметка: Если бедренная артерия разорвана, введение катетера в проксимальном положении все еще возможно. Таким образом, рекомендуется начинать имплантацию как можно дальше дистальнее. - Введите катетер термодилюции в бедренную артерию, открыв артерию крючком и вставив катетер с помощью щипцов.
- Начните измерять сердечный выброс методом термодилюции. Поэтому быстро введите 1 мл охлажденного NaCl вручную через венозный катетер после начала измерения с помощью программного обеспечения для измерения сердечного индекса. Выполните это измерение дважды.
5. Оценка функции почек
- Выполните лапаротомию, открыв ножницами швы кожи и брюшины. Надрезать мочевой пузырь хирургическими ножницами достаточно ровно настолько, чтобы катетеризировать его с помощью небольшого пластикового катетера. Проложив вокруг мочевого пузыря хлопчатобумажную нить длиной около 7 см, закрепите нить, зафиксируйте катетер узлами, и в конце соберите через катетер как можно больше мочи.
- Растворите флуоресцеин-изотиоцианат-инулин (FITC-инулин) в 0,9% NaCl и натриевую соль (ПАУ)-аминогиппуровой кислоты в 0,9% NaCl до получения концентраций 2 мг/мл инулина, 5 мг/мл ПАУ.
- Применяют болюс смеси обоих веществ по 75 мкл внутривенно с последующей постоянной внутривенной инфузией обоих веществ со скоростью 3,7 мкл/ч/300 г массы тела.
- После достижения устойчивого состояния17 с вливанием ФИТК-инулина и ПАУ собирают мочу в течение 20 мин. Возьмите образцы крови через артериальный катетер, как описано в пункте 4.2.1 в отношении проведения анализа газов крови.
- Определить концентрацию инулина в моче и плазме с помощью флуоресцентной спектрометрии и измерить ПАУ с помощью фотоспектрометрии с использованием метода антрона17.
6. Окончание экспериментов
- Усыпьте животное в соответствии с местными правовыми нормами.
- Извлеките как можно больше крови через артериальный катетер с помощью шприцев.
- Соберите тонкую и толстую кишку, разрезав перитонеальную фиксацию двенадцатиперстной кишки и толстой кишки, удалите некоторые их части с помощью хирургических ножниц. Подготовьте и соберите почки, подготовив забрюшинное пространство, освободите их от жировой капсулы и разрежьте мочеточник и прилегающие сосуды. Проведите торакотомию и вырежьте легкие и сердце. Зафиксировать все органы в формальдегиде и выполнить гистологические окрашивания, как было опубликовано ранее. 15,18
Результаты
Как ранее было опубликовано Schick et al.8, мы демонстрируем следующие результаты.
Индукция сепсиса без смертности
В модели CASP сепсис индуцируется непрерывной утечкой внутрипросветных бактерий толстой кишки в брюшную полость, что приводит к фекальному перитониту и бактериемии. Таким образом, размер имплантированного катетера регулирует выход кала и, следовательно, тяжесть перитонита и сепсиса. В представленном выше экспериментальном протоколе игла 14G в сочетании с наконечником специально подготовленного аспираторного катетера 10 FR использовалась для лечения достаточного перитонита. Катетеры меньшего размера вызывали только абсцессы с местным воспалением, поскольку семенные пузырьки в основном окклюзировали меньшие стенты и препятствовали непрерывному фекальному выходу.
Контрольные животные и животные, получавшие sCASP, выжили в эксперименте, но в группе sCASP для поддержания среднего артериального давления (MAP) ≥ 70 мм рт. У животных, получавших sCASP, наблюдался повсеместный фекальный перитонит без образования абсцессов и клинические признаки тяжелого сепсиса, проявляющиеся в снижении активности, снижении бдительности, взъерошенной шерсти и сгорбленной осанке. Этот клинический статус постоянно ухудшался с течением времени.
У реанимированных жидкостью крыс sCASP наблюдались значимые различия в MAP и частоте сердечных сокращений, но не было различий в сердечном выбросе по сравнению с контрольными животными (рис. 1). Анализы крови через 24 часа выявили признаки сепсиса у животных, получавших sCASP, с повышенным уровнем лактата, повышенным IL-6 и типичной для этих животных лейкопенией по сравнению с контролем (рис. 1).
Определение ОПП, индуцированного сепсисом
Клиренс инулина, описанный как золотой стандарт для оценки функции почек, был значительно снижен у животных с sCASP по сравнению с контролем через 24 часа (рис. 2 A). Кроме того, диурез (Рисунок 1) и клиренс ЛАГ были значительно снижены у животных с sCASP (Рисунок 2 B). NGAL (рисунок 2 C) и цистатин C (рисунок 2 D) были повышены при сепсисе по сравнению с контрольной группой. Стандартные параметры ОПП, такие как мочевина и креатинин, подтвердили нарушение функции почек в группе sCASP повышенными уровнями обоих параметров, измеренными в сыворотке крови (рис. 2, E и F).
Острое повреждение почек в группе sCASP определялось не только функциональными параметрами, но и повышенным баллом гистопатологического повреждения (рис. 3). Эта оценка основана на морфологических изменениях, включая образование отека, клеточный отек, отслоение канальцевого эпителия от базальной мембраны, потерю щеточной границы проксимальных трубчатых клеток, гибель клеток и вакуолизацию. В группе sCASP через 24 часа после индукции сепсиса наблюдалась повышенная гистопатологическая оценка почек, при этом интерстициальный отек и нарушение щеточной границы канальцев были ведущими факторами для получения более высокого балла по сравнению с контрольными животными (рис. 3). Кроме того, у животных с sCASP значительно увеличивалась частота гибели клеток и случаи отслоения базальной мембраны (рис. 3).
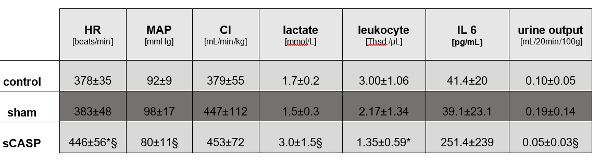
Рисунок 1: Макрогемодинамика и параметры сепсиса. Наличие сепсиса у животных, оперированных sCASP, подтверждают следующие показатели: частота сердечных сокращений (ЧСС), среднее артериальное давление (MAP), сердечный индекс (CI), лактат, лейкоциты, интерлейкин 6 (IL 6) и диурез. * p<0.05 против контроля, § p<0.05 против фиктивного. Данные уже опубликованы в ICMex Шиком и др.15 Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
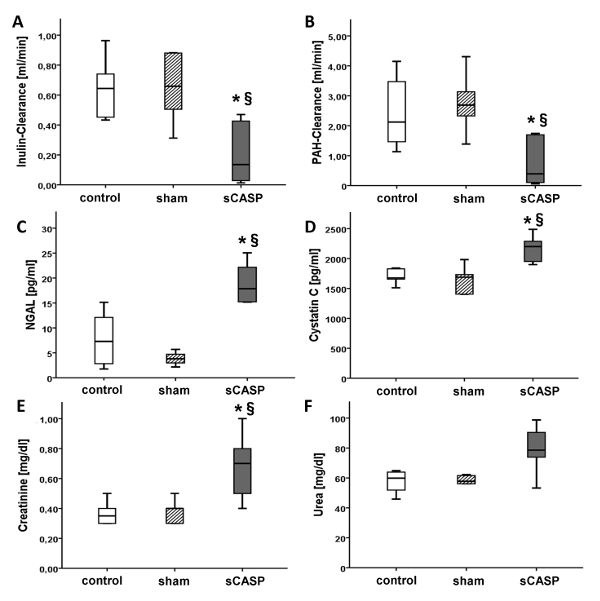
Рисунок 2: Параметры функции почек. Показатели инулин- (А) и ПАГ-клиренс (В) [мл/мин], описанные как золотой стандарт для измерения функции почек, были значительно снижены в группе sCASP. Напротив, NGAL (C) и цистатин C (D) [pg/mL] были повышены как еще один признак септического ОПП. Клинические стандартные параметры, такие как креатинин (Е) и мочевина (F) [мг/дл], также показали повышенные уровни у септических животных. * p< 0,05 против контроля, § p<0,05 против фиктивного. Данные уже опубликованы в ICMex Шиком и др.15 Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Оценка гистологических повреждений. Показаны различия между контролем, симуляцией и sCASP в отношении интерстициального отека, потери щеточной границы проксимальных канальцевых клеток, гибели клеток и общей оценки травмы. Столбцы показывают среднее ± стандартное отклонение. * p< 0,05 против контроля, § p<0,05 против фиктивного. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Патофизиология септического ОПП до сих пор остается неизвестной по своей сложности. Клинические исследования и испытания на пациентах не позволят получить новое представление об изменениях гистопатологии, нарушениях микроциркуляции или лекарственных взаимодействиях на клеточных уровнях15. Ранее было высказано предположение, что существует потребность в улучшенных и новых животных моделях для изучения острого повреждения почек, связанного с сепсисом19. Таким образом, мы создали новую животную модель септического ОПП, индуцированного стент-перитонитом стента толстой кишки.
Модель CASP представляет собой клинически релевантную модель для имитации сепсиса у людей, начавшегося с фекального перитонита, наблюдаемого у хирургических пациентов. Основным преимуществом CASP является то, что он не начинается с ишемического удара, как в широко используемой модели CLP, где выполняется лигирование слепой кишки14. Кроме того, Maier et al. показывают, что модель CLP представляет собой ситуацию внутрибрюшного абсцесса, а не повсеместно распространенный перитонит с системной бактериемией. Использование стента различных размеров, имплантированного в восходящую толстую кишку, может повлиять на тяжесть сепсиса и выживаемость, как показано в предыдущих публикациях 13,14,20. Чтобы избежать окклюзии стента сальником или семенными пузырьками, вводили модифицированный стент диаметром 10 FR15. В описанной выше животной модели для исключения вариаций гормонов использовались только самцы крыс, а не самки животных, как в оригинальной модели CASP от Zantl et al. и Traeger et al.13,21.
Следует учитывать, что даже после проведения эксперимента, представленного выше в стандартизированном виде, может возникнуть вариабельность в зависимости от различных линий мышей, животного помещения, пола и оператора. Поэтому может потребоваться корректировка размера стента и, следовательно, тяжести перитонита и сепсиса. Кроме того, рекомендуется, чтобы один и тот же оператор выполнял и sCASP, и управление в один и тот же день, чтобы уменьшить вариабельность.
Острое повреждение почек может возникнуть из-за гипоксии и ишемии, вызванных гипотензией или дыхательной недостаточностью со снижением PaO2 при сепсисе22. Изменения гемодинамических и метаболических состояний привели к гипоксии тканей, которая влияет на целостность почек и может влиять на заболеваемость и смертность23. Таким образом, непрерывная оценка гемодинамических и респираторных показателей должна быть доступна в модели in vivo, которая используется для исследования септического ОПП. Здесь мы представили модель in vivo, которая характеризуется конфигурацией отделения интенсивной терапии, сравнимой с пациентами 24,25,26. Он позволяет непрерывно измерять гемодинамические показатели, такие как частота сердечных сокращений и артериальное давление, а также оценивать состояние дыхания путем взятия крови на анализ газов крови. Кроме того, эти данные, полученные в результате непрерывного мониторинга, необходимы и полезны для реанимации жидкости и адаптации протокола анестезии.
Оценка функции почек путем измерения клиренса инулина и ЛАГ возможна только в конце эксперимента, так как необходима повторная лапаротомия и разрез мочевого пузыря. Если во время эксперимента требуется исследование функции почек, могут быть взяты образцы крови для измерения стандартных параметров, таких как креатинин и мочевина. При этом следует учитывать, что следует проводить замену жидкости, чтобы избежать преренальной недостаточности из-за гиповолемии.
Целью данной модели было создание стабильной установки септического ОПП у грызунов с клинической значимостью, что позволило бы проводить дальнейшие исследования в области патофизиологии и лечения почечной недостаточности. Эта модель также может быть использована для исследования различных стратегий терапии абдоминального сепсиса и септического ОПП. Таким образом, данная модель может служить устойчивой установкой септического ОПП у грызунов, находящейся в непосредственной близости от клинических условий отделения интенсивной терапии. Кроме того, описанная модель может быть модифицирована и успешно использована для широкого спектра исследований сепсиса in vivo , например, иммунной дисрегуляции, разрушения эндотелия, коагулопатии, нарушения микроциркуляции, фармакотерапии и реанимации25.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
М.А. Шик и Н. Шлегель получили финансирование от Deutsche Forschungsgemeinschaft (DFG) SCHL 1962/2-1 и SCHL 1962/4-1.
Материалы
| Name | Company | Catalog Number | Comments |
| Sprague-Dawley rats | Janvier Labs, France | ||
| Isoflurane CP | cp-pharma, Burgdorf, Germany | ||
| polyethylen catheter PE 10; 30m | A. Hartenstein, Wuerzburg, Germany | 0.58x0.96 mm | |
| Swivel (375/D/20) | Instech, Plymouth Meeting, PA, USA | (375/D/20) | |
| plastic button tethers | Instech, Plymouth Meeting, PA, USA | LW105S | |
| Perfusor | B. Braun; Melsungen, Germany | Perfusor fm | |
| suction catheter ch. 10 | B.Braun Melsungen AG, Germany | suction catheter typy „Ideal“; ch. 10 | |
| suture | Syneture; USA | Surgipro; Monofilament Polypropylen 4-0 | |
| suture | Ethicon; Scotland | Prolene; Polypropylen 5-0 | |
| 14G-i.v. catheter | BD Insynte; BD Vialon; Madrid; Spain | 14GA i.v. catheter | |
| cotton buds | NOBA Verbandmittel Danz GmbH u Co KG; Wetter; Germany | ||
| rodent respirator | Hugo Sachs Elektronik KG, Germany | rodent respirator, Type:7025 | |
| Midazolam | Ratiopharm, Germany | Midazolam | |
| Thermodilutioncatheter | ADInstruments, Spechbach, Germany | ||
| p-Aminohippuric acid | Sigma-Aldrich; St. Louis; USA | p-Aminohippuric acid sodium salt; A3759-25G | |
| Inulin | Sigma-Aldrich; St. Louis; USA | Inulin-FITC; F3272-1G | |
| Formaldehyde | Otto Fischar GmbH & CoKG; Saarbrücken, Germany | Formaldehyde 3.5% | |
| Cyclopentan | Merck; Darmstadt; Germany | Uvasol: 2-Methylbutan | |
| alcohol based scrub | Schülke & Mayr GmbH, Norderstedt; Germany | kodan Tinktur forte; 45g 2-Propanol, 10g 1-Propanol per 100g | |
| povidone iodine solution | B.Braun Melsungen AG, Germany | Braunol, 7.5g Povidone Iodine per 100g |
Ссылки
- Angus, D. C., et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med. 29, 1303-1310 (2001).
- Dellinger, R. P., et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 41, 580-637 (2013).
- Moerer, O., Quintel, M. [Sepsis in adult patients - definitions, epidemiology and economic aspects]. Internist (Berl). 50, 788-796 (2009).
- Belayev, L. Y., Palevsky, P. M. The link between acute kidney injury and chronic kidney disease. Curr Opin Nephrol Hypertens. 23, 149-154 (2014).
- Chao, C. T., et al. The impact of dialysis-requiring acute kidney injury on long-term prognosis of patients requiring prolonged mechanical ventilation: nationwide population-based study. PLoS One. 7, e50675(2012).
- Chertow, G. M., Christiansen, C. L., Cleary, P. D., Munro, C., Lazarus, J. M. Prognostic stratification in critically ill patients with acute renal failure requiring dialysis. Arch Intern Med. 155, 1505-1511 (1995).
- Doi, K. Role of kidney injury in sepsis. J Intensive Care. 4, 17(2016).
- Gomez, H., et al. A unified theory of sepsis-induced acute kidney injury: inflammation, microcirculatory dysfunction, bioenergetics, and the tubular cell adaptation to injury. Shock. 41, 3-11 (2014).
- Deitch, E. A. Animal models of sepsis and shock: a review and lessons learned. Shock. 9, 1-11 (1998).
- Esmon, C. T. Why do animal models (sometimes) fail to mimic human sepsis? Crit Care Med. 32, S219-S222 (2004).
- Rittirsch, D., Hoesel, L. M., Ward, P. A. The disconnect between animal models of sepsis and human sepsis. J Leukoc Biol. 81, 137-143 (2007).
- Doi, K., Leelahavanichkul, A., Yuen, P. S., Star, R. A. Animal models of sepsis and sepsis-induced kidney injury. J Clin Invest. 119, 2868-2878 (2009).
- Zantl, N., et al. Essential role of gamma interferon in survival of colon ascendens stent peritonitis, a novel murine model of abdominal sepsis. Infect Immun. 66, 2300-2309 (1998).
- Maier, S., et al. Cecal ligation and puncture versus colon ascendens stent peritonitis: two distinct animal models for polymicrobial sepsis. Shock. 21, 505-511 (2004).
- Schick, M. A., et al. Sepsis-induced acute kidney injury by standardized colon ascendens stent peritonitis in rats - a simple, reproducible animal model. Intensive Care Med Exp. 2, (2014).
- Schick, M. A., et al. Effects of crystalloids and colloids on liver and intestine microcirculation and function in cecal ligation and puncture induced septic rodents. BMC Gastroenterol. 12, 179(2012).
- Schneider, R., et al. Downregulation of organic anion transporters OAT1 and OAT3 correlates with impaired secretion of para-aminohippurate after ischemic acute renal failure in rats. Am J Physiol Renal Physiol. 292, F1599-F1605 (2007).
- Schick, M. A., et al. The impact of crystalloid and colloid infusion on the kidney in rodent sepsis. Intensive Care Med. 36, 541-548 (2010).
- Bellomo, R., Ronco, C., Kellum, J. A., Mehta, R. L., Palevsky, P. Acute renal failure - definition, outcome measures, animal models, fluid therapy and information technology needs the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care. 8, R204-R212 (2004).
- Lustig, M. K., et al. Colon ascendens stent peritonitis--a model of sepsis adopted to the rat: physiological, microcirculatory and laboratory changes. Shock. 28, 59-64 (2007).
- Traeger, T., et al. Colon ascendens stent peritonitis (CASP)--a standardized model for polymicrobial abdominal sepsis. J Vis Exp : JoVE. , (2010).
- Dyson, A., Rudiger, A., Singer, M. Temporal changes in tissue cardiorespiratory function during faecal peritonitis. Intensive Care Med. 37, 1192-1200 (2011).
- Arakelyan, K., et al. Early effects of an x-ray contrast medium on renal T(2) */T(2) MRI as compared to short-term hyperoxia, hypoxia and aortic occlusion in rats. Acta physiol. 208 (2), 202-213 (2013).
- Schick, M. A., et al. Balanced hydroxyethylstarch (HES 130/0.4) impairs kidney function in-vivo without Inflammation. PLoS One. 10 (9), e0137247(2015).
- Flemming, S., et al. Phosphodiesterase 4 inhibition dose dependently stabilizes microvascular barrier functions and microcirculation in a rodent model of polymicrobial sepsis. Shock. 41, 537-545 (2014).
- Flemming, S., et al. Sphingosine-1-phosphate receptor-1 agonist sew2871 causes severe cardiac side effects and does not improve microvascular barrier breakdown in sepsis. Shock. 49 (1), 71-81 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены