Method Article
Peritonitis estandarizada por stent de colon ascendente en ratas: un modelo animal simple y factible para inducir lesión renal aguda séptica
En este artículo
Resumen
La lesión renal aguda (IRA) es una complicación grave en el paciente crítico y se relaciona con un aumento de la mortalidad. Aquí, presentamos un modelo in vivo confiable y reproducible para imitar la LRA en condiciones inflamatorias que podría contribuir a la comprensión de la patogénesis de la LRA séptica.
Resumen
La LRA en pacientes sépticos se asocia con un aumento de la mortalidad y un mal pronóstico, a pesar de los grandes esfuerzos para refinar la comprensión de su fisiopatología. Aquí, se presenta un modelo in vivo que combina un foco séptico estandarizado para inducir LRA y una configuración de cuidados intensivos (UCI) para proporcionar un monitoreo hemodinámico avanzado y una terapia comparable en la sepsis humana. La sepsis es inducida por la peritonitis estandarizada del stent del colon ascendente (sCASP). La LRA se investiga funcionalmente mediante la medición de muestras de sangre y orina, así como histológicamente mediante la evaluación de las puntuaciones histopatológicas. Además, la monitorización hemodinámica avanzada y la posibilidad de tomar muestras repetitivas de gases en sangre permiten un análisis diferenciado de la gravedad de la sepsis inducida.
El método sCASP es un método estandarizado, fiable y reproducible para inducir LRA séptica. La configuración de cuidados intensivos, la monitorización hemodinámica y de intercambio gaseoso continua, la baja tasa de mortalidad, así como la posibilidad de realizar análisis detallados de la función renal y las deficiencias son ventajas de esta configuración. Por lo tanto, el método descrito puede servir como un nuevo estándar para las investigaciones experimentales de la LRA séptica.
Introducción
La sepsis sigue siendo la principal causa de muerte en las unidades de cuidados intensivos (UCI) no cardíacas, con tasas de mortalidad del 30 al 50% ≈1,2,3. Una característica distintiva de la sepsis grave y el shock séptico es la lesión renal aguda que provoca un aumento adicional de la tasa de mortalidad cuando se asocia a disfunción orgánica a distancia, como insuficiencia cardíaca y respiratoria 4,5,6. La incidencia global de LRA en pacientes de UCI varía del 20 al 50%7. A pesar del papel fundamental de la LRA en relación con el resultado y la mortalidad en la sepsis, el mecanismo patológico subyacente aún no se conoce bien.
En general, existen los 3 componentes principales: inflamación, lesión tóxica y cambios hemodinámicos que contribuyen al desarrollo de LRA7. Los cambios hemodinámicos incluyen reducción del flujo sanguíneo renal (FSR) e isquemia renal global o regional. En este caso, hay que tener en cuenta que la sepsis también puede causar un deterioro de la microcirculación renal debido a la hipotensión sistémica y/o a la ruptura de la barrera endotelial8. Por lo tanto, el estudio de la LRA séptica debe incluir siempre la monitorización hemodinámica. Los estudios in vivo recientes sobre LRA utilizaron mayoritariamente modelos animales, como la lesión por isquemia-reperfusión renal o la nefrectomía bilateral. Estos estudios generalmente mostraron una falta de monitoreo hemodinámico y cuidados intensivos.
La investigación de posibles nuevos mecanismos patológicos y terapias de la LRA séptica requiere un modelo in vivo con un foco séptico definido, una configuración de cuidados intensivos, un resultado predecible y una lesión orgánica 9,10,11,12. Aquí, describimos un modelo innovador de roedores para LRA séptica que cumple con los requisitos mencionados anteriormente. La LRA séptica es inducida por la peritonitis estandarizada del stent del colon ascendente (sCASP). El modelo sCASP utilizado provoca una sepsis abdominal por una fuga fecal intestinal que conduce a la invasión bacteriana y al fallo multiorgánico13. Se ha demostrado que los cambios fisiopatológicos después de la CASP son similares a los de la sepsis humana y, por lo tanto, la CASP representa un modelo clínicamente relevante en la investigación de la sepsis11,14.
Además, en el protocolo experimental se establece una configuración de cuidados intensivos (UCI) que comprende una monitorización hemodinámica avanzada y terapia de UCI. La configuración de la UCI permite la reanimación con líquidos, la aplicación de analgesia por vía intravenosa y el análisis repetitivo de gases en sangre. La función renal se evalúa mediante la medición de valores estándar como la creatinina y el aclaramiento de inulina y ácido p-aminohipúrico (HAP). Al final del experimento, las puntuaciones patológicas de los tejidos y órganos extraídos proporcionan información adicional. El modelo sCASP para inducir LRA séptica ya está evaluado y reveló nuevos conocimientos en patología renal15. La aplicación adicional de este protocolo que se presenta a continuación podría ayudar a refinar la comprensión de la LRA séptica.
Protocolo
Todos los procedimientos con animales fueron aprobados por el Comité de Cuidado y Uso de Animales de Laboratorio del Distrito de Unterfranken, Alemania, y se llevaron a cabo de acuerdo con la Declaración de Helsinki.
1. Preparación quirúrgica e instalación de monitorización invasiva y medicación continuada
- Anestesiar ratas Sprague-Dawley usando isoflurano administrado por un vaporizador de precisión a una concentración y caudal aprobados por el organismo de supervisión de investigación animal de la institución local y/o el equipo veterinario. Confirme la profundidad adecuada de la anestesia observando la frecuencia respiratoria, que se vuelve más lenta y profunda, y verifique la falta de respuesta después del pinzamiento de la cola o los dedos del pie. Afeita la garganta y el estómago con una navaja.
Nota: La reducción masiva de la frecuencia respiratoria puede ser un indicador de una sobredosis de anestesia y provocar bradipno, hipotensión y, finalmente, la muerte. - Coloque a la rata en posición supina sobre una almohadilla térmica. Aplica ungüento veterinario en los ojos para evitar que se sequen. Mantener la profundidad anestésica adecuada utilizando la concentración y el caudal de isoflurano basándose en el monitoreo intraoperatorio de la rata y/o las recomendaciones del organismo de supervisión de la investigación con animales y/o el equipo veterinario de la institución local. Coloque a la rata en posición supina sobre una almohadilla térmica automática.
Nota: La hipotermia y la lesión térmica influyen en los parámetros macro y microhemodinámicos y deben evitarse para obtener un resultado fiable. Se recomienda utilizar una almohadilla térmica con mecanismo de control que esté conectada a la rata a través de una sonda rectal flexible para mantener la temperatura corporal en el rango fisiológico. - Después de la desinfección del cuello y la garganta con la solución desinfectante adecuada, incidir la piel de la garganta medial con un bisturí y hacer una incisión de unos 2 cm. Girar la rata y realizar una incisión de aproximadamente 1 cm con tijeras quirúrgicas en el cuello aproximadamente 1 cm distal del occipucio.
- Vuelve a colocar a la rata en posición supina. Diseccionar suavemente la vena yugular derecha y la arteria carótida izquierda con las tijeras y bastoncillos de algodón. Disecciona las vasijas de las estructuras vecinas. Evite arrastrar demasiado y prepárese más con movimientos de separación cuidadosos.
Nota: Mantenga los recipientes siempre húmedos mediante la aplicación de solución salina estéril precalentada. - Diseccionar suavemente y con movimientos extendidos por vía subcutánea desde los vasos hasta el cuello para conseguir una conexión entre las dos incisiones. Inserte abrazaderas en cada túnel formado.
- Enjuague el eslabón giratorio y los catéteres, provenientes del dispositivo giratorio con NaCl al 0,9%. Inserte los catéteres en un resorte de acero inoxidable.
Nota: Los catéteres deben lavarse con cloruro de sodio antes de insertarlos, ya que la aplicación mínima de aire puede provocar la muerte súbita debido a la embolia gaseosa. - Gire la rata y sujete los catéteres con las pinzas insertadas. Deslice los catéteres desde el cuello hasta la garganta. Fije el resorte con una correa de botón de plástico a aproximadamente 1 cm distal del occipucio con 6 suturas singulares (por ejemplo, 4/0) en el cuello.
- Vuelva a colocar la rata en posición supina. Coloque hilos de algodón de unos 4 cm distal y proximal a cada vaso preparado. Cortar la arteria proximal con un microclip, que generalmente se usa para recortar aneurismas subaracnoideos. Alternativamente, deje el clip y detenga el flujo sanguíneo arterial apretando uno de los hilos.
- Incidir la arteria con unas microtijeras quirúrgicas, mantener la incisión abierta con un gancho en una mano e insertar el catéter arterial en el vaso utilizando fórceps con la otra mano. Abra el clip o el hilo estirado, empuje el catéter aproximadamente 1 cm hacia adelante en el vaso hacia el corazón y fíjelo con nudos quirúrgicos usando los hilos de algodón colocados.
- Repita el paso 1.8 en la vena yugular y deje el clip, ya que la vena no es tan sólida como la arteria.
- Una vez fijados ambos catéteres en línea recta en los vasos, cierre la herida en la garganta con suturas.
2. Procedimiento sCASP
- Mantenga a la rata en posición supina, afeitar el abdomen y desinfectar la región abdominal con las soluciones desinfectantes adecuadas.
Nota: Utilice siempre la técnica aséptica. - Realizar una incisión de la línea media abdominal de la piel de unos 2 cm de longitud con unas tijeras quirúrgicas y posteriormente de nuevo a lo largo de la línea alba para abrir la caverna peritoneal.
- Identifique el polo cecal y extraiga el ciego suavemente con bastoncillos de algodón.
- Perforar el colon ascendente alrededor de 2 cm distal de la válvula ileocecal, con una sutura (6/0) [sutura 1] en el lado antimesentérico y fijarlo con dos nudos quirúrgicos. Evite las lesiones de los vasos del colon.
- Corte el extremo distal, aproximadamente 1,5 cm, de un catéter de succión de 10 FR. Corta este trozo del catéter con las tijeras para formar una solapa rectangular con una longitud de unos 0,5 cm. Prepare el colgajo con una sutura (6/0) [sutura 2] en el centro del colgajo.
- Coloque el colgajo sobre una aguja de 14G y punción del colon ascendente con la aguja donde se fijó la sutura 115.
- Inserte el tubo de plástico preparado en el colon sobre la aguja. Al mismo tiempo, retire la aguja suavemente. Coloque la sonda de manera que el colgajo quede fuera del colon y el resto del tubo dentro del colon.
- Después de la colocación exacta del tubo de plástico, fije el colgajo con la sutura 2 ya existente suturando la pared colónica y los nudos quirúrgicos. Evitar de nuevo cualquier lesión de los vasos del colon. Coloque los extremos libres de la sutura 1 alrededor del resto del tubo de plástico que sale del colon y realice 2 nudos quirúrgicos.
- Ordeñar las heces desde el ciego hacia el stent colónico mediante el uso de bastoncillos de algodón hasta que aparezcan las heces a la salida del stent.
- Vuelva a colocar el intestino delgado y el colon en la caverna abdominal. De este modo, el tubo de plástico con las heces debe estar en contacto con el peritoneo. Enjuague el stent con 2 mL de NaCl al 0,9% para distribuir las heces en la caverna peritoneal.
- Cerrar la caverna abdominal con una sutura continua (4/0) del peritoneo y posteriormente con una sutura continua (4/0) de la piel.
3. Procedimiento postoperatorio
- Detenga la inhalación de isoflurano y vuelva a colocar a la rata en su jaula.
- Iniciar la analgesia intravenosa por vía venosa con fentanilo (2,0 μg/100 g de peso corporal/h).
4. Preparación de las mediciones el segundo día
- 24 h después del procedimiento sCASP, aplique 0,5-1,0 mg de midazolam por vía intravenosa. Mantener la profundidad anestésica adecuada utilizando la concentración y el caudal de isoflurano basándose en el monitoreo intraoperatorio de la rata y/o las recomendaciones del organismo de supervisión de la investigación con animales y/o el equipo veterinario de la institución local.
- Una vez desinfectado con alcohol y solución de nuevo, realizar una traqueotomía con el tubo de plástico de una cánula venosa de 14 G para proporcionar suficiente oxigenación y ventilación.
- Por lo tanto, abra la sutura en la garganta con tijeras quirúrgicas y ábrala suavemente desde la línea media hasta la tráquea. Haga una incisión vertical en la tráquea entre dos cartílagos de una longitud de unos 2 mm con unas tijeras quirúrgicas, lo suficiente para insertar las tijeras quirúrgicas. Ensancha la incisión sin filo hasta aproximadamente la mitad del diámetro de la tráquea con las tijeras. Inserte 1 cm de un tubo de plástico de 14 G y fíjelo con 2 suturas. 16
Nota: Si la incisión de la tráquea es más grande que la mitad de la circunferencia, los vasos que van a lo largo de la tráquea pueden dañarse, lo que resulta en una hemorragia grave, aspiración de sangre o bradicardia letal. - Iniciar ventilación mecánica con ventilador para roedores con un FiO2 de 0,28 y 0,7 % Vol. de isoflurano e iniciar anestesia intravenosa con midazolam (0,7 mg/100 g PC/h) y fentanilo (7 μg/100 g PC/h). Realizar análisis de gases en sangre para garantizar una ventilación y oxigenación suficientes. Por lo tanto, extraiga aproximadamente 0,7 ml de sangre a través del catéter arterial y mídala con un analizador de gases en sangre.
Nota: La anestesia intravenosa debe comenzar solo si se establece la ventilación controlada mecánicamente.
- Por lo tanto, abra la sutura en la garganta con tijeras quirúrgicas y ábrala suavemente desde la línea media hasta la tráquea. Haga una incisión vertical en la tráquea entre dos cartílagos de una longitud de unos 2 mm con unas tijeras quirúrgicas, lo suficiente para insertar las tijeras quirúrgicas. Ensancha la incisión sin filo hasta aproximadamente la mitad del diámetro de la tráquea con las tijeras. Inserte 1 cm de un tubo de plástico de 14 G y fíjelo con 2 suturas. 16
- Después de haber afeitado y desinfectado de forma similar a la 2.1, realice una incisión longitudinal de 1 cm de la piel de la pierna derecha, 0,5 cm proximal de la rodilla. Disecciona la arteria de las estructuras vecinas con tijeras quirúrgicas y bastoncillos de algodón sin rodeos.
Nota: Si la arteria femoral se desgarra, aún es posible la inserción del catéter en posición proximal. Por lo tanto, se recomienda iniciar la implantación lo más distal posible. - Inserte un catéter de termodilución en la arteria femoral abriendo la arteria con un gancho e insertando el catéter con pinzas.
- Comience a medir el gasto cardíaco mediante el método de termodilución. Por lo tanto, infunda 1 mL de NaCl enfriado rápidamente y manualmente a través del catéter venoso después de haber iniciado la medición de un software de medición del índice cardíaco. Realice esta medición dos veces.
5. Evaluación de la función renal
- Realizar una laparotomía abriendo las suturas de la piel y el peritoneo con unas tijeras. Haga una incisión en la vejiga urinaria con unas tijeras quirúrgicas lo suficiente como para cateterizarla con un pequeño catéter de plástico. Después de colocar un hilo de algodón de unos 7 cm alrededor de la vejiga, sujete el hilo, fije el catéter con nudos y, finalmente, recoja la mayor cantidad de orina posible a través del catéter.
- Disuelva la fluoresceína-isotiocianato-inulina (FITC-inulina) en NaCl al 0,9% y sal sódica (HAP) del ácido p-aminohipúrico en NaCl al 0,9% para obtener concentraciones de 2 mg/mL de inulina, 5 mg/mL de HAP.
- Aplicar un bolo de una mezcla de ambas sustancias de 75 μL i.v., seguido de una infusión intravenosa constante de ambas sustancias con una tasa de 3,7 μL/h/300 g de peso corporal.
- Después de haber alcanzado un estado estacionario17 con la infusión de FITC-Inulina y HAP, recoja la orina durante 20 min. Tomar muestras de sangre a través del catéter arterial como se describe en el punto 4.2.1 con respecto a la realización de un análisis de gases en sangre.
- Determinar las concentraciones de inulina en la orina y el plasma por espectrometría de fluorescencia y medir la HAP por fotoespectrometría utilizando el método de antrona17.
6. Fin de los experimentos
- Sacrificar al animal de acuerdo con las regulaciones legales locales.
- Extraiga la mayor cantidad de sangre posible a través del catéter arterial mediante el uso de jeringas.
- Extraiga el intestino delgado y grueso cortando la fijación peritoneal del duodeno y el colon, saque algunas partes de estos con tijeras quirúrgicas. Prepare y extraiga los riñones mediante la preparación retroperitoneal y libere su cápsula grasa y corte a través del uréter y los vasos adjuntos. Realizar una toracotomía y extirpar los pulmones y el corazón. Fijar todos los órganos en formaldehído y realizar tinciones histológicas como se publicó anteriormente. 15,18
Resultados
Como ya se publicó previamente por Schick et al.8, demostramos los siguientes resultados.
Inducción de sepsis sin mortalidad
En el modelo CASP, la sepsis es inducida por una fuga continua de bacterias intraluminales localizadas en el colon que ascienden a la cavidad abdominal, lo que resulta en peritonitis fecal y bacteriemia. De este modo, el tamaño del catéter implantado regula la salida de heces y, por tanto, la gravedad de la peritonitis y la sepsis. En el protocolo experimental presentado anteriormente, se utilizó una aguja de 14G combinada con la punta del catéter de succión de 10 FR especialmente preparado para tener una peritonitis suficiente. Los catéteres más pequeños solo causaron abscesos con inflamación local, ya que la vesícula seminal ocluyó en su mayoría los stents más pequeños e impidió una producción fecal continua.
Los animales de control y sCASP sobrevivieron al experimento, pero en el grupo sCASP fue necesaria una reanimación con líquidos para mantener la presión arterial media (PAM) ≥ 70 mmHg. Los animales tratados con sCASP mostraron peritonitis fecal ubicua sin formación de abscesos y mostraron signos clínicos de sepsis grave revelados por disminución de la actividad, disminución del estado de alerta, pelaje erizado y postura encorvada. Este estado clínico se deterioró continuamente a lo largo del tiempo.
Las ratas sCASP resucitadas con líquido mostraron diferencias significativas en la PAM y la frecuencia cardíaca, pero no diferencias en el gasto cardíaco en comparación con los animales de control (Figura 1). Los análisis de sangre después de 24 horas revelaron signos de sepsis en los animales tratados con sCASP con aumento de lactato, aumento de IL-6 y una leucopenia típica para estos animales en comparación con el control (Figura 1).
Determinación de LRA inducida por sepsis
El aclaramiento de inulina, descrito como el estándar de oro para evaluar la función renal, disminuyó significativamente en los animales sCASP en comparación con el control después de 24 horas (Figura 2 A). Además, la diuresis (Figura 1) y el aclaramiento de HAP se redujeron significativamente en los animales con sCASP (Figura 2 B). El NGAL (Figura 2 C) y la cistatina C (Figura 2 D) aumentaron en la sepsis en comparación con el grupo control. Los parámetros estándar para LRA, como la urea y la creatinina, confirmaron el deterioro de la función renal en el grupo sCASP por los niveles elevados de ambos parámetros medidos en el suero sanguíneo (Figura 2, E y F).
La lesión renal aguda en el grupo sCASP no solo se determinó por parámetros funcionales, sino también por un aumento de la puntuación histopatológica de la lesión (Figura 3). Esta puntuación se basa en alteraciones morfológicas que incluyen formación de edema, edema celular, desprendimiento del epitelio tubular de la membrana basal, pérdida del borde en cepillo de las células tubulares proximales, muerte celular y vacuolización. El grupo sCASP mostró un aumento de la puntuación histopatológica de los riñones 24 horas después de la inducción de la sepsis, donde el edema intersticial y la alteración del borde en cepillo de los túbulos fueron los factores principales para la puntuación más alta en comparación con los animales control (Figura 3). Además, la tasa de células muertas y los eventos de desprendimiento de la membrana basal aumentaron significativamente en los animales sCASP (Figura 3).
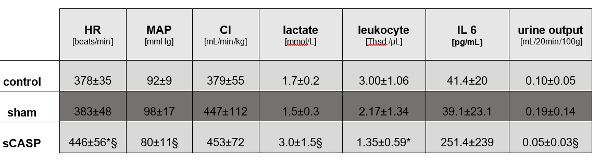
Figura 1: Parámetros de macrohemodinámica y sepsis. Los siguientes valores confirman la presencia de sepsis en animales operados con sCASP: frecuencia cardíaca (FC), presión arterial media (PAM), índice cardíaco (IC), lactato, leucocitos, interleucina 6 (IL 6) y diuresis. * p<0,05 vs. control, § p<0,05 vs. simulación. Los datos ya están publicados en ICMex por Schick et al.15 Haga clic aquí para ver una versión más grande de esta figura.
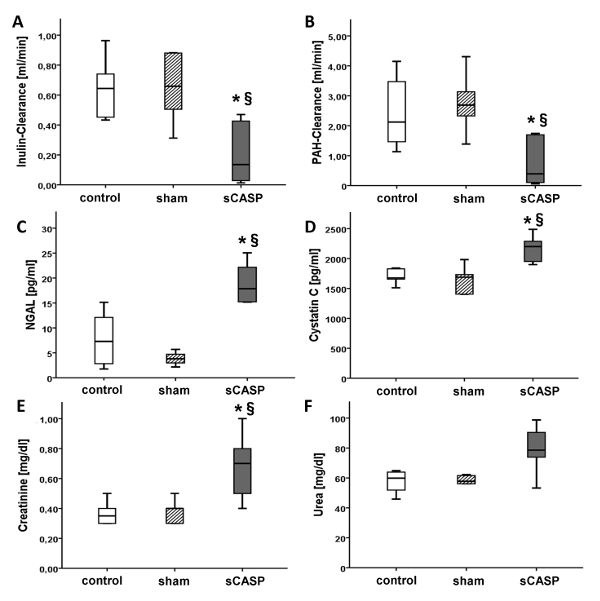
Figura 2: Parámetros de la función renal. Los parámetros aclaramiento de inulina (A) y HAP- (B) [mL/min], descritos como el estándar de oro para medir la función renal, disminuyeron significativamente en el grupo sCASP. Por el contrario, el NGAL (C) y la cistatina C (D) [pg/mL] aumentaron como un signo adicional de LRA séptica. Los parámetros clínicos estándar como creatinina (E) y urea (F) [mg/dL] también mostraron niveles elevados en animales sépticos. * p< 0,05 vs. control, § p<0,05 vs. simulación. Los datos ya están publicados en ICMex por Schick et al.15 Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Puntuaciones histológicas de las lesiones. Mostrando las diferencias entre control, simulado y sCASP en cuanto al edema intersticial, la pérdida del borde en cepillo de las células tubulares proximales, la muerte celular y la puntuación total de la lesión. Las barras muestran la media ± la desviación estándar. * p< 0,05 vs. control, § p<0,05 vs. simulación. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La fisiopatología de la LRA séptica sigue siendo desconocida en su complejidad. La investigación clínica y los ensayos en pacientes no permitirán obtener nuevos conocimientos con respecto a los cambios histopatológicos, las alteraciones de la microcirculación o las interacciones farmacológicas a nivel celular15. Se ha postulado previamente que existe la necesidad de modelos animales nuevos y mejorados para investigar la lesión renal aguda asociada a la sepsis19. Por lo tanto, establecimos un nuevo modelo animal para la LRA séptica inducida por la peritonitis del stent del colon ascendente.
El modelo CASP presenta un modelo clínico relevante para imitar la sepsis en humanos iniciada con peritonitis fecal observada en pacientes quirúrgicos. La gran ventaja del CASP es que no comienza con un golpe isquémico como en el modelo CLP ampliamente utilizado, donde se realiza una ligadura del ciego14. Además, Maier et al. muestran que el modelo CLP representa una situación de absceso intraabdominal más que una peritonitis ubicua con bacteriemia sistémica14. Mediante el uso de diferentes tamaños de stent implantado en el colon ascendente, la gravedad de la sepsis y la tasa de supervivencia pueden verse afectadas, como se ha demostrado en publicaciones previas 13,14,20. Para evitar la oclusión del stent por epiplón o vesículas seminales, se insertó un stent modificado con un diámetro de 10 FR15. En el modelo animal descrito anteriormente, solo se utilizaron ratas macho para excluir la variación hormonal en lugar de animales hembras como en el modelo CASP original de Zantl et al. y Traeger et al.13,21.
Hay que tener en cuenta que incluso después de realizar la configuración experimental presentada anteriormente de forma estandarizada, puede producirse variabilidad en función de las diferentes cepas de ratones, la instalación de animales, el sexo y el operador. Por lo tanto, puede ser necesario ajustar el tamaño del stent y, por lo tanto, la gravedad de la peritonitis y la sepsis. Además, se recomienda que el mismo operador realice tanto el sCASP como el control el mismo día para reducir la variabilidad.
Puede producirse una lesión renal aguda por hipoxia e isquemia causada por hipotensión o insuficiencia respiratoria con disminución de laPaO2 en la sepsis22. Los cambios en las condiciones hemodinámicas y metabólicas condujeron a una hipoxia tisular que influye en la integridad renal y puede afectar la morbimortalidad23. Por lo tanto, se debe disponer de una evaluación continua de los valores hemodinámicos y respiratorios en un modelo in vivo que se utilice para investigar la LRA séptica. En este trabajo presentamos un modelo in vivo que se caracteriza por una configuración de UCI comparable a la de los pacientes 24,25,26. Permite una medición continua de los valores hemodinámicos, como la frecuencia cardíaca y la presión arterial, y la evaluación del estado respiratorio mediante la extracción de sangre para análisis de gases en sangre. Además, estos datos obtenidos por la monitorización continua son necesarios y útiles para la reanimación con líquidos y la adaptación del protocolo de anestesia.
La evaluación de la función renal mediante la medición de la inulina y el aclaramiento de HAP solo es posible al final del experimento, ya que es necesaria una relaparotomía y una incisión de la vejiga urinaria. Si se requiere una investigación de la función renal durante el experimento, se pueden tomar muestras de sangre para medir parámetros estándar como la creatinina y la urea. Por lo tanto, se debe considerar que se debe realizar una reposición de líquidos para evitar una insuficiencia prerrenal debido a la hipovolemia.
El propósito de este modelo fue establecer una configuración estable de LRA séptica en roedores con relevancia clínica que permita realizar estudios adicionales en fisiopatología y tratamiento de la insuficiencia renal. Este modelo también se puede utilizar para investigar diferentes estrategias terapéuticas de la sepsis abdominal y la LRA séptica. Por lo tanto, este modelo puede servir como una configuración estable de roedores de LRA séptica al estar cerca del entorno clínico de una unidad de cuidados intensivos. Además, el modelo descrito puede modificarse y utilizarse con éxito para un amplio espectro de investigaciones in vivo sobre la sepsis, por ejemplo, la desregulación inmunitaria, la degradación endotelial, la coagulopatía, la alteración de la microcirculación, la farmacoterapia y la reanimación25.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
M.A. Schick y N. Schlegel recibieron financiación de la Deutsche Forschungsgemeinschaft (DFG) SCHL 1962/2-1 y SCHL 1962/4-1.
Materiales
| Name | Company | Catalog Number | Comments |
| Sprague-Dawley rats | Janvier Labs, France | ||
| Isoflurane CP | cp-pharma, Burgdorf, Germany | ||
| polyethylen catheter PE 10; 30m | A. Hartenstein, Wuerzburg, Germany | 0.58x0.96 mm | |
| Swivel (375/D/20) | Instech, Plymouth Meeting, PA, USA | (375/D/20) | |
| plastic button tethers | Instech, Plymouth Meeting, PA, USA | LW105S | |
| Perfusor | B. Braun; Melsungen, Germany | Perfusor fm | |
| suction catheter ch. 10 | B.Braun Melsungen AG, Germany | suction catheter typy „Ideal“; ch. 10 | |
| suture | Syneture; USA | Surgipro; Monofilament Polypropylen 4-0 | |
| suture | Ethicon; Scotland | Prolene; Polypropylen 5-0 | |
| 14G-i.v. catheter | BD Insynte; BD Vialon; Madrid; Spain | 14GA i.v. catheter | |
| cotton buds | NOBA Verbandmittel Danz GmbH u Co KG; Wetter; Germany | ||
| rodent respirator | Hugo Sachs Elektronik KG, Germany | rodent respirator, Type:7025 | |
| Midazolam | Ratiopharm, Germany | Midazolam | |
| Thermodilutioncatheter | ADInstruments, Spechbach, Germany | ||
| p-Aminohippuric acid | Sigma-Aldrich; St. Louis; USA | p-Aminohippuric acid sodium salt; A3759-25G | |
| Inulin | Sigma-Aldrich; St. Louis; USA | Inulin-FITC; F3272-1G | |
| Formaldehyde | Otto Fischar GmbH & CoKG; Saarbrücken, Germany | Formaldehyde 3.5% | |
| Cyclopentan | Merck; Darmstadt; Germany | Uvasol: 2-Methylbutan | |
| alcohol based scrub | Schülke & Mayr GmbH, Norderstedt; Germany | kodan Tinktur forte; 45g 2-Propanol, 10g 1-Propanol per 100g | |
| povidone iodine solution | B.Braun Melsungen AG, Germany | Braunol, 7.5g Povidone Iodine per 100g |
Referencias
- Angus, D. C., et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med. 29, 1303-1310 (2001).
- Dellinger, R. P., et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 41, 580-637 (2013).
- Moerer, O., Quintel, M. [Sepsis in adult patients - definitions, epidemiology and economic aspects]. Internist (Berl). 50, 788-796 (2009).
- Belayev, L. Y., Palevsky, P. M. The link between acute kidney injury and chronic kidney disease. Curr Opin Nephrol Hypertens. 23, 149-154 (2014).
- Chao, C. T., et al. The impact of dialysis-requiring acute kidney injury on long-term prognosis of patients requiring prolonged mechanical ventilation: nationwide population-based study. PLoS One. 7, e50675 (2012).
- Chertow, G. M., Christiansen, C. L., Cleary, P. D., Munro, C., Lazarus, J. M. Prognostic stratification in critically ill patients with acute renal failure requiring dialysis. Arch Intern Med. 155, 1505-1511 (1995).
- Doi, K. Role of kidney injury in sepsis. J Intensive Care. 4, 17 (2016).
- Gomez, H., et al. A unified theory of sepsis-induced acute kidney injury: inflammation, microcirculatory dysfunction, bioenergetics, and the tubular cell adaptation to injury. Shock. 41, 3-11 (2014).
- Deitch, E. A. Animal models of sepsis and shock: a review and lessons learned. Shock. 9, 1-11 (1998).
- Esmon, C. T. Why do animal models (sometimes) fail to mimic human sepsis?. Crit Care Med. 32, S219-S222 (2004).
- Rittirsch, D., Hoesel, L. M., Ward, P. A. The disconnect between animal models of sepsis and human sepsis. J Leukoc Biol. 81, 137-143 (2007).
- Doi, K., Leelahavanichkul, A., Yuen, P. S., Star, R. A. Animal models of sepsis and sepsis-induced kidney injury. J Clin Invest. 119, 2868-2878 (2009).
- Zantl, N., et al. Essential role of gamma interferon in survival of colon ascendens stent peritonitis, a novel murine model of abdominal sepsis. Infect Immun. 66, 2300-2309 (1998).
- Maier, S., et al. Cecal ligation and puncture versus colon ascendens stent peritonitis: two distinct animal models for polymicrobial sepsis. Shock. 21, 505-511 (2004).
- Schick, M. A., et al. Sepsis-induced acute kidney injury by standardized colon ascendens stent peritonitis in rats - a simple, reproducible animal model. Intensive Care Med Exp. 2, (2014).
- Schick, M. A., et al. Effects of crystalloids and colloids on liver and intestine microcirculation and function in cecal ligation and puncture induced septic rodents. BMC Gastroenterol. 12, 179 (2012).
- Schneider, R., et al. Downregulation of organic anion transporters OAT1 and OAT3 correlates with impaired secretion of para-aminohippurate after ischemic acute renal failure in rats. Am J Physiol Renal Physiol. 292, F1599-F1605 (2007).
- Schick, M. A., et al. The impact of crystalloid and colloid infusion on the kidney in rodent sepsis. Intensive Care Med. 36, 541-548 (2010).
- Bellomo, R., Ronco, C., Kellum, J. A., Mehta, R. L., Palevsky, P. Acute renal failure - definition, outcome measures, animal models, fluid therapy and information technology needs the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care. 8, R204-R212 (2004).
- Lustig, M. K., et al. Colon ascendens stent peritonitis--a model of sepsis adopted to the rat: physiological, microcirculatory and laboratory changes. Shock. 28, 59-64 (2007).
- Traeger, T., et al. Colon ascendens stent peritonitis (CASP)--a standardized model for polymicrobial abdominal sepsis. J Vis Exp : JoVE. , (2010).
- Dyson, A., Rudiger, A., Singer, M. Temporal changes in tissue cardiorespiratory function during faecal peritonitis. Intensive Care Med. 37, 1192-1200 (2011).
- Arakelyan, K., et al. Early effects of an x-ray contrast medium on renal T(2) */T(2) MRI as compared to short-term hyperoxia, hypoxia and aortic occlusion in rats. Acta physiol. 208 (2), 202-213 (2013).
- Schick, M. A., et al. Balanced hydroxyethylstarch (HES 130/0.4) impairs kidney function in-vivo without Inflammation. PLoS One. 10 (9), e0137247 (2015).
- Flemming, S., et al. Phosphodiesterase 4 inhibition dose dependently stabilizes microvascular barrier functions and microcirculation in a rodent model of polymicrobial sepsis. Shock. 41, 537-545 (2014).
- Flemming, S., et al. Sphingosine-1-phosphate receptor-1 agonist sew2871 causes severe cardiac side effects and does not improve microvascular barrier breakdown in sepsis. Shock. 49 (1), 71-81 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados