Method Article
標準化された結腸はラットのステント腹膜炎を上昇させます-敗血症性急性腎障害を誘発するためのシンプルで実行可能な動物モデル
要約
急性腎障害(AKI)は、重症患者の重篤な合併症であり、死亡率の増加と関連しています。ここでは、炎症条件下でAKIを模倣するための信頼性と再現性のある in vivo モデルを提示し、敗血症性AKIの病因の理解に貢献する可能性があります。
要約
敗血症患者における AKI は、その病態生理学の理解を深めるための多大な努力にもかかわらず、死亡率の増加と転帰不良と関連しています。ここでは、標準化された敗血症の焦点を組み合わせてAKIを誘発し、集中治療室(ICU)のセットアップを組み合わせて、ヒト敗血症に匹敵する高度な血行動態モニタリングと治療を提供する in vivo モデルを紹介します。敗血症は、標準化された結腸上昇ステント腹膜炎 (sCASP) によって誘発されます。AKIは、血液や尿のサンプルの測定による機能的な研究と、病理組織学的スコアの評価による組織学的研究を行っています。さらに、高度な血行動態モニタリングと反復的な血液ガスサンプリングの可能性により、誘発性敗血症の重症度の差別化された分析が可能になります。
sCASP法は、浄化槽AKIを誘導するための標準化された信頼性と再現性のある方法です。集中治療室の設定、継続的な血行動態とガス交換のモニタリング、低い死亡率、腎機能と障害の詳細な分析の機会は、この設定の利点です。したがって、記載されている方法は、敗血症性AKIの実験的調査の新しい標準として役立つ可能性があります。
概要
敗血症は依然として非心臓集中治療室 (ICU) の主要な死因であり、死亡率は ≈ 30 - 50% 1,2,3.重度の敗血症と敗血症性ショックの特徴は、心不全や呼吸不全などの遠隔臓器機能障害と関連している場合、死亡率のさらなる増加を引き起こす急性腎障害です4,5,6。ICU患者におけるAKIの全体的な発生率は20〜50%です7。敗血症における転帰と死亡率に関するAKIの重要な役割にもかかわらず、その根底にある病態メカニズムはまだ十分に理解されていません。
全体として、AKIの発症に寄与する炎症、中毒性損傷、血行動態の変化という3つの主要な要素があります7。血行動態の変化には、腎血流(RBF)の減少と全体的または局所的な腎虚血が含まれます。ここでは、敗血症は、全身性低血圧および/または内皮バリアの破壊8による腎微小循環の障害も引き起こす可能性があることを考慮する必要があります。したがって、敗血症性AKIの研究には、常に血行動態モニタリングを含める必要があります。AKIに関する最近の in vivo 研究では、腎虚血再灌流障害や両側腎摘出術などの動物モデルが主に使用されています。これらの研究は通常、血行動態モニタリングと集中治療の欠如を示しました。
敗血症性AKIの潜在的な新しい病態メカニズムと治療法の調査には、定義された敗血症の焦点、集中治療のセットアップ、予測可能な結果、および臓器損傷9,10,11,12を備えたin vivoモデルが必要です。ここでは、前述の要件を満たす浄化槽AKIの革新的なげっ歯類モデルについて説明します。敗血症性 AKI は、標準化された結腸上昇ステント腹膜炎 (sCASP) によって誘発されます。使用されたsCASPモデルは、腸の糞便漏出による腹部敗血症を引き起こし、細菌の侵入と多臓器不全につながります13。CASP後の病態生理学的変化はヒト敗血症の病態生理学的変化と類似していることが示されており、したがってCASPは敗血症研究における臨床的に関連性のあるモデルを表しています11,14。
さらに、高度な血行動態モニタリングとICU治療を含む集中治療室(ICU)のセットアップが実験プロトコルで確立されています。ICUのセットアップにより、輸液蘇生、鎮痛剤の静脈内投与、血液ガス分析の反復が可能です。腎機能は、クレアチニンなどの標準値の測定と、イヌリンおよびp-アミノ馬尿酸-(PAH)クリアランスによって評価されます。追加情報は、実験の最後に採取された組織と臓器の病理組織学的スコアによって提供されます。敗血症性AKIを誘導するsCASPモデルはすでに評価されており、腎臓病理学における新たな知見が明らかになっている15。以下に示すこのプロトコルをさらに適用すると、敗血症性AKIの理解を深めるのに役立つ可能性があります。
プロトコル
すべての動物実験手順は、ドイツのウンターフランケン地区の実験動物管理および使用委員会によって承認され、ヘルシンキ宣言に従って実施されました。
1. 侵襲的モニタリングと継続的な投薬の外科的準備と設置
- 精密気化器によって供給されるイソフルランを使用して、地元の機関の動物研究監督機関および/または獣医チームによって承認された濃度と流量でSprague-Dawleyラットに麻酔をかけます。呼吸数が遅くなり、深くなる呼吸数を観察して適切な麻酔の深さを確認し、尻尾/つま先をつまんだ後の無反応を確認します。カミソリで喉とお腹を剃ります。
手記: 呼吸数の大幅な減少は、麻酔の過剰摂取の指標となり、最終的には徐呼吸、低血圧、そして死につながる可能性があります。 - ラットを加熱パッドの上で仰臥位に置きます。目の乾燥を防ぐために、獣医軟膏を目に塗ります。ラットの術中モニタリングおよび/または地元の機関の動物研究監督機関および/または獣医チームの推奨事項に基づいて、イソフルラン濃度と流量を使用して適切な麻酔薬の深さを維持します。ラットを自動加熱パッドの仰臥位に置きます。
注:低体温症と熱傷害はマクロおよびミクロの血行動態パラメータに影響を与えるため、信頼性の高い結果を得るためには避けるべきです。体温を生理学的範囲に維持するために、柔軟な直腸プローブを介してラットにリンクされた制御メカニズムを備えた加熱パッドを使用することをお勧めします。 - 適切な消毒液で首とのどを消毒した後、メスで喉内側の皮膚を切開し、約2cmの切開を行います。ラットを回転させ、後頭部の約1cm遠位の首に外科用ハサミで約1cmの切開を行います。
- ラットを仰臥位に戻します。右頸静脈と左頸動脈をハサミと綿棒で優しく解剖します。隣接する構造物から容器を解剖します。引きずりすぎを避け、慎重に広げる動きでさらに準備します。
手記: 事前に温めた滅菌生理食塩水を適用して、血管を常に湿らせてください。 - 血管から首まで皮下運動を広げながら、穏やかに解剖し、2つの切開部をつなぎます。形成された各トンネルにクランプを挿入します。
- スイベル装置から出ているスイベルとカテーテルを0.9%NaClで洗い流します。カテーテルをステンレス製のスプリングに挿入します。
手記: カテーテルは、最小限の空気の塗布が空気塞栓症による突然死につながる可能性があるため、挿入する前に塩化ナトリウムで洗い流す必要があります。 - ラットを回転させ、挿入されたクランプを使用してカテーテルをクランプします。カテーテルを首から喉までスライドさせます。後頭部の約1cmの遠位にプラスチック製のボタンテザーでスプリングを固定し、首に6つの単数縫合糸(例:4/0)を付けます。
- ラットを再び仰臥位に置きます。準備した各容器の近位および近位に約4cmの綿糸を置きます。くも膜下動脈瘤のクリッピングに通常使用されるマイクロクリップで動脈を近位にクリップします。または、クリップを離れて、スレッドの1つを締めて動脈血流を停止します。
- 外科用マイクロハサミで動脈を切開し、片手でフックで切開部を開いたままにし、もう一方の手で鉗子を使用して動脈カテーテルを血管に挿入します。クリップまたは引っ張った糸を開き、カテーテルを血管の心臓に向かって約1cm前方に押し込み、敷設された綿糸を使用して外科的結び目で固定します。
- 頸静脈で手順1.8を繰り返し、静脈が動脈ほど固くないため、クリップを離れます。
- 両方のカテーテルを血管内で直線的に固定した後、縫合糸で喉の傷を閉じます。
2. sCASPの手順
- ラットを仰臥位に保ち、腹部を剃り、適切な消毒液で腹部を消毒します。
手記: 常に無菌技術を使用してください。 - 手術用ハサミで約 2 cm の長さの皮膚の腹部正中線切開を行い、その後、再びアルバ線に沿って腹腔を開きます。
- 盲腸極を特定し、綿棒を使用して盲腸をそっと引き出します。
- 回盲弁から約2cm遠位の上行結腸を抗腸間膜側の縫合糸(6/0)[縫合糸1]で突き刺し、2つの外科的結び目で固定します。結腸血管の病変を避けてください。
- 10FR吸引カテーテルの遠位端(約1.5cm)を切り取ります。カテーテルのこの部分をハサミで切断して、長さ約0.5cmの長方形のフラップを形成します。フラップの中央に縫合糸(6/0)[縫合糸2]でフラップを準備します。
- フラップを14G針にかざし、縫合糸1が固定された針で上行結腸に穿刺します15。
- 準備したプラスチックチューブを針の上の結腸に挿入します。同時に針をそっと外します。フラップが結腸の外側にあり、チューブの残りの部分が結腸の内側にあるようにチューブを配置します。
- プラスチックチューブの正確な位置決め後、結腸壁と外科的結び目を縫い合わせることにより、フラップを既存の縫合糸2で固定します。結腸血管の病変は再び避けてください。縫合糸1の自由端を、結腸の外側につながるプラスチックチューブの残りの部分の周りに置き、2回の外科的結び目を行います。
- ステントの出口に便が現れるまで綿棒を使用して、盲腸から結腸ステントに向かって乳便を便します。
- 小腸と結腸を腹部の空洞に戻します。これにより、スツール付きのプラスチックチューブが腹膜に接触している必要があります。ステントを2mLの0.9%NaClで洗い流し、糞便を腹腔に分配します。
- 腹腔を腹腔の連続縫合糸(4/0)で閉じ、その後、皮膚の連続縫合糸(4/0)で閉じます。
3. 術後の処置
- イソフルランの吸入を止め、ラットをケージに戻します。.
- フェンタニル(2.0μg/100g体重/時)を使用して静脈ラインを介して静脈内鎮痛を開始します。.
4. 2日目の測定値の準備
- sCASP手順の24時間後、0.5〜1.0 mgのミダゾラムを静脈内に適用します。.ラットの術中モニタリングおよび/または地元の機関の動物研究監督機関および/または獣医チームの推奨事項に基づいて、イソフルラン濃度と流量を使用して適切な麻酔薬の深さを維持します。
- アルコールと溶液で再度消毒した後、14G静脈カニューレのプラスチックチューブで気管切開を行い、十分な酸素供給と換気を提供します。
- そのため、手術用ハサミで喉の縫合糸を開き、正中線から気管に向かって穏やかに開きます。手術用ハサミを挿入するのに十分な長さの約2つの軟骨の間で気管を垂直に切開します。切開部をハサミで気管の直径の約半分まで鈍く広げます。14Gのプラスチックチューブを1cm挿入し、2本の縫合糸で固定します。16名
手記: 気管の切開部が円周の半分より大きい場合、気管に沿っている血管が損傷を受け、重度の出血、誤嚥、または致命的な徐脈を引き起こす可能性があります。 - FiO2 が 0.28 および 0.7 Vol. % イソフルランのげっ歯類人工呼吸器で人工呼吸器を開始し、ミダゾラム (0.7 mg/100 g BW/h) とフェンタニル (7 μg/100 g BW/h) による静脈内麻酔を開始します。十分な換気と酸素供給を確保するために、血液ガス分析を実施します。そのため、動脈カテーテルを介して約0.7mLの血液を採取し、血液ガス分析器で測定します。
手記: 静脈内麻酔は、機械的に制御された換気が確立されている場合にのみ開始する必要があります。
- そのため、手術用ハサミで喉の縫合糸を開き、正中線から気管に向かって穏やかに開きます。手術用ハサミを挿入するのに十分な長さの約2つの軟骨の間で気管を垂直に切開します。切開部をハサミで気管の直径の約半分まで鈍く広げます。14Gのプラスチックチューブを1cm挿入し、2本の縫合糸で固定します。16名
- 2.1と同様の方法で剃毛および消毒した後、右脚の皮膚の縦方向に1cm、膝の近位0.5cmを切開します。手術用ハサミと綿棒を使用して、隣接する構造から動脈を鈍く解剖します。
手記: 大腿動脈が裂けた場合でも、近位にカテーテルを挿入することは可能です。したがって、移植はできるだけ遠位から開始することをお勧めします。 - 大腿動脈に熱希釈カテーテルを挿入します フックで動脈を開き、カテーテルを鉗子で挿入します。
- 熱希釈法による心拍出量の測定を開始します。したがって、心指数測定ソフトウェアの測定を開始した後、冷やしたNaCl1 mLを静脈カテーテルを介して手動で迅速に注入します。この測定を2回実行します。
5. 腎機能の評価
- 皮膚と腹膜の縫合糸をハサミで開腹して開腹術を行います。手術用ハサミで膀胱を切開し、小さなプラスチックカテーテルでカテーテルを挿入します。膀胱の周りに約7cmの綿糸を敷き詰めた後、糸を固定し、カテーテルを結び目で固定し、最後にカテーテルを介してできるだけ多くの尿を採取します。
- フルオレセイン-イソチオシアネート-イヌリン(FITC-イヌリン)を0.9%NaClに、p-アミノ馬尿ナトリウム塩(PAH)を0.9%NaClに溶解して、2 mg/mLイヌリン、5 mg/mL PAHの濃度を得る。
- 75μLの静脈内両方の物質の混合物のボーラスを適用し、続いて3.7μL / h / 300gBWの速度で両方の物質の一定の静脈内注入を行います。
- FITCイヌリンおよびPAHの注入により定常状態17 に達した後、20分間尿を採取する。血液ガス分析の実施に関して4.2.1で説明されているように、動脈カテーテルを介して血液サンプルを採取します。
- 蛍光分光法により尿および血漿中のイヌリン濃度を決定し、アントロン法17を用いたフォトスペクトロメトリーによりPAHを測定する。
6. 実験の終了
- 地域の法的規制に従って動物を安楽死させます。
- 注射器を使用して、動脈カテーテルを介してできるだけ多くの血液を採取します。
- 十二指腸と結腸の腹膜固定を切開して小腸と大腸を収穫し、手術用ハサミを使用してこれらの一部を取り出します。後腹膜を準備し、脂肪嚢から腎臓を解放し、尿管と付着した血管を切断することにより、腎臓を準備して収穫します。開胸術を行い、肺と心臓を切り取ります。すべての臓器をホルムアルデヒドで固定し、以前に発表されたように組織学的染色を行います。15,18
結果
Schick et al.8によって以前に発表されたように、以下の結果を示しています。
死亡率を伴わない敗血症の誘発
CASP モデルでは、敗血症は、結腸の管腔内に位置する細菌の連続的な漏出によって誘発され、腹腔内が上昇し、糞便性腹膜炎と菌血症を引き起こします。これにより、埋め込まれたカテーテルのサイズは、糞便の排出を調節し、したがって腹膜炎と敗血症の重症度を調節します。上記の実験プロトコルでは、特別に準備された 10 FR 吸引カテーテルの先端と組み合わせた 14G 針を使用して、十分な腹膜炎を示しました。小さなカテーテルは、精嚢が主に小さなステントを閉塞し、継続的な糞便排出を妨げたため、局所炎症を伴う膿瘍のみを引き起こしました。
対照動物とsCASP動物は実験を生き延びましたが、sCASPグループでは、平均動脈圧(MAP)を70mmHg≥維持するために輸液蘇生が必要でした。sCASPで治療した動物は、膿瘍形成を伴わない遍在性糞便性腹膜炎を示し、活動性の低下、覚醒度の低下、毛皮の波立ち、猫背姿勢によって明らかになった重度の敗血症の臨床徴候を示しました。この臨床状態は、時間の経過とともに継続的に悪化しました。
輸液蘇生したsCASPラットは、対照動物と比較してMAPと心拍数に有意差を示しましたが、心拍出量に差はありませんでした(図1)。24時間後の血液分析では、sCASPで治療した動物では、対照群と比較して乳酸の増加、IL-6の増加、および典型的な白血球減少症の敗血症の兆候が明らかになりました(図1)。
敗血症誘発性AKIの定量
腎機能を評価するためのゴールドスタンダードとして記載されているイヌリンクリアランスは、24時間後の対照と比較して、sCASP動物で有意に減少しました(図2A)。さらに、尿量(図1)とPAHクリアランスは、sCASP動物(図2B)で有意に減少しました。NGAL(図2C)とシスタチンC(図2D)は、対照群と比較して敗血症で増加しました。.尿素やクレアチニンなどのAKIの標準パラメータは、血清で測定された両方のパラメータのレベルが上昇したことにより、sCASPグループの腎機能障害を確認しました(図2EおよびF)。
sCASP群における急性腎障害は、機能パラメータだけでなく、組織病理学的損傷スコアの増加によっても決定されました(図3)。このスコアは、浮腫の形成、細胞性浮腫、基底膜からの尿細管上皮の剥離、近位尿細管細胞のブラシ境界の喪失、細胞死、空胞化などの形態学的変化に基づいています。sCASP群は、敗血症導入後24時間で腎臓の組織病理学的スコアが上昇したことから、間質性浮腫と尿細管の筆の境界障害が対照動物と比較して高いスコアの主因であった(図3)。さらに、死細胞の発生率や基底膜剥離の事象は、sCASP動物で有意に増加しました(図3)。
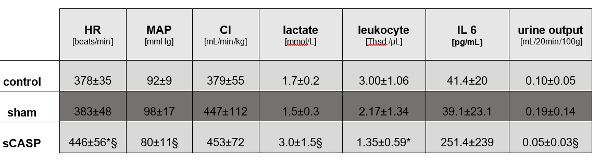
図1:マクロ血行動態と敗血症のパラメータ。 次の値は、sCASP手術動物における敗血症の存在を確認します:心拍数(HR)、平均動脈圧(MAP)、心指数(CI)、乳酸、白血球、インターロイキン6(IL 6)、および尿量。* p<0.05 対コントロール、§ p<0.05 対偽。データはすでにSchickらによってICMexで公開されています15 この図の拡大版を表示するには、ここをクリックしてください。
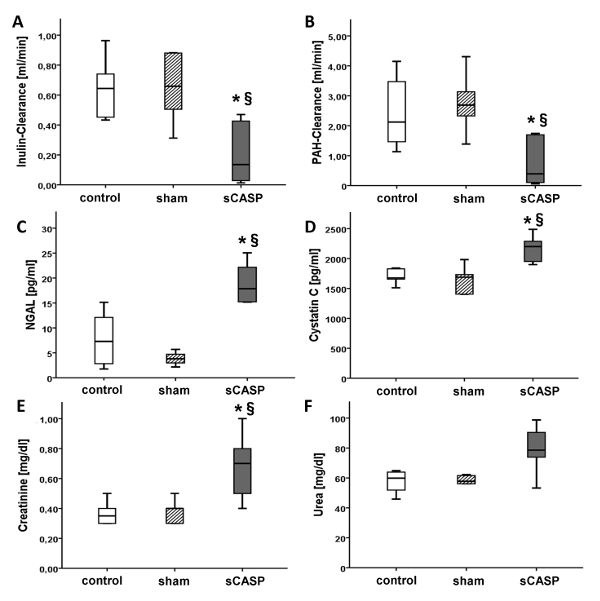
図2:腎機能パラメータ。 腎機能を測定するためのゴールドスタンダードとして記載されているインヌリン-(A)およびPAH-クリアランス(B)[mL / min]のパラメータは、sCASPグループで有意に減少しました。.対照的に、NGAL(C)とシスタチンC(D)[pg / mL]は、敗血症性AKIのさらなる兆候として増加しました。.クレアチニン(E)や尿素(F)[mg / dL]などの臨床標準パラメータも、敗血症動物でレベルの上昇を示しました。* p< 0.05 対コントロール、§ p<0.05 対偽。データはすでにSchickらによってICMexで公開されています15 この図の拡大版を表示するには、ここをクリックしてください。

図3:組織学的損傷スコア。 間質性浮腫、近位尿細管細胞のブラシ境界の喪失、細胞死、および総傷害スコアに関するコントロール、偽、およびsCASPの違いを示しています。バーは平均±標準偏差を示します。* p< 0.05 対コントロール、§ p<0.05 対偽。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
敗血症性AKIの病態生理学は、その複雑さにおいてまだ不明のままです。患者を対象とした臨床研究や臨床試験では、組織病理学の変化、微小循環障害、または細胞レベルでの薬物相互作用に関する新たな洞察を得ることはできない15。敗血症に関連する急性腎障害を調査するために、改良された新しい動物モデルが必要であると以前に仮定されてきました19。そこで、ステント腹膜炎の結腸上昇による敗血症性AKIの新たな動物モデルを確立した。
CASPモデルは、外科患者に見られる糞便性腹膜炎から始まったヒトの敗血症を模倣するための臨床的に関連するモデルを提示します。CASPの主な利点は、盲腸の結紮が行われる広く使用されているCLPモデルのように虚血性ヒットで開始しないことです14。さらに、Maierらは、CLPモデルが全身性菌血症を伴う遍在性腹膜炎ではなく、腹腔内膿瘍の状況を表していることを示しています14。結腸に埋め込まれたステントの異なるサイズを使用することにより、敗血症の重症度と生存率は、以前の出版物13、14、20に示されているように影響を受ける可能性があります。大網または精嚢によるステントの閉塞を避けるために、直径10FRの修正ステントが挿入された15。上記の動物モデルでは、ZantlらおよびTraegerらによる元のCASPモデルのように、雌動物の代わりに雄ラットのみを使用してホルモン変動を除外しました13,21。
上記の実験セットアップを標準化された方法で実行した後でも、マウスの系統、動物施設、性別、およびオペレーターによってばらつきが発生する可能性があることを考慮する必要があります。したがって、ステントのサイズを調整し、腹膜炎や敗血症の重症度を調整する必要がある場合があります。さらに、ばらつきを減らすために、同じオペレーターがsCASPと制御の両方を同じ日に実行することをお勧めします。
急性腎障害は、敗血症22のPaO2の減少を伴う低血圧または呼吸不全によって引き起こされる低酸素症および虚血が原因で発生する可能性があります。血行動態および代謝状態の変化は、腎臓の完全性に影響を及ぼし、罹患率と死亡率に影響を与える可能性のある組織の低酸素症につながりました23。したがって、血行動態および呼吸値の継続的な評価は、敗血症性AKIの調査に使用されるin vivoモデルで利用できるはずです。ここでは、患者24,25,26に匹敵するICUセットアップを特徴とするin vivoモデルを提示しました。心拍数や動脈血圧などの血行動態値を連続的に測定し、血液ガス分析のために血液を採取することで呼吸状態を評価することができます。さらに、継続的なモニタリングによって得られたこれらのデータは、体液蘇生と麻酔プロトコルの適応に必要であり、役立ちます。
イヌリンとPAHクリアランスの測定による腎機能の評価は、再開腹術と尿膀胱の切開が必要なため、実験の最後にのみ可能です。実験中に腎機能の調査が必要な場合は、血液サンプルを採取してクレアチニンや尿素などの標準パラメータを測定できます。これにより、血液量減少による腎不全前症を避けるために、液体交換を実施する必要があることを考慮する必要があります。.
このモデルの目的は、腎不全の病態生理学と治療におけるさらなる研究を可能にする臨床的関連性を備えた敗血症性 AKI の安定したげっ歯類のセットアップを確立することでした。このモデルは、腹部敗血症と敗血症性AKIのさまざまな治療戦略を調査するためにも使用できます。したがって、このモデルは、集中治療室の臨床環境に近い敗血症性AKIの安定したげっ歯類のセットアップとして機能します。さらに、記載されたモデルは、改良され、広範囲の in vivo 敗血症研究、例えば、免疫調節不全、内皮破壊、凝固障害、微小循環障害、薬物療法および蘇生25にうまく使用することができる。
開示事項
著者は何も開示していません。
謝辞
M.A. シックとN.シュレーゲルは、ドイツ研究振興協会(DFG)のSCHL 1962/2-1およびSCHL 1962/4-1から資金提供を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Sprague-Dawley rats | Janvier Labs, France | ||
| Isoflurane CP | cp-pharma, Burgdorf, Germany | ||
| polyethylen catheter PE 10; 30m | A. Hartenstein, Wuerzburg, Germany | 0.58x0.96 mm | |
| Swivel (375/D/20) | Instech, Plymouth Meeting, PA, USA | (375/D/20) | |
| plastic button tethers | Instech, Plymouth Meeting, PA, USA | LW105S | |
| Perfusor | B. Braun; Melsungen, Germany | Perfusor fm | |
| suction catheter ch. 10 | B.Braun Melsungen AG, Germany | suction catheter typy „Ideal“; ch. 10 | |
| suture | Syneture; USA | Surgipro; Monofilament Polypropylen 4-0 | |
| suture | Ethicon; Scotland | Prolene; Polypropylen 5-0 | |
| 14G-i.v. catheter | BD Insynte; BD Vialon; Madrid; Spain | 14GA i.v. catheter | |
| cotton buds | NOBA Verbandmittel Danz GmbH u Co KG; Wetter; Germany | ||
| rodent respirator | Hugo Sachs Elektronik KG, Germany | rodent respirator, Type:7025 | |
| Midazolam | Ratiopharm, Germany | Midazolam | |
| Thermodilutioncatheter | ADInstruments, Spechbach, Germany | ||
| p-Aminohippuric acid | Sigma-Aldrich; St. Louis; USA | p-Aminohippuric acid sodium salt; A3759-25G | |
| Inulin | Sigma-Aldrich; St. Louis; USA | Inulin-FITC; F3272-1G | |
| Formaldehyde | Otto Fischar GmbH & CoKG; Saarbrücken, Germany | Formaldehyde 3.5% | |
| Cyclopentan | Merck; Darmstadt; Germany | Uvasol: 2-Methylbutan | |
| alcohol based scrub | Schülke & Mayr GmbH, Norderstedt; Germany | kodan Tinktur forte; 45g 2-Propanol, 10g 1-Propanol per 100g | |
| povidone iodine solution | B.Braun Melsungen AG, Germany | Braunol, 7.5g Povidone Iodine per 100g |
参考文献
- Angus, D. C., et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med. 29, 1303-1310 (2001).
- Dellinger, R. P., et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 41, 580-637 (2013).
- Moerer, O., Quintel, M. [Sepsis in adult patients - definitions, epidemiology and economic aspects]. Internist (Berl). 50, 788-796 (2009).
- Belayev, L. Y., Palevsky, P. M. The link between acute kidney injury and chronic kidney disease. Curr Opin Nephrol Hypertens. 23, 149-154 (2014).
- Chao, C. T., et al. The impact of dialysis-requiring acute kidney injury on long-term prognosis of patients requiring prolonged mechanical ventilation: nationwide population-based study. PLoS One. 7, e50675 (2012).
- Chertow, G. M., Christiansen, C. L., Cleary, P. D., Munro, C., Lazarus, J. M. Prognostic stratification in critically ill patients with acute renal failure requiring dialysis. Arch Intern Med. 155, 1505-1511 (1995).
- Doi, K. Role of kidney injury in sepsis. J Intensive Care. 4, 17 (2016).
- Gomez, H., et al. A unified theory of sepsis-induced acute kidney injury: inflammation, microcirculatory dysfunction, bioenergetics, and the tubular cell adaptation to injury. Shock. 41, 3-11 (2014).
- Deitch, E. A. Animal models of sepsis and shock: a review and lessons learned. Shock. 9, 1-11 (1998).
- Esmon, C. T. Why do animal models (sometimes) fail to mimic human sepsis?. Crit Care Med. 32, S219-S222 (2004).
- Rittirsch, D., Hoesel, L. M., Ward, P. A. The disconnect between animal models of sepsis and human sepsis. J Leukoc Biol. 81, 137-143 (2007).
- Doi, K., Leelahavanichkul, A., Yuen, P. S., Star, R. A. Animal models of sepsis and sepsis-induced kidney injury. J Clin Invest. 119, 2868-2878 (2009).
- Zantl, N., et al. Essential role of gamma interferon in survival of colon ascendens stent peritonitis, a novel murine model of abdominal sepsis. Infect Immun. 66, 2300-2309 (1998).
- Maier, S., et al. Cecal ligation and puncture versus colon ascendens stent peritonitis: two distinct animal models for polymicrobial sepsis. Shock. 21, 505-511 (2004).
- Schick, M. A., et al. Sepsis-induced acute kidney injury by standardized colon ascendens stent peritonitis in rats - a simple, reproducible animal model. Intensive Care Med Exp. 2, (2014).
- Schick, M. A., et al. Effects of crystalloids and colloids on liver and intestine microcirculation and function in cecal ligation and puncture induced septic rodents. BMC Gastroenterol. 12, 179 (2012).
- Schneider, R., et al. Downregulation of organic anion transporters OAT1 and OAT3 correlates with impaired secretion of para-aminohippurate after ischemic acute renal failure in rats. Am J Physiol Renal Physiol. 292, F1599-F1605 (2007).
- Schick, M. A., et al. The impact of crystalloid and colloid infusion on the kidney in rodent sepsis. Intensive Care Med. 36, 541-548 (2010).
- Bellomo, R., Ronco, C., Kellum, J. A., Mehta, R. L., Palevsky, P. Acute renal failure - definition, outcome measures, animal models, fluid therapy and information technology needs the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care. 8, R204-R212 (2004).
- Lustig, M. K., et al. Colon ascendens stent peritonitis--a model of sepsis adopted to the rat: physiological, microcirculatory and laboratory changes. Shock. 28, 59-64 (2007).
- Traeger, T., et al. Colon ascendens stent peritonitis (CASP)--a standardized model for polymicrobial abdominal sepsis. J Vis Exp : JoVE. , (2010).
- Dyson, A., Rudiger, A., Singer, M. Temporal changes in tissue cardiorespiratory function during faecal peritonitis. Intensive Care Med. 37, 1192-1200 (2011).
- Arakelyan, K., et al. Early effects of an x-ray contrast medium on renal T(2) */T(2) MRI as compared to short-term hyperoxia, hypoxia and aortic occlusion in rats. Acta physiol. 208 (2), 202-213 (2013).
- Schick, M. A., et al. Balanced hydroxyethylstarch (HES 130/0.4) impairs kidney function in-vivo without Inflammation. PLoS One. 10 (9), e0137247 (2015).
- Flemming, S., et al. Phosphodiesterase 4 inhibition dose dependently stabilizes microvascular barrier functions and microcirculation in a rodent model of polymicrobial sepsis. Shock. 41, 537-545 (2014).
- Flemming, S., et al. Sphingosine-1-phosphate receptor-1 agonist sew2871 causes severe cardiac side effects and does not improve microvascular barrier breakdown in sepsis. Shock. 49 (1), 71-81 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved