Method Article
大鼠标准化结肠升行支架腹膜炎 - 一种诱导脓毒性急性肾损伤的简单、可行的动物模型
摘要
急性肾损伤 (AKI) 是危重患者的严重并发症,与死亡率增加有关。在这里,我们提出了一种可靠且可重复的 体内 模型来模拟炎症条件下的 AKI,这可能有助于了解脓毒性 AKI 的发病机制。
摘要
脓毒症患者的 AKI 与死亡率增加和不良结局相关,尽管人们付出了重大努力来完善对其病理生理学的理解。在这里,提出了一种 体内模型 ,该模型结合了诱导 AKI 的标准化脓毒症病灶和重症监护 (ICU) 设置,以提供与人类脓毒症相当的先进血流动力学监测和治疗。脓毒症是由标准化结肠升行支架腹膜炎 (sCASP) 诱发的。通过测量血液和尿液样本进行功能检查,并通过评估组织病理学评分进行组织学检查。此外,先进的血流动力学监测和重复血气采样的可能性能够对诱发的脓毒症的严重程度进行差异化分析。
sCASP 方法是一种标准化、可靠且可重复的诱发脓毒性 AKI 的方法。这种设置的优势在于重症监护设置、持续的血流动力学和气体交换监测、低死亡率以及详细分析肾功能和损伤的机会。因此,所描述的方法可作为脓毒性 AKI 实验研究的新标准。
引言
脓毒症仍然是非心脏重症监护病房 (ICU) 的主要死亡原因,死亡率≈ 30 - 50%1,2,3。严重脓毒症和感染性休克的一个标志是急性肾损伤,当它与心脏和呼吸衰竭等远处器官功能障碍有关时,会导致死亡率进一步增加 4,5,6。ICU 患者 AKI 的总发病率从 20% 到 50% 不等7。尽管 AKI 在脓毒症的结局和死亡率方面起着关键作用,但潜在的病理机制仍然知之甚少。
总的来说,有 3 个主要组成部分:炎症、中毒性损伤和血流动力学变化,这些因素会导致 AKI的发展 7。血流动力学变化包括肾血流量 (RBF) 减少和整体或区域肾缺血。在这里,必须考虑到败血症也会由于全身性低血压和/或内皮屏障破坏而导致肾脏微循环受损8。因此,脓毒性 AKI 的研究应始终包括血流动力学监测。最近关于 AKI 的 体内 研究主要使用动物模型,例如肾缺血再灌注损伤或双侧肾切除术。这些研究通常显示缺乏血流动力学监测和重症监护。
对脓毒性 AKI 的潜在新病理机制和疗法的研究需要一个具有明确脓毒症病灶的体内模型、重症监护设置、可预测的结果和器官损伤 9,10,11,12。在这里,我们描述了一种满足上述要求的脓毒性 AKI 的创新啮齿动物模型。脓毒性 AKI 由标准化结肠升起支架腹膜炎 (sCASP) 诱发。使用的 sCASP 模型通过肠道粪便渗漏导致腹部败血症,导致细菌侵袭和多器官衰竭13。已经表明,CASP 后的病理生理变化与人类脓毒症相似,因此 CASP 代表了脓毒症研究中的临床相关模型11,14。
此外,实验方案中建立了包括高级血流动力学监测和 ICU 治疗的重症监护 (ICU) 设置。ICU 设置可实现液体复苏、静脉镇痛应用和重复血气分析。通过测量标准值(如肌酐)以及菊粉和 p-氨基马尿酸 (PAH) 清除率来评估肾功能。实验结束时,收获的组织和器官的病理组织学评分提供了其他信息。诱导脓毒性 AKI 的 sCASP 模型已经得到评估,并揭示了肾脏病理学的新见解15。下面介绍的该方案的进一步应用可能有助于完善对脓毒性 AKI 的理解。
研究方案
所有动物程序均已获得德国 Unterfranken 区实验动物护理和使用委员会的批准,并根据赫尔辛基宣言进行。
1. 手术准备和侵入性监测和持续用药的安装
- 使用精密蒸发器以当地机构动物研究监督机构和/或兽医团队批准的浓度和流速输送的异氟醚麻醉 Sprague-Dawley 大鼠。通过观察呼吸频率(变得更慢和更深)来确认足够的麻醉深度,并验证尾巴/脚趾捏合后是否反应迟钝。用剃须刀剃掉喉咙和腹部。
注意: 呼吸频率的大幅降低可能是麻醉过量的指标,并最终导致呼吸迟缓、低血压和死亡。 - 将大鼠仰卧在加热垫上。在眼睛上涂抹兽医药膏,以免眼睛干燥。根据对大鼠的术中监测和/或当地机构动物研究监督机构和/或兽医团队的建议,使用异氟醚浓度和流速保持适当的麻醉深度。将大鼠仰卧在自动加热垫上。
注意:体温过低和热损伤会影响宏观和微观血流动力学参数,应避免使用以获得可靠的结果。建议使用带有控制机构的加热垫,该加热垫通过灵活的直肠探针与大鼠相连,以将体温维持在生理范围内。 - 用适当的消毒液对颈部和喉咙进行消毒后,用手术刀切开喉咙内侧的皮肤,切开约 2 厘米。转动大鼠,用手术剪刀在枕骨远端约 1 cm 的颈部切开约 1 cm。
- 将大鼠放回仰卧位。用剪刀和棉签轻轻解剖右颈静脉和左颈动脉。从邻近的结构中解剖血管。避免过多的阻力,并通过仔细的伸展动作进一步准备。
注意: 使用预热的无菌盐水,保持血管始终湿润。 - 轻轻地解剖,并以皮下运动从血管到颈部进行扩散运动,以在两个切口之间建立连接。将夹具插入每个成型的隧道中。
- 用 0.9% NaCl 冲洗来自旋转装置的旋转接头和导管。将导管插入不锈钢弹簧中。
注意: 导管在插入前必须用氯化钠冲洗,因为最少的空气应用会导致空气栓塞导致猝死。 - 转动大鼠并使用插入的夹子夹住导管。将导管从颈部滑到喉咙。用塑料纽扣系绳固定在枕骨远端约 1 厘米处,颈部有 6 条奇异缝合线(例如 4/0)。
- 将大鼠再次置于仰卧位。在每个准备好的血管远端和近端铺设约 4 厘米的棉线。用微夹夹住近端动脉,通常用于夹住蛛网膜下腔动脉瘤。或者,离开夹子并通过拧紧其中一根线来停止动脉血流。
- 用手术微剪刀切开动脉,一只手用钩子保持切口开放,另一只手用镊子将动脉导管插入血管。打开夹子或拉出的线,将导管向前推入血管中约 1 厘米,朝向心脏方向,并使用铺设的棉线用手术结固定。
- 在颈静脉上重复步骤 1.8 并离开夹子,因为静脉不像动脉那样坚固。
- 将两根导管在血管中沿直线固定后,用缝合线缝合喉咙上的伤口。
2. sCASP 程序
- 让大鼠保持仰卧位,剃掉腹部并用适当的消毒液对腹部区域进行消毒。
注意: 始终使用无菌技术。 - 用手术剪刀在皮肤上做一个约 2 厘米长的腹部中线切口,然后再次沿白线切开腹膜腔。
- 确定盲肠杆,用棉签轻轻拉出盲肠。
- 在抗肠系膜侧用缝合线 (6/0) [缝合线 1] 刺穿距回盲瓣约 2 cm 的升结肠,并用两个手术结固定。避免任何结肠血管的病变。
- 切掉 1.5 FR 抽吸导管的远端 - 约 10 厘米。用剪刀剪断这段导管,形成一个长度约为 0.5 厘米的矩形皮瓣。准备皮瓣,在皮瓣中间缝合 (6/0) [缝合线 2]。
- 将皮瓣放在 14G 针头上,用固定缝合线 1 的针头刺穿升结肠15。
- 将准备好的塑料管插入针头上方的结肠中。同时轻轻取出针头。放置管子,使皮瓣位于结肠外,管子的其余部分位于结肠内。
- 在塑料管精确定位后,通过缝合结肠壁和手术结,用已经存在的缝合线 2 固定皮瓣。再次避免结肠血管的任何病变。将缝合线 1 的自由端放在通向结肠外的塑料管的其余部分周围,并打 2 个手术结。
- 使用棉签将粪便从盲肠流向结肠支架,直到粪便出现在支架的出口处。
- 将小肠和结肠放回腹腔中。因此,带有粪便的塑料管应与腹膜接触。用 2 mL 0.9% NaCl 冲洗支架,使粪便分配到腹膜腔中。
- 用腹膜的连续缝合 (4/0) 闭合腹腔,然后用皮肤的连续缝合 (4/0) 闭合。
3. 术后流程
- 停止吸入异氟醚,将大鼠放回笼子里。
- 使用芬太尼(2.0 μg/100 g 体重/hr)通过静脉管开始静脉镇痛。
4. 第二天准备测量
- sCASP 手术后 24 小时,静脉内施用 0.5-1.0 mg 咪达唑仑。根据对大鼠的术中监测和/或当地机构动物研究监督机构和/或兽医团队的建议,使用异氟醚浓度和流速保持适当的麻醉深度。
- 再次用酒精和溶液消毒后,用 14 G 静脉插管的塑料管进行气管切开术,以提供足够的氧合和通气。
- 因此,用手术剪刀打开喉咙上的缝合线,从中线到气管轻轻打开。用手术剪刀在两个长度约为 2 毫米的软骨之间垂直切开气管 - 刚好足以插入手术剪刀。用剪刀钝地将切口扩大到气管直径的一半左右。插入 1 厘米的 14 G 塑料管并用 2 根缝合线固定。16
注意: 如果气管切口大于圆周的一半,则沿着气管的血管可能会受到伤害,从而导致严重出血、误血或致命的心动过缓。 - 使用 FiO2 为 0.28 和 0.7 Vol. % 异氟醚的啮齿动物呼吸机开始机械通气,并使用咪达唑仑 (0.7 mg/100 g BW/h) 和芬太尼 (7 μg/100 g BW/h) 开始静脉麻醉。进行血气分析,以确保充足的通气和氧合。因此,通过动脉导管抽取约 0.7 mL 血液,并用血气分析仪测量。
注意: 只有在建立机械控制通气后,才应开始静脉麻醉。
- 因此,用手术剪刀打开喉咙上的缝合线,从中线到气管轻轻打开。用手术剪刀在两个长度约为 2 毫米的软骨之间垂直切开气管 - 刚好足以插入手术剪刀。用剪刀钝地将切口扩大到气管直径的一半左右。插入 1 厘米的 14 G 塑料管并用 2 根缝合线固定。16
- 以与 2.1 类似的方式剃须和消毒后,在膝盖近端 0.5 厘米处对右腿皮肤进行 1 厘米的纵向切口。使用手术剪刀和棉签钝地从邻近结构中解剖动脉。
注意: 如果股动脉撕裂,仍然可以在近端位置插入导管。因此,建议在尽可能远的地方开始植入。 - 用钩子打开动脉并用镊子插入导管,将热稀释导管插入股动脉。
- 开始通过热稀释法测量心输出量。因此,在开始测量心脏指数测量软件后,通过静脉导管手动快速注入 1 mL 冷却的 NaCl。执行此测量两次。
5. 肾功能评估
- 用剪刀打开皮肤和腹膜的缝合线进行剖腹手术。用手术剪刀切开膀胱,刚好足以用小塑料导管插入膀胱。在膀胱周围铺设约 7 厘米的棉线后,系紧棉线,打结固定导管,最后通过导管收集尽可能多的尿液。
- 将荧光素 - 异硫氰酸酯 - 菊粉 (FITC-菊粉) 溶解在 0.9% NaCl 中,将对氨基马尿酸钠盐 (PAH) 溶解在 0.9% NaCl 中,得到 2 mg/mL 菊粉、5 mg/mL PAH 的浓度。
- 静脉注射 75 μL 两种物质的混合物,然后以 3.7 μL/h/300 g BW 的速度持续静脉输注两种物质。
- 在达到稳态17 后,输注 FITC-菊粉和 PAH 收集尿液 20 分钟。按照 4.2.1 中关于进行血气分析的说明,通过动脉导管采集血样。
- 通过荧光光谱法测定尿液和血浆的菊粉浓度,并使用蒽酮法通过光光谱法测量 PAH17。
6. 实验结束
- 根据当地法律法规对动物实施安乐死。
- 使用注射器通过动脉导管抽出尽可能多的血液。
- 通过剪断十二指肠和结肠的腹膜固定来收获小肠和大肠,用手术剪刀取出其中的一些部分。通过准备腹膜后来准备和收获肾脏,并释放它们的脂肪囊并切开输尿管和连接的血管。进行开胸手术并切除肺和心脏。将所有器官固定在甲醛中,并按照以前发表的方式进行组织学染色。15,18 元
结果
正如 Schick 等人之前发表的那样8,我们展示了以下结果。
诱导脓毒症,无死亡
在 CASP 模型中,脓毒症是由结肠腔内细菌持续渗漏升入腹腔引起的,导致粪便腹膜炎和菌血症。因此,植入导管的大小决定了粪便的排出量,从而调节了腹膜炎和败血症的严重程度。在上面介绍的实验方案中,使用 14G 针头与专门制备的 10 FR 抽吸导管的尖端相结合,以引起足够的腹膜炎。较小的导管仅引起伴有局部炎症的脓肿,因为精囊大部分堵塞了较小的支架并阻止了持续的粪便排出。
对照和 sCASP 动物在实验中存活下来,但在 sCASP 组中,需要液体复苏以维持平均动脉压 (MAP) ≥ 70 mmHg。sCASP 处理的动物显示普遍存在的粪便腹膜炎,没有脓肿形成,并表现出严重败血症的临床体征,表现为活动减少、警觉性降低、皮毛褶皱和驼背姿势。这种临床状态随着时间的推移不断恶化。
与对照动物相比,液体复苏的 sCASP 大鼠在 MAP 和心率方面表现出显着差异,但在心输出量方面没有差异(图 1)。24 小时后的血液分析显示,与对照相比,sCASP 处理的动物出现脓毒症迹象,乳酸增加,IL-6 增加,这些动物出现典型的白细胞减少症(图 1)。
脓毒症诱导的 AKI 的测定
与对照相比,24 小时后 sCASP 动物的菊粉清除率(被描述为评估肾功能的金标准)显着降低(图 2 A)。此外,sCASP 动物的尿量 (图 1) 和 PAH 清除率显着降低 (图 2 B)。与对照组相比,脓毒症患者的 NGAL (图 2 C) 和胱抑素 C (图 2 D) 增加。AKI 的标准参数(如尿素和肌酐)通过血清中测量的这两个参数水平升高来证实 sCASP 组的肾功能受损(图 2、E 和 F)。
sCASP 组的急性肾损伤不仅由功能参数决定,还由增加的组织病理损伤评分决定 (图3)。该评分基于形态学改变,包括水肿的形成、细胞水肿、肾小管上皮与基底膜的脱离、近端肾小管细胞刷状边界的缺失、细胞死亡和空泡化。sCASP 组显示脓毒症诱导后 24 小时肾脏组织病理评分升高,其中间质水肿和肾小管刷状缘受损是与对照动物相比评分较高的主要因素(图 3)。此外,sCASP 动物的死细胞率和分离的基底膜事件显着增加(图 3)。
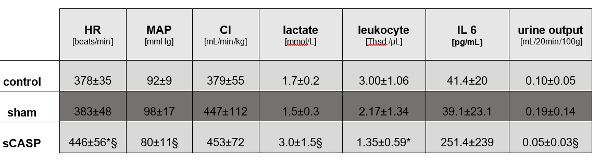
图 1:宏观血流动力学和脓毒症参数。 以下值证实 sCASP 手术动物存在脓毒症:心率 (HR)、平均动脉压 (MAP)、心脏指数 (CI)、乳酸、白细胞、白细胞介素 6 (IL 6) 和尿量。* P<0.05 vs. 对照,§ p<0.05 vs. 假手术。数据已由 Schick 等人在 ICMex 上发表15 请单击此处查看此图的较大版本。
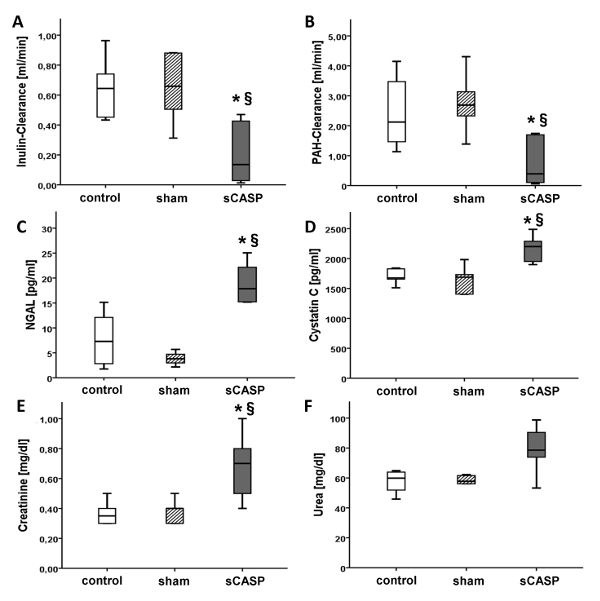
图 2:肾功能参数。 参数菊粉 - (A) 和 PAH- 清除率 (B) [mL/min],被描述为测量肾功能的金标准,在 sCASP 组中显着降低。相比之下,NGAL (C) 和胱抑素 C (D) [pg/mL] 升高是脓毒性 AKI 的进一步体征。肌酐 (E) 和尿素 (F) [mg/dL] 等临床标准参数在脓毒症动物中的水平也升高。* 第 < 0.05 对对照组,§ 第 <0.05 对假。数据已由 Schick 等人在 ICMex 上发表15 请单击此处查看此图的较大版本。

图 3:组织学损伤评分。 显示对照、假和 sCASP 在间质水肿、近端肾小管细胞刷状边界丢失、细胞死亡和总损伤评分方面的差异。条形显示平均值±标准差。* 第 < 0.05 对对照组,§ 第 <0.05 对假。 请单击此处查看此图的较大版本。
讨论
脓毒性 AKI 的病理生理学复杂性仍然未知。患者的临床研究和试验不会获得有关细胞水平组织病理学变化、微循环障碍或药物相互作用的新见解15。之前已经假设需要改进的和新的动物模型来研究与败血症相关的急性肾损伤19。因此,我们建立了结肠升行支架腹膜炎诱导的脓毒性 AKI 的新动物模型。
CASP 模型提出了一个临床相关模型,用于模拟以手术患者粪便腹膜炎为起点的人类脓毒症。CASP 的主要优点是它不会像广泛使用的 CLP 模型那样以缺血性打击开始,其中进行盲肠结扎14。此外,Maier 等人表明,CLP 模型代表腹腔内脓肿情况,而不是普遍存在的伴有全身性菌血症的腹膜炎14。通过使用植入结肠升升处的不同尺寸的支架,脓毒症的严重程度和存活率会受到影响,如以前的出版物 13,14,20 所示。为避免支架被网膜或精囊堵塞,插入了直径为 10 FR 的改良支架15。在上述动物模型中,仅使用雄性大鼠来排除激素变异,而不是像 Zantl 等人和 Traeger 等人的原始 CASP 模型那样使用雌性动物13,21。
必须考虑到,即使在以标准化方式进行上述实验设置后,也可能根据不同的小鼠品系、动物设施、性别和作员而发生变异性。因此,可能需要调整支架的大小,从而调整腹膜炎和败血症的严重程度。此外,建议同一作员在同一天同时执行 sCASP 和控制,以减少可变性。
脓毒症22 中,低血压或呼吸衰竭伴 PaO2 降低引起的缺氧和缺血可发生急性肾损伤。血流动力学和代谢条件的变化导致组织缺氧,从而影响肾脏完整性,并可能影响发病率和死亡率23。因此,应在用于研究脓毒性 AKI 的体内模型中提供对血流动力学和呼吸值的连续评估。在这里,我们提出了一个体内模型,其特征是 ICU 设置与患者 24,25,26 相当。它能够连续测量血流动力学值,例如心率和动脉血压,并通过采集血液进行血气分析来评估呼吸状态。此外,通过持续监测获得的这些数据对于液体复苏和麻醉方案的调整是必要的和有帮助的。
只有在实验结束时才能通过测量菊粉和 PAH 清除率来评估肾功能,因为需要重新剖腹手术和切开尿囊。如果需要在实验期间检查肾功能,可以采集血样来测量标准参数,例如肌酐和尿素。因此,必须考虑应进行液体补充以避免因低血容量引起的肾前性衰竭。
该模型的目的是建立具有临床相关性的脓毒性 AKI 的稳定啮齿动物设置,以便进一步研究肾功能衰竭的病理生理学和治疗。该模型还可用于研究腹部败血症和脓毒性 AKI 的不同治疗策略。因此,该模型可以作为接近重症监护病房临床环境的脓毒性 AKI 的稳定啮齿动物设置。此外,所描述的模型可以修改并成功用于广泛的 体内 脓毒症研究,例如 免疫失调、内皮分解、凝血病、微循环障碍、药物治疗和复苏25。
披露声明
作者没有什么可披露的。
致谢
M.A. Schick 和 N. Schlegel 获得了德国研究中心 (DFG) SCHL 1962/2-1 和 SCHL 1962/4-1 的资助。
材料
| Name | Company | Catalog Number | Comments |
| Sprague-Dawley rats | Janvier Labs, France | ||
| Isoflurane CP | cp-pharma, Burgdorf, Germany | ||
| polyethylen catheter PE 10; 30m | A. Hartenstein, Wuerzburg, Germany | 0.58x0.96 mm | |
| Swivel (375/D/20) | Instech, Plymouth Meeting, PA, USA | (375/D/20) | |
| plastic button tethers | Instech, Plymouth Meeting, PA, USA | LW105S | |
| Perfusor | B. Braun; Melsungen, Germany | Perfusor fm | |
| suction catheter ch. 10 | B.Braun Melsungen AG, Germany | suction catheter typy „Ideal“; ch. 10 | |
| suture | Syneture; USA | Surgipro; Monofilament Polypropylen 4-0 | |
| suture | Ethicon; Scotland | Prolene; Polypropylen 5-0 | |
| 14G-i.v. catheter | BD Insynte; BD Vialon; Madrid; Spain | 14GA i.v. catheter | |
| cotton buds | NOBA Verbandmittel Danz GmbH u Co KG; Wetter; Germany | ||
| rodent respirator | Hugo Sachs Elektronik KG, Germany | rodent respirator, Type:7025 | |
| Midazolam | Ratiopharm, Germany | Midazolam | |
| Thermodilutioncatheter | ADInstruments, Spechbach, Germany | ||
| p-Aminohippuric acid | Sigma-Aldrich; St. Louis; USA | p-Aminohippuric acid sodium salt; A3759-25G | |
| Inulin | Sigma-Aldrich; St. Louis; USA | Inulin-FITC; F3272-1G | |
| Formaldehyde | Otto Fischar GmbH & CoKG; Saarbrücken, Germany | Formaldehyde 3.5% | |
| Cyclopentan | Merck; Darmstadt; Germany | Uvasol: 2-Methylbutan | |
| alcohol based scrub | Schülke & Mayr GmbH, Norderstedt; Germany | kodan Tinktur forte; 45g 2-Propanol, 10g 1-Propanol per 100g | |
| povidone iodine solution | B.Braun Melsungen AG, Germany | Braunol, 7.5g Povidone Iodine per 100g |
参考文献
- Angus, D. C., et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med. 29, 1303-1310 (2001).
- Dellinger, R. P., et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 41, 580-637 (2013).
- Moerer, O., Quintel, M. [Sepsis in adult patients - definitions, epidemiology and economic aspects]. Internist (Berl). 50, 788-796 (2009).
- Belayev, L. Y., Palevsky, P. M. The link between acute kidney injury and chronic kidney disease. Curr Opin Nephrol Hypertens. 23, 149-154 (2014).
- Chao, C. T., et al. The impact of dialysis-requiring acute kidney injury on long-term prognosis of patients requiring prolonged mechanical ventilation: nationwide population-based study. PLoS One. 7, e50675 (2012).
- Chertow, G. M., Christiansen, C. L., Cleary, P. D., Munro, C., Lazarus, J. M. Prognostic stratification in critically ill patients with acute renal failure requiring dialysis. Arch Intern Med. 155, 1505-1511 (1995).
- Doi, K. Role of kidney injury in sepsis. J Intensive Care. 4, 17 (2016).
- Gomez, H., et al. A unified theory of sepsis-induced acute kidney injury: inflammation, microcirculatory dysfunction, bioenergetics, and the tubular cell adaptation to injury. Shock. 41, 3-11 (2014).
- Deitch, E. A. Animal models of sepsis and shock: a review and lessons learned. Shock. 9, 1-11 (1998).
- Esmon, C. T. Why do animal models (sometimes) fail to mimic human sepsis?. Crit Care Med. 32, S219-S222 (2004).
- Rittirsch, D., Hoesel, L. M., Ward, P. A. The disconnect between animal models of sepsis and human sepsis. J Leukoc Biol. 81, 137-143 (2007).
- Doi, K., Leelahavanichkul, A., Yuen, P. S., Star, R. A. Animal models of sepsis and sepsis-induced kidney injury. J Clin Invest. 119, 2868-2878 (2009).
- Zantl, N., et al. Essential role of gamma interferon in survival of colon ascendens stent peritonitis, a novel murine model of abdominal sepsis. Infect Immun. 66, 2300-2309 (1998).
- Maier, S., et al. Cecal ligation and puncture versus colon ascendens stent peritonitis: two distinct animal models for polymicrobial sepsis. Shock. 21, 505-511 (2004).
- Schick, M. A., et al. Sepsis-induced acute kidney injury by standardized colon ascendens stent peritonitis in rats - a simple, reproducible animal model. Intensive Care Med Exp. 2, (2014).
- Schick, M. A., et al. Effects of crystalloids and colloids on liver and intestine microcirculation and function in cecal ligation and puncture induced septic rodents. BMC Gastroenterol. 12, 179 (2012).
- Schneider, R., et al. Downregulation of organic anion transporters OAT1 and OAT3 correlates with impaired secretion of para-aminohippurate after ischemic acute renal failure in rats. Am J Physiol Renal Physiol. 292, F1599-F1605 (2007).
- Schick, M. A., et al. The impact of crystalloid and colloid infusion on the kidney in rodent sepsis. Intensive Care Med. 36, 541-548 (2010).
- Bellomo, R., Ronco, C., Kellum, J. A., Mehta, R. L., Palevsky, P. Acute renal failure - definition, outcome measures, animal models, fluid therapy and information technology needs the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care. 8, R204-R212 (2004).
- Lustig, M. K., et al. Colon ascendens stent peritonitis--a model of sepsis adopted to the rat: physiological, microcirculatory and laboratory changes. Shock. 28, 59-64 (2007).
- Traeger, T., et al. Colon ascendens stent peritonitis (CASP)--a standardized model for polymicrobial abdominal sepsis. J Vis Exp : JoVE. , (2010).
- Dyson, A., Rudiger, A., Singer, M. Temporal changes in tissue cardiorespiratory function during faecal peritonitis. Intensive Care Med. 37, 1192-1200 (2011).
- Arakelyan, K., et al. Early effects of an x-ray contrast medium on renal T(2) */T(2) MRI as compared to short-term hyperoxia, hypoxia and aortic occlusion in rats. Acta physiol. 208 (2), 202-213 (2013).
- Schick, M. A., et al. Balanced hydroxyethylstarch (HES 130/0.4) impairs kidney function in-vivo without Inflammation. PLoS One. 10 (9), e0137247 (2015).
- Flemming, S., et al. Phosphodiesterase 4 inhibition dose dependently stabilizes microvascular barrier functions and microcirculation in a rodent model of polymicrobial sepsis. Shock. 41, 537-545 (2014).
- Flemming, S., et al. Sphingosine-1-phosphate receptor-1 agonist sew2871 causes severe cardiac side effects and does not improve microvascular barrier breakdown in sepsis. Shock. 49 (1), 71-81 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。