Method Article
القولون القياسي يصعد التهاب الصفاق في الفئران - نموذج حيواني بسيط وممكن للحث على إصابة الكلى الحادة الإنتانية
In This Article
Summary
إصابة الكلى الحادة (AKI) هي من المضاعفات الشديدة لدى المرضى المصابين بأمراض خطيرة وترتبط بزيادة معدل الوفيات. هنا ، نقدم نموذجا موثوقا به وقابلا للتكرار في الجسم الحي لتقليد AKI في ظل الظروف الالتهابية التي قد تساهم في فهم التسبب في AKI الإنتاني.
Abstract
يرتبط AKI في مرضى الإنتان بزيادة معدل الوفيات والنتائج السيئة على الرغم من الجهود الكبيرة لتحسين فهم الفيزيولوجيا المرضية. هنا ، يتم تقديم نموذج في الجسم الحي يجمع بين تركيز الإنتان القياسي للحث على AKI وإعداد العناية المركزة (ICU) لتوفير مراقبة وعلاج ديناميكي دموي متقدم يمكن مقارنته بالإنتان البشري. يحدث الإنتان بسبب التهاب الصفاق الدعامات الصاعد المعياري للقولون (sCASP). يتم فحص AKI وظيفيا عن طريق قياس عينات الدم والبول وكذلك من الناحية النسيجية عن طريق تقييم الدرجات النسيجية المرضية. علاوة على ذلك ، فإن المراقبة الديناميكية الدموية المتقدمة وإمكانية أخذ عينات غازات الدم المتكررة تتيح تحليلا متباينا لشدة الإنتان المستحث.
طريقة sCASP هي طريقة موحدة وموثوقة وقابلة للتكرار للحث على AKI الإنتاني. يعد إعداد العناية المركزة ، والمراقبة المستمرة لديناميكية الدم وتبادل الغازات ، ومعدل الوفيات المنخفض ، بالإضافة إلى فرصة إجراء تحليلات مفصلة لوظائف الكلى وضعف الكلى من مزايا هذا الإعداد. لذلك ، قد تكون الطريقة الموصوفة بمثابة معيار جديد للتحقيقات التجريبية ل AKI الإنتاني.
Introduction
لا يزال الإنتان هو السبب الرئيسي للوفاة في وحدات العناية المركزة غير القلبية (ICU) بمعدلات وفيات تتراوح بين 30 ≈ و 50٪ 1،2،3. السمة المميزة للتعفن الشديد والصدمة الإنتانية هي إصابة الكلى الحادة التي تسبب زيادة أخرى في معدل الوفيات عندما تترافق مع خلل وظيفي في الأعضاء البعيدة مثل فشل القلب والجهاز التنفسي4،5،6. يتراوح معدل الإصابة الإجمالي ل AKI في مرضى وحدة العناية المركزة من 20 إلى 50٪ 7. على الرغم من الدور المحوري ل AKI فيما يتعلق بالنتائج والوفيات في الإنتان ، إلا أن الآلية المرضية الأساسية لا تزال غير مفهومة جيدا.
بشكل عام ، هناك 3 مكونات رئيسية: الالتهاب ، والإصابة السامة ، والتغيرات الديناميكية الدموية التي تساهم في تطوير AKI7. تشمل التغيرات الديناميكية الدموية انخفاض تدفق الدم الكلوي (RBF) ونقص التروية الكلوي العالمي أو الإقليمي. هنا ، يجب مراعاة أن الإنتان يمكن أن يسبب أيضا ضعفا في دوران الأوعية الدقيقة الكلوي بسبب انخفاض ضغط الدم الجهازي و / أو اضطراب الحاجز البطاني8. لذلك ، يجب أن تتضمن دراسة AKI الإنتاني دائما مراقبة ديناميكية الدم. استخدمت الدراسات الحديثة في الجسم الحي حول AKI في الغالب نماذج حيوانية مثل إصابة نقص التروية الكلوي أو استئصال الكلية الثنائي. أظهرت هذه الدراسات عادة نقصا في مراقبة ديناميكية الدم والعناية المركزة.
يتطلب التحقيق في الآليات المرضية والعلاجات الجديدة المحتملة ل AKI الإنتاني نموذجا في الجسم الحي مع تركيز إنتاني محدد ، وإعداد عناية مركزة ، ونتيجة يمكن التنبؤ بها وإصابة في الأعضاء9،10،11،12. هنا ، نصف نموذج القوارض المبتكر ل AKI للصرف الصحي الذي يلبي المتطلبات المذكورة سابقا. يحدث AKI الإنتاني عن طريق التهاب الصفاق الصاعد المعياري للقولون (sCASP). يتسبب نموذج sCASP المستخدم في تعفن الدم البطني عن طريق تسرب البراز المعوي مما يؤدي إلى غزو بكتيري وفشل متعدد الأعضاء13. لقد ثبت أن التغيرات الفيزيولوجية المرضية بعد CASP تشبه تلك الموجودة في الإنتان البشري ، وبالتالي يمثل CASP نموذجا ذا صلة سريريا في أبحاث الإنتان11،14.
علاوة على ذلك ، تم إنشاء إعداد العناية المركزة (ICU) الذي يشتمل على مراقبة ديناميكية الدم المتقدمة وعلاج وحدة العناية المركزة في البروتوكول التجريبي. يتيح إعداد وحدة العناية المركزة إنعاش السوائل وتطبيق التسكين عن طريق الوريد وتحليل غازات الدم المتكرر. يتم تقييم وظائف الكلى عن طريق قياس القيم القياسية مثل الكرياتينين وإزالة الأنسولين وحمض الأمينوهيبوريك (PAH). يتم تقديم معلومات إضافية عن طريق الدرجات المرضية للأنسجة والأعضاء المحصودة في نهاية التجربة. تم بالفعل تقييم نموذج sCASP للحث على AKI الإنتاني وكشف عن رؤى جديدة في علم أمراض الكلى15. قد يساعد التطبيق الإضافي لهذا البروتوكول المعروض أدناه في تحسين فهم AKI الإنتاني.
Protocol
تمت الموافقة على جميع الإجراءات الحيوانية من قبل لجنة رعاية واستخدام المختبر في مقاطعة Unterfranken بألمانيا وتم تنفيذها وفقا لإعلان هلسنكي.
1. التحضير الجراحي وتركيب المراقبة الغازية والأدوية المستمرة
- تخدير فئران Sprague-Dawley باستخدام الأيزوفلوران الذي يتم تسليمه بواسطة مبخر دقيق بتركيز ومعدل تدفق معتمد من قبل هيئة الإشراف على أبحاث في المؤسسة المحلية و / أو الفريق البيطري. تأكد من عمق التخدير الكافي من خلال مراقبة معدل التنفس ، الذي يصبح أبطأ وأعمق ، وتحقق من عدم الاستجابة بعد قرص الذيل / إصبع القدم. احلق الحلق والمعدة بشفرة حلاقة.
ملاحظه: يمكن أن يكون الانخفاض الهائل في معدل التنفس مؤشرا على جرعة زائدة من التخدير ويؤدي إلى بطء الدم وانخفاض ضغط الدم والوفاة في النهاية. - ضع الجرذ في وضع ضعيف على وسادة تدفئة. ضع مرهما بيطري على العينين لتجنب جفاف العينين. الحفاظ على عمق التخدير المناسب باستخدام تركيز الأيزوفلوران ومعدل التدفق بناء على المراقبة أثناء الجراحة للفئران و / أو توصيات هيئة الإشراف على أبحاث في المؤسسة المحلية و / أو الفريق البيطري. ضع الجرذ في وضع ضعيف على وسادة تسخين آلية.
ملاحظة: يؤثر انخفاض حرارة الجسم والإصابة الحرارية على المعلمات الديناميكية الدقيقة والدقيقة ويجب تجنبها للحصول على نتيجة موثوقة. يوصى باستخدام وسادة تسخين مزودة بآلية تحكم مرتبطة بالجرذ من خلال مسبار مستقيمي مرن للحفاظ على درجة حرارة الجسم في النطاق الفسيولوجي. - بعد تطهير الرقبة والحلق بمحلول التطهير المناسب ، قم بشق الجلد على الحلق الإنسي بمشرط وقم بعمل شق بحوالي 2 سم. اقلب الجرذ وقم بإجراء شق بطول حوالي 1 سم بمقص جراحي على الرقبة على بعد حوالي 1 سم من القفف.
- ضع الجرذ مرة أخرى في وضع ضعيف. قم بتشريح الوريد الوداجي الأيمن والشريان السباتي الأيسر برفق بالمقص وبراعم القطن. تشريح الأوعية من الهياكل المجاورة. تجنب الكثير من السحب واستعد أكثر بحركات انتشار دقيقة.
ملاحظه: حافظ على رطوبة الأوعية دائما عن طريق استخدام محلول ملحي معقم مسخن مسبقا. - قم بالتشريح برفق وبحركات منتشرة تحت الجلد من الأوعية إلى الرقبة للحصول على اتصال بين الشقين. أدخل المشابك في كل نفق مشكل.
- اغسل القطب والقسطرة القادمة من الجهاز الدوار بنسبة 0.9٪ كلوريد الصوديوم. أدخل القسطرة في زنبرك من الفولاذ المقاوم للصدأ.
ملاحظه: يجب شطف القسطرة بكلوريد الصوديوم قبل إدخالها ، حيث يمكن أن يؤدي الحد الأدنى من استخدام الهواء إلى الموت المفاجئ بسبب انسداد الهواء. - اقلب الجرذ وقم بتثبيت القسطرة باستخدام المشابك المدخلة. حرك القسطرة من الرقبة إلى الحلق. ثبت الزنبرك بحبل زر بلاستيكي على بعد حوالي 1 سم من القفا مع 6 خيوط مفردة (على سبيل المثال 4/0) على الرقبة.
- ضع الجرذ مرة أخرى في وضع ضعيف. ضع خيوط قطنية بطول حوالي 4 سم بعيدة وقريبة من كل وعاء معد. قص الشريان القريب بمشبك صغير، يستخدم عادة لقص تمدد الأوعية الدموية تحت العنكبوتية. بدلا من ذلك ، اترك المشبك وأوقف تدفق الدم الشرياني عن طريق شد أحد الخيوط.
- شق الشريان بمقص دقيق جراحي ، وإبقاء الشق مفتوحا بخطاف في يد وأدخل القسطرة الشريانية في الوعاء باستخدام الملقط باليد الأخرى. افتح المشبك أو الخيط المسحوب ، وادفع القسطرة حوالي 1 سم للأمام في الوعاء باتجاه القلب وثبته بعقد جراحية باستخدام خيوط القطن الموضوعة.
- كرر الخطوة 1.8 على الوريد الوداجي واترك المشبك ، لأن الوريد ليس صلبا مثل الشريان.
- بعد تثبيت كلا القسطرة في خط مستقيم في الأوعية الدموية ، أغلق الجرح على الحلق بالغرز.
2. إجراء sCASP
- حافظ على الفئران في وضع ضعيف ، واحلق البطن وقم بتطهير منطقة البطن بمحاليل التطهير المناسبة.
ملاحظه: استخدم دائما تقنية التعقيم. - قم بإجراء شق خط الوسط البطني للجلد بطول حوالي 2 سم بمقص جراحي وبعد ذلك مرة أخرى على طول الخط البريتوني لفتح الكهف البريتوني.
- حدد عمود الرأس واسحب الرأس برفق باستخدام براعم القطن.
- ثقب القولون الصاعد على بعد حوالي 2 سم من الصمام اللفائفي بخياطة (6/0) [خياطة 1] في الجانب المضاد للمساريقي وثبته بعقدتين جراحيتين. تجنب آفات أي أوعية قولونية.
- قطع الطرف البعيد - حوالي 1.5 سم - من قسطرة شفط 10 FR. اقطع هذه القطعة من القسطرة بالمقص لتشكيل رفرف مستطيل بطول حوالي 0.5 سم. تحضير الغطاء بخياطة (6/0) [خياطة 2] في منتصف السديلة.
- ضع الغطاء فوق إبرة 14G وثقب القولون الصاعد بالإبرة حيث تم تثبيت الخياطة 115.
- أدخل الأنبوب البلاستيكي المحضر في القولون فوق الإبرة. قم بإزالة الإبرة برفق في نفس الوقت. ضع الأنبوب بحيث يوضع السديلة خارج القولون وبقية الأنبوب داخل القولون.
- بعد تحديد الموضع الدقيق للأنبوب البلاستيكي ، قم بتثبيت السديلة بالخياطة الموجودة بالفعل 2 عن طريق خياطة جدار القولون والعقد الجراحية. تجنب مرة أخرى أي آفة في أوعية القولون. ضع الأطراف الحرة للخياطة 1 حول بقية الأنبوب البلاستيكي الذي يؤدي إلى خارج القولون وقم بإجراء عقدتين جراحيتين.
- براز الحليب من القي باتجاه دعامة القولون باستخدام أعواد القطن حتى يظهر البراز عند مخرج الدعامة.
- ضع الأمعاء الدقيقة والقولون مرة أخرى في كهف البطن. بموجب هذا ، يجب أن يكون الأنبوب البلاستيكي مع البراز على اتصال مع الصفاق. اغسل الدعامة ب 2 مل 0.9٪ كلوريد الصوديوم لتوزيع البراز في الكهف البريتوني.
- أغلق الكهف البطني بخياطة مستمرة (4/0) من الصفاق وبعد ذلك بخياطة مستمرة (4/0) من الجلد.
3. إجراءات ما بعد الجراحة
- أوقف استنشاق الأيزوفلوران وأعد الفئران إلى قفصه.
- ابدأ التسكين الوريدي عن طريق الخط الوريدي باستخدام الفنتانيل (2.0 ميكروغرام / 100 جم من وزن الجسم / ساعة).
4. تحضير القياسات في اليوم الثاني
- بعد 24 ساعة من إجراء sCASP ، ضع 0.5-1.0 مجم ميدازولام عن طريق الوريد. الحفاظ على عمق التخدير المناسب باستخدام تركيز الأيزوفلوران ومعدل التدفق بناء على المراقبة أثناء الجراحة للفئران و / أو توصيات هيئة الإشراف على أبحاث في المؤسسة المحلية و / أو الفريق البيطري.
- بعد تطهيرها بالكحول والمحلول مرة أخرى ، قم بإجراء بضع القصبة الهوائية باستخدام الأنبوب البلاستيكي للقنية الوريدية 14 جم لتوفير الأكسجين والتهوية الكافية.
- لذلك ، افتح الخيط على الحلق بمقص جراحي وافتحه برفق من خط الوسط إلى القصبة الهوائية. شق القصبة الهوائية عموديا بين غضروفين بطول حوالي 2 مم بمقص جراحي - يكفي فقط لإدخال مقص جراحي. قم بتوسيع الشق بصراحة إلى حوالي نصف قطر القصبة الهوائية بالمقص. أدخل 1 سم من أنبوب بلاستيكي 14 جم وثبته ب 2 خيوط. 16
ملاحظه: إذا كان شق القصبة الهوائية أكبر من نصف محيط القصبة الهوائية ، فقد تتضرر الأوعية التي تسير بجانب القصبة الهوائية مما يؤدي إلى نزيف شديد أو شفط الدم أو بطء القلب المميت. - بدء التهوية الميكانيكية باستخدام جهاز التنفس الصناعي للقوارض بدرجة FiO2 من 0.28 و 0.7 Vol. ٪ إيزوفلوران والبدء في التخدير الوريدي بالميدازولام (0.7 ملغم/100 جم وزن بي/ساعة) والفنتانيل (7 ميكروغرام/100 جم وزن بي/ساعة). إجراء تحاليل غازات الدم لضمان التهوية والأكسجين الكافيين. لذلك ، اسحب حوالي 0.7 مل من الدم عبر القسطرة الشريانية وقم بقياسه باستخدام محلل غازات الدم.
ملاحظه: يجب أن يبدأ التخدير في الوريد فقط إذا تم إنشاء تهوية يتم التحكم فيها ميكانيكيا.
- لذلك ، افتح الخيط على الحلق بمقص جراحي وافتحه برفق من خط الوسط إلى القصبة الهوائية. شق القصبة الهوائية عموديا بين غضروفين بطول حوالي 2 مم بمقص جراحي - يكفي فقط لإدخال مقص جراحي. قم بتوسيع الشق بصراحة إلى حوالي نصف قطر القصبة الهوائية بالمقص. أدخل 1 سم من أنبوب بلاستيكي 14 جم وثبته ب 2 خيوط. 16
- بعد الحلاقة والتطهير بطريقة مماثلة كما في 2.1 ، قم بإجراء شق طولي بطول 1 سم في جلد الساق اليمنى 0.5 سم بالقرب من الركبة. قم بتشريح الشريان من الهياكل المجاورة باستخدام المقص الجراحي وبراعم القطن بصراحة.
ملاحظه: إذا تمزق الشريان الفخذي ، فلا يزال من الممكن إدخال القسطرة في الوضع القريب. وبالتالي ، يوصى ببدء الزرع بعيدا قدر الإمكان. - أدخل قسطرة التخفيف الحراري في الشريان الفخذي عن طريق فتح الشريان بخطاف وإدخال القسطرة بالملقط.
- ابدأ في قياس النتاج القلبي بطريقة التخفيف الحراري. لذلك ، قم بغرس 1 مل من كلوريد الصوديوم المبرد يدويا بسرعة عبر القسطرة الوريدية بعد البدء في قياس برنامج قياس مؤشر القلب. قم بإجراء هذا القياس مرتين.
5. تقييم وظائف الكلى
- قم بإجراء شق البطن عن طريق فتح خيوط الجلد والصفاق بالمقص. شق المثانة البولية بمقص جراحي يكفي لقسطرة باستخدام قسطرة بلاستيكية صغيرة. بعد وضع خيط قطني يبلغ طوله حوالي 7 سم حول المثانة ، اربط الخيط ، وقم بتثبيت القسطرة بعقدة ، وأخيرا اجمع أكبر قدر ممكن من البول عبر القسطرة.
- قم بإذابة الفلوريسئين - إيزوثيوسيانات - إينولين (FITC-Inulin) في 0.9٪ كلوريد الصوديوم وحمض الأمينوهيبوريك (PAH) في 0.9٪ كلوريد الصوديوم للحصول على تركيزات 2 مجم / مل من الأنسولين ، 5 مجم / مل من الهيدروكربونات العطرية متعددة الحلقات (PAH).
- ضع بلعة من خليط من كلتا المادتين 75 ميكرولتر من الوريد ، متبوعا بالتسريب الوريدي المستمر لكلتا المادتين بمعدل 3.7 ميكرولتر / ساعة / 300 جم وزن الجسم.
- بعد الوصول إلى حالة مستقرة17 مع ضخ FITC-Inulin و PAH جمع البول لمدة 20 دقيقة. أخذ عينات الدم عن طريق القسطرة الشريانية كما هو موضح في 4.2.1 فيما يتعلق بإجراء تحليل غازات الدم.
- تحديد تركيزات الأنسولين في البول والبلازما عن طريق قياس الطيف الفلوري وقياس الهيدروكربونات العطرية متعددة الحلقات عن طريق قياس الطيف الضوئي باستخدام طريقة العرش17.
6. إنهاء التجارب
- القتل الرحيم للحيوان وفقا للوائح القانونية المحلية.
- سحب أكبر قدر ممكن من الدم عن طريق القسطرة الشريانية باستخدام المحاقن.
- حصاد الأمعاء الدقيقة والغليظة عن طريق قطع التثبيت البريتوني للاثني عشر والقولون ، وإخراج بعض أجزاء هذه باستخدام المقص الجراحي. تحضير وحصاد الكلى عن طريق تحضير خلف الصفاق وتحريرها من كبسولاتها الدهنية وقطع الحالب والأوعية المرفقة. إجراء بضع الصدر وقطع الرئتين والقلب. إصلاح جميع الأعضاء في الفورمالديهايد وإجراء البقع النسيجية كما تم نشرها سابقا. 15,18
النتائج
كما نشره سابقا Schick et al.8 ، نوضح النتائج التالية.
تحريض الإنتان دون وفيات
في نموذج CASP ، يحدث الإنتان عن طريق التسرب المستمر للبكتيريا الموجودة داخل اللمعة في القولون التي تصعد إلى تجويف البطن مما يؤدي إلى التهاب الصفاق البرازي وتجرثم الدم. بموجب هذا ، فإن حجم القسطرة المزروعة ينظم إخراج البراز وبالتالي شدة التهاب الصفاق والإنتان. في البروتوكول التجريبي المقدم أعلاه ، تم استخدام إبرة 14G جنبا إلى جنب مع طرف قسطرة الشفط 10 FR المعدة خصيصا للحصول على التهاب الصفاق الكافي. تسببت القسطرة الأصغر فقط في حدوث خراجات مع التهاب موضعي حيث أن الحويصلة المنوية تسد في الغالب الدعامات الأصغر وتمنع إنتاج البراز المستمر.
نجت التحكم و sCASP من التجربة ، ولكن في مجموعة sCASP ، كان الإنعاش السائل ضروريا للحفاظ على متوسط الضغط الشرياني (MAP) ≥ 70 مم زئبق. أظهرت المعالجة ب sCASP التهاب الصفاق البرازي في كل مكان دون تكوينات خراج وأظهرت علامات سريرية للتعفن الحاد الذي تم الكشف عنه من خلال انخفاض النشاط ، وانخفاض اليقظة ، والفراء المكشكش ، والموقف المنحني. تدهورت هذه الحالة السريرية باستمرار بمرور الوقت.
أظهرت فئران sCASP التي تم إنعاشها بالسوائل اختلافات كبيرة في MAP ومعدل ضربات القلب ولكن لا توجد فروق في النتاج القلبي مقارنة بالحيوانات الضابطة (الشكل 1). كشفت تحليلات الدم بعد 24 ساعة عن علامات الإنتان في المعالجة ب sCASP مع زيادة اللاكتات ، وزيادة IL-6 وقلة الكريات البيض النموذجية لهذه مقارنة بالتحكم (الشكل 1).
تحديد AKI الناجم عن الإنتان
انخفض تصفية الأنسولين ، الموصوفة بأنها المعيار الذهبي لتقييم وظائف الكلى ، بشكل كبير في sCASP مقارنة بالتحكم بعد 24 ساعة (الشكل 2 أ). علاوة على ذلك ، انخفض إخراج البول (الشكل 1) وتصفية الهيدروكربونات العطرية متعددة الحلقات بشكل كبير في حيوانات sCASP (الشكل 2 ب). زادت NGAL (الشكل 2 ج) و Cystatin C (الشكل 2 D) في الإنتان مقارنة بالمجموعة الضابطة. أكدت المعلمات القياسية ل AKI مثل اليوريا والكرياتينين ضعف وظائف الكلى في مجموعة sCASP من خلال مستويات مرتفعة من كلا المعلمتين المقاستين في مصل الدم (الشكل 2 E و F).
لم يتم تحديد إصابة الكلى الحادة في مجموعة sCASP فقط من خلال المعلمات الوظيفية ولكن أيضا من خلال زيادة درجة الإصابة النسيجية المرضية (الشكل 3). تعتمد هذه النتيجة على التغيرات المورفولوجية بما في ذلك تكوين الوذمة ، والوذمة الخلوية ، وانفصال الظهارة الأنبوبية عن الغشاء القاعدي ، وفقدان حدود الفرشاة للخلايا الأنبوبية القريبة ، وموت الخلايا والفراغ. أظهرت مجموعة sCASP زيادة في النتيجة النسيجية المرضية للكلى بعد 24 ساعة من تحريض الإنتان ، حيث كانت الوذمة الخلالية وحدود فرشاة الأنابيب الضعيفة هي العوامل الرئيسية للحصول على درجة أعلى مقارنة بالحيوانات الضابطة (الشكل 3). علاوة على ذلك ، زاد معدل الخلايا الميتة وأحداث الغشاء القاعدي المنفصل بشكل كبير في sCASP (الشكل 3).
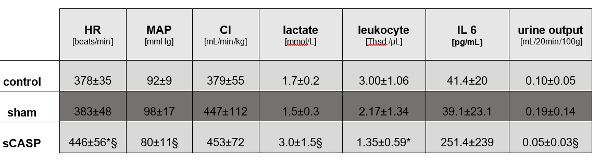
الشكل 1: ديناميكا الدم الكبيرة ومعلمات الإنتان. تؤكد القيم التالية وجود تعفن الدم في الحيوانات التي يتم تشغيلها بواسطة sCASP: معدل ضربات القلب (HR) ، ومتوسط الضغط الشرياني (MAP) ، ومؤشر القلب (CI) ، واللاكتات ، والكريات البيض ، والإنترلوكين 6 (IL 6) وإخراج البول. * p<0.05 مقابل التحكم ، § P<0.05 مقابل sham. تم نشر البيانات بالفعل في ICMex بواسطة Schick et al.15 الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
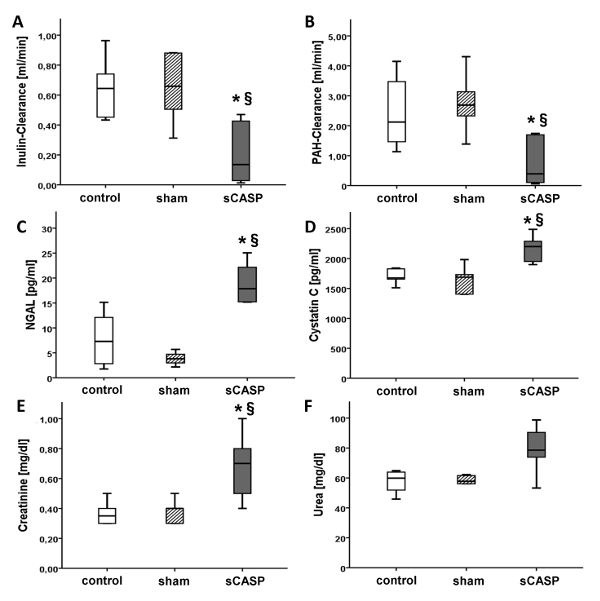
الشكل 2: معلمات وظائف الكلى. انخفضت معلمات الأنسولين (A) و PAH- تصفية (B) [مل / دقيقة] ، الموصوفة على أنها المعيار الذهبي لقياس وظائف الكلى بشكل ملحوظ في مجموعة sCASP. في المقابل ، تمت زيادة NGAL (C) و cystatin C (D) [pg / mL] كعلامة أخرى على AKI الإنتاني. أظهرت المعلمات القياسية السريرية مثل الكرياتينين (E) واليوريا (F) [مجم / ديسيلتر] أيضا مستويات مرتفعة في الصرف الصحي. * ص< 0.05 مقابل السيطرة، § ص<0.05 مقابل الوهم. تم نشر البيانات بالفعل في ICMex بواسطة Schick et al.15 الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: درجات الإصابات النسيجية. إظهار الاختلافات بين التحكم والزائفة و sCASP فيما يتعلق بالوذمة الخلالية ، وفقدان حدود الفرشاة للخلايا الأنبوبية القريبة ، وموت الخلايا ودرجة الإصابة الإجمالية. تظهر الأشرطة متوسط ± الانحراف المعياري. * ص< 0.05 مقابل السيطرة، § ص<0.05 مقابل الوهم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
لا تزال الفيزيولوجيا المرضية للإنتان AKI غير معروفة في تعقيدها. لن تمكن الأبحاث والتجارب السريرية على المرضى من اكتساب رؤى جديدة فيما يتعلق بتغيرات علم الأنسجة المرضية أو اضطرابات دوران الأوعية الدقيقة أو التفاعلات الدوائية على المستويات الخلوية15. لقد تم افتراض سابقا أن هناك حاجة إلى نماذج حيوانية محسنة وجديدة للتحقيق في إصابة الكلى الحادة المرتبطة بالإنتان19. لذلك ، أنشأنا نموذجا حيوانيا جديدا ل AKI الإنتاني الناجم عن التهاب الصفاق الصاعد في القولون.
يقدم نموذج CASP نموذجا سريريا ذا صلة لتقليد الإنتان لدى البشر الذي بدأ بالتهاب الصفاق البرازي الذي يظهر في مرضى الجراحة. الميزة الرئيسية ل CASP هي أنه لا يبدأ بضربة إقفارية كما هو الحال في نموذج CLP المستخدم على نطاق واسع حيث يتم إجراء ربط القي14. علاوة على ذلك ، يوضح Maier et al. أن نموذج CLP يمثل حالة خراج داخل البطن بدلا من التهاب الصفاق في كل مكان مع تجرثم الدمالجهازي 14. باستخدام أحجام مختلفة من الدعامة المزروعة في القولون الصاعد ، يمكن أن تتأثر شدة الإنتان ومعدل البقاء على قيد الحياة كما هو موضح في المنشورات السابقة13،14،20. لتجنب انسداد الدعامة بواسطة الثرب أو الحويصلات المنوية ، تم إدخال دعامة معدلة بقطر 10 FR15. في النموذج الحيواني الموصوف أعلاه ، تم استخدام ذكور الفئران فقط لاستبعاد التباين الهرموني بدلا من إناث كما هو الحال في نموذج CASP الأصلي بواسطة Zantl et al. و Traeger et al.13،21.
يجب مراعاة أنه حتى بعد أداء الإعداد التجريبي المعروض أعلاه بطريقة موحدة ، يمكن أن يحدث التباين بناء على سلالات الفئران المختلفة ، ومنشأة ، والجنس ، والمشغل. لذلك ، قد يكون من الضروري ضبط حجم الدعامة وبالتالي شدة التهاب الصفاق والإنتان. علاوة على ذلك ، يوصى بأن يقوم نفس المشغل بإجراء كل من sCASP والتحكم في نفس اليوم لتقليل التباين.
يمكن أن تحدث إصابة حادة في الكلى بسبب نقص الأكسجة ونقص التروية الناجمة عن انخفاض ضغط الدم أو فشل الجهاز التنفسي مع انخفاض PaO2 في الإنتان22. أدت التغيرات في حالات ديناميكا الدم والتمثيل الغذائي إلى نقص الأكسجة في الأنسجة الذي يؤثر على سلامة الكلى وقد يؤثر على المراضة والوفيات23. لذلك ، يجب أن يكون التقييم المستمر للقيم الديناميكية الدموية والتنفسية متاحا في نموذج في الجسم الحي يستخدم للتحقيق في AKI الإنتاني. هنا ، قدمنا نموذجا في الجسم الحي يتميز بإعداد وحدة العناية المركزة مقارنة بالمرضى24،25،26. يتيح القياس المستمر لقيم ديناميكا الدم مثل معدل ضربات القلب وضغط الدم الشرياني وتقييم حالة الجهاز التنفسي عن طريق أخذ الدم لتحليل غازات الدم. علاوة على ذلك ، فإن هذه البيانات المكتسبة من خلال المراقبة المستمرة ضرورية ومفيدة لإنعاش السوائل وتكييف بروتوكول التخدير.
لا يمكن تقييم وظائف الكلى عن طريق قياس إزالة الأنسولين والهيدروكربونات العطرية متعددة الحلقات إلا في نهاية التجربة حيث من الضروري إعادة شق البطن وشق المثانة. إذا كان التحقيق في وظائف الكلى أثناء التجربة مطلوبا ، فيمكن أخذ عينات الدم لقياس المعلمات القياسية مثل الكرياتينين واليوريا. بموجب هذا ، يجب مراعاة أنه يجب إجراء استبدال السوائل لتجنب فشل ما قبل الكلوي بسبب نقص حجم الدم.
كان الغرض من هذا النموذج هو إنشاء إعداد مستقر للقوارض من AKI الإنتاني مع الأهمية السريرية التي تتيح إجراء مزيد من الدراسات في الفيزيولوجيا المرضية وعلاج الفشل الكلوي. يمكن أيضا استخدام هذا النموذج للتحقيق في استراتيجيات العلاج المختلفة للتعفن البطني و AKI. لذلك ، يمكن أن يكون هذا النموذج بمثابة إعداد مستقر للقوارض للإنتان AKI كونها قريبة من الإعداد السريري لوحدة العناية المركزة. علاوة على ذلك ، يمكن تعديل النموذج الموصوف واستخدامه بنجاح في مجموعة واسعة من أبحاث الإنتان في الجسم الحي ، مثل عدم التنظيم المناعي ، وانهيار البطان ، واعتلال التخثر ، واضطراب دوران الأوعية الدقيقة ، والعلاج الدوائي والإنعاش25.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
تلقى M.A. Schick و N. Schlegel تمويلا من Deutsche Forschungsgemeinschaft (DFG) SCHL 1962 / 2-1 و SCHL 1962 / 4-1.
Materials
| Name | Company | Catalog Number | Comments |
| Sprague-Dawley rats | Janvier Labs, France | ||
| Isoflurane CP | cp-pharma, Burgdorf, Germany | ||
| polyethylen catheter PE 10; 30m | A. Hartenstein, Wuerzburg, Germany | 0.58x0.96 mm | |
| Swivel (375/D/20) | Instech, Plymouth Meeting, PA, USA | (375/D/20) | |
| plastic button tethers | Instech, Plymouth Meeting, PA, USA | LW105S | |
| Perfusor | B. Braun; Melsungen, Germany | Perfusor fm | |
| suction catheter ch. 10 | B.Braun Melsungen AG, Germany | suction catheter typy „Ideal“; ch. 10 | |
| suture | Syneture; USA | Surgipro; Monofilament Polypropylen 4-0 | |
| suture | Ethicon; Scotland | Prolene; Polypropylen 5-0 | |
| 14G-i.v. catheter | BD Insynte; BD Vialon; Madrid; Spain | 14GA i.v. catheter | |
| cotton buds | NOBA Verbandmittel Danz GmbH u Co KG; Wetter; Germany | ||
| rodent respirator | Hugo Sachs Elektronik KG, Germany | rodent respirator, Type:7025 | |
| Midazolam | Ratiopharm, Germany | Midazolam | |
| Thermodilutioncatheter | ADInstruments, Spechbach, Germany | ||
| p-Aminohippuric acid | Sigma-Aldrich; St. Louis; USA | p-Aminohippuric acid sodium salt; A3759-25G | |
| Inulin | Sigma-Aldrich; St. Louis; USA | Inulin-FITC; F3272-1G | |
| Formaldehyde | Otto Fischar GmbH & CoKG; Saarbrücken, Germany | Formaldehyde 3.5% | |
| Cyclopentan | Merck; Darmstadt; Germany | Uvasol: 2-Methylbutan | |
| alcohol based scrub | Schülke & Mayr GmbH, Norderstedt; Germany | kodan Tinktur forte; 45g 2-Propanol, 10g 1-Propanol per 100g | |
| povidone iodine solution | B.Braun Melsungen AG, Germany | Braunol, 7.5g Povidone Iodine per 100g |
References
- Angus, D. C., et al. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med. 29, 1303-1310 (2001).
- Dellinger, R. P., et al. Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit Care Med. 41, 580-637 (2013).
- Moerer, O., Quintel, M. [Sepsis in adult patients - definitions, epidemiology and economic aspects]. Internist (Berl). 50, 788-796 (2009).
- Belayev, L. Y., Palevsky, P. M. The link between acute kidney injury and chronic kidney disease. Curr Opin Nephrol Hypertens. 23, 149-154 (2014).
- Chao, C. T., et al. The impact of dialysis-requiring acute kidney injury on long-term prognosis of patients requiring prolonged mechanical ventilation: nationwide population-based study. PLoS One. 7, e50675(2012).
- Chertow, G. M., Christiansen, C. L., Cleary, P. D., Munro, C., Lazarus, J. M. Prognostic stratification in critically ill patients with acute renal failure requiring dialysis. Arch Intern Med. 155, 1505-1511 (1995).
- Doi, K. Role of kidney injury in sepsis. J Intensive Care. 4, 17(2016).
- Gomez, H., et al. A unified theory of sepsis-induced acute kidney injury: inflammation, microcirculatory dysfunction, bioenergetics, and the tubular cell adaptation to injury. Shock. 41, 3-11 (2014).
- Deitch, E. A. Animal models of sepsis and shock: a review and lessons learned. Shock. 9, 1-11 (1998).
- Esmon, C. T. Why do animal models (sometimes) fail to mimic human sepsis? Crit Care Med. 32, S219-S222 (2004).
- Rittirsch, D., Hoesel, L. M., Ward, P. A. The disconnect between animal models of sepsis and human sepsis. J Leukoc Biol. 81, 137-143 (2007).
- Doi, K., Leelahavanichkul, A., Yuen, P. S., Star, R. A. Animal models of sepsis and sepsis-induced kidney injury. J Clin Invest. 119, 2868-2878 (2009).
- Zantl, N., et al. Essential role of gamma interferon in survival of colon ascendens stent peritonitis, a novel murine model of abdominal sepsis. Infect Immun. 66, 2300-2309 (1998).
- Maier, S., et al. Cecal ligation and puncture versus colon ascendens stent peritonitis: two distinct animal models for polymicrobial sepsis. Shock. 21, 505-511 (2004).
- Schick, M. A., et al. Sepsis-induced acute kidney injury by standardized colon ascendens stent peritonitis in rats - a simple, reproducible animal model. Intensive Care Med Exp. 2, (2014).
- Schick, M. A., et al. Effects of crystalloids and colloids on liver and intestine microcirculation and function in cecal ligation and puncture induced septic rodents. BMC Gastroenterol. 12, 179(2012).
- Schneider, R., et al. Downregulation of organic anion transporters OAT1 and OAT3 correlates with impaired secretion of para-aminohippurate after ischemic acute renal failure in rats. Am J Physiol Renal Physiol. 292, F1599-F1605 (2007).
- Schick, M. A., et al. The impact of crystalloid and colloid infusion on the kidney in rodent sepsis. Intensive Care Med. 36, 541-548 (2010).
- Bellomo, R., Ronco, C., Kellum, J. A., Mehta, R. L., Palevsky, P. Acute renal failure - definition, outcome measures, animal models, fluid therapy and information technology needs the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care. 8, R204-R212 (2004).
- Lustig, M. K., et al. Colon ascendens stent peritonitis--a model of sepsis adopted to the rat: physiological, microcirculatory and laboratory changes. Shock. 28, 59-64 (2007).
- Traeger, T., et al. Colon ascendens stent peritonitis (CASP)--a standardized model for polymicrobial abdominal sepsis. J Vis Exp : JoVE. , (2010).
- Dyson, A., Rudiger, A., Singer, M. Temporal changes in tissue cardiorespiratory function during faecal peritonitis. Intensive Care Med. 37, 1192-1200 (2011).
- Arakelyan, K., et al. Early effects of an x-ray contrast medium on renal T(2) */T(2) MRI as compared to short-term hyperoxia, hypoxia and aortic occlusion in rats. Acta physiol. 208 (2), 202-213 (2013).
- Schick, M. A., et al. Balanced hydroxyethylstarch (HES 130/0.4) impairs kidney function in-vivo without Inflammation. PLoS One. 10 (9), e0137247(2015).
- Flemming, S., et al. Phosphodiesterase 4 inhibition dose dependently stabilizes microvascular barrier functions and microcirculation in a rodent model of polymicrobial sepsis. Shock. 41, 537-545 (2014).
- Flemming, S., et al. Sphingosine-1-phosphate receptor-1 agonist sew2871 causes severe cardiac side effects and does not improve microvascular barrier breakdown in sepsis. Shock. 49 (1), 71-81 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved