Method Article
Quantificação de Micro e Nanoplásticos à Base de Polibutileno Adipato Tereftalato do Solo Usando Espectroscopia de Ressonância Magnética Nuclear de Prótons
Neste Artigo
Resumo
Um método para quantificar micro e nanoplásticos originários de tereftalato de adipato de polibutileno no solo usando espectroscopia de ressonância magnética nuclear é descrito aqui. Essa técnica melhora a metodologia existente porque se estende à quantificação de nanoplásticos e pode ser facilmente adaptada para o processamento de amostras ambientais a granel.
Resumo
Um método para recuperar e quantificar micro e nanoplásticos (MPs e NPs) formados no solo durante a biodegradação é necessário para avaliar com precisão a degradação e o impacto ambiental de produtos plásticos biodegradáveis. A presença de MPs e NPs no solo pode alterar as propriedades do solo, como o comportamento de agregação, ou ter efeitos tóxicos na biota do solo. Os métodos de recuperação de MP existentes nem sempre são adequados para medir polímeros biodegradáveis como tereftalato de adipato de polibutileno (PBAT); alguns procedimentos comuns de digestão com ácidos ou oxidantes podem destruir MPs biodegradáveis à base de PBAT. Métodos de identificação como espectroscopia micro-FTIR e micro-Raman também são limitados pelo tamanho mínimo das partículas que podem ser recuperadas e analisadas. Portanto, este método foi desenvolvido para extrair e quantificar o PBAT do solo para avaliar a fração de massa de MPs e NPs no solo sem transformar quimicamente o PBAT. No protocolo, uma solução de clorofórmio-metanol é usada para extrair seletivamente o PBAT do solo. O solvente é evaporado do extracto e, em seguida, o extracto é dissolvido novamente em clorofórmio deuterado. O extrato é analisado por espectroscopia de ressonância magnética nuclear de prótons (1H-QNMR) sob parâmetros quantitativos para quantificar a quantidade de PBAT em cada amostra. As eficiências de extração por solvente para PBAT variam de 76% em um solo franco-sombreado a 45% em um solo franco-arenoso Elkhorn. A recuperação de PBAT pode ser reduzida para materiais fotooxidados em comparação com os primitivos e pode ser reduzida em solos com alto teor de argila. As eficiências de extração não dependem da concentração de PBAT dentro da faixa de teste, mas eficiências de extração mais baixas foram observadas para NPs do que para MPs. Os resultados da quantificação de PBAT foram comparáveis à quantificação da degradação plástica medindo a respiração cumulativa do solo em um estudo de incubação de laboratório.
Introdução
Métodos para medir a contaminação por MP no solo são necessários para entender o escopo da contaminação por plástico em solos globais1, fontes de contaminação por plástico2 e possíveis soluções3. Os solos agrícolas estão expostos de forma única à contaminação por plástico: mais de 15 milhões de toneladas métricas de plástico são usadas na agricultura a cada ano a partir de 20214, incluindo 2,5 milhões de toneladas de cobertura morta de plástico5. A cobertura plástica é usada em contato próximo com o solo, reaplicada uma ou mais vezes por ano6 e pode ser difícil de remover totalmente do solo após sua vida útil7. Uma área-chave em que os métodos de medição de MP são necessários é na avaliação de produtos plásticos biodegradáveis, como coberturas plásticas biodegradáveis para uso em sistemas vegetais8.
Os produtos plásticos biodegradáveis no solo são alternativas promissoras aos plásticos agrícolas convencionais porque podem eliminar a contaminação plástica do solo pela cobertura morta de plástico se funcionarem conforme o esperado. Em 2022, menos de 1 milhão de toneladas métricas de plástico biodegradável foram produzidas globalmente, com rápido crescimento esperado para a indústria9. Os quatro polímeros biodegradáveis mais comuns, ácido polilático (PLA), amido polimerizado, polihidroxialcanoatos (PHA) e tereftalato de adipato de polibutileno (PBAT), são todos usados comercialmente ou experimentalmente em coberturas plásticas biodegradáveis agrícolas10. Apesar de sua promessa, a degradação desses produtos plásticos biodegradáveis em condições de campo é variável11. Embora alguns estudos de degradação de cobertura plástica biodegradável no campo tenham se concentrado em fragmentos de macroplástico11, avaliar a degradação completa de materiais plásticos requer a capacidade de recuperar MPs e NPs do solo. A quantificação de microplásticos do solo também é importante para avaliar o potencial de impactos negativos nos ecossistemas do solo da poluição por MP12.
Algumas técnicas comumente usadas para identificação e quantificação de MP incluem análise visual, espectroscopia de infravermelho com transformada de micro-Fourier (μFTIR), espectroscopia micro-Raman (μRaman), cromatografia gasosa-espectroscopia de massa (GCMS incluindo pirólise GCMS e dessorção por extração térmica GCMS) e análise termogravimétrica13. Outras técnicas em desenvolvimento incluem espectroscopia de infravermelho próximo para medição in situ de MP em solos14, extração de metilesterificação de ácidos graxos para análise GCMS15 e espectroscopia de ressonância magnética nuclear16. Até 90% dos estudos que quantificaram MPs no solo usaram análise visual (sozinha ou emparelhada com outras técnicas) para identificar partículas plásticas, enquanto 77% usaram técnicas de espectroscopia FTIR, Raman ou GCMS17. Desenvolver e harmonizar uma variedade diversificada de técnicas de quantificação de MP pode ajudar a expandir a capacidade da comunidade científica de responder a diversas questões de pesquisa em microplásticos18. Existem três abordagens genéricas para preparar amostras de solo para quantificar microplásticos: 1) separar partículas individuais de microplástico inalteradas do solo (por exemplo, por separação por densidade), 2) extrair plástico transformado ou material polimérico (por exemplo, por dissolução) ou 3) analisar o solo a granel. Tanto a espectroscopia μFTIR quanto a μRaman exigem que MPs individuais sejam separados do solo antes de serem identificados quimicamente19, enquanto o piro-GCMS pode ser realizado em partículas plásticas isoladas separadas do solo ou solo a granel20. Separar MPs biodegradáveis do solo pode ser difícil porque algumas diversões usadas para remover a matéria orgânica do solo podem degradar ou alterar quimicamente os polímeros biodegradáveis, incluindo o PBAT21. A espectroscopia Micro-Raman e μFTIR também tem um limite de resolução espacial: as partículas devem ser maiores que 10-20 μm para μFTIR e 1 μm para μRaman (se partículas individuais tão pequenas puderem ser preparadas para análise) 19 , 22 . Essas técnicas podem fornecer identificação química de polímeros MP, e imagens espectroscópicas podem ser empregadas para medir o tamanho do MP22. Todos os tipos de piro-GCMS são limitados, pois as amostras são destruídas durante a análise.
A RMN tem sido usada com sucesso para caracterizar constituintes e contaminantes do solo23, quantificar MPs 16,24,25,26 e avaliar a degradação de PBAT e outro polímero, poliestireno27,28. Quando executada sob parâmetros quantitativos, 1espectroscopia de H-RMN produz espectros em que a área de cada pico espectral é diretamente proporcional ao número de hidrogênios contribuintes na amostra; Isso permite a quantificação dos componentes constituintes em uma amostra29. A RMN é uma técnica analítica valiosa para quantificar alguns MPs, incluindo PBAT, no solo, pois permite quantificação e identificação simultâneas, é adequada para misturas complexas e impuras e não requer padrões de referência quimicamente idênticos 30,31. A espectroscopia de RMN de um extrato solvente pode quantificar MPs ou NPs menores do que aqueles que podem ser processados para quantificação de μFTIR, μRaman ou GCMS. Apesar dessas vantagens, as abordagens quantitativas de RMN ainda fornecem sensibilidades mais baixas do que as abordagens destrutivas baseadas em espectroscopia de massa32.
O método proposto, diagramado na Figura 1, descreve um fluxo de trabalho para processar e analisar amostras de solo contendo PBAT - incluindo plásticos PBAT de tamanho nanométrico. No método, o polímero PBAT é extraído de amostras de solo agitando o solo com uma mistura de clorofórmio e metanol. Os extractos de solvente contendo PBAT são secos e depois dissolvidos novamente em clorofórmio deuterado com adição de um calibrante interno. A espectroscopia de RMN é realizada nos extratos usando parâmetros quantitativos. Os espectros resultantes são analisados para quantificar o PBAT comparando a área dos picos ajustados correspondentes aos átomos de hidrogênio do PBAT e das moléculas calibrantes. Este método aplica a abordagem de extração por solvente e espectroscopia de ressonância magnética nuclear de prótons (1H-RMN) demonstrada por Nelson et al.33. O objetivo era empregar um método adequado para processar amostras em escala ambiental (~ 100 g de solo) e processar várias amostras em paralelo sem equipamentos de extração especializados.
Protocolo
1. Coleta e preparação do solo
NOTA: O equipamento de amostragem e processamento não deve conter o polímero PBAT ou seus constituintes para evitar a contaminação da amostra. Outros materiais poliméricos não interferem necessariamente na quantificação do PBAT do solo. Por exemplo, o polietileno e o polipropileno não produzem picos espectrais no clorofórmio 1H-NMR que interferem na quantificação do PBAT34, mas o tereftalato de polietileno, com seu grupo tereftalato, provavelmente interferiria35, assim como outros poliésteres. Textos de referência como Brandolini e Hills34 podem ser usados para determinar os espectros de 1H-NMR de vários polímeros e rastrear picos sobrepostos com os picos PBAT usados para quantificação (descritos abaixo).
- Recolha pelo menos 100 g de peso seco equivalente de solo para cada amostra. Determine o tamanho da amostra do solo com base na concentração esperada de plásticos para coletar uma amostra representativa e homogeneizar o solo para coletar uma subamostra, se necessário36.
NOTA: Os sistemas de solo são inerentemente heterogêneos37, assim como as distribuições de contaminantes (por exemplo, MPs) dentro deles38. Há também variabilidade associada aos métodos usados para medir as concentrações de contaminantes39. Portanto, recomenda-se criar um projeto de amostragem ou projeto experimental que inclua amostras replicadas como uma ferramenta para estimar a incerteza e coletar volumes de amostra representativos com base na concentração de plástico40. As concentrações de MP no solo foram documentadas como variando de quase zero a 1 x 107 itens por kg de solo, com a maioria dos locais contendo menos de 10.000 itens por kg de solo41. Um volume elementar representativo teórico pode variar de 23 m2 a uma concentração de MP de 10 itens por metro quadrado a 0,02 m2 quando as concentrações de MP são de 10.000 itens por metro quadrado36.- Para aumentar a área de amostragem efetiva de um local de campo e minimizar a quantidade de solo que deve ser processada, colete solo de uma grande área (por exemplo, 1 m2) e, em seguida, use o método de esquartejamento para homogeneizar e consolidar a amostra (por exemplo, até 500 g de solo) 36 .
- No método de esquartejamento, empilhe o solo de uma grande área em uma lona ou outra superfície, misture bem com uma pá e divida em quartos. Conservar um quarto da amostra e rejeitar os outros três quartos. Repita esse processo até que a amostra tenha o tamanho desejado.
- Peneire o solo através de uma peneira de malha de 2 mm. Limpe completamente a peneira e a bandeja coletora entre as amostras de solo.
- Secar o solo ao ar e armazená-lo em sacos de amostra lacrados. O solo seco pode ser armazenado neste estado antes da extração do PBAT.
2. Extração de PBAT dos solos
CUIDADO: O clorofórmio é volátil e tóxico. Guarde-o no escuro em vidro âmbar, longe de oxidantes. Ao trabalhar com ele, use luvas adequadas, proteção para os olhos e roupas de proteção. Manuseie-o apenas em um exaustor. O metanol é inflamável, volátil e tóxico. Armazene o metanol em um armário à prova de fogo. Ao trabalhar com metanol, use luvas adequadas, proteção para os olhos e roupas de proteção. Manuseie o metanol apenas em uma capela de exaustão. Os copos podem quebrar e causar ferimentos. Use proteção para os olhos ao manusear vidraria. Evite tocar em cacos de vidro com as mãos desprotegidas. Em vez disso, limpe o vidro quebrado com luvas, pinças, vassouras ou outra ferramenta resistente a cortes.
NOTA: O clorofórmio não é compatível com a maioria dos plásticos ou metais. Certifique-se de que todos os materiais sejam compatíveis (por exemplo, vidro ou politetrafluoretileno, plástico PTFE).
- Em uma hotte, prepare 100 mL de mistura 90:10 v/v de clorofórmio (triclorometano; CHCl3) e metanol (CH3OH) por amostra a ser extraída. Por exemplo, para extrair de 5 amostras, misture 450 mL de clorofórmio com 50 mL de metanol.
- Adicione 100 g de solo seco, 100 mL de solução de clorofórmio-metanol e 20 esferas de vidro em um frasco de extração de vidro. Sele bem os frascos de extração com tampas revestidas de PTFE para que nenhum vapor de solvente possa sair dos frascos.
NOTA: O PBAT é altamente solúvel em clorofórmio; uma mistura de clorofórmio-metanol foi usada porque o metanol pode formar ligações de hidrogênio com solutos, competindo com constituintes minerais e orgânicos do solo e aumentando a recuperação de PBAT do solo33. - Use uma mesa agitadora para agitar os frascos de extração por 8 h a 200 rpm. Após agitar, deixe o solo nos potes de extração assentar por pelo menos 4 h.
- Separe o extrato do solo. Na hotte, destampar um frasco de extração e transferir o líquido por pipeta através de um filtro de papel qualitativo com um tamanho de poro de 11 μm para um frasco de vidro limpo rotulado. Registar o volume de solvente recuperado do frasco de extração. Evite transferir sólidos do solo com o extrato; deixe alguns mL de solvente para trás, se necessário.
NOTA: O papel de filtro destina-se a remover grandes pedaços de matéria orgânica da solução solvente. - Secar os extractos deixando-os na hotte até que o solvente se evapore completamente. Isso pode levar até 24 horas. Seque também o solo na hotte. Quando o solo estiver completamente seco, descarte-o.
- Quando os extratos estiverem secos, tampe cada frasco de amostra e armazene-os em uma área fresca, escura e seca até que sejam necessários.
3. Coleta de espectros de RMN
CUIDADO: O clorofórmio deuterado apresenta os mesmos riscos e requer as mesmas precauções que o clorofórmio protonado descrito acima.
- Adicione um calibrante interno42 à amostra. Use uma balança para pesar 1,00 mg de 1,4-dimetoxibenzeno (DMB; C6H14O) em cada frasco de amostra contendo um extracto seco.
- Ressuspender a amostra em clorofórmio deuterado (CDCl3; tricloro(deutero)metano). Na hotte, adicionar 500 μL de clorofórmio deuterado ao frasco com extracto de amostra seco com uma micropipeta.
- Tampe o frasco e agite para dissolver o extrato seco, batendo suavemente o frasco contra uma mão ou bancada, aproximadamente 10x de cada lado. Em seguida, use uma ponta de pipeta limpa para transferir o líquido para um tubo de RMN.
- Repita as etapas 3.2 e 3.3 com 500 μL adicionais de clorofórmio deuterado, adicionando a segunda porção da amostra ao mesmo tubo de RMN que o primeiro. O segundo enxágue destina-se a garantir a dissolução total e a recuperação do extrato seco do recipiente.
- Tampe o tubo de RMN e guarde-o por 3 dias antes de coletar os espectros de RMN. O tempo de armazenamento apropriado dependerá da taxa de evaporação do solvente do tubo de RMN. Analise as amostras logo após prepará-las com clorofórmio deuterado.
- Para transportar tubos de RMN para o espectrômetro, use um suporte projetado para suportar os tubos longos e delicados. Estes normalmente têm suporte próximo à base e à parte superior do tubo. Mantenha os tubos na posição vertical durante o transporte.
- Usando um espectrômetro de RMN de 500 MHz, colete um espectro de prótons de 1H com um ângulo de pulso de 90 °29, uma largura de pulso de 8 μs33, um tempo de atraso de 25 s (determinado pelo experimento de recuperação de inversão29,43), 262K pontos por varredura e 32 varreduras compostas29,44 de 12 a -2 ppm para um tempo de execução total de 25 minutos.
NOTA: Usamos um espectrômetro Bruker Neo 500 MHz com uma sonda otimizada para banda larga e amostrador automático a uma temperatura controlada de 300 K. Outros espectrômetros semelhantes podem ser usados. Se estiver usando um instrumento com uma intensidade de campo magnético diferente, o tempo de atraso apropriado pode ser calculado com base no tempo de relaxamento T1 para PBAT e 1,4-dimetoxibenzeno usando um experimento de recuperação de inversão29,43. - Depois que a amostra for executada, salve, transfira ou acesse os dados espectrais conforme necessário.
Inspecione os dados espectrais. Verificar se todos os picos de PBAT utilizados na quantificação estão claramente resolvidos, se presentes. Use os picos PBAT 5 (8.10 ppm), 6 (4.44 ppm), 6' (4.38 ppm), 3' (4.15 ppm) e 3 (4.09 ppm) para quantificação (detalhes na Tabela 1). Use os picos DMB A (6,84 ppm) e B (3,77 ppm) também para quantificação (detalhes na Tabela 2). Observe particularmente os picos 6, 6', 3' e 3 do PBAT, que aparecem muito próximos uns dos outros e podem se sobrepor. - Se alguns picos não forem claramente resolvidos, diluir a amostra. Combine 100 μl de amostra e 500 μl de clorofórmio deuterado em um tubo de RMN limpo e execute novamente a amostra sob os mesmos parâmetros definidos na etapa 3.7.
4. Análise de espectros de RMN para quantificar o PBAT
NOTA: A análise espectral pode ser realizada a qualquer momento após a coleta. A análise dos dados no mesmo dia em que os espectros são produzidos é preferível para garantir que as amostras ainda estejam disponíveis para serem executadas novamente em caso de problemas.
- Abra o arquivo FID criado pelo espectrômetro no software de processamento NMR FID (usamos o MestreNova do MestreLab, outras opções, mas outras opções estão disponíveis).
- Aplicar alargamento de linha aos espectros: No software de processamento FID, selecione Modelo de processamento no menu Processamento e navegue até a seção Apodização. Selecione um modelo exponencial com uma magnitude de 0,5 Hz e um primeiro ponto de 0,5 Hz.
- Aplique a correção automática de fase clicando no botão Correção automática de fase no menu Processamento. Aplique a correção automática da linha de base clicando no botão Correção automática da linha de base no menu Processamento.
- Use a deconvolução de pico para ajustar os picos espectrais medidos: na guia Análise do software de processamento de espectros, na seção Ajuste, clique no botão Novo ajuste . Use o cursor para clicar nos espectros em um deslocamento de 8,5 ppm, arraste o cursor para um deslocamento de 3,0 e solte.
- Clique em Tabela de Ajuste de Linha na seção Ajuste para visualizar todos os picos ajustados.
- Manter os picos utilizados para a quantificação conforme descrito no quadro 1 e no quadro 2 e rotulados na figura 2. Use os picos PBAT 5 (8,10 ppm), 6 (4,44 ppm), 6' (4,38 ppm), 3' (4,15 ppm) e 3 (4,09 ppm) na quantificação (detalhes na Tabela 1), bem como os picos DMB A (6,84 ppm) e B (3,77 ppm). Os átomos de hidrogênio que correspondem a cada pico listado na Tabela 1 e na Tabela 2 são rotulados nos diagramas estruturais da Figura 3, com a Figura 3A mostrando a estrutura dos dois dímeros de PBAT, a Figura 3B mostrando como a posição dos dímeros no polímero interage para alterar o deslocamento de pico em hidrogênios do monômero de 1,4-butanodiol, e Figura 3C mostrando a estrutura do DMB.
- Exclua todos os outros picos do ajuste selecionando os picos indesejados e clicando em Excluir pico.
- Use a Tabela de Ajuste para copiar a área de cada pico em um aplicativo de planilha para cálculos (optamos por usar planilha).
- Para copiar áreas de pico para uma planilha, primeiro selecione todas as informações de pico na Tabela de Ajuste de Linha. Em seguida, clique com o botão direito do mouse e escolha Copiar no menu pop-up. Cole os dados na planilha.
- Calcule o número de moles de DMB adicionados à amostra, nDMB, usando a equação

onde mDMB é a massa de DMB adicionada à amostra em gramas (sugerido 1,00 mg) e MMDMB é a massa molar de DMB (138,17 g/mol). - Calcular o número de moles do dímero de tereftalato de butileno do PBAT na amostra, nBT, utilizando a equação

onde A5 é a área medida do pico 5 do PBAT, AA é a área medida do pico A do DMB e AB é a área medida do pico B do DMB. As unidades de área produzidas pelo software de análise espectral são arbitrárias. - Calcular o número de moles do dímero de adipato de butilno do PBAT na amostra, nBA, utilizando a equação

onde A3 é a área medida do pico 3 do BAT, A3' é a área medida do pico 3' do BAT, A6 é a área medida do pico 6 do PBAT e A6' é a área medida do pico 6' do BAT. As unidades de área produzidas pelo software de análise espectral são arbitrárias. - Calcular a massa de PBAT na amostra, mPBAT, recuperada, utilizando a equação

onde MMBA é a massa molar de um dímero BA de PBAT (200 g/mol), e MMBT é a massa molar de um dímero BT de PBAT (220 g/mol). - Se uma quantidade conhecida de PBAT estava presente na amostra, a porcentagem de recuperação, η, pode ser calculada para a amostra como uma medida da eficiência de extração de acordo com a equação

- Calcular a concentração de PBAT numa amostra, CPBAT, utilizando a equação

onde msolo seco é a massa de solo seco usada para produzir o extrato (0,1 kg), Vsolvente recuperado é o volume de solvente recuperado do solo na etapa 2.4 e Vsovlent adicionado é a quantidade inicial de solvente adicionada à amostra de solo (100 mL).
5. Preparação da curva de calibração para quantificação do PBAT de um determinado solo
NOTA: Uma curva de calibração criada com base em amostras de solo com quantidades conhecidas de PBAT adicionadas fornecerá informações úteis sobre como o PBAT é extraído e recuperado de um determinado solo. A extração não é a mesma para todos os solos ou todas as formas de PBAT. Suspeitamos que a eficiência da extração dependa do teor de argila e matéria orgânicado solo 33 e recomendamos a criação de uma curva de calibração para cada série de solo e horizonte de interesse. A curva de calibração pode ser criada antes ou depois de amostras desconhecidas serem processadas com este método.
- Colete e prepare o equivalente a 2,5 kg de solo seco, conforme descrito nas etapas 1.1 a 1.3.
- Determinar a gama a abranger pela curva de calibração; a concentração máxima de PBAT utilizada na curva de calibração deve ser superior à concentração de PBAT mais elevada entre as amostras desconhecidas.
- Prepare ou obtenha plástico PBAT suficiente para criar 5 amostras enriquecidas de 100 g de solo com 0%, 25%, 50%, 75% e 100% da concentração máxima (25 amostras no total). Por exemplo, se 40 mg/kg for a concentração máxima desejada, um total de 50 mg de PBAT será necessário para criar as amostras enriquecidas.
- Prepare 25 amostras de 100 g de solo cada. Crave as amostras pesando plástico à base de PBAT e adicionando-o às amostras de solo nas taxas prescritas. Por exemplo, se 40 mg/kg de PBAT for a concentração máxima desejada, crie 5 amostras sem PBAT, 5 amostras com 1 mg de PBAT, 5 amostras com 2 mg de PBAT, 5 amostras com 3 mg de PBAT e 5 amostras com 4 mg de PBAT. Depois de adicionar PBAT ao solo, misture bem.
- Extraia o PBAT das 25 amostras enriquecidas, colete espectros de RMN dos extratos e analise os espectros resultantes conforme descrito nas etapas 2.1 a 4.16.
- Identifique a equação de uma curva de calibração para PBAT neste solo, realizando uma regressão linear entre a quantidade medida de PBAT em cada amostra enriquecida e a quantidade real de PBAT adicionada em uma ferramenta de análise estatística. Usamos uma planilha. Se nenhum PBAT for detectado nas amostras com pico sem PBAT adicionado, force b = 0 na regressão.
NOTA: Um teste de regressão linear avalia a força da relação linear entre duas variáveis numéricas contínuas x e y, de acordo com a relação y = mx + b. Os valores de m e b que melhor se ajustam aos dados são calculados pelo teste. O coeficiente r2 do teste de regressão descreve o quão intimamente correlacionadas as duas variáveis estão entre si. - Teste uma relação significativa entre a eficiência de extração e a concentração de PBAT usando a ferramenta de análise estatística. Calcule a eficiência de extração de PBAT das amostras enriquecidas como

- Use a ferramenta de análise estatística para calcular a probabilidade de que os dados observados possam ocorrer aleatoriamente sem uma correlação entre a eficiência da extração e a concentração de PBAT. Se esse valor-p for maior que o limite de significância predeterminado, α, ele não rejeitará a hipótese nula de que não há relação entre as duas variáveis. Se for esse o caso, pode presumir-se que a eficiência de extração é constante para todas as concentrações de PBAT dentro da gama ensaiada. Se a hipótese nula for rejeitada, o modelo linear descrito aqui pode não ser a melhor maneira de modelar os dados.
- Use a equação de regressão linear da curva de calibração para estimar a quantidade de PBAT em amostras desconhecidas processadas usando este método. Se a variável x de regressão fosse a quantidade real de PBAT nas amostras com pichas da curva de calibração, a variável y era a quantidade medida de PBAT e b era definida como 0, então

NOTA: O conteúdo de PBAT de amostras replicadas estimado usando uma equação de curva de calibração pode ser usado para gerar um intervalo de confiança para a quantidade de PBAT em um determinado solo, ou se uma média e um intervalo de confiança puderem ser calculados para as concentrações de PBAT em extratos replicados, então a curva de calibração pode ser aplicada para estimar a concentração de PBAT no solo. Qualquer ordem de operações produz o mesmo intervalo de confiança para o teor de PBAT no solo. Por exemplo, considere extratos de 10 amostras replicadas que têm concentrações de PBAT de 10, 5, 2, 4, 10, 11, 2, 6, 8 e 5 mg/kg e a equação da curva de calibração y (PBAT medido no extrato) = 0,75 x (PBAT verdadeiro no solo). As concentrações de PBAT no solo em cada repetição podem ser estimadas em 13, 7, 3, 5, 13, 15, 3, 8, 11 e 7 mg/kg. Em seguida, a concentração média de PBAT no solo seria estimada em 8,4 mg/kg com um desvio padrão de 4,4 mg/kg. Se uma média e um desvio padrão forem calculados primeiro para as concentrações de PBAT do extrato (10, 5, 2, 4, 10, 11, 2, 6, 8 e 5), uma média de 6,3 mg / kg e um desvio padrão de 3,3 mg / kg seriam calculados. Em seguida, a curva de calibração pôde ser aplicada tanto à média quanto ao desvio padrão para estimar a concentração de PBAT no solo: média de 8,4 mg/kg, desvio padrão de 4,4 mg/kg.
Resultados
Para avaliar a eficácia deste método na quantificação do polímero PBAT do solo, curvas de calibração foram construídas extraindo PBAT de amostras enriquecidas criadas a partir de três solos diferentes. Para cada um dos três solos (detalhes na Tabela 3), o solo foi passado por uma peneira de 2 mm e depois seco ao ar. Amostras enriquecidas foram criadas adicionando 0, 9, 18, 27 ou 36 mg de MP à base de PBAT a 100 g de solo seco (5 repetições de cada). Isso equivale a 0, 63, 126, 189 ou 252 mg/kg de polímero PBAT. Os MPs foram feitos de cobertura plástica com 70% de PBAT em massa e 50 μm de espessura de acordo com o procedimento de moagem descrito em Astner et al.45 e eram menores que 840 μm. Para criar cada curva de calibração, o PBAT foi extraído de cada amostra enriquecida seguindo o procedimento definido acima. A recuperação do PBAT foi então comparada com a quantidade de PBAT adicionada a cada amostra. A taxa de recuperação e quantificação de PBAT também foram testadas para NPs (diâmetro médio de 780 nm, índice de polidispersidade de 0,77, preparado de acordo com Astner et al.45) em um solo (franco-sombreado).
Para todos os solos, não foi detectado nenhum PBAT nas amostras sem adição de PBAT, ou seja, não foram observados falsos positivos por este método. A Figura 1 suplementar mostra um espectro coletado de um solo franco-sombreado que não continha PBAT (e continha DMB adicionado durante o processo de preparação). Os dois picos característicos do calibrante interno DMB estão presentes, mas os picos característicos do PBAT não. Para solos com adição de BAT, os cinco picos característicos utilizados para identificar o BAT estavam presentes. A Figura 2 mostra um espectro coletado de um solo franco-sombreado com 63 mg/kg de PBAT adicionado. Todos os picos de PBAT e DMB usados na quantificação são claramente resolvidos. A Figura 2 suplementar mostra a região ajustada do espectro mostrada na Figura 2 com picos integrados sobrepostos. Devido à sobreposição de picos de 3, 3', 6 e 6' com outros sinais no espectro, é importante calcular o conteúdo de PBAT com base nas integrais de picos ajustados, em vez de integrais de pico simples. Isso remove a área contribuída por outros constituintes do extrato do solo e da sobreposição de picos de PBAT. A Figura 3 suplementar mostra os efeitos da diluição na resolução espectral da RMN. A figura mostra um espectro coletado de uma argila arenosa Elkhorn com 252 mg / kg de PBAT adicionado. No painel A, os picos de PBAT de 3, 3', 6 e 6' na faixa de 4,5 a 4,0 ppm não podem ser resolvidos. A Figura 3B suplementar mostra um espectro coletado da mesma amostra após ter sido diluída em 1:5 com clorofórmio deuterado adicional. Após a diluição, os quatro picos são distintos e sua área pode ser ajustada.
As curvas de calibração variaram entre os três solos testados. A Figura 4 mostra as concentrações estimadas de PBAT de cada solo com base no PBAT medido (CPBAT,m) em cada extrato em comparação com a quantidade real de PBAT (CPBAT,a) adicionada ao solo. A quantidade de PBAT recuperada de solos franco-argilosos foi fortemente correlacionada com a quantidade de PBAT adicionada (r2 = 0,99). Para a equação da curva de calibração CPBAT,m = m*CPBAT,a, m = 0,76 ± 0,02 (média ± um erro padrão), e m foi significativamente diferente de zero (df = 24; F = 2000; p < 1*10-16). O PBAT foi recuperado com uma eficiência de η = 76 % ± 10 % (média ± um desvio padrão) deste solo. A eficiência de extração do solo Shady não foi correlacionada com a quantidade de PBAT nas amostras (r2 = 0,009; p = 0,7). A NP foi recuperada com uma eficiência de η = 59% ± 8% (média ± um desvio padrão). A Figura 5 mostra a eficiência de extração de MPs e NPs da argila Shady; foi significativamente menor para NP (p = 0,0002). A quantidade de PBAT recuperada do barro Los Osos foi menos fortemente correlacionada com a quantidade de PBAT adicionada (r2 = 0,85) do que no solo Shady. Para a equação da curva de calibração CPBAT,m = m*CPBAT,a, m = 0,57 ± 0,05 (média ± um erro padrão), e m foi significativamente diferente de zero (df = 23; F = 100; p = 8*10-11). O PBAT foi recuperado com uma eficiência de η = 57 % ± 22 % (média ± um desvio padrão) deste solo. A eficiência de extração no solo de Los Osos não se correlacionou com a quantidade de PBAT nas amostras (r2 = 0,01; p = 0,6). A quantidade de PBAT recuperada da argila arenosa Elkhorn foi fortemente correlacionada com a quantidade de PBAT adicionada (r2 = 0,88). Para a equação da curva de calibração CPBAT,m = m*CPBAT,a, m = 0,70 ± 0,05 (média ± um erro padrão), e m foi significativamente diferente de zero (df = 23; F = 200; p = 5*10-12). O PBAT foi recuperado com uma eficiência de η = 70 % ± 14 % (média ± um desvio padrão) deste solo. A eficiência de extração não foi correlacionada com a quantidade de PBAT nas amostras (r2 = 0,006; p = 0,7) para o solo Elkhorn.
Além disso, este método foi aplicado para quantificar o PBAT em um solo da série Elkhorn. Neste experimento, o solo Elkhorn foi coletado de dois locais dentro de um campo agrícola, peneirado em uma peneira de 2 mm e depois seco ao ar. O solo foi misturado com MPs de cobertura morta à base de PBAT (criados conforme descrito acima, diâmetro < 840 μm), com 50 mg de MPs e 150 g de solo seco em cada mesocosmo (250 mg / kg de PBAT) para criar 5 mesocosmos com MPs misturados ao solo do local A e 5 com MPs misturados ao solo do local B (10 no total). Cinco mesocosmos compostos de solo de cada local sem adição de MPs serviram como controle negativo (10 no total). Os mesocosmos foram incubados por 6 meses para investigar a biodegradação dos MPs de cobertura morta à base de PBAT. Durante a incubação, a respiração cumulativa do solo foi medida por meio das concentrações de CO2 no headspace (usando um analisador de gás infravermelho) e usada para quantificar a degradação do PBAT. A quantidade de plástico remanescente no mesocosmos no final da incubação foi calculada como
CFraturamento de plástico, final = [mPlástico, i / Cfraturamento de plástico - (CCO2, plástico adicionado - CCO2 sem plástico)*msolo seco]/(mPlástico, i/ Cfraturamento de plástico)
onde msolo seco é a quantidade de solo em cada frasco de incubação, Cfrac Plastic é o teor de carbono dos microplásticos adicionados, CCO2, plástico adicionado é a quantidade cumulativa de CO2 produzida em um mesocosmo com plástico adicionado por grama de solo seco, CCO2 sem plástico é a quantidade de CO2 produzida em um mesocosmo sem plástico adicionado por grama de solo seco, e mplástico, i é a massa inicial do plástico adicionado.
Usamos bootstrapping para estimar intervalos de confiança para o plástico remanescente nos solos A e B, calculando o plástico remanescente com 10.000 subamostras teóricas de pares aleatórios dos 10 mesocosmos experimentais de cada local. No local A, a média estimada de plástico remanescente dos dados de respiração foi de 86%, com um intervalo de confiança de 95% de 62 a >100%. No local B, a média estimada de plástico remanescente foi de 98%, com intervalo de confiança de 95% variando de 79 a >100%. Ao final dos 6 meses, o conteúdo de PBAT também foi medido pelo método de extração e quantificação de RMN descrito neste manuscrito (n = 5 para o local A e n = 4 para o local B). No local A, a média estimada de plástico remanescente dos dados de RMN foi de 79%, com intervalo de confiança de 95% (média ± 1,96xSE) variando de 71% a 87%. No local B, a média estimada de plástico remanescente foi de 88%, com intervalo de confiança de 95% variando de 71% a 100%. A Figura 6 mostra os intervalos de confiança para o teor de plástico do solo dos dois locais estimados pelos dois métodos diferentes. As estimativas de conteúdo de plástico dos dois métodos parecem mutuamente consistentes com base na grande porção de sobreposição entre cada par de intervalos de confiança.

Figura 1: Visão geral visual do procedimento de extração e quantificação do tereftalato de adipato de polibutileno (PBAT). Clique aqui para ver uma versão maior desta figura.
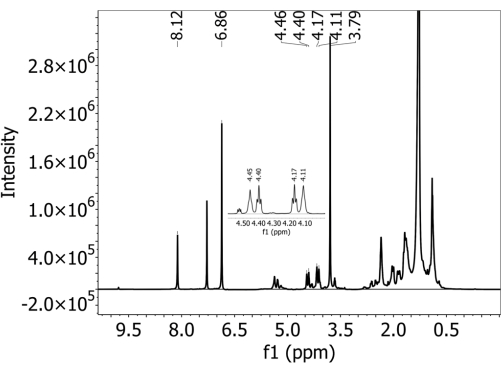
Figura 2: 1espectro de H-NMR coletado em solvente de clorofórmio deuterado com um espectrômetro de 500 MHz em um extrato de um solo franco-defasado com tereftalato de adipato de polibutileno (PBAT) MPs. 1,4-Dimetoxibenzeno (DMB) foi adicionado ao extrato como um calibrante interno antes da análise de RMN. Os picos característicos de PBAT e DMB estão presentes no espectro. Clique aqui para ver uma versão maior desta figura.

Figura 3: Estruturas de tereftalato de adipato de polibutileno (PBAT) e 1,4-dimetoxibenzeno (DMB) com prótons marcados. As estruturas correspondentes são mostradas na Tabela 1 e na Tabela 2. (A) Estrutura de uma unidade BA-BT de PBAT. (B) Estrutura das tríades T-B-T, T-B-A e A-B-A do PBAT. (C) Estrutura do DMB. Clique aqui para ver uma versão maior desta figura.

Figura 4: Concentrações de PBAT medidas por 1H-QNMR em extratos em solvente de clorofórmio deuterado de um solo franco-sombreado, um barro Los Osos e um franco-arenoso Elkhorn contendo quantidades conhecidas de PBAT. Clique aqui para ver uma versão maior desta figura.

Figura 5: Eficiência de extração de PBAT MPs e NPs de amostras enriquecidas em solo franco-sombreado. A recuperação do PBAT é significativamente menor para NPs (p = 0,0002). A linha do meio de cada caixa representa a média dos pontos de dados medidos, enquanto os limites superior e inferior da caixa refletem Q3 e Q1, respectivamente. Os limites superior e inferior dos bigodes refletem os pontos de dados máximo e mínimo, respectivamente. Os pontos de dados individuais são mostrados dentro da caixa e dos bigodes. Clique aqui para ver uma versão maior desta figura.

Figura 6: O teor de plástico de dois solos Elkhorn foi medido por respiração de incubação cumulativa e por extração de solvente acoplada a RMN. Para o conteúdo de plástico medido pela respiração, as barras representam um intervalo de confiança de 95%. Para o conteúdo de plástico medido por RMN, as barras representam um intervalo de confiança de 95% com base em duas vezes o erro padrão acima e abaixo da estimativa média (n = 5 para o local a e n = 4 para o local b). Clique aqui para ver uma versão maior desta figura.
| ID de pico | Localização | Número de prótons | Multiplicidade | Monômero | usado na quantificação |
| 5 | 8.1 | 4 | Singleto | T | Sim |
| 6 | 4.44 | 2 | Trinca | B | Sim |
| 6’ | 4.38 | 2 | Trinca | B | Sim |
| 3’ | 4.15 | 2 | Trinca | B | Sim |
| 3 | 4.09 | 2 | Trinca | B | Sim |
| 1 | 2.34 | 4 | Trinca | Um | Não |
| 7 | 1.97 | 2 | Multiplicador | B | Não |
| 7’ | 1.87 | 2 | Multiplicador | B | Não |
| 4’ | 1.81 | 2 | Multiplicador | B | Não |
| 4 | 1.68 | 2 | Multiplicador | B | Não |
| 2 | 1.66 | 4 | Multiplicador | Um | Não |
Tabela 1: 1Picos espectrais de H-NMR de tereftalato de adipato de polibutileno (PBAT) em solvente de clorofórmio deuterado. Os hidrogênios atribuídos a cada pico são rotulados na Figura 3. As atribuições de pico são baseadas em Herrera et al.27.
| ID de pico | Localização | Número de prótons | Multiplicidade | Usado na quantificação |
| Um | 6.84 | 4 | Singleto | Sim |
| B | 3.77 | 6 | Singleto | Sim |
Tabela 2: 1picos de H-NMR de 1,4-dimetoxibenzeno (DMB) em solvente de clorofórmio deuterado. Os hidrogênios atribuídos a cada pico são rotulados na Figura 3B. As atribuições de pico são baseadas em Nelson et al.33.
| Série de solo | Classificação | Textura | Carbono orgânico total | ph | Local de coleta | Profundidade de coleta (cm) |
| Duvidoso | Argissolo Vermelho distrófico fino, misto, subativo, térmico | Barro | 1.70% | 6 | Knoxville, Tennessee, EUA | 0-5 |
| Los Osos | Fino, esquítico, térmico Typic Argixeroll | Barro | 3.00% | 6 | San Luis Obispo, Califórnia, EUA | 0-5 |
| Elkhorn | Pachic Argixeroll argiloso fino, misto, superativo e térmico | Argila arenosa | 1% | 7 | Watsonville, Califórnia, EUA | 0-5 |
Tabela 3: Propriedades dos três solos que foram usados para demonstrar o método de extração do PBAT.
Figura suplementar 1: 1espectro de H-NMR coletado em solvente de clorofórmio deuterado com um espectrômetro de 500 MHz em um extrato de uma argila Shady sem polímero PBAT presente. Os picos característicos do PBAT não estão presentes, enquanto os picos do DMB (adicionado como calibrante interno) estão. Clique aqui para baixar este arquivo.
Figura suplementar 2: Região ajustada do espectro de 1H-NMR, conforme mostrado na Figura 4. O espectro foi coletado em solvente clorofórmio deuterado. O fundo verde mostra a região do espectro que foi ajustada. As linhas roxas mostram os picos ajustados, enquanto as linhas vermelhas mostram o erro (partes do sinal do espectro não incluídas nos picos ajustados). Os picos PBAT 5, 6, 6', 3' e 3 estão incluídos no ajuste junto com os picos DMB A e B. Clique aqui para baixar este arquivo.
Figura suplementar 3: 1espectros de H-NMR em solvente de clorofórmio deuterado coletados com um espectrômetro de 500 MHz em um extrato de argila arenosa Elkhorn com PBAT MPs adicionados. Os picos característicos de PBAT e DMB estão presentes no espectro. (A) Os picos de PBAT não podem ser distinguidos para quantificar o polímero. Se os extratos de amostra produzirem espectros como este, dilua a amostra e use-a para coletar um novo espectro de 1H-RMN. (B) O mesmo extrato é diluído para que todos os picos espectrais sejam claramente resolvidos. Clique aqui para baixar este arquivo.
Discussão
Propomos um método para extração por solvente de PBAT do solo acoplado a 1H-NMR para quantificar o PBAT no extrato. Os principais elementos do processo de extração incluem a técnica e o equipamento de extração, o solvente usado para extrair e os requisitos de tempo. Optamos por usar uma técnica de extração que requer equipamentos relativamente simples e baratos (potes de vidro, esferas de vidro e mesa agitadora) em comparação com a extração de Soxhlet e extração acelerada por solvente (ASE) demonstrada por Nelson et al.33. O objetivo deste método é que muitas amostras possam ser extraídas em paralelo para acelerar o processamento de amostras de solo a granel. Outra vantagem da extração simples por agitação com solvente é que volumes maiores de solo podem ser acomodados em comparação com as abordagens Soxhlet ou ASE, permitindo um processamento mais fácil de amostras ambientalmente representativas13,36. Selecionamos a solução solvente de clorofórmio-metanol com base nos resultados bem-sucedidos apresentados por Nelson et al.33 e na disponibilidade de clorofórmio deuterado como solvente de RMN-1H. Testamos a ultrassonografia de misturas solvente-matriz alinhadas com o protocolo descrito em Nelson et al.33 em comparação com o método simples de agitação do solvente e não encontramos diferença significativa nas taxas de recuperação do PBAT entre os dois métodos. Verificou-se que 8 h de agitação a 200 rpm foram suficientes para quebrar agregados de solo em 100 g de matriz de solo para os três solos testados, enquanto tempos de agitação mais curtos ou velocidades de agitação mais baixas foram insuficientes. A decantação foi então necessária para recuperar o solvente sem partículas de solo. A recuperação do PBAT foi testada com plásticos nanométricos e a recuperação foi significativamente menor do que a dos MPs. Isso significa que o método pode precisar de mais desenvolvimento para quantificar com precisão amostras ambientais de NPs desconhecidas, mas a recuperação parcial e a medição de NPs ainda são valiosas em comparação com outros métodos de tamanho limitado, embora as informações de tamanho de partícula não possam ser obtidas por esse método.
Embora Nelson et al.33 tenham relatado eficiências de extração próximas a 100% para um método de extração por ultrassom, descobrimos que a ultrassonografia e o método de extração baseado em agitador descrito aqui levaram a eficiências de extração significativamente abaixo de 100%. Acreditamos que isso pode ser devido aos efeitos do intemperismo ambiental, incluindo a fotooxidação na cobertura morta de plástico. Nelson et al.33 observaram eficiência de extração significativamente reduzida para PBAT MPs irradiados com UV em comparação com material não intemperizado. O plástico que usamos para testar esse método de quantificação foi intemperizado em campo à luz do sol por uma estação de crescimento completa antes de ser processado em MPs. Apesar dos fotoestabilizadores adicionados aos filmes plásticos comerciais, a estrutura do polímero das coberturas mortas muda devido à radiação UV (por exemplo, reticulação da cadeia que aumenta o conteúdo de gel do material) 46 em condições ambientais de intemperismo e a degradação do polímero pode alterar seu espectro de RMN47. Isso pode contribuir para as menores taxas de recuperação do PBAT observadas em comparação com Nelson et al.33. Também descobrimos que a eficiência de extração do PBAT variou entre os três solos testados. O solo Shady contém principalmente argilas de baixa atividade, enquanto os outros dois solos têm argilas esmectíticas (Los Osos) e mistas e superativas (Elkhorn). A presença de argilominerais de alta atividade e 2:1 pode ter inibido a extração por solvente de PBAT desses solos33,48 levando à menor recuperação de PBAT observada. Recomendamos mais pesquisas que investiguem as associações plástico-mineral no solo para MPs e NPs biodegradáveis, incluindo PBAT, bem como MPs e NPs de polímeros convencionais não degradáveis. Isso é importante tanto para entender como os polímeros de MP podem ser extraídos e medidos do solo quanto para entender como eles podem se biodegradar ou afetar os sistemas do solo.
Os principais elementos do processo de aquisição do espectro de RMN incluem a força do ímã do instrumento, o número de varreduras usadas, o tempo de relaxamento da amostra entre as varreduras e o tempo total de medição por amostra. Utilizou-se um espectrômetro de 500 MHz; maiores intensidades de campo magnético fornecem maior sensibilidade e resolução em espectros de RMN. A relação sinal-ruído espectral pode ser aumentada coletando varreduras repetidas da mesma amostra e adicionando-as. A coleta de n varreduras aumentará a relação sinal-ruído por um fator de √n, mas aumentará o tempo de medição por um fator de n29. Isso significa que, se uma relação sinal-ruído mais alta for necessária para quantificar o PBAT em uma amostra, o número de varreduras pode ser aumentado ao custo de tempos de execução de amostra mais longos. Uma relação sinal-ruído de 150 para um sinal específico é necessária para manter um erro <1% na quantificação44. De acordo com nossos parâmetros de aquisição (instrumento, sonda, número de exames), cerca de 5 mg de PBAT por amostra (ou 50 μg de PBAT por mL de extrato) foram necessários para obter uma relação sinal-ruído de 150 e, portanto, erro <1% na quantificação; Essa concentração é específica para nossa configuração de coleta de dados. Essa concentração de PBAT é maior do que os limites de quantificação alcançados por outros usando 1H-NMR para quantificar outros tipos de MPs na ausência de solo16,24, demonstrando o impacto da matéria orgânica do solo e outros compostos co-extraídos no método de quantificação. A faixa quantificável de PBAT também é limitada na extremidade superior devido ao alargamento da linha observado em concentrações de PBAT superiores a 25 mg por amostra (250 μg de PBAT por mL de extrato), o que levou à sobreposição de pico de PBAT conforme descrito nos resultados representativos e mostrado na Figura Suplementar 3. No entanto, este método permite flexibilidade na resposta a essas limitações, a fim de garantir que as amostras sejam quantificáveis. A quantidade de solo usada para criar extratos pode ser aumentada ou diminuída e os extratos podem ser diluídos e reanalisados para ajustar a concentração de PBAT dentro da faixa ideal.
Os principais elementos do processo para quantificar o PBAT com base nos espectros de RMN incluem os picos usados para quantificar o PBAT, o uso de ajuste de linha para calcular as áreas de pico e a curva de calibração. Conceitualmente, qualquer par de picos de PBAT e DMB pode ser comparado para calcular a proporção dos dois compostos em uma amostra. Encontramos os resultados mais precisos quando calculamos a razão BT: DMB como a média das áreas de pico 5: A e as áreas de pico 5: B (normalizadas por seus respectivos números de prótons). O pico 5 do PBAT fornece apenas quantificação do monômero 1,4-butanodiol-tereftalato (BT), portanto, a área dos picos 3 e 3' (representando o monômero 1,4-butanodiol-adipato, ou BA) foi comparada com a área dos picos 6 e 6' (representando o monômero BT) para quantificar os grupos BA presentes na amostra. A quantidade de BT e BA foi somada para representar a quantidade total de PBAT restante. Não foi possível usar o pico 1 ou 2 do PBAT na quantificação de BA devido à interferência de compostos coextraídos (hipotetizados como matéria orgânica do solo), que criaram vários picos amplos na faixa de 2,7-0,7 ppm. Exploramos a remoção desses sinais indesejados dos espectros com correção de fundo (ou seja, subtraindo um espectro em branco de cada espectro de amostra), mas descobrimos que a criação de espectros de fundo e amostra comparáveis equivalentes sem o uso de um calibrante não é confiável. O ajuste de linha foi usado para calcular a área dos picos ajustados em vez de integrar os picos espectrais diretamente. Devido à sobreposição entre os picos de PBAT 3 e 3' e entre os picos de 6 e 6', isso forneceu estimativas mais precisas do conteúdo de PBAT com base em análises preliminares. Recomendamos a criação de uma curva de calibração para levar em conta as taxas variáveis de recuperação de PBAT de diferentes solos. As taxas de recuperação do PBAT foram significativamente diferentes para um par, dos três solos testados, conforme indicado pelos intervalos de confiança de 95% não sobrepostos para a inclinação da curva de calibração. A recuperação do PBAT em um terceiro solo não foi significativamente diferente de qualquer um dos outros dois. Na ausência de uma compreensão mecanicista de como a composição do solo afeta a recuperação do PBAT, recomendamos que as curvas de calibração sejam criadas para avaliar a recuperação do PBAT em cada série de solo de interesse e para cada horizonte dentro de um perfil de solo. Se as curvas de calibração forem estatisticamente semelhantes entre os solos, os solos podem ser facilmente analisados em combinação.
Acreditamos que este método pode fornecer uma ferramenta valiosa para os interessados em quantificar MPs e NPs de PBAT no solo, especialmente para quantificar o PBAT em um grande número de amostras coletadas em solos semelhantes, por exemplo, em um estudo de campo de biodegradação plástica de longo prazo. Um método de RMN para quantificar MPs do solo é valioso porque permite que pesquisadores com acesso e experiência em RMN contribuam para atender às necessidades do campo emergente, respondendo a perguntas importantes sobre a presença e o comportamento de MPs em sistemas de solo. Embora o acesso à instrumentação e à experiência provavelmente sejam algumas das primeiras preocupações práticas que limitam a seleção de técnicas de quantificação pelos pesquisadores, a RMN não é a ferramenta mais eficiente ou adequada para quantificar microplásticos do solo em todas as condições. As informações sobre a forma e o tamanho das partículas não podem ser obtidas com uma técnica de extração por solvente; se a forma e o tamanho do MP forem de interesse, os pesquisadores seriam mais bem servidos por uma técnica para identificar partículas individuais de MP, como FTIR ou espectroscopia Raman. Uma vantagem dos métodos de extração por solvente como os apresentados aqui e em Nelson et al.33 em comparação com outras abordagens de quantificação de MP, como FTIR ou espectroscopia Raman, é que conceitualmente não há limite de tamanho para os MPs e NPs que podem ser quantificados; A extração por solvente pode ser mais benéfica quando a informação do tamanho das partículas não é necessária ou quando as partículas de interesse são muito difíceis de separar por outros meios. A pirólise GCMS pode ser valiosa porque tem uma sensibilidade maior do que a RMN, mas os resultados também estão sujeitos a efeitos de matriz, como provavelmente é a extração com solvente de PBAT.
Esperamos que trabalhos futuros melhorem a robustez deste método, abordando os constituintes do solo coextraídos que interferem na resolução do pico de PBAT nos espectros de RMN. Mais trabalhos também são necessários para estabelecer a relação entre o intemperismo do plástico PBAT e as eficiências de extração por meio desse método, talvez acompanhados por uma compreensão mais detalhada dos produtos de degradação do PBAT e seus espectros de 1H-NMR. Com base em nossos resultados e nos de Nelson et al.33, esse procedimento de quantificação tem melhor desempenho para quantificar plásticos PBAT não intemperizados em solos com baixa matéria orgânica e sem argilas de alta atividade. Embora tenhamos usado esse método apenas para quantificar MPs baseados em PBAT do solo, a extração por solvente e o procedimento de quantificação de 1H-NMR podem ser úteis para quantificar outros MPs e NPs de solos adicionais26,49. Estender o método a MPs feitos de outro polímero requer garantir a solubilidade do polímero no solvente e identificar picos de RMN característicos do polímero no solvente escolhido. Pode ser necessário selecionar um novo calibrante interno que seja solúvel no solvente escolhido e que não produza picos que se sobreponham aos do polímero em causa42.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes conhecidos ou relacionamentos pessoais que possam ter influenciado o trabalho relatado neste artigo.
Agradecimentos
Obrigado ao USDA-NIFA por financiar este projeto por meio do prêmio número 2020-67019-31167 para SMS e ao programa de Iniciativas de Pesquisa de Planejamento Estratégico da Universidade do Tennessee (SPRINT) para uma concessão interna DGH e SMS. Os financiadores não tiveram nenhum papel no desenho do estudo, coleta de dados, análise, interpretação, redação do relatório ou na decisão de enviar o artigo para publicação.
Materiais
| Name | Company | Catalog Number | Comments |
| 1,4-dimethoxybenzene | Arcos Organics 99%+ | AC115411000 | 1 mg per sample |
| Amber glass bottle with PTFE lined lid (1 L) | Kimble | 5223253C-26 | reusable |
| Chloroform; trichloromethane | Fisher Chemical | AA43685M6 | 90 mL per sample; Fisher Optima |
| Deuterated chlorform; trichloro(deuterio)methane | Sigma Aldrich | 1034200025 | 1 mL per sample; minimum 99.8% deuterated; stabilized with silver |
| Glass beads (3 mm diameter) | Propper Manufacturing | 3000600 | 20 per sample |
| Glass extraction jars with PTFE lined lid (~250 mL volume) | Kimble | 5510858B | 2 per sample, reusable |
| Graduated cylinder, 1 L, polypropylene | Nalgene | 3662-1000 | reusable |
| Graduated cylinder, 500 mL, polypropylene | Nalgene | 3662-0500 | reusable |
| Methanol | Fisher Chemical | A412-4 | 20 mL per sample; certified ACS |
| Micropipette wth range of 0.5 - 1 mL | Fisher Scientific | 3123000063 | reusable |
| NMR spectrometer | Bruker | n/a | 500 MHz instrument |
| NMR tube (7 inch height, high-throughput) | Wilmad | WG-1000-7 | 1 per sample |
| Platform shaker | Eppendorf, Excella E5 | M1355-0000 | reusable |
| Polyethylene pipette tip (10 mL volume) | Eppendorf | 22492098 | 1 per sample, single use |
| Polypropylene micropipette tips (1 mL volume) | Fisher Scientific | 02-707-510 | 3 per sample, single use |
| Semi-microbalance | Mettler Toledo | 30532226 | reusable |
Referências
- Andrady, A. L. The plastic in microplastics: A review. Mar Pollut Bull. 119 (1), 12-22 (2017).
- Fakour, H., et al. Quantification and analysis of microplastics in farmland soils: Characterization, sources, and pathways. Agriculture. 11 (4), 330(2021).
- Wang, K., et al. Impact of long-term conventional and biodegradable film mulching on microplastic abundance, soil structure and organic carbon in a cotton field. Environ Pollut. 356, 124367(2024).
- Plastics Europe Plastics - the Facts. , Plastics Europe. Available from: https://plasticseurope.org/knowledge-hub/plastics-the-facts-2022/ (2022).
- Assessment of agricultural plastics and their sustainability: A call for action. , Food Agriculture Organization. Rome. (2021).
- Beriot, N., et al. Intensive vegetable production under plastic mulch: A field study on soil plastic and pesticide residues and their effects on the soil microbiome. Sci Total Environ. 900, 165179(2023).
- Liu, E. K., He, W. Q., Yan, C. R. White revolution to white pollution - Agricultural plastic film mulch in China. Environ Res Lett. 9 (9), 091001(2014).
- Sintim, H. Y., et al. Release of micro- and nanoparticles from biodegradable plastic during in situ composting. Sci Total Environ. 675, 686-693 (2019).
- Skoczinski, P., et al. Bio-based building blocks and polymers - Global capacities, production and trends 2023-2028. Indust Biotech. 20 (2), 52-59 (2024).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Li, C., et al. Effects of biodegradable mulch on soil quality. Appl Soil Ecol. 79, 59-69 (2014).
- Wang, F., Wang, Q., Adams, C. A., Sun, Y., Zhang, S. Effects of microplastics on soil properties: Current knowledge and future perspectives. J Hazardous Mater. 424, 127531(2021).
- Möller, J. N., Löder, M. G. J., Laforsch, C. Finding microplastics in soils: A review of analytical methods. Environ Sci Technol. 54 (4), 2078-2090 (2020).
- Paul, A., Wander, L., Becker, R., Goedecke, C., Braun, U. High-throughput NIR spectroscopic (NIRS) detection of microplastics in soil. Environ Sci Pollut Res. 26 (8), 7364-7374 (2019).
- Wortman, S. E., Jeske, E., Samuelson, M. B., Drijber, R. A new method for detecting micro-fragments of biodegradable mulch films containing poly(butylene adipate-co-terephthalate) (PBAT) in soil. J Environ Quality. 51 (1), 123-128 (2021).
- Peez, N., et al. Quantitative analysis of PET microplastics in environmental model samples using quantitative 1H-NMR spectroscopy: Validation of an optimized and consistent sample clean-up method. Anal Bioanal Chem. 411 (28), 7409-7418 (2019).
- Praveena, S. M., Aris, A. Z., Singh, V. Quality assessment for methodological aspects of microplastics analysis in soil. Trend Environ Anal Chem. 34, e00159(2022).
- Primpke, S., et al. Critical assessment of analytical methods for the harmonized and cost-efficient analysis of microplastics. Appl Spectro. 74 (9), 1012-1047 (2020).
- Käppler, A., et al. Analysis of environmental microplastics by vibrational microspectroscopy: FTIR, Raman or both. Anal Bioanal Chem. 408 (29), 8377-8391 (2016).
- Watteau, F., Dignac, M. F., Bouchard, A., Revallier, A., Houot, S. Microplastic detection in soil amended with municipal solid waste composts as revealed by transmission electronic microscopy and pyrolysis/GC/MS. Front Sustainable Food Syst. 2, 407866(2018).
- Pfohl, P., et al. Microplastic extraction protocols can impact the polymer structure. Microplastics Nanoplastics. 1 (1), 1-13 (2021).
- Xu, J. L., Thomas, K. V., Luo, Z., Gowen, A. A. FTIR and Raman imaging for microplastics analysis: State of the art, challenges and prospects. Trend Anal Chem. 119, 115629(2019).
- Cardoza, L. A., Korir, A. K., Otto, W. H., Wurrey, C. J., Larive, C. K. Applications of NMR spectroscopy in environmental science. Prog Nucl Magnetic Resonance Spectr. 45 (3-4), 209-238 (2004).
- Peez, N., Rinesch, T., Kolz, J., Imhof, W. Applicable and cost-efficient microplastic analysis by quantitative 1H-NMR spectroscopy using benchtop NMR and NoD methods. Magnetic Resonance Chem. 60 (1), 172-183 (2022).
- Günther, M., Imhof, W. Simultaneous quantification of microplastic particles by non-deuterated (NoD) 1 H-qNMR from samples comprising different polymer types. Analyst. 148 (5), 1151-1161 (2023).
- Papini, G., Petrella, G., Cicero, D. O., Boglione, C., Rakaj, A. Identification and quantification of polystyrene microplastics in marine sediments facing a river mouth through NMR spectroscopy. Marine Pollut Bull. 198, 115784(2024).
- Herrera, R., Franco, L., Rodríguez-Galán, A., Puiggalí, J. Characterization and degradation behavior of poly(butylene adipate-co-terephthalate)s. J Polymer Sci Part A. 40 (23), 4141-4157 (2002).
- Mauel, A., Pötzschner, B., Meides, N., Siegel, R., Strohriegl, P., Senker, J. Quantification of photooxidative defects in weathered microplastics using 13 C multiCP NMR spectroscopy. RSC Adv. 12 (18), 10875-10885 (2022).
- Bharti, S. K., Roy, R. Quantitative 1H NMR spectroscopy. Trend Anal Chem. 35, 5-26 (2012).
- Li, X., Hu, K. Quantitative NMR Studies of Multiple Compound Mixtures. Ann Rep NMR Spectro. 90, 85-143 (2017).
- Simmler, C., Napolitano, J. G., McAlpine, J. B., Chen, S. N., Pauli, G. F. Universal quantitative NMR analysis of complex natural samples. Curr Opinion Biotechnol. 25, 51-59 (2014).
- Giraudeau, P. Challenges and perspectives in quantitative NMR. Magnetic Reason Chem. 55 (1), 61-69 (2017).
- Nelson, T. F., Remke, S. C., Kohler, H. P. E., McNeill, K., Sander, M. Quantification of Synthetic Polyesters from Biodegradable Mulch Films in Soils. Environ Sci Technol. 54, 266-275 (2020).
- Brandolini, A. J., Hills, D. D. NMR spectra of polymers and polymer additives. , CRC Press. Boca Raton. (2000).
- Matsuda, H., Asakura, T., Miki, T. Triad sequence analysis of poly(ethylene/butylene terephthalate) copolymer using 1H NMR. Macromolecules. 35 (12), 4664-4668 (2002).
- Yu, Y., Flury, M. How to take representative samples to quantify microplastic particles in soil. Sci Total Environ. 784, 147166(2021).
- Cambardella, C. A., et al. Field-scale variability of soil properties in central Iowa soils. Soil Sci Soc Am J. 58, 1501-1511 (1994).
- Ramsey, M. H., Argyraki, A. Estimation of measurement uncertainty from field sampling: Implications for the classification of contaminated land. Sci Total Environ. 198 (3), 243-257 (1997).
- Desaules, A. Critical evaluation of soil contamination assessment methods for trace metals. Sci Total Environ. 426, 120-131 (2012).
- Pennock, D., Yates, T., Braidek, J. Soil Sampling Designs. Soil Sampl Meth Anal. , 25-38 (2006).
- Büks, F., Kaupenjohann, M. Global concentrations of microplastics in soils - A review. SOIL. 6 (2), 649-662 (2020).
- Bowen, M., O'Neill, I., Pringuer, M. Quantitiative Applications of Nuclear Magnetic Resonance in Pharmaceutical Analysis. Proc Soc Anal Chem. , 294-297 (1974).
- Frank, O., Kreissl, J. K., Daschner, A., Hofmann, T. Accurate determination of reference materials and natural isolates by means of quantitative 1H NMR spectroscopy. J Agri Food Chem. 62 (12), 2506-2515 (2014).
- Malz, F., Jancke, H. Validation of quantitative NMR. J Pharma Biomed Anal. 38 (5), 813-823 (2005).
- Astner, A. F., et al. Forming micro-and nano-plastics from agricultural plastic films for employment in fundamental research studies. J Vis Exp. (185), e641112(2022).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. J Polymer Environ. 29 (9), 2916-2931 (2021).
- Deshoulles, Q., et al. Hydrolytic degradation of biodegradable poly(butylene adipate-co-terephthalate) (PBAT) - Towards an understanding of microplastics fragmentation. Polymer Degrad Stability. 205, 110122(2022).
- Zhang, Y., et al. Aging significantly increases the interaction between polystyrene nanoplastic and minerals. Water Res. 219, 118544(2022).
- Peez, N., Janiska, M. C., Imhof, W. The first application of quantitative 1H NMR spectroscopy as a simple and fast method of identification and quantification of microplastic particles (PE, PET, and PS). Anal Bioanal Chem. 411 (4), 823-833 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados