Method Article
Quantifizierung von Polybutylenadipat-Terephthalat-basierten Mikro- und Nanokunststoffen aus dem Boden mittels Protonenkernspinresonanzspektroskopie
In diesem Artikel
Zusammenfassung
Hier wird eine Methode zur Quantifizierung von Mikro- und Nanoplastik aus Polybutylenadipatterephthalat im Boden mittels Kernspinresonanzspektroskopie beschrieben. Diese Technik verbessert die bestehende Methodik, da sie sich auf die Quantifizierung von Nanoplastik erstreckt und leicht für die Verarbeitung von Umweltproben in großen Mengen angepasst werden kann.
Zusammenfassung
Eine Methode zur Rückgewinnung und Quantifizierung von Mikro- und Nanoplastik (MP und NPs), das sich während des biologischen Abbaus im Boden gebildet hat, ist erforderlich, um den Abbau und die Umweltauswirkungen von biologisch abbaubaren Kunststoffprodukten genau zu bewerten. Das Vorhandensein von MP und NP im Boden kann Bodeneigenschaften wie das Aggregationsverhalten verändern oder toxische Auswirkungen auf die Bodenbiota haben. Bestehende MP-Rückgewinnungsmethoden sind nicht immer für die Messung von biologisch abbaubaren Polymeren wie Polybutylenadipatterephthalat (PBAT) geeignet. Einige gängige Aufschlussverfahren mit Säuren oder Oxidationsmitteln können PBAT-basierte biologisch abbaubare MP zerstören. Identifizierungsmethoden wie Mikro-FTIR- und Mikro-Raman-Spektroskopie sind auch durch die Mindestgröße der Partikel begrenzt, die zurückgewonnen und analysiert werden können. Daher wurde diese Methode entwickelt, um PBAT aus dem Boden zu extrahieren und zu quantifizieren, um den Massenanteil von MP und NP im Boden zu bewerten, ohne PBAT chemisch umzuwandeln. In dem Protokoll wird eine Chloroform-Methanol-Lösung verwendet, um PBAT selektiv aus dem Boden zu extrahieren. Das Lösungsmittel wird aus dem Extrakt verdampft und dann wieder in deuteriertem Chloroform gelöst. Der Extrakt wird mittels Protonenkernspinresonanzspektroskopie (1H-QNMR) unter quantitativen Parametern analysiert, um die Menge an PBAT in jeder Probe zu quantifizieren. Die Lösungsmittelextraktionseffizienz für PBAT reicht von 76 % in einem schattigen Lehmboden bis zu 45 % in einem sandigen Elkhorn-Lehmboden. Die PBAT-Rückgewinnung kann bei photooxidierten Materialien im Vergleich zu unberührten Materialien reduziert sein und bei Böden mit hohem Tongehalt reduziert sein. Die Extraktionseffizienz hängt nicht von der PBAT-Konzentration innerhalb des Testbereichs ab, aber es wurden niedrigere Extraktionseffizienzen für NPs als für MP beobachtet. Die Ergebnisse der PBAT-Quantifizierung waren vergleichbar mit der Quantifizierung des Kunststoffabbaus durch Messung der kumulativen Bodenatmung in einer Laborinkubationsstudie.
Einleitung
Methoden zur Messung der MP-Kontamination im Boden sind notwendig, um das Ausmaß der Plastikkontamination in globalen Böden1, die Quellen der Plastikkontamination2 und mögliche Lösungen3 zu verstehen. Landwirtschaftliche Böden sind in besonderer Weise der Kontamination durch Kunststoffe ausgesetzt: Im Jahr 2021 wurden jährlich mehr als 15 Millionen Tonnen Kunststoff in der Landwirtschaftverwendet 4, darunter 2,5 Millionen Tonnen Kunststoffmulch5. Kunststoffmulch wird in engem Kontakt mit dem Boden verwendet, ein- oder mehrmals pro Jahr erneut ausgebracht6 und kann nach seiner Nutzungsdauer nur schwer vollständig aus dem Boden zu entfernensein 7. Ein wichtiger Bereich, in dem MP-Messmethoden benötigt werden, ist die Bewertung von biologisch abbaubaren Kunststoffprodukten wie biologisch abbaubaren Kunststoffmulchen für den Einsatz in pflanzlichen Systemen8.
Biologisch abbaubare Kunststoffprodukte aus der Erde sind vielversprechende Alternativen zu herkömmlichen landwirtschaftlichen Kunststoffen, da sie die Kontamination des Bodens durch Kunststoffmulchen beseitigen könnten, wenn sie wie vorgesehen funktionieren. Im Jahr 2022 wurden weltweit weniger als 1 Million Tonnen biologisch abbaubarer Kunststoff produziert, wobei für die Branche ein schnelles Wachstum erwartetwird 9. Die vier gebräuchlichsten biologisch abbaubaren Polymere, Polymilchsäure (PLA), polymerisierte Stärke, Polyhydroxyalkanoate (PHA) und Polybutylenadipatterephthalat (PBAT), werden alle kommerziell oder experimentell in landwirtschaftlich abbaubaren biologisch abbaubaren Kunststoffmulchen verwendet10. Trotz ihres Versprechens ist der Abbau dieser biologisch abbaubaren Kunststoffprodukte unter Feldbedingungen variabel11. Während sich einige Studien über den Abbau von biologisch abbaubarem Kunststoffmulch im Feld auf makroplastische Fragmente konzentriert haben11, erfordert die Bewertung des vollständigen Abbaus von Kunststoffmaterialien die Fähigkeit, MP und NP aus dem Boden zurückzugewinnen. Die Quantifizierung von Mikroplastik aus dem Boden ist auch wichtig, um das Potenzial für negative Auswirkungen auf die Bodenökosysteme durch MP-Verschmutzungabzuschätzen 12.
Zu den häufig verwendeten Techniken zur Identifizierung und Quantifizierung von MP gehören die visuelle Analyse, die Mikro-Fourier-transformierte Infrarotspektroskopie (μFTIR), die Mikro-Raman-Spektroskopie (μRaman), die Gaschromatographie-Massenspektroskopie (GCMS einschließlich Pyrolyse-GCMS und thermischer Extraktionsdesorptions-GCMS) und die thermogravimetrische Analyse13. Zu den weiteren sich entwickelnden Techniken gehören die Nahinfrarotspektroskopie für die In-situ-MP-Messung in Böden 14, die Extraktion der Fettsäuremethylveresterung für die GCMS-Analyse15 und die Kernspinresonanzspektroskopie16. Bis zu 90 % der Studien, in denen MP im Boden quantifiziert wurden, verwendeten visuelle Analysen (allein oder in Kombination mit anderen Techniken), um Kunststoffpartikel zu identifizieren, während 77 % FTIR-, Raman- oder GCMS-Spektroskopietechniken verwendeten17. Die Entwicklung und Harmonisierung einer Vielzahl von MP-Quantifizierungstechniken kann dazu beitragen, die Fähigkeit der wissenschaftlichen Gemeinschaft zu erweitern, verschiedene Fragen der Mikroplastikforschung zu beantworten18. Es gibt drei generische Ansätze zur Aufbereitung von Bodenproben zur Quantifizierung von Mikroplastik: 1) Abtrennung unveränderter einzelner Mikroplastikpartikel aus dem Boden (z. B. durch Dichtetrennung), 2) Extraktion von transformiertem Kunststoff- oder Polymermaterial (z. B. durch Auflösung) oder 3) Analyse von Schüttgut. Sowohl die μFTIR- als auch die μRaman-Spektroskopie erfordern, dass einzelne MP vom Boden getrennt werden, bevor sie chemisch identifiziert werden können19, während Pyro-GCMS an isolierten Kunststoffpartikeln durchgeführt werden kann, die vom Boden oder Schüttgut abgetrennt wurden20. Die Trennung von biologisch abbaubaren MP aus dem Boden kann schwierig sein, da einige Aufschlüsse zur Entfernung von organischer Substanz im Boden biologisch abbaubare Polymere, einschließlich PBAT21, abbauen oder anderweitig chemisch verändern können. Sowohl die Mikro-Raman- als auch die μFTIR-Spektroskopie haben ebenfalls eine räumliche Auflösungsgrenze: Partikel müssen größer als 10-20 μm für μFTIR und 1 μm für μRaman sein (wenn einzelne Partikel so klein für die Analyse vorbereitet werden können)19,22. Diese Techniken können die chemische Identifizierung von MP-Polymeren ermöglichen, und spektroskopische Bildgebung kann zur Messung der MP-Größe22 eingesetzt werden. Alle Arten von Pyro-GCMS sind insofern begrenzt, als Proben während der Analyse zerstört werden.
NMR wurde erfolgreich zur Charakterisierung von Bodenbestandteilen und Schadstoffen23, zur Quantifizierung von MPs 16,24,25,26 und zur Bewertung des Abbaus von PBAT und einem anderen Polymer, Polystyrol 27,28, eingesetzt. Bei quantitativen Parametern erzeugt die 1H-NMR-Spektroskopie Spektren, bei denen die Fläche jedes spektralen Peaks direkt proportional zur Anzahl der beitragenden Wasserstoffatome in der Probe ist. Dies ermöglicht die Quantifizierung der Bestandteile in einer Probe29. Die NMR ist eine wertvolle Analysetechnik für die Quantifizierung einiger MP, einschließlich PBAT, im Boden, da sie eine gleichzeitige Quantifizierung und Identifizierung ermöglicht, für komplexe und unreine Gemische geeignet ist und keine chemisch identischen Referenzstandards benötigt 30,31. Die NMR-Spektroskopie eines Lösungsmittelextrakts könnte MPs oder NPs quantifizieren, die kleiner sind als solche, die für die μFTIR-, μRaman- oder GCMS-Quantifizierung verarbeitet werden können. Trotz dieser Vorteile bieten quantitative NMR-Ansätze immer noch eine geringere Empfindlichkeit als destruktive massenspektroskopie-basierte Ansätze32.
Die vorgeschlagene Methode, die in Abbildung 1 dargestellt ist, beschreibt einen Arbeitsablauf zur Verarbeitung und Analyse von PBAT-haltigen Bodenproben, einschließlich PBAT-Kunststoffen in Nanogröße. Bei der Methode wird PBAT-Polymer aus Bodenproben extrahiert, indem der Boden mit einer Mischung aus Chloroform und Methanol geschüttelt wird. Die Lösungsmittelextrakte, die PBAT enthalten, werden getrocknet und dann in deuteriertem Chloroform unter Zugabe eines internen Kalibrants wieder gelöst. Die NMR-Spektroskopie wird an den Extrakten anhand quantitativer Parameter durchgeführt. Die resultierenden Spektren werden analysiert, um PBAT zu quantifizieren, indem die Fläche der angepassten Peaks, die den Wasserstoffatomen der PBAT und den kalibrierenden Molekülen entspricht, verglichen wird. Diese Methode wendet den von Nelson et al. demonstrierten Ansatz der Lösungsmittelextraktion und der Protonenkernspinresonanzspektroskopie (1H-NMR) an33. Ziel war es, eine Methode anzuwenden, die geeignet ist, Proben im Umweltmaßstab (~100 g Boden) zu verarbeiten und eine Reihe von Proben parallel ohne spezielle Extraktionsgeräte zu verarbeiten.
Protokoll
1. Sammlung und Aufbereitung des Bodens
HINWEIS: Probenahme- und Verarbeitungsgeräte sollten das Polymer PBAT oder seine Bestandteile nicht enthalten, um eine Kontamination der Probe zu vermeiden. Andere Polymermaterialien beeinträchtigen nicht unbedingt die Quantifizierung von PBAT aus dem Boden. Zum Beispiel erzeugen Polyethylen und Polypropylen keine spektralen Peaks in Chloroform 1H-NMR, die die Quantifizierung von PBAT34 beeinträchtigen, aber Polyethylenterephthalat mit seiner Terephthalatgruppe würdehöchstwahrscheinlich 35 stören, ebenso wie andere Polyester. Referenztexte wie Brandolini und Hills34 können verwendet werden, um die 1H-NMR-Spektren verschiedener Polymere zu bestimmen und auf überlappende Peaks mit den zur Quantifizierung verwendeten PBAT-Peaks zu suchen (siehe unten).
- Für jede Probe sind mindestens 100 g äquivalentes Trockengewicht des Bodens zu entnehmen. Bestimmen Sie die Größe der Bodenprobe auf der Grundlage der erwarteten Konzentration von Kunststoffen, um eine repräsentative Probe zu entnehmen, und homogenisieren Sie den Boden, um bei Bedarf eine Teilprobe zu entnehmen36.
ANMERKUNG: Bodensysteme sind von Natur aus heterogen37, ebenso wie die Schadstoffverteilungen (z. B. MP) in ihnen38. Es gibt auch Variabilität im Zusammenhang mit Methoden, die zur Messung von Schadstoffkonzentrationen verwendet werden39. Daher wird empfohlen, ein Probenahmedesign oder ein Versuchsdesign zu erstellen, das Replikatproben als Werkzeug zur Abschätzung der Unsicherheit und zur Entnahme repräsentativer Probenvolumina auf der Grundlage der Kunststoffkonzentration40 enthält. Es wurde dokumentiert, dass die MP-Konzentrationen im Boden zwischen nahezu Null und 1 x 107 Items pro kg Boden liegen, wobei die meisten Standorte weniger als 10.000 Items pro kg Boden enthalten41. Ein theoretisch repräsentatives Elementarvolumen könnte von 23m2 bei einer MP-Konzentration von 10 Items pro Quadratmeter bis zu 0,02m2 reichen, wenn die MP-Konzentrationen 10.000 Items pro Quadratmeter betragen36.- Um die effektive Probenahmefläche von einem Feldstandort zu vergrößern und gleichzeitig die Menge an zu verarbeitender Erde zu minimieren, sammeln Sie Erde von einer großen Fläche (z. B. 1 m2) und verwenden Sie dann die Viertelmethode, um die Probe zu homogenisieren und zu konsolidieren (z. B. auf 500 g Erde)36.
- Bei der Viertelmethode die Erde großflächig auf eine Plane oder eine andere Oberfläche häufen, mit einer Schaufel gründlich mischen und dann in Viertel teilen. Ein Viertel der Probe wird aufbewahrt und die anderen drei Viertel verworfen. Wiederholen Sie diesen Vorgang, bis die Probe die gewünschte Größe hat.
- Sieben Sie die Erde durch ein 2-mm-Maschensieb. Reinigen Sie das Sieb und die Auffangwanne zwischen den Bodenproben vollständig.
- Trocknen Sie den Boden an der Luft und lagern Sie ihn dann in versiegelten Probenbeuteln. Trockener Boden kann vor der PBAT-Extraktion in diesem Zustand gelagert werden.
2. Extraktion von PBAT aus Böden
ACHTUNG: Chloroform ist flüchtig und giftig. Lagern Sie es im Dunkeln in Braunglas, fern von Oxidationsmitteln. Tragen Sie bei der Arbeit damit geeignete Handschuhe, Augenschutz und Schutzkleidung. Fassen Sie es nur in einem Abzug an. Methanol ist brennbar, flüchtig und giftig. Lagern Sie Methanol in einem feuerfesten Schrank. Tragen Sie bei der Arbeit mit Methanol geeignete Handschuhe, Augenschutz und Schutzkleidung. Verarbeiten Sie Methanol nur in einem Abzug. Glaswaren können zerbrechen und Verletzungen verursachen. Tragen Sie beim Umgang mit Glaswaren einen Augenschutz. Vermeiden Sie es, Glasscherben mit bloßen Händen zu berühren. Reinigen Sie stattdessen Glasscherben mit schnittfesten Handschuhen, einer Zange, einem Besen oder einem anderen Werkzeug.
HINWEIS: Chloroform ist mit den meisten Kunststoffen oder Metallen nicht kompatibel. Stellen Sie sicher, dass alle Materialien kompatibel sind (z. B. Glas oder Polytetrafluorethylen, PTFE-Kunststoff).
- Bereiten Sie in einem Abzug 100 ml eines 90:10 V/V-Gemischs aus Chloroform (Trichlormethan; CHCl3) und Methanol (CH3OH) pro zu extrahierender Probe. Um beispielsweise aus 5 Proben zu extrahieren, mischen Sie 450 mL Chloroform mit 50 mL Methanol.
- Geben Sie 100 g trockene Erde, 100 ml Chloroform-Methanol-Lösung und 20 Glasperlen in ein Extraktionsglas aus Glas. Verschließen Sie die Extraktionsgläser mit PTFE-ausgekleideten Deckeln, so dass kein Lösungsmitteldampf aus den Gläsern austreten kann.
HINWEIS: PBAT ist in Chloroform gut löslich; Es wurde ein Chloroform-Methanol-Gemisch verwendet, da Methanol Wasserstoffbrückenbindungen mit gelösten Stoffen bilden kann, die mit mineralischen und organischen Bestandteilen des Bodens konkurrieren und die Rückgewinnung von PBAT aus dem Boden erhöhen33. - Verwenden Sie einen Schütteltisch, um die Extraktionsgläser 8 Stunden lang bei 200 U/min zu schütteln. Lassen Sie die Erde in den Extraktionsgläsern nach dem Schütteln mindestens 4 h ruhen.
- Trennen Sie den Extrakt vom Boden. Öffnen Sie im Abzug einen Deckel für ein Extraktionsgefäß und geben Sie die Flüssigkeit per Pipette durch einen qualitativen Papierfilter mit einer Porengröße von 11 μm in ein beschriftetes, sauberes Glasgefäß. Notieren Sie die Menge des aus dem Extraktionsgefäß zurückgewonnenen Lösungsmittels. Vermeiden Sie die Übertragung von Bodenfeststoffen mit dem Extrakt; Lassen Sie bei Bedarf einige ml Lösungsmittel zurück.
HINWEIS: Das Filterpapier ist dazu bestimmt, große Stücke organischer Substanz aus der Lösungsmittellösung zu entfernen. - Trocknen Sie die Extrakte, indem Sie sie im Abzug belassen, bis das Lösungsmittel vollständig verdampft ist. Dies kann bis zu 24 Stunden dauern. Trocknen Sie die Erde auch im Abzug. Sobald die Erde vollständig trocken ist, entsorgen Sie sie.
- Sobald die Extrakte getrocknet sind, verschließen Sie jedes Probenglas und lagern Sie sie bis zur Verwendung an einem kühlen, dunklen und trockenen Ort.
3. Sammlung von NMR-Spektren
VORSICHT: Deuteriertes Chloroform birgt die gleichen Risiken und erfordert die gleichen Vorsichtsmaßnahmen wie das oben beschriebene protonierte Chloroform.
- Der Probe wird ein internes Kalibrant42 zugesetzt. Verwenden Sie eine Waage, um 1,00 mg 1,4-Dimethoxybenzol (DMB; C6H14O) in jedes Probengefäß mit einem getrockneten Extrakt geben.
- Die Probe wird in deuteriertem Chloroform (CDCl3; Trichlor(deutero)methan resuspendiert. Geben Sie im Abzug mit einer Mikropipette 500 μl deuteriertes Chloroform in das Glas mit dem getrockneten Probenextrakt.
- Verschließen Sie das Glas und schütteln Sie, um den getrockneten Extrakt aufzulösen, indem Sie das Glas vorsichtig gegen eine Hand oder eine Tischplatte klopfen, etwa 10x auf jeder Seite. Verwenden Sie dann eine saubere Pipettenspitze, um die Flüssigkeit in ein NMR-Röhrchen zu übertragen.
- Wiederholen Sie die Schritte 3.2 und 3.3 mit zusätzlichen 500 μl deuteriertem Chloroform und geben Sie den zweiten Teil der Probe in dasselbe NMR-Röhrchen wie das erste. Die zweite Spülung dient dazu, die vollständige Auflösung und Rückgewinnung des getrockneten Extrakts aus dem Behälter zu gewährleisten.
- Verschließen Sie das NMR-Röhrchen und lagern Sie es 3 Tage lang, bevor Sie die NMR-Spektren sammeln. Die geeignete Lagerzeit hängt von der Verdampfungsrate des Lösungsmittels aus dem NMR-Röhrchen ab. Analysieren Sie die Proben kurz nach der Aufbereitung mit deuteriertem Chloroform.
- Um NMR-Röhrchen zum Spektrometer zu transportieren, verwenden Sie eine Halterung, die für die Halterung der langen, empfindlichen Röhrchen ausgelegt ist. Diese haben in der Regel eine Stütze in der Nähe der Basis und der Oberseite des Rohrs. Halten Sie die Rohre während des Transports in einer aufrechten Position.
- Mit einem 500 MHz NMR-Spektrometer wird ein 1H-Protonenspektrum mit einem 90°-Pulswinkel29, einer Pulsbreite von 8 μs33, einer Verzögerungszeit von 25 s (bestimmt durch das Inversionswiederherstellungsexperiment29,43), 262 K Punkten pro Scan und 32 Komposit-Scans29,44 von 12 bis -2 ppm für eine Gesamtlaufzeit von 25 Minuten erfasst.
HINWEIS: Wir haben ein Bruker Neo 500 MHz Spektrometer mit einer breitbandoptimierten Sonde und einem Autosampler bei einer kontrollierten Temperatur von 300 K verwendet. Andere ähnliche Spektrometer können verwendet werden. Bei Verwendung eines Geräts mit einer anderen Magnetfeldstärke kann die geeignete Verzögerungszeit auf der Grundlage der T1-Relaxationszeit für PBAT und 1,4-Dimethoxybenzol unter Verwendung eines Inversionswiederherstellungsexperiments berechnet werden29,43. - Nachdem die Probe ausgeführt wurde, speichern, übertragen oder greifen Sie nach Bedarf auf die Spektraldaten zu.
Überprüfen Sie Spektraldaten. Vergewissern Sie sich, dass alle bei der Quantifizierung verwendeten PBAT-Peaks eindeutig aufgelöst sind, falls vorhanden. Zur Quantifizierung werden die PBAT-Peaks 5 (8,10 ppm), 6 (4,44 ppm), 6' (4,38 ppm), 3' (4,15 ppm) und 3 (4,09 ppm) verwendet (Details in Tabelle 1). Verwenden Sie die DMB-Peaks A (6,84 ppm) und B (3,77 ppm) auch für die Quantifizierung (Details in Tabelle 2). Achten Sie besonders auf die 6, 6', 3' und 3 Peaks von PBAT, die sehr nahe beieinander liegen und sich überlappen können. - Wenn einige Peaks nicht eindeutig aufgelöst sind, verdünnen Sie die Probe. Kombinieren Sie 100 μl Probe und 500 μl deuteriertes Chloroform in einem sauberen NMR-Röhrchen und führen Sie die Probe unter denselben in Schritt 3.7 definierten Parametern erneut durch.
4. Analyse von NMR-Spektren zur Quantifizierung von PBAT
HINWEIS: Eine Spektralanalyse kann jederzeit nach der Entnahme durchgeführt werden. Die Analyse der Daten am selben Tag, an dem die Spektren erstellt werden, wird bevorzugt, um sicherzustellen, dass die Proben im Falle von Problemen immer noch für eine Wiederholung zur Verfügung stehen.
- Öffnen Sie die vom Spektrometer erstellte FID-Datei in der NMR-FID-Verarbeitungssoftware (wir haben MestreNova von MestreLab verwendet, andere Optionen, aber andere Optionen sind verfügbar).
- Linienverbreiterung auf die Spektren anwenden: Wählen Sie in der FID-Verarbeitungssoftware im Menü "Verarbeitung" die Option "Verarbeitungsvorlage " aus und navigieren Sie dann zum Abschnitt "Apodisierung". Wählen Sie ein Exponentialmodell mit einer Helligkeit von 0,5 Hz und einem ersten Punkt von 0,5 Hz aus.
- Wenden Sie die automatische Phasenkorrektur an, indem Sie im Menü "Verarbeitung" auf die Schaltfläche "Automatische Phasenkorrektur" klicken. Wenden Sie die automatische Baseline-Korrektur an, indem Sie im Menü "Verarbeitung" auf die Schaltfläche "Automatische Baseline-Korrektur" klicken.
- Verwenden Sie die Peak-Dekonvolution, um die gemessenen spektralen Peaks anzupassen: Klicken Sie auf der Registerkarte Analyse der Spektrenverarbeitungssoftware im Abschnitt Anpassung auf die Schaltfläche Neue Anpassung . Klicken Sie mit dem Cursor auf die Spektren bei einer Verschiebung von 8,5 ppm, ziehen Sie den Cursor dann auf eine Verschiebung von 3,0 und lassen Sie ihn los.
- Klicken Sie unter dem Abschnitt Anpassung auf Linienanpassungstabelle , um alle angepassten Spitzen anzuzeigen.
- Behalten Sie die für die Quantifizierung verwendeten Peaks bei, wie in Tabelle 1 und Tabelle 2 beschrieben und in Abbildung 2 beschriftet. Zur Quantifizierung werden die PBAT-Peaks 5 (8,10 ppm), 6 (4,44 ppm), 6' (4,38 ppm), 3' (4,15 ppm) und 3 (4,09 ppm) zur Quantifizierung (Details in Tabelle 1) sowie die DMB-Peaks A (6,84 ppm) und B (3,77 ppm) verwendet. Die Wasserstoffatome, die jedem in Tabelle 1 und Tabelle 2 aufgeführten Peak entsprechen, sind in den Strukturdiagrammen in Abbildung 3 gekennzeichnet, wobei Abbildung 3A die Struktur der beiden PBAT-Dimere zeigt, Abbildung 3B zeigt, wie die Position der Dimere im Polymer interagiert, um die Peakverschiebung in Wasserstoffatomen aus dem 1,4-Butandiol-Monomer zu verändern, und Abbildung 3C, die die Struktur von DMB zeigt.
- Löschen Sie alle anderen Peaks aus der Passung, indem Sie die unerwünschten Peaks auswählen und auf Peak löschen klicken.
- Verwenden Sie die Anpassungstabelle, um die Fläche jedes Peaks für Berechnungen in ein Tabellenkalkulationsprogramm zu kopieren (wir haben uns für die Verwendung von Tabellenkalkulationen entschieden).
- Um Peakflächen in eine Tabelle zu kopieren, wählen Sie zunächst alle Peakinformationen in der Linienanpassungstabelle aus. Klicken Sie dann mit der rechten Maustaste und wählen Sie "Kopieren " aus dem Einblendmenü. Fügen Sie die Daten in die Tabelle ein.
- Berechnen Sie die Anzahl der Mol DMB, die der Probe hinzugefügt wurden, nDMB, mit der Gleichung

wobei mDMB die Masse von DMB ist, die der Probe zugesetzt wird, in Gramm (empfohlen 1,00 mg) und MMDMB die molare Masse von DMB (138,17 g/mol). - Berechnen Sie die Anzahl der Mole des Butylenterephthalat-Dimers von PBAT in der Probe, nBT, unter Verwendung der Gleichung

Dabei ist A5 die gemessene Fläche des PBAT-Peaks 5, AA die gemessene Fläche des DMB-Peaks A und AB die gemessene Fläche des DMB-Peaks B. Die von der Spektralanalysesoftware erzeugten Flächeneinheiten sind beliebig. - Berechnen Sie die Anzahl der Mole des Butylenadipat-Dimers von PBAT in der Probe, nBA, unter Verwendung der Gleichung

Dabei ist A3 die gemessene Fläche des PBAT-Peaks 3, A3' die gemessene Fläche des PBAT-Peaks 3', A6 die gemessene Fläche des PBAT-Peaks 6 und A6' die gemessene Fläche des PBAT-Peaks 6'. Die von der Spektralanalysesoftware erzeugten Flächeneinheiten sind beliebig. - Berechnen Sie die Masse von PBAT in der Probe, mPBAT, zurückgewonnen, unter Verwendung der Gleichung

wobei MMBA die molare Masse eines BA-Dimers von PBAT (200 g/mol) und MMBT die molare Masse eines BT-Dimers von PBAT (220 g/mol) ist. - Wenn eine bekannte Menge an PBAT in der Probe vorhanden war, kann die prozentuale Wiederfindung η für die Probe als Maß für die Extraktionseffizienz gemäß der Gleichung berechnet werden

- Berechnen Sie die Konzentration von PBAT in einer Probe, CPBAT, mit der Gleichung

wobei mtrockener Boden die Masse des trockenen Bodens ist, die zur Herstellung des Extrakts verwendet wurde (0,1 kg), Vzurückgewonnenes Lösungsmittel das Volumen des in Schritt 2.4 aus dem Boden zurückgewonnenen Lösungsmittels und Vsovlent die anfängliche Menge an Lösungsmittel, die der Bodenprobe (100 ml) zugesetzt wurde.
5. Erstellung einer Kalibrierkurve für die Quantifizierung der PBAT aus einem bestimmten Boden
HINWEIS: Eine Kalibrierungskurve, die auf der Grundlage von Bodenproben mit bekannten Mengen an PBAT erstellt wurde, liefert nützliche Informationen darüber, wie PBAT aus einem bestimmten Boden extrahiert und zurückgewonnen wird. Die Extraktion ist nicht für alle Böden oder alle Formen von PBAT gleich. Wir vermuten, dass die Extraktionseffizienz vom Gehalt an Boden, Ton und organischer Substanz abhängt33, und empfehlen, eine Kalibrierungskurve für jede interessierende Bodenserie und jeden Horizont zu erstellen. Die Kalibrierkurve kann vor oder nach der Verarbeitung unbekannter Proben mit dieser Methode erstellt werden.
- Sammeln und bereiten Sie das Äquivalent von 2,5 kg trockener Erde vor, wie in den Schritten 1.1-1.3 beschrieben.
- Bestimmen Sie den Bereich, der von der Kalibrierkurve abgedeckt werden soll. Die in der Kalibrierkurve verwendete maximale PBAT-Konzentration sollte höher sein als die höchste PBAT-Konzentration unter unbekannten Proben.
- Bereiten Sie ausreichend PBAT-Kunststoff vor oder besorgen Sie sich, um 5 dotierte Proben von 100 g Erde mit 0 %, 25 %, 50 %, 75 % und 100 % der maximalen Konzentration (insgesamt 25 Proben) herzustellen. Wenn beispielsweise 40 mg/kg die gewünschte Höchstkonzentration ist, werden insgesamt 50 mg PBAT benötigt, um die dotierten Proben zu erstellen.
- Bereiten Sie 25 Proben à 100 g Erde vor. Spiken Sie die Proben, indem Sie PBAT-basierten Kunststoff wiegen und ihn in den vorgeschriebenen Mengen zu Bodenproben hinzufügen. Wenn beispielsweise 40 mg/kg PBAT die gewünschte maximale Konzentration ist, erstellen Sie 5 Proben ohne PBAT, 5 Proben mit 1 mg PBAT, 5 Proben mit 2 mg PBAT, 5 Proben mit 3 mg PBAT und 5 Proben mit 4 mg PBAT. Nachdem Sie PBAT in die Erde gegeben haben, mischen Sie gut.
- Extrahieren Sie PBAT aus den 25 dotierten Proben, sammeln Sie dann NMR-Spektren aus den Extrakten und analysieren Sie die resultierenden Spektren, wie in den Schritten 2.1 bis 4.16 beschrieben.
- Identifizieren Sie die Gleichung einer Kalibrierungskurve für PBAT in diesem Boden, indem Sie eine lineare Regression zwischen der gemessenen Menge an PBAT in jeder dotierten Probe und der tatsächlichen Menge an PBAT durchführen, die in einem statistischen Analysetool hinzugefügt wurde. Wir haben eine Tabelle verwendet. Wenn in den Spike-Stichproben keine PBAT erkannt wird, ohne dass PBAT hinzugefügt wurde, dann erzwingt b = 0 in der Regression.
HINWEIS: Bei einem linearen Regressionstest wird die Stärke der linearen Beziehung zwischen zwei kontinuierlichen numerischen Variablen x und y entsprechend der Beziehung y = mx + b bewertet. Die Werte von m und b, die am besten zu den Daten passen, werden durch den Test berechnet. Der r2-Koeffizient des Regressionstests beschreibt, wie eng die beiden Variablen miteinander korrelieren. - Testen Sie mit dem statistischen Analysetool auf einen signifikanten Zusammenhang zwischen der Extraktionseffizienz und der PBAT-Konzentration. Berechnen Sie die Extraktionseffizienz von PBAT aus den dotierten Proben wie folgt:

- Verwenden Sie das statistische Analysetool, um die Wahrscheinlichkeit zu berechnen, dass die beobachteten Daten zufällig auftreten könnten, ohne dass eine Korrelation zwischen der Extraktionseffizienz und der PBAT-Konzentration besteht. Wenn dieser p-Wert größer als der vorgegebene Signifikanzschwellenwert α ist, kann die Nullhypothese, dass es keine Beziehung zwischen den beiden Variablen gibt, nicht zurückgewiesen werden. Ist dies der Fall, kann davon ausgegangen werden, dass die Extraktionseffizienz für alle PBAT-Konzentrationen innerhalb des untersuchten Bereichs konstant ist. Wenn die Nullhypothese verworfen wird, ist das hier beschriebene lineare Modell möglicherweise nicht die beste Methode zum Modellieren der Daten.
- Verwenden Sie die lineare Regressionsgleichung der Kalibrierungskurve, um die Menge an PBAT in unbekannten Proben zu schätzen, die mit dieser Methode verarbeitet wurden. Wenn die Regressionsvariable x die tatsächliche Menge an PBAT in Stichproben mit Stichproben mit Schwerpunkten der Kalibrierungskurve war, war die Variable y die gemessene Menge an PBAT, und b wurde auf 0 gesetzt, dann

HINWEIS: Der PBAT-Gehalt von Replikatproben, die unter Verwendung einer Kalibrierungskurvengleichung geschätzt wurden, kann verwendet werden, um ein Konfidenzintervall für die PBAT-Menge in einem bestimmten Boden zu generieren, oder wenn ein Mittelwert und ein Konfidenzintervall für die PBAT-Konzentrationen in Replikatextrakten berechnet werden konnten, könnte die Kalibrierkurve zur Schätzung der PBAT-Konzentration im Boden angewendet werden. Beide Arbeitsgangsreihenfolgen ergeben das gleiche Konfidenzintervall für den PBAT-Gehalt im Boden. Betrachten Sie beispielsweise Extrakte aus 10 Wiederholungsproben mit PBAT-Konzentrationen von 10, 5, 2, 4, 10, 11, 2, 6, 8 und 5 mg/kg und die Kalibrierkurvengleichung y (gemessene PBAT im Extrakt) = 0,75 x (wahre PBAT im Boden). Die PBAT-Konzentrationen im Boden in jedem Replikat könnten auf 13, 7, 3, 5, 13, 15, 3, 8, 11 und 7 mg/kg geschätzt werden. Dann würde die mittlere PBAT-Konzentration im Boden auf 8,4 mg/kg mit einer Standardabweichung von 4,4 mg/kg geschätzt. Wenn zunächst ein Mittelwert und eine Standardabweichung für die PBAT-Konzentrationen von Extrakten (10, 5, 2, 4, 10, 11, 2, 6, 8 und 5) berechnet werden, wird ein Mittelwert von 6,3 mg/kg und eine Standardabweichung von 3,3 mg/kg berechnet. Dann könnte die Kalibrierkurve sowohl auf den Mittelwert als auch auf die Standardabweichung angewendet werden, um die PBAT-Konzentration im Boden zu schätzen: Mittelwert von 8,4 mg/kg, Standardabweichung von 4,4 mg/kg.
Ergebnisse
Um die Wirksamkeit dieser Methode bei der Quantifizierung von PBAT-Polymer aus dem Boden zu bewerten, wurden Kalibrierungskurven erstellt, indem PBAT aus dotierten Proben extrahiert wurde, die aus drei verschiedenen Böden hergestellt wurden. Für jeden der drei Böden (Details in Tabelle 3) wurde der Boden durch ein 2-mm-Sieb geleitet und anschließend an der Luft getrocknet. Die Spike-Proben wurden durch Zugabe von 0, 9, 18, 27 oder 36 mg MP auf PBAT-Basis zu 100 g trockener Erde (jeweils 5 Wiederholungen) erstellt. Dies entspricht 0, 63, 126, 189 oder 252 mg/kg PBAT-Polymer. MPs wurden aus Kunststoffmulch mit 70 % PBAT in Massenanteil und 50 μm Dicke nach dem in Astner et al.45 beschriebenen Mahlverfahren hergestellt und waren kleiner als 840 μm. Um jede Kalibrierkurve zu erstellen, wurde die PBAT aus jeder dotierten Probe nach dem oben beschriebenen Verfahren extrahiert. Die Wiederfindung von PBAT wurde dann mit der Menge an PBAT verglichen, die jeder Probe zugesetzt wurde. Die PBAT-Wiederfindungsrate und -Quantifizierung wurden auch für NPs (mittlerer Durchmesser 780 nm, Polydispersitätsindex 0,77, hergestellt nach Astner et al.45) in einem Boden (Schattenlehm) getestet.
Für alle Böden wurde in Proben, denen keine PBAT zugesetzt wurde, keine PBAT nachgewiesen, d.h. es wurden keine falsch positiven Ergebnisse bei dieser Methode beobachtet. Ergänzende Abbildung 1 zeigt ein Spektrum, das von einem schattigen Lehmboden gesammelt wurde, der kein PBAT enthielt (und während des Aufbereitungsprozesses DMB zugesetzt wurde). Die beiden charakteristischen Peaks des internen Kalibrants DMB sind vorhanden, die PBAT-charakteristischen Peaks jedoch nicht. Bei Böden mit PBAT-Zugabe waren die fünf charakteristischen Peaks vorhanden, die zur Identifizierung von PBAT verwendet wurden. Abbildung 2 zeigt ein Spektrum, das aus einem schattigen Lehmboden mit 63 mg/kg PBAT entnommen wurde. Alle PBAT- und DMB-Peaks, die bei der Quantifizierung verwendet werden, sind eindeutig aufgelöst. Ergänzend Abbildung 2 zeigt den angepassten Bereich des Spektrums, der in Abbildung 2 gezeigt ist, mit integrierten Peaks, die überlagert sind. Aufgrund der Überlappung von 3-, 3'-, 6- und 6'-Peaks mit anderen Signalen im Spektrum ist es wichtig, den PBAT-Gehalt auf der Grundlage der Integrale der angepassten Peaks und nicht auf einfachen Peak-Integralen zu berechnen. Dadurch wird die Fläche entfernt, die von anderen Bestandteilen des Bodenextrakts und von überlappenden PBAT-Peaks beigesteuert wird. Ergänzende Abbildung 3 zeigt die Auswirkungen der Verdünnung auf die spektrale Auflösung der NMR. Die Abbildung zeigt ein Spektrum, das aus einem sandigen Elkhorn-Lehm mit 252 mg/kg PBAT entnommen wurde. In Panel A können die PBAT-Peaks von 3, 3', 6 und 6" im Bereich von 4,5 bis 4,0 ppm nicht aufgelöst werden. Die ergänzende Abbildung 3B zeigt ein Spektrum, das aus derselben Probe entnommen wurde, nachdem es mit zusätzlichem deuteriertem Chloroform um 1:5 verdünnt wurde. Nach der Verdünnung sind die vier Peaks unterschiedlich und ihre Fläche kann angepasst werden.
Die Kalibrierkurven variierten zwischen den drei von uns getesteten Böden. Abbildung 4 zeigt die geschätzten PBAT-Konzentrationen jedes Bodens auf der Grundlage der in jedem Extrakt gemessenenPBAT (C PBAT,m) im Vergleich zur tatsächlichen Menge an PBAT (CPBAT,a), die dem Boden zugesetzt wurde. Die Menge an PBAT, die aus schattigen Lehmböden gewonnen wurde, korrelierte stark mit der Menge an zugesetzter PBAT (r2 = 0,99). Für die Kalibrierkurvengleichung CPBAT,m = m*CPBAT,a, m = 0,76 ± 0,02 (Mittelwert ± einem Standardfehler) und m war signifikant von Null verschieden (df = 24; F = 2000; S. < 1*10-16). PBAT wurde mit einem Wirkungsgrad von η = 76 % ± 10 % (Mittelwert ± einer Standardabweichung) aus diesem Boden gewonnen. Die Extraktionseffizienz aus dem Schattenboden korrelierte nicht mit der Menge an PBAT in den Proben (r2 = 0,009; p = 0,7). Der NP wurde mit einem Wirkungsgrad von η = 59 % ± 8 % (Mittelwert ± einer Standardabweichung) wiedergewonnen. Abbildung 5 zeigt die Extraktionseffizienz von MP und NPs aus dem Shady-Lehm; Der Wirkungsgrad war für NP signifikant niedriger (p = 0,0002). Die Menge an PBAT, die aus dem Lehm von Los Osos gewonnen wurde, korrelierte weniger stark mit der Menge an zugesetzter PBAT (r2 = 0,85) als im Schattenboden. Für die Kalibrierkurvengleichung CPBAT,m = m*CPBAT,a, m = 0,57 ± 0,05 (Mittelwert ± einem Standardfehler), und m war signifikant von Null verschieden (df = 23; F = 100; p = 8*10-11). PBAT wurde mit einem Wirkungsgrad von η = 57 % ± 22 % (Mittelwert ± einer Standardabweichung) aus diesem Boden gewonnen. Die Extraktionseffizienz im Boden von Los Osos korrelierte nicht mit der Menge an PBAT in den Proben (r2 = 0,01; p = 0,6). Die Menge an PBAT, die aus dem sandigen Elkhorn-Lehm gewonnen wurde, korrelierte stark mit der Menge an zugesetzter PBAT (r2 = 0,88). Für die Kalibrierkurvengleichung Cunterschied sich PBAT,m = m*CPBAT,a, m = 0,70 ± 0,05 (Mittelwert ± einem Standardfehler), und m unterschied sich signifikant von Null (df = 23; F = 200; p = 5*10-12). PBAT wurde mit einem Wirkungsgrad von η = 70 % ± 14 % (Mittelwert ± einer Standardabweichung) aus diesem Boden gewonnen. Die Extraktionseffizienz korrelierte nicht mit der Menge an PBAT in den Proben (r2 = 0,006; p = 0,7) für den Elkhorn-Boden.
Darüber hinaus wurde diese Methode zur Quantifizierung der PBAT in einem Boden der Elkhorn-Serie angewendet. In diesem Experiment wurde Elchhornerde von zwei Standorten auf einem landwirtschaftlichen Feld gesammelt, durch ein 2-mm-Sieb gesiebt und dann an der Luft getrocknet. Der Boden wurde mit PBAT-basiertem Mulch MP (wie oben beschrieben erstellt, Durchmesser < 840 μm) mit 50 mg MP und 150 g trockenem Boden in jedem Mesokosmos (250 mg/kg PBAT) gemischt, um 5 Mesokosmen zu bilden, wobei MP von Standort A in den Boden gemischt wurden und 5 MP von Standort B in den Boden gemischt wurden (insgesamt 10). Als Negativkontrolle dienten fünf Mesokosmen, die aus Erde von jedem Standort ohne Zugabe von MP bestanden (insgesamt 10). Mesokosmen wurden 6 Monate lang inkubiert, um den biologischen Abbau der PBAT-basierten Mulch-MP zu untersuchen. Während der Inkubation wurde die kumulative Bodenatmung über die CO2 -Konzentrationen im Kopfraum (mit einem Infrarot-Gasanalysator) gemessen und zur Quantifizierung der PBAT-Degradation verwendet. Die Menge an Plastik, die am Ende der Inkubation in den Mesokosmen verbleibt, wurde wie folgt berechnet:
CFrac aus Kunststoff, final = [mKunststoff, i / CFrac-Kunststoff - (CCO2, Kunststoff hinzugefügt - CCO2 ohne Kunststoff)*mtrockener Boden]/(mKunststoff, i/ CFrac-Kunststoff)
wobei mtrockener Boden die Menge an Erde in jedem Inkubationsgefäß ist, CFrac-Plastik der Kohlenstoffgehalt des zugesetzten Mikroplastiks, CCO2, zugesetztes Plastik die kumulative Menge an CO2 ist, die in einem Mesokosmen mit Kunststoffzusatz pro Gramm trockenem Boden produziert wird, CCO2 kein Kunststoff die Menge an CO2 ist, die in einem Mesokosmos ohne Zugabe von Plastik pro Gramm trockenem Boden produziert wird, undm Kunststoff, i ist die Anfangsmasse des zugesetzten Kunststoffs.
Wir haben Bootstrapping verwendet, um Konfidenzintervalle für Plastikreste in den Böden A und B zu schätzen, indem wir Plastikreste mit 10.000 theoretischen Teilstichproben von zufälligen Paarungen der 10 experimentellen Mesokosmen von jedem Standort berechnet haben. An Standort A betrug der geschätzte mittlere Kunststoffanteil aus den Atmungsdaten 86 %, mit einem Bootstrapped-Konfidenzintervall von 95 % zwischen 62 und >100 %. An Standort B betrug der geschätzte mittlere verbleibende Kunststoffanteil 98 % mit einem Konfidenzintervall von 95 % zwischen 79 und >100 %. Am Ende der 6 Monate wurde der PBAT-Gehalt auch mit der in diesem Manuskript beschriebenen Extraktions- und NMR-Quantifizierungsmethode gemessen (n = 5 für Stelle A und n = 4 für Stelle B). An Standort A betrug der geschätzte mittlere verbleibende Kunststoffanteil aus NMR-Daten 79 %, wobei ein Konfidenzintervall von 95 % (Mittelwert ± 1,96xSE) zwischen 71 % und 87 % lag. An Standort B betrug der geschätzte mittlere verbleibende Kunststoffanteil 88 %, mit einem Konfidenzintervall von 95 % zwischen 71 % und 100 %. Abbildung 6 zeigt die Konfidenzintervalle für den Kunststoffgehalt des Bodens von den beiden Standorten, die mit den beiden unterschiedlichen Methoden geschätzt wurden. Die Schätzungen des plastischen Gehalts aus den beiden Methoden scheinen sich gegenseitig konsistent zu sein, basierend auf dem großen Anteil der Überlappung zwischen den einzelnen Konfidenzintervallpaaren.

Abbildung 1: Visueller Überblick über das Extraktions- und Quantifizierungsverfahren für Polybutylenadipatterephthalat (PBAT). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
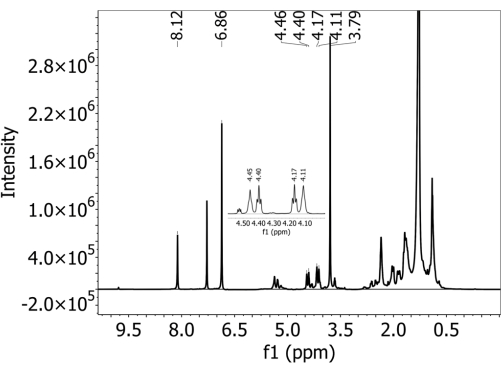
Abbildung 2: 1H-NMR-Spektrum, das in deuteriertem Chloroform-Lösungsmittel mit einem 500-MHz-Spektrometer an einem Extrakt aus einem schattigen Lehmboden mit Polybutylenadipatterephthalat (PBAT) MPs gesammelt wurde. 1,4-Dimethoxybenzol (DMB) wurde dem Extrakt als internes Kalibrans vor der NMR-Analyse zugesetzt. Sowohl PBAT- als auch DMB-charakteristische Peaks sind im Spektrum vorhanden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Strukturen von Polybutylenadipatterephthalat (PBAT) und 1,4-Dimethoxybenzol (DMB) mit markierten Protonen. Die entsprechenden Strukturen sind in Tabelle 1 und Tabelle 2 dargestellt. (A) Struktur einer BA-BT-Einheit von PBAT. (B) Struktur der T-B-T-, T-B-A- und A-B-A-Triaden aus PBAT. (C) Struktur des DMB. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: PBAT-Konzentrationen, gemessen mit 1H-QNMR in Extrakten in deuteriertem Chloroform-Lösungsmittel aus einem schattigen Lehmboden, einem Lehm aus Los Osos und einem sandigen Elkhorn-Lehm, die bekannte Mengen an PBAT enthalten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Extraktionseffizienz von PBAT-MP und NPs aus dotierten Proben in einem schattigen Lehmboden. Die PBAT-Wiederfindung ist bei NPs signifikant niedriger (p = 0,0002). Die mittlere Linie jedes Feldes stellt den Mittelwert der gemessenen Datenpunkte dar, während die oberen und unteren Grenzen des Feldes Q3 bzw. Q1 widerspiegeln. Die obere und untere Grenze der Whisker spiegeln die maximalen bzw. minimalen Datenpunkte wider. Einzelne Datenpunkte werden in der Box und den Whiskern angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Der Kunststoffgehalt von zwei Elkhorn-Böden wurde durch kumulative Inkubationsatmung und durch Lösungsmittelextraktion in Verbindung mit NMR gemessen. Für den Kunststoffgehalt, der durch die Atmung gemessen wird, stellen die Balken ein Bootstrapped-Konfidenzintervall von 95 % dar. Für den mittels NMR gemessenen Kunststoffgehalt stellen die Balken ein 95 %-Konfidenzintervall dar, das auf dem Zweifachen des Standardfehlers über und unter der mittleren Schätzung basiert (n = 5 für Stelle a und n = 4 für Stelle b). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Peak-ID | Ort | Anzahl der Protonen | Multiplizität | Monomer | Wird bei der Quantifizierung verwendet |
| 5 | 8.1 | 4 | Singulett | T | ja |
| 6 | 4.44 | 2 | Drilling | B | ja |
| 6’ | 4.38 | 2 | Drilling | B | ja |
| 3’ | 4.15 | 2 | Drilling | B | ja |
| 3 | 4.09 | 2 | Drilling | B | ja |
| 1 | 2.34 | 4 | Drilling | Ein | Nein |
| 7 | 1.97 | 2 | Multiplett | B | Nein |
| 7’ | 1.87 | 2 | Multiplett | B | Nein |
| 4’ | 1.81 | 2 | Multiplett | B | Nein |
| 4 | 1.68 | 2 | Multiplett | B | Nein |
| 2 | 1.66 | 4 | Multiplett | Ein | Nein |
Tabelle 1: 1H-NMR-Spektralpeaks von Polybutylenadipatterephthalat (PBAT) in deuteriertem Chloroform-Lösungsmittel. Die Wasserstoffatome, die jedem Peak zugeordnet sind, sind in Abbildung 3 markiert. Die Peak-Zuordnungen basieren auf Herrera et al.27.
| Peak-ID | Ort | Anzahl der Protonen | Multiplizität | Wird in der Quantifizierung verwendet |
| Ein | 6.84 | 4 | Singulett | ja |
| B | 3.77 | 6 | Singulett | ja |
Tabelle 2: 1H-NMR-Peaks von 1,4-Dimethoxybenzol (DMB) in deuteriertem Chloroform-Lösungsmittel. Die Wasserstoffatome, die jedem Peak zugeordnet sind, sind in Abbildung 3B markiert. Die Peak-Zuordnungen basieren auf Nelson et al.33.
| Boden-Serie | Klassifikation | Textur | Organischer Kohlenstoff insgesamt | Ph | Sammelort | Sammeltiefe (cm) |
| Schattig | Feinlehmig, gemischt, subaktiv, thermisch Typisches Hapludult | Lehm | 1.70% | 6 | Knoxville, Tennessee, Vereinigte Staaten von Amerika | 0-5 |
| Los Osos | Feines, smektisches, thermisches typisches Argixeroll | Lehm | 3.00% | 6 | San Luis Obispo, Kalifornien, USA | 0-5 |
| Elkhorn | Feinlehmiges, gemischtes, superaktives, thermisches Pachic Argixeroll | Sandiger Lehm | 1% | 7 | Watsonville, Kalifornien, Vereinigte Staaten von Amerika | 0-5 |
Tabelle 3: Eigenschaften der drei Böden, die zur Demonstration der PBAT-Extraktionsmethode verwendet wurden.
Ergänzende Abbildung 1: 1H-NMR-Spektrum, das in einem deuterierten Chloroform-Lösungsmittel mit einem 500-MHz-Spektrometer an einem Extrakt aus einem Shady-Lehm ohne PBAT-Polymer gesammelt wurde. PBAT-charakteristische Peaks sind nicht vorhanden, während DMB-Peaks (als interner Kalibrant hinzugefügt) vorhanden sind. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Angepasster Bereich des 1H-NMR-Spektrums, wie in Abbildung 4 dargestellt. Das Spektrum wurde in deuteriertem Chloroform-Lösungsmittel gesammelt. Der grüne Hintergrund zeigt den Bereich des Spektrums, der angepasst wurde. Lila Linien zeigen die angepassten Peaks, während rote Linien den Fehler anzeigen (Teile des Spektrums, die nicht in den angepassten Peaks enthalten sind). Die PBAT-Peaks 5, 6, 6', 3' und 3 sind zusammen mit den DMB-Peaks A und B in der Passform enthalten. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: 1H-NMR-Spektren in deuteriertem Chloroform-Lösungsmittel, gesammelt mit einem 500 MHz-Spektrometer an einem Extrakt aus einem sandigen Elkhorn-Lehm mit PBAT-MPs. Sowohl PBAT- als auch DMB-charakteristische Peaks sind im Spektrum vorhanden. (A) PBAT-Peaks können zur Quantifizierung des Polymers nicht unterschieden werden. Wenn Probenextrakte solche Spektren erzeugen, verdünnen Sie die Probe und verwenden Sie sie dann, um ein neues 1-H-NMR-Spektrum zu sammeln. (B) Derselbe Extrakt wird so verdünnt, dass alle spektralen Peaks klar aufgelöst werden. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Wir schlagen eine Methode zur Lösungsmittelextraktion von PBAT aus dem Boden vor, die mit 1H-NMR gekoppelt ist, um PBAT im Extrakt zu quantifizieren. Zu den Schlüsselelementen des Extraktionsprozesses gehören die Extraktionstechnik und -ausrüstung, das für die Extraktion verwendete Lösungsmittel und der Zeitaufwand. Wir haben uns für eine Extraktionstechnik entschieden, die im Vergleich zur von Nelson et al. demonstrierten Soxhlet-Extraktion und der beschleunigten Lösungsmittelextraktion (ASE) eine relativ einfache und kostengünstige Ausrüstung (Gläser, Glasperlen und einen Shaker-Tisch) erfordert33. Das Ziel dieser Methode ist es, dass viele Proben parallel entnommen werden können, um die Verarbeitung von Bodenschüttproben zu beschleunigen. Ein weiterer Vorteil der einfachen Lösungsmittelschüttelextraktion besteht darin, dass im Vergleich zu Soxhlet- oder ASE-Ansätzen größere Bodenmengen aufgenommen werden können, was eine einfachere Verarbeitung von umweltrepräsentativen Proben ermöglicht13,36. Wir wählten die Chloroform-Methanol-Lösungsmittellösung auf der Grundlage der erfolgreichen Ergebnisse von Nelson et al.33 und der Verfügbarkeit von deuteriertem Chloroform als 1H-NMR-Lösungsmittel aus. Wir testeten die Ultraschalluntersuchung von Lösungsmittel-Matrix-Gemischen, die dem in Nelson et al.33 beschriebenen Protokoll entsprachen, im Vergleich zur einfachen Lösungsmittelschüttelmethode und fanden keinen signifikanten Unterschied in den PBAT-Wiederfindungsraten zwischen den beiden Methoden. Wir stellten fest, dass 8 Stunden Schütteln bei 200 U/min ausreichten, um Bodenzuschlagstoffe in 100 g Bodenmatrix für die drei von uns getesteten Böden aufzubrechen, während kürzere Schüttelzeiten oder niedrigere Schüttelgeschwindigkeiten nicht ausreichten. Anschließend war ein Absetzen erforderlich, um das Lösungsmittel ohne Bodenpartikel zurückzugewinnen. Die PBAT-Rückgewinnung wurde mit Kunststoffen in Nanogröße getestet, und die Rückgewinnung war deutlich geringer als die von MP. Dies bedeutet, dass die Methode möglicherweise weiterentwickelt werden muss, um Umweltproben von unbekannten NPs genau zu quantifizieren, aber die teilweise Rückgewinnung und Messung von NPs ist im Vergleich zu anderen größenbegrenzten Methoden immer noch wertvoll, auch wenn mit dieser Methode keine Informationen über die Partikelgröße erhalten werden können.
Während Nelson et al.33 über Extraktionseffizienzen von nahezu 100 % für eine Ultraschall-Extraktionsmethode berichteten, stellten wir fest, dass Ultraschall und die hier beschriebene Shaker-basierte Extraktionsmethode beide zu einer Extraktionseffizienz von deutlich unter 100 % führten. Wir glauben, dass dies auf die Auswirkungen der Umweltverwitterung, einschließlich der Photooxidation auf den Kunststoffmulch, zurückzuführen sein könnte. Nelson et al.33 beobachteten eine signifikant reduzierte Extraktionseffizienz für UV-bestrahlte PBAT-MP im Vergleich zu nicht verwittertem Material. Der Kunststoff, den wir zum Testen dieser Quantifizierungsmethode verwendet haben, wurde eine ganze Vegetationsperiode lang im Sonnenlicht verwittert, bevor er zu MP verarbeitet wurde. Trotz der Photostabilisatoren, die kommerziellen Kunststoffmulchfolien zugesetzt werden, ändert sich die Struktur des Mulchpolymers aufgrund von UV-Strahlung (z. B. Kettenvernetzung, die den Gelgehalt des Materials erhöht)46 unter Umweltwitterungsbedingungen, und der Abbau des Polymers kann sein NMR-Spektrumverändern 47. Dies könnte zu den niedrigeren PBAT-Wiederfindungsraten beitragen, die wir im Vergleich zu Nelson et al. beobachtet haben33. Wir stellten auch fest, dass die PBAT-Extraktionseffizienz zwischen den drei von uns getesteten Böden variierte. Der Schattenboden enthält hauptsächlich niedrig aktive Tonerde, während die beiden anderen Böden smektische (Los Osos) und gemischte, superaktive (Elkhorn) Tone aufweisen. Das Vorhandensein von Tonmineralien mit hoher Aktivität und 2:1 könnte die Lösungsmittelextraktion von PBAT aus diesen Böden gehemmt haben33,48, was zu der von uns beobachteten geringeren PBAT-Ausbeute führte. Wir empfehlen weitere Forschungen, die Kunststoff-Mineral-Assoziationen im Boden für biologisch abbaubare MP und NPs, einschließlich PBAT, sowie konventionelle, nicht abbaubare Polymer-MP und NP untersuchen. Dies ist wichtig, um zu verstehen, wie MP-Polymere aus dem Boden extrahiert und gemessen werden können, und um zu verstehen, wie sie biologisch abbaubar sind oder sich anderweitig auf Bodensysteme auswirken können.
Zu den Schlüsselelementen des NMR-Spektrumerfassungsprozesses gehören die Magnetstärke des Instruments, die Anzahl der verwendeten Scans, die Probenrelaxationszeit zwischen den Scans und die Gesamtmesszeit pro Probe. Wir haben ein 500-MHz-Spektrometer verwendet; höhere Magnetfeldstärken sorgen für eine höhere Empfindlichkeit und Auflösung in NMR-Spektren. Das spektrale Signal-Rausch-Verhältnis kann erhöht werden, indem wiederholte Scans derselben Probe gesammelt und addiert werden. Das Sammeln von n Scans erhöht das Signal-Rausch-Verhältnis um den Faktor √n, verlängert jedoch die Messzeit um den Faktor n29. Das bedeutet, dass, wenn ein höheres Signal-Rausch-Verhältnis benötigt wird, um die PBAT in einer Probe zu quantifizieren, die Anzahl der Scans auf Kosten längerer Probenlaufzeiten erhöht werden kann. Ein Signal-Rausch-Verhältnis von 150 für ein bestimmtes Signal ist erforderlich, um einen Fehler von <1 % bei der Quantifizierung44 aufrechtzuerhalten. Unter unseren Erfassungsparametern (Instrument, Sonde, Anzahl der Scans) waren etwa 5 mg PBAT pro Probe (oder 50 μg PBAT pro mL Extrakt) erforderlich, um ein Signal-Rausch-Verhältnis von 150 und damit einen Fehler von <1% bei der Quantifizierung zu erhalten; Diese Konzentration ist spezifisch für unsere Datenerfassung. Diese PBAT-Konzentration ist höher als die Bestimmungsgrenzen, die von anderen Grenzwerten erreicht werden, die 1H-NMR verwenden, um andere Arten von MP in Abwesenheit von Boden zu quantifizieren16,24, was den Einfluss von organischer Bodensubstanz und anderen mitextrahierten Verbindungen auf die Quantifizierungsmethode zeigt. Der quantifizierbare Bereich der PBAT ist auch am oberen Ende begrenzt, da die Linienverbreiterung bei PBAT-Konzentrationen von mehr als 25 mg pro Probe (250 μg PBAT pro ml Extrakt) zu beobachten ist, was zu einer PBAT-Peak-Überlappung führte, wie in den repräsentativen Ergebnissen beschrieben und in der ergänzenden Abbildung 3 dargestellt. Diese Methode ermöglicht jedoch eine flexible Reaktion auf diese Einschränkungen, um sicherzustellen, dass die Proben quantifizierbar sind. Die Menge an Erde, die zur Herstellung von Extrakten verwendet wird, kann erhöht oder verringert werden, und die Extrakte können verdünnt und erneut analysiert werden, um die PBAT-Konzentration in den optimalen Bereich zu bringen.
Zu den Schlüsselelementen des Prozesses zur Quantifizierung von PBAT auf der Grundlage von NMR-Spektren gehören die Peaks, die zur Quantifizierung von PBAT verwendet werden, die Verwendung von Linienanpassung zur Berechnung von Peakbereichen und die Kalibrierungskurve. Konzeptionell könnte jedes Paar von PBAT- und DMB-Peaks verglichen werden, um das Verhältnis der beiden Verbindungen in einer Probe zu berechnen. Die genauesten Ergebnisse fanden wir, als wir das BT:DMB-Verhältnis als Durchschnitt der 5:A-Peakbereiche und der 5:B-Peakbereiche (normiert durch ihre jeweilige Anzahl von Protonen) berechneten. PBAT-Peak 5 liefert nur eine Quantifizierung des 1,4-Butandiol-terephthalat (BT)-Monomers, so dass der Bereich der 3- und 3'-Peaks (der das 1,4-Butandiol-Adipat oder BA-Monomer darstellt) mit dem Bereich der 6- und 6'-Peaks (der das BT-Monomer darstellt) verglichen wurde, um die in der Stichprobe vorhandenen BA-Gruppen zu quantifizieren. Die Menge an BT und BA wurde addiert, um die Gesamtmenge an verbleibender PBAT darzustellen. Es war nicht möglich, PBAT-Peak 1 oder 2 in der BA-Quantifizierung zu verwenden, da die Interferenz von co-extrahierten Verbindungen (vermutlich organische Substanz aus dem Boden) mehrere breite Peaks im Bereich von 2,7-0,7 ppm erzeugte. Wir haben untersucht, wie wir diese unerwünschten Signale aus Spektren mit Hintergrundkorrektur entfernen können (d. h. indem wir ein leeres Spektrum von jedem Probenspektrum subtrahieren), aber wir fanden heraus, dass die Erstellung gleichwertiger vergleichbarer Hintergrund- und Probenspektren ohne die Verwendung eines Kalibrants unzuverlässig ist. Die Linienanpassung wurde verwendet, um die Fläche der angepassten Peaks zu berechnen, anstatt die spektralen Peaks direkt zu integrieren. Aufgrund der Überlappung zwischen PBAT-3- und 3'-Peaks und zwischen 6- und 6'-Peaks ermöglichte dies genauere Schätzungen des PBAT-Gehalts auf der Grundlage vorläufiger Analysen. Wir empfehlen die Erstellung einer Kalibrierkurve, um unterschiedliche Wiederfindungsraten von PBAT aus verschiedenen Böden zu berücksichtigen. Die PBAT-Gewinnungsraten waren für ein Paar der drei von uns getesteten Böden signifikant unterschiedlich, wie die nicht überlappenden 95%-Konfidenzintervalle für die Steigung der Kalibrierkurve zeigen. Die PBAT-Wiederfindung in einem dritten Boden unterschied sich nicht signifikant von den beiden anderen. In Ermangelung eines mechanistischen Verständnisses darüber, wie sich die Bodenzusammensetzung auf die PBAT-Gewinnung auswirkt, empfehlen wir, Kalibrierungskurven zu erstellen, um die PBAT-Ausbeute in jeder interessierenden Bodenserie und für jeden Horizont innerhalb eines Bodenprofils zu bewerten. Wenn sich herausstellt, dass die Kalibrierkurven zwischen den Böden statistisch ähnlich sind, können die Böden leicht in Kombination analysiert werden.
Wir glauben, dass diese Methode ein wertvolles Werkzeug für diejenigen sein kann, die an der Quantifizierung von PBAT-MP und NPs im Boden interessiert sind, insbesondere für die Quantifizierung von PBAT in einer großen Anzahl von Proben, die in ähnlichen Böden gesammelt wurden, z. B. in einer Langzeit-Feldstudie zum biologischen Abbau von Kunststoffen. Eine NMR-Methode zur Quantifizierung von MP aus dem Boden ist wertvoll, da sie es Forschern mit Zugang zu und Expertise in NMR ermöglicht, dazu beizutragen, die Bedürfnisse des aufstrebenden Feldes zu erfüllen, indem sie wichtige Fragen über das Vorhandensein und Verhalten von MP in Bodensystemen beantworten. Während der Zugang zu Instrumenten und Fachwissen wahrscheinlich einige der ersten praktischen Bedenken sein wird, die die Auswahl der Quantifizierungstechniken durch die Forscher einschränken, ist die NMR nicht das effizienteste oder geeignetste Instrument zur Quantifizierung von Mikroplastik aus dem Boden unter allen Bedingungen. Informationen über Partikelform und -größe können mit einer Lösungsmittelextraktionstechnik nicht gewonnen werden. Wenn MP-Form und -Größe von Interesse sind, wären die Forscher mit einer Technik zur Identifizierung einzelner MP-Partikel wie FTIR- oder Raman-Spektroskopie besser bedient. Ein Vorteil von Lösungsmittelextraktionsmethoden, wie sie hier und in Nelson et al.33 vorgestellt werden, im Vergleich zu anderen MP-Quantifizierungsansätzen wie FTIR oder Raman-Spektroskopie besteht darin, dass es konzeptionell keine Größenbeschränkung für die MP und NPs gibt, die quantifiziert werden können; Die Lösungsmittelextraktion kann am vorteilhaftesten sein, wenn keine Informationen über die Partikelgröße erforderlich sind oder wenn die interessierenden Partikel mit anderen Mitteln zu schwer zu trennen sind. Die Pyrolyse-GCMS kann wertvoll sein, da sie eine höhere Empfindlichkeit als NMR aufweist, aber die Ergebnisse unterliegen auch Matrixeffekten, wie es bei der PBAT-Lösungsmittelextraktion wahrscheinlich der Fall ist.
Wir hoffen, dass weitere Arbeiten die Robustheit dieser Methode verbessern werden, indem sie sich mit den mitextrahierten Bodenbestandteilen befassen, die die PBAT-Spitzenauflösung in den NMR-Spektren beeinträchtigen. Weitere Arbeiten sind auch erforderlich, um die Beziehung zwischen der Bewitterung von PBAT-Kunststoffen und der Extraktionseffizienz durch diese Methode zu ermitteln, möglicherweise begleitet von einem detaillierteren Verständnis der PBAT-Abbauprodukte und ihrer 1-H-NMR-Spektren. Basierend auf unseren Ergebnissen und denen von Nelson et al.33 eignet sich dieses Quantifizierungsverfahren am besten für die Quantifizierung von unverwitterten PBAT-Kunststoffen in Böden mit geringer organischer Substanz und ohne hochaktive Tone. Während wir diese Methode nur zur Quantifizierung von PBAT-basierten MP aus dem Boden verwendeten, könnten die Lösungsmittelextraktion und das 1-H-NMR-Quantifizierungsverfahren nützlich sein, um andere MP und NPs aus zusätzlichen Böden zu quantifizieren 26,49. Die Ausweitung der Methode auf MPs aus einem anderen Polymer erfordert die Sicherstellung der Löslichkeit des Polymers im Lösungsmittel und die Identifizierung charakteristischer NMR-Peaks des Polymers im gewählten Lösungsmittel. Es kann erforderlich sein, ein neues internes Kalibrant auszuwählen, das in dem gewählten Lösungsmittel löslich ist und keine Peaks erzeugt, die sich mit denen des interessierenden Polymersüberlappen 42.
Offenlegungen
Die Autoren erklären, dass ihnen keine konkurrierenden finanziellen Interessen oder persönlichen Beziehungen bekannt sind, die die in diesem Artikel berichtete Arbeit beeinflusst haben könnten.
Danksagungen
Vielen Dank an das USDA-NIFA für die Finanzierung dieses Projekts durch die Fördernummer 2020-67019-31167 an SMS und an das Programm Strategic Planning Research Initiatives (SPRINT) der University of Tennessee für einen internen Zuschuss DGH und SMS. Die Geldgeber spielten keine Rolle beim Studiendesign, der Datenerhebung, der Analyse, der Interpretation, dem Verfassen des Berichts oder der Entscheidung, den Artikel zur Veröffentlichung einzureichen.
Materialien
| Name | Company | Catalog Number | Comments |
| 1,4-dimethoxybenzene | Arcos Organics 99%+ | AC115411000 | 1 mg per sample |
| Amber glass bottle with PTFE lined lid (1 L) | Kimble | 5223253C-26 | reusable |
| Chloroform; trichloromethane | Fisher Chemical | AA43685M6 | 90 mL per sample; Fisher Optima |
| Deuterated chlorform; trichloro(deuterio)methane | Sigma Aldrich | 1034200025 | 1 mL per sample; minimum 99.8% deuterated; stabilized with silver |
| Glass beads (3 mm diameter) | Propper Manufacturing | 3000600 | 20 per sample |
| Glass extraction jars with PTFE lined lid (~250 mL volume) | Kimble | 5510858B | 2 per sample, reusable |
| Graduated cylinder, 1 L, polypropylene | Nalgene | 3662-1000 | reusable |
| Graduated cylinder, 500 mL, polypropylene | Nalgene | 3662-0500 | reusable |
| Methanol | Fisher Chemical | A412-4 | 20 mL per sample; certified ACS |
| Micropipette wth range of 0.5 - 1 mL | Fisher Scientific | 3123000063 | reusable |
| NMR spectrometer | Bruker | n/a | 500 MHz instrument |
| NMR tube (7 inch height, high-throughput) | Wilmad | WG-1000-7 | 1 per sample |
| Platform shaker | Eppendorf, Excella E5 | M1355-0000 | reusable |
| Polyethylene pipette tip (10 mL volume) | Eppendorf | 22492098 | 1 per sample, single use |
| Polypropylene micropipette tips (1 mL volume) | Fisher Scientific | 02-707-510 | 3 per sample, single use |
| Semi-microbalance | Mettler Toledo | 30532226 | reusable |
Referenzen
- Andrady, A. L. The plastic in microplastics: A review. Mar Pollut Bull. 119 (1), 12-22 (2017).
- Fakour, H., et al. Quantification and analysis of microplastics in farmland soils: Characterization, sources, and pathways. Agriculture. 11 (4), 330(2021).
- Wang, K., et al. Impact of long-term conventional and biodegradable film mulching on microplastic abundance, soil structure and organic carbon in a cotton field. Environ Pollut. 356, 124367(2024).
- Plastics Europe Plastics - the Facts. , Plastics Europe. Available from: https://plasticseurope.org/knowledge-hub/plastics-the-facts-2022/ (2022).
- Assessment of agricultural plastics and their sustainability: A call for action. , Food Agriculture Organization. Rome. (2021).
- Beriot, N., et al. Intensive vegetable production under plastic mulch: A field study on soil plastic and pesticide residues and their effects on the soil microbiome. Sci Total Environ. 900, 165179(2023).
- Liu, E. K., He, W. Q., Yan, C. R. White revolution to white pollution - Agricultural plastic film mulch in China. Environ Res Lett. 9 (9), 091001(2014).
- Sintim, H. Y., et al. Release of micro- and nanoparticles from biodegradable plastic during in situ composting. Sci Total Environ. 675, 686-693 (2019).
- Skoczinski, P., et al. Bio-based building blocks and polymers - Global capacities, production and trends 2023-2028. Indust Biotech. 20 (2), 52-59 (2024).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Li, C., et al. Effects of biodegradable mulch on soil quality. Appl Soil Ecol. 79, 59-69 (2014).
- Wang, F., Wang, Q., Adams, C. A., Sun, Y., Zhang, S. Effects of microplastics on soil properties: Current knowledge and future perspectives. J Hazardous Mater. 424, 127531(2021).
- Möller, J. N., Löder, M. G. J., Laforsch, C. Finding microplastics in soils: A review of analytical methods. Environ Sci Technol. 54 (4), 2078-2090 (2020).
- Paul, A., Wander, L., Becker, R., Goedecke, C., Braun, U. High-throughput NIR spectroscopic (NIRS) detection of microplastics in soil. Environ Sci Pollut Res. 26 (8), 7364-7374 (2019).
- Wortman, S. E., Jeske, E., Samuelson, M. B., Drijber, R. A new method for detecting micro-fragments of biodegradable mulch films containing poly(butylene adipate-co-terephthalate) (PBAT) in soil. J Environ Quality. 51 (1), 123-128 (2021).
- Peez, N., et al. Quantitative analysis of PET microplastics in environmental model samples using quantitative 1H-NMR spectroscopy: Validation of an optimized and consistent sample clean-up method. Anal Bioanal Chem. 411 (28), 7409-7418 (2019).
- Praveena, S. M., Aris, A. Z., Singh, V. Quality assessment for methodological aspects of microplastics analysis in soil. Trend Environ Anal Chem. 34, e00159(2022).
- Primpke, S., et al. Critical assessment of analytical methods for the harmonized and cost-efficient analysis of microplastics. Appl Spectro. 74 (9), 1012-1047 (2020).
- Käppler, A., et al. Analysis of environmental microplastics by vibrational microspectroscopy: FTIR, Raman or both. Anal Bioanal Chem. 408 (29), 8377-8391 (2016).
- Watteau, F., Dignac, M. F., Bouchard, A., Revallier, A., Houot, S. Microplastic detection in soil amended with municipal solid waste composts as revealed by transmission electronic microscopy and pyrolysis/GC/MS. Front Sustainable Food Syst. 2, 407866(2018).
- Pfohl, P., et al. Microplastic extraction protocols can impact the polymer structure. Microplastics Nanoplastics. 1 (1), 1-13 (2021).
- Xu, J. L., Thomas, K. V., Luo, Z., Gowen, A. A. FTIR and Raman imaging for microplastics analysis: State of the art, challenges and prospects. Trend Anal Chem. 119, 115629(2019).
- Cardoza, L. A., Korir, A. K., Otto, W. H., Wurrey, C. J., Larive, C. K. Applications of NMR spectroscopy in environmental science. Prog Nucl Magnetic Resonance Spectr. 45 (3-4), 209-238 (2004).
- Peez, N., Rinesch, T., Kolz, J., Imhof, W. Applicable and cost-efficient microplastic analysis by quantitative 1H-NMR spectroscopy using benchtop NMR and NoD methods. Magnetic Resonance Chem. 60 (1), 172-183 (2022).
- Günther, M., Imhof, W. Simultaneous quantification of microplastic particles by non-deuterated (NoD) 1 H-qNMR from samples comprising different polymer types. Analyst. 148 (5), 1151-1161 (2023).
- Papini, G., Petrella, G., Cicero, D. O., Boglione, C., Rakaj, A. Identification and quantification of polystyrene microplastics in marine sediments facing a river mouth through NMR spectroscopy. Marine Pollut Bull. 198, 115784(2024).
- Herrera, R., Franco, L., Rodríguez-Galán, A., Puiggalí, J. Characterization and degradation behavior of poly(butylene adipate-co-terephthalate)s. J Polymer Sci Part A. 40 (23), 4141-4157 (2002).
- Mauel, A., Pötzschner, B., Meides, N., Siegel, R., Strohriegl, P., Senker, J. Quantification of photooxidative defects in weathered microplastics using 13 C multiCP NMR spectroscopy. RSC Adv. 12 (18), 10875-10885 (2022).
- Bharti, S. K., Roy, R. Quantitative 1H NMR spectroscopy. Trend Anal Chem. 35, 5-26 (2012).
- Li, X., Hu, K. Quantitative NMR Studies of Multiple Compound Mixtures. Ann Rep NMR Spectro. 90, 85-143 (2017).
- Simmler, C., Napolitano, J. G., McAlpine, J. B., Chen, S. N., Pauli, G. F. Universal quantitative NMR analysis of complex natural samples. Curr Opinion Biotechnol. 25, 51-59 (2014).
- Giraudeau, P. Challenges and perspectives in quantitative NMR. Magnetic Reason Chem. 55 (1), 61-69 (2017).
- Nelson, T. F., Remke, S. C., Kohler, H. P. E., McNeill, K., Sander, M. Quantification of Synthetic Polyesters from Biodegradable Mulch Films in Soils. Environ Sci Technol. 54, 266-275 (2020).
- Brandolini, A. J., Hills, D. D. NMR spectra of polymers and polymer additives. , CRC Press. Boca Raton. (2000).
- Matsuda, H., Asakura, T., Miki, T. Triad sequence analysis of poly(ethylene/butylene terephthalate) copolymer using 1H NMR. Macromolecules. 35 (12), 4664-4668 (2002).
- Yu, Y., Flury, M. How to take representative samples to quantify microplastic particles in soil. Sci Total Environ. 784, 147166(2021).
- Cambardella, C. A., et al. Field-scale variability of soil properties in central Iowa soils. Soil Sci Soc Am J. 58, 1501-1511 (1994).
- Ramsey, M. H., Argyraki, A. Estimation of measurement uncertainty from field sampling: Implications for the classification of contaminated land. Sci Total Environ. 198 (3), 243-257 (1997).
- Desaules, A. Critical evaluation of soil contamination assessment methods for trace metals. Sci Total Environ. 426, 120-131 (2012).
- Pennock, D., Yates, T., Braidek, J. Soil Sampling Designs. Soil Sampl Meth Anal. , 25-38 (2006).
- Büks, F., Kaupenjohann, M. Global concentrations of microplastics in soils - A review. SOIL. 6 (2), 649-662 (2020).
- Bowen, M., O'Neill, I., Pringuer, M. Quantitiative Applications of Nuclear Magnetic Resonance in Pharmaceutical Analysis. Proc Soc Anal Chem. , 294-297 (1974).
- Frank, O., Kreissl, J. K., Daschner, A., Hofmann, T. Accurate determination of reference materials and natural isolates by means of quantitative 1H NMR spectroscopy. J Agri Food Chem. 62 (12), 2506-2515 (2014).
- Malz, F., Jancke, H. Validation of quantitative NMR. J Pharma Biomed Anal. 38 (5), 813-823 (2005).
- Astner, A. F., et al. Forming micro-and nano-plastics from agricultural plastic films for employment in fundamental research studies. J Vis Exp. (185), e641112(2022).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. J Polymer Environ. 29 (9), 2916-2931 (2021).
- Deshoulles, Q., et al. Hydrolytic degradation of biodegradable poly(butylene adipate-co-terephthalate) (PBAT) - Towards an understanding of microplastics fragmentation. Polymer Degrad Stability. 205, 110122(2022).
- Zhang, Y., et al. Aging significantly increases the interaction between polystyrene nanoplastic and minerals. Water Res. 219, 118544(2022).
- Peez, N., Janiska, M. C., Imhof, W. The first application of quantitative 1H NMR spectroscopy as a simple and fast method of identification and quantification of microplastic particles (PE, PET, and PS). Anal Bioanal Chem. 411 (4), 823-833 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten