Method Article
Quantification des micro- et nanoplastiques à base d’adipate de polybutylène téréphtalate du sol à l’aide de la spectroscopie par résonance magnétique nucléaire des protons
Dans cet article
Résumé
Une méthode de quantification des microplastiques et nanoplastiques provenant de l’adipate de polybutylène téréphtalate dans le sol à l’aide de la spectroscopie par résonance magnétique nucléaire est décrite ici. Cette technique améliore la méthodologie existante car elle s’étend à la quantification des nanoplastiques et peut facilement être adaptée au traitement d’échantillons environnementaux en vrac.
Résumé
Une méthode de récupération et de quantification des microplastiques et nanoplastiques (MP et NP) formés dans le sol lors de la biodégradation est nécessaire pour évaluer avec précision la dégradation et l’impact environnemental des produits en plastique biodégradables. La présence de MP et de NP dans le sol peut modifier les propriétés du sol, comme le comportement d’agrégation, ou avoir des effets toxiques sur le biote du sol. Les méthodes existantes de récupération des MP ne sont pas toujours adaptées à la mesure des polymères biodégradables comme le polypléphtalate adipate de butylène (PBAT) ; certaines procédures de digestion courantes avec des acides ou des oxydants peuvent détruire les MP biodégradables à base de PBAT. Les méthodes d’identification telles que la spectroscopie micro-FTIR et micro-Raman sont également limitées par la taille minimale des particules qui peuvent être récupérées et analysées. Par conséquent, cette méthode a été développée pour extraire et quantifier le PBAT du sol afin d’évaluer la fraction massique de MP et de NP dans le sol sans transformer chimiquement le PBAT. Dans le protocole, une solution de chloroforme-méthanol est utilisée pour extraire sélectivement le PBAT du sol. Le solvant est évaporé de l’extrait, puis l’extrait est redissous dans du chloroforme deutéré. L’extrait est analysé par spectroscopie par résonance magnétique nucléaire des protons (1H-QNMR) sous des paramètres quantitatifs pour quantifier la quantité de PBAT dans chaque échantillon. L’efficacité de l’extraction par solvant pour le PBAT varie de 76 % dans un sol limoneux ombragé à 45 % dans un sol limoneux sableux Elkhorn. La récupération des PBAT peut être réduite pour les matériaux photo-oxydés par rapport aux matériaux vierges et peut être réduite dans les sols à forte teneur en argile. L’efficacité de l’extraction ne dépend pas de la concentration de PBAT dans la plage d’essai, mais des efficacités d’extraction plus faibles ont été observées pour les NP que pour les MP. Les résultats de la quantification du PBAT étaient comparables à la quantification de la dégradation du plastique en mesurant la respiration cumulative du sol dans une étude d’incubation en laboratoire.
Introduction
Des méthodes de mesure de la contamination par les MP dans le sol sont nécessaires pour comprendre l’ampleur de la contamination par le plastique dans les sols mondiaux1, les sources de contamination par le plastique2 et les solutions potentielles3. Les sols agricoles sont particulièrement exposés à la contamination plastique : plus de 15 millions de tonnes métriques de plastique sont utilisées dans l’agriculture chaque année en 20214, dont 2,5 millions de tonnes de paillis plastique5. Le paillis de plastique est utilisé en contact étroit avec le sol, réappliqué une ou plusieurs fois par an6, et peut être difficile à enlever complètement du sol après sa vie utile7. L’un des principaux domaines dans lesquels des méthodes de mesure des MP sont nécessaires est l’évaluation des produits en plastique biodégradables, comme les paillis de plastique biodégradables utilisés dans les systèmes maraîchers8.
Les produits en plastique biodégradables dans le sol sont des alternatives prometteuses aux plastiques agricoles conventionnels, car ils pourraient éliminer la contamination plastique du sol par le paillage plastique s’ils fonctionnent comme prévu. En 2022, moins de 1 million de tonnes métriques de plastique biodégradable ont été produites dans le monde, avec une croissance rapide attendue pour l’industrie9. Les quatre polymères biodégradables les plus courants, l’acide polylactique (PLA), l’amidon polymérisé, les polyhydroxyalcanoates (PHA) et le polybutylène adipate téréphtalate (PBAT), sont tous utilisés à des fins commerciales ou expérimentales dans les paillis de plastique biodégradables agricoles10. Malgré leurs promesses, la dégradation de ces produits en plastique biodégradables sur le terrain est variable11. Alors que certaines études sur la dégradation du paillis de plastique biodégradable sur le terrain se sont concentrées sur les fragments de macroplastiques11, l’évaluation de la dégradation complète des matériaux plastiques nécessite la capacité de récupérer les MP et les NP du sol. La quantification des microplastiques à partir du sol est également importante pour évaluer le potentiel d’impacts négatifs sur les écosystèmes du sol de la pollution par les MP12.
Parmi les techniques couramment utilisées pour l’identification et la quantification des MP, citons l’analyse visuelle, la spectroscopie infrarouge à transformée de Fourier (μFTIR), la spectroscopie micro-Raman (μRaman), la chromatographie en phase gazeuse-spectroscopie de masse (GCMS incluant la pyrolyse GCMS et la désorption d’extraction thermique GCMS) et l’analyse thermogravimétrique13. Parmi les autres techniques en développement, citons la spectroscopie proche infrarouge pour la mesure in situ des MP dans les sols14, l’extraction par estérification méthylique des acides gras pour l’analyse GCMS15 et la spectroscopie par résonance magnétique nucléaire16. Pas moins de 90 % des études quantifiant les MP dans le sol ont utilisé l’analyse visuelle (seule ou associée à d’autres techniques) pour identifier les particules de plastique, tandis que 77 % ont utilisé des techniques de spectroscopie FTIR, Raman ou GCMS17. Le développement et l’harmonisation d’une grande variété de techniques de quantification des MP peuvent aider à accroître la capacité de la communauté scientifique à répondre à diverses questions de recherche sur les microplastiques18. Il existe trois approches génériques pour préparer des échantillons de sol afin de quantifier les microplastiques : 1) séparer les particules de microplastiques individuelles inchangées du sol (par exemple par séparation de densité), 2) extraire des matériaux plastiques ou polymères transformés (par exemple par dissolution), ou 3) analyser le sol en vrac. La spectroscopie μFTIR et μRaman exige que les MP individuels soient séparés du sol avant de pouvoir être identifiés chimiquement19, tandis que la pyro-GCMS peut être réalisée sur des particules de plastique isolées séparées du sol ou du sol en vrac20. Il peut être difficile de séparer les MP biodégradables du sol, car certaines digestions utilisées pour éliminer la matière organique du sol peuvent dégrader ou altérer chimiquement les polymères biodégradables, y compris le PBAT21. La spectroscopie micro-Raman et la spectroscopie μFTIR ont également toutes deux une limite de résolution spatiale : les particules doivent être supérieures à 10-20 μm pour le μFTIR et à 1 μm pour le μRaman (si des particules individuelles aussi petites peuvent être préparées pour l’analyse)19,22. Ces techniques peuvent fournir une identification chimique des polymères MP, et l’imagerie spectroscopique peut être utilisée pour mesurer la taille22 des MP. Tous les types de pyro-GCMS sont limités en ce sens que les échantillons sont détruits pendant l’analyse.
La RMN a été utilisée avec succès pour caractériser les constituants et les contaminantsdu sol 23, pour quantifier les MP16, 24, 25, 26 et pour évaluer la dégradation du PBAT et d’un autre polymère, le polystyrène27,28. Lorsqu’elle est exécutée sous des paramètres quantitatifs, la spectroscopie RMN-H 1produit des spectres où l’aire de chaque pic spectral est directement proportionnelle au nombre d’hydrogènes contributeurs dans l’échantillon ; Cela permet de quantifier les composants constitutifs d’un échantillon29. La RMN est une technique analytique précieuse pour quantifier certains MP, y compris le PBAT, dans le sol, car elle permet une quantification et une identification simultanées, elle convient aux mélanges complexes et impurs et elle ne nécessite pas d’étalons de référence chimiquement identiques30,31. La spectroscopie RMN d’un extrait de solvant pourrait quantifier des MP ou des NP plus petits que ceux qui peuvent être traités pour la quantification μFTIR, μRaman ou GCMS. Malgré ces avantages, les approches RMN quantitatives offrent toujours des sensibilités plus faibles que les approches basées sur la spectroscopie de masse destructrice32.
La méthode proposée, schématisée à la figure 1, décrit un flux de travail pour traiter et analyser des échantillons de sol contenant du PBAT, y compris des plastiques PBAT de taille nanométrique. Dans la méthode, le polymère PBAT est extrait d’échantillons de sol en secouant le sol avec un mélange de chloroforme et de méthanol. Les extraits de solvant contenant du PBAT sont séchés puis redissous dans du chloroforme deutéré avec un calibrant interne ajouté. La spectroscopie RMN est réalisée sur les extraits à l’aide de paramètres quantitatifs. Les spectres résultants sont analysés pour quantifier le PBAT en comparant l’aire des pics ajustés correspondant aux atomes d’hydrogène du PBAT et aux molécules de calibrant. Cette méthode applique l’approche d’extraction par solvant et de spectroscopie par résonance magnétique nucléaire des protons (RMN 1H) démontrée par Nelson et al.33. L’objectif était d’utiliser une méthode adaptée au traitement d’échantillons à l’échelle de l’environnement (~100 g de sol) et de traiter un certain nombre d’échantillons en parallèle sans équipement d’extraction spécialisé.
Protocole
1. Collecte et préparation du sol
REMARQUE : L’équipement d’échantillonnage et de traitement ne doit pas contenir le polymère PBAT ou ses constituants afin d’éviter la contamination de l’échantillon. D’autres matériaux polymères n’interfèrent pas nécessairement avec la quantification du PBAT dans le sol. Par exemple, le polyéthylène et le polypropylène ne produisent pas de pics spectraux dans la RMN H du chloroforme 1qui interfèrent avec la quantification du PBAT34, mais le polyéthylène téréphtalate, avec son groupe téréphtalate, interférerait très probablement35, comme le pourraient d’autres polyesters. Des textes de référence comme Brandolini et Hills34 peuvent être utilisés pour déterminer les spectres RMN-1H de divers polymères et détecter les pics qui se chevauchent avec les pics PBAT utilisés pour la quantification (décrits ci-dessous).
- Prélever au moins 100 g d’équivalent poids sec de sol pour chaque échantillon. Déterminer la taille de l’échantillon de sol en fonction de la concentration prévue de plastiques afin de prélever un échantillon représentatif et homogénéiser le sol pour prélever un sous-échantillon si nécessaire36.
REMARQUE : Les systèmes de sol sont intrinsèquement hétérogènes37, tout comme la distribution des contaminants (p. ex., les MP) à l’intérieur de ceux-ci38. Il existe également une variabilité associée aux méthodes utilisées pour mesurer les concentrations de contaminants39. Par conséquent, il est recommandé de créer un plan d’échantillonnage ou un plan expérimental qui comprend des échantillons répétés comme outil pour estimer l’incertitude et pour recueillir des volumes d’échantillons représentatifs en fonction de la concentration de plastique40. Les concentrations de MP dans le sol varient de près de zéro à 1 x 107 éléments par kg de sol, la plupart des sites contenant moins de 10 000 éléments par kg de sol41. Un volume élémentaire représentatif théoriquement pourrait aller de 23 m2 à une concentration de MP de 10 éléments par mètre carré à 0,02 m2 lorsque les concentrations de MP sont de 10 000 éléments par mètre carré36.- Pour augmenter la surface d’échantillonnage efficace d’un site sur le terrain tout en minimisant la quantité de sol à traiter, prélever la terre sur une grande surface (p. ex., 1 m2), puis utiliser la méthode du découpage en quartiers pour homogénéiser et consolider l’échantillon (p. ex., jusqu’à 500 g de terre)36.
- Dans la méthode de coupe en quartiers, empilez la terre d’une grande surface sur une bâche ou une autre surface, mélangez soigneusement à l’aide d’une pelle, puis divisez en quartiers. Conservez un quart de l’échantillon et jetez les trois quarts restants. Répétez ce processus jusqu’à ce que l’échantillon ait la taille souhaitée.
- Tamisez le sol à travers un tamis à mailles de 2 mm. Nettoyez complètement le tamis et le bac de récupération entre les échantillons de sol.
- Séchez le sol à l’air libre, puis rangez-le dans des sacs d’échantillonnage scellés. Le sol sec peut être stocké dans cet état avant l’extraction PBAT.
2. Extraction du PBAT à partir des sols
ATTENTION : Le chloroforme est volatil et toxique. Conservez-le dans l’obscurité dans un verre ambré, à l’abri des oxydants. Lorsque vous travaillez avec lui, portez des gants appropriés, des lunettes de protection et des vêtements de protection. Manipulez-le uniquement dans une hotte. Le méthanol est inflammable, volatil et toxique. Stockez le méthanol dans une armoire ignifuge. Lorsque vous travaillez avec du méthanol, portez des gants appropriés, des lunettes de protection et des vêtements de protection. Manipulez le méthanol uniquement dans une hotte. La verrerie peut se briser et causer des blessures. Portez des lunettes de protection lorsque vous manipulez de la verrerie. Évitez de toucher le verre brisé à mains nues. Au lieu de cela, nettoyez le verre brisé avec des gants résistants aux coupures, des pinces, un balai ou un autre outil.
REMARQUE : Le chloroforme n’est pas compatible avec la plupart des plastiques ou des métaux. Assurez-vous que tous les matériaux sont compatibles (p. ex., verre ou polytétrafluoroéthylène, plastique PTFE).
- Dans une hotte, préparer 100 mL d’un mélange 90:10 v/v de chloroforme (trichlorométhane ; CHCl3) et du méthanol (CH3OH) par échantillon à extraire. Par exemple, pour extraire de 5 échantillons, mélangez 450 mL de chloroforme avec 50 mL de méthanol.
- Ajouter 100 g de terre sèche, 100 ml de solution de chloroforme-méthanol et 20 billes de verre dans un bocal d’extraction en verre. Fermez hermétiquement les bocaux d’extraction avec des couvercles doublés de PTFE afin qu’aucune vapeur de solvant ne puisse sortir des bocaux.
REMARQUE : Le PBAT est très soluble dans le chloroforme ; Un mélange chloroforme-méthanol a été utilisé car le méthanol peut former des liaisons hydrogène avec les solutés, entrant en compétition avec les constituants minéraux et organiques du sol et augmentant la récupération de PBAT dans le sol33. - À l’aide d’un shaker, secouez les bocaux d’extraction pendant 8 h à 200 tr/min. Après avoir secoué, laissez le sol dans les bocaux d’extraction se déverser pendant au moins 4 h.
- Séparez l’extrait du sol. Dans la hotte, débouchez un bocal d’extraction et transférez le liquide par pipette à travers un filtre en papier qualitatif avec une taille de pores de 11 μm dans un bocal en verre propre étiqueté. Noter le volume de solvant récupéré dans le bocal d’extraction. Évitez de transférer des solides du sol avec l’extrait ; laissez quelques ml de solvant si nécessaire.
REMARQUE : Le papier filtre est destiné à éliminer de gros morceaux de matière organique de la solution de solvant. - Séchez les extraits en les laissant dans la hotte jusqu’à ce que le solvant soit complètement évaporé. Cela peut prendre jusqu’à 24 heures. Séchez également le sol dans la hotte. Une fois que le sol est complètement sec, jetez-le.
- Une fois que les extraits sont secs, fermez chaque pot d’échantillon et conservez-les dans un endroit frais, sombre et sec jusqu’à ce que vous en ayez besoin.
3. Collecte de spectres RMN
ATTENTION : Le chloroforme deutéré présente les mêmes risques et nécessite les mêmes précautions que le chloroforme protoné décrit ci-dessus.
- Ajoutez un calibrateur interne42 à l’échantillon. À l’aide d’une balance, peser 1,00 mg de 1,4-diméthoxybenzène (DMB ; C6H14O) dans chaque bocal d’échantillon contenant un extrait séché.
- Remettre l’échantillon en suspension dans du chloroforme deutéré (CDCl 3 ; trichloro(deutéro)méthane). Dans la hotte, à l’aide d’une micropipette, ajoutez 500 μL de chloroforme deutéré dans le bocal contenant l’extrait d’échantillon séché.
- Fermez le pot et secouez-le pour dissoudre l’extrait séché en tapotant doucement le pot contre une main ou une paillasse, environ 10 fois de chaque côté. Ensuite, utilisez une pointe de pipette propre pour transférer le liquide dans un tube RMN.
- Répétez les étapes 3.2 et 3.3 avec 500 μL supplémentaires de chloroforme deutéré, en ajoutant la deuxième partie de l’échantillon dans le même tube RMN que le premier. Le deuxième rinçage est destiné à assurer la dissolution complète et la récupération de l’extrait séché du récipient.
- Boucher le tube RMN et le stocker pendant 3 jours avant de collecter les spectres RMN. Le temps de stockage approprié dépendra du taux d’évaporation du solvant du tube RMN. Analysez les échantillons peu de temps après les avoir préparés avec du chloroforme deutéré.
- Pour transporter les tubes RMN vers le spectromètre, utilisez un support conçu pour supporter les tubes longs et délicats. Ceux-ci ont généralement un support près de la base et du haut du tube. Maintenez les tubes en position verticale pendant le transport.
- À l’aide d’un spectromètre RMN de 500 MHz, prélever un spectre de protons de 1H avec un angle d’impulsion de 90°29, une largeur d’impulsion de 8 μs33, un temps de retard de 25 s (déterminé par l’expérience de récupération d’inversion29,43), 262K points par balayage et 32 balayages composites29,44 de 12 à -2 ppm pour une durée totale de 25 minutes.
REMARQUE : Nous avons utilisé un spectromètre Bruker Neo 500 MHz avec une sonde optimisée pour la large bande et un échantillonneur automatique à une température contrôlée de 300 K. D’autres spectromètres similaires peuvent être utilisés. Si l’on utilise un instrument ayant une intensité de champ magnétique différente, le temps de retard approprié peut être calculé sur la base du temps de relaxation T1 pour le PBAT et le 1,4-diméthoxybenzène à l’aide d’une expérience de récupération par inversion29,43. - Une fois l’échantillon analysé, enregistrez, transférez ou accédez aux données spectrales si nécessaire.
Inspectez les données spectrales. Vérifiez que tous les pics de PBAT utilisés dans la quantification sont clairement résolus s’ils sont présents. Utilisez les pics PBAT 5 (8,10 ppm), 6 (4,44 ppm), 6' (4,38 ppm), 3' (4,15 ppm) et 3 (4,09 ppm) pour la quantification (détails dans le tableau 1). Utilisez également les pics DMB A (6,84 ppm) et B (3,77 ppm) pour la quantification (détails dans le tableau 2). Notez en particulier les pics 6, 6', 3' et 3 de PBAT, qui apparaissent très proches les uns des autres et peuvent se chevaucher. - Si certains pics ne sont pas clairement résolus, diluez l’échantillon. Combinez 100 μL d’échantillon et 500 μL de chloroforme deutéré dans un tube RMN propre et réanalysez l’échantillon selon les mêmes paramètres définis à l’étape 3.7.
4. Analyse des spectres RMN pour quantifier le PBAT
REMARQUE : L’analyse spectrale peut être effectuée à tout moment après la collecte. Il est préférable d’analyser les données le jour même de la production des spectres afin de s’assurer que les échantillons sont toujours disponibles pour être réanalysés en cas de problème.
- Ouvrez le fichier FID créé par le spectromètre dans le logiciel de traitement NMR FID (nous avons utilisé MestreNova de MestreLab, d’autres options mais d’autres options sont disponibles).
- Appliquer l’élargissement de ligne aux spectres : Dans le logiciel de traitement FID, sélectionnez Modèle de traitement dans le menu Traitement, puis accédez à la section Apodisation. Sélectionnez un modèle exponentiel avec une amplitude de 0,5 Hz et un premier point de 0,5 Hz.
- Appliquez la correction de phase automatique en cliquant sur le bouton Correction de phase automatique dans le menu Traitement. Appliquez la correction automatique de la ligne de base en cliquant sur le bouton Correction automatique de la ligne de base dans le menu Traitement.
- Utilisez la déconvolution de crête pour ajuster les pics spectraux mesurés : dans l’onglet Analyse du logiciel de traitement des spectres, dans la section Ajustement, cliquez sur le bouton Nouvel ajustement . Utilisez le curseur pour cliquer sur les spectres à un décalage de 8,5 ppm, puis faites glisser le curseur sur un décalage de 3,0 et relâchez.
- Cliquez sur le tableau d’ajustement de ligne dans la section Ajustement pour afficher tous les pics ajustés.
- Conservez les pics utilisés pour la quantification, comme décrit dans les tableaux 1 et 2 et étiqueté dans la figure 2. Utilisez les pics PBAT 5 (8,10 ppm), 6 (4,44 ppm), 6' (4,38 ppm), 3' (4,15 ppm) et 3 (4,09 ppm) pour la quantification (détails dans le tableau 1), ainsi que les pics DMB A (6,84 ppm) et B (3,77 ppm). Les atomes d’hydrogène qui correspondent à chaque pic répertorié dans le tableau 1 et le tableau 2 sont étiquetés dans les schémas structurels de la figure 3, la figure 3A montrant la structure des deux dimères PBAT, la figure 3B montrant comment la position des dimères dans le polymère interagit pour modifier le décalage du pic des hydrogènes du monomère 1,4-butanediol, et la figure 3C montrant la structure de la DMB.
- Supprimez tous les autres pics de l’ajustement en sélectionnant les pics indésirables et en cliquant sur Supprimer le pic.
- Utilisez la table d’ajustement pour copier l’aire de chaque pic dans une application de tableur pour les calculs (nous avons choisi d’utiliser une feuille de calcul).
- Pour copier les zones de pics dans une feuille de calcul, sélectionnez d’abord toutes les informations de pics dans le tableau d’ajustement de ligne. Cliquez ensuite avec le bouton droit de la souris et choisissez Copier dans le menu contextuel. Collez les données dans la feuille de calcul.
- Calculer le nombre de moles de DMB ajoutées à l’échantillon, nDMB, à l’aide de l’équation

où mDMB est la masse de DMB ajoutée à l’échantillon en grammes (suggéré 1,00 mg) et MMDMB est la masse molaire de DMB (138,17 g/mol). - Calculer le nombre de moles du dimère de téréphtalate de butylène du PBAT dans l’échantillon, nBT, à l’aide de l’équation

où A5 est l’aire mesurée du pic 5 du PBAT, AA est l’aire mesurée du pic A du DMB et AB est l’aire mesurée du pic B du DMB. Les unités de surface produites par le logiciel d’analyse spectrale sont arbitraires. - Calculer le nombre de moles du dimère d’adipate de butylène du PBAT dans l’échantillon, nBA, à l’aide de l’équation

où A3 est l’aire mesurée du pic 3 du PBAT, A3' est l’aire mesurée du pic 3' du PBAT, A6 est l’aire mesurée du pic 6 du PBAT et A6' est l’aire mesurée du pic 6' du PBAT. Les unités de surface produites par le logiciel d’analyse spectrale sont arbitraires. - Calculer la masse de PBAT dans l’échantillon, mPBAT, récupérée, à l’aide de l’équation

où MMBA est la masse molaire d’un dimère BA de PBAT (200 g/mol), et MMBT est la masse molaire d’un dimère BT de PBAT (220 g/mol). - Si une quantité connue de PBAT était présente dans l’échantillon, le pourcentage de récupération, η, peut être calculé pour l’échantillon comme mesure de l’efficacité d’extraction selon l’équation

- Calculer la concentration de PBAT dans un échantillon, CPBAT, à l’aide de l’équation

où msol sec est la masse de sol sec utilisée pour produire l’extrait (0,1 kg), Vsolvant récupéré est le volume de solvant récupéré du sol à l’étape 2.4, et Vsovlent ajouté est la quantité initiale de solvant ajoutée à l’échantillon de sol (100 mL).
5. Préparation de la courbe d’étalonnage pour la quantification du PBAT à partir d’un sol particulier
REMARQUE : Une courbe d’étalonnage créée à partir d’échantillons de sol avec des quantités connues de PBAT ajoutées fournira des informations utiles sur la façon dont le PBAT est extrait et récupéré d’un sol particulier. L’extraction n’est pas la même pour tous les sols ou toutes les formes de PBAT. Nous soupçonnons que l’efficacité de l’extraction dépend de la teneur en argile et en matière organiquedu sol 33, et nous recommandons de créer une courbe de calibrage pour chaque série de sols et horizon d’intérêt. La courbe d’étalonnage peut être créée avant ou après le traitement d’échantillons inconnus avec cette méthode.
- Recueillir et préparer l’équivalent de 2,5 kg de sol sec comme décrit aux étapes 1.1 à 1.3.
- Déterminer la plage à couvrir par la courbe d’étalonnage ; la concentration maximale de PBAT utilisée dans la courbe d’étalonnage doit être supérieure à la concentration la plus élevée de PBAT parmi les échantillons inconnus.
- Préparez ou obtenez suffisamment de plastique PBAT pour créer 5 échantillons enrichis de 100 g de sol avec 0 %, 25 %, 50 %, 75 % et 100 % de la concentration maximale (25 échantillons au total). Par exemple, si 40 mg/kg est la concentration maximale souhaitée, un total de 50 mg de PBAT sera nécessaire pour créer les échantillons enrichis.
- Préparez 25 échantillons de 100 g de sol chacun. Augmentez l’enrichissement des échantillons en pesant le plastique à base de PBAT et en l’ajoutant aux échantillons de sol aux doses prescrites. Par exemple, si 40 mg/kg de PBAT est la concentration maximale souhaitée, créez 5 échantillons sans PBAT, 5 échantillons avec 1 mg de PBAT, 5 échantillons avec 2 mg de PBAT, 5 échantillons avec 3 mg de PBAT et 5 échantillons avec 4 mg de PBAT. Après avoir ajouté du PBAT au sol, mélangez bien.
- Extrayez le PBAT des 25 échantillons enrichis, puis collectez les spectres RMN des extraits et analysez les spectres résultants comme décrit aux étapes 2.1 à 4.16.
- Identifiez l’équation d’une courbe d’étalonnage pour le PBAT dans ce sol en effectuant une régression linéaire entre la quantité mesurée de PBAT dans chaque échantillon enrichi et la quantité réelle de PBAT ajoutée dans un outil d’analyse statistique. Nous avons utilisé une feuille de calcul. Si aucun PBAT n’est détecté dans les échantillons enrichis sans PBAT ajouté, alors force b = 0 dans la régression.
REMARQUE : Un test de régression linéaire évalue la force de la relation linéaire entre deux variables numériques continues x et y, selon la relation y = mx + b. Les valeurs de m et b qui correspondent le mieux aux données sont calculées par le test. Le coefficient r2 du test de régression décrit le degré de corrélation entre les deux variables. - Testez une relation significative entre l’efficacité de l’extraction et la concentration de PBAT à l’aide de l’outil d’analyse statistique. Calculer l’efficacité d’extraction du PBAT à partir des échantillons enrichis comme suit :

- Utilisez l’outil d’analyse statistique pour calculer la probabilité que les données observées puissent apparaître de manière aléatoire sans corrélation entre l’efficacité d’extraction et la concentration de PBAT. Si cette valeur p est supérieure au seuil de signification prédéterminé, α, elle ne parvient pas à rejeter l’hypothèse nulle selon laquelle il n’existe pas de relation entre les deux variables. Si tel est le cas, on peut supposer que l’efficacité d’extraction est constante pour toutes les concentrations de PBAT dans la plage testée. Si l’hypothèse nulle est rejetée, le modèle linéaire décrit ici n’est peut-être pas la meilleure façon de modéliser les données.
- Utilisez l’équation de régression linéaire de la courbe d’étalonnage pour estimer la quantité de PBAT dans des échantillons inconnus traités à l’aide de cette méthode. Si la variable x de régression était la quantité réelle de PBAT dans les échantillons enrichis de la courbe d’étalonnage, la variable y était la quantité mesurée de PBAT, et b était fixée à 0, alors

REMARQUE : La teneur en PBAT des échantillons répétés estimée à l’aide d’une équation de courbe d’étalonnage peut être utilisée pour générer un intervalle de confiance pour la quantité de PBAT dans un sol particulier, ou si une moyenne et un intervalle de confiance peuvent être calculés pour les concentrations de PBAT dans les extraits répétés, la courbe d’étalonnage pourrait être appliquée pour estimer la concentration de PBAT dans le sol. L’un ou l’autre ordre des opérations produit le même intervalle de confiance pour la teneur en PBAT dans le sol. Par exemple, considérons des extraits de 10 échantillons répétés qui ont des concentrations de PBAT de 10, 5, 2, 4, 10, 11, 2, 6, 8 et 5 mg/kg et l’équation de la courbe d’étalonnage y (PBAT mesuré dans l’extrait) = 0,75 x (PBAT vrai dans le sol). Les concentrations de PBAT dans le sol de chaque répétition ont pu être estimées à 13, 7, 3, 5, 13, 15, 3, 8, 11 et 7 mg/kg. Ensuite, la concentration moyenne de PBAT dans le sol serait estimée à 8,4 mg/kg avec un écart-type de 4,4 mg/kg. Si une moyenne et un écart-type sont calculés pour les concentrations de PBAT dans l’extrait (10, 5, 2, 4, 10, 11, 2, 6, 8 et 5), une moyenne de 6,3 mg/kg et un écart-type de 3,3 mg/kg seraient calculés. Ensuite, la courbe d’étalonnage a pu être appliquée à la fois à la moyenne et à l’écart-type pour estimer la concentration de PBAT dans le sol : moyenne de 8,4 mg/kg, écart-type de 4,4 mg/kg.
Résultats
Pour évaluer l’efficacité de cette méthode dans la quantification du polymère PBAT dans le sol, des courbes d’étalonnage ont été construites en extrayant le PBAT à partir d’échantillons enrichis créés à partir de trois sols différents. Pour chacun des trois sols (détails dans le tableau 3), le sol a été passé à travers un tamis de 2 mm, puis séché à l’air. Des échantillons enrichis ont été créés en ajoutant 0, 9, 18, 27 ou 36 mg de MP à base de PBAT à 100 g de sol sec (5 répétitions de chaque). Cela équivaut à 0, 63, 126, 189 ou 252 mg/kg de polymère PBAT. Les MP ont été fabriqués à partir de paillis plastique avec 70 % de PBAT en masse et 50 μm d’épaisseur selon la procédure de broyage décrite dans Astner et al.45 et étaient inférieurs à 840 μm. Pour créer chaque courbe d’étalonnage, le PBAT a été extrait de chaque échantillon enrichi selon la procédure définie ci-dessus. La récupération de PBAT a ensuite été comparée à la quantité de PBAT ajoutée à chaque échantillon. Le taux de récupération et la quantification des PBAT ont également été testés pour les NP (diamètre moyen 780 nm, indice de polydispersité 0,77, préparé selon Astner et al.45) dans un sol (limon ombragé).
Pour tous les sols, aucun PBAT n’a été détecté dans les échantillons sans PBAT ajouté, c’est-à-dire qu’il n’y a pas eu de faux positifs observés par cette méthode. La figure supplémentaire 1 montre un spectre prélevé dans un sol limoneux ombragé qui ne contenait pas de PBAT (et qui contenait du DMB ajouté pendant le processus de préparation). Les deux pics caractéristiques du calibrateur interne DMB sont présents, mais les pics caractéristiques du PBAT ne le sont pas. Pour les sols auxquels on a ajouté du PBAT, les cinq pics caractéristiques utilisés pour identifier le PBAT étaient présents. La figure 2 montre un spectre prélevé dans un sol limoneux ombrageux avec 63 mg/kg de PBAT ajouté. Tous les pics PBAT et DMB utilisés dans la quantification sont clairement résolus. La figure supplémentaire 2 montre la région ajustée du spectre illustrée à la figure 2 avec des pics intégrés superposés. En raison du chevauchement des crêtes 3, 3', 6 et 6' avec d’autres signaux du spectre, il est important de calculer le contenu PBAT en se basant sur les intégrales des crêtes ajustées plutôt que sur les simples intégrales de crête. Cela élimine la zone apportée par d’autres constituants de l’extrait de sol et par le chevauchement des pics de PBAT. La figure supplémentaire 3 montre les effets de la dilution sur la résolution spectrale de la RMN. La figure montre un spectre prélevé dans un loam sableux Elkhorn avec 252 mg/kg de PBAT ajouté. Dans l’écran A, les pics PBAT 3, 3', 6 et 6' dans la plage de 4,5 à 4,0 ppm ne peuvent pas être résolus. La figure supplémentaire 3B montre un spectre recueilli à partir du même échantillon après qu’il a été dilué à 1:5 avec du chloroforme deutéré supplémentaire. Après dilution, les quatre pics sont distincts et leur aire peut être ajustée.
Les courbes d’étalonnage variaient entre les trois sols que nous avons testés. La figure 4 montre les concentrations estimées de PBAT de chaque sol sur la base de la PBAT mesurée (CPBAT,m) dans chaque extrait par rapport à la quantité réelle de PBAT (CPBAT,a) ajoutée au sol. La quantité de PBAT récupérée dans les sols limoneux ombragés était fortement corrélée avec la quantité de PBAT ajoutée (r2 = 0,99). Pour l’équation de la courbe d’étalonnage CPBAT, m = m*CPBAT,a, m = 0,76 ± 0,02 (moyenne ± une erreur type), et m était significativement différent de zéro (df = 24 ; F = 2000 ; p < 1*10-16). Le PBAT a été récupéré à une efficacité de η = 76 % ± 10 % (moyenne ± un écart-type) de ce sol. L’efficacité d’extraction du sol ombragé n’était pas corrélée avec la quantité de PBAT dans les échantillons (r2 = 0,009 ; p = 0,7). Le NP a été récupéré à une efficacité de η = 59 % ± 8 % (moyenne ± un écart-type). La figure 5 montre l’efficacité d’extraction des MP et des NP du terreau ombragé ; l’efficacité était significativement plus faible pour la NP (p = 0,0002). La quantité de PBAT récupérée dans le loam de Los Osos était moins fortement corrélée avec la quantité de PBAT ajoutée (r2 = 0,85) que dans le sol ombragé. Pour l’équation de la courbe d’étalonnage CPBAT, m = m*CPBAT,a, m = 0,57 ± 0,05 (moyenne ± une erreur type), et m était significativement différent de zéro (df = 23 ; F = 100 ; p = 8*10-11). Le PBAT a été récupéré à une efficacité de η = 57 % ± 22 % (moyenne ± un écart-type) de ce sol. L’efficacité d’extraction dans le sol de Los Osos n’était pas corrélée avec la quantité de PBAT dans les échantillons (r2 = 0,01 ; p = 0,6). La quantité de PBAT récupérée dans le limon sableux Elkhorn était fortement corrélée avec la quantité de PBAT ajoutée (r2 = 0,88). Pour l’équation de la courbe d’étalonnage CPBAT, m = m*CPBAT,a, m = 0,70 ± 0,05 (moyenne ± une erreur type), et m était significativement différent de zéro (df = 23 ; F = 200 ; p = 5*10-12). Le PBAT a été récupéré à une efficacité de η = 70 % ± 14 % (moyenne ± un écart-type) de ce sol. L’efficacité de l’extraction n’était pas corrélée avec la quantité de PBAT dans les échantillons (r2 = 0,006 ; p = 0,7) pour le sol Elkhorn.
De plus, cette méthode a été appliquée pour quantifier le PBAT dans un sol de la série Elkhorn. Dans cette expérience, de la terre Elkhorn a été recueillie à deux endroits dans un champ agricole, tamisée à travers un tamis de 2 mm, puis séchée à l’air. Le sol a été mélangé avec des MP de paillis à base de PBAT (créés comme décrit ci-dessus, diamètre < 840 μm), avec 50 mg de MP et 150 g de sol sec dans chaque mésocosme (250 mg/kg de PBAT) pour créer 5 mésocosmes avec des MP mélangés au sol du site A et 5 avec des MP mélangés au sol du site B (10 au total). Cinq mésocosmes composés de terre de chaque site sans MP ajoutés ont servi de témoin négatif (10 au total). Des mésocosmes ont été incubés pendant 6 mois pour étudier la biodégradation des MP de paillis à base de PBAT. Pendant l’incubation, la respiration cumulative du sol a été mesurée via les concentrations deCO2 dans l’espace de tête (à l’aide d’un analyseur de gaz infrarouge) et utilisée pour quantifier la dégradation du PBAT. La quantité de plastique restant dans les mésocosmes à la fin de l’incubation a été calculée comme suit :
CFracture à partir de plastique, finale = [mPlastique, i / C Plastique defracturation - (CCO2, plastique ajouté - CCO2 sans plastique)*msol sec]/(mPlastique, i/ C Plastique defracturation)
où msol sec est la quantité de terre dans chaque bocal d’incubation, Cfrac Plastique est la teneur en carbone des microplastiques ajoutés, CCO2, plastique ajouté est la quantité cumulée de CO2 produite dans un mésocosme avec plastique ajouté par gramme de sol sec, CCO2 sans plastique est la quantité de CO2 produite dans un mésocosme sans plastique ajouté par gramme de sol sec, Et Mplastique, I est la masse initiale du plastique ajouté.
Nous avons utilisé le bootstrap pour estimer les intervalles de confiance pour le plastique restant dans les sols A et B en calculant le plastique restant avec 10 000 sous-échantillons théoriques d’appariements aléatoires des 10 mésocosmes expérimentaux de chaque site. Au site A, l’estimation moyenne du plastique restant à partir des données sur la respiration était de 86 %, avec un intervalle de confiance à 95 % de 62 à >100 %. Au site B, l’estimation de la quantité moyenne de plastique restant était de 98 %, avec un intervalle de confiance à 95 % allant de 79 à >100 %. A la fin des 6 mois, la teneur en PBAT a également été mesurée par la méthode d’extraction et de quantification RMN décrite dans ce manuscrit (n = 5 pour le site A et n = 4 pour le site B). Au site A, l’estimation de la quantité moyenne de plastique restante à partir des données RMN était de 79 %, avec un intervalle de confiance à 95 % (moyenne ± 1,96xSE) allant de 71 % à 87 %. Au site B, la quantité moyenne estimée de plastique restant était de 88 %, avec un intervalle de confiance à 95 % allant de 71 % à 100 %. La figure 6 montre les intervalles de confiance pour la teneur en plastique du sol des deux sites estimés par les deux méthodes différentes. Les estimations de la teneur en plastique des deux méthodes semblent mutuellement cohérentes d’après la grande partie du chevauchement entre chaque paire d’intervalles de confiance.

Figure 1 : Vue d’ensemble visuelle de la procédure d’extraction et de quantification de l’adipate de polybutylène téréphtalate (PBAT). Veuillez cliquer ici pour voir une version agrandie de cette figure.
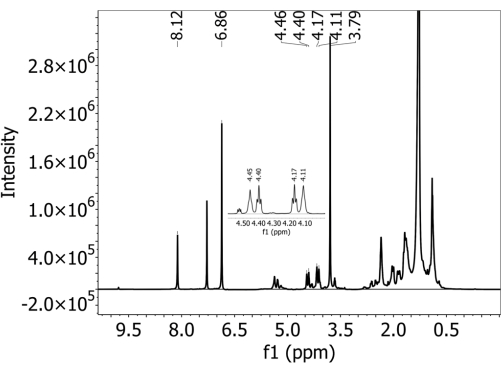
Figure 2 : Spectre1 H-RMN recueilli dans un solvant chloroforme deutéré à l’aide d’un spectromètre de 500 MHz sur un extrait d’un sol limoneux ombrageux avec des MP d’adipate de butylène téréphtalate (PBAT). Les pics caractéristiques PBAT et DMB sont présents dans le spectre. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Structures du polybutylène adipate téréphtalate (PBAT) et du 1,4-diméthoxybenzène (DMB) avec des protons marqués. Les structures correspondantes sont présentées dans le tableau 1 et le tableau 2. (A) Structure d’une unité BA-BT de PBAT. (B) Structure des triades T-B-T, T-B-A et A-B-A à partir de PBAT. (C) Structure de DMB. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Concentrations de PBAT mesurées par 1H-QNMR dans des extraits dans un solvant chloroforme deutéré provenant d’un sol de loam ombragé, d’un loam de Los Osos et d’un loam sableux d’Elkhorn contenant des quantités connues de PBAT. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Efficacité d’extraction des MP et NP PBAT à partir d’échantillons enrichis dans un sol limoneux ombragé. La récupération du PBAT est significativement plus faible pour les NP (p = 0,0002). La ligne médiane de chaque boîte représente la moyenne des points de données mesurés, tandis que les limites supérieure et inférieure de la boîte reflètent Q3 et Q1, respectivement. Les limites supérieure et inférieure des moustaches reflètent respectivement les points de données maximum et minimum. Les points de données individuels sont affichés dans la boîte et les moustaches. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : La teneur en plastique de deux sols d’Elkhorn a été mesurée par respiration cumulative par incubation et par extraction par solvant couplée à la RMN. Pour la teneur en plastique mesurée par la respiration, les barres représentent un intervalle de confiance de 95 %. Pour le contenu en plastique mesuré par RMN, les barres représentent un intervalle de confiance à 95 % basé sur deux fois l’erreur-type au-dessus et au-dessous de l’estimation moyenne (n = 5 pour le site a et n = 4 pour le site b). Veuillez cliquer ici pour voir une version agrandie de cette figure.
| ID du pic | Emplacement | Nombre de protons | Multiplicité | Monomère | Utilisé dans la quantification |
| 5 | 8.1 | 4 | Maillot | T | oui |
| 6 | 4.44 | 2 | Triplet | B | oui |
| 6’ | 4.38 | 2 | Triplet | B | oui |
| 3’ | 4.15 | 2 | Triplet | B | oui |
| 3 | 4.09 | 2 | Triplet | B | oui |
| 1 | 2.34 | 4 | Triplet | Un | Non |
| 7 | 1.97 | 2 | Multiplet | B | Non |
| 7’ | 1.87 | 2 | Multiplet | B | Non |
| 4’ | 1.81 | 2 | Multiplet | B | Non |
| 4 | 1.68 | 2 | Multiplet | B | Non |
| 2 | 1.66 | 4 | Multiplet | Un | Non |
Tableau 1 :Pics spectraux 1 H-NMR du polybutylène adipate téréphtalate (PBAT) dans un solvant chloroforme deutéré. Les hydrogènes attribués à chaque pic sont étiquetés à la figure 3. Les assignations de pics sont basées sur Herrera et al.27.
| ID du pic | Emplacement | Nombre de protons | Multiplicité | Utilisé dans la quantification |
| Un | 6.84 | 4 | Maillot | oui |
| B | 3.77 | 6 | Maillot | oui |
Tableau 2 : Pics de RMN-H de 1,4-diméthoxybenzène (DMB) dans un solvant chloroforme deutérat. Les hydrogènes attribués à chaque pic sont étiquetés à la figure 3B. Les affectations de pics sont basées sur Nelson et al.33.
| Série de sols | Classification | Texture | Carbone organique total | pH | Lieu de collecte | Profondeur de collecte (cm) |
| Ombragé | Limoneux fin, mixte, subactif, thermique Hapludult typique | Terreau | 1.70% | 6 | Knoxville, Tennessee, États-Unis | 0-5 |
| Los Osos | Fine, smectitique, thermique Typic Argixeroll | Terreau | 3.00% | 6 | San Luis Obispo, Californie, États-Unis | 0-5 |
| Elkhorn | Pachic Argixeroll fin-limoneux, mixte, superactif, thermique | Loam sableux | 1% | 7 | Watsonville, Californie, États-Unis | 0-5 |
Tableau 3 : Propriétés des trois sols qui ont été utilisés pour démontrer la méthode d’extraction PBAT.
Figure supplémentaire 1 : Spectrede RMN-H 1 recueilli dans un solvant chloroforme deutéré à l’aide d’un spectromètre de 500 MHz sur un extrait d’un loam ombragé sans polymère PBAT présent. Les pics caractéristiques du PBAT ne sont pas présents, contrairement aux pics DMB (ajoutés en tant que calibrateur interne) le sont. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Région ajustée du spectre 1 H-RMN, comme le montre la Figure 4. Le spectre a été collecté dans un solvant chloroforme deutéré. Le fond vert montre la région du spectre qui a été ajustée. Les lignes violettes indiquent les pics ajustés tandis que les lignes rouges indiquent l’erreur (parties du signal spectral non incluses dans les pics ajustés). Les pics PBAT 5, 6, 6', 3' et 3 sont inclus dans l’ajustement ainsi que les pics DMB A et B. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Spectresde RMN-H 1 dans un solvant chloroforme deutéré collectés à l’aide d’un spectromètre de 500 MHz sur un extrait de loam sableux Elkhorn avec ajout de MP PBAT. Les pics caractéristiques PBAT et DMB sont présents dans le spectre. (A) Les pics de PBAT ne peuvent pas être distingués pour quantifier le polymère. Si les extraits d’échantillons produisent des spectres comme celui-ci, diluez l’échantillon, puis utilisez-le pour collecter un nouveau spectre RMN 1H. (B) Le même extrait est dilué de manière à ce que tous les pics spectraux soient clairement résolus. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Nous proposons une méthode d’extraction par solvant du PBAT du sol couplée à la RMN 1H pour quantifier le PBAT dans l’extrait. Les éléments clés du processus d’extraction comprennent la technique et l’équipement d’extraction, le solvant utilisé pour l’extraction et le temps requis. Nous avons choisi d’utiliser une technique d’extraction qui nécessite un équipement relativement simple et peu coûteux (bocaux en verre, billes de verre et table vibrante) par rapport à l’extraction Soxhlet et à l’extraction accélérée par solvant (ASE) démontrées par Nelson et al.33. L’objectif de cette méthode est que de nombreux échantillons puissent être extraits en parallèle pour accélérer le traitement des échantillons de sol en vrac. Un autre avantage de l’extraction simple par agitation par solvant est que de plus grands volumes de sol peuvent être accueillis par rapport aux approches Soxhlet ou ASE, ce qui permet un traitement plus facile des échantillons représentatifs de l’environnement13,36. Nous avons sélectionné la solution de solvant chloroforme-méthanol en fonction des résultats positifs présentés par Nelson et coll.33 et de la disponibilité du chloroforme deutéré comme solvant 1H-RMN. Nous avons testé l’ultrasonication de mélanges solvant-matrice alignés sur le protocole décrit dans Nelson et al.33 par rapport à la méthode simple d’agitation par solvant et n’avons trouvé aucune différence significative dans les taux de récupération PBAT entre les deux méthodes. Nous avons constaté que 8 h de secousses à 200 tr/min étaient suffisantes pour briser les agrégats du sol dans 100 g de matrice de sol pour les trois sols que nous avons testés, tandis que des temps de secouage plus courts ou des vitesses de secouage plus faibles étaient insuffisants. Il a ensuite fallu un décantation pour récupérer le solvant sans particules de sol. La récupération du PBAT a été testée avec des plastiques de taille nanométrique, et la récupération était nettement inférieure à celle des MP. Cela signifie que la méthode peut nécessiter d’autres développements pour quantifier avec précision les échantillons environnementaux de NP inconnus, mais la récupération et la mesure partielles des NP sont toujours précieuses par rapport à d’autres méthodes de taille limitée, même si l’information sur la taille des particules ne peut pas être obtenue par cette méthode.
Alors que Nelson et coll.33 ont rapporté des efficacités d’extraction proches de 100 % pour une méthode d’extraction par ultrasons, nous avons constaté que les ultrasons et la méthode d’extraction basée sur un agitateur décrite ici ont toutes deux conduit à des efficacités d’extraction nettement inférieures à 100 %. Nous pensons que cela peut être dû aux effets de l’altération environnementale, y compris la photooxydation sur le paillis de plastique. Nelson et al.33 ont observé une réduction significative de l’efficacité d’extraction des MP PBAT irradiés aux UV par rapport aux matériaux non altérés. Le plastique que nous avons utilisé pour tester cette méthode de quantification a été exposé au soleil pendant une saison de croissance complète avant d’être transformé en MP. Malgré les photostabilisants ajoutés aux films de paillis de plastique commerciaux, la structure du polymère des paillis change en raison des rayons UV (par exemple, la réticulation en chaîne qui augmente la teneur en gel du matériau)46 dans des conditions d’altération environnementale et la dégradation du polymère peut modifier son spectre RMN47. Cela peut contribuer aux taux de récupération PBAT plus faibles que nous avons observés par rapport à Nelson et al.33. Nous avons également constaté que l’efficacité d’extraction du PBAT variait entre les trois sols que nous avons testés. Le sol ombragé contient principalement des argiles de faible activité, tandis que les deux autres sols ont des argiles smectitiques (Los Osos) et mixtes et superactives (Elkhorn). La présence de minéraux argileux de haute activité et de 2:1 peut avoir inhibé l’extraction par solvant du PBAT dans ces sols33,48, conduisant à la récupération plus faible du PBAT que nous avons observée. Nous recommandons d’autres recherches sur les associations plastiques-minéraux dans le sol pour les MP et les NP biodégradables, y compris le PBAT, ainsi que les MP et NP polymères non dégradables conventionnels. Ceci est important à la fois pour comprendre comment les polymères MP peuvent être extraits et mesurés du sol et pour comprendre comment ils peuvent se biodégrader ou affecter les systèmes du sol.
Les éléments clés du processus d’acquisition du spectre RMN comprennent la force de l’aimant de l’instrument, le nombre de balayages utilisés, le temps de relaxation de l’échantillon entre les balayages et le temps de mesure total par échantillon. Nous avons utilisé un spectromètre de 500 MHz ; des insufflations de champ magnétique plus élevées offrent une sensibilité et une résolution accrues dans les spectres RMN. Le rapport spectral signal/bruit peut être augmenté en collectant des balayages répétés du même échantillon et en les additionnant. La collecte de n balayages augmentera le rapport signal/bruit d’un facteur √n, mais augmentera le temps de mesure d’un facteur n29. Cela signifie que si un rapport signal/bruit plus élevé est nécessaire pour quantifier le PBAT dans un échantillon, le nombre de balayages peut être augmenté au prix d’une durée d’exécution d’échantillon plus longue. Un rapport signal/bruit de 150 pour un signal particulier est nécessaire pour maintenir une erreur de <1 % dans la quantification44. Selon nos paramètres d’acquisition (instrument, sonde, nombre de balayages), environ 5 mg de PBAT par échantillon (ou 50 μg de PBAT par mL d’extrait) ont été nécessaires pour obtenir un rapport signal/bruit de 150 et donc une erreur de <1 % dans la quantification ; Cette concentration est spécifique à notre dispositif de collecte de données. Cette concentration de PBAT est supérieure aux limites de quantification atteintes par d’autres utilisant laRMN-1 pour quantifier d’autres types de MP en l’absence de sol16,24, démontrant l’impact de la matière organique du sol et d’autres composés co-extraits sur la méthode de quantification. La plage quantifiable de PBAT est également limitée à l’extrémité supérieure en raison de l’élargissement de la raie observé à des concentrations de PBAT supérieures à 25 mg par échantillon (250 μg de PBAT par mL d’extrait), ce qui a conduit à un chevauchement des pics de PBAT comme décrit dans les résultats représentatifs et illustré à la figure supplémentaire 3. Cependant, cette méthode permet une certaine souplesse pour répondre à ces limites afin de s’assurer que les échantillons sont quantifiables. La quantité de sol utilisée pour créer des extraits peut être augmentée ou diminuée et les extraits peuvent être dilués et réanalysés pour ajuster la concentration de PBAT dans la plage optimale.
Les éléments clés du processus de quantification du PBAT sur la base des spectres RMN comprennent les pics utilisés pour quantifier le PBAT, l’utilisation de l’ajustement de ligne pour calculer les zones de pics et la courbe d’étalonnage. Conceptuellement, n’importe quelle paire de pics PBAT et DMB pourrait être comparée pour calculer le rapport des deux composés dans un échantillon. Nous avons trouvé les résultats les plus précis lorsque nous avons calculé le rapport BT :DMB comme la moyenne des aires de pic 5 :A et des aires de pic 5 :B (normalisées par leur nombre respectif de protons). Le pic PBAT 5 ne fournit que la quantification du monomère 1,4-butanediol-téréphtalate (BT), de sorte que l’aire des pics 3 et 3' (représentant le monomère 1,4-butanediol-adipate, ou BA) a été comparée à l’aire des pics 6 et 6' (représentant le monomère BT) pour quantifier les groupes BA présents dans l’échantillon. Le montant de BT et de BA a été additionné pour représenter le montant total de PBAT restant. Il n’a pas été possible d’utiliser le pic 1 ou 2 de PBAT dans la quantification de l’AB en raison de l’interférence de composés coextraits (supposés être de la matière organique du sol), ce qui a créé plusieurs pics larges dans la gamme de 2,7 à 0,7 ppm. Nous avons exploré la possibilité de supprimer ces signaux indésirables des spectres avec une correction de fond (c’est-à-dire en soustrayant un spectre vide de chaque spectre d’échantillon), mais nous avons constaté que la création de spectres de fond et d’échantillon comparables équivalents sans l’utilisation d’un étalon n’était pas fiable. L’ajustement linéaire a été utilisé pour calculer l’aire des pics ajustés plutôt que d’intégrer directement les pics spectraux. En raison du chevauchement entre les pics PBAT 3 et 3' et entre les pics 6 et 6', cela a permis d’obtenir des estimations plus précises du contenu PBAT basées sur une analyse préliminaire. Nous recommandons la création d’une courbe d’étalonnage pour tenir compte des différents taux de récupération de PBAT dans différents sols. Les taux de récupération des PBAT étaient significativement différents pour une paire, sur les trois sols que nous avons testés, comme l’indiquent les intervalles de confiance à 95 % non chevauchants pour la pente de la courbe d’étalonnage. La récupération des PBAT dans un troisième sol n’était pas significativement différente de celle des deux autres. En l’absence d’une compréhension mécaniste de l’impact de la composition du sol sur la récupération du PBAT, nous recommandons de créer des courbes de calibrage pour évaluer le rétablissement du PBAT dans chaque série de sols d’intérêt et pour chaque horizon d’un profil de sol. Si les courbes d’étalonnage sont statistiquement similaires entre les sols, les sols peuvent facilement être analysés en combinaison.
Nous pensons que cette méthode peut fournir un outil précieux à ceux qui s’intéressent à la quantification des MP et des NP PBAT dans le sol, en particulier pour quantifier le PBAT dans un grand nombre d’échantillons collectés dans des sols similaires, par exemple, dans une étude de terrain à long terme sur la biodégradation du plastique. Une méthode de RMN pour quantifier les MP du sol est précieuse car elle permet aux chercheurs ayant accès à la RMN et une expertise en la RMN de contribuer à répondre aux besoins du domaine émergent en répondant à des questions importantes sur la présence et le comportement des MP dans les systèmes pédologiques. Bien que l’accès à l’instrumentation et à l’expertise soit probablement l’une des premières préoccupations pratiques limitant le choix des techniques de quantification par les chercheurs, la RMN n’est pas l’outil le plus efficace ou le plus approprié pour quantifier les microplastiques du sol dans toutes les conditions. Il n’est pas possible d’obtenir des informations sur la forme et la taille des particules à l’aide d’une technique d’extraction par solvant ; si la forme et la taille des MP sont intéressantes, les chercheurs seraient mieux servis par une technique permettant d’identifier des particules MP individuelles, comme la spectroscopie FTIR ou Raman. L’un des avantages des méthodes d’extraction par solvant comme celles présentées ici et dans Nelson et coll.33 par rapport à d’autres approches de quantification des MP comme la FTIR ou la spectroscopie Raman est qu’il n’y a théoriquement aucune limite de taille aux MP et aux NP qui peut être quantifiée ; L’extraction par solvant peut être plus bénéfique lorsque l’information sur la taille des particules n’est pas nécessaire ou lorsque les particules d’intérêt sont trop difficiles à séparer par d’autres moyens. La pyrolyse GCMS peut être précieuse parce qu’elle a une sensibilité plus élevée que la RMN, mais les résultats sont également sujets à des effets de matrice, comme l’est probablement l’extraction par solvant PBAT.
Nous espérons que des travaux supplémentaires amélioreront la robustesse de cette méthode en s’attaquant aux constituants du sol coextraits qui interfèrent avec la résolution du pic PBAT dans les spectres RMN. Des travaux supplémentaires sont également nécessaires pour établir la relation entre l’altération plastique du PBAT et l’efficacité de l’extraction grâce à cette méthode, peut-être accompagnée d’une compréhension plus détaillée des produits de dégradation du PBAT et de leurs spectres RMN 1H. Sur la base de nos résultats et de ceux de Nelson et al.33, cette procédure de quantification est la plus performante pour quantifier les plastiques PBAT non altérés dans les sols à faible teneur en matière organique et sans argiles à haute activité. Bien que nous n’ayons utilisé cette méthode que pour quantifier les MP à base de PBAT dans le sol, l’extraction par solvant et laprocédure de quantification de la RMN-1 H pourraient être utiles pour quantifier d’autres MP et NP provenant de sols supplémentaires26,49. L’extension de la méthode aux MP constitués d’un autre polymère nécessite de s’assurer de la solubilité du polymère dans le solvant et d’identifier les pics RMN caractéristiques du polymère dans le solvant choisi. Il peut être nécessaire de sélectionner un nouvel étalon interne soluble dans le solvant choisi et qui ne produit pas de pics qui se chevauchent avec ceux du polymère d’intérêt42.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents connus ou de relations personnelles qui auraient pu sembler influencer les travaux rapportés dans cet article.
Remerciements
Merci à l’USDA-NIFA d’avoir financé ce projet par le biais de l’attribution 2020-67019-31167 à SMS et au programme SPRINT (Strategic Planning Research Initiatives) de l’Université du Tennessee pour une subvention interne DGH et SMS. Les bailleurs de fonds n’ont joué aucun rôle dans la conception de l’étude, la collecte de données, l’analyse, l’interprétation, la rédaction du rapport ou la décision de soumettre l’article pour publication.
matériels
| Name | Company | Catalog Number | Comments |
| 1,4-dimethoxybenzene | Arcos Organics 99%+ | AC115411000 | 1 mg per sample |
| Amber glass bottle with PTFE lined lid (1 L) | Kimble | 5223253C-26 | reusable |
| Chloroform; trichloromethane | Fisher Chemical | AA43685M6 | 90 mL per sample; Fisher Optima |
| Deuterated chlorform; trichloro(deuterio)methane | Sigma Aldrich | 1034200025 | 1 mL per sample; minimum 99.8% deuterated; stabilized with silver |
| Glass beads (3 mm diameter) | Propper Manufacturing | 3000600 | 20 per sample |
| Glass extraction jars with PTFE lined lid (~250 mL volume) | Kimble | 5510858B | 2 per sample, reusable |
| Graduated cylinder, 1 L, polypropylene | Nalgene | 3662-1000 | reusable |
| Graduated cylinder, 500 mL, polypropylene | Nalgene | 3662-0500 | reusable |
| Methanol | Fisher Chemical | A412-4 | 20 mL per sample; certified ACS |
| Micropipette wth range of 0.5 - 1 mL | Fisher Scientific | 3123000063 | reusable |
| NMR spectrometer | Bruker | n/a | 500 MHz instrument |
| NMR tube (7 inch height, high-throughput) | Wilmad | WG-1000-7 | 1 per sample |
| Platform shaker | Eppendorf, Excella E5 | M1355-0000 | reusable |
| Polyethylene pipette tip (10 mL volume) | Eppendorf | 22492098 | 1 per sample, single use |
| Polypropylene micropipette tips (1 mL volume) | Fisher Scientific | 02-707-510 | 3 per sample, single use |
| Semi-microbalance | Mettler Toledo | 30532226 | reusable |
Références
- Andrady, A. L. The plastic in microplastics: A review. Mar Pollut Bull. 119 (1), 12-22 (2017).
- Fakour, H., et al. Quantification and analysis of microplastics in farmland soils: Characterization, sources, and pathways. Agriculture. 11 (4), 330(2021).
- Wang, K., et al. Impact of long-term conventional and biodegradable film mulching on microplastic abundance, soil structure and organic carbon in a cotton field. Environ Pollut. 356, 124367(2024).
- Plastics Europe Plastics - the Facts. , Plastics Europe. Available from: https://plasticseurope.org/knowledge-hub/plastics-the-facts-2022/ (2022).
- Assessment of agricultural plastics and their sustainability: A call for action. , Food Agriculture Organization. Rome. (2021).
- Beriot, N., et al. Intensive vegetable production under plastic mulch: A field study on soil plastic and pesticide residues and their effects on the soil microbiome. Sci Total Environ. 900, 165179(2023).
- Liu, E. K., He, W. Q., Yan, C. R. White revolution to white pollution - Agricultural plastic film mulch in China. Environ Res Lett. 9 (9), 091001(2014).
- Sintim, H. Y., et al. Release of micro- and nanoparticles from biodegradable plastic during in situ composting. Sci Total Environ. 675, 686-693 (2019).
- Skoczinski, P., et al. Bio-based building blocks and polymers - Global capacities, production and trends 2023-2028. Indust Biotech. 20 (2), 52-59 (2024).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Li, C., et al. Effects of biodegradable mulch on soil quality. Appl Soil Ecol. 79, 59-69 (2014).
- Wang, F., Wang, Q., Adams, C. A., Sun, Y., Zhang, S. Effects of microplastics on soil properties: Current knowledge and future perspectives. J Hazardous Mater. 424, 127531(2021).
- Möller, J. N., Löder, M. G. J., Laforsch, C. Finding microplastics in soils: A review of analytical methods. Environ Sci Technol. 54 (4), 2078-2090 (2020).
- Paul, A., Wander, L., Becker, R., Goedecke, C., Braun, U. High-throughput NIR spectroscopic (NIRS) detection of microplastics in soil. Environ Sci Pollut Res. 26 (8), 7364-7374 (2019).
- Wortman, S. E., Jeske, E., Samuelson, M. B., Drijber, R. A new method for detecting micro-fragments of biodegradable mulch films containing poly(butylene adipate-co-terephthalate) (PBAT) in soil. J Environ Quality. 51 (1), 123-128 (2021).
- Peez, N., et al. Quantitative analysis of PET microplastics in environmental model samples using quantitative 1H-NMR spectroscopy: Validation of an optimized and consistent sample clean-up method. Anal Bioanal Chem. 411 (28), 7409-7418 (2019).
- Praveena, S. M., Aris, A. Z., Singh, V. Quality assessment for methodological aspects of microplastics analysis in soil. Trend Environ Anal Chem. 34, e00159(2022).
- Primpke, S., et al. Critical assessment of analytical methods for the harmonized and cost-efficient analysis of microplastics. Appl Spectro. 74 (9), 1012-1047 (2020).
- Käppler, A., et al. Analysis of environmental microplastics by vibrational microspectroscopy: FTIR, Raman or both. Anal Bioanal Chem. 408 (29), 8377-8391 (2016).
- Watteau, F., Dignac, M. F., Bouchard, A., Revallier, A., Houot, S. Microplastic detection in soil amended with municipal solid waste composts as revealed by transmission electronic microscopy and pyrolysis/GC/MS. Front Sustainable Food Syst. 2, 407866(2018).
- Pfohl, P., et al. Microplastic extraction protocols can impact the polymer structure. Microplastics Nanoplastics. 1 (1), 1-13 (2021).
- Xu, J. L., Thomas, K. V., Luo, Z., Gowen, A. A. FTIR and Raman imaging for microplastics analysis: State of the art, challenges and prospects. Trend Anal Chem. 119, 115629(2019).
- Cardoza, L. A., Korir, A. K., Otto, W. H., Wurrey, C. J., Larive, C. K. Applications of NMR spectroscopy in environmental science. Prog Nucl Magnetic Resonance Spectr. 45 (3-4), 209-238 (2004).
- Peez, N., Rinesch, T., Kolz, J., Imhof, W. Applicable and cost-efficient microplastic analysis by quantitative 1H-NMR spectroscopy using benchtop NMR and NoD methods. Magnetic Resonance Chem. 60 (1), 172-183 (2022).
- Günther, M., Imhof, W. Simultaneous quantification of microplastic particles by non-deuterated (NoD) 1 H-qNMR from samples comprising different polymer types. Analyst. 148 (5), 1151-1161 (2023).
- Papini, G., Petrella, G., Cicero, D. O., Boglione, C., Rakaj, A. Identification and quantification of polystyrene microplastics in marine sediments facing a river mouth through NMR spectroscopy. Marine Pollut Bull. 198, 115784(2024).
- Herrera, R., Franco, L., Rodríguez-Galán, A., Puiggalí, J. Characterization and degradation behavior of poly(butylene adipate-co-terephthalate)s. J Polymer Sci Part A. 40 (23), 4141-4157 (2002).
- Mauel, A., Pötzschner, B., Meides, N., Siegel, R., Strohriegl, P., Senker, J. Quantification of photooxidative defects in weathered microplastics using 13 C multiCP NMR spectroscopy. RSC Adv. 12 (18), 10875-10885 (2022).
- Bharti, S. K., Roy, R. Quantitative 1H NMR spectroscopy. Trend Anal Chem. 35, 5-26 (2012).
- Li, X., Hu, K. Quantitative NMR Studies of Multiple Compound Mixtures. Ann Rep NMR Spectro. 90, 85-143 (2017).
- Simmler, C., Napolitano, J. G., McAlpine, J. B., Chen, S. N., Pauli, G. F. Universal quantitative NMR analysis of complex natural samples. Curr Opinion Biotechnol. 25, 51-59 (2014).
- Giraudeau, P. Challenges and perspectives in quantitative NMR. Magnetic Reason Chem. 55 (1), 61-69 (2017).
- Nelson, T. F., Remke, S. C., Kohler, H. P. E., McNeill, K., Sander, M. Quantification of Synthetic Polyesters from Biodegradable Mulch Films in Soils. Environ Sci Technol. 54, 266-275 (2020).
- Brandolini, A. J., Hills, D. D. NMR spectra of polymers and polymer additives. , CRC Press. Boca Raton. (2000).
- Matsuda, H., Asakura, T., Miki, T. Triad sequence analysis of poly(ethylene/butylene terephthalate) copolymer using 1H NMR. Macromolecules. 35 (12), 4664-4668 (2002).
- Yu, Y., Flury, M. How to take representative samples to quantify microplastic particles in soil. Sci Total Environ. 784, 147166(2021).
- Cambardella, C. A., et al. Field-scale variability of soil properties in central Iowa soils. Soil Sci Soc Am J. 58, 1501-1511 (1994).
- Ramsey, M. H., Argyraki, A. Estimation of measurement uncertainty from field sampling: Implications for the classification of contaminated land. Sci Total Environ. 198 (3), 243-257 (1997).
- Desaules, A. Critical evaluation of soil contamination assessment methods for trace metals. Sci Total Environ. 426, 120-131 (2012).
- Pennock, D., Yates, T., Braidek, J. Soil Sampling Designs. Soil Sampl Meth Anal. , 25-38 (2006).
- Büks, F., Kaupenjohann, M. Global concentrations of microplastics in soils - A review. SOIL. 6 (2), 649-662 (2020).
- Bowen, M., O'Neill, I., Pringuer, M. Quantitiative Applications of Nuclear Magnetic Resonance in Pharmaceutical Analysis. Proc Soc Anal Chem. , 294-297 (1974).
- Frank, O., Kreissl, J. K., Daschner, A., Hofmann, T. Accurate determination of reference materials and natural isolates by means of quantitative 1H NMR spectroscopy. J Agri Food Chem. 62 (12), 2506-2515 (2014).
- Malz, F., Jancke, H. Validation of quantitative NMR. J Pharma Biomed Anal. 38 (5), 813-823 (2005).
- Astner, A. F., et al. Forming micro-and nano-plastics from agricultural plastic films for employment in fundamental research studies. J Vis Exp. (185), e641112(2022).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. J Polymer Environ. 29 (9), 2916-2931 (2021).
- Deshoulles, Q., et al. Hydrolytic degradation of biodegradable poly(butylene adipate-co-terephthalate) (PBAT) - Towards an understanding of microplastics fragmentation. Polymer Degrad Stability. 205, 110122(2022).
- Zhang, Y., et al. Aging significantly increases the interaction between polystyrene nanoplastic and minerals. Water Res. 219, 118544(2022).
- Peez, N., Janiska, M. C., Imhof, W. The first application of quantitative 1H NMR spectroscopy as a simple and fast method of identification and quantification of microplastic particles (PE, PET, and PS). Anal Bioanal Chem. 411 (4), 823-833 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon