Method Article
使用质子核磁共振波谱定量土壤中基于聚己二酸对苯二酸丁二醇酯的微塑料和纳米塑料
摘要
这里描述了一种使用核磁共振波谱法量化土壤中己二酸对苯二酸丁二醇酯衍生的微塑料和纳米塑料的方法。该技术改进了现有方法,因为它扩展到纳米塑料的定量,并且可以轻松适应批量处理环境样品。
摘要
需要一种方法来恢复和量化生物降解过程中在土壤中形成的微塑料和纳米塑料(MP 和 NPs),以准确评估可生物降解塑料产品的降解和环境影响。土壤中 MP 和 NP 的存在可能会改变土壤特性,如聚集行为或对土壤生物群产生毒性作用。现有的 MP 回收方法并不总是适用于测量聚己二酸对苯二醇酯 (PBAT) 等可生物降解聚合物;一些常见的酸或氧化剂消解程序会破坏基于 PBAT 的可生物降解 MP。微量 FTIR 和微量拉曼光谱等鉴定方法也受到可回收和分析的颗粒最小尺寸的限制。因此,开发了这种方法来从土壤中提取和量化 PBAT,以评估土壤中 MPs 和 NPs 的质量分数,而无需化学转化 PBAT。在该方案中,使用氯仿 - 甲醇溶液从土壤中选择性提取 PBAT。溶剂从提取物中蒸发,然后将提取物重新溶解在氘代氯仿中。在定量参数下通过质子核磁共振波谱 (1H-QNMR) 分析提取物,以量化每个样品中 PBAT 的量。PBAT 的溶剂萃取效率范围从阴凉壤土中的 76% 到 Elkhorn 沙壤土中的 45% 不等。与原始材料相比,光氧化材料的 PBAT 回收率可能会降低,而在粘土含量高的土壤中可能会降低。提取效率不取决于测试范围内的 PBAT 浓度,但观察到 NP 的提取效率低于 MP。PBAT 定量结果与在实验室培养研究中通过测量累积土壤呼吸来量化塑料降解的结果相当。
引言
测量土壤中 MP 污染的方法对于了解全球土壤中塑料污染的范围1、塑料污染源2 和潜在解决方案3 是必要的。农业土壤特别容易受到塑料污染:截至 2021 年,每年农业中使用的塑料超过 1500 万吨4,其中包括 250 万吨塑料覆盖物5。塑料覆盖物与土壤紧密接触,每年重新施用一次或多次6,并且在使用寿命过后很难从土壤中完全清除7。需要 MP 测量方法的一个关键领域是评估可生物降解的塑料产品,例如用于蔬菜系统的可生物降解塑料覆盖物8。
土壤中可生物降解的塑料产品是传统农业塑料的有前途的替代品,因为如果它们按预期工作,它们可以消除塑料覆盖物对土壤的塑料污染。2022 年,全球可生物降解塑料产量不到 100 万吨,预计该行业将快速增长9。四种最常见的可生物降解聚合物,即聚乳酸 (PLA)、聚合淀粉、聚羟基脂肪酸酯 (PHA) 和己二酸对苯二甲酸丁二醇酯 (PBAT),均用于农业可生物降解塑料地膜的商业或实验10。尽管前景广阔,但这些可生物降解塑料产品在田间条件下的降解是可变的11。虽然现场一些关于可生物降解塑料覆盖物降解的研究集中在大型塑料碎片11 上,但评估塑料材料的完全降解需要能够从土壤中回收 MP 和 NP。土壤中的微塑料量化对于评估 MP 污染对土壤生态系统的潜在负面影响也很重要12。
MP 鉴定和定量的一些常用技术包括视觉分析、微傅里叶变换红外光谱 (μFTIR)、微拉曼光谱 (μRaman)、气相色谱-质谱(GCMS,包括热解 GCMS 和热萃取脱附 GCMS)和热重分析13。其他开发中的技术包括用于土壤中原位 MP 测量的近红外光谱14、用于 GCMS 分析的脂肪酸甲酯萃取15 和核磁共振波谱16。在量化土壤中 MP 的研究中,多达 90% 使用视觉分析(单独或与其他技术配对)来识别塑料颗粒,而 77% 使用 FTIR、拉曼或 GCMS 光谱技术17。开发和协调各种 MP 定量技术有助于扩大科学界回答各种微塑料研究问题的能力18。有三种通用方法可以制备土壤样品以量化微塑料:1) 从土壤中分离不变的单个微塑料颗粒(例如通过密度分离),2) 提取转化的塑料或聚合物材料(例如通过溶解),或 3) 分析散装土壤。μFTIR 和 μRaman 光谱都需要先将单个 MP 与土壤分离,然后才能对其进行化学鉴定19,而 pyro-GCMS 可以对从土壤或散装土壤中分离的塑料颗粒进行20。从土壤中分离可生物降解的 MP 可能很困难,因为一些用于去除土壤有机物的消化会降解或以其他方式化学改变可生物降解的聚合物,包括 PBAT21。微量拉曼光谱和 μFTIR 光谱也都有空间分辨率限制:μFTIR 的颗粒必须大于 10-20 μm,μRaman 的颗粒必须大于 1 μm(如果可以制备如此小的单个颗粒进行分析)19,22。这些技术可以提供 MP 聚合物的化学鉴定,并且可以采用光谱成像来测量 MP22 尺寸。所有类型的 pyro-GCMS 都受到限制,因为样品在分析过程中会被破坏。
核磁共振已成功用于表征土壤成分和污染物23,量化 MP 16,24,25,26,以及评估 PBAT 和另一种聚合物聚苯乙烯的降解27,28。当在定量参数下运行时,1H-NMR 波谱产生的波谱中,每个波谱峰的面积与样品中贡献的氢的数量成正比;这允许定量样品29 中的组成成分。NMR 是一种有价值的分析技术,可用于定量土壤中的一些 MP,包括 PBAT,因为它可以同时定量和鉴定,适用于复杂和不纯的混合物,并且不需要化学上相同的参考标准品30,31。溶剂提取物的 NMR 波谱可以定量比可用于 μFTIR、μRaman 或 GCMS 定量的 MP 或 NP 小的 MP 或 NP。尽管有这些优势,但定量 NMR 方法的灵敏度仍然低于基于破坏性质谱的方法32。
所提出的方法如图 1 所示,描述了处理和分析含有 PBAT 的土壤样品(包括纳米级 PBAT 塑料)的工作流程。在该方法中,通过用氯仿和甲醇的混合物摇动土壤,从土壤样品中提取 PBAT 聚合物。将含有 PBAT 的溶剂提取物干燥,然后重新溶解在添加内部校准剂的氘代氯仿中。使用定量参数对提取物进行 NMR 波谱分析。通过比较对应于 PBAT 和校准分子的氢原子的拟合峰面积,分析所得谱图以定量 PBAT。该方法应用了 Nelson 等人33 演示的溶剂萃取和质子核磁共振波谱 (1H-NMR) 方法。目标是采用一种适合处理环境规模样品(~100 g 土壤)的方法,并在没有专业提取设备的情况下并行处理多个样品。
研究方案
1. 土壤的收集和准备
注:采样和处理设备不应包含聚合物 PBAT 或其成分,以避免样品污染。其他聚合物材料不一定会干扰土壤中 PBAT 的定量。例如,聚乙烯和聚丙烯在氯仿 1H-NMR 中不会产生干扰 PBAT34 定量的光谱峰,但聚对苯二甲酸乙二醇酯及其对苯二甲酸乙二醇酯很可能会干扰35,其他聚酯也是如此。Brandolini 和 Hills34 等参考文本可用于确定各种聚合物的 1H-NMR 波谱,并筛选与用于定量的 PBAT 峰重叠的峰(如下所述)。
- 每个样品至少收集 100 g 等效干重的土壤。根据预期的塑料浓度确定土壤样本量,以便收集具有代表性的样本,并在需要时将土壤均质化以收集子样本36。
注:土壤系统本质上是异质的37,土壤系统内的污染物分布(例如 MP)也是如此38。用于测量污染物浓度的方法也存在差异39。因此,建议创建包括重复样品的抽样设计或实验设计,作为估计不确定性和根据塑料浓度收集代表性样品量的工具40。据记载,土壤中的 MP 浓度范围从接近零到每公斤土壤 1 x 107 项,大多数地点每公斤土壤含有不到 10,000 项41。理论代表性基本体积的范围可以从 MP 浓度为每平方米 23 项时的 10 m2 到 MP 浓度为每平方米 0.02 项时的 10,000 m2 36。- 为了增加田间的有效采样面积,同时最大限度地减少必须处理的土壤量,从大面积(例如,1 m2)收集土壤,然后使用四分之一方法将样品均质化和固结(例如,至 500 g 土壤)36。
- 在四分之一法中,将大面积的土壤堆放在防水布或其他表面上,用铲子充分混合,然后分成四分之一。保留四分之一的样品,丢弃其余四分之三的样品。重复此过程,直到样品达到所需的大小。
- 通过 2 毫米网筛筛分土壤。彻底清洁土壤样品之间的筛子和收集盘。
- 风干土壤,然后储存在密封的样品袋中。在 PBAT 提取之前,干燥的土壤可以以这种状态储存。
2. 从土壤中提取 PBAT
注意:氯仿易挥发且有毒。将其存放在琥珀色玻璃中,避光,远离氧化剂。使用它时,请佩戴适当的手套、护目镜和防护服。只能在通风橱中处理。甲醇易燃、易挥发且有毒。将甲醇储存在防火柜中。使用甲醇时,应佩戴适当的手套、护目镜和防护服。只能在通风橱中处理甲醇。玻璃器皿可能会破裂并造成伤害。处理玻璃器皿时佩戴护目镜。避免徒手触摸碎玻璃。相反,请使用防割手套、钳子、扫帚或其他工具清理碎玻璃。
注意:氯仿与大多数塑料或金属不兼容。确保所有材料均兼容(例如,玻璃或聚四氟乙烯、PTFE 塑料)。
- 在通风橱中,制备 100 mL 90:10 v/v 氯仿(三氯甲烷;CHCl3) 和甲醇 (CH3OH) 的提取量。例如,要从 5 个样品中提取,将 450 mL 氯仿与 50 mL 甲醇混合。
- 将 100 g 干土、100 mL 氯仿-甲醇溶液和 20 个玻璃珠加入玻璃萃取罐中。用 PTFE 衬里的盖子密封萃取瓶,这样溶剂蒸气就不会从罐中流出。
注:PBAT 极易溶于氯仿;使用氯仿-甲醇混合物是因为甲醇可以与溶质形成氢键,与土壤矿物质和有机成分竞争,并增加土壤中 PBAT 的回收率33。 - 使用摇床以 200 rpm 的速度摇动提取罐 8 小时。摇动后,让提取罐中的土壤沉降至少 4 小时。
- 从土壤中分离提取物。在通风橱中,打开提取罐的盖子,通过移液管将液体通过孔径为 11 μm 的定性纸过滤器转移到标记的干净玻璃罐中。记录从萃取罐中回收的溶剂体积。避免用提取物转移土壤固体;如果需要,留下几 mL 溶剂。
注意:滤纸用于去除溶剂溶液中的大块有机物。 - 将提取物放在通风橱中干燥,直到溶剂完全蒸发。这可能需要长达 24 小时。也要干燥通风橱中的土壤。土壤完全干燥后,将其丢弃。
- 提取物干燥后,盖上每个样品瓶并将它们存放在阴凉、黑暗、干燥的地方,直到需要。
3. NMR 波谱的收集
注意:氘代氯仿带来与上述质子化氯仿相同的风险,需要采取相同的预防措施。
- 向样品中加入内部校准剂42 。使用天平称取 1.00 mg 1,4-二甲氧基苯(DMB;C6H14O) 放入每个装有干燥提取物的样品罐中。
- 将样品重悬于氘代氯仿(CDCl3;三氯(氘)甲烷)中。在通风橱中,使用微量移液器将 500 μL 氘代氯仿加入装有干燥样品提取物的罐子中。
- 盖上罐子盖子,用手或工作台轻轻敲击罐子,摇晃以溶解干燥的提取物,每侧约 10 次。然后使用干净的移液器吸头将液体转移到 NMR 管中。
- 重复步骤 3.2 和 3.3,再加入 500 μL 氘代氯仿,将样品的第二部分添加到与第一部分相同的 NMR 管中。第二次冲洗旨在确保从容器中完全溶解和回收干燥的提取物。
- 在收集 NMR 波谱之前,盖上 NMR 管并储存 3 天。适当的储存时间将取决于 NMR 管中溶剂的蒸发速率。用氘代氯仿制备样品后不久分析样品。
- 要将 NMR 管运输到波谱仪,请使用设计用于支撑长而精致的管子的支架。这些通常在管的底部和顶部附近有支撑。在运输过程中,将试管保持在直立位置。
- 使用 500 MHz NMR 波谱仪,收集 1H 质子谱,脉冲角为90°,脉冲宽度为 8 μs33,延迟时间为 25 s(由反转恢复实验确定29,43),每次扫描 262K 点,以及 32 次复合扫描29,44,从 12 到 -2 ppm,总运行时间为 25 分钟。
注意:我们使用了 Bruker Neo 500 MHz 波谱仪,该波谱仪带有宽带优化探头和自动进样器,温度控制在 300 K。可以使用其他类似的光谱仪。如果使用具有不同磁场强度的仪器,则可以使用反转恢复实验29,43 根据 PBAT 和 1,4-二甲氧基苯的 T1 弛豫时间计算适当的延迟时间。 - 运行样品后,根据需要保存、传输或访问光谱数据。
检查光谱数据。检查定量中使用的所有 PBAT 峰(如果存在)均已清晰分离。使用 PBAT 峰 5 (8.10 ppm)、6 (4.44 ppm)、6' (4.38 ppm)、3' (4.15 ppm) 和 3 (4.09 ppm) 进行定量(详见 表 1)。DMB 峰 A (6.84 ppm) 和 B (3.77 ppm) 也可用于定量(详见 表 2)。请特别注意 PBAT 的 6、6'、3' 和 3 个峰,它们看起来彼此非常接近,并且可能会重叠。 - 如果某些峰无法明确分离,请稀释样品。将 100 μL 样品和 500 μL 氘代氯仿混合在干净的 NMR 管中,并在步骤 3.7 中定义的相同参数下重新运行样品。
4. 分析 NMR 波谱以量化 PBAT
注:光谱分析可在采集后的任何时间进行。最好在生成光谱的同一天分析数据,以确保样品在出现任何问题时仍可重新运行。
- 在 NMR FID 处理软件中打开波谱仪创建的 FID 文件(我们使用了 MestreLab 的 MestreNova,其他选项,但其他选项可用)。
- 对光谱应用线展宽:在 FID 处理软件中,在 Processing 菜单中选择 Processing Template ,然后导航到 Aspectization 部分。选择幅度为 0.5 Hz、第一个点为 0.5 Hz 的指数模型。
- 通过单击 Processing 菜单中的 Auto Phase Correction 按钮来应用自动相位校正。通过单击“处理”菜单中的 “自动基线校正 ”按钮来应用自动基线校正。
- 使用峰反卷积拟合测得的光谱峰:在光谱处理软件的 Analysis 选项卡的 Fitting 部分中,单击 New Fit 按钮。使用光标以 8.5 ppm 的偏移单击光谱,然后将光标拖动到 3.0 的偏移并释放。
- 点击 Fitting 部分下的 Line Fitting Table 查看所有拟合峰。
- 保留用于定量的峰,如 表 1 和 表 2 中所述,并在 图 2 中标记。使用 PBAT 峰 5 (8.10 ppm)、6 (4.44 ppm)、6' (4.38 ppm)、3' (4.15 ppm) 和 3 (4.09 ppm) 进行定量(详见 表 1),以及 DMB 峰 A (6.84 ppm) 和 B (3.77 ppm)。对应于 表 1 和 表 2 中列出的每个峰的氢原子在 图 3 的结构图中标记, 图 3A 显示了两个 PBAT 二聚体的结构, 图 3B 显示了二聚体在聚合物中的位置如何相互作用以改变 1,4-丁二醇单体氢中的峰偏移, 图 3C 显示了 DMB 的结构。
- 通过选择不需要的峰并单击 Delete Peak 从拟合中删除所有其他峰。
- 使用“拟合表”将每个峰的面积复制到电子表格应用程序中进行计算(我们选择使用电子表格)。
- 要将峰面积复制到电子表格中,请首先在“线拟合表”中选择所有峰信息。然后右键单击并从弹出菜单中选择 Copy 。将数据粘贴到电子表格中。
- 使用方程计算添加到样品中的 DMB 摩尔数 nDMB

其中 mDMB 是添加到样品中的 DMB 质量,单位为克(建议 1.00 mg), MMDMB 是 DMB 的摩尔质量 (138.17 g/mol)。 - 使用方程计算样品中 PBAT 的对苯二甲酸丁二醇酯二聚体的摩尔数 nBT

其中 A5 是 PBAT 峰 5 的实测面积, AA 是 DMB 峰 A 的实测面积, AB 是 DMB 峰 B 的实测面积。光谱分析软件生成的面积单位是任意的。 - 使用方程计算样品中 PBAT 的己二酸丁二酯二聚体的摩尔数 nBA

其中 A3 是 PBAT 峰 3 的实测面积, A3' 是 PBAT 峰 3' 的实测面积, A6 是 PBAT 峰 6' 的实测面积, A6' 是 PBAT 峰 6' 的实测面积。光谱分析软件生成的面积单位是任意的。 - 使用以下方程计算样品中 PBAT 的质量, mPBAT,回收率

其中, MMBA 是来自 PBAT 的 BA 二聚体的摩尔质量 (200 g/mol), MMBT 是来自 PBAT 的 BT 二聚体的摩尔质量 (220 g/mol)。 - 如果样品中存在已知量的 PBAT,则可以根据方程计算样品的回收率百分比 η,作为提取效率的量度

- 使用以下公式计算样品中 PBAT 的浓度 CPBAT

其中 m干土 是用于生产提取物的干土质量 (0.1 kg),回收的 V溶剂 是在步骤 2.4 中从土壤中回收的溶剂体积,添加的 Vsovlent 是添加到土壤样品中的溶剂的初始量 (100 mL)。
5. 制备校准曲线,用于定量特定土壤的 PBAT
注意:根据添加已知量 PBAT 的土壤样品创建的校准曲线将提供有关如何从特定土壤中提取和回收 PBAT 的有用信息。所有土壤或所有形式的 PBAT 的提取都不相同。我们怀疑提取效率取决于土壤粘土和有机质含量33,并建议为每个感兴趣的土壤系列和层级创建校准曲线。可以在使用此方法处理未知样品之前或之后创建校准曲线。
- 收集并准备相当于 2.5 公斤的干土,如步骤 1.1-1.3 所述。
- 确定校准曲线要覆盖的范围;校准曲线中使用的 PBAT 最大浓度应高于未知样品中的最高 PBAT 浓度。
- 准备或获得足够的 PBAT 塑料,以制备 5 个 100 克土壤的加标样品,最大浓度为 0%、25%、50%、75% 和 100%(总共 25 个样品)。例如,如果所需的最大浓度为 40 mg/kg,则总共需要 50 mg PBAT 来制备加标样品。
- 准备 25 个样品,每个样品 100 克土壤。通过称量基于 PBAT 的塑料并以规定的速率将其添加到土壤样品中来加标样品。例如,如果所需的最大浓度为 40 mg/kg PBAT,则创建 5 个不含 PBAT 的样品、5 个含 1 mg PBAT 的样品、5 个含 2 mg PBAT 的样品、5 个含 3 mg PBAT 的样品和 5 个含 4 mg PBAT 的样品。将 PBAT 加入土壤后,搅拌均匀。
- 从 25 个加标样品中提取 PBAT,然后从提取物中收集 NMR 波谱,并按照步骤 2.1 至 4.16 中的说明分析所得波谱。
- 通过在每个加标样品中测量的 PBAT 量与统计分析工具中实际添加的 PBAT 量之间执行线性回归,确定该土壤中 PBAT 校准曲线的方程式。我们使用了电子表格。如果在未添加 PBAT 的加标样品中未检测到 PBAT,则在回归中强制 b = 0。
注:线性回归检验根据关系式 y = mx + b 评估两个连续数值变量 x 和 y 之间线性关系的强度。测试将计算最适合数据的 m 和 b 的值。回归检验的 r2 系数描述两个变量之间的相关性。 - 使用统计分析工具测试提取效率和 PBAT 浓度之间的显著关系。从加标样品中计算 PBAT 的提取效率为

- 使用统计分析工具计算观察到的数据随机出现的概率,而萃取效率和 PBAT 浓度之间没有相关性。如果此 p 值大于预先确定的显著性阈值 α,则它无法否定两个变量之间没有关系的原假设。如果是这种情况,则可以假设测试范围内所有浓度的 PBAT 的萃取效率都是恒定的。如果 null 假设被拒绝,则此处描述的线性模型可能不是对数据进行建模的最佳方式。
- 使用校准曲线线性回归方程估计使用该方法处理的未知样品中的 PBAT 含量。如果回归 x 变量是校准曲线加标样品中 PBAT 的实际量,则 y 变量是 PBAT 的实测量,并且 b 设置为 0,则

注:使用校准曲线方程估计的重复样品的 PBAT 含量可用于生成特定土壤中 PBAT 含量的置信区间,或者如果可以计算重复提取物中 PBAT 浓度的平均值和置信区间,则可以应用校准曲线来估计土壤中的 PBAT 浓度。任一作顺序都会为土壤中的 PBAT 含量生成相同的置信区间。例如,考虑 10 个重复样品的提取物,这些样品的 PBAT 浓度为 10、5、2、4、10、11、2、6、8 和 5 mg/kg,校准曲线方程 y(在提取物中测量的 PBAT) =0.75 x (土壤中的真实 PBAT)。每个重复中的土壤 PBAT 浓度可以估计为 13、7、3、5、13、15、3、8、11 和 7 mg/kg。然后土壤中的平均 PBAT 浓度估计为 8.4 mg/kg,标准差为 4.4 mg/kg。如果首先计算提取物 PBAT 浓度(10、5、2、4、10、11、2、6、8 和 5)的平均值和标准差,则计算出平均值为 6.3 mg/kg,标准差为 3.3 mg/kg。然后,校准曲线可以应用于平均值和标准差,以估计土壤中的 PBAT 浓度:平均值为 8.4 mg/kg,标准差为 4.4 mg/kg。
结果
为了评估该方法在定量土壤中 PBAT 聚合物的有效性,通过从三种不同土壤产生的加标样品中提取 PBAT 来构建校准曲线。对于三种土壤中的每一种(详见 表 3),土壤通过 2 毫米的筛子,然后风干。向 100 g 干土壤中加入 0 mg、9 mg、18 mg、27 mg 或 36 mg 基于 PBAT 的 MP(每种重复 5 次),制备加标样品。这相当于 0、63、126、189 或 252 mg/kg 的 PBAT 聚合物。根据 Astner 等人45 中描述的研磨程序,MP 由质量为 70% PBAT 和 50 μm 厚度的塑料覆盖物制成,小于 840 μm。为了创建每条校准曲线,按照上述程序从每个加标样品中提取 PBAT。然后将 PBAT 的回收率与添加到每个样品中的 PBAT 量进行比较。还测试了一种土壤(阴壤土)中 NPs(平均直径 780 nm,多分散指数 0.77,根据 Astner 等人 45 制备)的 PBAT 回收率和定量。
对于所有土壤,在未添加 PBAT 的样品中均未检测到 PBAT,即该方法未观察到假阳性。 补充图 1 显示了从不含 PBAT(并且确实含有在制备过程中添加的 DMB)的阴凉壤土中收集的光谱。内部校准液 DMB 的两个特征峰存在,但 PBAT 特征峰不存在。对于添加了 PBAT 的土壤,存在用于识别 PBAT 的 5 个特征峰。 图 2 显示了从添加 63 mg/kg PBAT 的阴壤土中收集的光谱。定量中使用的所有 PBAT 和 DMB 峰均得到清晰分离。 补充图 2 显示了 图 2 中所示的光谱拟合区域,其中叠加了积分峰。由于 3、3'、6' 和 6' 峰与光谱中的其他信号重叠,因此根据拟合峰的积分而不是简单的峰积分来计算 PBAT 含量非常重要。这将去除土壤提取物的其他成分和重叠的 PBAT 峰贡献的面积。 补充图 3 显示了稀释对 NMR 波谱分辨率的影响。该图显示了从添加 252 mg/kg PBAT 的 Elkhorn 砂壤土中收集的光谱。在图 A 中,无法分辨 4.5 - 4.0 ppm 范围内的 3、3'、6' 和 6' PBAT 峰。 补充图 3B 显示了用额外的氘代氯仿以 1:5 稀释后从同一样品中收集的光谱。稀释后,四个峰是不同的,它们的面积是拟合的。
我们测试的三种土壤之间的校准曲线各不相同。 图 4 显示了根据每种提取物中测量的PBAT (C PBAT,m) 与添加到土壤中的 PBAT (CPBAT,a) 的实际含量进行比较,估计每种土壤的 PBAT 浓度。从阴壤土中回收的 PBAT 量与 PBAT 添加量密切相关 (r2 = 0.99)。对于校准曲线方程 CPBAT,m = m*CPBAT,a,m = 0.76 ± 0.02(平均值±一个标准误差),并且 m 与零显著不同(df = 24;F = 2000;p < 1*10-16)。从该土壤中以 η = 76 % ± 10 % 的效率(平均值±一个标准差)回收 PBAT。阴凉土壤的提取效率与样品中 PBAT 的含量无关 (r2 = 0.009;p = 0.7)。NP 的回收效率为 η = 59 % ± 8 %(平均值±一个标准差)。 图 5 显示了 Shady 壤土中 MP 和 NPs 的提取效率;NP 的效率显着降低 (p = 0.0002)。与阴凉土壤相比,从 Los Osos 壤土中回收的 PBAT 量与 PBAT 添加量 (r2 = 0.85) 的相关性较低。对于校准曲线方程 CPBAT,m = m*CPBAT,a,m = 0.57 ± 0.05(平均值±一个标准误差),并且 m 与零显著不同(df = 23;F = 100;p = 8*10-11)。PBAT 以 η = 57 % ± 22 % 的效率(平均值±一个标准差)从该土壤中回收。Los Osos 土壤中的提取效率与样品中 PBAT 的含量无关 (r2 = 0.01;p = 0.6)。从 Elkhorn 沙壤土中回收的 PBAT 量与添加的 PBAT 量密切相关 (r2 = 0.88)。对于校准曲线方程 CPBAT,m = m*CPBAT,a,m = 0.70 ± 0.05(平均值±一个标准误差),并且 m 与零显著不同(df = 23;F = 200;p = 5*10-12)。PBAT 以 η = 70 % ± 14 % 的效率(平均值±一个标准差)从该土壤中回收。对于 Elkhorn 土壤,提取效率与样品中 PBAT 的含量无关 (r2 = 0.006;p = 0.7)。
此外,该方法还用于量化 Elkhorn 级数土壤中的 PBAT。在这个实验中,从农田内的两个地点收集了 Elkhorn 土壤,通过 2 毫米的筛子筛分,然后风干。将土壤与基于 PBAT 的覆盖物 MP(如上所述创建,直径< 840 μm)混合,每个中层中含有 50 毫克 MP 和 150 克干土(250 毫克/千克 PBAT),形成 5 个中层,其中 MPS 混合到来自地点 A 的土壤中,5 个中层与 MP 混合到来自地点 B 的土壤中(共 10 个)。由来自每个地点的土壤组成的 5 个中间宇宙,没有添加 MP 作为阴性对照(总共 10 个)。中球菌孵育 6 个月,以研究基于 PBAT 的覆盖物 MPs 的生物降解。在孵育过程中,通过顶空 CO2 浓度(使用红外气体分析仪)测量累积土壤呼吸,并用于量化 PBAT 降解。在孵育结束时,中层中残留的塑料量计算为
C塑料压裂,最终 = [m塑料,i /C压裂塑料 - (CCO2,添加塑料 - CCO2 无塑料)*m干土]/(m塑料,i/ C压裂塑料)
其中 m干土 是每个培养罐中的土壤量,C压裂塑料 是添加的微塑料的碳含量,CCO2,添加的塑料 是每克干土壤中添加塑料的中宇宙中产生的 CO2 的累积量,CCO2 无塑料 是在每克干土壤中不添加塑料的中宇宙中产生的 CO2 量, 和 mplastic,i 是添加的塑料的初始质量。
我们使用自举来估计土壤 A 和 B 中残留塑料的置信区间,方法是使用来自每个地点的 10 个实验中层的 10,000 个随机配对的理论子样本来计算剩余塑料。在站点 A,呼吸数据中剩余的估计平均塑料为 86%,自举 95% 置信区间范围为 62 至 >100%。在站点 B,估计的平均剩余塑料为 98%,95% 置信区间范围为 79 至 >100%。在 6 个月结束时,还通过本手稿中描述的提取和 NMR 定量方法测量 PBAT 含量(位点 A 为 n = 5,位点 B 为 n = 4)。在站点 A,NMR 数据估计的平均剩余塑料为 79%,95% 置信区间(平均值± 1.96xSE)在 71% 到 87% 之间。在站点 B,估计的平均剩余塑料为 88%,95% 置信区间范围为 71% 至 100%。 图 6 显示了通过两种不同方法估计的两个地点土壤塑性含量的置信区间。根据每对置信区间之间的大部分重叠,这两种方法的塑料含量估计值似乎是相互一致的。

图 1:聚己二酸对苯二酸丁二醇酯 (PBAT) 提取和定量程序的直观概述。请点击此处查看此图的较大版本。
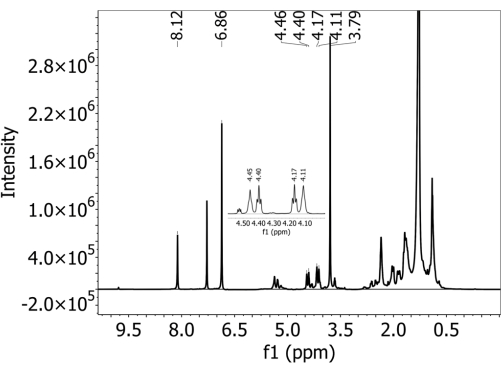
图 2:使用 500 MHz 波谱仪在氘代氯仿溶剂中收集的 1个 H-NMR 波谱,用于使用聚己二酸对苯二醇丁二醇酯 (PBAT) MP 的阴暗壤土提取物。 在 NMR 分析之前,将 1,4-二甲氧基苯 (DMB) 作为内部校准剂添加到提取物中。谱图中同时存在 PBAT 和 DMB 特征峰。 请单击此处查看此图的较大版本。

图 3:己二酸对苯二甲酸丁二醇酯 (PBAT) 和 1,4-二甲氧基苯 (DMB) 与标记质子的结构。 相应的结构如 表 1 和 表 2 所示。 (A) PBAT 的一个 BA-BT 单元的结构。(B) PBAT 的 T-B-T、T-B-A 和 A-B-A 三元组的结构。(C) DMB 的结构。 请单击此处查看此图的较大版本。

图 4:在含有已知量 PBAT 的阴凉壤土、Los Osos 壤土和 Elkhorn 沙壤土的氘代氯仿溶剂提取物中用 1H-QNMR 测量的 PBAT 浓度。请单击此处查看此图的较大版本。

图 5:阴壤土中加标样品中 PBAT MP 和 NP 的提取效率。 NP 的 PBAT 回收率显着降低 (p = 0.0002)。每个框的中线代表测量数据点的平均值,而框的上限和下限分别反映 Q3 和 Q1。须线的上限和下限分别反映最大和最小数据点。各个数据点显示在框和须线中。 请单击此处查看此图的较大版本。

图 6:通过累积孵育呼吸和溶剂萃取与 NMR 耦合来测量两种 Elkhorn 土壤的塑料含量。 对于通过呼吸测量的塑料含量,条形表示自举的 95% 置信区间。对于通过 NMR 测量的塑料含量,条形表示 95% 置信区间,该置信区间基于高于和低于平均估计值的标准误差的两倍(位点 a 为 n = 5,位点 b 为 n = 4)。 请单击此处查看此图的较大版本。
| 峰 ID | 位置 | 质子数 | 多样性 | 单体 | 用于定量 |
| 5 | 8.1 | 4 | 汗衫 | T | 是的 |
| 6 | 4.44 | 2 | 三重 | B | 是的 |
| 6’ | 4.38 | 2 | 三重 | B | 是的 |
| 3’ | 4.15 | 2 | 三重 | B | 是的 |
| 3 | 4.09 | 2 | 三重 | B | 是的 |
| 1 | 2.34 | 4 | 三重 | 一个 | 不 |
| 7 | 1.97 | 2 | 多重 | B | 不 |
| 7’ | 1.87 | 2 | 多重 | B | 不 |
| 4’ | 1.81 | 2 | 多重 | B | 不 |
| 4 | 1.68 | 2 | 多重 | B | 不 |
| 2 | 1.66 | 4 | 多重 | 一个 | 不 |
表 1: 聚己二酸对苯二甲酸丁二醇酯 (PBAT) 在氘代氯仿溶剂中的 1 个 H-NMR 谱峰。 归因于每个峰的氢如图 3 所示。峰分配基于 Herrera 等人27。
| 峰 ID | 位置 | 质子数 | 多样性 | 用于定量 |
| 一个 | 6.84 | 4 | 汗衫 | 是的 |
| B | 3.77 | 6 | 汗衫 | 是的 |
表 2:1,4-二甲氧基苯 (DMB) 在氘代氯仿溶剂中的 1个 H-NMR 峰。 归因于每个峰的氢如图 3B 所示。峰分配基于 Nelson 等人33。
| 土系列 | 分类 | 质地 | 总有机碳 | 酸碱度 | 取件地点 | 采集深度 (cm) |
| 阴暗 | 细肥沃、混合、亚活性、热 Typic Hapludult | 壤土 | 1.70% | 6 | 美国田纳西州诺克斯维尔 | 0-5 |
| 洛斯奥索斯 | 细、蒙脱、热 Typic Argixeroll | 壤土 | 3.00% | 6 | 美国加利福尼亚州圣路易斯奥比斯波 | 0-5 |
| 麋鹿角 | 细肥沃、混合、超活性、热 Pachic Argixeroll | 沙壤土 | 1% | 7 | 美国加利福尼亚州沃森维尔 | 0-5 |
表 3:用于演示 PBAT 提取方法的三种土壤的特性。
补充图 1:使用 500 MHz 波谱仪在氘代氯仿溶剂中对不存在 PBAT 聚合物的阴壤土提取物收集的 1个 H-NMR 波谱。 不存在 PBAT 特征峰,而 DMB(作为内部校准物添加)峰存在。 请点击此处下载此文件。
补充图 2: 1H-NMR 谱图的拟合区域,如图 4 所示。 在氘代氯仿溶剂中收集光谱。 绿色背景显示拟合的光谱区域。紫色线表示拟合峰,红线表示误差(拟合峰中未包含部分谱图信号)。拟合包括 PBAT 峰 5、6、6'、3' 和 3 以及 DMB 峰 A 和 B。 请单击此处下载此文件。
补充图 3:用 500 MHz 波谱仪在添加了 PBAT MPs 的 Elkhorn 砂壤土提取物上采集的氘代氯仿溶剂中的 1个 H-NMR 波谱。 谱图中同时存在 PBAT 和 DMB 特征峰。(A) 无法区分 PBAT 峰来定量聚合物。如果样品提取物产生这样的波谱,请稀释样品,然后用它来收集新的 1H-NMR 波谱。(B) 稀释相同的提取物,以便清楚地分离所有光谱峰。 请点击此处下载此文件。
讨论
我们提出了一种从土壤中溶剂提取 PBAT 的方法,结合 1H-NMR 来量化提取物中的 PBAT。提取过程的关键要素包括提取技术和设备、用于提取的溶剂以及时间要求。与 Nelson 等人33 演示的索氏萃取和加速溶剂萃取 (ASE) 相比,我们选择使用一种提取技术,该技术需要相对简单且廉价的设备(玻璃罐、玻璃珠和摇床)。该方法的目标是可以并行提取许多样品,以加快散装土壤样品的处理速度。简单的溶剂振荡萃取的另一个优点是,与索氏萃取或 ASE 方法相比,可以容纳更大量的土壤,从而更容易处理具有环境代表性的样品13,36。我们根据 Nelson 等人33 提出的成功结果以及氘代氯仿作为 1H-NMR 溶剂的可用性选择了氯仿-甲醇溶剂。与简单的溶剂振荡方法相比,我们测试了符合 Nelson 等人 33 中描述的方案的溶剂-基质混合物的超声处理,发现两种方法之间的 PBAT 回收率没有显着差异。我们发现,对于我们测试的三种土壤,以 200 rpm 的转速振荡 8 小时足以打破 100 g 土壤基质中的土壤团聚体,而较短的振荡时间或较低的振荡速度是不够的。然后需要沉降以回收不含污垢颗粒的溶剂。用纳米级塑料测试了 PBAT 回收率,回收率明显低于 MP。这意味着该方法可能需要进一步开发才能准确定量未知 NP 的环境样品,但与其他尺寸受限的方法相比,NP 的部分回收和测量仍然很有价值,即使该方法无法获得粒度信息。
虽然 Nelson 等人33 报告了超声萃取法的萃取效率接近 100%,但我们发现超声法和此处描述的基于摇床的萃取方法都导致萃取效率显著低于 100%。我们认为这可能是由于环境风化的影响,包括光氧化对塑料覆盖物的影响。Nelson 等人33 观察到,与非风化材料相比,紫外线照射的 PBAT MP 的提取效率显著降低。我们用于测试这种定量方法的塑料在阳光下经过田间风化一整季,然后被加工成 MP。尽管商业塑料地膜中添加了光稳定剂,但在环境风化条件下,地膜聚合物的结构会因紫外线辐射而发生变化(例如,增加材料的凝胶含量的链交联)46,聚合物的降解会改变其 NMR 光谱47。与 Nelson 等人相比,这可能是我们观察到的 PBAT 回收率较低的原因33。我们还发现,我们测试的三种土壤之间的 PBAT 提取效率各不相同。阴凉土壤主要含有低活性粘土,而其他两种土壤则含有蒙脱石 (Los Osos) 和混合的超活性 (Elkhorn) 粘土。高活性和 2:1 粘土矿物的存在可能抑制了从这些土壤中溶剂提取 PBAT33,48,导致我们观察到的 PBAT 回收率较低。我们建议进一步研究,调查土壤中可生物降解的 MP 和 NPs(包括 PBAT)以及传统的不可降解聚合物 MP 和 NPs的塑料-矿物关联。这对于了解如何从土壤中提取和测量 MP 聚合物以及了解它们如何生物降解或以其他方式影响土壤系统都非常重要。
NMR 波谱采集过程的关键要素包括仪器磁体强度、使用的扫描次数、扫描之间的样品弛豫时间以及每个样品的总测量时间。我们使用了 500 MHz 的光谱仪;更高的磁场强度可在 NMR 波谱中提供更高的灵敏度和分辨率。通过收集同一样品的重复扫描并将它们相加,可以提高光谱信噪比。收集 n 次扫描将使信噪比增加 √n 倍,但将增加测量时间 n29 倍。这意味着,如果需要更高的信噪比来量化样品中的 PBAT,则可以增加扫描次数,但代价是样品运行时间更长。特定信号的信噪比需要为 150 才能在定量44 中保持误差 <1%。根据我们的采集参数(仪器、探针、扫描次数),每个样品大约需要 5 mg PBAT(或每 mL 提取物 50 μg PBAT)才能获得 150 的信噪比,因此定量误差为 <1%;这种集中度特定于我们的数据收集设置。该 PBAT 浓度高于其他人在没有土壤的情况下使用 1H-NMR 定量其他类型的 MP 所达到的定量限值 16,24,证明了土壤有机质和其他共提取化合物对定量方法的影响。由于 PBAT 浓度大于 25 mg/样品(每毫升提取物 250 μg PBAT)时出现谱线展宽,因此 PBAT 的可定量范围也受到限制,这导致 PBAT 峰重叠,如代表性结果所示,如补充图 3 所示。然而,这种方法可以灵活地应对这些限制,以确保样品是可量化的。可以增加或减少用于制造提取物的土壤量,并且可以稀释和重新分析提取物,以将 PBAT 浓度调整到最佳范围内。
根据 NMR 波谱定量 PBAT 的过程的关键要素包括用于定量 PBAT 的峰、使用线拟合计算峰面积以及校准曲线。从概念上讲,可以比较任何一对 PBAT 和 DMB 峰,以计算样品中两种化合物的比率。当我们将 BT:DMB 比值计算为 5:A 峰面积和 5:B 峰面积(按各自的质子数归一化)的平均值时,我们发现了最准确的结果。PBAT 峰 5 仅提供 1,4-丁二醇对苯二醇酯 (BT) 单体的定量,因此将 3 和 3' 峰(代表 1,4-己二醇-己二酸丁二醇酯或 BA 单体)的峰面积与 6 和 6' 峰的面积(代表 BT 单体)进行比较,以定量样品中存在的 BA 基团。将 BT 和 BA 的数量相加,以表示剩余的 PBAT 总量。由于共提取化合物(假设为土壤有机质)的干扰,无法在 BA 定量中使用 PBAT 峰 1 或 2,从而在 2.7-0.7 ppm 范围内产生多个宽峰。我们探索了使用背景校正(即从每个样品光谱中减去一个空白光谱)从光谱中去除这些不需要的信号,但我们发现在不使用校准剂的情况下创建等效的可比背景和样品光谱是不可靠的。使用线拟合计算拟合峰的面积,而不是直接对谱峰进行积分。由于 PBAT 3 和 3' 峰之间以及 6 和 6' 峰之间存在重叠,因此根据初步分析,这提供了更准确的 PBAT 含量估计值。我们建议创建校准曲线,以说明不同土壤中 PBAT 的不同回收率。在我们测试的三种土壤中,一对土壤的 PBAT 回收率存在显著差异,如校准曲线斜率的非重叠 95% 置信区间所示。第三种土壤中的 PBAT 回收率与其他两种土壤中的任何一种都没有显着差异。在缺乏对土壤成分如何影响 PBAT 采收率的机械理解的情况下,我们建议创建校准曲线来评估每个感兴趣土壤系列和土壤剖面内每个层位的 PBAT 采收率。如果发现土壤之间的校准曲线在统计上相似,则可以轻松地对土壤进行组合分析。
我们相信这种方法可以为那些对量化土壤中 PBAT MP 和 NP 感兴趣的人提供有价值的工具,特别是用于量化在类似土壤中收集的大量样品中的 PBAT,例如,在长期的塑料生物降解现场研究中。一种从土壤中量化 MP 的 NMR 方法很有价值,因为它使具有 NMR 和专业知识的研究人员能够通过回答有关土壤系统中 MP 的存在和行为的重要问题,为满足新兴领域的需求做出贡献。虽然获得仪器和专业知识可能是限制研究人员选择定量技术的第一个实际问题,但 NMR 并不是在所有条件下量化土壤中塑料微粒的最有效或最合适的工具。颗粒形状和大小信息无法通过溶剂萃取技术获得;如果 MP 形状和大小感兴趣,研究人员可以更好地使用一种技术来识别单个 MP 颗粒,例如 FTIR 或拉曼光谱。与其他 MP 定量方法(如 FTIR 或拉曼光谱)相比,本文和 Nelson 等人33 中介绍的溶剂萃取方法的一个优点是,从概念上讲,可以量化的 MP 和 NP 没有大小限制;当不需要粒度信息或目标颗粒难以通过其他方式分离时,溶剂萃取可能最有益。热解 GCMS 可能很有价值,因为它比 NMR 具有更高的灵敏度,但结果也会像 PBAT 溶剂萃取一样受到基质效应的影响。
我们希望进一步的工作将通过解决干扰 NMR 波谱中 PBAT 峰分辨率的共提取土壤成分来提高该方法的稳健性。还需要进一步的工作来通过这种方法确定 PBAT 塑料老化与提取效率之间的关系,也许还可以更详细地了解 PBAT 降解产物及其 1H-NMR 波谱。根据我们和 Nelson 等人 33 的结果,该定量程序最适合量化有机质含量低且不含高活性粘土的土壤中未风化的 PBAT 塑料。虽然我们仅使用这种方法来定量土壤中基于 PBAT 的 MP,但溶剂萃取和 1H-NMR 定量程序可能有助于定量其他土壤中的其他 MP 和 NP26,49。将该方法扩展到由另一种聚合物制成的 MP 需要确保聚合物在溶剂中的溶解度,并识别聚合物在所选溶剂中的特征 NMR 峰。可能需要选择一种新的内校准液,该内校准液可溶于所选溶剂,并且不会产生与目标聚合物重叠的峰42。
披露声明
作者声明,他们没有已知的竞争性经济利益或个人关系,这些利益或个人关系似乎可能会影响本文报告的工作。
致谢
感谢 USDA-NIFA 通过授予 SMS 的奖励号 2020-67019-31167 资助该项目,并感谢田纳西大学战略规划研究计划 (SPRINT) 计划的内部赠款 DGH 和 SMS。资助者在研究设计、数据收集、分析、解释、报告撰写或提交文章发表的决定中没有作用。
材料
| Name | Company | Catalog Number | Comments |
| 1,4-dimethoxybenzene | Arcos Organics 99%+ | AC115411000 | 1 mg per sample |
| Amber glass bottle with PTFE lined lid (1 L) | Kimble | 5223253C-26 | reusable |
| Chloroform; trichloromethane | Fisher Chemical | AA43685M6 | 90 mL per sample; Fisher Optima |
| Deuterated chlorform; trichloro(deuterio)methane | Sigma Aldrich | 1034200025 | 1 mL per sample; minimum 99.8% deuterated; stabilized with silver |
| Glass beads (3 mm diameter) | Propper Manufacturing | 3000600 | 20 per sample |
| Glass extraction jars with PTFE lined lid (~250 mL volume) | Kimble | 5510858B | 2 per sample, reusable |
| Graduated cylinder, 1 L, polypropylene | Nalgene | 3662-1000 | reusable |
| Graduated cylinder, 500 mL, polypropylene | Nalgene | 3662-0500 | reusable |
| Methanol | Fisher Chemical | A412-4 | 20 mL per sample; certified ACS |
| Micropipette wth range of 0.5 - 1 mL | Fisher Scientific | 3123000063 | reusable |
| NMR spectrometer | Bruker | n/a | 500 MHz instrument |
| NMR tube (7 inch height, high-throughput) | Wilmad | WG-1000-7 | 1 per sample |
| Platform shaker | Eppendorf, Excella E5 | M1355-0000 | reusable |
| Polyethylene pipette tip (10 mL volume) | Eppendorf | 22492098 | 1 per sample, single use |
| Polypropylene micropipette tips (1 mL volume) | Fisher Scientific | 02-707-510 | 3 per sample, single use |
| Semi-microbalance | Mettler Toledo | 30532226 | reusable |
参考文献
- Andrady, A. L. The plastic in microplastics: A review. Mar Pollut Bull. 119 (1), 12-22 (2017).
- Fakour, H., et al. Quantification and analysis of microplastics in farmland soils: Characterization, sources, and pathways. Agriculture. 11 (4), 330(2021).
- Wang, K., et al. Impact of long-term conventional and biodegradable film mulching on microplastic abundance, soil structure and organic carbon in a cotton field. Environ Pollut. 356, 124367(2024).
- Plastics Europe Plastics - the Facts. , Plastics Europe. Available from: https://plasticseurope.org/knowledge-hub/plastics-the-facts-2022/ (2022).
- Assessment of agricultural plastics and their sustainability: A call for action. , Food Agriculture Organization. Rome. (2021).
- Beriot, N., et al. Intensive vegetable production under plastic mulch: A field study on soil plastic and pesticide residues and their effects on the soil microbiome. Sci Total Environ. 900, 165179(2023).
- Liu, E. K., He, W. Q., Yan, C. R. White revolution to white pollution - Agricultural plastic film mulch in China. Environ Res Lett. 9 (9), 091001(2014).
- Sintim, H. Y., et al. Release of micro- and nanoparticles from biodegradable plastic during in situ composting. Sci Total Environ. 675, 686-693 (2019).
- Skoczinski, P., et al. Bio-based building blocks and polymers - Global capacities, production and trends 2023-2028. Indust Biotech. 20 (2), 52-59 (2024).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Li, C., et al. Effects of biodegradable mulch on soil quality. Appl Soil Ecol. 79, 59-69 (2014).
- Wang, F., Wang, Q., Adams, C. A., Sun, Y., Zhang, S. Effects of microplastics on soil properties: Current knowledge and future perspectives. J Hazardous Mater. 424, 127531(2021).
- Möller, J. N., Löder, M. G. J., Laforsch, C. Finding microplastics in soils: A review of analytical methods. Environ Sci Technol. 54 (4), 2078-2090 (2020).
- Paul, A., Wander, L., Becker, R., Goedecke, C., Braun, U. High-throughput NIR spectroscopic (NIRS) detection of microplastics in soil. Environ Sci Pollut Res. 26 (8), 7364-7374 (2019).
- Wortman, S. E., Jeske, E., Samuelson, M. B., Drijber, R. A new method for detecting micro-fragments of biodegradable mulch films containing poly(butylene adipate-co-terephthalate) (PBAT) in soil. J Environ Quality. 51 (1), 123-128 (2021).
- Peez, N., et al. Quantitative analysis of PET microplastics in environmental model samples using quantitative 1H-NMR spectroscopy: Validation of an optimized and consistent sample clean-up method. Anal Bioanal Chem. 411 (28), 7409-7418 (2019).
- Praveena, S. M., Aris, A. Z., Singh, V. Quality assessment for methodological aspects of microplastics analysis in soil. Trend Environ Anal Chem. 34, e00159(2022).
- Primpke, S., et al. Critical assessment of analytical methods for the harmonized and cost-efficient analysis of microplastics. Appl Spectro. 74 (9), 1012-1047 (2020).
- Käppler, A., et al. Analysis of environmental microplastics by vibrational microspectroscopy: FTIR, Raman or both. Anal Bioanal Chem. 408 (29), 8377-8391 (2016).
- Watteau, F., Dignac, M. F., Bouchard, A., Revallier, A., Houot, S. Microplastic detection in soil amended with municipal solid waste composts as revealed by transmission electronic microscopy and pyrolysis/GC/MS. Front Sustainable Food Syst. 2, 407866(2018).
- Pfohl, P., et al. Microplastic extraction protocols can impact the polymer structure. Microplastics Nanoplastics. 1 (1), 1-13 (2021).
- Xu, J. L., Thomas, K. V., Luo, Z., Gowen, A. A. FTIR and Raman imaging for microplastics analysis: State of the art, challenges and prospects. Trend Anal Chem. 119, 115629(2019).
- Cardoza, L. A., Korir, A. K., Otto, W. H., Wurrey, C. J., Larive, C. K. Applications of NMR spectroscopy in environmental science. Prog Nucl Magnetic Resonance Spectr. 45 (3-4), 209-238 (2004).
- Peez, N., Rinesch, T., Kolz, J., Imhof, W. Applicable and cost-efficient microplastic analysis by quantitative 1H-NMR spectroscopy using benchtop NMR and NoD methods. Magnetic Resonance Chem. 60 (1), 172-183 (2022).
- Günther, M., Imhof, W. Simultaneous quantification of microplastic particles by non-deuterated (NoD) 1 H-qNMR from samples comprising different polymer types. Analyst. 148 (5), 1151-1161 (2023).
- Papini, G., Petrella, G., Cicero, D. O., Boglione, C., Rakaj, A. Identification and quantification of polystyrene microplastics in marine sediments facing a river mouth through NMR spectroscopy. Marine Pollut Bull. 198, 115784(2024).
- Herrera, R., Franco, L., Rodríguez-Galán, A., Puiggalí, J. Characterization and degradation behavior of poly(butylene adipate-co-terephthalate)s. J Polymer Sci Part A. 40 (23), 4141-4157 (2002).
- Mauel, A., Pötzschner, B., Meides, N., Siegel, R., Strohriegl, P., Senker, J. Quantification of photooxidative defects in weathered microplastics using 13 C multiCP NMR spectroscopy. RSC Adv. 12 (18), 10875-10885 (2022).
- Bharti, S. K., Roy, R. Quantitative 1H NMR spectroscopy. Trend Anal Chem. 35, 5-26 (2012).
- Li, X., Hu, K. Quantitative NMR Studies of Multiple Compound Mixtures. Ann Rep NMR Spectro. 90, 85-143 (2017).
- Simmler, C., Napolitano, J. G., McAlpine, J. B., Chen, S. N., Pauli, G. F. Universal quantitative NMR analysis of complex natural samples. Curr Opinion Biotechnol. 25, 51-59 (2014).
- Giraudeau, P. Challenges and perspectives in quantitative NMR. Magnetic Reason Chem. 55 (1), 61-69 (2017).
- Nelson, T. F., Remke, S. C., Kohler, H. P. E., McNeill, K., Sander, M. Quantification of Synthetic Polyesters from Biodegradable Mulch Films in Soils. Environ Sci Technol. 54, 266-275 (2020).
- Brandolini, A. J., Hills, D. D. NMR spectra of polymers and polymer additives. , CRC Press. Boca Raton. (2000).
- Matsuda, H., Asakura, T., Miki, T. Triad sequence analysis of poly(ethylene/butylene terephthalate) copolymer using 1H NMR. Macromolecules. 35 (12), 4664-4668 (2002).
- Yu, Y., Flury, M. How to take representative samples to quantify microplastic particles in soil. Sci Total Environ. 784, 147166(2021).
- Cambardella, C. A., et al. Field-scale variability of soil properties in central Iowa soils. Soil Sci Soc Am J. 58, 1501-1511 (1994).
- Ramsey, M. H., Argyraki, A. Estimation of measurement uncertainty from field sampling: Implications for the classification of contaminated land. Sci Total Environ. 198 (3), 243-257 (1997).
- Desaules, A. Critical evaluation of soil contamination assessment methods for trace metals. Sci Total Environ. 426, 120-131 (2012).
- Pennock, D., Yates, T., Braidek, J. Soil Sampling Designs. Soil Sampl Meth Anal. , 25-38 (2006).
- Büks, F., Kaupenjohann, M. Global concentrations of microplastics in soils - A review. SOIL. 6 (2), 649-662 (2020).
- Bowen, M., O'Neill, I., Pringuer, M. Quantitiative Applications of Nuclear Magnetic Resonance in Pharmaceutical Analysis. Proc Soc Anal Chem. , 294-297 (1974).
- Frank, O., Kreissl, J. K., Daschner, A., Hofmann, T. Accurate determination of reference materials and natural isolates by means of quantitative 1H NMR spectroscopy. J Agri Food Chem. 62 (12), 2506-2515 (2014).
- Malz, F., Jancke, H. Validation of quantitative NMR. J Pharma Biomed Anal. 38 (5), 813-823 (2005).
- Astner, A. F., et al. Forming micro-and nano-plastics from agricultural plastic films for employment in fundamental research studies. J Vis Exp. (185), e641112(2022).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. J Polymer Environ. 29 (9), 2916-2931 (2021).
- Deshoulles, Q., et al. Hydrolytic degradation of biodegradable poly(butylene adipate-co-terephthalate) (PBAT) - Towards an understanding of microplastics fragmentation. Polymer Degrad Stability. 205, 110122(2022).
- Zhang, Y., et al. Aging significantly increases the interaction between polystyrene nanoplastic and minerals. Water Res. 219, 118544(2022).
- Peez, N., Janiska, M. C., Imhof, W. The first application of quantitative 1H NMR spectroscopy as a simple and fast method of identification and quantification of microplastic particles (PE, PET, and PS). Anal Bioanal Chem. 411 (4), 823-833 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。