Method Article
プロトン核磁気共鳴分光法を用いた土壌からのポリブチレンアジピン酸テレフタレートベースのマイクロプラスチックおよびナノプラスチックの定量化
要約
ここでは、核磁気共鳴分光法を用いて、土壌中のポリブチレンアジピン酸テレフタレートに由来するマイクロプラスチックおよびナノプラスチックを定量する方法について述べる。この手法は、ナノプラスチックの定量化にまで及び、環境サンプルの大量処理に容易に適応できるため、既存の方法論を改良したものです。
要約
生分解性プラスチック製品の分解と環境への影響を正確に評価するためには、生分解中に土壌中に形成されたマイクロプラスチックおよびナノプラスチック(MPおよびNP)を回収および定量する方法が必要です。土壌中のMPおよびNPの存在は、凝集挙動などの土壌特性を変化させたり、土壌生物相に毒性影響を及ぼしたりする可能性があります。既存のMP回収法は、ポリブチレンアジピン酸テレフタレート(PBAT)などの生分解性ポリマーの測定に必ずしも適しているわけではありません。酸や酸化剤を用いた一般的な消化手順では、PBATベースの生分解性MPを破壊することがあります。マイクロFTIRやマイクロラマン分光法などの同定方法も、回収および分析できる粒子の最小サイズによって制限されます。そこで、この手法は、PBATを化学的に形質転換することなく、土壌中のMPおよびNPの質量分率を評価するために、土壌からPBATを抽出および定量するために開発されました。このプロトコルでは、クロロホルム - メタノール溶液を使用して、土壌からPBATを選択的に抽出します。溶媒を抽出物から蒸発させ、次いで抽出物を重水素化クロロホルムに再溶解する。抽出物は、陽子核磁気共鳴分光法(1H-QNMR)によって定量パラメータで分析され、各サンプル中のPBAT量を定量化されます。PBATの溶媒抽出効率は、日陰ローム土壌の76%からエルクホーン砂質ローム土壌の45%までの範囲です。PBAT回収率は、光酸化材料の場合、元の材料と比較して減少する可能性があり、粘土含有量の高い土壌では減少する可能性があります。抽出効率は試験範囲内のPBAT濃度には依存しませんが、NPの抽出効率はMPよりも低いことが観察されました。
概要
土壌中のMP汚染を測定する方法は、地球規模の土壌1、プラスチック汚染源2、および潜在的な解決策3を理解するために必要です。農業用土壌はプラスチック汚染に特有にさらされており、2021年現在、毎年1,500万トン以上のプラスチックが農業で使用されており4、そのうち250万トンのプラスチックマルチ5が含まれています。プラスチックマルチは、土壌と密接に接触して使用され、年に1回以上再適用され6、耐用年数7後に土壌から完全に除去するのが難しい場合があります。MP測定方法が必要とされる重要な分野の1つは、野菜システムで使用するための生分解性プラスチックマルチなどの生分解性プラスチック製品の評価です8。
土壌中の生分解性プラスチック製品は、意図したとおりに機能すれば、プラスチックマルチングによる土壌のプラスチック汚染を排除できるため、従来の農業用プラスチックの有望な代替品です。2022年には、世界で生産された生分解性プラスチックは100万トン未満であり、業界の急速な成長が予想されています9。最も一般的な4つの生分解性ポリマー、ポリ乳酸(PLA)、重合デンプン、ポリヒドロキシアルカノエート(PHA)、およびポリブチレンアジピン酸テレフタレート(PBAT)は、すべて農業用生分解性プラスチックマルチ10で商業的または実験的に使用されている。その約束にもかかわらず、これらの生分解性プラスチック製品の野外条件での劣化は変数11です。現場での生分解性プラスチックマルチの劣化に関するいくつかの研究は、マクロプラスチックの破片に焦点を当てています11が、プラスチック材料の完全な分解を評価するには、土壌からMPとNPを回復する能力が必要です。土壌からのマイクロプラスチックの定量化は、MP汚染による土壌生態系への悪影響の可能性を評価するためにも重要です12。
MPの同定と定量に一般的に使用される技術には、視覚分析、マイクロフーリエ変換赤外分光法(μFTIR)、マイクロラマン分光法(μラマン)、ガスクロマトグラフィー質量分析法(熱分解GCMSおよび熱抽出脱着GCMSを含むGCMS)、および熱重量分析13が含まれます。その他の開発中の技術には、土壌中のin situ MP測定のための近赤外分光法14、GCMS分析のための脂肪酸メチルエステル化抽出法15、核磁気共鳴分光法16などがあります。土壌中のMPを定量した研究の90%は、プラスチック粒子を特定するために視覚分析(単独または他の技術と組み合わせて)を使用し、77%はFTIR、ラマン、またはGCMS分光法技術を使用しました17。多様なMP定量技術を開発し、調和させることで、科学界が多様なマイクロプラスチック研究の疑問に答える能力を拡大することができる18。マイクロプラスチックを定量化するために土壌サンプルを調製するための一般的なアプローチは、1)変化していない個々のマイクロプラスチック粒子を土壌から分離する(密度分離など)、2)変換プラスチックまたはポリマー材料を抽出する(溶解など)、3)バルク土壌を分析するという3つの一般的なアプローチがあります。μFTIR分光法とラマン分光法はどちらも、個々のMPを化学的に同定する前に土壌から分離する必要があります19が、Pyro-GCMSは、土壌またはバルク土壌20から分離された分離されたプラスチック粒子に対して実行できます。土壌有機物の除去に使用される一部の消化物は、PBAT21などの生分解性ポリマーを分解したり、化学的に変化させたりする可能性があるため、生分解性MPを土壌から分離することは困難な場合があります。マイクロラマン分光法とμFTIR分光法の両方には空間分解能の限界があり、粒子はμFTIRで10-20μmより大きくなければならず、μラマンでは1μm以上でなければならない(この小さな個々の粒子を分析用に準備できる場合)19,22。これらの技術により、MPポリマーの化学的同定が可能となり、分光イメージングを用いてMPサイズ22を測定することができます。すべてのタイプのpyro-GCMSは、分析中にサンプルが破壊されるという点で制限されています。
NMRは、土壌成分と汚染物質23の特性評価、MPの定量化16,24,25,26、PBATと別のポリマーであるポリスチレン27,28の劣化の評価にうまく使用されています。定量パラメータで実行すると、1H-NMR分光法は、各スペクトルピークの面積がサンプル中の寄与水素の数に正比例するスペクトルを生成します。これにより、サンプル29の構成成分の定量化が可能になる。NMRは、PBATを含む土壌中の一部のMPを定量するための貴重な分析手法であり、同時に定量と同定が可能であり、複雑で不純な混合物に適しており、化学的に同一の参照標準30,31を必要としない。溶媒抽出物のNMR分光法は、μFTIR、μRaman、またはGCMS定量に処理できるものよりも小さいMPまたはNPを定量できます。これらの利点にもかかわらず、定量的NMRアプローチは、破壊的な質量分析法に基づくアプローチよりも感度が低くなっています32。
図1に示す提案手法は、ナノサイズのPBATプラスチックを含むPBATを含む土壌サンプルを処理および分析するワークフローを示しています。この方法では、クロロホルムとメタノールの混合物で土壌を振とうすることにより、PBATポリマーを土壌サンプルから抽出します。PBATを含む溶媒抽出物を乾燥させた後、内部キャリブラントを添加した重水素化クロロホルムに再溶解します。NMR分光法は、定量的パラメータを使用して抽出物に対して行われます。得られたスペクトルを解析し、PBATとキャリブラント分子の水素原子に対応する適合ピークの面積を比較することにより、PBATを定量化します。この方法は、Nelsonらによって実証された溶媒抽出および陽子核磁気共鳴分光法(1H-NMR)アプローチを適用します33。目標は、環境規模のサンプル(~100 gの土壌)を処理するのに適した方法を採用し、特別な抽出装置なしで多数のサンプルを並行して処理することでした。
プロトコル
1. 土の収集と準備
注:サンプリングおよび処理装置には、サンプルの汚染を避けるために、ポリマーPBATまたはその成分を含んでいないでください。他のポリマー材料は、土壌からのPBATの定量に必ずしも干渉しません。例えば、ポリエチレンとポリプロピレンは、クロロホルム 1H-NMRでPBAT34の定量を妨げるスペクトルピークを生成しませんが、ポリエチレンテレフタレートとそのテレフタレート基は、他のポリエステルと同様に35を妨害する可能性が最も高いです。BrandoliniやHills34 などの参照テキストを使用して、さまざまなポリマーの 1H-NMRスペクトルを決定し、定量に使用されるPBATピークと重なるピークをスクリーニングできます(以下で説明します)。
- 各サンプルについて、少なくとも100g相当の乾燥重量の土壌を収集します。代表的なサンプルを収集するために、プラスチックの予想濃度に基づいて土壌サンプルサイズを決定し、必要に応じて土壌を均質化してサブサンプルを収集します36。
注:土壌システムは本質的に不均一であり37、その中の汚染物質の分布(例えば、MPs)38も同様である。また、汚染物質濃度の測定に使用される方法にもばらつきがあります39。したがって、不確実性を推定し、プラスチック濃度40に基づいて代表的なサンプル量を収集するためのツールとして、複製サンプルを含むサンプリングデザインまたは実験デザインを作成することが推奨される。土壌中のMP濃度は、土壌1kgあたりゼロから1×107 アイテムの範囲であることが文書化されており、ほとんどのサイトでは土壌1kgあたり10,000アイテム未満である41。理論上の代表的な基本体積は、MP濃度が1平方メートルあたり10アイテムの23 m2 から、MP濃度が1平方メートルあたり10,000アイテムの0.02 m2 までの範囲です36。- 処理しなければならない土壌の量を最小限に抑えながら、フィールドサイトからの有効サンプリング面積を増やすには、広い面積(例えば、1 m2)から土壌を収集し、次に四分の一法を使用してサンプルを均質化し、統合する(例えば、500 gの土壌)36。
- 四分の一法は、広い範囲からタープなどに土を積み上げ、シャベルでよく混ぜてから四分の一に分ける方法です。サンプルの4分の1を保持し、残りの4分の3を廃棄します。サンプルが目的のサイズになるまで、このプロセスを繰り返します。
- 2mmメッシュのふるいを通して土をふるいにかけます。ふるいと土のサンプルの間のキャッチパンを完全にきれいにします。
- 土壌を風乾させてから、密封されたサンプルバッグに保管します。乾燥した土壌は、PBAT抽出前にこの状態で保存することができます。
2. 土壌からのPBATの抽出
注意:クロロホルムは揮発性で有毒です。酸化剤から離れた琥珀色のガラスで暗闇に保管してください。それを扱うときは、適切な手袋、目の保護具、および防護服を着用してください。ヒュームフードでのみ取り扱ってください。メタノールは可燃性で、揮発性で、有毒です。メタノールは耐火キャビネットに保管してください。メタノールを取り扱う際は、適切な手袋、目の保護具、防護服を着用してください。メタノールはヒュームフード内でのみ取り扱ってください。ガラス製品が壊れて怪我をする可能性があります。ガラス製品を取り扱うときは、目の保護具を着用してください。割れたガラスに素手で触れることは避けてください。代わりに、切れにくい手袋、トング、ほうき、または別の道具で割れたガラスを掃除してください。
注:クロロホルムは、ほとんどのプラスチックや金属と互換性がありません。すべての材料に互換性があることを確認してください(例:ガラスまたはポリテトラフルオロエチレン、PTFEプラスチック)。
- ドラフトで、クロロホルム(トリクロロメタン;抽出するサンプルあたりのCHCl3)およびメタノール(CH3OH)。例えば、5つのサンプルから抽出するには、450 mLのクロロホルムと50 mLのメタノールを混合します。
- 乾燥土壌100g、クロロホルムメタノール溶液100mL、ガラスビーズ20個をガラス抽出ジャーに加えます。抽出ジャーをPTFEで裏打ちされた蓋でしっかりと密封し、溶媒蒸気がジャーから出ないようにします。
注:PBATはクロロホルムに非常に溶けます。クロロホルム-メタノール混合物が使用されたのは、メタノールが溶質と水素結合を形成し、土壌鉱物および有機成分と競合し、土壌からのPBATの回収率を増加させる可能性があるためである33。 - シェーカーテーブルを使用して、抽出ジャーを200rpmで8時間振とうします。振とうした後、抽出ジャーの中の土壌を少なくとも4時間沈殿させます。
- 土壌から抽出物を分離します。ヒュームフード内で、抽出ジャーのキャップを外し、細孔径11μmの定性的なペーパーフィルターを介して液体をピペットでラベル付きのきれいなガラスジャーに移します。抽出ジャーから回収した溶媒の量を記録します。抽出物と一緒に土壌固形物を移すことは避けてください。必要に応じて、数mLの溶媒を残しておきます。
注意: 濾紙は、溶剤溶液から大きな有機物片を取り除くことを目的としています。 - 溶媒が完全に蒸発するまで、抽出物をドラフトに残して乾燥させます。これには最大24時間かかる場合があります。ドラフトの土も乾かします。土が完全に乾いたら、それを捨てます。
- 抽出物が乾いたら、各サンプルジャーに蓋をし、必要になるまで冷暗所で乾燥した場所に保管します。
3. NMRスペクトルの収集
注意:重水素化クロロホルムは、上記のプロトン化クロロホルムと同じリスクをもたらし、同じ予防措置が必要です。
- 内部キャリブラント42 をサンプルに加えます。天びんを使用して、1.00 mgの1,4-ジメトキシベンゼン(DMB;C6H14O)を乾燥抽出物を含む各サンプルジャーに入れる。
- サンプルを重水素化クロロホルム(CDCl3;トリクロロ(重水素)メタン)に再懸濁します。ヒュームフードで、マイクロピペットを使用して、乾燥サンプル抽出物を含む500μLの重水素化クロロホルムをジャーに加えます。
- 瓶に蓋をして振ると、手またはベンチトップに瓶を両側約10回軽くたたいて、乾燥抽出物を溶かします。次に、清潔なピペットチップを使用して、液体をNMRチューブに移します。
- ステップ3.2と3.3を繰り返して、さらに500μLの重水素化クロロホルムを加え、サンプルの2番目の部分を最初の部分と同じNMRチューブに加えます。2回目のすすぎは、乾燥した抽出物が容器から完全に溶解し、回収されることを保証することを目的としています。
- NMRチューブにキャップをして3日間保管してから、NMRスペクトルを収集します。適切な保存時間は、NMRチューブからの溶媒の蒸発速度によって異なります。重水素化クロロホルムでサンプルを調製した直後にサンプルを分析します。
- NMRチューブを分光器に輸送するには、長くて繊細なチューブを支えるように設計されたホルダーを使用してください。これらは通常、チューブのベースと上部の近くにサポートがあります。輸送中はチューブを直立位置に保ちます。
- 500MHz NMR分光計を使用して、90°のパルス角29、8μsのパルス幅33、25秒の遅延時間(反転回復実験29,43によって決定)、スキャンあたり262Kポイント、および12から-2ppmまでの32の複合スキャン29,44で1Hの陽子スペクトルを収集し、合計25分間の実行時間。
注:Bruker Neo 500 MHz分光計と、ブロードバンド最適化プローブおよびオートサンプラーを300 Kの制御温度で使用しました。他の同様の分光計を使用することができます。磁場強度の異なる装置を使用する場合、反転回復実験29,43を用いて、PBATと1,4-ジメトキシベンゼンのT1緩和時間に基づいて適切な遅延時間を計算することができる。 - サンプルの実行後、必要に応じてスペクトルデータを保存、転送、またはアクセスします。
スペクトルデータを検査します。定量に使用したすべてのPBATピークが存在する場合は、明確に分離されていることを確認してください。定量には、PBAT ピーク 5(8.10 ppm)、6(4.44 ppm)、6' ピーク(4.38 ppm)、3' ピーク(4.15 ppm)、3 ピーク (4.09 ppm) を使用します(詳細は 表 1 を参照)。定量には、DMB ピーク A(6.84 ppm)と B(3.77 ppm)も使用します(詳細は 表 2 を参照)。PBATの6、6'、3'、および3つのピークは、互いに非常に接近して見え、重なり合う可能性があることに注意してください。 - 一部のピークが明確に分離されない場合は、サンプルを希釈します。100 μLのサンプルと500 μLの重水素化クロロホルムを清潔なNMRチューブに混合し、ステップ3.7で定義したのと同じパラメーターでサンプルを再分析します。
4. PBATを定量するためのNMRスペクトルの解析
注:スペクトル分析は、収集後いつでも実施できます。スペクトルが生成されるのと同じ日にデータを分析することは、問題が発生した場合にサンプルを再実行できるようにするために好まれます。
- 分光器で作成したFIDファイルをNMR FID処理ソフトウェアで開きます(MestreLabのMestreNovaを使用しましたが、他のオプションもありますが、他のオプションも利用可能です)。
- スペクトルに線の広がりを適用する: FID 処理ソフトウェアで、[処理] メニューの [処理テンプレート ] を選択し、[アポダイゼーション] セクションに移動します。マグニチュードが 0.5 Hz で、最初の点が 0.5 Hz の指数モデルを選択します。
- 自動位相補正を適用するには、処理メニューの 自動位相補正 ボタンをクリックします。自動ベースライン補正を適用するには、処理メニューの 「自動ベースライン補正 」ボタンをクリックします。
- ピークデコンボリューションを使用して測定されたスペクトルピークをフィットする:スペクトル処理ソフトウェアの[解析]タブの[フィッティング]セクションで、[ 新規フィット ]ボタンをクリックします。カーソルを使用して 8.5 ppm シフトでスペクトルをクリックし、カーソルを 3.0 シフトまでドラッグして離します。
- 「フィッティング」セクションの 「ラインフィッティングテーブル 」をクリックして、すべてのフィッティングピークを表示します。
- 定量に使用したピークは、表 1 および表 2 に記載し、図 2 にラベル付けしたものを保持してください。定量には、PBAT ピーク 5(8.10 ppm)、6(4.44 ppm)、6' (4.38 ppm)、3' (4.15 ppm)、3(4.09 ppm)、および DMB ピーク A(6.84 ppm)および B(3.77 ppm)を使用します。表1および表2にリストされている各ピークに対応する水素原子は、図3の構造図でラベル付けされており、図3Aは2つのPBAT二量体の構造を示し、図3Bはポリマー内の二量体の位置がどのように相互作用して1,4-ブタンジオールモノマーからの水素のピークシフトを変化させるかを示しています。 DMBの構造を示す図3C。
- フィットから他のすべてのピークを削除するには、不要なピークを選択し、[ ピークの削除]をクリックします。
- フィッティングテーブルを使用して、各ピークの面積を計算用のスプレッドシートアプリケーションにコピーします(スプレッドシートを使用することを選択しました)。
- ピーク面積をスプレッドシートにコピーするには、まずラインフィットテーブルですべてのピーク情報を選択します。次に、右クリックして、ポップアップメニューから 「コピー 」を選択します。データをスプレッドシートに貼り付けます。
- 次式を使用して、サンプルに添加された DMB のモル数 nDMB を計算します

ここで、 mDMBはサンプルに添加されたDMBの質量(グラム単位)(推奨1.00 mg)、 MMDMB はDMBの分子量(138.17 g / mol)です。 - 次の式を使用して、サンプル中のPBATのブチレンテレフタレート二量体nBTのモル数を計算します

ここで、A5 はPBATピーク5の測定面積、AAはDMBピークAの測定面積、ABはDMBピークBの測定面積です。スペクトル解析ソフトウェアによって生成される面積単位は任意です。 - 次式を使用して、サンプル中のPBATのアジピン酸ブチレン二量体nBAのモル数を計算します

ここで、 A3 は PBAT ピーク 3 の測定領域、 A3' は PBAT ピーク 3' の測定領域、 A6 は PBAT ピーク 6' の測定領域、 A6' は PBAT ピーク 6' の測定領域です。スペクトル解析ソフトウェアによって生成される面積単位は任意です。 - 次の式を使用して、サンプル中のPBATの質量mPBATを計算します。

ここで、MMBAはPBATからのBA二量体のモル質量(200 g / mol)であり、MMBTはPBATからのBT二量体のモル質量(220 g / mol)です。 - サンプル中に既知の量のPBATが存在していた場合、η式に従って抽出効率の尺度として、サンプルの回収率()を計算できます

- 次式を使用して、サンプル中のPBAT濃度CPBATを計算します

ここで、 m乾燥土壌 は抽出物の製造に使用された乾燥土壌の質量(0.1 kg)、回収された V 溶媒 はステップ 2.4 で土壌から回収された溶媒の量、添加された V sovlent は土壌サンプルに添加された溶媒の初期量(100 mL)です。
5. 特定の土壌からのPBATの定量のための検量線の作成
注:既知の量のPBATが追加された土壌サンプルに基づいて作成された検量線は、PBATが特定の土壌から抽出および回復される方法についての有用な情報を提供します。抽出は、すべての土壌またはすべての形態のPBATで同じではありません。我々は、抽出効率が土壌粘土および有機物含有量33に依存すると疑っており、各土壌系列および対象地平線の較正曲線を作成することを推奨する。検量線は、この方法で未知のサンプルを処理する前または後に作成できます。
- 手順1.1〜1.3で説明されているように、2.5kg相当の乾燥土壌を収集して準備します。
- 検量線でカバーする範囲を決定します。検量線で使用されるPBATの最大濃度は、未知のサンプルの中で最も高いPBAT濃度よりも高くする必要があります。
- 最大濃度の0%、25%、50%、75%、および100%の土壌100gの5つのスパイクサンプルを作成するのに十分なPBATプラスチックを調製または入手します(合計25サンプル)。例えば、40 mg/kg が望ましい最大濃度である場合、スパイクサンプルを作成するには合計 50 mg の PBAT が必要になります。
- 各100gの土壌を25サンプル調製します。PBATベースのプラスチックを計量し、規定の速度で土壌サンプルに追加することにより、サンプルをスパイクします。例えば、40 mg/kg の PBAT が望ましい最大濃度である場合は、PBAT を含まないサンプルを 5 つ、PBAT を 1 mg 含むサンプルを 5 つ、PBAT 2 mg をサンプルとして 5 つ、PBAT を 3 mg で 5 サンプル、PBAT を 4 mg で 5 つのサンプルを作成します。PBATを土に加えた後、よく混ぜます。
- スパイクした25個のサンプルからPBATを抽出し、抽出物からNMRスペクトルを収集し、ステップ2.1から4.16で説明したように、得られたスペクトルを分析します。
- この土壌のPBATの検量線の方程式を特定するには、各スパイクサンプルのPBATの測定量と統計分析ツールで追加されたPBATの実際の量との間の線形回帰を実行します。スプレッドシートを使用しました。PBATが追加されていないスパイクされたサンプルでPBATが検出されない場合は、回帰でb = 0を強制します。
注:線形回帰テストは、2つの連続する数値変数xとyの間の線形関係の強さを、y = mx + bの関係に従って評価します。データに最も適合するmとbの値は、テストによって計算されます。回帰検定のr2 係数は、2つの変数が互いにどの程度密接に相関しているかを示します。 - 統計分析ツールを使用して、抽出効率とPBAT濃度との間に有意な関係があるかどうかをテストします。スパイクしたサンプルからPBATの抽出効率を次のように計算します。

- 統計分析ツールを使用して、抽出効率とPBAT濃度との間に相関関係がない状態で観測データがランダムに発生する確率を計算します。このp値が所定の有意性のしきい値( α)より大きい場合、2つの変数間に関係がないという帰無仮説を棄却できません。この場合、抽出効率は、試験範囲内のすべてのPBAT濃度で一定であると想定できます。帰無仮説が棄却された場合、ここで説明する線形モデルは、データをモデル化する最適な方法ではない可能性があります。
- 検量線線形回帰式を使用して、この方法を使用して処理された未知サンプル中のPBAT量を推定します。回帰 x 変数が検量線スパイクサンプルの実際の PBAT 量であり、y 変数が PBAT の測定量であり、b が 0 に設定されている場合、次のようになります

注:検量線式を使用して推定された反復サンプルのPBAT含有量は、特定の土壌中のPBAT量の信頼区間を生成するために使用でき、または反復抽出物中のPBAT濃度の平均と信頼区間を計算できる場合は、検量線を適用して土壌中のPBAT濃度を推定できます。どちらの順序でも、土壌中のPBAT含有量の信頼区間は同じになります。例えば、PBAT濃度が10、5、2、4、10、11、2、6、8、5 mg/kgの10個の反復サンプルからの抽出物と、検量線式y(抽出物中のPBATの測定) =0.75 x (土壌中の真のPBAT)について考えてみます。各複製の土壌PBAT濃度は、13、7、3、5、13、15、3、8、11、および7 mg / kgと推定できます。次に、土壌中のPBAT濃度の平均は8.4 mg / kgと推定され、標準偏差は4.4 mg / kgになります。抽出物PBAT濃度(10、5、2、4、10、11、2、6、8、5)について平均と標準偏差を最初に計算すると、平均は6.3 mg/kg、標準偏差は3.3 mg/kgと計算されます。次に、検量線を平均と標準偏差の両方に適用して、土壌中のPBAT濃度を推定できます(平均は8.4 mg / kg、標準偏差は4.4 mg / kg)。
結果
土壌からのPBATポリマーの定量におけるこの方法の有効性を評価するために、3つの異なる土壌から作成されたスパイクサンプルからPBATを抽出することにより、検量線を作成しました。3つの土壌( 詳細は表3)のそれぞれについて、土壌を2mmのふるいに通し、次いで風乾させた。スパイクサンプルは、0、9、18、27、または 36 mg の PBAT ベースの MP を 100 g の乾燥土壌 (それぞれ 5 回の繰り返し) に加えて作成しました。これは、0、63、126、189、または252 mg / kgのPBATポリマーに相当します。MPは、Astner et al.45 に記載されている粉砕手順に従って、質量で70%のPBATと50μmの厚さのプラスチックマルチから作られ、840μm未満でした。各検量線を作成するために、上記で定義した手順に従って、各スパイクサンプルからPBATを抽出しました。次に、PBATの回収率を、各サンプルに添加したPBATの量と比較しました。PBATの回収率と定量化は、1つの土壌(Shady loam)のNP(平均直径780 nm、多分散指数0.77、Astner et al.45に従って調製)についてもテストされました。
すべての土壌について、PBATを添加していないサンプルではPBATは検出されなかった、つまり、この方法では偽陽性は観察されませんでした。 補足図1 は、PBATを含まない(および調製プロセス中に添加されたDMBを含む)日陰ローム土壌から収集されたスペクトルを示しています。内部キャリブラントDMBの2つの特性ピークは存在しますが、PBAT特性ピークは存在しません。PBATが添加された土壌については、PBATの同定に使用された5つの特徴的なピークが存在しました。 図2 は、63 mg / kgのPBATを添加した日陰ローム土壌から収集されたスペクトルを示しています。定量に使用したすべてのPBATおよびDMBピークが明確に分離されています。 補足図2 は、 図2 に示すスペクトルのフィット領域を、積分ピークを重ね合わせたものです。3、3'、6、6' のピークはスペクトル内の他の信号と重なるため、単純なピーク積分ではなく、適合したピークの積分に基づいて PBAT 含有量を計算することが重要です。これにより、土壌抽出物の他の成分による面積と、重なり合うPBATピークから領域が除去されます。 補足図3 は、希釈がNMRスペクトル分解能に及ぼす影響を示しています。この図は、エルクホーン砂壌土から採取したスペクトルに252 mg/kgのPBATを添加したものです。パネルAでは、4.5 ppm から 4.0 ppm の範囲の 3、3'、6'、6' PBAT ピークは分離できません。 補足図3B は、同じサンプルを追加の重水素化クロロホルムで1:5に希釈した後に収集したスペクトルを示しています。希釈後、4つのピークは明瞭になり、その面積を適合させることができます。
検量線は、試験した3つの土壌間で異なっていました。 図4 は、各抽出物で測定されたPBAT(CPBAT,m)に基づく各土壌の推定PBAT濃度を、土壌に添加された実際のPBAT(CPBAT,a)と比較したものです。日陰ローム土壌から回収されたPBATの量は、添加されたPBATの量と強く相関していました(r2 = 0.99)。検量線式C PBAT,m = m*CPBAT,a, m = 0.76 ± 0.02 (1 標準誤差±平均) の場合、m はゼロ (df = 24;F = 2000;p < 1*10-16)。PBATは、この土壌からη = 76 %± 10 %(平均±1標準偏差)の効率で回収されました。日陰の土壌からの抽出効率は、サンプル中のPBATの量と相関していなかった(r2 = 0.009;p = 0.7)。NP は、η = 59 % ± 8 % (平均 ± 1 標準偏差) の効率で回収されました。 図5 は、シェイディロームからのMPとNPの抽出効率を示しています。NPでは効率が有意に低かった(p = 0.0002)。ロスオソスロームから回収されたPBATの量は、日陰の土壌よりも添加されたPBATの量(r2 = 0.85)との相関があまり強くありませんでした。検量線式C PBAT,m = m*CPBAT,a, m = 0.57 ± 0.05 (1 標準誤差±平均) の場合、m はゼロと有意に異なり (df = 23;F = 100;p = 8*10-11)。PBATは、この土壌からη = 57 %±22 %(平均±1標準偏差)の効率で回収されました。ロスオソス土壌の抽出効率は、サンプル中のPBATの量と相関していませんでした(r2 = 0.01;p = 0.6)。エルクホーン砂壌土から回収されたPBATの量は、添加されたPBATの量と強く相関していました(r2 = 0.88)。検量線式CPBAT,m = m*CPBAT,a, m = 0.70 ± 0.05 (平均± 1 標準誤差) の場合、m はゼロと有意に異なり (df = 23;F = 200;p = 5*10-12)。PBATは、この土壌からη = 70 %± 14 %(平均±1標準偏差)の効率で回収されました。抽出効率は、エルクホーン土壌のサンプル中のPBATの量(r2 = 0.006;p = 0.7)と相関していなかった。
さらに、この方法を適用して、エルクホーンシリーズ土壌中のPBATを定量化しました。この実験では、農業圃場内の2つの場所からエルクホーンの土壌を採取し、2mmのふるいにかけた後、風乾しました。土壌をPBATベースのマルチMP(上記のように作成、直径840μm)<混合し、各メソコズムに50 mgのMPと150 gの乾燥土壌(250 mg / kgのPBAT)を混合して、サイトAの土壌にMPを混合した5つのメソコスムと、サイトBの土壌にMPを混合した5つのメソコスム(合計10)を作成しました。各サイトの土壌で構成された5つのメソコズムにMPを追加せずに、ネガティブコントロールとして機能しました(合計10)。メソコズムを6ヶ月間インキュベートして、PBATベースのマルチMPの生分解を調査しました。インキュベーション中、累積土壌呼吸はヘッドスペースCO2 濃度(赤外線ガス分析器を使用)を介して測定され、PBAT劣化を定量化するために使用されました。インキュベーション終了時にメソコズムに残存するプラスチックの量は、次のように計算されました。
プラスチックからのCフラック、最終= [mプラスチック、i / Cフラックプラスチック - (CCO2、プラスチック添加 - CCO2プラスチックなし)* m乾燥土壌]/(mプラスチック、i / Cフラックプラスチック)
ここで、m乾燥土壌 は各インキュベーションジャー内の土壌の量、Cフラックプラスチック は添加されたマイクロプラスチックの炭素含有量、CCO2、プラスチック添加は 乾燥土壌のグラムあたりにプラスチックを添加したメソコズムで生成されるCO2 の累積量、CCO2プラスチックは 乾燥土壌のグラムあたりにプラスチックを添加しないメソコスムで生成されるCO2 の量です。 プラスチックMとは、プラスチック を添加した初期質量です。
ブートストラップを使用して、各サイトからの10の実験的メソコズムのランダムなペアの10,000の理論サブサンプルでプラスチックの残留を計算することにより、土壌AおよびBに残存するプラスチックの信頼区間を推定しました。サイトAでは、呼吸データから残存する推定平均プラスチックは86%であり、ブートストラップされた95%信頼区間の範囲は62〜>100%でした。施設Bでは、プラスチックの残存平均は98%と推定され、95%信頼区間の範囲は79〜>100%でした。6ヶ月の終わりには、この原稿に記載されている抽出法とNMR定量法(サイトAはn = 5、サイトBはn = 4)によってPBAT含量も測定しました。サイトAでは、NMRデータから推定された平均プラスチック残存量は79%で、95%信頼区間(平均±1.96xSE)は71%から87%の範囲でした。施設Bでは、プラスチックの残存平均は88%と推定され、95%信頼区間の範囲は71%から100%でした。 図6 は、2つの異なる方法で推定された2つのサイトからの土壌の可塑性含有量の信頼区間を示しています。2つの方法による可塑性含有量の推定値は、信頼区間の各ペア間のオーバーラップの大部分に基づいて、相互に一致しているように見えます。

図1:ポリブチレンアジペートテレフタレート(PBAT)抽出および定量手順の視覚的な概要。この図の拡大版を表示するには、ここをクリックしてください。
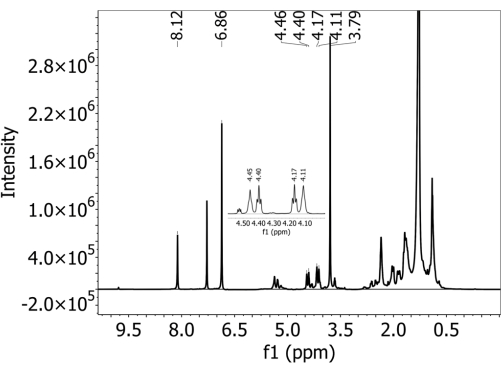
図2:ポリブチレンジジピン酸テレフタレート(PBAT)MPs.を含む日陰ローム土壌からの抽出物に、重水素化クロロホルム溶媒中で500MHz分光計を用いて収集した1H-NMRスペクトル 1,4-ジメトキシベンゼン(DMB)をNMR分析前に内部キャリブラントとして抽出物に添加した。PBATとDMBの両方の特性ピークがスペクトルに存在します。この図の拡大版を表示するには、ここをクリックしてください。

図3:ポリブチレンジジピン酸テレフタレート(PBAT)と1,4-ジメトキシベンゼン(DMB)の標識プロトン構造。対応する構造を表1および表2に示す(A)PBATのBA−BTユニット1台の構造。(B)PBATのT-B-T、T-B-A、およびABAトライアドの構造。(C)DMBの構造。この図の拡大版を表示するには、ここをクリックしてください。

図4:日陰ローム土壌、ロスオソスローム、および既知の量のPBATを含むエルクホーン砂壌土からの重水素化クロロホルム溶媒中の抽出物中の 1H-QNMRによって測定されたPBAT濃度。 この 図の拡大版を表示するには、ここをクリックしてください。

図5:日陰ローム土壌のスパイクサンプルからのPBATのMPおよびNPの抽出効率。 NPのPBAT回復率は有意に低い(p = 0.0002)。各ボックスの中央の線は測定されたデータ ポイントの平均を表し、ボックスの上限と下限はそれぞれ Q3 と Q1 を反映しています。ひげの上限と下限は、それぞれ最大データ ポイントと最小データ ポイントを反映します。個々のデータポイントは、箱とひげの中に表示されます。 この図の拡大版を表示するには、ここをクリックしてください。

図6:2つのエルクホーン土壌のプラスチック含有量は、累積インキュベーション呼吸とNMRと組み合わせた溶媒抽出によって測定されました。 呼吸によって測定されたプラスチック含有量の場合、バーはブートストラップされた95%信頼区間を表します。NMRで測定した可塑性含有量の場合、バーは平均推定値の上下の標準誤差の2倍に基づく95%信頼区間を表します(サイトaはn = 5、サイトbはn = 4)。 この図の拡大版を表示するには、ここをクリックしてください。
| ピーク ID | 場所 | 陽子の数 | 多様 性 | モノマー | 定量に使用 |
| 5 | 8.1 | 4 | 襦袢 | T | はい |
| 6 | 4.44 | 2 | 三つ子 | B | はい |
| 6’ | 4.38 | 2 | 三つ子 | B | はい |
| 3’ | 4.15 | 2 | 三つ子 | B | はい |
| 3 | 4.09 | 2 | 三つ子 | B | はい |
| 1 | 2.34 | 4 | 三つ子 | ある | いいえ |
| 7 | 1.97 | 2 | マルチプレット | B | いいえ |
| 7’ | 1.87 | 2 | マルチプレット | B | いいえ |
| 4’ | 1.81 | 2 | マルチプレット | B | いいえ |
| 4 | 1.68 | 2 | マルチプレット | B | いいえ |
| 2 | 1.66 | 4 | マルチプレット | ある | いいえ |
表1: 重水素化クロロホルム溶媒中のポリブチレンジジピン酸テレフタレート(PBAT)のH-NMRスペクトルピーク。 各ピークに起因する水素は、 図3に標識されています。ピークアサインメントは Herrera et al.27 に基づいています。
| ピーク ID | 場所 | 陽子の数 | 多様 性 | 定量に使用 |
| ある | 6.84 | 4 | 襦袢 | はい |
| B | 3.77 | 6 | 襦袢 | はい |
表2:重水素化クロロホルム溶媒中の1,4-ジメトキシベンゼン(DMB)の 1つのH-NMRピーク。 各ピークに起因する水素は、 図3Bに標識されています。ピーク割り当てはNelson et al.33に基づいています。
| 土壌シリーズ | 分類 | テクスチャー | 全有機炭素 | pHの | 収集場所 | 収集深さ(cm) |
| 如何わしい | ファインローム質、混合、亜活性、熱性 Typic Hapludult | ローム | 1.70% | 6 | 米国テネシー州ノックスビル | 0-5 |
| ロスオソス | ファイン、スメクタイト、サーミックタイピックアルギセロール | ローム | 3.00% | 6 | サンルイスオビスポ、カリフォルニア州、米国 | 0-5 |
| エルクホーン | ファインローム質、ミックス、スーパーアクティブ、熱性パシックアルギセロール | サンディローム | 1% | 7 | ワトソンビル、カリフォルニア州、米国 | 0-5 |
表3:PBAT抽出法のデモンストレーションに使用した3つの土壌の特性。
補足図1:重水素化クロロホルム溶媒中で500MHz分光計を用いて、PBATポリマーが存在しないShadyロームの抽出物にH-NMRスペクトルを1個採取した結果。PBAT特性ピークは存在せず、DMB(内部キャリブラントとして追加)ピークは存在します。このファイルをダウンロードするには、ここをクリックしてください。
補足図2:図4に示す1H-NMRスペクトルの適合領域。スペクトルは重水素化クロロホルム溶媒中で収集しました。緑色の背景は、適合したスペクトルの領域を示しています。紫の線はフィットしたピークを示し、赤い線は誤差(スペクトラム信号のフィットしたピークに含まれていない部分)を示します。PBATピーク5、6、6'、3'、および3は、DMBピークAおよびBとともにフィットに含まれています。
補足図3:PBAT MPを添加したエルクホーン砂壌土の抽出物に対して、500MHz分光計で収集した重水素化クロロホルム溶媒中の 1つのH-NMRスペクトル。 PBATとDMBの両方の特性ピークがスペクトルに存在します。(A)PBATピークを区別してポリマーを定量することはできません。サンプル抽出物がこのようなスペクトルを生成する場合は、サンプルを希釈してから、それを使用して新しい 1H-NMRスペクトルを収集します。(B)同じ抽出物を希釈して、すべてのスペクトルピークが明確に分離されるようにします。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
私たちは、抽出物中のPBATを定量するために、1H-NMRと組み合わせて土壌からPBATを溶媒抽出する方法を提案します。抽出プロセスの主な要素には、抽出技術と装置、抽出に使用する溶媒、および時間要件が含まれます。私たちは、Nelson et al.33 によって実証されたソックスレー抽出と加速溶媒抽出 (ASE) と比較して、比較的単純で安価な機器 (ガラス瓶、ガラスビーズ、シェーカーテーブル) を必要とする抽出技術を使用することを選択しました。この方法の目標は、バルク土壌サンプルの処理速度に合わせて、多くのサンプルを並行して抽出できることです。単純な溶媒振とう抽出の別の利点は、ソックスレーまたはASEアプローチと比較して大量の土壌を収容でき、環境を代表するサンプル13,36の処理を容易にすることです。Nelsonらによって提示された成功した結果33と、1H-NMR溶媒としての重水素化クロロホルムの利用可能性に基づいて、クロロホルム-メタノール溶媒溶液を選択しました。我々は、単純な溶媒振盪法と比較して、Nelsonらに記載されているプロトコル33に準拠した溶媒 - マトリックス混合物の超音波処理をテストし、2つの方法間でPBAT回収率に大きな差は見られませんでした。その結果、200rpmで8時間の振とうを行うと、試験した3つの土壌について、100gの土壌マトリックス中の土壌凝集体を壊すのに十分である一方で、振とう時間が短いか、振とう速度が遅いだけでは不十分であることがわかりました。その後、土壌粒子を含まない溶媒を回収するために、沈降が必要でした。PBATの回収率はナノサイズのプラスチックで試験され、MPの回収率よりも大幅に低かった。つまり、未知のNPの環境サンプルを正確に定量するには、この方法をさらに開発する必要があるかもしれませんが、この方法では粒子サイズ情報を取得できない場合でも、NPの部分的な回収と測定は、他のサイズ制限のある方法と比較して依然として価値があります。
Nelsonら33は、超音波抽出法の抽出効率が100%に近いと報告しましたが、超音波処理とここに記載されているシェーカーベースの抽出方法の両方が抽出効率を100%を大幅に下回ることがわかりました。これは、プラスチックマルチの光酸化を含む環境風化の影響によるものと考えています。Nelson et al.33 は、UV 照射 PBAT MP の抽出効率が非耐候性材料と比較して大幅に低下していることを観察しました。この定量化方法のテストに使用したプラスチックは、MPに加工される前に、生育期全体にわたって日光の下で圃場風化されました。市販のプラスチックマルチフィルムに光安定剤が添加されているにもかかわらず、マルチのポリマーの構造は、環境風化条件での紫外線(例えば、材料のゲル含有量を増加させる鎖架橋)46、およびポリマーの劣化により、そのNMRスペクトルを変化させる可能性がある47。これは、Nelson et al.33と比較して観察されたPBAT回復率が低いことに寄与している可能性があります。また、PBATの抽出効率は、テストした3つの土壌間で異なることもわかりました。日陰の土壌には主に低活性粘土が含まれていますが、他の2つの土壌にはスメクタイト粘土(Los Osos)と混合した超活性粘土(Elkhorn)があります。高活性と2:1の粘土鉱物の存在が、これらの土壌からのPBATの溶媒抽出を阻害した可能性があります33,48、観察されたPBAT回収率の低下につながった可能性があります。PBATを含む生分解性MPおよびNPs、および従来の非分解性ポリマーMPおよびNPについて、土壌中のプラスチックと鉱物の関連を調査するさらなる研究をお勧めします。これは、MPポリマーを土壌から抽出および測定する方法を理解するため、また、MPポリマーが生分解したり、土壌システムにどのように影響を及ぼすかを理解するために重要です。
NMRスペクトル取得プロセスの主な要素には、装置の磁石強度、使用したスキャンの数、スキャン間のサンプル緩和時間、サンプルあたりの合計測定時間などがあります。500MHzの分光計を使用しました。磁場強度が高いほど、NMRスペクトルの感度と分解能が向上します。スペクトルのS/N比は、同じサンプルの繰り返しスキャンを収集し、それらを合計することで向上させることができます。n個のスキャンを収集すると、S/N比は√n倍に増加しますが、測定時間はn倍に増加します29。つまり、サンプル中のPBATを定量化するためにより高いS/N比が必要な場合、スキャンの回数を増やすことができますが、その代償としてサンプルの実行時間が長くなります。特定の信号に対する150の信号対雑音比は、定量化44で誤差<1%を維持するために必要である。当社の取得パラメーター(装置、プローブ、スキャン回数)では、150のS/N比を得るためには、サンプルあたり約5 mgのPBAT(または抽出物1 mLあたり50 μg PBAT)が必要であり、したがって定量で<1%の誤差がありました。この濃度は、当社のデータ収集設定に固有のものです。このPBAT濃度は、土壌16,24の非存在下で他のタイプのMPを定量するために1H-NMRを使用して他の人が達成した定量限界よりも高く、土壌有機物や他の共抽出化合物が定量法に与える影響を示しています。PBATの定量可能な範囲は、サンプルあたり25 mg(抽出物1 mLあたり250 μg PBAT)を超えるPBAT濃度で線が広がるため、上端でも制限されます。これにより、代表的な結果で説明され、補足図3に示されているように、PBATピークのオーバーラップが発生しました。ただし、この方法では、サンプルを定量化できるように、これらの制限に柔軟に対応することができます。抽出物の作成に使用される土壌の量は増減することができ、抽出物を希釈して再分析し、PBAT濃度を最適な範囲内に調整することができます。
NMRスペクトルに基づいてPBATを定量するプロセスの主要な要素には、PBATの定量に使用されるピーク、ピーク面積を計算するためのラインフィッティングの使用、および検量線が含まれます。概念的には、PBATピークとDMBピークの任意のペアを比較して、サンプル中の2つの化合物の比率を計算できます。最も正確な結果を得たのは、BT:DMB比を5:Aのピーク面積と5:Bのピーク面積(それぞれの陽子数で正規化)の平均として計算したときでした。PBAT ピーク 5 は 1,4-ブタンジオールテレフタレート(BT)モノマーの定量のみを提供するため、3 および 3' ピークの面積(1,4-ブタンジオールアジピン酸またはBAモノマーを表す)を 6 および 6' ピークの面積(BT モノマーを表す)と比較して、サンプル中に存在する BA 基を定量しました。BTとBAの量を合計して、PBATの残り量の合計を表しています。BA 定量では、共抽出された化合物(土壌有機物と仮定)の干渉により PBAT ピーク 1 または 2 を使用することはできませんでした。これにより、2.7 〜 0.7 ppm の範囲に複数の広範なピークが生成されました。バックグラウンド補正を使用してスペクトルからこれらの不要な信号を削除する(つまり、各サンプルスペクトルから空白のスペクトルを差し引く)ことを検討しましたが、キャリブラントを使用せずに同等の同等のバックグラウンドスペクトルとサンプルスペクトルを作成することは信頼性が低いことがわかりました。ラインフィッティングは、スペクトルピークを直接積分するのではなく、フィットしたピークの面積を計算するために使用されました。PBAT 3 と 3' のピーク間、および 6 と 6' のピークが重なっているため、予備分析に基づく PBAT 含有量の推定値の精度が向上しました。異なる土壌からのPBATの異なる回収率を考慮して、検量線を作成することをお勧めします。PBATの回収率は、試験した3つの土壌のうち1組で有意に異なり、これは検量線の傾きの95%信頼区間が重複しないことで示されています。第3の土壌でのPBATの回復は、他の2つの土壌のいずれとも有意差はありませんでした。土壌組成がPBATの回復にどのように影響するかについてのメカニズム的な理解がない場合、関心のある各土壌シリーズおよび土壌プロファイル内の各ホライゾンでPBATの回復を評価するための較正曲線を作成することをお勧めします。土壌間で検量線が統計的に類似していることが判明した場合、土壌を組み合わせて簡単に分析できます。
この方法は、土壌中のPBATのMPおよびNPの定量化、特に類似の土壌で収集された多数のサンプルのPBATの定量化、たとえば長期的なプラスチック生分解フィールド研究に関心のある人々にとって貴重なツールを提供できると考えています。土壌中のMPを定量化するNMR法は、NMRへのアクセスと専門知識を持つ研究者が、土壌システムにおけるMPの存在と挙動に関する重要な質問に答えることで、新興分野のニーズを満たすことができるという点で価値があります。装置や専門知識へのアクセスは、研究者の定量技術の選択を制限する最初の実用的な懸念事項の一部となる可能性がありますが、NMRは、あらゆる条件下で土壌からマイクロプラスチックを定量するための最も効率的で最適なツールではありません。粒子の形状とサイズの情報は、溶媒抽出技術では取得できません。MPの形状とサイズに関心がある場合、研究者はFTIRやラマン分光法などの個々のMP粒子を識別する技術の方が適しています。FTIRやラマン分光法などの他のMP定量アプローチと比較した場合、ここやNelsonら33 で紹介されているような溶媒抽出法の利点の1つは、定量化できるMPとNPに概念的にサイズ制限がないことです。溶媒抽出は、粒子径情報が必要ない場合や、目的の粒子を他の手段で分離するのが難しすぎる場合に最も有益です。熱分解GCMSはNMRよりも感度が高いため、価値があるかもしれませんが、PBAT溶媒抽出がそうである可能性が高いため、結果はマトリックス効果にも左右されます。
さらなる研究により、NMRスペクトルのPBATピーク分解能を妨げる共抽出土壌成分に対処することにより、この方法の堅牢性が向上することを期待しています。この方法によるPBATプラスチックの耐候性と抽出効率の関係を確立するには、さらなる研究が必要であり、おそらくPBAT分解生成物とその1H-NMRスペクトルのより詳細な理解を伴うでしょう。私たちの結果とNelsonらの結果33に基づくと、この定量化手順は、有機物が少なく、高活性粘土を含まない土壌中の風化していないPBATプラスチックを定量するのに最も効果的です。この方法は、土壌からのPBATベースのMPを定量するためにのみ使用しましたが、溶媒抽出および1H-NMR定量手順は、追加の土壌から他のMPおよびNPを定量するのに役立つ可能性があります26,49。この分析法を別のポリマー製のMPに拡張するには、ポリマーの溶媒への溶解性を確保し、選択した溶媒中のポリマーから特徴的なNMRピークを特定する必要があります。選択した溶媒に可溶性で、対象ポリマー42のピークと重なるピークを生じない新しい内部キャリブラントを選択する必要があるかもしれない。
開示事項
著者らは、この論文で報告された研究に影響を与えたと思われる可能性のある既知の競合する金銭的利益や個人的な関係がないことを宣言します。
謝辞
このプロジェクトに資金を提供してくださったUSDA-NIFAには、SMSへの賞番号2020-67019-31167、およびテネシー大学戦略計画研究イニシアチブ(SPRINT)プログラムの内部助成金DGHおよびSMSに感謝します。資金提供者は、研究デザイン、データ収集、分析、解釈、レポート作成、または論文の出版のための提出の決定に関与していませんでした。
資料
| Name | Company | Catalog Number | Comments |
| 1,4-dimethoxybenzene | Arcos Organics 99%+ | AC115411000 | 1 mg per sample |
| Amber glass bottle with PTFE lined lid (1 L) | Kimble | 5223253C-26 | reusable |
| Chloroform; trichloromethane | Fisher Chemical | AA43685M6 | 90 mL per sample; Fisher Optima |
| Deuterated chlorform; trichloro(deuterio)methane | Sigma Aldrich | 1034200025 | 1 mL per sample; minimum 99.8% deuterated; stabilized with silver |
| Glass beads (3 mm diameter) | Propper Manufacturing | 3000600 | 20 per sample |
| Glass extraction jars with PTFE lined lid (~250 mL volume) | Kimble | 5510858B | 2 per sample, reusable |
| Graduated cylinder, 1 L, polypropylene | Nalgene | 3662-1000 | reusable |
| Graduated cylinder, 500 mL, polypropylene | Nalgene | 3662-0500 | reusable |
| Methanol | Fisher Chemical | A412-4 | 20 mL per sample; certified ACS |
| Micropipette wth range of 0.5 - 1 mL | Fisher Scientific | 3123000063 | reusable |
| NMR spectrometer | Bruker | n/a | 500 MHz instrument |
| NMR tube (7 inch height, high-throughput) | Wilmad | WG-1000-7 | 1 per sample |
| Platform shaker | Eppendorf, Excella E5 | M1355-0000 | reusable |
| Polyethylene pipette tip (10 mL volume) | Eppendorf | 22492098 | 1 per sample, single use |
| Polypropylene micropipette tips (1 mL volume) | Fisher Scientific | 02-707-510 | 3 per sample, single use |
| Semi-microbalance | Mettler Toledo | 30532226 | reusable |
参考文献
- Andrady, A. L. The plastic in microplastics: A review. Mar Pollut Bull. 119 (1), 12-22 (2017).
- Fakour, H., et al. Quantification and analysis of microplastics in farmland soils: Characterization, sources, and pathways. Agriculture. 11 (4), 330(2021).
- Wang, K., et al. Impact of long-term conventional and biodegradable film mulching on microplastic abundance, soil structure and organic carbon in a cotton field. Environ Pollut. 356, 124367(2024).
- Plastics Europe Plastics - the Facts. , Plastics Europe. Available from: https://plasticseurope.org/knowledge-hub/plastics-the-facts-2022/ (2022).
- Assessment of agricultural plastics and their sustainability: A call for action. , Food Agriculture Organization. Rome. (2021).
- Beriot, N., et al. Intensive vegetable production under plastic mulch: A field study on soil plastic and pesticide residues and their effects on the soil microbiome. Sci Total Environ. 900, 165179(2023).
- Liu, E. K., He, W. Q., Yan, C. R. White revolution to white pollution - Agricultural plastic film mulch in China. Environ Res Lett. 9 (9), 091001(2014).
- Sintim, H. Y., et al. Release of micro- and nanoparticles from biodegradable plastic during in situ composting. Sci Total Environ. 675, 686-693 (2019).
- Skoczinski, P., et al. Bio-based building blocks and polymers - Global capacities, production and trends 2023-2028. Indust Biotech. 20 (2), 52-59 (2024).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Li, C., et al. Effects of biodegradable mulch on soil quality. Appl Soil Ecol. 79, 59-69 (2014).
- Wang, F., Wang, Q., Adams, C. A., Sun, Y., Zhang, S. Effects of microplastics on soil properties: Current knowledge and future perspectives. J Hazardous Mater. 424, 127531(2021).
- Möller, J. N., Löder, M. G. J., Laforsch, C. Finding microplastics in soils: A review of analytical methods. Environ Sci Technol. 54 (4), 2078-2090 (2020).
- Paul, A., Wander, L., Becker, R., Goedecke, C., Braun, U. High-throughput NIR spectroscopic (NIRS) detection of microplastics in soil. Environ Sci Pollut Res. 26 (8), 7364-7374 (2019).
- Wortman, S. E., Jeske, E., Samuelson, M. B., Drijber, R. A new method for detecting micro-fragments of biodegradable mulch films containing poly(butylene adipate-co-terephthalate) (PBAT) in soil. J Environ Quality. 51 (1), 123-128 (2021).
- Peez, N., et al. Quantitative analysis of PET microplastics in environmental model samples using quantitative 1H-NMR spectroscopy: Validation of an optimized and consistent sample clean-up method. Anal Bioanal Chem. 411 (28), 7409-7418 (2019).
- Praveena, S. M., Aris, A. Z., Singh, V. Quality assessment for methodological aspects of microplastics analysis in soil. Trend Environ Anal Chem. 34, e00159(2022).
- Primpke, S., et al. Critical assessment of analytical methods for the harmonized and cost-efficient analysis of microplastics. Appl Spectro. 74 (9), 1012-1047 (2020).
- Käppler, A., et al. Analysis of environmental microplastics by vibrational microspectroscopy: FTIR, Raman or both. Anal Bioanal Chem. 408 (29), 8377-8391 (2016).
- Watteau, F., Dignac, M. F., Bouchard, A., Revallier, A., Houot, S. Microplastic detection in soil amended with municipal solid waste composts as revealed by transmission electronic microscopy and pyrolysis/GC/MS. Front Sustainable Food Syst. 2, 407866(2018).
- Pfohl, P., et al. Microplastic extraction protocols can impact the polymer structure. Microplastics Nanoplastics. 1 (1), 1-13 (2021).
- Xu, J. L., Thomas, K. V., Luo, Z., Gowen, A. A. FTIR and Raman imaging for microplastics analysis: State of the art, challenges and prospects. Trend Anal Chem. 119, 115629(2019).
- Cardoza, L. A., Korir, A. K., Otto, W. H., Wurrey, C. J., Larive, C. K. Applications of NMR spectroscopy in environmental science. Prog Nucl Magnetic Resonance Spectr. 45 (3-4), 209-238 (2004).
- Peez, N., Rinesch, T., Kolz, J., Imhof, W. Applicable and cost-efficient microplastic analysis by quantitative 1H-NMR spectroscopy using benchtop NMR and NoD methods. Magnetic Resonance Chem. 60 (1), 172-183 (2022).
- Günther, M., Imhof, W. Simultaneous quantification of microplastic particles by non-deuterated (NoD) 1 H-qNMR from samples comprising different polymer types. Analyst. 148 (5), 1151-1161 (2023).
- Papini, G., Petrella, G., Cicero, D. O., Boglione, C., Rakaj, A. Identification and quantification of polystyrene microplastics in marine sediments facing a river mouth through NMR spectroscopy. Marine Pollut Bull. 198, 115784(2024).
- Herrera, R., Franco, L., Rodríguez-Galán, A., Puiggalí, J. Characterization and degradation behavior of poly(butylene adipate-co-terephthalate)s. J Polymer Sci Part A. 40 (23), 4141-4157 (2002).
- Mauel, A., Pötzschner, B., Meides, N., Siegel, R., Strohriegl, P., Senker, J. Quantification of photooxidative defects in weathered microplastics using 13 C multiCP NMR spectroscopy. RSC Adv. 12 (18), 10875-10885 (2022).
- Bharti, S. K., Roy, R. Quantitative 1H NMR spectroscopy. Trend Anal Chem. 35, 5-26 (2012).
- Li, X., Hu, K. Quantitative NMR Studies of Multiple Compound Mixtures. Ann Rep NMR Spectro. 90, 85-143 (2017).
- Simmler, C., Napolitano, J. G., McAlpine, J. B., Chen, S. N., Pauli, G. F. Universal quantitative NMR analysis of complex natural samples. Curr Opinion Biotechnol. 25, 51-59 (2014).
- Giraudeau, P. Challenges and perspectives in quantitative NMR. Magnetic Reason Chem. 55 (1), 61-69 (2017).
- Nelson, T. F., Remke, S. C., Kohler, H. P. E., McNeill, K., Sander, M. Quantification of Synthetic Polyesters from Biodegradable Mulch Films in Soils. Environ Sci Technol. 54, 266-275 (2020).
- Brandolini, A. J., Hills, D. D. NMR spectra of polymers and polymer additives. , CRC Press. Boca Raton. (2000).
- Matsuda, H., Asakura, T., Miki, T. Triad sequence analysis of poly(ethylene/butylene terephthalate) copolymer using 1H NMR. Macromolecules. 35 (12), 4664-4668 (2002).
- Yu, Y., Flury, M. How to take representative samples to quantify microplastic particles in soil. Sci Total Environ. 784, 147166(2021).
- Cambardella, C. A., et al. Field-scale variability of soil properties in central Iowa soils. Soil Sci Soc Am J. 58, 1501-1511 (1994).
- Ramsey, M. H., Argyraki, A. Estimation of measurement uncertainty from field sampling: Implications for the classification of contaminated land. Sci Total Environ. 198 (3), 243-257 (1997).
- Desaules, A. Critical evaluation of soil contamination assessment methods for trace metals. Sci Total Environ. 426, 120-131 (2012).
- Pennock, D., Yates, T., Braidek, J. Soil Sampling Designs. Soil Sampl Meth Anal. , 25-38 (2006).
- Büks, F., Kaupenjohann, M. Global concentrations of microplastics in soils - A review. SOIL. 6 (2), 649-662 (2020).
- Bowen, M., O'Neill, I., Pringuer, M. Quantitiative Applications of Nuclear Magnetic Resonance in Pharmaceutical Analysis. Proc Soc Anal Chem. , 294-297 (1974).
- Frank, O., Kreissl, J. K., Daschner, A., Hofmann, T. Accurate determination of reference materials and natural isolates by means of quantitative 1H NMR spectroscopy. J Agri Food Chem. 62 (12), 2506-2515 (2014).
- Malz, F., Jancke, H. Validation of quantitative NMR. J Pharma Biomed Anal. 38 (5), 813-823 (2005).
- Astner, A. F., et al. Forming micro-and nano-plastics from agricultural plastic films for employment in fundamental research studies. J Vis Exp. (185), e641112(2022).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. J Polymer Environ. 29 (9), 2916-2931 (2021).
- Deshoulles, Q., et al. Hydrolytic degradation of biodegradable poly(butylene adipate-co-terephthalate) (PBAT) - Towards an understanding of microplastics fragmentation. Polymer Degrad Stability. 205, 110122(2022).
- Zhang, Y., et al. Aging significantly increases the interaction between polystyrene nanoplastic and minerals. Water Res. 219, 118544(2022).
- Peez, N., Janiska, M. C., Imhof, W. The first application of quantitative 1H NMR spectroscopy as a simple and fast method of identification and quantification of microplastic particles (PE, PET, and PS). Anal Bioanal Chem. 411 (4), 823-833 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved