Method Article
Quantificazione di micro e nanoplastiche a base di polibutilene adipato tereftalato dal suolo mediante spettroscopia di risonanza magnetica nucleare protonica
In questo articolo
Riepilogo
Qui viene descritto un metodo per quantificare le micro e nanoplastiche originate dal polibutilene adipato tereftalato nel suolo utilizzando la spettroscopia di risonanza magnetica nucleare. Questa tecnica migliora la metodologia esistente perché si estende alla quantificazione delle nanoplastiche e può essere facilmente adattata per l'elaborazione di campioni ambientali in massa.
Abstract
Per valutare con precisione la degradazione e l'impatto ambientale dei prodotti in plastica biodegradabile è necessario un metodo per recuperare e quantificare le micro e nanoplastiche (MP e NP) che si formano nel suolo durante la biodegradazione. La presenza di MP e NP nel suolo può alterare le proprietà del suolo come il comportamento di aggregazione o avere effetti tossici sul biota del suolo. I metodi di recupero MP esistenti non sono sempre adatti per misurare polimeri biodegradabili come il polibutilene adipato tereftalato (PBAT); alcune comuni procedure di digestione con acidi o ossidanti possono distruggere le MP biodegradabili a base di PBAT. I metodi di identificazione come la spettroscopia micro-FTIR e micro-Raman sono inoltre limitati dalla dimensione minima delle particelle che possono essere recuperate e analizzate. Pertanto, questo metodo è stato sviluppato per estrarre e quantificare il PBAT dal suolo per valutare la frazione di massa di MP e NP nel suolo senza trasformare chimicamente il PBAT. Nel protocollo, una soluzione di cloroformio-metanolo viene utilizzata per estrarre selettivamente il PBAT dal suolo. Il solvente viene evaporato dall'estratto, quindi l'estratto viene ridisciolto in cloroformio deuterato. L'estratto viene analizzato mediante spettroscopia di risonanza magnetica nucleare protonica (1H-QNMR) secondo parametri quantitativi per quantificare la quantità di PBAT in ciascun campione. L'efficienza dell'estrazione con solvente per PBAT varia dal 76% in un terreno argilloso ombreggiato al 45% in un terreno argilloso sabbioso Elkhorn. Il recupero di PBAT può essere ridotto per i materiali foto-ossidati rispetto a quelli incontaminati e può essere ridotto nei terreni con alto contenuto di argilla. Le efficienze di estrazione non dipendono dalla concentrazione di PBAT all'interno dell'intervallo di prova, ma sono state osservate efficienze di estrazione inferiori per le NP rispetto alle MP. I risultati della quantificazione del PBAT sono stati paragonabili alla quantificazione della degradazione della plastica misurando la respirazione cumulativa del suolo in uno studio di incubazione di laboratorio.
Introduzione
I metodi per misurare la contaminazione da MP nel suolo sono necessari per comprendere la portata della contaminazione da plastica nei suoli globali1, le fonti di contaminazione da plastica2 e le potenziali soluzioni3. I suoli agricoli sono esposti in modo univoco alla contaminazione da plastica: ogni anno nel 2021 vengono utilizzate in agricoltura più di 15 milioni di tonnellate di plastica4, di cui 2,5 milioni di tonnellate di pacciame di plastica5. Il pacciame di plastica viene utilizzato a stretto contatto con il terreno, riapplicato una o più volte all'anno6 e può essere difficile da rimuovere completamente dal terreno dopo la loro vita utile7. Un'area chiave in cui sono necessari metodi di misurazione MP è la valutazione di prodotti in plastica biodegradabile come i pacciami in plastica biodegradabile per l'uso nei sistemi vegetali8.
I prodotti in plastica biodegradabile nel suolo sono alternative promettenti alla plastica agricola convenzionale perché potrebbero eliminare la contaminazione da plastica del suolo mediante pacciamatura di plastica se funzionano come previsto. Nel 2022 sono state prodotte meno di 1 milione di tonnellate di plastica biodegradabile a livello globale, con una rapida crescita prevista per il settore9. I quattro polimeri biodegradabili più comuni, acido polilattico (PLA), amido polimerizzato, poliidrossialcanoati (PHA) e polibutilene adipato tereftalato (PBAT), sono tutti utilizzati commercialmente o sperimentalmente nelle pacciamature di plastica biodegradabile in agricoltura10. Nonostante le loro promesse, la degradazione di questi prodotti in plastica biodegradabile in condizioni di campo è variabile11. Mentre alcuni studi sulla degradazione del pacciame plastico biodegradabile in campo si sono concentrati sui frammenti macroplastici11, la valutazione della completa degradazione dei materiali plastici richiede la capacità di recuperare MP e NP dal suolo. La quantificazione delle microplastiche dal suolo è importante anche per valutare i potenziali impatti negativi sugli ecosistemi del suolo derivanti dall'inquinamento da MP12.
Alcune tecniche comunemente utilizzate per l'identificazione e la quantificazione delle MP includono l'analisi visiva, la spettroscopia infrarossa trasformata in micro-Fourier (μFTIR), la spettroscopia micro-Raman (μRaman), la gascromatografia-spettroscopia di massa (GCMS che include la pirolisi GCMS e la GCMS di desorbimento per estrazione termica) e l'analisi termogravimetrica13. Altre tecniche in via di sviluppo includono la spettroscopia nel vicino infrarosso per la misurazione in situ di MP nei suoli14, l'estrazione di esterificazione metilica degli acidi grassi per l'analisi GCMS15 e la spettroscopia di risonanza magnetica nucleare16. Ben il 90% degli studi che quantificano le MP nel suolo ha utilizzato l'analisi visiva (da sola o in coppia con altre tecniche) per identificare le particelle di plastica, mentre il 77% ha utilizzato tecniche di spettroscopia FTIR, Raman o GCMS17. Lo sviluppo e l'armonizzazione di una varietà diversificata di tecniche di quantificazione MP può aiutare ad ampliare la capacità della comunità scientifica di rispondere a diverse domande di ricerca sulle microplastiche18. Esistono tre approcci generici per preparare campioni di terreno per quantificare le microplastiche: 1) separare singole particelle di microplastica immutate dal suolo (es. mediante separazione per densità), 2) estrarre materiale plastico o polimerico trasformato (es. per dissoluzione) o 3) analizzare il suolo sfuso. Sia la spettroscopia μFTIR che quella μRaman richiedono che le singole MP siano separate dal suolo prima di poter essere identificate chimicamente19, mentre il piro-GCMS può essere eseguito su particelle di plastica isolate separate dal suolo o dal suolo sfuso20. Separare gli MP biodegradabili dal suolo può essere difficile perché alcune digestioni utilizzate per rimuovere la materia organica del suolo possono degradare o alterare chimicamente i polimeri biodegradabili, incluso il PBAT21. La spettroscopia micro-Raman e μFTIR ha entrambe un limite di risoluzione spaziale: le particelle devono essere più grandi di 10-20 μm per μFTIR e 1 μm per μRaman (se singole particelle così piccole possono essere preparate per l'analisi)19,22. Queste tecniche possono fornire l'identificazione chimica dei polimeri MP e l'imaging spettroscopico può essere impiegato per misurare la dimensione MP22. Tutti i tipi di piro-GCMS sono limitati in quanto i campioni vengono distrutti durante l'analisi.
La risonanza magnetica nucleare è stata utilizzata con successo per caratterizzare i costituenti e i contaminanti del suolo23, per quantificare le MP 16,24,25,26 e per valutare la degradazione del PBAT e di un altro polimero, il polistirene 27,28. Quando viene eseguita con parametri quantitativi, la spettroscopia 1H-NMR produce spettri in cui l'area di ciascun picco spettrale è direttamente proporzionale al numero di idrogeni che contribuiscono nel campione; Ciò consente di quantificare i componenti costitutivi in un campione29. La RMN è una tecnica analitica preziosa per quantificare alcune MP, tra cui il PBAT, all'interno del suolo perché consente la quantificazione e l'identificazione simultanee, è adatta per miscele complesse e impure e non richiede standard di riferimento chimicamente identici30,31. La spettroscopia NMR di un estratto di solvente potrebbe quantificare MP o NP più piccoli di quelli che possono essere elaborati per la quantificazione μFTIR, μRaman o GCMS. Nonostante questi vantaggi, gli approcci NMR quantitativi forniscono ancora sensibilità inferiori rispetto agli approcci basati sulla spettroscopia di massa distruttiva32.
Il metodo proposto, schematizzato nella Figura 1, descrive un flusso di lavoro per elaborare e analizzare campioni di terreno contenenti PBAT, comprese le plastiche PBAT di dimensioni nanometriche. Nel metodo, il polimero PBAT viene estratto da campioni di terreno agitando il terreno con una miscela di cloroformio e metanolo. Gli estratti solventi contenenti PBAT vengono essiccati e poi ridisciolti in cloroformio deuterato con l'aggiunta di un calibrante interno. La spettroscopia NMR viene condotta sugli estratti utilizzando parametri quantitativi. Gli spettri risultanti vengono analizzati per quantificare il PBAT confrontando l'area dei picchi adattati corrispondenti agli atomi di idrogeno del PBAT e alle molecole calibranti. Questo metodo applica l'approccio dell'estrazione con solvente e della spettroscopia di risonanza magnetica nucleare protonica (1H-NMR) dimostrato da Nelson et al.33. L'obiettivo era quello di impiegare un metodo adatto a processare campioni su scala ambientale (~100 g di terreno) e di elaborare un numero di campioni in parallelo senza attrezzature di estrazione specializzate.
Protocollo
1. Raccolta e preparazione del terreno
NOTA: Le apparecchiature di campionamento e trattamento non devono contenere il polimero PBAT o i suoi costituenti per evitare la contaminazione del campione. Altri materiali polimerici non interferiscono necessariamente con la quantificazione del PBAT dal suolo. Ad esempio, il polietilene e il polipropilene non producono picchi spettrali nel cloroformio 1H-NMR che interferiscono con la quantificazione del PBAT34, ma il polietilene tereftalato, con il suo gruppo tereftalato, molto probabilmente interferirebbe35, così come altri poliesteri. Testi di riferimento come Brandolini e Hills34 possono essere utilizzati per determinare gli spettri 1H-NMR di vari polimeri e per individuare i picchi sovrapposti con i picchi PBAT utilizzati per la quantificazione (descritti di seguito).
- Raccogliere almeno 100 g di peso secco equivalente di terreno per ogni campione. Determinare la dimensione del campione di suolo in base alla concentrazione prevista di plastica al fine di raccogliere un campione rappresentativo e omogeneizzare il terreno per raccogliere un sottocampione, se necessario36.
NOTA: I sistemi del suolo sono intrinsecamente eterogenei37, così come le distribuzioni dei contaminanti (ad esempio, le MP) al loro interno38. Esiste anche una variabilità associata ai metodi utilizzati per misurare le concentrazioni di contaminanti39. Pertanto, si raccomanda di creare un disegno di campionamento o un disegno sperimentale che includa campioni replicati come strumento per stimare l'incertezza e raccogliere volumi di campione rappresentativi in base alla concentrazione di plastica40. È stato documentato che le concentrazioni di MP nel suolo variano da quasi zero a 1 x 107 elementi per kg di suolo, con la maggior parte dei siti che contengono meno di 10.000 elementi per kg di suolo41. Un volume elementare rappresentativo teorico potrebbe variare da 23 m2 a una concentrazione di MP di 10 elementi per metro quadrato a 0,02 m2 quando le concentrazioni di MP sono 10.000 elementi per metro quadrato36.- Per aumentare l'area di campionamento effettiva da un sito sul campo, riducendo al minimo la quantità di terreno che deve essere lavorata, raccogliere il terreno da un'ampia area (ad esempio, 1 m2), quindi utilizzare il metodo del quartiering per omogeneizzare e consolidare il campione (ad esempio, fino a 500 g di terreno)36.
- Nel metodo di squartamento, ammucchiare il terreno da una vasta area su un telo o un'altra superficie, mescolare accuratamente con una pala, quindi dividere in quarti. Conservare un quarto del campione e scartare gli altri tre quarti. Ripetere questo processo fino a quando il campione non raggiunge la dimensione desiderata.
- Setacciare il terreno attraverso un setaccio a maglie da 2 mm. Pulire completamente il setaccio e la vaschetta di raccolta tra i campioni di terreno.
- Asciugare il terreno all'aria, quindi conservare in sacchetti per campioni sigillati. Il terreno asciutto può essere conservato in questo stato prima dell'estrazione del PBAT.
2. Estrazione di PBAT dai suoli
ATTENZIONE: Il cloroformio è volatile e tossico. Conservalo al buio in vetro ambrato, lontano da ossidanti. Durante il lavoro, indossare guanti, protezione per gli occhi e indumenti protettivi adeguati. Maneggiarlo solo in una cappa aspirante. Il metanolo è infiammabile, volatile e tossico. Conservare il metanolo in un armadio ignifugo. Durante il lavoro con il metanolo, indossare guanti adeguati, protezione per gli occhi e indumenti protettivi. Maneggiare il metanolo solo in una cappa aspirante. La vetreria può rompersi e causare lesioni. Indossare una protezione per gli occhi quando si maneggia la vetreria. Evitare di toccare i vetri rotti a mani nude. Invece, pulisci i vetri rotti con guanti, pinze, scopa o un altro strumento resistenti al taglio.
NOTA: Il cloroformio non è compatibile con la maggior parte delle plastiche o dei metalli. Assicurarsi che tutti i materiali siano compatibili (ad es. vetro o politetrafluoroetilene, plastica PTFE).
- In una cappa aspirante, preparare 100 mL di miscela 90:10 v/v di cloroformio (triclorometano; CHCl3) e metanolo (CH3OH) per campione da estrarre. Ad esempio, per estrarre da 5 campioni, mescolare 450 mL di cloroformio con 50 mL di metanolo.
- Aggiungere 100 g di terreno asciutto, 100 ml di soluzione di cloroformio-metanolo e 20 perle di vetro in un barattolo di estrazione di vetro. Sigillare ermeticamente i barattoli di estrazione con coperchi rivestiti in PTFE in modo che il vapore del solvente non possa fuoriuscire dai barattoli.
NOTA: Il PBAT è altamente solubile in cloroformio; È stata utilizzata una miscela di cloroformio e metanolo perché il metanolo può formare legami idrogeno con i soluti, competendo con i costituenti minerali e organici del suolo e aumentando il recupero di PBAT dal suolo33. - Utilizzare un tavolo vibrante per agitare le giare di estrazione per 8 ore a 200 giri/min. Dopo l'agitazione, lasciare riposare il terreno nelle giare di estrazione per almeno 4 ore.
- Separare l'estratto dal terreno. Nella cappa aspirante, stappare un barattolo di estrazione e trasferire il liquido con una pipetta attraverso un filtro di carta di qualità con una dimensione dei pori di 11 μm in un barattolo di vetro pulito etichettato. Registrare il volume di solvente recuperato dal barattolo di estrazione. Evitare di trasferire i solidi del suolo con l'estratto; lasciare qualche mL di solvente, se necessario.
NOTA: La carta da filtro ha lo scopo di rimuovere grandi pezzi di materia organica dalla soluzione solvente. - Essiccare gli estratti lasciandoli nella cappa fino alla completa evaporazione del solvente. Questa operazione può richiedere fino a 24 ore. Asciugare anche il terreno nella cappa aspirante. Una volta che il terreno è completamente asciutto, scartalo.
- Una volta che gli estratti sono asciutti, tappare ogni barattolo di campioni e conservarli in un luogo fresco, buio e asciutto fino al momento del bisogno.
3. Raccolta di spettri NMR
ATTENZIONE: Il cloroformio deuterato presenta gli stessi rischi e richiede le stesse precauzioni del cloroformio protonato descritto sopra.
- Aggiungere un calibrante interno42 al campione. Utilizzare una bilancia per pesare 1,00 mg di 1,4-dimetossibenzene (DMB; C6H14O) in ogni vasetto contenente un estratto secco.
- Risospendere il campione in cloroformio deuterato (CDCl3; tricloro(deutero)metano). Nella cappa aspirante, utilizzare una micropipetta per aggiungere 500 μl di cloroformio deuterato al barattolo con estratto di campione essiccato.
- Tappare il barattolo e agitare per sciogliere l'estratto secco picchiettando delicatamente il barattolo contro una mano o un piano di lavoro, circa 10 volte per lato. Quindi utilizzare un puntale di pipetta pulito per trasferire il liquido in una provetta NMR.
- Ripetere i passaggi 3.2 e 3.3 con altri 500 μl di cloroformio deuterato, aggiungendo la seconda porzione del campione alla stessa provetta NMR della prima. Il secondo risciacquo ha lo scopo di garantire la completa dissoluzione e il recupero dell'estratto secco dal contenitore.
- Tappare la provetta NMR e conservarla per 3 giorni prima di raccogliere gli spettri NMR. Il tempo di conservazione appropriato dipenderà dalla velocità di evaporazione del solvente dalla provetta NMR. Analizzare i campioni poco dopo averli preparati con cloroformio deuterato.
- Per trasportare i tubi NMR allo spettrometro, utilizzare un supporto progettato per sostenere i tubi lunghi e delicati. Questi in genere hanno un supporto vicino alla base e alla parte superiore del tubo. Mantenere i tubi in posizione verticale durante il trasporto.
- Utilizzando uno spettrometro NMR a 500 MHz, raccogliere uno spettro di protoni di 1H con un angolo di impulso di 90°29, una larghezza di impulso di 8 μs33, un tempo di ritardo di 25 s (determinato dall'esperimento di recupero dell'inversione29,43), 262K punti per scansione e 32 scansioni composite29,44 da 12 a -2 ppm per un tempo di esecuzione totale di 25 minuti.
NOTA: Abbiamo utilizzato uno spettrometro Bruker Neo 500 MHz con una sonda ottimizzata per la banda larga e un autocampionatore a una temperatura controllata di 300 K. Possono essere utilizzati altri spettrometri simili. Se si utilizza uno strumento con una diversa intensità del campo magnetico, il tempo di ritardo appropriato può essere calcolato in base al tempo di rilassamento T1 per PBAT e 1,4-dimetossibenzene utilizzando un esperimento di recupero per inversione29,43. - Dopo che il campione è stato eseguito, salvare, trasferire o accedere ai dati spettrali in base alle esigenze.
Ispeziona i dati spettrali. Verificare che tutti i picchi PBAT utilizzati nella quantificazione siano chiaramente risolti, se presenti. Utilizzare i picchi PBAT 5 (8,10 ppm), 6 (4,44 ppm), 6' (4,38 ppm), 3' (4,15 ppm) e 3 (4,09 ppm) per la quantificazione (dettagli nella Tabella 1). Utilizzare i picchi DMB A (6,84 ppm) e B (3,77 ppm) anche per la quantificazione (dettagli nella Tabella 2). Prendi particolare nota dei picchi di 6, 6', 3' e 3 di PBAT, che appaiono molto vicini tra loro e possono sovrapporsi. - Se alcuni picchi non vengono risolti in modo chiaro, diluire il campione. Combinare 100 μl di campione e 500 μl di cloroformio deuterato in una provetta NMR pulita ed eseguire nuovamente il campione secondo gli stessi parametri definiti al punto 3.7.
4. Analisi degli spettri NMR per quantificare il PBAT
NOTA: L'analisi spettrale può essere condotta in qualsiasi momento dopo la raccolta. L'analisi dei dati lo stesso giorno in cui vengono prodotti gli spettri è preferibile per garantire che i campioni siano ancora disponibili per la ripetizione in caso di problemi.
- Aprire il file FID creato dallo spettrometro nel software di elaborazione NMR FID (abbiamo usato MestreNova di MestreLab, altre opzioni ma altre opzioni sono disponibili).
- Applicare l'allargamento della linea agli spettri: nel software di elaborazione FID, selezionare Modello di elaborazione nel menu Elaborazione, quindi passare alla sezione Apodizzazione. Selezionare un modello esponenziale con una magnitudine di 0,5 Hz e un primo punto di 0,5 Hz.
- Per applicare la correzione di fase automatica, fare clic sul pulsante Correzione di fase automatica nel menu Elaborazione. Applicare la correzione automatica della linea di base facendo clic sul pulsante Correzione automatica della linea di base nel menu Elaborazione.
- Utilizzare la deconvoluzione dei picchi per adattare i picchi spettrali misurati: nella scheda Analisi del software di elaborazione degli spettri, nella sezione Fitting, fare clic sul pulsante New Fit . Utilizzare il cursore per fare clic sugli spettri con uno spostamento di 8,5 ppm, quindi trascinare il cursore su uno spostamento di 3,0 e rilasciare.
- Fare clic su Tabella raccordi linea nella sezione Raccordo per visualizzare tutti i picchi montati.
- Conservare i picchi utilizzati per la quantificazione come descritto nella Tabella 1 e nella Tabella 2 ed etichettati nella Figura 2. Utilizzare i picchi PBAT 5 (8,10 ppm), 6 (4,44 ppm), 6' (4,38 ppm), 3' (4,15 ppm) e 3 (4,09 ppm) nella quantificazione (dettagli nella Tabella 1), nonché i picchi DMB A (6,84 ppm) e B (3,77 ppm). Gli atomi di idrogeno che corrispondono a ciascun picco elencato nella Tabella 1 e nella Tabella 2 sono etichettati nei diagrammi strutturali della Figura 3, con la Figura 3A che mostra la struttura dei due dimeri PBAT, la Figura 3B che mostra come la posizione dei dimeri nel polimero interagisce per alterare lo spostamento del picco negli idrogeni dal monomero 1,4-butandiolo, e la Figura 3C che mostra la struttura della DMB.
- Elimina tutti gli altri picchi dall'adattamento selezionando i picchi indesiderati e facendo clic su Elimina picco.
- Utilizzare la tabella di raccordo per copiare l'area di ciascun picco in un'applicazione per fogli di calcolo per i calcoli (si è scelto di utilizzare un foglio di calcolo).
- Per copiare le aree dei picchi in un foglio di calcolo, selezionare innanzitutto tutte le informazioni sui picchi nella tabella dei raccordi delle linee. Quindi fai clic con il pulsante destro del mouse e scegli Copia dal menu a comparsa. Incolla i dati nel foglio di calcolo.
- Calcola il numero di moli di DMB aggiunte al campione, nDMB, usando l'equazione

dove mDMB è la massa di DMB aggiunta al campione in grammi (suggerita 1,00 mg) e MMDMB è la massa molare di DMB (138,17 g/mol). - Calcolare il numero di moli del dimero di butilene tereftalato di PBAT nel campione, nBT, utilizzando l'equazione

dove A5 è l'area misurata del picco PBAT 5, AA è l'area misurata del picco DMB A e AB è l'area misurata del picco DMB B. Le unità di area prodotte dal software di analisi spettrale sono arbitrarie. - Calcolare il numero di moli del dimero adipato di butilene di PBAT nel campione, nBA, utilizzando l'equazione

dove A3 è l'area misurata del picco PBAT 3, A3' è l'area misurata del picco PBAT 3', A6 è l'area misurata del picco PBAT 6 e A6' è l'area misurata del picco PBAT 6'. Le unità di area prodotte dal software di analisi spettrale sono arbitrarie. - Calcolare la massa di PBAT nel campione, mPBAT, recuperato, utilizzando l'equazione

dove MMBA è la massa molare di un dimero BA da PBAT (200 g/mol) e MMBT è la massa molare di un dimero BT da PBAT (220 g/mol). - Se nel campione era presente una quantità nota di PBAT, la percentuale di recupero, η, può essere calcolata per il campione come misura dell'efficienza di estrazione secondo l'equazione

- Calcolare la concentrazione di PBAT in un campione, CPBAT, utilizzando l'equazione

dove mterreno secco è la massa di terreno asciutto utilizzata per produrre l'estratto (0,1 kg), Vsolvente recuperato è il volume di solvente recuperato dal suolo nella fase 2.4 e Vsovlent aggiunto è la quantità iniziale di solvente aggiunta al campione di terreno (100 mL).
5. Preparazione della curva di calibrazione per la quantificazione del PBAT da un particolare terreno
NOTA: Una curva di calibrazione creata sulla base di campioni di terreno con l'aggiunta di quantità note di PBAT fornirà informazioni utili su come il PBAT viene estratto e recuperato da un particolare terreno. L'estrazione non è la stessa per tutti i terreni o tutte le forme di PBAT. Sospettiamo che l'efficienza dell'estrazione dipenda dal contenuto di argilla e materia organicadel suolo 33 e raccomandiamo di creare una curva di calibrazione per ogni serie di suolo e orizzonte di interesse. La curva di calibrazione può essere creata prima o dopo l'elaborazione di campioni sconosciuti con questo metodo.
- Raccogliere e preparare l'equivalente di 2,5 kg di terreno asciutto come descritto nei passaggi 1.1-1.3.
- Determinare l'intervallo che deve essere coperto dalla curva di calibrazione; la concentrazione massima di PBAT utilizzata nella curva di taratura deve essere superiore alla concentrazione più elevata di PBAT tra i campioni sconosciuti.
- Preparare o procurarsi una quantità sufficiente di plastica PBAT per creare 5 campioni addizionati di 100 g di terreno con 0%, 25%, 50%, 75% e 100% della concentrazione massima (25 campioni in totale). Ad esempio, se 40 mg/kg è la concentrazione massima desiderata, saranno necessari un totale di 50 mg di PBAT per creare i campioni addizionati.
- Preparare 25 campioni da 100 g di terreno ciascuno. Addizionare i campioni pesando la plastica a base di PBAT e aggiungendola ai campioni di terreno alle dosi prescritte. Ad esempio, se 40 mg/kg di PBAT è la concentrazione massima desiderata, creare 5 campioni senza PBAT, 5 campioni con 1 mg di PBAT, 5 campioni con 2 mg di PBAT, 5 campioni con 3 mg di PBAT e 5 campioni con 4 mg di PBAT. Dopo aver aggiunto il PBAT al terreno, mescola bene.
- Estrarre il PBAT dai 25 campioni addizionati, quindi raccogliere gli spettri NMR dagli estratti e analizzare gli spettri risultanti come descritto nei passaggi da 2.1 a 4.16.
- Identificare l'equazione di una curva di calibrazione per PBAT in questo terreno eseguendo una regressione lineare tra la quantità misurata di PBAT in ciascun campione addizionato e la quantità effettiva di PBAT aggiunta in uno strumento di analisi statistica. Abbiamo usato un foglio di calcolo. Se non viene rilevato alcun PBAT nei campioni con spike senza PBAT aggiunto, forza b = 0 nella regressione.
NOTA: Un test di regressione lineare valuta la forza della relazione lineare tra due variabili numeriche continue x e y, secondo la relazione y = mx + b. I valori di m e b che meglio si adattano ai dati vengono calcolati dal test. Il coefficiente r2 del test di regressione descrive quanto siano strettamente correlate tra loro le due variabili. - Verificare una relazione significativa tra l'efficienza di estrazione e la concentrazione di PBAT utilizzando lo strumento di analisi statistica. Calcolare l'efficienza di estrazione del PBAT dai campioni addizionati come

- Utilizza lo strumento di analisi statistica per calcolare la probabilità che i dati osservati possano verificarsi in modo casuale senza una correlazione tra l'efficienza di estrazione e la concentrazione di PBAT. Se questo valore p è maggiore della soglia di significatività predeterminata, α, allora non riesce a rifiutare l'ipotesi nulla che non vi sia alcuna relazione tra le due variabili. In questo caso, si può presumere che l'efficienza di estrazione sia costante per tutte le concentrazioni di PBAT all'interno dell'intervallo testato. Se l'ipotesi nulla viene rifiutata, il modello lineare qui descritto potrebbe non essere il modo migliore per modellare i dati.
- Utilizzare l'equazione di regressione lineare della curva di calibrazione per stimare la quantità di PBAT in campioni sconosciuti elaborati con questo metodo. Se la variabile x di regressione era la quantità effettiva di PBAT nei campioni con spike della curva di calibrazione, la variabile y era la quantità misurata di PBAT e b era impostata su 0, allora

NOTA: Il contenuto di PBAT dei campioni replicati stimato utilizzando un'equazione della curva di calibrazione può essere utilizzato per generare un intervallo di confidenza per la quantità di PBAT in un particolare terreno, oppure se è possibile calcolare una media e un intervallo di confidenza per le concentrazioni di PBAT negli estratti replicati, è possibile applicare la curva di calibrazione per stimare la concentrazione di PBAT nel suolo. Entrambi gli ordini di operazioni producono lo stesso intervallo di confidenza per il contenuto di PBAT nel suolo. Ad esempio, si considerino gli estratti di 10 campioni replicati con concentrazioni di PBAT di 10, 5, 2, 4, 10, 11, 2, 6, 8 e 5 mg/kg e l'equazione della curva di calibrazione y (PBAT misurato nell'estratto) = 0,75 x (PBAT reale nel suolo). Le concentrazioni di PBAT nel suolo in ciascuna replica potrebbero essere stimate come 13, 7, 3, 5, 13, 15, 3, 8, 11 e 7 mg/kg. Quindi la concentrazione media di PBAT nel suolo sarebbe stimata come 8,4 mg/kg con una deviazione standard di 4,4 mg/kg. Se si calcolano prima una media e una deviazione standard per le concentrazioni di PBAT dell'estratto (10, 5, 2, 4, 10, 11, 2, 6, 8 e 5), si calcola una media di 6,3 mg/kg e una deviazione standard di 3,3 mg/kg. Quindi, la curva di calibrazione potrebbe essere applicata sia alla media che alla deviazione standard per stimare la concentrazione di PBAT nel suolo: media di 8,4 mg/kg, deviazione standard di 4,4 mg/kg.
Risultati
Per valutare l'efficacia di questo metodo nella quantificazione del polimero PBAT dal suolo, sono state costruite curve di calibrazione estraendo PBAT da campioni addizionati creati da tre diversi terreni. Per ciascuno dei tre terreni (dettagli nella Tabella 3), il terreno è stato passato attraverso un setaccio da 2 mm e poi essiccato all'aria. I campioni addizionati sono stati creati aggiungendo 0, 9, 18, 27 o 36 mg di MP a base di PBAT a 100 g di terreno asciutto (5 repliche di ciascuno). Ciò equivale a 0, 63, 126, 189 o 252 mg/kg di polimero PBAT. Gli MP sono stati realizzati con pacciame di plastica con il 70% di PBAT in massa e 50 μm di spessore secondo la procedura di macinazione descritta in Astner et al.45 ed erano più piccoli di 840 μm. Per creare ogni curva di calibrazione, il PBAT è stato estratto da ciascun campione addizionato seguendo la procedura sopra definita. Il recupero di PBAT è stato quindi confrontato con la quantità di PBAT aggiunta a ciascun campione. Il tasso di recupero e la quantificazione dei PBAT sono stati testati anche per le NP (diametro medio 780 nm, indice di polidispersione 0,77, preparato secondo Astner et al.45) in un terreno (terriccio ombreggiato).
Per tutti i suoli, non è stato rilevato alcun PBAT nei campioni senza PBAT aggiunto, ovvero non sono stati osservati falsi positivi con questo metodo. La Figura 1 supplementare mostra uno spettro raccolto da un terreno argilloso ombreggiato che non conteneva PBAT (e conteneva DMB aggiunto durante il processo di preparazione). I due picchi caratteristici del calibratore interno DMB sono presenti, ma non i picchi caratteristici PBAT. Per i terreni con aggiunta di PBAT, erano presenti i cinque picchi caratteristici utilizzati per identificare il PBAT. La Figura 2 mostra uno spettro raccolto da un terreno argilloso ombreggiato con l'aggiunta di 63 mg/kg di PBAT. Tutti i picchi PBAT e DMB utilizzati nella quantificazione sono chiaramente risolti. La Figura 2 supplementare mostra la regione adattata dello spettro mostrata nella Figura 2 con i picchi integrati sovrapposti. A causa della sovrapposizione dei picchi di 3, 3', 6 e 6' con altri segnali nello spettro, è importante calcolare il contenuto di PBAT in base agli integrali dei picchi adattati piuttosto che ai semplici integrali di picco. Questo rimuove l'area fornita da altri costituenti dell'estratto del suolo e dai picchi PBAT sovrapposti. La Figura 3 supplementare mostra gli effetti della diluizione sulla risoluzione spettrale NMR. La figura mostra uno spettro raccolto da un terriccio sabbioso Elkhorn con l'aggiunta di 252 mg/kg di PBAT. Nel pannello A, i picchi PBAT di 3, 3', 6 e 6' nell'intervallo 4,5 - 4,0 ppm non possono essere risolti. La Figura 3B supplementare mostra uno spettro raccolto dallo stesso campione dopo che è stato diluito di 1:5 con ulteriore cloroformio deuterato. Dopo la diluizione, i quattro picchi sono distinti e la loro area può essere adattata.
Le curve di calibrazione variavano tra i tre terreni che abbiamo testato. La Figura 4 mostra le concentrazioni stimate di PBAT di ciascun suolo in base al PBAT misurato (CPBAT,m) in ciascun estratto rispetto alla quantità effettiva di PBAT (CPBAT,a) aggiunta al suolo. La quantità di PBAT recuperata dai terreni argillosi ombreggiati era fortemente correlata con la quantità di PBAT aggiunta (r2 = 0,99). Per l'equazione della curva di calibrazione CPBAT,m = m*CPBAT,a, m = 0,76 ± 0,02 (media ± un errore standard) e m era significativamente diverso da zero (df = 24; F = 2000; p < 1*10-16). Il PBAT è stato recuperato con un'efficienza di η = 76 % ± 10 % (media ± una deviazione standard) da questo suolo. L'efficienza di estrazione dal terreno ombreggiato non era correlata con la quantità di PBAT nei campioni (r2 = 0,009; p = 0,7). NP è stato recuperato con un'efficienza di η = 59 % ± 8 % (media ± una deviazione standard). La Figura 5 mostra l'efficienza di estrazione di MP e NP dal terriccio ombreggiato; l'efficienza era significativamente inferiore per NP (p = 0,0002). La quantità di PBAT recuperata dal terriccio di Los Osos era meno fortemente correlata con la quantità di PBAT aggiunta (r2 = 0,85) rispetto al suolo ombreggiato. Per l'equazione della curva di calibrazione CPBAT,m = m*CPBAT,a, m = 0,57 ± 0,05 (media ± un errore standard) e m era significativamente diverso da zero (df = 23; F = 100; p = 8*10-11). Il PBAT è stato recuperato con un'efficienza di η = 57 % ± 22 % (media ± una deviazione standard) da questo suolo. L'efficienza di estrazione nel suolo di Los Osos non era correlata con la quantità di PBAT nei campioni (r2 = 0,01; p = 0,6). La quantità di PBAT recuperata dal terriccio sabbioso di Elkhorn era fortemente correlata con la quantità di PBAT aggiunta (r2 = 0,88). Per l'equazione della curva di calibrazione CPBAT,m = m*CPBAT,a, m = 0,70 ± 0,05 (media ± un errore standard) e m era significativamente diverso da zero (df = 23; F = 200; p = 5*10-12). Il PBAT è stato recuperato con un'efficienza di η = 70 % ± 14 % (media ± una deviazione standard) da questo suolo. L'efficienza di estrazione non è stata correlata con la quantità di PBAT nei campioni (r2 = 0,006; p = 0,7) per il suolo di Elkhorn.
Inoltre, questo metodo è stato applicato per quantificare il PBAT in un suolo della serie Elkhorn. In questo esperimento, il terreno di Elkhorn è stato raccolto da due siti all'interno di un campo agricolo, setacciato attraverso un setaccio da 2 mm e poi essiccato all'aria. Il terreno è stato mescolato con pacciamatura a base di PBAT MP (creata come descritto sopra, diametro < 840 μm), con 50 mg di MP e 150 g di terreno asciutto in ciascun mesocosmo (250 mg/kg di PBAT) per creare 5 mesocosmi con MP mescolati al terreno dal sito A e 5 con MP mescolati al terreno dal sito B (10 in totale). Cinque mesocosmi composti da terreno di ciascun sito senza l'aggiunta di MP sono serviti come controllo negativo (10 in totale). I mesocosmi sono stati incubati per 6 mesi per studiare la biodegradazione degli MP di pacciamatura a base di PBAT. Durante l'incubazione, la respirazione cumulativa del suolo è stata misurata tramite le concentrazioni di CO2 nello spazio di testa (utilizzando un analizzatore di gas a infrarossi) e utilizzata per quantificare la degradazione del PBAT. La quantità di plastica rimasta nei mesocosmi alla fine dell'incubazione è stata calcolata come
CFrac da plastica, finale = [mPlastica, i / Cfrac plastica - (CCO2, plastica aggiunta - CCO2 senza plastica)*mterreno asciutto]/(mPlastica, i/ Cfrac plastica)
dove mterreno secco è la quantità di terreno in ogni barattolo di incubazione, Cfrac Plastic è il contenuto di carbonio delle microplastiche aggiunte, CCO2, plastica aggiunta è la quantità cumulativa di CO2 prodotta in un mesocosmo con l'aggiunta di plastica per grammo di terreno asciutto, CCO2 no plastic è la quantità di CO2 prodotta in un mesocosmo senza plastica aggiunta per grammo di terreno asciutto, e mplastica, i è la massa iniziale della plastica aggiunta.
Abbiamo usato il bootstrapping per stimare gli intervalli di confidenza per la plastica che rimane nei terreni A e B calcolando la plastica rimanente con 10.000 sottocampioni teorici di accoppiamenti casuali dei 10 mesocosmi sperimentali di ciascun sito. Nel sito A, la plastica media stimata rimanente dai dati respiratori era dell'86%, con un intervallo di confidenza del 95% compreso tra il 62 e il >100%. Nel sito B, la plastica media rimanente stimata era del 98%, con un intervallo di confidenza del 95% compreso tra il 79 e il >100%. Alla fine dei 6 mesi, il contenuto di PBAT è stato misurato anche con il metodo di estrazione e quantificazione NMR descritto in questo manoscritto (n = 5 per il sito A e n = 4 per il sito B). Nel sito A, la plastica media stimata rimanente dai dati NMR era del 79%, con un intervallo di confidenza del 95% (media ± 1,96xSE) compreso tra il 71% e l'87%. Nel sito B, la plastica rimanente media stimata era dell'88%, con un intervallo di confidenza del 95% compreso tra il 71% e il 100%. La Figura 6 mostra gli intervalli di confidenza per il contenuto plastico del suolo dei due siti stimati con i due diversi metodi. Le stime del contenuto plastico dei due metodi appaiono reciprocamente coerenti in base all'ampia porzione di sovrapposizione tra ciascuna coppia di intervalli di confidenza.

Figura 1: Panoramica visiva della procedura di estrazione e quantificazione del polibutilene adipato tereftalato (PBAT). Fare clic qui per visualizzare una versione più grande di questa figura.
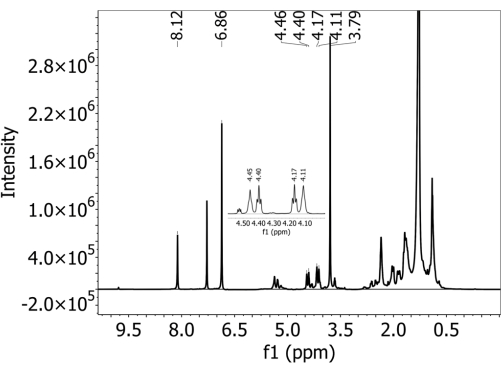
Figura 2: 1spettro H-NMR raccolto in solvente deuterato di cloroformio con uno spettrometro a 500 MHz su un estratto da un terreno argilloso ombreggiato con MP di polibutilene adipato tereftalato (PBAT). L'1,4-dimetossibenzene (DMB) è stato aggiunto all'estratto come calibrante interno prima dell'analisi NMR. Nello spettro sono presenti sia i picchi caratteristici PBAT che DMB. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Strutture del polibutilene adipato tereftalato (PBAT) e dell'1,4-dimetossibenzene (DMB) con protoni marcati. Le strutture corrispondenti sono mostrate nella Tabella 1 e nella Tabella 2. (A) Struttura di un'unità BA-BT di PBAT. (B) Struttura delle triadi T-B-T, T-B-A e A-B-A da PBAT. (c) Struttura del DMB. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Concentrazioni di PBAT misurate con 1H-QNMR in estratti in solvente cloroformio deuterato da un terriccio argilloso ombreggiato, un terriccio di Los Osos e un terriccio sabbioso di Elkhorn contenenti quantità note di PBAT. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Efficienza di estrazione di PBAT MP e NP da campioni appuntiti in un terreno argilloso ombreggiato. Il recupero del PBAT è significativamente inferiore per le NP (p = 0,0002). La linea centrale di ogni casella rappresenta la media dei punti dati misurati, mentre i limiti superiore e inferiore della casella riflettono rispettivamente Q3 e Q1. I limiti superiore e inferiore dei baffi riflettono rispettivamente i punti dati massimo e minimo. I singoli punti dati sono mostrati all'interno della casella e dei baffi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Il contenuto di plastica di due terreni di Elkhorn è stato misurato mediante incubazione cumulativa, respirazione ed estrazione con solvente accoppiata a NMR. Per il contenuto di plastica misurato mediante respirazione, le barre rappresentano un intervallo di confidenza del 95%. Per il contenuto di plastica misurato mediante NMR, le barre rappresentano un intervallo di confidenza del 95% basato su due volte l'errore standard al di sopra e al di sotto della stima media (n = 5 per il sito a e n = 4 per il sito b). Clicca qui per visualizzare una versione più grande di questa figura.
| ID picco | Ubicazione | Numero di protoni | Molteplicità | Monomero | utilizzato nella quantificazione |
| 5 | 8.1 | 4 | Canottiera | T | Sì |
| 6 | 4.44 | 2 | Tripletta | B | Sì |
| 6’ | 4.38 | 2 | Tripletta | B | Sì |
| 3’ | 4.15 | 2 | Tripletta | B | Sì |
| 3 | 4.09 | 2 | Tripletta | B | Sì |
| 1 | 2.34 | 4 | Tripletta | Un | No |
| 7 | 1.97 | 2 | Multiplo | B | No |
| 7’ | 1.87 | 2 | Multiplo | B | No |
| 4’ | 1.81 | 2 | Multiplo | B | No |
| 4 | 1.68 | 2 | Multiplo | B | No |
| 2 | 1.66 | 4 | Multiplo | Un | No |
Tabella 1: 1Picchi spettrali H-NMR di polibutilene adipato tereftalato (PBAT) in solvente deuterato di cloroformio. Gli idrogeni attribuiti a ciascun picco sono etichettati nella Figura 3. Le assegnazioni dei picchi si basano su Herrera et al.27.
| ID picco | Ubicazione | Numero di protoni | Molteplicità | Utilizzato nella quantificazione |
| Un | 6.84 | 4 | Canottiera | Sì |
| B | 3.77 | 6 | Canottiera | Sì |
Tabella 2: 1Picchi H-NMR di 1,4-dimetossibenzene (DMB) in solvente cloroformio deuterato. Gli idrogeni attribuiti a ciascun picco sono etichettati nella Figura 3B. Le assegnazioni dei picchi si basano su Nelson et al.33.
| Serie del suolo | Classificazione | Trama | Carbonio organico totale | ph | Luogo di ritiro | Profondità collezione (cm) |
| Ombreggiato | Fine-argilloso, misto, subattivo, termico Tipico Hapludult | Terriccio | 1.70% | 6 | Knoxville, Tennessee, Stati Uniti | 0-5 |
| Los Osos | Fine smectitico, termico Tipico Argixeroll | Terriccio | 3.00% | 6 | San Luis Obispo, California, Stati Uniti | 0-5 |
| Elkhorn | Argixeroll Pachico argixeroll, argixeroll fine-argilloso, misto, superattivo | Terriccio sabbioso | 1% | 7 | Watsonville, California, Stati Uniti | 0-5 |
Tabella 3: Proprietà dei tre terreni che sono stati utilizzati per dimostrare il metodo di estrazione del PBAT.
Figura supplementare 1: 1spettro H-NMR raccolto in solvente cloroformio deuterato con uno spettrometro a 500 MHz su un estratto di un terriccio ombreggiato senza la presenza di polimero PBAT. I picchi caratteristici PBAT non sono presenti, mentre i picchi DMB (aggiunti come calibratore interno) lo sono. Clicca qui per scaricare questo file.
Figura 2 supplementare: Regione adattata dello spettro 1H-NMR come mostrato nella Figura 4. Lo spettro è stato raccolto in solvente deuterato di cloroformio. Lo sfondo verde mostra la regione dello spettro che era adatta. Le linee viola mostrano i picchi adattati, mentre le linee rosse mostrano l'errore (porzioni del segnale dello spettro non incluse nei picchi adattati). I picchi PBAT 5, 6, 6', 3' e 3 sono inclusi nella vestibilità insieme ai picchi DMB A e B. Clicca qui per scaricare questo file.
Figura 3 supplementare: 1spettri H-NMR in solvente deuterato di cloroformio raccolti con uno spettrometro a 500 MHz su un estratto di un terriccio sabbioso di Elkhorn con aggiunta di MP PBAT. Nello spettro sono presenti sia i picchi caratteristici PBAT che DMB. (A) I picchi di PBAT non possono essere distinti per quantificare il polimero. Se gli estratti del campione producono spettri come questo, diluire il campione e quindi utilizzarlo per raccogliere un nuovo spettro 1H-NMR. (B) Lo stesso estratto viene diluito in modo che tutti i picchi spettrali siano chiaramente risolti. Clicca qui per scaricare questo file.
Discussione
Proponiamo un metodo per l'estrazione con solvente di PBAT dal suolo accoppiato con 1H-NMR per quantificare il PBAT nell'estratto. Gli elementi chiave del processo di estrazione includono la tecnica e l'attrezzatura di estrazione, il solvente utilizzato per l'estrazione e i requisiti di tempo. Abbiamo scelto di utilizzare una tecnica di estrazione che richiede attrezzature relativamente semplici ed economiche (barattoli di vetro, perle di vetro e un tavolo vibrante) rispetto all'estrazione Soxhlet e all'estrazione accelerata con solvente (ASE) dimostrata da Nelson et al.33. L'obiettivo di questo metodo è che molti campioni possano essere estratti in parallelo per velocizzare l'elaborazione di campioni di terreno sfusi. Un altro vantaggio della semplice estrazione con agitazione con solvente è che è possibile ospitare volumi maggiori di terreno rispetto agli approcci Soxhlet o ASE, consentendo una più facile elaborazione di campioni rappresentativi dell'ambiente13,36. Abbiamo selezionato la soluzione solvente cloroformio-metanolo sulla base dei risultati positivi presentati da Nelson et al.33 e della disponibilità di cloroformio deuterato come solvente 1H-NMR. Abbiamo testato l'ultrasonicazione di miscele solvente-matrice allineate con il protocollo descritto in Nelson et al.33 rispetto al semplice metodo di agitazione del solvente e non abbiamo riscontrato differenze significative nei tassi di recupero del PBAT tra i due metodi. Abbiamo scoperto che 8 ore di agitazione a 200 giri/min erano sufficienti per rompere gli aggregati del terreno in 100 g di matrice del suolo per i tre terreni che abbiamo testato, mentre tempi di scuotimento più brevi o velocità di scuotimento inferiori erano insufficienti. La decantazione è stata quindi necessaria per recuperare il solvente senza particelle di terreno. Il recupero del PBAT è stato testato con plastiche di dimensioni nanometriche e il recupero è stato significativamente inferiore a quello degli MP. Ciò significa che il metodo potrebbe richiedere ulteriori sviluppi per quantificare con precisione campioni ambientali di NP sconosciute, ma il recupero parziale e la misurazione delle NP sono ancora preziosi rispetto ad altri metodi di dimensioni limitate, anche se le informazioni sulla dimensione delle particelle non possono essere ottenute con questo metodo.
Mentre Nelson et al.33 hanno riportato efficienze di estrazione vicine al 100% per un metodo di estrazione ad ultrasuoni, abbiamo scoperto che gli ultrasuoni e il metodo di estrazione basato su agitatore qui descritti hanno entrambi portato a efficienze di estrazione significativamente inferiori al 100%. Riteniamo che ciò possa essere dovuto agli effetti degli agenti atmosferici ambientali, inclusa la fotoossidazione sul pacciame di plastica. Nelson et al.33 hanno osservato un'efficienza di estrazione significativamente ridotta per i PBAT MP irradiati con raggi UV rispetto al materiale non alterato. La plastica che abbiamo usato per testare questo metodo di quantificazione è stata esposta al sole per un'intera stagione di crescita prima di essere trasformata in MP. Nonostante i fotostabilizzanti aggiunti ai film di pacciamatura in plastica commerciale, la struttura del polimero dei pacciami cambia a causa delle radiazioni UV (ad esempio, la reticolazione a catena che aumenta il contenuto di gel del materiale)46 in condizioni ambientali di erosione e la degradazione del polimero può modificare il suo spettro NMR47. Ciò potrebbe contribuire ai tassi di recupero PBAT più bassi che abbiamo osservato rispetto a Nelson et al.33. Abbiamo anche scoperto che l'efficienza di estrazione del PBAT variava tra i tre terreni che abbiamo testato. Il terreno ombreggiato contiene per lo più argille a bassa attività, mentre gli altri due terreni hanno argille smectitiche (Los Osos) e miste, superattive (Elkhorn). La presenza di minerali argillosi ad alta attività e 2:1 potrebbe aver inibito l'estrazione con solvente di PBAT da quei terreni33,48 portando al minor recupero di PBAT che abbiamo osservato. Raccomandiamo ulteriori ricerche che indaghino le associazioni plastica-minerale nel suolo per MP e NP biodegradabili, incluso PBAT, nonché MP e NP polimerici convenzionali non degradabili. Questo è importante sia per capire come i polimeri MP possono essere estratti e misurati dal suolo, sia per capire come potrebbero biodegradarsi o influenzare in altro modo i sistemi del suolo.
Gli elementi chiave del processo di acquisizione dello spettro NMR includono la forza del magnete dello strumento, il numero di scansioni utilizzate, il tempo di rilassamento del campione tra le scansioni e il tempo di misurazione totale per campione. Abbiamo utilizzato uno spettrometro a 500 MHz; le intensità del campo magnetico più elevate forniscono una maggiore sensibilità e risoluzione negli spettri NMR. Il rapporto spettrale segnale/rumore può essere aumentato raccogliendo scansioni ripetute dello stesso campione e sommandole. La raccolta di n scansioni aumenterà il rapporto segnale/rumore di un fattore di √n, ma aumenterà il tempo di misurazione di un fattore di n29. Ciò significa che se è necessario un rapporto segnale/rumore più elevato per quantificare il PBAT in un campione, il numero di scansioni può essere aumentato al costo di tempi di esecuzione del campione più lunghi. Un rapporto segnale/rumore di 150 per un particolare segnale è necessario per mantenere un errore <1% nella quantificazione44. In base ai nostri parametri di acquisizione (strumento, sonda, numero di scansioni), erano necessari circa 5 mg di PBAT per campione (o 50 μg di PBAT per mL di estratto) per ottenere un rapporto segnale/rumore di 150 e quindi un errore di <1% nella quantificazione; Questa concentrazione è specifica per la nostra configurazione di raccolta dati. Questa concentrazione di PBAT è superiore ai limiti di quantificazione raggiunti da altri utilizzando 1H-NMR per quantificare altri tipi di MP in assenza di suolo16,24, dimostrando l'impatto della materia organica del suolo e di altri composti coestratti sul metodo di quantificazione. L'intervallo quantificabile di PBAT è limitato anche all'estremità superiore a causa dell'allargamento della linea osservato a concentrazioni di PBAT superiori a 25 mg per campione (250 μg di PBAT per mL di estratto), che ha portato alla sovrapposizione dei picchi di PBAT come descritto nei risultati rappresentativi e mostrato nella Figura 3 supplementare. Tuttavia, questo metodo consente flessibilità nel rispondere a queste limitazioni al fine di garantire che i campioni siano quantificabili. La quantità di terreno utilizzata per creare gli estratti può essere aumentata o diminuita e gli estratti possono essere diluiti e rianalizzati per regolare la concentrazione di PBAT entro l'intervallo ottimale.
Gli elementi chiave del processo di quantificazione del PBAT in base agli spettri NMR includono i picchi utilizzati per quantificare il PBAT, l'uso dell'adattamento delle linee per calcolare le aree dei picchi e la curva di calibrazione. Concettualmente, qualsiasi coppia di picchi di PBAT e DMB potrebbe essere confrontata per calcolare il rapporto dei due composti in un campione. Abbiamo trovato i risultati più accurati quando abbiamo calcolato il rapporto BT:DMB come la media delle aree di picco 5:A e delle aree di picco 5:B (normalizzate dal rispettivo numero di protoni). Il picco 5 del PBAT fornisce solo la quantificazione del monomero 1,4-butandiolo-tereftalato (BT), quindi l'area dei picchi 3 e 3' (che rappresentano il monomero 1,4-butandiolo-adipanato, o BA) è stata confrontata con l'area dei picchi 6 e 6' (che rappresentano il monomero BT) per quantificare i gruppi BA presenti nel campione. La quantità di BT e BA è stata sommata per rappresentare la quantità totale di PBAT rimanente. Non è stato possibile utilizzare il picco 1 o 2 di PBAT nella quantificazione BA a causa dell'interferenza di composti coestratti (che si ipotizza essere materia organica del suolo), che ha creato picchi multipli nell'intervallo 2,7-0,7 ppm. Abbiamo esplorato la possibilità di rimuovere questi segnali indesiderati dagli spettri con la correzione dello sfondo (cioè sottraendo uno spettro vuoto da ogni spettro di campioni), ma abbiamo scoperto che la creazione di spettri di fondo e campioni comparabili equivalenti senza l'uso di un calibrante è inaffidabile. L'adattamento della linea è stato utilizzato per calcolare l'area dei picchi adattati piuttosto che integrare direttamente i picchi spettrali. A causa della sovrapposizione tra i picchi PBAT 3 e 3' e tra i picchi 6-6', ciò ha fornito stime più accurate del contenuto di PBAT basate su analisi preliminari. Si consiglia la creazione di una curva di calibrazione per tenere conto dei tassi di recupero variabili di PBAT da terreni diversi. I tassi di recupero del PBAT erano significativamente diversi per una coppia, dei tre terreni che abbiamo testato, come indicato dagli intervalli di confidenza non sovrapposti del 95% per la pendenza della curva di calibrazione. Il recupero di PBAT in un terzo terreno non era significativamente diverso da nessuno degli altri due. In assenza di una comprensione meccanicistica di come la composizione del suolo influisca sul recupero dei PBAT, si raccomanda di creare curve di calibrazione per valutare il recupero dei PBAT in ogni serie di suolo di interesse e per ogni orizzonte all'interno di un profilo del suolo. Se le curve di calibrazione risultano statisticamente simili tra i suoli, i suoli possono essere facilmente analizzati in combinazione.
Riteniamo che questo metodo possa fornire uno strumento prezioso a coloro che sono interessati a quantificare PBAT MP e NP nel suolo, in particolare per quantificare PBAT in un gran numero di campioni raccolti in terreni simili, ad esempio in uno studio sul campo a lungo termine sulla biodegradazione della plastica. Un metodo NMR per quantificare le MP dal suolo è prezioso perché consente ai ricercatori con accesso e competenza in NMR di contribuire a soddisfare le esigenze del campo emergente rispondendo a domande importanti sulla presenza e il comportamento delle MP nei sistemi del suolo. Mentre l'accesso alla strumentazione e alle competenze sarà probabilmente una delle prime preoccupazioni pratiche che limiteranno la selezione delle tecniche di quantificazione da parte dei ricercatori, la risonanza magnetica nucleare non è lo strumento più efficiente o più adatto per quantificare le microplastiche dal suolo in tutte le condizioni. Le informazioni sulla forma e sulla dimensione delle particelle non possono essere ottenute con una tecnica di estrazione con solvente; se la forma e le dimensioni delle MP sono di interesse, i ricercatori sarebbero meglio serviti da una tecnica per identificare le singole particelle MP come la spettroscopia FTIR o Raman. Un vantaggio dei metodi di estrazione con solvente come quelli presentati qui e in Nelson et al.33 rispetto ad altri approcci di quantificazione MP come FTIR o spettroscopia Raman è che concettualmente non esiste alcun limite di dimensione per le MP e le NP che possono essere quantificate; L'estrazione con solvente può essere più vantaggiosa quando le informazioni sulla dimensione delle particelle non sono necessarie o quando le particelle di interesse sono troppo difficili da separare con altri mezzi. La pirolisi GCMS può essere preziosa perché ha una sensibilità maggiore rispetto alla risonanza magnetica nucleare, ma i risultati sono anche soggetti a effetti matrice come probabilmente lo è l'estrazione con solvente PBAT.
Ci auguriamo che ulteriori lavori migliorino la robustezza di questo metodo affrontando i costituenti del suolo coestratti che interferiscono con la risoluzione del picco di PBAT negli spettri NMR. Sono inoltre necessari ulteriori lavori per stabilire la relazione tra l'erosione della plastica PBAT e l'efficienza di estrazione attraverso questo metodo, forse accompagnati da una comprensione più dettagliata dei prodotti di degradazione del PBAT e dei loro spettri 1H-NMR. Sulla base dei nostri risultati e di quelli di Nelson et al.33, questa procedura di quantificazione funziona meglio per quantificare le plastiche PBAT non alterate in terreni con bassa materia organica e senza argille ad alta attività. Sebbene sia stato utilizzato questo metodo solo per quantificare le MP a base di PBAT dal suolo, l'estrazione con solvente e la procedura di quantificazione 1H-NMR potrebbero essere utili per quantificare altre MP e NP da ulteriori suoli26,49. L'estensione del metodo alle MP costituite da un altro polimero richiede di garantire la solubilità del polimero nel solvente e di identificare i picchi NMR caratteristici dal polimero nel solvente scelto. Potrebbe essere necessario selezionare un nuovo calibrante interno che sia solubile nel solvente scelto e che non produca picchi sovrapponibili a quelli del polimero di interesse42.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti noti o relazioni personali che possano aver influenzato il lavoro riportato in questo articolo.
Riconoscimenti
Grazie all'USDA-NIFA per aver finanziato questo progetto attraverso il premio numero 2020-67019-31167 a SMS e al programma Strategic Planning Research Initiatives (SPRINT) dell'Università del Tennessee per una sovvenzione interna DGH e SMS. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta dei dati, nell'analisi, nell'interpretazione, nella stesura del rapporto o nella decisione di presentare l'articolo per la pubblicazione.
Materiali
| Name | Company | Catalog Number | Comments |
| 1,4-dimethoxybenzene | Arcos Organics 99%+ | AC115411000 | 1 mg per sample |
| Amber glass bottle with PTFE lined lid (1 L) | Kimble | 5223253C-26 | reusable |
| Chloroform; trichloromethane | Fisher Chemical | AA43685M6 | 90 mL per sample; Fisher Optima |
| Deuterated chlorform; trichloro(deuterio)methane | Sigma Aldrich | 1034200025 | 1 mL per sample; minimum 99.8% deuterated; stabilized with silver |
| Glass beads (3 mm diameter) | Propper Manufacturing | 3000600 | 20 per sample |
| Glass extraction jars with PTFE lined lid (~250 mL volume) | Kimble | 5510858B | 2 per sample, reusable |
| Graduated cylinder, 1 L, polypropylene | Nalgene | 3662-1000 | reusable |
| Graduated cylinder, 500 mL, polypropylene | Nalgene | 3662-0500 | reusable |
| Methanol | Fisher Chemical | A412-4 | 20 mL per sample; certified ACS |
| Micropipette wth range of 0.5 - 1 mL | Fisher Scientific | 3123000063 | reusable |
| NMR spectrometer | Bruker | n/a | 500 MHz instrument |
| NMR tube (7 inch height, high-throughput) | Wilmad | WG-1000-7 | 1 per sample |
| Platform shaker | Eppendorf, Excella E5 | M1355-0000 | reusable |
| Polyethylene pipette tip (10 mL volume) | Eppendorf | 22492098 | 1 per sample, single use |
| Polypropylene micropipette tips (1 mL volume) | Fisher Scientific | 02-707-510 | 3 per sample, single use |
| Semi-microbalance | Mettler Toledo | 30532226 | reusable |
Riferimenti
- Andrady, A. L. The plastic in microplastics: A review. Mar Pollut Bull. 119 (1), 12-22 (2017).
- Fakour, H., et al. Quantification and analysis of microplastics in farmland soils: Characterization, sources, and pathways. Agriculture. 11 (4), 330(2021).
- Wang, K., et al. Impact of long-term conventional and biodegradable film mulching on microplastic abundance, soil structure and organic carbon in a cotton field. Environ Pollut. 356, 124367(2024).
- Plastics Europe Plastics - the Facts. , Plastics Europe. Available from: https://plasticseurope.org/knowledge-hub/plastics-the-facts-2022/ (2022).
- Assessment of agricultural plastics and their sustainability: A call for action. , Food Agriculture Organization. Rome. (2021).
- Beriot, N., et al. Intensive vegetable production under plastic mulch: A field study on soil plastic and pesticide residues and their effects on the soil microbiome. Sci Total Environ. 900, 165179(2023).
- Liu, E. K., He, W. Q., Yan, C. R. White revolution to white pollution - Agricultural plastic film mulch in China. Environ Res Lett. 9 (9), 091001(2014).
- Sintim, H. Y., et al. Release of micro- and nanoparticles from biodegradable plastic during in situ composting. Sci Total Environ. 675, 686-693 (2019).
- Skoczinski, P., et al. Bio-based building blocks and polymers - Global capacities, production and trends 2023-2028. Indust Biotech. 20 (2), 52-59 (2024).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Li, C., et al. Effects of biodegradable mulch on soil quality. Appl Soil Ecol. 79, 59-69 (2014).
- Wang, F., Wang, Q., Adams, C. A., Sun, Y., Zhang, S. Effects of microplastics on soil properties: Current knowledge and future perspectives. J Hazardous Mater. 424, 127531(2021).
- Möller, J. N., Löder, M. G. J., Laforsch, C. Finding microplastics in soils: A review of analytical methods. Environ Sci Technol. 54 (4), 2078-2090 (2020).
- Paul, A., Wander, L., Becker, R., Goedecke, C., Braun, U. High-throughput NIR spectroscopic (NIRS) detection of microplastics in soil. Environ Sci Pollut Res. 26 (8), 7364-7374 (2019).
- Wortman, S. E., Jeske, E., Samuelson, M. B., Drijber, R. A new method for detecting micro-fragments of biodegradable mulch films containing poly(butylene adipate-co-terephthalate) (PBAT) in soil. J Environ Quality. 51 (1), 123-128 (2021).
- Peez, N., et al. Quantitative analysis of PET microplastics in environmental model samples using quantitative 1H-NMR spectroscopy: Validation of an optimized and consistent sample clean-up method. Anal Bioanal Chem. 411 (28), 7409-7418 (2019).
- Praveena, S. M., Aris, A. Z., Singh, V. Quality assessment for methodological aspects of microplastics analysis in soil. Trend Environ Anal Chem. 34, e00159(2022).
- Primpke, S., et al. Critical assessment of analytical methods for the harmonized and cost-efficient analysis of microplastics. Appl Spectro. 74 (9), 1012-1047 (2020).
- Käppler, A., et al. Analysis of environmental microplastics by vibrational microspectroscopy: FTIR, Raman or both. Anal Bioanal Chem. 408 (29), 8377-8391 (2016).
- Watteau, F., Dignac, M. F., Bouchard, A., Revallier, A., Houot, S. Microplastic detection in soil amended with municipal solid waste composts as revealed by transmission electronic microscopy and pyrolysis/GC/MS. Front Sustainable Food Syst. 2, 407866(2018).
- Pfohl, P., et al. Microplastic extraction protocols can impact the polymer structure. Microplastics Nanoplastics. 1 (1), 1-13 (2021).
- Xu, J. L., Thomas, K. V., Luo, Z., Gowen, A. A. FTIR and Raman imaging for microplastics analysis: State of the art, challenges and prospects. Trend Anal Chem. 119, 115629(2019).
- Cardoza, L. A., Korir, A. K., Otto, W. H., Wurrey, C. J., Larive, C. K. Applications of NMR spectroscopy in environmental science. Prog Nucl Magnetic Resonance Spectr. 45 (3-4), 209-238 (2004).
- Peez, N., Rinesch, T., Kolz, J., Imhof, W. Applicable and cost-efficient microplastic analysis by quantitative 1H-NMR spectroscopy using benchtop NMR and NoD methods. Magnetic Resonance Chem. 60 (1), 172-183 (2022).
- Günther, M., Imhof, W. Simultaneous quantification of microplastic particles by non-deuterated (NoD) 1 H-qNMR from samples comprising different polymer types. Analyst. 148 (5), 1151-1161 (2023).
- Papini, G., Petrella, G., Cicero, D. O., Boglione, C., Rakaj, A. Identification and quantification of polystyrene microplastics in marine sediments facing a river mouth through NMR spectroscopy. Marine Pollut Bull. 198, 115784(2024).
- Herrera, R., Franco, L., Rodríguez-Galán, A., Puiggalí, J. Characterization and degradation behavior of poly(butylene adipate-co-terephthalate)s. J Polymer Sci Part A. 40 (23), 4141-4157 (2002).
- Mauel, A., Pötzschner, B., Meides, N., Siegel, R., Strohriegl, P., Senker, J. Quantification of photooxidative defects in weathered microplastics using 13 C multiCP NMR spectroscopy. RSC Adv. 12 (18), 10875-10885 (2022).
- Bharti, S. K., Roy, R. Quantitative 1H NMR spectroscopy. Trend Anal Chem. 35, 5-26 (2012).
- Li, X., Hu, K. Quantitative NMR Studies of Multiple Compound Mixtures. Ann Rep NMR Spectro. 90, 85-143 (2017).
- Simmler, C., Napolitano, J. G., McAlpine, J. B., Chen, S. N., Pauli, G. F. Universal quantitative NMR analysis of complex natural samples. Curr Opinion Biotechnol. 25, 51-59 (2014).
- Giraudeau, P. Challenges and perspectives in quantitative NMR. Magnetic Reason Chem. 55 (1), 61-69 (2017).
- Nelson, T. F., Remke, S. C., Kohler, H. P. E., McNeill, K., Sander, M. Quantification of Synthetic Polyesters from Biodegradable Mulch Films in Soils. Environ Sci Technol. 54, 266-275 (2020).
- Brandolini, A. J., Hills, D. D. NMR spectra of polymers and polymer additives. , CRC Press. Boca Raton. (2000).
- Matsuda, H., Asakura, T., Miki, T. Triad sequence analysis of poly(ethylene/butylene terephthalate) copolymer using 1H NMR. Macromolecules. 35 (12), 4664-4668 (2002).
- Yu, Y., Flury, M. How to take representative samples to quantify microplastic particles in soil. Sci Total Environ. 784, 147166(2021).
- Cambardella, C. A., et al. Field-scale variability of soil properties in central Iowa soils. Soil Sci Soc Am J. 58, 1501-1511 (1994).
- Ramsey, M. H., Argyraki, A. Estimation of measurement uncertainty from field sampling: Implications for the classification of contaminated land. Sci Total Environ. 198 (3), 243-257 (1997).
- Desaules, A. Critical evaluation of soil contamination assessment methods for trace metals. Sci Total Environ. 426, 120-131 (2012).
- Pennock, D., Yates, T., Braidek, J. Soil Sampling Designs. Soil Sampl Meth Anal. , 25-38 (2006).
- Büks, F., Kaupenjohann, M. Global concentrations of microplastics in soils - A review. SOIL. 6 (2), 649-662 (2020).
- Bowen, M., O'Neill, I., Pringuer, M. Quantitiative Applications of Nuclear Magnetic Resonance in Pharmaceutical Analysis. Proc Soc Anal Chem. , 294-297 (1974).
- Frank, O., Kreissl, J. K., Daschner, A., Hofmann, T. Accurate determination of reference materials and natural isolates by means of quantitative 1H NMR spectroscopy. J Agri Food Chem. 62 (12), 2506-2515 (2014).
- Malz, F., Jancke, H. Validation of quantitative NMR. J Pharma Biomed Anal. 38 (5), 813-823 (2005).
- Astner, A. F., et al. Forming micro-and nano-plastics from agricultural plastic films for employment in fundamental research studies. J Vis Exp. (185), e641112(2022).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. J Polymer Environ. 29 (9), 2916-2931 (2021).
- Deshoulles, Q., et al. Hydrolytic degradation of biodegradable poly(butylene adipate-co-terephthalate) (PBAT) - Towards an understanding of microplastics fragmentation. Polymer Degrad Stability. 205, 110122(2022).
- Zhang, Y., et al. Aging significantly increases the interaction between polystyrene nanoplastic and minerals. Water Res. 219, 118544(2022).
- Peez, N., Janiska, M. C., Imhof, W. The first application of quantitative 1H NMR spectroscopy as a simple and fast method of identification and quantification of microplastic particles (PE, PET, and PS). Anal Bioanal Chem. 411 (4), 823-833 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon