Method Article
Modelo de transplante de fígado total auxiliar heterotópico de rato utilizando uma hepaticouretorostomia para estudos de rejeição de aloenxerto
Neste Artigo
Resumo
O protocolo auxiliar de transplante hepático heterotópico de rato descrito aqui oferece uma ferramenta prática de investigação para explorar os mecanismos de rejeição do aloenxerto hepático. Este modelo ajuda a aliviar os obstáculos cirúrgicos e o estresse animal do transplante hepático ortotópico em ratos.
Resumo
Modelos de transplante de pequenos animais são indispensáveis para estudos de tolerância a órgãos que investigam intervenções terapêuticas viáveis em estudos pré-clínicos. Os protocolos de transplante de fígado de rato (LTx) geralmente usam um modelo ortotópico em que o fígado nativo dos receptores é removido e substituído por um fígado de doador. Este procedimento cirúrgico tecnicamente exigente requer habilidades microcirúrgicas avançadas e é ainda mais complicado por longos tempos de isquemia anepática e inferior do corpo. Isso levou ao desenvolvimento de um método heterotópico menos complicado que pode ser realizado mais rapidamente sem tempo de isquemia anepática ou inferior do corpo, reduzindo o estresse pós-operatório para o animal receptor.
Este protocolo heterotópico de LTx inclui duas etapas principais: excisão do fígado do rato doador e transplante de todo o fígado para o rato receptor. Durante a excisão do fígado do doador, o cirurgião liga a veia cava supra-hepática (SHVC) e a artéria hepática (AH). Do lado receptor, o cirurgião remove o rim esquerdo e posiciona o fígado do doador com a veia porta (VP), a veia cava infra-hepática (IHVC) e o ducto biliar voltados para os vasos renais. Além disso, o cirurgião anastomosa a veia renal do receptor de ponta a ponta com a CVHI do fígado e arterializa a VP com a artéria renal usando um stent. A hepaticouretorostomia é utilizada para drenagem biliar, anastomosando o ducto biliar ao ureter do receptor, permitindo a descarga da bile pela bexiga.
A duração média do transplante foi de 130 min, a duração da isquemia fria foi de cerca de 35 min e a duração da isquemia quente foi inferior a 25 min. A histologia da hematoxilina e eosina do fígado auxiliar de transplantes singênicos mostrou estrutura hepatócita normal, sem alterações parenquimatosas significativas 30 dias após o transplante. Em contraste, amostras de enxerto alogênico pós-transplante de 8 dias demonstraram infiltração linfocítica extensa com uma pontuação no índice de atividade de rejeição do Esquema de Banff de 9. Portanto, este método de Tx facilita uma alternativa de modelo de rejeição de baixa morbidade ao TxL ortotópico.
Introdução
O LTx de pequenos animais é um modelo inestimável para investigar mecanismos de rejeição hepática. O transplante hepático auxiliar heterotópico com arterialização da veia porta (HALT-PVA) em ratos foi introduzido em 1968 por Lee e Edgington1quando relataram o uso da veia e artéria renal de um receptor para revascularizar um fígado auxiliar enxertado. Posteriormente, Hess et al.2 aprimoraram o protocolo com a mitigação da competição funcional entre os fígados nativo e auxiliar, reduzindo o tamanho do fígado nativo e do doador, juntamente com a reconstrução da conexão do ducto biliar do doador, resultando em sobrevida do enxerto a longo prazo. Refinamentos adicionais foram feitos com a introdução da anastomose do balonete 3,4, e Schleimer et al.5 determinaram o diâmetro ideal do stent para regular o fluxo sanguíneo para obter fluxo portal fisiológico e evitar hiper ou hipoperfusão do enxerto. Outros pesquisadores desenvolveram alterações significativas no método usando a artéria esplênica6 ou ilíaca comum7 para o suprimento sanguíneo do enxerto, enquanto alguns desenvolveram modelos que usavam apenas sangue venoso8 ou apenas sangue arterial através da artéria hepática9 para fornecer o enxerto hepático auxiliar.
O presente estudo levantou a hipótese de que a competição funcional do fígado nativo não interferiria na rejeição do aloenxerto, então desenvolvemos um protocolo baseado no modelo de Schleimer regulado por fluxo10 que não incluiu nenhuma redução de tamanho do fígado nativo ou auxiliar. O lado esquerdo do receptor foi selecionado para localizar o enxerto porque forneceu orientação ideal entre os vasos renais e hepáticos do receptor. Inicialmente, tentamos a reconstrução biliar por meio de duodenononomia hepática, mas esses estudos simplesmente confirmaram a afirmação de Schleimer de que "a drenagem biliar é o calcanhar de Aquiles do transplante hepático"10. Isso levou ao desenvolvimento de uma nova técnica em que o ducto biliar é anastomosado término-terminal usando um stent com o ureter dos receptores, permitindo a descarga da bile pela bexiga. Um benefício notável do uso de uma hepaticouretorostomia é que a funcionalidade do enxerto hepático pode ser monitorada diariamente pela observação da urina; Um enxerto de fígado produtor de bile colore a urina de um amarelo brilhante. A Figura 1 representa a visão geral esquemática do método HALT-PVA.
Uma vantagem importante do LTx heterotópico sobre o ortotópico em ratos está relacionada à ausência de qualquer tempo de isquemia anepática ou total da parte inferior do corpo, o que permite recuperações mais rápidas e fáceis para receptores heterotópicos. Além disso, os estudos imunológicos de TxP utilizando métodos ortotópicos geralmente dependem da rejeição grave ou morte do receptor como desfecho experimental, o que não é o caso dos transplantes heterotópicos, em que o animal permanece saudável mesmo que o aloenxerto pare de funcionar devido à rejeição. Ambas as características do método heterotópico apoiam os princípios da iniciativa internacional 3R's (Substituição, Redução e Refinamento)11, que promove uma estrutura para minimizar a dor, o sofrimento e o sofrimento experimentados pelos animais de pesquisa e melhorar seu bem-estar.
O modelo HALT-PVA aqui relatado é um método prático e confiável para investigar os mecanismos de rejeição do enxerto hepático em estudos pré-clínicos. Esta técnica experimental útil ajuda a superar as consideráveis demandas cirúrgicas e o estresse animal do LTx ortotópico em ratos. No futuro, pretendemos usar esse método para investigar os mecanismos de rejeição imune aguda enquanto exploramos novos alvos e estratégias terapêuticas para suprimir a rejeição do enxerto hepático.
Protocolo
Os animais foram criados e alojados em condições específicas livres de patógenos nas instalações de cuidados com animais da Universidade de Wisconsin (UW)-Madison Institute for Medical Research, de acordo com as diretrizes institucionais. O protocolo do estudo (nº M006022) foi aprovado pelo Comitê Institucional de Cuidados e Uso de Animais da Escola de Medicina e Saúde Pública da UW, e todos os animais foram tratados de forma ética.
1. Animais
- Use ratos fêmeas Lewis adultos pesando 205-235 g e machos Lewis pesando 250-280 g como ratos doadores. Use ratos machos adultos Lewis e Brown Norway pesando 365-420 g como receptores.
- Realizar transplantes singênicos transplantando doadores de Lewis em receptores de Lewis, enquanto os transplantes alogênicos utilizaram doadores de Lewis transplantados em receptores da Brown Norway.
- Realize todas as cirurgias por duas pessoas usando um microscópio de cabeça dupla.
2. Procedimento auxiliar de colheita de dadores de fígado
- Anestesiar o rato doador com inalação de isoflurano a 5% em uma câmara de indução. Registre o peso do rato e raspe o abdômen com um cortador elétrico.
- Posicione o rato em decúbito dorsal em uma almofada de cirurgia aquecida com o nariz em um cone de anestesia e imobilize os membros com fita adesiva. Desinfete o abdômen com álcool 75% e diminua o isoflurano para 2%.
- Faça uma incisão longitudinal na linha média da pele e no músculo do púbis ao xifóide usando uma tesoura. Próximo ao ponto médio da incisão longitudinal, estenda-a lateralmente para a esquerda e para a direita e, em seguida, instale afastadores em ambos os lados da parede abdominal e do apêndice xifóide.
- Usando cotonetes úmidos, retraia os intestinos para o lado esquerdo do abdômen enquanto usa uma tesoura de mola para cortar os ligamentos gastro ligados ao fígado e, em seguida, imobilize os intestinos sob gaze umedecida. Cubra o fígado com um pequeno pedaço de gaze estéril umedecida com solução salina morna.
- Use cotonetes úmidos para retrair o fígado e dissecar os ligamentos falciforme, triangular, hepatogástrico e hepatoduodenal. Em seguida, cauterize com pinça bipolar e divida os vasos paraesofágicos entre o lobo caudado lateral esquerdo e anterior.
- Usando uma pinça angular ou porta-agulhas, disseque atrás do SHVC inferior ao diafragma, depois passe uma sutura de seda 5-0 sob o SHVC e dê um nó duplo frouxamente para uso posterior.
- Retraia o lobo lateral inferior direito para cima, corte o ligamento e imobilize sob gaze umedecida. Isole a CVIH do tecido retroperitoneal até a veia renal direita e ligue a veia adrenal direita com uma sutura de seda 6-0 o mais próximo possível da CVHI. Divida essa veia mais tarde, quando o enxerto for removido.
- Usando uma agulha de hidrodissecção 27 G (Figura 2A), dissocie o VP do tecido conjuntivo circundante e separe-o das veias pilórica e esplênica ligando-as e dividindo-as com uma sutura de seda 7-0.
- Isole, ligue com sutura de seda 6-0 e divida a artéria hepática comum perto de onde ela passa abaixo da VP.
- Ligue o ducto biliar com uma sutura de seda 5-0 na ramificação da artéria gastroduodenal, preservando o tecido adiposo ao redor do ducto biliar o máximo possível; Em particular, evite separar o ducto biliar da artéria hepática adequada, mantendo o comprimento total o mais curto possível.
- Usando uma tesoura de mola, faça uma pequena incisão na parede do ducto biliar proximal à ligadura. Insira um stent de tubo de poliimida de 0,0215" de diâmetro por 5 mm de comprimento no lúmen do ducto biliar e prenda-o com uma sutura de seda 6-0, deixando uma extremidade da sutura longa para uso posterior. Divida o ducto biliar cortando entre as ligaduras 5-0 e 6-0.
- Marque a parte superior do IHVC e PV com uma caneta de corante cirúrgico para ajudar a alinhar os vasos durante a anastomose e, em seguida, prenda a veia porta com uma pinça de microvasos o mais distal possível ao fígado.
- Insira uma seringa de 20 mL com uma agulha de 26 G no PV proximal ao micro clamp e perfunda o fígado com 10-15 mL de solução salina heparinizada gelada; simultaneamente, divida a CVIH usando uma tesoura de mola o mais próximo possível da veia renal direita.
- Extirpar o fígado usando uma tesoura de mola, dissecando o PV proximal ao micro clamp, apertando a sutura 5-0 previamente colocada ao redor da SHVC e dissecando o diafragma para transeccionar a veia cava intratorácica.
- Continue dissecando os ligamentos restantes na parte de trás do fígado e divida a veia adrenal previamente ligada. Coloque o fígado excisado em solução salina fria no gelo.
3. Procedimento auxiliar de transplante de receptor de fígado
- Anestesiar o rato receptor com inalação de isoflurano a 5% em uma câmara de indução. Registre o peso do rato e raspe o abdômen com um cortador elétrico.
- Posicione o rato em decúbito dorsal em uma almofada de cirurgia aquecida com o nariz em um cone de anestesia e imobilize os membros com fita adesiva. Aplique um lubrificante para os olhos, desinfete o abdômen com álcool 75% e diminua o isoflurano para 2%.
- Usando uma tesoura, faça uma incisão longitudinal da linha média da pele e do músculo do púbis ao xifóide e, em seguida, instale afastadores em ambos os lados da parede abdominal.
- Usando cotonetes úmidos, retraia os intestinos para o lado direito do abdômen e cubra-os com gaze umedecida. Aplique outra gaze úmida para cobrir o estômago, baço e fígado, expondo o rim esquerdo e os vasos renais.
- Usando uma agulha de hidrodissecção 27 G e uma pinça de ponta romba, separe a veia renal esquerda da artéria renal, removendo cuidadosamente a gordura e o tecido conjuntivo de ambos os vasos.
- Isole as veias gonadal e adrenal e use seda 6-0 para ligá-las proximalmente à veia renal temporariamente. Cauterizar, usando pinça bipolar, todos os micro ramos laterais isolando a veia e a artéria renal entre a aorta/CV e o rim.
- Mobilize e ligue o ureter com uma sutura de seda 6-0 no polo inferior. Marque a veia e a artéria renal com uma caneta cirúrgica para ajudar a orientar os vasos durante a anastomose e garantir que não haja torções.
- Pinçar a artéria renal e a veia renal com uma pinça de microvasos o mais próximo possível da aorta e da CV. Passe a artéria renal com uma tesoura de mola logo após a bifurcação do vaso e divida a veia renal a meio caminho entre a CV e o rim. Mobilize o rim esquerdo do tecido conjuntivo circundante e remova-o.
- Lave ambos os vasos com solução salina heparinizada usando uma agulha de hidrodissecção 27 G para remover todo o sangue restante.
- Com uma tesoura de mola, corte uma pequena abertura boca de peixe na forquilha da bifurcação da artéria renal para fazer uma abertura em forma de funil e insira um stent de 8 mm cortado de um cateter 26 G (Figura 2B). Prenda o stent com sutura de seda 6-0, deixando uma extremidade da sutura longa para uso posterior.
- Introduza o fígado do doador e posicione-o com o PV, IHVC e ducto biliar voltados para a veia e artéria renal esquerda do receptor. Usando uma sutura de náilon 9-0, instale duas suturas em lados opostos da conexão IHVC-veia renal.
- Compare a largura dos vasos e faça uma pequena incisão na boca de peixe usando uma tesoura de mola na face da veia renal até que tenha uma largura semelhante à IHVC do doador (Figura 2C).
- Usando uma sutura de náilon 9-0, anastomose o IHVC hepático de ponta a ponta à veia renal com 9 ou 10 suturas contínuas nas paredes frontal e posterior do vaso. Alternativamente, use um método de balonete para completar esta anastomose 3,4.
- Confirme se a colocação da artéria renal está abaixo da CVIH (Figura 2D) e insira o stent previamente colocado na artéria renal na veia porta do fígado e prenda com uma sutura de seda 6-0, deixando uma extremidade da sutura longa para se prender ao fio oposto na artéria. Junte as extremidades para evitar que cada uma escorregue do stent.
- Remova primeiro o micro grampo na veia renal e, em seguida, remova o micro grampo na artéria renal.
- Durante a reperfusão do fígado, use gaze e cotonetes para aplicar uma leve pressão ao redor da região da anastomose até que uma anastomose patente seja alcançada (Figura 2D). Remova as ligaduras temporárias previamente colocadas nas veias supra-renais e gonadais.
- Mobilize cuidadosamente aproximadamente 10 mm abaixo da extremidade do ureter esquerdo do tecido conjuntivo circundante, deixando uma quantidade significativa de tecido adiposo aderido. Com uma tesoura de mola, faça uma pequena incisão na parede do ureter proximal à ligadura 5-0 previamente colocada.
- Insira o stent de poliimida previamente fixado ao ducto biliar na pequena incisão feita na parede do ureter. Prenda com uma sutura de seda 6-0 e amarre uma extremidade com o fio longo no lado do ducto biliar do stent, juntando as duas extremidades firmemente.
- Retorne os intestinos de volta à sua posição natural ( Figura 2E ), irrigue com 2-3 mL de solução salina e feche o abdômen em duas camadas usando suturas de seda 3-0.
- Injete 0,1 mg/kg de buprenorfina por via subcutânea, coloque o receptor em uma gaiola limpa e aquecida e monitore a recuperação por 1-2 h antes de retornar o animal ao alojamento de animais.
4. Acompanhamento pós-cirúrgico
- A partir do dia 2 após a cirurgia, injete heparina (1 UI/g) por via subcutânea nos receptores de transplante alogênico diariamente.
- A partir do dia 2 após a cirurgia, injete heparina (1 UI/2 g) nos receptores de transplante singênico por via subcutânea em dias alternados.
Resultados
Atualmente, 29 pares de ratos foram utilizados para estabelecer o protocolo HALT-PVA, 17 transplantes singênicos e 12 transplantes alogênicos. Os fígados transplantados singênicos sobreviveram até o desfecho experimental designado de 8 ou 30 dias com uma taxa de sucesso de 70%, enquanto os fígados transplantados alogênicos sobreviveram até os desfechos designados de 3 ou 8 dias com uma taxa de sucesso de 50%. As falhas incluem ratos que morreram devido a complicações cirúrgicas e fígados auxiliares que falharam mesmo quando o receptor sobreviveu.
A duração média da operação foi de 130 min, com um tempo de isquemia fria de cerca de 35 min e um tempo de isquemia quente de menos de 25 min. Desde que não houvesse complicações intraoperatórias, os receptores acordavam e se tornavam ativos dentro de 10-20 minutos, começavam a beber e deambular dentro de 1 h e 24 h depois, eles se comportavam como ratos saudáveis normais.
Os enxertos hepáticos singênicos demonstraram excelente cor e permeabilidade do ducto biliar 30 dias após o transplante (Figura 3), enquanto a histologia da hematoxilina e da eosina (H&E) mostrou estrutura normal dos hepatócitos, sem alterações parenquimatosas significativas nos pontos de tempo de 8 e 30 dias (Figura 4A,B). Após apenas 3 dias, a histologia dos transplantes alogênicos mostrou inflamação portal significativa (Figura 4C), enquanto os enxertos alogênicos de 8 dias demonstraram rejeição celular aguda com extensa infiltração linfocítica (Figura 4D).
Amostras de TxL alogênico e singênico representativo foram avaliadas por um patologista hepático certificado, e a rejeição foi pontuada usando o índice de atividade de rejeição do Esquema de Banff (RAI)12. A avaliação patológica determinou que não houve rejeição presente, com um RAI de Banff de 0, em transplantes singênicos de 8 e 30 dias, enquanto os aloenxertos de 8 dias foram severamente rejeitados com um escore de Banff RAI de 9 (Tabela 1).
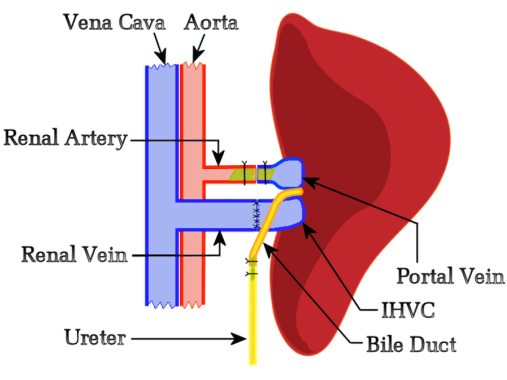
Figura 1: Diagrama esquemático do procedimento HALT-PVA em ratos. A VP é arterializada com a artéria renal esquerda usando um stent, a IHVC é anastomosada término-terminal à veia renal esquerda e o ducto biliar é ligado ao ureter usando um stent. Clique aqui para ver uma versão maior desta figura.

Figura 2: Procedimento cirúrgico. (A) Hidrodissecção da VP. Dissocie o PV do tecido conjuntivo circundante com uma agulha de hidrodissecção 27 G. (B) Inserção de stent arterial. O stent arterial é inserido em uma pequena abertura em forma de funil cortada na forquilha da bifurcação da artéria renal. (C) Alargamento da veia renal. Para corresponder à maior largura do IHVC doador para anastomose, um pequeno corte na boca do peixe é feito na face da veia renal do receptor após duas suturas de permanência. (D) Enxerto hepático perfundido imediatamente após a anastomose. O posicionamento da artéria renal e da conexão PV abaixo da veia renal e da CVHI é crucial para prevenir a trombose do enxerto. (E) Ratazana HALT-PVA in situ. O fígado auxiliar é posicionado contra a parede esquerda do abdômen antes de retornar os intestinos. Clique aqui para ver uma versão maior desta figura.
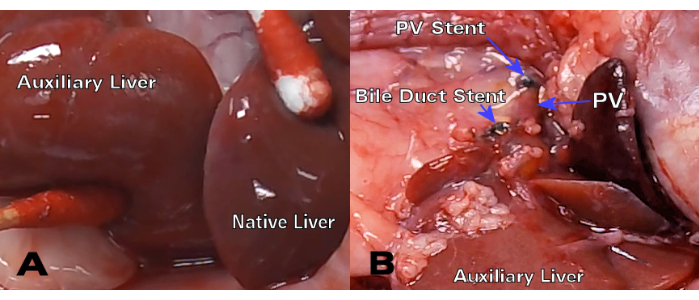
Figura 3: HALT-PVA singênico 30 dias após o transplante. (A) Após 30 dias, o fígado auxiliar tem cor e textura semelhantes ao fígado nativo, enquanto (B) o ducto biliar e o stent PV permanecem pérvios e irrestritos. Clique aqui para ver uma versão maior desta figura.
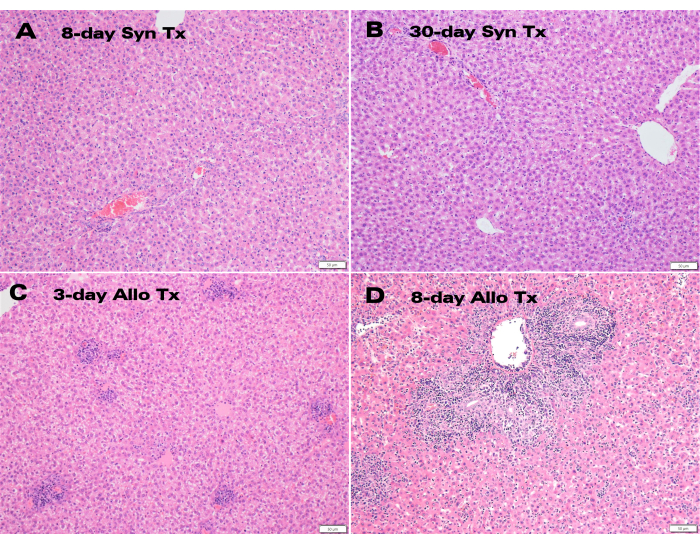
Figura 4: Histologia dos enxertos hepáticos auxiliares. Coloração H&E de (A) enxertos singênicos pós-transplante de 8 dias e (B) 30 dias exibindo estrutura hepatócita normal, juntamente com enxertos alogênicos de (C) 3 dias e (D) 8 dias exibindo inflamação portal e infiltração linfocítica. Barra de escala: 50 μm. Clique aqui para ver uma versão ampliada desta figura.
| Tx's alogênicos | Inflamação do portal | Lesão do ducto biliar | Inflamação Endo Venosa | Banff RAI |
| 3 dias (LT-34) | 2 | 2 | 3 | 7 |
| 3 dias (LT-38) | 1 | 0 | 0 | 1 |
| 8 dias (LT-20) | 3 | 3 | 3 | 9 |
| 8 dias (LT-40) | 3 | 3 | 3 | 9 |
| Tx's singênicos | ||||
| 8 dias (LT-13) | 0 | 0 | 0 | 0 |
| 8 dias (LT-19) | 0 | 0 | 0 | 0 |
| 30 dias (LT-28) | 0 | 0 | 0 | 0 |
| 30 dias (LT-32) | 0 | 0 | 0 | 0 |
Tabela 1: Esquema de Banff. Índice de atividade de rejeição (RAI) de LTx's alogênicos e singênicos de ratos.
Discussão
O transplante hepático é a única opção de tratamento para pacientes com doença hepática terminal, com quase 9.000 LTxs realizados anualmente nos EUA13. Infelizmente, a rejeição imunológica é observada em até 25% dos receptores de TxT, e essa rejeição é prejudicial ao órgão transplantado e ao paciente14,15. Para melhorar os resultados após o TxT, é necessário o desenvolvimento de modelos inovadores para estudar a rejeição de órgãos e implementar estratégias para diminuir a rejeição.
Comparado ao transplante hepático ortotópico de ratos, o presente modelo heterotópico é notavelmente fácil de estabelecer. O grau de dificuldade técnica é melhor calculado considerando a etapa mais difícil do procedimento, que são as anastomoses término-terminal da CVHI com a veia renal. Nossa preferência pessoal por essa conexão é utilizar a sutura tradicional, enquanto outros acham o sistema de balonete mais conveniente 3,4; De qualquer forma, qualquer pessoa que se sinta confortável com a anastomose término-terminal de uma veia de 3 mm por qualquer método tem todas as habilidades técnicas necessárias para realizar esse procedimento. Tendo acesso a um microscópio de cabeça dupla, preferimos fazer essas cirurgias com duas pessoas; no entanto, isso não é um requisito para o sucesso com este protocolo, pois também foi realizado sozinho.
A principal complicação pós-operatória deste modelo é a trombose do fígado do enxerto, que é provocada por três coisas. Primeiro, o próprio stent arterial pode induzir trombose se as extremidades do stent tiverem rebarbas ou irregularidades que causem turbulência no fluxo sanguíneo. O stent deve ser cortado com uma navalha afiada, não com uma tesoura, e depois inspecionado ao microscópio para garantir que não haja imperfeições. Em segundo lugar, se a anastomose da artéria renal/stent PV estiver posicionada sobre a anastomose da veia renal/IHVC, ela restringirá o fluxo sanguíneo e induzirá trombose. A colocação final do stent arterial deve ser abaixo do IHVC, ver Figura 2D. Em terceiro lugar, o tratamento pós-cirúrgico com o anticoagulante heparina é essencial para prevenir a trombose de transplantes alogênicos, enquanto uma dose menor de heparina também é útil para eliminar o risco de trombose nos enxertos singênicos.
A menor taxa de sobrevida para os transplantes alogênicos em comparação com os enxertos singênicos aqui relatados reflete a natureza pró-trombótica do fígado auxiliar de rejeição, que desencadeia trombose do stent arterial. Várias tentativas foram necessárias para encontrar um esquema de dosagem de heparina que pudesse impedir a trombose do stent em transplantes alogênicos. Inicialmente, dos primeiros 6 receptores de aloenxerto a sobreviver à cirurgia, 50% dos fígados auxiliares falharam devido à trombose, mas após um aumento na dosagem de heparina, os três transplantes alogênicos finais seguintes sobreviveram sem trombose. Seguindo em frente, tendo determinado uma dose eficaz de heparina, esperamos que a taxa de sucesso dos transplantes alogênicos aumente significativamente. Da mesma forma, a maioria das falhas singéicas ocorreu no início do desenvolvimento, e esperamos que a taxa de sucesso dos transplantes singênicos também melhore.
Usamos o modelo de rejeição aguda de Lewis para Brown Norway LTx porque a combinação de cepas Brown Norway para Lewis não rejeita16. Vale ressaltar que, quando os métodos de transplante ortotópico são utilizados com esse modelo de rejeição, e ocorre a rejeição hepática, os animais receptores sofrem morbidade severa à medida que ficam deprimidos, inativos e param de comer antes de morrer em 14 dias16. No entanto, com este modelo heterotópico de LTx, a morte não é usada como desfecho e a morbidade não ocorre; O animal permanece saudável e ativo durante o experimento, mesmo quando o fígado auxiliar é completamente rejeitado. Sem dúvida, este modelo heterotópico de LTx contribui significativamente para minimizar a dor, o sofrimento e o sofrimento experimentados pelos animais receptores.
Avanços recentes na perfusão hepática ex vivo normotérmica (NEVLP) são um avanço empolgante na forma como os fígados são armazenados antes do transplante clínico 17,18,19. Durante a NEVLP, o fígado do doador retoma a atividade fisiológica, permitindo intervenções terapêuticas antes do transplante20,21. A NEVLP também está sendo cada vez mais usada para avaliar a viabilidade de órgãos marginais (fígados de doadores mais velhos ou obesos ou fígados obtidos de doadores após morte cardíaca)22,23. Embora empolgante, apenas um punhado de laboratórios conseguiu transplantar fígados de ratos após o NEVLP24,25. Isso provavelmente se deve ao estresse cirúrgico do animal e à alta demanda técnica de preparação do fígado para NEVLP e transplante. Em contraste, a técnica operatória heterotópica de LTx descrita neste manuscrito é menos exigente tecnicamente e causa menos estresse no animal. Como tal, pode ser uma opção viável para modelos de pequenos animais de NEVLP e transplante subsequente.
Em conclusão, apresentamos um modelo alternativo de transplante hepático de baixa morbidade que pode ser benéfico para futuros estudos de rejeição de transplante.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Esta pesquisa foi apoiada pelo National Institute of Health (NIH) K08AI155816, concedido ao DA.
Materiais
| Name | Company | Catalog Number | Comments |
| 3-0 Silk Suture | Ethicon | C013D | |
| 5-0 Silk ties | Fine Science Tools | 18020-50 | |
| 6-0 Silk ties | Fine Science Tools | 18020-60 | |
| 7-0 Silk ties | Teleflex | 103-s | |
| 9-0 Polyamide Suture | AROSurgical | T05A09N10-13 | Black |
| Bipolar Cautery | Codman & Shurtleff Inc. | P.H. 234 | |
| Buprenorphine HCL | Hospira | 409201232 | |
| Forceps, Adson-Brown | Fine Science Tools | 11627-12 | 12.5 cm |
| Forceps, Angled Dumont | Fine Science Tools | 11253-25 | Medical #5/45 11 cm |
| Forceps, Suture Tying | Fine Science Tools | 18025-10 | 10 cm |
| Heparin Sodium Injection, USB | Fresenius Kabi | 504015 | 10,000 USP units per 10 mL |
| Hydrodissection Cannula | Ambler Surgical | 1021E | 27 G |
| Isoflurane | Dechra Vet. Products | 17033-091-25 | |
| I.V. Catheter | Kendall | 2619PUR | 26 G x 3/4" |
| Magnetic Retraction System | Fine Science Tools | 18200-50 | |
| Micro Clamps | Fine Science Tools | 18055-05 | 6 mm |
| Micro Clamps | Fine Science Tools | 18055-06 | 4 mm |
| Micro Clamp Applicator | Fine Science Tools | 18057-14 | 14 cm |
| Micro Needle Holder | S&T | C-14 | 14 cm |
| Microscope | Zeiss | Universal S3 | Dual head |
| Ophthalmic Ointment | Puralube | 14590500 | |
| Polyimidi Tubing | Cole Parmer | 95820-04 | OD 0.0215", ID 0.0195", wall 0.0010" |
| Saline | Baxter | 281324 | 0.9% Sodium Chloride |
| Surgical Spring Scissors | S&T | SDC-15 | Blunt 14 cm |
| Surgical Spring Scissors | Fine Science Tools | 15021-15 | Vannas 14 cm |
Referências
- Lee, S., Edgington, T. S. Heterotopic liver transplantation utilizing inbred rat strains. Am J Pathol. 52 (3), 649-669 (1968).
- Hess, F., Jerusalem, C., Van der Heyde, M. N. Advantages of auxiliary liver homotransplantation in rats. Arch Surg. 104, 76-80 (1972).
- Marni, A., Ferrero, M. Heterotopic liver grafting in the rat. A simplified method using cuff techniques. Transplantation. 39 (3), 329-331 (1985).
- Kobayashi, E., et al. Auxiliary heterotopic liver transplantation in the rat: a simplified model using cuff technique and application for congenitally hyperbilirubimemic Gunn rat. Microsurgery. 18 (2), 97-102 (1998).
- Schleimer, K., et al. Auxiliary liver transplantation with flow-regulated portal vein arterialization offers a successful therapeutic option in acute hepatic failure--investigations in heterotopic auxiliary rat liver transplantation. Transpl Int. 19 (7), 581-588 (2006).
- Qiao, J., Han, C., Zhang, J., Wang, Z., Meng, X. A new model of auxiliary partial heterotopic liver transplantation with liver dual artery supply. Exp Ther Med. 9 (2), 367-371 (2015).
- Li, J., Ren, J., Zhang, J., Meng, X. A. Modified kidney-sparing portal vein arterialization model of heterotopic auxiliary liver transplantation increases liver IL-6, TNF-α, and HGF levels and enhances liver regeneration: an animal model. BMC Surg. 2, 281-292 (2022).
- Ono, Y., et al. Regeneration and cell recruitment in an improved heterotopic auxiliary partial liver transplantation (APLT) model in the rat. Transplantation. 101 (1), 92-100 (2017).
- Wang, J., et al. Auxiliary partial liver grafting in rats: effect of host hepatectomy on graft regeneration, and review of literature on surgical technique. Microsurgery. 22 (8), 371-377 (2002).
- Schleimer, K., et al. Heterotopic auxiliary rat liver transplantation with flow-regulated portal vein arterialization in acute hepatic failure. J Vis Exp. (91), e51115(2014).
- Prescott, M. J., Lidster, K. Improving quality of science through better animal welfare: the NC3Rs strategy. Lab Animal. 46 (4), 152-156 (2017).
- Banff schema for grading liver allograft rejection: an international consensus document. Hepatology. 25 (3), 658-663 (1997).
- Kwong, A. J., et al. OPTN/SRTR 2020 Annual Data Report: Liver. Am J Transplant. 22, Suppl 2 204-309 (2022).
- Nacif, L. S., et al. Late acute rejection in liver transplant: a systematic review. Arq Bras Cir Dig. 28 (3), 212-215 (2015).
- Levitsky, J., et al. Acute rejection increases risk of graft failure and death in recent liver transplant recipients. Clin Gastroenterol Hepatol. 15 (4), 584-593 (2017).
- Gong, J., Cao, D., Chen, Y., Li, J., Gong, J., Zeng, Z. Role of programmed death ligand 1 and Kupffer cell in immune regulation after orthotopic liver transplantation in rats. Int Immunopharmacol. 48, 8-16 (2017).
- Ceresa, C. D. L., Nasralla, D., Coussios, C. C., Friend, P. J. The case for normothermic machine perfusion in liver transplantation. Liver Transpl. 24 (2), 269-275 (2018).
- Nasralla, D., et al. A randomized trial of normothermic preservation in liver transplantation. Nature. 557 (7703), 50-56 (2018).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Goldaracena, N., et al. Anti-inflammatory signaling during ex vivo liver perfusion improves the preservation of pig liver grafts before transplantation. Liver Transpl. 22 (11), 1573-1583 (2016).
- Carlson, K. N., et al. Interleukin-10 and transforming growth factor-beta cytokines decrease immune activation during normothermic ex vivo machine perfusion of the rat liver. Liver Transpl. 27 (11), 1577-1591 (2021).
- Ig-Izevbekhai, K., Goldberg, D. S., Karp, S. J., Foley, D. P., Abt, P. L. Immunosuppression in donation after circulatory death liver transplantation: Can induction modify graft survival. Liver Transpl. 26 (9), 1154-1166 (2020).
- Kageyama, S., et al. Ischemia-reperfusion Injury in allogeneic liver transplantation: A role of CD4 T cells in early allograft injury. Transplantation. 105 (9), 1989-1997 (2021).
- Oldani, G., et al. The impact of short-term machine perfusion on the risk of cancer recurrence after rat liver transplantation with donors after circulatory death. PLoS One. 14 (11), e0224890(2019).
- Schlegel, A., Graf, R., Clavien, P. A., Dutkowski, P. Hypothermic oxygenated perfusion (HOPE) protects from biliary injury in a rodent model of DCD liver transplantation. J Hepatol. 59 (5), 984-991 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados