Method Article
利用肝输尿管造口术进行同种异体移植物排斥反应研究的异位辅助全肝大鼠移植模型
摘要
此处描述的大鼠异位辅助肝移植方案为探索肝同种异体移植物排斥反应的机制提供了一种实用的研究工具。该模型有助于缓解大鼠原位肝移植的手术障碍和动物应激。
摘要
小动物移植模型对于临床前研究中研究可行的治疗干预措施的器官耐受性研究是必不可少的。大鼠肝移植 (LTx) 方案通常使用原位模型,其中受体的天然肝脏被切除并替换为供体肝脏。这种技术要求很高的外科手术需要先进的显微外科技术,并且由于漫长的肝脏无休和下半身缺血时间而进一步复杂化。这促使开发了一种不太复杂的异位方法,该方法可以在没有肝脏或下半身缺血时间的情况下更快地进行,从而减少受体动物的术后压力。
这种异位 LTx 方案包括两个主要步骤:从供体大鼠中切除肝脏并将整个肝脏移植到受体大鼠中。在供体肝脏切除过程中,外科医生结扎肝上腔静脉 (SHVC) 和肝动脉 (HA)。在受体侧,外科医生切除左肾,将供体肝脏与门静脉 (PV)、肝下腔静脉 (IHVC) 和面向肾血管的胆管放在一起。此外,外科医生将受者的肾静脉与肝脏的 IHVC 首尾相吻合,并使用支架将 PV 与肾动脉隔开。肝输尿管造口术用于胆道引流,将胆管吻合到受者的输尿管,允许胆汁通过膀胱排出。
移植平均持续时间为 130 min,冷缺血持续时间约为 35 min,热缺血持续时间小于 25 min。来自同基因移植的辅助肝脏的苏木精和伊红组织学显示肝细胞结构正常,移植后 30 天没有明显的实质改变。相比之下,移植后 8 天的同种异体移植物标本显示广泛的淋巴细胞浸润,Banff Schema 排斥活性指数评分为 9。因此,这种 LTx 方法有助于替代原位 LTx 的低发病率排斥模型。
引言
小动物 LTx 是研究肝脏排斥机制的宝贵模型。1968 年,Lee 和 Edgington1在大鼠中引入了异位门静脉动脉化辅助肝移植 (HALT-PVA),当时他们报告了使用受者的肾静脉和动脉对移植的辅助肝脏进行血管化。随后,Hess 等人 2 通过减小自体和供体肝脏的大小以及重建供体胆管连接,从而减轻自体肝脏和辅助肝脏之间的功能竞争,从而增强方案,从而实现移植物的长期存活。通过引入袖带吻合术 3,4 进行了进一步的改进,Schleimer 等人 5 确定了调节血流以获得生理门静脉流并避免移植物高灌注或低灌注的最佳支架直径。其他研究人员通过使用脾6 动脉或髂总动脉7 动脉进行移植物血液供应,对该方法进行了重大改变,而一些研究人员开发了仅使用静脉血8 或仅使用动脉血通过肝动脉9 供应辅助肝移植物的模型。
本研究假设来自天然肝脏的功能竞争不会干扰同种异体移植物排斥反应,因此我们开发了一种基于流量调节的 Schleimer 模型10 的方案,该方案不包括天然或辅助肝脏的任何尺寸减小。选择受体的左侧来定位移植物,因为它在受体的肾血管和供体肝血管之间提供了最佳方向。最初,我们尝试通过肝十二指肠造口术进行胆道重建,但这些试验只是证实了 Schleimer 的断言,即“胆道引流是肝移植的阿喀琉斯之踵”10。这促使开发了一种新技术,其中使用支架与受者输尿管进行端到端吻合胆管,从而允许胆汁通过膀胱排出。使用肝输尿管造口术的一个值得注意的好处是,可以通过观察尿液每天监测移植物肝脏的功能;产生胆汁的肝脏移植物使尿液呈亮黄色。 图 1 显示了 HALT-PVA 方法的示意图。
异位大鼠 LTx 的一个重要优势是没有任何肝或全下半身缺血时间,这允许异位受者更快、更容易地恢复。此外,利用原位方法的 LTx 免疫学研究通常依赖于受体的严重排斥反应或死亡作为实验终点,而异位移植的情况并非如此,即使同种异体移植物因排斥反应而停止功能,动物也能保持健康。异位方法的这两个特点都支持国际 3R 倡议(替代、减少和细化)11 的原则,该倡议促进了一个框架,以最大限度地减少研究动物所经历的痛苦、痛苦和痛苦并改善它们的福利。
这里报道的 HALT-PVA 模型是一种实用且可靠的方法,用于研究临床前研究中肝同种异体移植物排斥反应的机制。这种有用的实验技术有助于克服大鼠原位 LTx 的相当大的手术需求和动物应激。未来,我们打算使用这种方法来研究急性免疫排斥反应的机制,同时探索抑制肝同种异体移植物排斥反应的新靶点和治疗策略。
研究方案
根据机构指南,在威斯康星大学 (UW)-麦迪逊医学研究所 (University of Wisconsin-Madison Institute for Medical Research) 的动物护理机构中,将动物饲养在无病原体的特定条件下。研究方案(第 M006022 号)得到了威斯康星大学医学与公共卫生学院机构动物护理和使用委员会的批准,所有动物都得到了合乎道德的对待。
1. 动物
- 使用体重为 205-235 克的成年 Lewis 雌性大鼠和体重为 250-280 克的 Lewis 雄性作为供体大鼠。使用体重为 365-420 g 的成年雄性 Lewis 和 Brown Norway 大鼠作为受体。
- 通过将 Lewis 供体移植到 Lewis 受体中来进行同基因移植,而同种异体移植则利用移植到 Brown Norway 受体中的 Lewis 供体。
- 由两个人使用双头显微镜进行所有手术。
2. 辅助肝脏供体获取程序
- 在诱导室中吸入 5% 异氟醚麻醉供体大鼠。记录大鼠的体重,并用电动剪刀剃掉腹部。
- 将大鼠仰卧在加热的手术垫上,鼻子位于麻醉锥中,并用胶带固定四肢。用 75% 酒精消毒腹部,并将异氟醚降低至 2%。
- 用剪刀从耻骨到剑突做一个纵向中线皮肤和肌肉切口。在纵向切口的中点附近,将其向左和向右横向延伸,然后在腹壁和剑突两侧安装牵开器。
- 使用湿棉签将肠道缩回腹部左侧,同时用弹簧剪刀剪断附着在肝脏上的胃韧带,然后将肠道固定在湿润的纱布下。用一小块蘸有温盐水的无菌纱布覆盖肝脏。
- 使用湿棉签缩回肝脏并解剖镰状韧带、三角韧带、肝胃韧带和肝十二指肠韧带。接下来,用双极镊子烧灼,并将食管旁血管分为左侧尾状叶和前尾状叶。
- 使用角镊或持针器,在隔膜下方的 SHVC 后面解剖,然后在 SHVC 下通过 5-0 丝缝合线,松散地打一个双结以备后用。
- 向上缩回右下外叶,切断韧带,并固定在湿润的纱布下。将 IHVC 从腹膜后组织分离到右肾静脉,并用 6-0 丝线缝合尽可能靠近 IHVC 连接右肾上腺静脉。稍后去除移植物时,将这条静脉分开。
- 使用 27 G 水解剖针(图 2A),将 PV 与周围的结缔组织分离,并通过使用 7-0 丝缝合线结扎和分割它们,将其与幽门和脾静脉分离。
- 隔离,用 6-0 丝缝合线连接,并在靠近 PV 下方通过的位置分开肝总动脉。
- 在胃十二指肠动脉的分支处用 5-0 丝缝合线结扎胆管,同时尽可能保留胆管周围的脂肪组织;特别是,避免将胆管与适当的肝动脉分开,同时保持总长度尽可能短。
- 使用弹簧剪刀,在结扎近端的胆管壁上做一个小切口。将直径为 0.0215 英寸、长 5 毫米的聚酰亚胺管支架插入胆管管腔,并用 6-0 丝缝合线固定,将缝合线的一端留长以备后用。通过在 5-0 和 6-0 结扎之间切割来分割胆管。
- 用手术染笔标记 IHVC 和 PV 的顶部,以帮助在吻合过程中对齐血管,然后用尽可能远离肝脏的微血管夹夹住门静脉。
- 将带有 20 G 针头的 26 mL 注射器插入微型夹近端的 PV 中,并用 10-15 mL 冰冷的肝素化盐水灌注肝脏;同时,使用弹簧剪刀尽可能靠近右肾静脉分开 IHVC。
- 使用弹簧剪刀切除肝脏,方法是解剖微夹近端的 PV,拧紧先前放置在 SHVC 周围的 5-0 缝合线,并解剖隔膜以横切胸腔内静脉。
- 继续解剖肝脏后部的剩余韧带,并分割先前结扎的肾上腺静脉。将切除的肝脏放入冰上的冷盐水中。
3. 辅助肝受体移植手术
- 在诱导室中用 5% 异氟醚吸入麻醉受体大鼠。记录大鼠的体重,并用电动剪刀剃掉腹部。
- 将大鼠仰卧在加热的手术垫上,鼻子位于麻醉锥中,并用胶带固定四肢。涂抹眼部润滑剂,用 75% 酒精消毒腹部,并将异氟醚降至 2%。
- 用剪刀从耻骨到剑突做一个纵向中线皮肤和肌肉切口,然后在腹壁两侧安装牵开器。
- 使用湿棉签将肠道缩回腹部右侧,并用湿润的纱布覆盖。再用湿纱布覆盖胃、脾和肝,露出左肾和肾血管。
- 使用 27 G 水解剖针和钝尖镊子,将左肾静脉与肾动脉分开,小心地去除两条血管中的脂肪和结缔组织。
- 隔离性腺和肾上腺静脉,并使用 6-0 丝暂时将它们结扎在肾静脉近端。使用双极镊子烧灼所有微侧支,隔离主动脉/VC 和肾脏之间的肾静脉和动脉。
- 在下极用 6-0 丝缝合线移动和结扎输尿管。用手术染笔标记肾静脉和动脉,以帮助在吻合过程中确定血管的方向并确保没有扭曲。
- 用微血管夹夹住肾动脉和肾静脉,尽可能靠近主动脉和 VC。用弹簧剪刀横切肾动脉,刚好经过血管分叉处,并在 VC 和肾脏之间将肾静脉分成大约一半。从周围的结缔组织中动员左肾并将其取出。
- 使用 27 G 水解剖针用肝素化盐水冲洗两根血管,以去除所有剩余的血液。
- 用弹簧剪刀在肾动脉分叉的叉子上切出一个小鱼口,形成一个漏斗形的开口,并插入一个从 26 G 导管上切下的 8 毫米支架(图 2B)。用 6-0 丝缝线固定支架,将缝合线的一端留作后用。
- 引入供体肝脏并将其放置在面向受者左肾静脉和动脉的 PV、IHVC 和胆管的位置。使用 9-0 尼龙缝合线,在 IHVC-肾静脉连接的相对两侧安装两条支撑缝合线。
- 比较血管的宽度,并使用弹簧剪刀在肾静脉表面做一个小鱼口切口,直到它与供体的 IHVC 的宽度相似(图 2C)。
- 使用 9-0 尼龙缝合线,用 9 或 10 条穿过血管前后壁的 9 或 10 条连续缝合线将肝脏 IHVC 端到端吻合到肾静脉。或者,使用袖带方法完成这种吻合 3,4。
- 确认肾动脉的位置在 IHVC 下方(图 2D),并将先前放置在肾动脉中的支架插入肝门静脉并用 6-0 丝缝线固定,使缝合线的一端长连接到动脉上的相反螺纹。将两端拉在一起,以防止每端从支架上滑落。
- 先取下肾静脉上的微夹,然后再取下肾动脉上的微夹。
- 在肝脏再灌注期间,使用纱布和棉签在吻合区域周围施加轻压,直到实现未闭吻合(图 2D)。移除先前放置在肾上腺和性腺静脉上的临时结扎。
- 小心地从左输尿管末端从周围的结缔组织中向下移动约 10 毫米,留下大量附着的脂肪组织。用弹簧剪刀在输尿管壁上做一个小切口,靠近先前放置的 5-0 结扎。
- 将先前连接到胆管的聚酰亚胺支架插入输尿管壁上的小切口中。用 6-0 丝缝合线固定,用支架胆管侧的长线将一端系在一起,将两端牢固地拉在一起。
- 将肠道恢复到自然位置(图 2E),用 2-3 mL 盐水冲洗,并使用 3-0 丝线缝合线将腹部分成两层封闭。
- 皮下注射 0.1 mg/kg 丁丙诺啡,将受体置于干净、加热的笼子中,监测恢复 1-2 小时,然后将动物送回动物饲养设施。
4. 术后随访
- 从术后第 2 天开始,每天皮下注射同种异体移植受者肝素 (1 IU/g)。
- 从术后第 2 天开始,每隔一天皮下注射同基因移植受者肝素 (1 IU/2 g)。
结果
目前,已使用 29 对大鼠建立 HALT-PVA 方案、17 例同基因移植和 12 例同种异体移植。同基因移植肝脏存活到指定的 8 或 30 天实验终点,成功率为 70%,而同种异体移植肝脏存活到指定的 3 或 8 天终点,成功率为 50%。失败包括因手术并发症而死亡的大鼠和即使受体存活下来也失败的辅助肝脏。
手术平均持续时间为 130 min,冷缺血时间约为 35 min,热缺血时间小于 25 min。在没有术中并发症的情况下,受者在 10-20 分钟内醒来并变得活跃,在 1 小时内开始饮水和走动,24 小时后,他们的行为与正常健康大鼠相似。
同基因肝移植物在移植后 30 天表现出优异的颜色和胆管通畅性(图 3),而苏木精和伊红 (H&E) 组织学显示正常的肝细胞结构,在 8 天和 30 天的时间点上没有明显的实质改变(图 4A、B)。仅 3 天后,同种异体移植的组织学显示明显的门静脉炎症(图 4C),而 8 天的同种异体移植物显示急性细胞排斥反应和广泛的淋巴细胞浸润(图 4D)。
由董事会认证的肝脏病理学家评估代表性同种异体和同源 LTx 标本,并使用 Banff Schema 排斥活性指数 (RAI) 对排斥反应进行评分12。病理评估确定在 8 天和 30 天同基因移植中不存在排斥反应,班夫 RAI 为 0,而 8 天同种异体移植物严重排斥反应,班夫 RAI 评分为 9(表 1)。
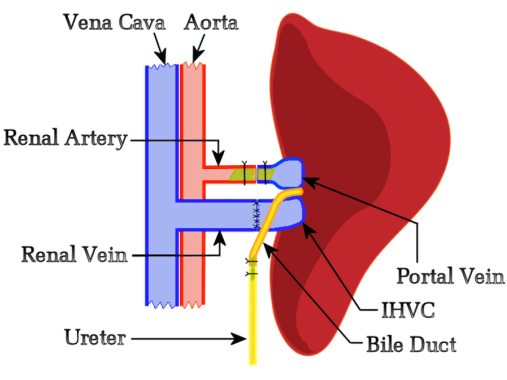
图 1:大鼠 HALT-PVA 程序示意图。 PV 使用支架与左肾动脉动脉相连,IHVC 与左肾静脉首尾相连,胆管使用支架连接到输尿管。 请单击此处查看此图的较大版本。

图 2: 外科手术。 (A) PV 的水解剖。用 27 G 水解剖针将 PV 与周围结缔组织解离。(B) 插入动脉支架。动脉支架插入肾动脉分叉叉处的一个小漏斗状开口中。(C) 扩大肾静脉。为了匹配用于吻合的供体 IHVC 的较大宽度,在两次固定缝合就位后,在受者的肾静脉表面做一个小鱼口切口。 (D) 吻合后立即灌注肝移植物。将肾动脉和 PV 连接定位在肾静脉和 IHVC 下方对于防止移植物血栓形成至关重要。(E) 大鼠 HALT-PVA 原位。 辅助肝脏位于腹部左壁上,然后返回肠道。 请单击此处查看此图的较大版本。
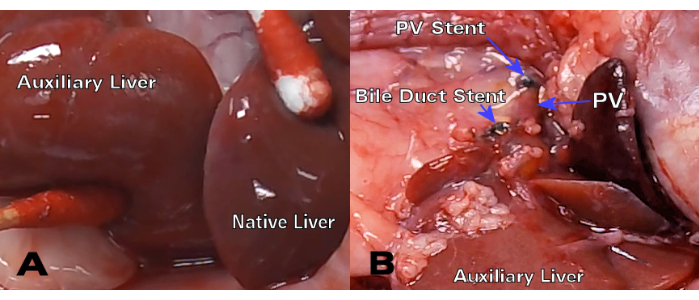
图 3:移植后 30 天的同基因 HALT-PVA。 (A) 30 天后,辅助肝脏具有与天然肝脏相似的颜色和质地,而 (B) 胆管和 PV 支架保持通畅且不受限制。 请单击此处查看此图的较大版本。
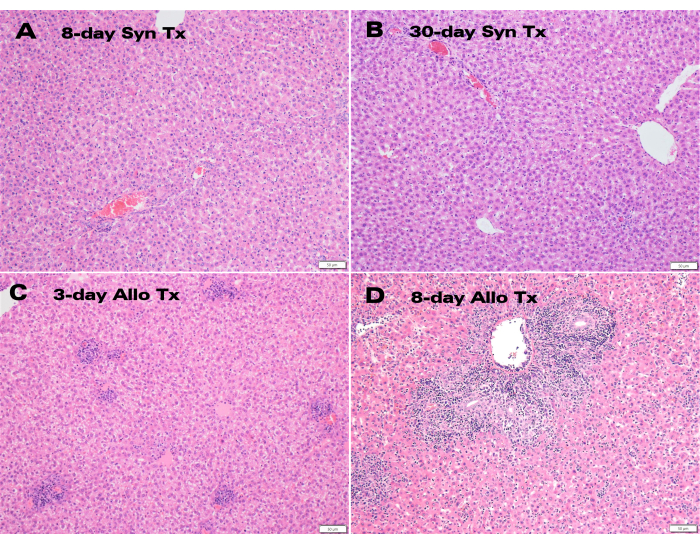
图 4:辅助肝移植物的组织学。 (A) 移植后 8 天和 (B) 30 天同基因移植物的 H&E 染色显示正常的肝细胞结构,以及 (C) 3 天和 (D) 8 天的同种异体移植物,显示门静脉炎症和淋巴细胞浸润。比例尺:50 μm。 请点击此处查看此图的较大版本。
| 同种异体 Tx | 门静脉炎 | 胆管损伤 | 静脉内膜炎 | 班夫 RAI |
| 3 天 (LT-34) | 2 | 2 | 3 | 7 |
| 3 天 (LT-38) | 1 | 0 | 0 | 1 |
| 8 天 (LT-20) | 3 | 3 | 3 | 9 |
| 8 天 (LT-40) | 3 | 3 | 3 | 9 |
| 同源 Tx | ||||
| 8 天 (LT-13) | 0 | 0 | 0 | 0 |
| 8 天 (LT-19) | 0 | 0 | 0 | 0 |
| 30 天 (LT-28) | 0 | 0 | 0 | 0 |
| 30 天 (LT-32) | 0 | 0 | 0 | 0 |
表 1:Banff 架构。 同种异体和同源大鼠 LTx 的排斥活性指数 (RAI)。
讨论
肝移植是终末期肝病患者的唯一治疗选择,美国每年进行近 9,000 例LTxs13。不幸的是,高达 25% 的 LTx 受者存在免疫排斥反应,这种排斥反应对移植器官和患者有害14,15。为了改善 LTx 后的结果,需要开发创新模型来研究器官排斥反应并实施减少排斥反应的策略。
与原位大鼠肝移植相比,目前的异位模型非常容易建立。通过考虑手术中最困难的单个步骤,即 IHVC 与肾静脉的端到端吻合,最好计算技术难度的程度。我们个人对这种连接的偏好是使用传统的缝合,而其他人则发现袖带系统更方便 3,4;无论哪种方式,任何熟悉通过任何方法进行 3 mm 静脉端到端吻合的人都拥有完成此手术所需的所有技术技能。由于可以使用双头显微镜,我们更喜欢由两个人进行这些手术;然而,这不是该协议成功的必要条件,因为它也是单独执行的。
该模型的主要术后并发症是移植物肝脏血栓形成,这是由三件事引起的。首先,如果支架的末端有任何毛刺或不规则现象导致血流涡流湍流,动脉支架本身可以诱发血栓形成。支架应用锋利的剃须刀而不是剪刀切割,然后在显微镜下检查以确保没有缺陷。其次,如果肾动脉/PV 支架吻合口位于肾静脉/IHVC 吻合的顶部,它将限制血流并诱发血栓形成。动脉支架的最终放置应在 IHVC 下方,参见 图 2D。第三,术后使用抗凝肝素治疗对于预防同种异体移植的血栓形成至关重要,而较低剂量的肝素也有助于消除同基因移植物血栓形成的风险。
与此处报道的同基因移植物相比,同种异体移植的存活率较低,这反映了排斥辅助肝脏的促血栓形成性质,这会触发动脉支架的血栓形成。需要多次尝试才能找到一种肝素给药方案,以防止支架在同种异体移植中血栓形成。最初,在前 6 名手术存活的同种异体移植物受者中,50% 的辅助肝脏因血栓形成而失败,但在肝素剂量增加后,接下来的最后 3 名同种异体移植存活下来,没有血栓形成。展望未来,在确定了有效的肝素剂量后,我们预计同种异体移植的成功率将显着提高。同样,大多数同基因失败发生在发育早期,我们预计同基因移植的成功率也会提高。
我们使用了 Lewis 到 Brown Norway LTx 的急性排斥模型,因为 Brown Norway 到 Lewis 菌株组合不排斥16。值得注意的是,当原位移植方法与这种排斥模型一起使用时,发生肝脏排斥反应,受体动物会患上严重的并发症,因为它们变得抑郁、不活跃并在 14 天内死亡前停止进食16。然而,对于这种异位 LTx 模型,死亡不作为终点,也不会发生并发症;即使辅助肝脏完全排斥,动物在实验期间仍保持健康和活跃。毫无疑问,这种异位 LTx 模型有助于最大限度地减少受体动物所经历的痛苦、痛苦和痛苦。
常温离体肝灌注 (NEVLP) 的最新进展是临床移植前肝脏储存方式的一个令人兴奋的进步 17,18,19。在 NEVLP 期间,供体肝脏恢复生理活性,允许在移植前进行治疗干预20,21。NEVLP 也越来越多地用于评估边缘器官(来自老年或肥胖供体的肝脏或心脏死亡后从供体处获得的肝脏)的活力22,23。虽然令人兴奋,但只有少数实验室能够在 NEVLP24,25 后移植大鼠肝脏。这可能是由于动物的手术压力以及为 NEVLP 和移植准备肝脏的高技术要求。相比之下,本手稿中概述的异位 LTx 手术技术对技术的要求较低,对动物造成的压力也较小。因此,它可能是 NEVLP 小动物模型和后续移植的可行选择。
总之,我们提出了一种替代的低发病率肝移植模型,可能对未来的移植排斥反应研究有益。
披露声明
作者没有什么可披露的。
致谢
这项研究得到了美国国立卫生研究院 (NIH) K08AI155816 的支持,该研究所授予 DA。
材料
| Name | Company | Catalog Number | Comments |
| 3-0 Silk Suture | Ethicon | C013D | |
| 5-0 Silk ties | Fine Science Tools | 18020-50 | |
| 6-0 Silk ties | Fine Science Tools | 18020-60 | |
| 7-0 Silk ties | Teleflex | 103-s | |
| 9-0 Polyamide Suture | AROSurgical | T05A09N10-13 | Black |
| Bipolar Cautery | Codman & Shurtleff Inc. | P.H. 234 | |
| Buprenorphine HCL | Hospira | 409201232 | |
| Forceps, Adson-Brown | Fine Science Tools | 11627-12 | 12.5 cm |
| Forceps, Angled Dumont | Fine Science Tools | 11253-25 | Medical #5/45 11 cm |
| Forceps, Suture Tying | Fine Science Tools | 18025-10 | 10 cm |
| Heparin Sodium Injection, USB | Fresenius Kabi | 504015 | 10,000 USP units per 10 mL |
| Hydrodissection Cannula | Ambler Surgical | 1021E | 27 G |
| Isoflurane | Dechra Vet. Products | 17033-091-25 | |
| I.V. Catheter | Kendall | 2619PUR | 26 G x 3/4" |
| Magnetic Retraction System | Fine Science Tools | 18200-50 | |
| Micro Clamps | Fine Science Tools | 18055-05 | 6 mm |
| Micro Clamps | Fine Science Tools | 18055-06 | 4 mm |
| Micro Clamp Applicator | Fine Science Tools | 18057-14 | 14 cm |
| Micro Needle Holder | S&T | C-14 | 14 cm |
| Microscope | Zeiss | Universal S3 | Dual head |
| Ophthalmic Ointment | Puralube | 14590500 | |
| Polyimidi Tubing | Cole Parmer | 95820-04 | OD 0.0215", ID 0.0195", wall 0.0010" |
| Saline | Baxter | 281324 | 0.9% Sodium Chloride |
| Surgical Spring Scissors | S&T | SDC-15 | Blunt 14 cm |
| Surgical Spring Scissors | Fine Science Tools | 15021-15 | Vannas 14 cm |
参考文献
- Lee, S., Edgington, T. S. Heterotopic liver transplantation utilizing inbred rat strains. Am J Pathol. 52 (3), 649-669 (1968).
- Hess, F., Jerusalem, C., Van der Heyde, M. N. Advantages of auxiliary liver homotransplantation in rats. Arch Surg. 104, 76-80 (1972).
- Marni, A., Ferrero, M. Heterotopic liver grafting in the rat. A simplified method using cuff techniques. Transplantation. 39 (3), 329-331 (1985).
- Kobayashi, E., et al. Auxiliary heterotopic liver transplantation in the rat: a simplified model using cuff technique and application for congenitally hyperbilirubimemic Gunn rat. Microsurgery. 18 (2), 97-102 (1998).
- Schleimer, K., et al. Auxiliary liver transplantation with flow-regulated portal vein arterialization offers a successful therapeutic option in acute hepatic failure--investigations in heterotopic auxiliary rat liver transplantation. Transpl Int. 19 (7), 581-588 (2006).
- Qiao, J., Han, C., Zhang, J., Wang, Z., Meng, X. A new model of auxiliary partial heterotopic liver transplantation with liver dual artery supply. Exp Ther Med. 9 (2), 367-371 (2015).
- Li, J., Ren, J., Zhang, J., Meng, X. A. Modified kidney-sparing portal vein arterialization model of heterotopic auxiliary liver transplantation increases liver IL-6, TNF-α, and HGF levels and enhances liver regeneration: an animal model. BMC Surg. 2, 281-292 (2022).
- Ono, Y., et al. Regeneration and cell recruitment in an improved heterotopic auxiliary partial liver transplantation (APLT) model in the rat. Transplantation. 101 (1), 92-100 (2017).
- Wang, J., et al. Auxiliary partial liver grafting in rats: effect of host hepatectomy on graft regeneration, and review of literature on surgical technique. Microsurgery. 22 (8), 371-377 (2002).
- Schleimer, K., et al. Heterotopic auxiliary rat liver transplantation with flow-regulated portal vein arterialization in acute hepatic failure. J Vis Exp. (91), e51115 (2014).
- Prescott, M. J., Lidster, K. Improving quality of science through better animal welfare: the NC3Rs strategy. Lab Animal. 46 (4), 152-156 (2017).
- . Banff schema for grading liver allograft rejection: an international consensus document. Hepatology. 25 (3), 658-663 (1997).
- Kwong, A. J., et al. OPTN/SRTR 2020 Annual Data Report: Liver. Am J Transplant. 22, 204-309 (2022).
- Nacif, L. S., et al. Late acute rejection in liver transplant: a systematic review. Arq Bras Cir Dig. 28 (3), 212-215 (2015).
- Levitsky, J., et al. Acute rejection increases risk of graft failure and death in recent liver transplant recipients. Clin Gastroenterol Hepatol. 15 (4), 584-593 (2017).
- Gong, J., Cao, D., Chen, Y., Li, J., Gong, J., Zeng, Z. Role of programmed death ligand 1 and Kupffer cell in immune regulation after orthotopic liver transplantation in rats. Int Immunopharmacol. 48, 8-16 (2017).
- Ceresa, C. D. L., Nasralla, D., Coussios, C. C., Friend, P. J. The case for normothermic machine perfusion in liver transplantation. Liver Transpl. 24 (2), 269-275 (2018).
- Nasralla, D., et al. A randomized trial of normothermic preservation in liver transplantation. Nature. 557 (7703), 50-56 (2018).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Goldaracena, N., et al. Anti-inflammatory signaling during ex vivo liver perfusion improves the preservation of pig liver grafts before transplantation. Liver Transpl. 22 (11), 1573-1583 (2016).
- Carlson, K. N., et al. Interleukin-10 and transforming growth factor-beta cytokines decrease immune activation during normothermic ex vivo machine perfusion of the rat liver. Liver Transpl. 27 (11), 1577-1591 (2021).
- Ig-Izevbekhai, K., Goldberg, D. S., Karp, S. J., Foley, D. P., Abt, P. L. Immunosuppression in donation after circulatory death liver transplantation: Can induction modify graft survival. Liver Transpl. 26 (9), 1154-1166 (2020).
- Kageyama, S., et al. Ischemia-reperfusion Injury in allogeneic liver transplantation: A role of CD4 T cells in early allograft injury. Transplantation. 105 (9), 1989-1997 (2021).
- Oldani, G., et al. The impact of short-term machine perfusion on the risk of cancer recurrence after rat liver transplantation with donors after circulatory death. PLoS One. 14 (11), e0224890 (2019).
- Schlegel, A., Graf, R., Clavien, P. A., Dutkowski, P. Hypothermic oxygenated perfusion (HOPE) protects from biliary injury in a rodent model of DCD liver transplantation. J Hepatol. 59 (5), 984-991 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。