Method Article
Modello di trapianto di fegato intero di ratto ausiliario eterotopico che utilizza un'epaticoureterostomia per studi di rigetto dell'allotrapianto
In questo articolo
Riepilogo
Il protocollo di trapianto di fegato ausiliario eterotopico di ratto qui descritto offre uno strumento sperimentale pratico per esplorare i meccanismi di rigetto dell'allotrapianto epatico. Questo modello aiuta ad alleviare gli ostacoli chirurgici e lo stress animale del trapianto di fegato ortotopico nei ratti.
Abstract
I modelli di trapianto di piccoli animali sono indispensabili per gli studi di tolleranza d'organo che studiano interventi terapeutici fattibili negli studi preclinici. I protocolli di trapianto di fegato di ratto (LTx) utilizzano in genere un modello ortotopico in cui il fegato nativo dei riceventi viene rimosso e sostituito con un fegato di donatore. Questa procedura chirurgica tecnicamente impegnativa richiede competenze microchirurgiche avanzate ed è ulteriormente complicata dai lunghi tempi di ischemia anepatica e della parte inferiore del corpo. Ciò ha portato allo sviluppo di un metodo eterotopico meno complicato che può essere eseguito più velocemente senza tempo di ischemia anepatica o della parte inferiore del corpo, riducendo lo stress post-operatorio per l'animale ricevente.
Questo protocollo LTx eterotopico comprende due passaggi principali: l'asportazione del fegato dal ratto donatore e il trapianto dell'intero fegato nel ratto ricevente. Durante l'escissione del fegato del donatore, il chirurgo lega la vena cava sopraepatica (SHVC) e l'arteria epatica (HA). Sul lato ricevente, il chirurgo rimuove il rene sinistro e posiziona il fegato del donatore con la vena porta (PV), la vena cava infraepatica (IHVC) e il dotto biliare rivolti verso i vasi renali. Inoltre, il chirurgo anastomosi la vena renale del ricevente da un capo all'altro con l'IHVC del fegato e arterializza il PV con l'arteria renale utilizzando uno stent. L'epaticoureterostomia viene utilizzata per il drenaggio biliare anastomizzando il dotto biliare all'uretere del ricevente, consentendo lo scarico della bile attraverso la vescica.
La durata media del trapianto è stata di 130 minuti, la durata dell'ischemia fredda è stata di circa 35 minuti e la durata dell'ischemia calda è stata inferiore a 25 minuti. L'ematossilina e l'eosina istologica del fegato ausiliario da trapianti singenici hanno mostrato una struttura epatocitaria normale senza alterazioni parenchimali significative 30 giorni dopo il trapianto. Al contrario, i campioni di trapianto allogenico post-trapianto di 8 giorni hanno dimostrato un'estesa infiltrazione linfocitaria con un punteggio dell'indice di attività di rigetto dello schema di Banff di 9. Pertanto, questo metodo LTx facilita un modello di rigetto a bassa morbilità alternativo all'LTx ortotopico.
Introduzione
L'LTx per piccoli animali è un modello inestimabile per studiare i meccanismi di rigetto epatico. Il trapianto di fegato ausiliario eterotopico con arterializzazione della vena porta (HALT-PVA) nei ratti è stato introdotto nel 1968 da Lee e Edgington1quando hanno riferito di aver utilizzato la vena renale e l'arteria di un ricevente per rivascolarizzare un fegato ausiliario innestato. Successivamente, Hess et al.2 hanno migliorato il protocollo con la mitigazione della competizione funzionale tra il fegato nativo e quello ausiliario, riducendo le dimensioni del fegato nativo e del donatore e ricostruendo la connessione del dotto biliare del donatore, con conseguente sopravvivenza a lungo termine del trapianto. Ulteriori perfezionamenti sono stati apportati con l'introduzione dell'anastomosi della cuffia 3,4 e Schleimer et al.5 hanno determinato il diametro ottimale dello stent per regolare il flusso sanguigno per ottenere il flusso portale fisiologico ed evitare l'iper- o ipo-perfusione dell'innesto. Altri ricercatori hanno sviluppato modifiche significative al metodo utilizzando l'arteria splenica6 o l'arteria iliaca7 comune per l'alimentazione del sangue dell'innesto, mentre alcuni hanno sviluppato modelli che utilizzavano solo sangue venoso8 o solo sangue arterioso attraverso l'arteria epatica9 per fornire l'innesto epatico ausiliario.
Il presente studio ha ipotizzato che la competizione funzionale del fegato nativo non interferisca con il rigetto dell'allotrapianto, quindi abbiamo sviluppato un protocollo basato sul modello di Schleimer10 regolato dal flusso che non includeva alcuna riduzione delle dimensioni del fegato nativo o ausiliario. Il lato sinistro del ricevente è stato selezionato per localizzare l'innesto perché forniva un orientamento ottimale tra i vasi renali e epatici del ricevente e del donatore. Inizialmente, abbiamo tentato la ricostruzione biliare tramite epaticoduodenostomia, ma questi studi hanno semplicemente confermato l'affermazione di Schleimer che "il drenaggio biliare è il tallone d'Achille del trapianto di fegato"10. Ciò ha portato allo sviluppo di una nuova tecnica in cui il dotto biliare viene anastomizzato end-to-end utilizzando uno stent con l'uretere dei riceventi, consentendo lo scarico della bile attraverso la vescica. Un vantaggio degno di nota dell'utilizzo di un'epaticoureterostomia è che la funzionalità epatica del trapianto può essere monitorata quotidianamente osservando le urine; Un trapianto di fegato che produce bile colora l'urina di un giallo brillante. La Figura 1 rappresenta la panoramica schematica del metodo HALT-PVA.
Un importante vantaggio dell'LTx eterotopico rispetto a quello ortotopico del ratto è legato all'assenza di qualsiasi tempo di ischemia anepatica o totale della parte inferiore del corpo, che consente recuperi più rapidi e facili per i riceventi eterotopici. Inoltre, gli studi immunologici LTx che utilizzano metodi ortotopici spesso si basano sul grave rigetto o sulla morte del ricevente come endpoint sperimentale, cosa che non è il caso dei trapianti eterotopici, in cui l'animale rimane sano anche se l'allotrapianto smette di funzionare a causa del rigetto. Entrambe queste caratteristiche del metodo eterotopico supportano i principi dell'iniziativa internazionale delle 3R (Replacement, Reduction, and Refinement)11, che promuove un quadro per ridurre al minimo il dolore, la sofferenza e l'angoscia vissuti dagli animali da ricerca e migliorare il loro benessere.
Il modello HALT-PVA qui riportato è un metodo pratico e affidabile per studiare i meccanismi di rigetto dell'allotrapianto epatico negli studi preclinici. Questa utile tecnica sperimentale aiuta a superare le notevoli esigenze chirurgiche e lo stress animale della LTx ortotopica nei ratti. In futuro, intendiamo utilizzare questo metodo per studiare i meccanismi del rigetto immunitario acuto, esplorando nuovi bersagli e strategie terapeutiche per sopprimere il rigetto dell'allotrapianto epatico.
Protocollo
Gli animali sono stati allevati e alloggiati in specifiche condizioni prive di agenti patogeni nelle strutture di cura degli animali dell'Università del Wisconsin (UW)-Madison Institute for Medical Research in conformità con le linee guida istituzionali. Il protocollo di studio (n. M006022) è stato approvato dal Comitato istituzionale per la cura e l'uso degli animali presso la UW School of Medicine and Public Health e tutti gli animali sono stati trattati in modo etico.
1. Animali
- Utilizzare ratti femmine di Lewis adulti del peso di 205-235 g e maschi di Lewis del peso di 250-280 g come ratti donatori. Utilizzare come riceventi ratti maschi adulti di Lewis e Brown Norway del peso di 365-420 g.
- Eseguire trapianti singenici trapiantando donatori di Lewis in riceventi di Lewis, mentre i trapianti allogenici utilizzavano donatori di Lewis trapiantati in riceventi di Norvegia marrone.
- Eseguire tutti gli interventi chirurgici da parte di due persone utilizzando un microscopio a doppia testa.
2. Procedura ausiliaria di reperimento del donatore di fegato
- Anestetizzare il ratto donatore con inalazione di isoflurano al 5% in una camera di induzione. Registra il peso del ratto e rade l'addome con un tagliacapelli elettrico.
- Posizionare il ratto in posizione supina su un cuscinetto chirurgico riscaldato con il naso in un cono per anestesia e immobilizzare gli arti con del nastro adesivo. Disinfettare l'addome con alcol al 75% e abbassare l'isoflurano al 2%.
- Praticare un'incisione longitudinale della pelle e dei muscoli della linea mediana dal pube allo xifoide usando le forbici. Vicino al punto medio dell'incisione longitudinale, estenderla lateralmente a sinistra e a destra, quindi installare i divaricatori su entrambi i lati della parete addominale e del processo xifoideo.
- Usando tamponi di cotone umidi, ritrarre l'intestino sul lato sinistro dell'addome mentre si usano le forbici a molla per tagliare i legamenti gastrointestinali attaccati al fegato, quindi immobilizzare l'intestino sotto una garza inumidita. Copri il fegato con un pezzetto di garza sterile inumidita con soluzione salina calda.
- Utilizzare tamponi di cotone umidi per ritrarre il fegato e sezionare i legamenti falciformi, triangolari, epatogastrici ed epatoduodenali. Successivamente, cauterizzare con una pinza bipolare e dividere i vasi para-esofagei tra il lobo caudato laterale sinistro e quello anteriore.
- Utilizzando una pinza angolare o un portaaghi, sezionare dietro l'SHVC inferiore al diaframma, quindi passare una sutura di seta 5-0 sotto l'SHVC e fare un doppio nodo per un uso successivo.
- Ritrarre il lobo laterale destro inferiore verso l'alto, tagliare il legamento e immobilizzare sotto una garza inumidita. Isolare l'IHVC dal tessuto retroperitoneale fino alla vena renale destra e legare la vena surrenalica destra con una sutura di seta 6-0 il più vicino possibile all'IHVC. Dividi questa vena in un secondo momento, quando l'innesto viene rimosso.
- Utilizzando un ago per idrodissezione da 27 G (Figura 2A), dissociare il PV dal tessuto connettivo circostante e separarlo dalle vene piloriche e spleniche legandole e dividendole utilizzando una sutura di seta 7-0.
- Isolare, legare con sutura di seta 6-0 e dividere l'arteria epatica comune vicino al punto in cui passa sotto il PV.
- Legare il dotto biliare con una sutura di seta 5-0 alla ramificazione dell'arteria gastroduodenale, preservando il più possibile il tessuto adiposo intorno al dotto biliare; In particolare, evitare di separare il dotto biliare dall'arteria epatica corretta, mantenendo la lunghezza complessiva il più corta possibile.
- Usando le forbici a molla, praticare una piccola incisione nella parete del dotto biliare prossimale alla legatura. Inserire uno stent per tubo in poliimmide di 0,0215" di diametro per 5 mm di lunghezza nel lume del dotto biliare e fissarlo con una sutura di seta 6-0, lasciando un'estremità della sutura lunga per un uso successivo. Dividi il dotto biliare tagliando tra le legature 5-0 e 6-0.
- Segnare il lato superiore dell'IHVC e del PV con una penna chirurgica per aiutare ad allineare i vasi durante l'anastomosi, quindi bloccare la vena porta con un morsetto per microvasi il più distale possibile al fegato.
- Inserire una siringa da 20 ml con un ago da 26 G nel PV prossimale al micro morsetto e perfondere il fegato con 10-15 ml di soluzione salina eparinizzata ghiacciata; contemporaneamente, dividere l'IHVC usando le forbici a molla il più vicino possibile alla vena renale destra.
- Asportare il fegato usando le forbici a molla sezionando il PV prossimale al micro morsetto, stringendo la sutura 5-0 precedentemente posizionata attorno all'SHVC e sezionando il diaframma per sezionare la vena cava intratoracica.
- Continuare sezionando i legamenti rimanenti nella parte posteriore del fegato e dividere la vena surrenalica precedentemente legata. Mettere il fegato asportato in soluzione salina fredda su ghiaccio.
3. Procedura ausiliaria di trapianto di fegato ricevente
- Anestetizzare il ratto ricevente con inalazione di isoflurano al 5% in una camera di induzione. Registra il peso del ratto e rade l'addome con un tagliacapelli elettrico.
- Posizionare il ratto in posizione supina su un cuscinetto chirurgico riscaldato con il naso in un cono per anestesia e immobilizzare gli arti con del nastro adesivo. Applicare un lubrificante per gli occhi, disinfettare l'addome con alcol al 75% e abbassare l'isoflurano al 2%.
- Usando le forbici, praticare un'incisione longitudinale della pelle e dei muscoli della linea mediana dal pube allo xifoide, quindi installare i divaricatori su entrambi i lati della parete addominale.
- Usando tamponi di cotone umidi, ritrarre l'intestino sul lato destro dell'addome e coprirlo con una garza inumidita. Applicare un'altra garza umida per coprire lo stomaco, la milza e il fegato, esponendo il rene sinistro e i vasi renali.
- Utilizzando un ago per idrodissezione da 27 G e una pinza a punta smussata, separare la vena renale sinistra dall'arteria renale, rimuovendo accuratamente il grasso e il tessuto connettivo da entrambi i vasi.
- Isolare le vene gonadiche e surrenali e utilizzare la seta 6-0 per legarle temporaneamente prossimalmente alla vena renale. Cauterizzare, utilizzando una pinza bipolare, tutti i micro rami laterali isolando la vena renale e l'arteria tra l'aorta/VC e il rene.
- Mobilizzare e legare l'uretere con una sutura di seta 6-0 al polo inferiore. Contrassegna la vena renale e l'arteria con una penna chirurgica per aiutare a orientare i vasi durante l'anastomosi e assicurarti che non ci siano torsioni.
- Bloccare l'arteria renale e la vena renale con un morsetto per microvasi il più vicino possibile all'aorta e al VC. Sezionare l'arteria renale con le forbici a molla appena oltre la biforcazione del vaso e dividere la vena renale circa a metà strada tra il VC e il rene. Mobilizzare il rene sinistro dal tessuto connettivo circostante e rimuoverlo.
- Lavare entrambi i vasi con soluzione fisiologica eparinizzata utilizzando un ago per idrodissezione da 27 G per rimuovere tutto il sangue rimanente.
- Con le forbici a molla, tagliare una piccola apertura della bocca di pesce nella forchetta della biforcazione dell'arteria renale per creare un'apertura a forma di imbuto e inserire uno stent da 8 mm tagliato da un catetere da 26 G (Figura 2B). Fissare lo stent con una sutura di seta 6-0, lasciando un'estremità della sutura lunga per un uso successivo.
- Introdurre il fegato del donatore e posizionarlo con il PV, l'IHVC e il dotto biliare rivolti verso la vena renale sinistra e l'arteria del ricevente. Utilizzando una sutura in nylon 9-0, installare due suture di permanenza sui lati opposti della connessione IHVC-vena renale.
- Confrontare la larghezza dei vasi e praticare una piccola incisione della bocca di pesce utilizzando le forbici a molla nella faccia della vena renale fino a quando non ha una larghezza simile all'IHVC del donatore (Figura 2C).
- Utilizzando una sutura in nylon 9-0, anastomizzare l'IHVC epatico end-to-end alla vena renale con 9 o 10 suture in esecuzione su entrambe le pareti anteriore e posteriore del vaso. In alternativa, utilizzare un metodo del bracciale per completare questa anastomosi 3,4.
- Verificare che il posizionamento dell'arteria renale sia al di sotto dell'IHVC (Figura 2D) e inserire lo stent precedentemente posizionato nell'arteria renale nella vena porta del fegato e fissarlo con una sutura di seta 6-0, lasciando un'estremità della sutura lunga per attaccarsi al filo opposto sull'arteria. Avvicinare le estremità per evitare che ciascuna scivoli via dallo stent.
- Rimuovere prima il micro morsetto sulla vena renale, quindi rimuovere il micro morsetto sull'arteria renale.
- Durante la riperfusione del fegato, utilizzare una garza e tamponi di cotone per applicare una leggera pressione intorno alla regione dell'anastomosi fino a raggiungere un'anastomosi pervietà (Figura 2D). Rimuovere le legature temporanee precedentemente posizionate sulle vene surrenali e gonadiche.
- Mobilizzare con cautela circa 10 mm lungo l'estremità dell'uretere sinistro dal tessuto connettivo circostante, lasciando attaccata una quantità significativa di tessuto adiposo. Con le forbici a molla, praticare una piccola incisione nella parete dell'uretere prossimale alla legatura 5-0 precedentemente posizionata.
- Inserire lo stent in poliimmide precedentemente attaccato al dotto biliare nella piccola incisione praticata nella parete dell'uretere. Fissare con una sutura di seta 6-0 e legare un'estremità insieme al filo lungo sul lato del dotto biliare dello stent, unendo saldamente entrambe le estremità.
- Riportare l'intestino nella loro posizione naturale (Figura 2E), irrigare con 2-3 ml di soluzione fisiologica e chiudere l'addome in due strati utilizzando suture di seta 3-0.
- Iniettare 0,1 mg/kg di buprenorfina per via sottocutanea, posizionare il ricevente in una gabbia pulita e riscaldata e monitorare il recupero per 1-2 ore prima di riportare l'animale alla struttura di stabulazione per animali.
4. Follow-up post-chirurgico
- A partire dal 2° giorno dopo l'intervento, iniettare quotidianamente eparina (1 UI/g) per via sottocutanea ai riceventi di trapianto allogenico.
- A partire dal 2° giorno dopo l'intervento, iniettare ai riceventi di trapianto singenico eparina (1 UI/2 g) per via sottocutanea a giorni alterni.
Risultati
Attualmente, 29 coppie di ratti sono state utilizzate per stabilire il protocollo HALT-PVA, 17 trapianti singenici e 12 trapianti allogenici. I fegati trapiantati singenici sono sopravvissuti all'endpoint sperimentale designato di 8 o 30 giorni con un tasso di successo del 70%, mentre i fegati trapiantati allogenici sono sopravvissuti agli endpoint designati di 3 o 8 giorni con un tasso di successo del 50%. I fallimenti includono ratti morti a causa di complicazioni chirurgiche e fegati ausiliari che hanno fallito anche quando il ricevente è sopravvissuto.
La durata media dell'operazione è stata di 130 minuti, con un tempo di ischemia fredda di circa 35 minuti e un tempo di ischemia calda inferiore a 25 minuti. A condizione che non ci fossero complicazioni intraoperatorie, i riceventi si svegliavano e diventavano attivi entro 10-20 minuti, iniziavano a bere e a deambulare entro 1 ora e 24 ore dopo, si comportavano come normali ratti sani.
Gli innesti epatici singenici hanno dimostrato un eccellente colore e pervietà del dotto biliare 30 giorni dopo il trapianto (Figura 3), mentre l'ematossilina e l'eosina (H&E) hanno mostrato una struttura epatocitaria normale senza alterazioni parenchimali significative sia a 8 giorni che a 30 giorni (Figura 4A, B). Dopo soli 3 giorni, l'istologia dei trapianti allogenici ha mostrato una significativa infiammazione portale (Figura 4C), mentre i trapianti allogenici di 8 giorni hanno dimostrato un rigetto cellulare acuto con estesa infiltrazione linfocitaria (Figura 4D).
I campioni rappresentativi di LTx allogenici e singenici sono stati valutati da un patologo epatico certificato e il rigetto è stato valutato utilizzando l'indice di attività di rigetto dello schema di Banff (RAI)12. La valutazione patologica ha determinato che non era presente rigetto, con un RAI di Banff pari a 0, sia nei trapianti singenici di 8 giorni che in quelli di 30 giorni, mentre gli allotrapianti di 8 giorni sono stati gravemente respinti con un punteggio RAI di Banff di 9 (Tabella 1).
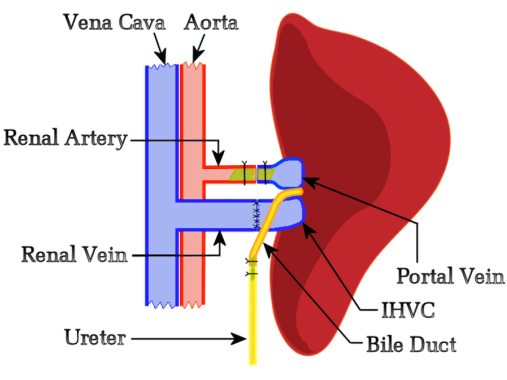
Figura 1: Diagramma schematico della procedura HALT-PVA del ratto. La PV viene arterializzata con l'arteria renale sinistra utilizzando uno stent, l'IHVC viene anastomizzata end-to-end alla vena renale sinistra e il dotto biliare viene collegato all'uretere utilizzando uno stent. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Procedura chirurgica. (A) Idrodissezione della PV. Dissociare il PV dal tessuto connettivo circostante con un ago per idrodissezione da 27 G. (B) Inserimento di uno stent arterioso. Lo stent arterioso viene inserito in una piccola apertura a forma di imbuto tagliata nella forchetta della biforcazione dell'arteria renale. (C) Allargamento della vena renale. Al fine di corrispondere alla maggiore larghezza dell'IHVC del donatore per l'anastomosi, viene praticato un piccolo taglio della bocca di pesce sulla faccia della vena renale del ricevente dopo che sono state posizionate due suture di soggiorno. (D) Innesto epatico perfuso subito dopo l'anastomosi. Il posizionamento dell'arteria renale e della connessione PV sotto la vena renale e l'IHVC è fondamentale per prevenire la trombosi del trapianto. (E) Rat HALT-PVA in situ. Il fegato ausiliario è posizionato contro la parete sinistra dell'addome prima di restituire l'intestino. Clicca qui per visualizzare una versione più grande di questa figura.
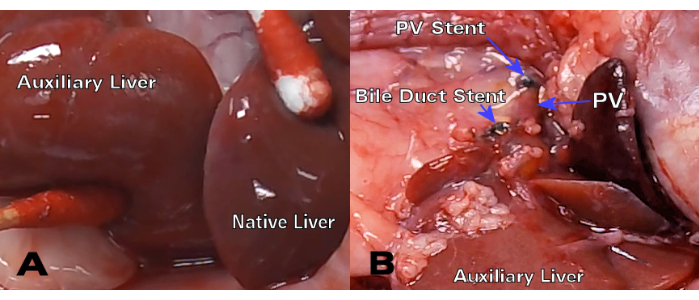
Figura 3: HALT-PVA singenico 30 giorni dopo il trapianto. (A) Dopo 30 giorni, il fegato ausiliario ha un colore e una consistenza simili al fegato nativo, mentre (B) il dotto biliare e lo stent PV rimangono pervii e senza restrizioni. Clicca qui per visualizzare una versione più grande di questa figura.
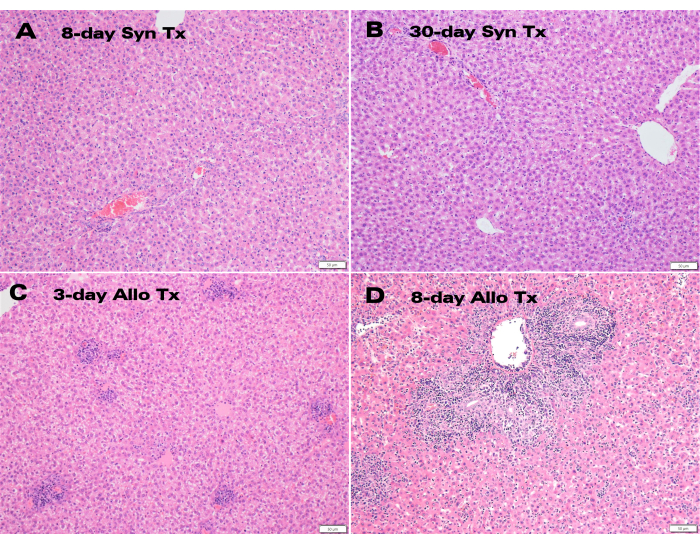
Figura 4: Istologia degli innesti epatici ausiliari. Colorazione H&E di (A) innesti singenici post-trapianto di 8 giorni e (B) 30 giorni che presentano una struttura epatocitaria normale insieme a (C) innesti allogenici di 3 giorni e (D) 8 giorni che mostrano infiammazione portale e infiltrazione linfocitaria. Barra della scala: 50 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
| Tx allogenici | Infiammazione portale | Lesione del dotto biliare | Infiammazione endovenosa | Banff RAI |
| 3 giorni (LT-34) | 2 | 2 | 3 | 7 |
| 3 giorni (LT-38) | 1 | 0 | 0 | 1 |
| 8 giorni (LT-20) | 3 | 3 | 3 | 9 |
| 8 giorni (LT-40) | 3 | 3 | 3 | 9 |
| Syngeneic Tx | ||||
| 8 giorni (LT-13) | 0 | 0 | 0 | 0 |
| 8 giorni (LT-19) | 0 | 0 | 0 | 0 |
| 30 giorni (LT-28) | 0 | 0 | 0 | 0 |
| 30 giorni (LT-32) | 0 | 0 | 0 | 0 |
Tabella 1: Schema di Banff. Indice di attività di rigetto (RAI) di LTx di ratto allogenico e singeneico.
Discussione
Il trapianto di fegato è l'unica opzione di trattamento per i pazienti con malattia epatica allo stadio terminale, con quasi 9.000 LTx eseguiti ogni anno negli Stati Uniti13. Sfortunatamente, il rigetto immunologico si osserva fino al 25% dei riceventi di LTx e questo rigetto è dannoso per l'organo trapiantato e per il paziente14,15. Per migliorare gli esiti dopo LTx, è necessario lo sviluppo di modelli innovativi per studiare il rigetto d'organo e implementare strategie per ridurre il rigetto.
Rispetto al trapianto ortotopico di fegato di ratto, l'attuale modello eterotopico è notevolmente facile da stabilire. Il grado di difficoltà tecnica è meglio calcolato considerando il singolo passaggio più difficile della procedura, che è l'anastomosi end-to-end dell'IHVC alla vena renale. La nostra preferenza personale per questa connessione è quella di utilizzare la sutura tradizionale, mentre altri trovano più conveniente un sistema di polsini 3,4; In ogni caso, chiunque si senta a proprio agio con l'anastomosi end-to-end di una vena di 3 mm con qualsiasi metodo ha tutte le competenze tecniche necessarie per eseguire questa procedura. Avendo accesso a un microscopio a doppia testa, preferiamo eseguire questi interventi chirurgici con due persone; Tuttavia, questo non è un requisito per il successo di questo protocollo, poiché è stato eseguito anche da solo.
La complicanza postoperatoria primaria di questo modello è la trombosi del fegato dell'innesto, che è provocata da tre cose. In primo luogo, lo stent arterioso stesso può indurre trombosi se le estremità dello stent presentano sbavature o irregolarità che causano turbolenze parassite nel flusso sanguigno. Lo stent deve essere tagliato con un rasoio affilato, non con le forbici, quindi ispezionato al microscopio per assicurarsi che non vi siano imperfezioni. In secondo luogo, se l'anastomosi dell'arteria renale/stent PV è posizionata sopra l'anastomosi della vena renale/IHVC, limiterà il flusso sanguigno e indurrà la trombosi. Il posizionamento finale dello stent arterioso deve essere sotto l'IHVC, vedere la Figura 2D. In terzo luogo, il trattamento post-chirurgico con l'anticoagulante eparina è essenziale per prevenire la trombosi dei trapianti allogenici, mentre una dose più bassa di eparina è utile anche per eliminare il rischio di trombosi nei trapianti singenici.
Il tasso di sopravvivenza inferiore per i trapianti allogenici rispetto ai trapianti singenici qui riportati riflette la natura pro-trombotica del fegato ausiliario di rigetto, che innesca la trombosi dello stent arterioso. Sono stati necessari diversi tentativi per trovare uno schema di dosaggio dell'eparina che potesse prevenire la trombosi dello stent nei trapianti allogenici. Inizialmente, dei primi 6 destinatari di allotrapianto sopravvissuti all'intervento chirurgico, il 50% dei fegati ausiliari ha fallito a causa della trombosi, ma a seguito di un aumento del dosaggio di eparina, i successivi tre trapianti allogenici sono sopravvissuti senza trombosi. Andando avanti, dopo aver determinato una dose efficace di eparina, ci aspettiamo che il tasso di successo dei trapianti allogenici aumenti in modo significativo. Allo stesso modo, la maggior parte dei fallimenti singenici si è verificata all'inizio dello sviluppo e ci aspettiamo che anche il tasso di successo dei trapianti singenici migliori.
Abbiamo utilizzato il modello di rigetto acuto di Lewis a Brown Norway LTx perché la combinazione di ceppo Brown Norway a Lewis non rifiutail 16. È interessante notare che quando i metodi di trapianto ortotopico vengono utilizzati con questo modello di rigetto e si verifica il rigetto epatico, gli animali riceventi soffrono di grave morbilità poiché diventano depressi, inattivi e smettono di mangiare prima di morire entro 14 giorni16. Tuttavia, con questo modello LTx eterotopico, la morte non viene utilizzata come endpoint e la morbilità non si verifica; L'animale rimane sano e attivo per tutta la durata dell'esperimento anche quando il fegato ausiliario è completamente rigettato. Indubbiamente, questo modello eterotopico di LTx contribuisce in modo significativo a ridurre al minimo il dolore, la sofferenza e l'angoscia vissuti dagli animali riceventi.
I recenti progressi nella perfusione epatica normotermica ex vivo (NEVLP) sono un progresso entusiasmante nel modo in cui i fegati vengono conservati prima del trapianto clinico 17,18,19. Durante la NEVLP, il fegato del donatore riprende l'attività fisiologica consentendo interventi terapeutici prima del trapianto20,21. La NEVLP viene anche sempre più utilizzata per valutare la vitalità di organi marginali (fegati da donatori anziani o obesi o fegati prelevati da donatori dopo morte cardiaca)22,23. Sebbene entusiasmante, solo una manciata di laboratori è stata in grado di trapiantare fegati di ratto dopo NEVLP 24,25. Ciò è probabilmente dovuto allo stress chirurgico sull'animale e all'elevata richiesta tecnica di preparazione del fegato sia per la NEVLP che per il trapianto. Al contrario, la tecnica operatoria eterotopica LTx descritta in questo manoscritto è meno impegnativa dal punto di vista tecnico e causa meno stress all'animale. In quanto tale, può essere un'opzione praticabile per piccoli modelli animali di NEVLP e successivo trapianto.
In conclusione, presentiamo un modello alternativo di trapianto di fegato a bassa morbilità che potrebbe essere utile per futuri studi di rigetto del trapianto.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata supportata dal National Institute of Health (NIH) K08AI155816, assegnato a DA.
Materiali
| Name | Company | Catalog Number | Comments |
| 3-0 Silk Suture | Ethicon | C013D | |
| 5-0 Silk ties | Fine Science Tools | 18020-50 | |
| 6-0 Silk ties | Fine Science Tools | 18020-60 | |
| 7-0 Silk ties | Teleflex | 103-s | |
| 9-0 Polyamide Suture | AROSurgical | T05A09N10-13 | Black |
| Bipolar Cautery | Codman & Shurtleff Inc. | P.H. 234 | |
| Buprenorphine HCL | Hospira | 409201232 | |
| Forceps, Adson-Brown | Fine Science Tools | 11627-12 | 12.5 cm |
| Forceps, Angled Dumont | Fine Science Tools | 11253-25 | Medical #5/45 11 cm |
| Forceps, Suture Tying | Fine Science Tools | 18025-10 | 10 cm |
| Heparin Sodium Injection, USB | Fresenius Kabi | 504015 | 10,000 USP units per 10 mL |
| Hydrodissection Cannula | Ambler Surgical | 1021E | 27 G |
| Isoflurane | Dechra Vet. Products | 17033-091-25 | |
| I.V. Catheter | Kendall | 2619PUR | 26 G x 3/4" |
| Magnetic Retraction System | Fine Science Tools | 18200-50 | |
| Micro Clamps | Fine Science Tools | 18055-05 | 6 mm |
| Micro Clamps | Fine Science Tools | 18055-06 | 4 mm |
| Micro Clamp Applicator | Fine Science Tools | 18057-14 | 14 cm |
| Micro Needle Holder | S&T | C-14 | 14 cm |
| Microscope | Zeiss | Universal S3 | Dual head |
| Ophthalmic Ointment | Puralube | 14590500 | |
| Polyimidi Tubing | Cole Parmer | 95820-04 | OD 0.0215", ID 0.0195", wall 0.0010" |
| Saline | Baxter | 281324 | 0.9% Sodium Chloride |
| Surgical Spring Scissors | S&T | SDC-15 | Blunt 14 cm |
| Surgical Spring Scissors | Fine Science Tools | 15021-15 | Vannas 14 cm |
Riferimenti
- Lee, S., Edgington, T. S. Heterotopic liver transplantation utilizing inbred rat strains. Am J Pathol. 52 (3), 649-669 (1968).
- Hess, F., Jerusalem, C., Van der Heyde, M. N. Advantages of auxiliary liver homotransplantation in rats. Arch Surg. 104, 76-80 (1972).
- Marni, A., Ferrero, M. Heterotopic liver grafting in the rat. A simplified method using cuff techniques. Transplantation. 39 (3), 329-331 (1985).
- Kobayashi, E., et al. Auxiliary heterotopic liver transplantation in the rat: a simplified model using cuff technique and application for congenitally hyperbilirubimemic Gunn rat. Microsurgery. 18 (2), 97-102 (1998).
- Schleimer, K., et al. Auxiliary liver transplantation with flow-regulated portal vein arterialization offers a successful therapeutic option in acute hepatic failure--investigations in heterotopic auxiliary rat liver transplantation. Transpl Int. 19 (7), 581-588 (2006).
- Qiao, J., Han, C., Zhang, J., Wang, Z., Meng, X. A new model of auxiliary partial heterotopic liver transplantation with liver dual artery supply. Exp Ther Med. 9 (2), 367-371 (2015).
- Li, J., Ren, J., Zhang, J., Meng, X. A. Modified kidney-sparing portal vein arterialization model of heterotopic auxiliary liver transplantation increases liver IL-6, TNF-α, and HGF levels and enhances liver regeneration: an animal model. BMC Surg. 2, 281-292 (2022).
- Ono, Y., et al. Regeneration and cell recruitment in an improved heterotopic auxiliary partial liver transplantation (APLT) model in the rat. Transplantation. 101 (1), 92-100 (2017).
- Wang, J., et al. Auxiliary partial liver grafting in rats: effect of host hepatectomy on graft regeneration, and review of literature on surgical technique. Microsurgery. 22 (8), 371-377 (2002).
- Schleimer, K., et al. Heterotopic auxiliary rat liver transplantation with flow-regulated portal vein arterialization in acute hepatic failure. J Vis Exp. (91), e51115 (2014).
- Prescott, M. J., Lidster, K. Improving quality of science through better animal welfare: the NC3Rs strategy. Lab Animal. 46 (4), 152-156 (2017).
- . Banff schema for grading liver allograft rejection: an international consensus document. Hepatology. 25 (3), 658-663 (1997).
- Kwong, A. J., et al. OPTN/SRTR 2020 Annual Data Report: Liver. Am J Transplant. 22, 204-309 (2022).
- Nacif, L. S., et al. Late acute rejection in liver transplant: a systematic review. Arq Bras Cir Dig. 28 (3), 212-215 (2015).
- Levitsky, J., et al. Acute rejection increases risk of graft failure and death in recent liver transplant recipients. Clin Gastroenterol Hepatol. 15 (4), 584-593 (2017).
- Gong, J., Cao, D., Chen, Y., Li, J., Gong, J., Zeng, Z. Role of programmed death ligand 1 and Kupffer cell in immune regulation after orthotopic liver transplantation in rats. Int Immunopharmacol. 48, 8-16 (2017).
- Ceresa, C. D. L., Nasralla, D., Coussios, C. C., Friend, P. J. The case for normothermic machine perfusion in liver transplantation. Liver Transpl. 24 (2), 269-275 (2018).
- Nasralla, D., et al. A randomized trial of normothermic preservation in liver transplantation. Nature. 557 (7703), 50-56 (2018).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Goldaracena, N., et al. Anti-inflammatory signaling during ex vivo liver perfusion improves the preservation of pig liver grafts before transplantation. Liver Transpl. 22 (11), 1573-1583 (2016).
- Carlson, K. N., et al. Interleukin-10 and transforming growth factor-beta cytokines decrease immune activation during normothermic ex vivo machine perfusion of the rat liver. Liver Transpl. 27 (11), 1577-1591 (2021).
- Ig-Izevbekhai, K., Goldberg, D. S., Karp, S. J., Foley, D. P., Abt, P. L. Immunosuppression in donation after circulatory death liver transplantation: Can induction modify graft survival. Liver Transpl. 26 (9), 1154-1166 (2020).
- Kageyama, S., et al. Ischemia-reperfusion Injury in allogeneic liver transplantation: A role of CD4 T cells in early allograft injury. Transplantation. 105 (9), 1989-1997 (2021).
- Oldani, G., et al. The impact of short-term machine perfusion on the risk of cancer recurrence after rat liver transplantation with donors after circulatory death. PLoS One. 14 (11), e0224890 (2019).
- Schlegel, A., Graf, R., Clavien, P. A., Dutkowski, P. Hypothermic oxygenated perfusion (HOPE) protects from biliary injury in a rodent model of DCD liver transplantation. J Hepatol. 59 (5), 984-991 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon