Method Article
מודל השתלת חולדה בכבד שלם עזר הטרוטופי תוך שימוש בכבד כבד למחקרי דחיית אלוגרפט
In This Article
Summary
פרוטוקול השתלת כבד עזר הטרוטופי של חולדות המתואר כאן מציע כלי מחקר מעשי לחקר מנגנונים של דחיית השתלת כבד. מודל זה מסייע להקל על המכשולים הכירורגיים והלחץ של בעלי חיים של השתלת כבד אורתוטופית בחולדות.
Abstract
מודלים להשתלת בעלי חיים קטנים הם הכרחיים למחקרי סבילות לאיברים הבוחנים התערבויות טיפוליות אפשריות במחקרים פרה-קליניים. פרוטוקולים של השתלת כבד חולדה (LTx) משתמשים בדרך כלל במודל אורתוטופי שבו הכבד המקורי של המושתלים מוסר ומוחלף בכבד תורם. הליך כירורגי תובעני מבחינה טכנית זה דורש מיומנויות מיקרו-כירורגיות מתקדמות ומסובך עוד יותר על ידי זמני איסכמיה ממושכים של אנהפט ופלג גוף תחתון. זה הוביל לפיתוח שיטה הטרוטופית פחות מסובכת שניתן לבצע מהר יותר ללא זמן אנהפטי או איסכמיה בפלג גוף תחתון, מה שמפחית את הלחץ לאחר הניתוח עבור בעל החיים המקבל.
פרוטוקול LTx הטרוטופי זה כולל שני שלבים עיקריים: כריתת הכבד מהחולדה התורמת והשתלת הכבד כולו בחולדה המקבלת. במהלך כריתת הכבד התורם, המנתח קושר את הווריד הנבוב העל-כבדי (SHVC) ואת עורק הכבד (HA). בצד המקבל, המנתח מסיר את הכליה השמאלית וממקם את הכבד התורם עם וריד הפורטל (PV), הווריד הנבוב האינפרא-כבדי (IHVC) וצינור המרה הפונים לכלי הכליה. יתר על כן, המנתח מבצע אנסטומוזה של וריד הכליה של המקבל מקצה לקצה עם ה-IHVC של הכבד ועורק את ה-PV עם עורק הכליה באמצעות סטנט. הפטיקורטרוסטומיה משמשת לניקוז המרה על ידי אנסטומוזה של צינור המרה לשופכן של המקבל, מה שמאפשר הזרמת מרה דרך שלפוחית השתן.
משך ההשתלה הממוצע היה 130 דקות, משך איסכמיה קרה היה בסביבות 35 דקות ומשך איסכמיה חמה היה פחות מ-25 דקות. היסטולוגיה של המטוקסילין ואאוזין של כבד העזר מהשתלות סינגניות הראתה מבנה הפטוציטים תקין ללא שינויים פרנכימליים משמעותיים 30 יום לאחר ההשתלה. לעומת זאת, דגימות שתל אלוגניות של 8 ימים לאחר ההשתלה הדגימו חדירה לימפוציטית נרחבת עם ציון מדד פעילות דחיית סכימת Banff של 9. לכן, שיטת LTx זו מאפשרת חלופה למודל דחיית תחלואה נמוכה ל-LTx אורתוטופי.
Introduction
LTx של בעלי חיים קטנים הוא מודל שלא יסולא בפז לחקירת מנגנונים של דחיית כבד. השתלת כבד עזר הטרוטופית עם עורקי ורידים פורטליים (HALT-PVA) בחולדות הוצגה בשנת 1968 על ידי לי ואדג'ינגטון1כאשר הם דיווחו על שימוש בווריד הכליה ובעורק של המושתל כדי לחדש את כלי הדם של כבד עזר מושתל. לאחר מכן, Hess et al.2 שיפרו את הפרוטוקול עם הפחתת התחרות התפקודית בין הכבד הטבעי לכבד העזר על ידי הקטנת גודל הכבד הטבעי והתורם יחד עם שחזור החיבור של צינור המרה של התורם, וכתוצאה מכך הישרדות השתל לטווח ארוך. שיפורים נוספים נעשו עם הכנסת אנסטומוזה של השרוול 3,4, ו-Schleimer et al.5 קבעו את קוטר הסטנט האופטימלי לוויסות זרימת הדם כדי להשיג זרימת פורטל פיזיולוגית ולמנוע זלוף יתר או היפו-פרפוזיה של השתל. חוקרים אחרים פיתחו שינויים משמעותיים בשיטה על ידי שימוש בעורק הטחול6 או עורק הכסל7 המצוי לאספקת דם להשתלה, בעוד שחלקם פיתחו מודלים שהשתמשו רק בדם ורידי8 או רק בדם עורקי דרך עורק הכבד9 כדי לספק את שתל הכבד העזר.
המחקר הנוכחי שיער כי תחרות תפקודית מהכבד הטבעי לא תפריע לדחיית אלוגרפט, ולכן פיתחנו פרוטוקול המבוסס על מודל Schleimer10 המווסת זרימה שלא כלל שום הקטנת גודל של הכבד הטבעי או העזר. הצד השמאלי של המושתל נבחר לאיתור השתל מכיוון שהוא סיפק אוריינטציה אופטימלית בין כלי הכליה והכבד של התורם. בתחילה, ניסינו שחזור מרה באמצעות הפטיקודודנוסטומיה, אך ניסויים אלה פשוט אישרו את קביעתו של שליימר כי "ניקוז המרה הוא עקב אכילס של השתלת כבד"10. זה הניע את הפיתוח של טכניקה חדשה שבה צינור המרה עובר אנסטומוזה מקצה לקצה באמצעות סטנט עם השופכן של המקבלים, המאפשר שחרור מרה דרך שלפוחית השתן. יתרון ראוי לציון בשימוש בכבד כבד הוא שניתן לנטר את תפקוד כבד השתל מדי יום על ידי התבוננות בשתן; שתל כבד המייצר מרה צובע את השתן בצהוב בוהק. איור 1 מייצג את הסקירה הסכמטית של שיטת HALT-PVA.
יתרון חשוב של חולדה הטרוטופית על פני חולדה אורתוטופית LTx מתייחס להיעדר זמן איסכמיה אנהפטי או מוחלט בפלג הגוף התחתון, מה שמאפשר התאוששות מהירה וקלה יותר עבור מקבלי חולדה הטרוטופיים. בנוסף, מחקרים אימונולוגיים LTx המשתמשים בשיטות אורתוטופיות מסתמכים לרוב על דחייה חמורה או מוות של הנמען כנקודת קצה ניסיונית, מה שלא קורה בהשתלות הטרוטופיות, שבהן בעל החיים נשאר בריא גם אם האלוגרפט מפסיק לתפקד עקב דחייה. שני המאפיינים הללו של השיטה ההטרוטופית תומכים בעקרונות היוזמה הבינלאומית של 3R (החלפה, צמצום ועידון )11, המקדמת מסגרת למזעור הכאב, הסבל והמצוקה שחווים חיות מחקר ושיפור רווחתן.
מודל HALT-PVA המדווח כאן הוא שיטה מעשית ואמינה לחקירת המנגנונים של דחיית אלוגרפט בכבד במחקרים פרה-קליניים. טכניקה ניסיונית שימושית זו עוזרת להתגבר על הדרישות הניתוחיות הניכרות והלחץ של בעלי חיים של LTx אורתוטופי בחולדות. בעתיד, אנו מתכוונים להשתמש בשיטה זו כדי לחקור את המנגנונים של דחייה חיסונית חריפה תוך בחינת מטרות חדשות ואסטרטגיות טיפוליות לדיכוי דחיית השתל בכבד.
Protocol
בעלי חיים גודלו ושוכנו בתנאים ספציפיים ללא פתוגנים במתקני הטיפול בבעלי חיים באוניברסיטת ויסקונסין (UW) - מכון מדיסון למחקר רפואי בהתאם להנחיות המוסדיות. פרוטוקול המחקר (מס' M006022) אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים בבית הספר לרפואה ובריאות הציבור של אוניברסיטת וושינגטון, וכל בעלי החיים טופלו באופן אתי.
1. בעלי חיים
- השתמש בחולדות נקבות לואיס בוגרות במשקל 205-235 גרם ובזכרי לואיס במשקל 250-280 גרם כחולדות תורמות. השתמש בחולדות לואיס ובראון נורווגיה זכרים בוגרים במשקל 365-420 גרם כנמענים.
- בצע השתלות סינגניות על ידי השתלת תורמי לואיס למושתלי לואיס, בעוד שההשתלות האלוגניות השתמשו בתורמי לואיס שהושתלו במושתלי בראון נורבגיה.
- בצע את כל הניתוחים על ידי שני אנשים באמצעות מיקרוסקופ בעל ראש כפול.
2. הליך רכש תורם כבד עזר
- להרדים את החולדה התורמת בשאיפת איזופלורן של 5% בתא אינדוקציה. רשום את משקל החולדה וגלח את הבטן בעזרת קוצץ חשמלי.
- מקם את החולדה במצב שכיבה על משטח ניתוח מחומם עם אפה בקונוס הרדמה ושתק את הגפיים בעזרת סרט. לחטא את הבטן עם 75% אלכוהול ולהוריד את האיזופלורן ל -2%.
- בצע חתך עור ושריר קו אמצע אורכי מהערווה לקסיפואיד בעזרת מספריים. בסמוך לנקודת האמצע של החתך האורכי, הרחב אותו לרוחב שמאלה וימינה, ואז התקן מחזירים משני צידי דופן הבטן ותהליך ה- xiphoid.
- בעזרת צמר גפן לח, החזירו את המעיים לצד שמאל של הבטן תוך שימוש במספריים קפיציים כדי לחתוך את רצועות הגסטרו המחוברות לכבד, ואז לשתק את המעיים מתחת לגזה לחה. מכסים את הכבד בחתיכה קטנה של גזה סטרילית לחה במי מלח חמים.
- השתמש במקלוני צמר גפן לחים כדי למשוך את הכבד ולנתח את הרצועות הפלציפורמיות, המשולשות, הכבד והתריסריון. לאחר מכן, צרבו בעזרת מלקחיים דו קוטביים וחלקו את כלי הוושט הפרה-וושטי בין האונה הזנבית השמאלית והקדמית.
- בעזרת מלקחיים זוויתיים או מחזיקי מחט, נתחו מאחורי ה-SHVC הנחות מהסרעפת, ואז העבירו תפר משי 5-0 מתחת ל-SHVC וקשרו באופן רופף קשר כפול לשימוש מאוחר יותר.
- החזר את האונה הצדדית הימנית התחתונה כלפי מעלה, חתוך את הרצועה ושיתק מתחת לגזה לחה. בודד את ה-IHVC מהרקמה הרטרופריטונאלית עד לווריד הכליה הימני וקשר את וריד יותרת הכליה הימני עם תפר משי 6-0 קרוב ככל האפשר ל-IHVC. חלקו את הווריד הזה מאוחר יותר עם הסרת השתל.
- באמצעות מחט הידרו-דיסקציה של 27 גרם (איור 2A), נתקו את ה-PV מרקמת החיבור שמסביב והפרידו אותו מהוורידים הפילוריים והטחול על ידי קשירה וחלוקה שלהם באמצעות תפר משי 7-0.
- לבודד, לקשור עם תפר משי 6-0 ולחלק את עורק הכבד המשותף קרוב למקום שבו הוא עובר מתחת ל-PV.
- קשרו את צינור המרה בתפר משי 5-0 בהסתעפות עורק התריסריון תוך שמירה על רקמת השומן סביב צינור המרה ככל האפשר; בפרט, הימנע מהפרדת צינור המרה מעורק הכבד התקין תוך שמירה על האורך הכולל קצר ככל האפשר.
- בעזרת מספריים קפיציים, בצע חתך קטן בדופן צינור המרה הפרוקסימלי לקשירה. הכנס סטנט צינור פולימיד בקוטר 0.0215 אינץ' על 5 מ"מ ללומן צינור המרה ואבטח אותו עם תפר משי 6-0, והשאיר קצה אחד של התפר ארוך לשימוש מאוחר יותר. חלקו את צינור המרה על ידי חיתוך בין הקשירה 5-0 ו-6-0.
- סמן את הצד העליון של ה-IHVC וה-PV עם עט צבע כירורגי כדי לעזור ליישר את כלי הדם במהלך אנסטומוזיס, ולאחר מכן הדק את וריד הפורטל עם מהדק מיקרו-כלי רחוק ככל האפשר לכבד.
- הכנס מזרק של 20 מ"ל עם מחט 26 גרם לתוך ה-PV הפרוקסימלי למיקרו clamp והחדיר את הכבד עם 10-15 מ"ל של מי מלח קרים כקרח; במקביל, חלקו את ה-IHVC באמצעות מספריים קפיציים קרוב ככל האפשר לווריד הכליה הימני.
- כרתו את הכבד באמצעות מספריים קפיציים על ידי ניתוח ה-PV הפרוקסימלי למיקרו מהדק, הידוק התפר 5-0 שהונח בעבר סביב ה-SHVC, וניתוח הסרעפת כדי לחצות את הווריד הנבוב התוך-חזה.
- המשך בניתוח הרצועות הנותרות בחלק האחורי של הכבד וחלק את וריד יותרת הכליה שנקשר בעבר. מניחים את הכבד הכרות במי מלח קרים על קרח.
3. הליך השתלת מושתל כבד עזר
- להרדים את החולדה הנמענת בשאיפת איזופלורן של 5% בתא אינדוקציה. רשום את משקל החולדה וגלח את הבטן בעזרת קוצץ חשמלי.
- מקם את החולדה במצב שכיבה על משטח ניתוח מחומם עם אפה בקונוס הרדמה ושתק את הגפיים בעזרת סרט. מרחו חומר סיכה לעיניים, חטאו את הבטן ב-75% אלכוהול והורידו את האיזופלורן ל-2%.
- בעזרת מספריים, בצע חתך אורכי של קו האמצע והשריר מהערווה לקסיפואיד, ולאחר מכן התקן מחזירים משני צידי דופן הבטן.
- בעזרת צמר גפן לח, החזירו את המעיים לצד ימין של הבטן וכסו אותם בגזה לחה. מרחו גזה לחה נוספת כדי לכסות את הקיבה, הטחול והכבד, וחשפו את הכליה השמאלית וכלי הכליה.
- בעזרת מחט הידרו-דיסקציה של 27 גרם ומלקחיים קהים, הפרד את וריד הכליה השמאלי מעורק הכליה, והסר בזהירות שומן ורקמת חיבור משני הכלים.
- בודד את ורידי בלוטת המין ויותרת הכליה, והשתמש במשי 6-0 כדי לקשור אותם פרוקסימליים לווריד הכליה באופן זמני. צרוב, באמצעות מלקחיים דו קוטביים, את כל ענפי הצד המיקרו המבודדים את וריד הכליה והעורק בין אבי העורקים / VC לכליה.
- גייס וקשר את השופכן עם תפר משי 6-0 בקוטב התחתון. סמן את וריד הכליה והעורק בעט צבע כירורגי כדי לעזור לכוון את כלי הדם במהלך אנסטומוזה ולוודא שאין פיתולים.
- מהדקים את עורק הכליה ואת וריד הכליה בעזרת מהדק מיקרו-כלי קרוב ככל האפשר לאבי העורקים ול-VC. חצו את עורק הכליה עם מספריים קפיציים ממש מעבר לפיצול כלי הדם וחלקו את וריד הכליה בערך באמצע הדרך בין ה-VC לכליה. גייס את הכליה השמאלית מרקמת החיבור שמסביב והסר אותה.
- שטפו את שני כלי הדם במי מלח שעברו הפרין באמצעות מחט הידרו-דיסקציה של 27 גרם כדי להסיר את כל הדם שנותר.
- בעזרת מספריים קפיציים, חתכו פתח קטן של פה דג במזלג של התפצלות עורק הכליה כדי ליצור פתח בצורת משפך, והכניסו סטנט בקוטר 8 מ"מ שנחתך מצנתר 26 G (איור 2B). אבטח את הסטנט עם תפר משי 6-0, והשאיר קצה אחד של התפר ארוך לשימוש מאוחר יותר.
- הציגו את הכבד התורם ומקמו אותו עם ה-PV, IHVC וצינור המרה מול וריד הכליה השמאלי והעורק של המקבל. בעזרת תפר ניילון 9-0, התקן שני תפרי שהייה בצדדים מנוגדים של חיבור IHVC-וריד הכליה.
- השוו את רוחב הכלים ובצעו חתך קטן בפה של דג באמצעות מספריים קפיציים לתוך הפנים של וריד הכליה עד שיהיה לו רוחב דומה ל-IHVC של התורם (איור 2C).
- באמצעות תפר ניילון 9-0, אנסטומוזה של הכבד IHVC מקצה לקצה לווריד הכליה עם 9 או 10 תפרים רצים על פני הדפנות הקדמיות והאחוריות של כלי הדם. לחלופין, השתמש בשיטת שרוול כדי להשלים את האנסטומוזה הזו 3,4.
- ודא שמיקום עורק הכליה נמצא מתחת ל-IHVC (איור 2D), והכנס את הסטנט שהונח קודם לכן בעורק הכליה לווריד פורטל הכבד ואבטח עם תפר משי 6-0, והשאיר קצה אחד של התפר ארוך לחיבור לחוט הנגדי בעורק. משוך את הקצוות יחד כדי למנוע מכל אחד מהם להחליק מהסטנט.
- הסר תחילה את מהדק המיקרו על וריד הכליה, ולאחר מכן הסר את מהדק המיקרו על עורק הכליה.
- במהלך עירוי מחדש של הכבד, השתמשו בגזה ובמקלוני צמר גפן כדי להפעיל לחץ קל סביב אזור האנסטומוזיס עד להשגת אנסטומוזה פטנטית (איור 2D). הסר את הקשרים הזמניים שהונחו בעבר על ורידי יותרת הכליה ובלוטת המין.
- גייסו בזהירות כ-10 מ"מ במורד קצה השופכן השמאלי מרקמת החיבור שמסביב, והשאירו כמות משמעותית של רקמת שומן מחוברת. בעזרת מספריים קפיציים, בצע חתך קטן בדופן השופכן הפרוקסימלי לקשירה 5-0 שהוצבה בעבר.
- הכנס את סטנט הפולימיד שהוצמד בעבר לצינור המרה לתוך החתך הקטן שנעשה בדופן השופכן. אבטח עם תפר משי 6-0 וקשר קצה אחד יחד עם החוט הארוך בצד צינור המרה של הסטנט, מושך את שני הקצוות בחוזקה זה לזה.
- החזירו את המעיים למקומם הטבעי (איור 2E), השקו עם 2-3 מ"ל מי מלח וסגרו את הבטן בשתי שכבות באמצעות 3-0 תפרי משי.
- יש להזריק 0.1 מ"ג/ק"ג בופרנורפין תת עורית, להניח את המקבל בכלוב נקי ומחומם ולעקוב אחר ההתאוששות למשך 1-2 שעות לפני החזרת בעל החיים למתקן הדיור לבעלי חיים.
4. מעקב לאחר ניתוח
- החל מהיום השני לאחר הניתוח, יש להזריק למושתלים אלוגניים הפרין (1 IU/g) באופן תת עורי מדי יום.
- החל מהיום השני לאחר הניתוח, יש להזריק למושתלים סינגניים הפרין (1 IU/2 גרם) באופן תת עורי אחת ליומיים.
תוצאות
נכון לעכשיו, נעשה שימוש ב-29 זוגות חולדות כדי לבסס את פרוטוקול HALT-PVA, 17 השתלות סינגניות ו-12 השתלות אלוגניות. הכבדים המושתלים הסינגניים שרדו עד לנקודת הסיום של 8 או 30 יום עם שיעור הצלחה של 70%, בעוד שהכבדים המושתלים האלוגניים שרדו עד לנקודת הקצה המיועדת שלהם ל-3 או 8 ימים עם שיעור הצלחה של 50%. כישלונות כוללים חולדות שמתו עקב סיבוכים כירורגיים וכבדי עזר שנכשלו גם כאשר המושתל שרד.
משך הניתוח הממוצע היה 130 דקות, עם זמן איסכמיה קרה של כ-35 דקות, וזמן איסכמיה חמה של פחות מ-25 דקות. בתנאי שלא היו סיבוכים תוך ניתוחיים, המושתלים התעוררו והפכו לפעילים תוך 10-20 דקות, החלו לשתות ולהסתובב תוך שעה ו-24 שעות לאחר מכן, הם התנהגו כמו חולדות בריאות רגילות.
שתלי כבד סינגניים הראו צבע מצוין וסבלנות של דרכי המרה 30 יום לאחר ההשתלה (איור 3), בעוד שהיסטולוגיה של המטוקסילין ואאוזין (H&E) הראתה מבנה הפטוציטים תקין ללא שינויים פרנכימליים משמעותיים הן בנקודות הזמן של 8 ימים והן ב-30 יום (איור 4A,B). לאחר 3 ימים בלבד, ההיסטולוגיה של ההשתלות האלוגניות הראתה דלקת פורטלית משמעותית (איור 4C), בעוד שהשתלים האלוגניים של 8 הימים הראו דחייה תאית חריפה עם חדירה לימפוציטית נרחבת (איור 4D).
דגימות LTx אלוגניות וסינגניות מייצגות הוערכו על ידי פתולוג כבד מוסמך, והדחייה נקבעה באמצעות מדד פעילות הדחייה של סכימת באנף (RAI)12. הערכה פתולוגית קבעה שלא הייתה דחייה, עם RAI של Banff של 0, הן בהשתלות סינגניות של 8 ימים והן ב-30 יום, בעוד שהשתלות של 8 ימים נדחו קשות עם ציון Banff RAI של 9 (טבלה 1).
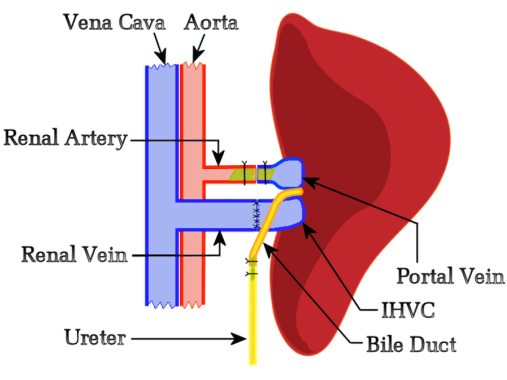
איור 1: תרשים סכמטי של נוהל HALT-PVA של חולדות. ה-PV עובר עורקים עם עורק הכליה השמאלי באמצעות סטנט, ה-IHVC עובר אנסטומוזה מקצה לקצה לווריד הכליה השמאלי, וצינור המרה מחובר לשופכן באמצעות סטנט. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: הליך כירורגי. (A) דיסקציה הידרולוגית של PV. נתק את ה-PV מרקמת החיבור שמסביב באמצעות מחט הידרו-דיסקציה של 27 גרם. (ב) החדרת סטנט עורקי. הסטנט העורקי מוחדר לפתח קטן בצורת משפך שנחתך במזלג של התפצלות עורק הכליה. (ג) הרחבת וריד הכליה. על מנת להתאים את הרוחב הגדול יותר של התורם IHVC לאנסטומוזיס, נעשה חתך קטן בפה של דג בפנים של וריד הכליה של המקבל לאחר שני תפרי שהייה במקומם. (D) שתל כבד מחורר מיד לאחר אנסטומוזיס. מיקום עורק הכליה וחיבור ה-PV מתחת לווריד הכליה ו-IHVC הוא חיוני למניעת פקקת של השתל. (ה) חולדה HALT-PVA באתרה. כבד העזר ממוקם כנגד הדופן השמאלית של הבטן לפני החזרת המעיים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
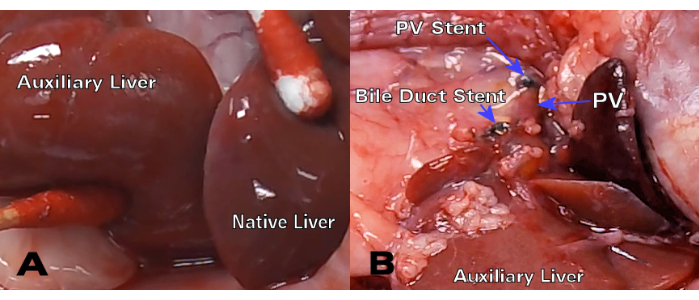
איור 3: HALT-PVA סינגני 30 יום לאחר ההשתלה. (A) לאחר 30 יום, לכבד העזר יש צבע ומרקם דומים לכבד הטבעי, בעוד (B) צינור המרה והסטנט PV נשארים פטנטים ובלתי מוגבלים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
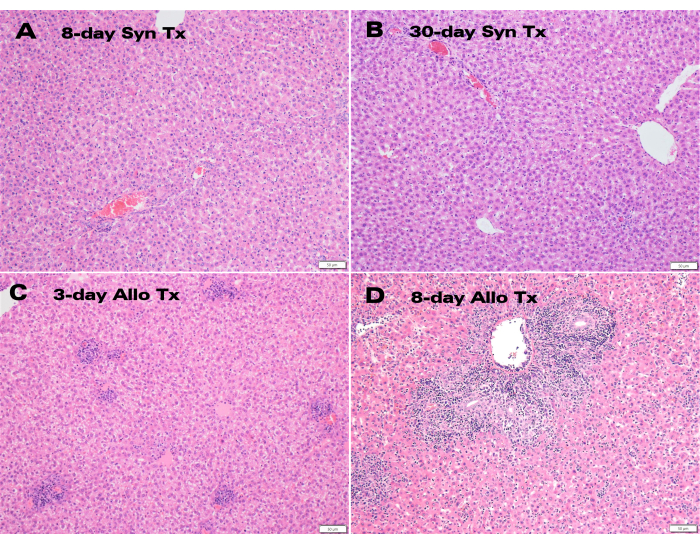
איור 4: היסטולוגיה של שתלי כבד עזר. צביעת H&E של (A) שתלים סינגניים של 8 ימים ו-(B) 30 יום לאחר ההשתלה המציגים מבנה הפטוציטים תקין יחד עם (C) שתלים אלוגניים של 3 ימים ו-(D) 8 ימים המציגים דלקת פורטלית וחדירה לימפוציטית. סרגל קנה מידה: 50 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| Tx's אלוגניים | דלקת בפורטל | פגיעה בדרכי המרה | דלקת אנדו ורידית | באנף RAI |
| 3 ימים (LT-34) | 2 | 2 | 3 | 7 |
| 3 ימים (LT-38) | 1 | 0 | 0 | 1 |
| 8 ימים (LT-20) | 3 | 3 | 3 | 9 |
| 8 ימים (LT-40) | 3 | 3 | 3 | 9 |
| Syngeneic Tx's | ||||
| 8 ימים (LT-13) | 0 | 0 | 0 | 0 |
| 8 ימים (LT-19) | 0 | 0 | 0 | 0 |
| 30 יום (LT-28) | 0 | 0 | 0 | 0 |
| 30 יום (LT-32) | 0 | 0 | 0 | 0 |
טבלה 1: סכימת באנף. מדד פעילות דחייה (RAI) של LTx חולדות אלוגניות וסינגניות.
Discussion
השתלת כבד היא אפשרות הטיפול היחידה לחולים עם מחלת כבד סופנית, עם כמעט 9,000 LTxs המבוצעים מדי שנה בארה"ב13. למרבה הצער, דחייה חיסונית נראית אצל עד 25% ממקבלי LTx, ודחייה זו מזיקה לאיבר המושתל ולמטופל14,15. כדי לשפר את התוצאות לאחר LTx, יש צורך בפיתוח מודלים חדשניים לחקר דחיית איברים ויישום אסטרטגיות להפחתת הדחייה.
בהשוואה להשתלת כבד אורתוטופית של חולדות, המודל ההטרוטופי הנוכחי קל להפליא לביסוס. מידת הקושי הטכני מחושבת בצורה הטובה ביותר על ידי התחשבות בשלב הקשה ביותר בהליך, שהוא האנסטומוזה מקצה לקצה של ה-IHVC לווריד הכליה. ההעדפה האישית שלנו לחיבור זה היא להשתמש בתפירה מסורתית בעוד שאחרים מוצאים מערכת שרוול נוחה יותר 3,4; כך או כך, לכל מי שנוח לו עם אנסטומוזה מקצה לקצה של וריד 3 מ"מ בכל שיטה יש את כל הכישורים הטכניים הדרושים לביצוע הליך זה. לאחר גישה למיקרוסקופ ראש כפול, אנו מעדיפים לבצע את הניתוחים הללו עם שני אנשים; עם זאת, זו אינה דרישה להצלחה עם פרוטוקול זה מכיוון שהוא בוצע גם לבד.
הסיבוך העיקרי לאחר הניתוח של מודל זה הוא פקקת של כבד השתל אשר מעורר על ידי שלושה דברים. ראשית, הסטנט העורקי עצמו יכול לגרום לפקקת אם בקצות הסטנט יש כתמים או אי סדרים הגורמים למערבולת בזרימת הדם. יש לחתוך את הסטנט בסכין גילוח חד, לא במספריים, ואז לבדוק אותו במיקרוסקופ כדי לוודא שאין פגמים. שנית, אם אנסטומוזה של עורק הכליה/סטנט PV ממוקמת על גבי וריד הכליה/אנסטומוזיס IHVC, זה יגביל את זרימת הדם ויגרום לפקקת. המיקום הסופי של הסטנט העורקי צריך להיות מתחת ל-IHVC, ראה איור 2D. שלישית, טיפול לאחר ניתוח בהפרין נוגד קרישה חיוני למניעת פקקת של השתלות אלוגניות, בעוד שמינון נמוך יותר של הפרין מועיל גם לביטול הסיכון לפקקת בשתלים הסינגניים.
שיעור ההישרדות הנמוך יותר עבור השתלים האלוגניים בהשוואה לשתלים הסינגניים המדווחים כאן משקף את האופי הפרו-טרומבוטי של כבד העזר הדוחה את הכבד, המעורר פקקת של הסטנט העורקי. נדרשו מספר ניסיונות למצוא תוכנית מינון הפרין שתוכל למנוע מהסטנט לפקק בהשתלות אלוגניות. בתחילה, מתוך 6 מושתלי האלוגרפט הראשונים ששרדו את הניתוח, 50% מכבדי העזר נכשלו עקב פקקת, אך בעקבות עלייה במינון הפרין, שלוש ההשתלות האלוגניות הבאות שרדו ללא פקקת. בהמשך, לאחר שקבענו מינון יעיל של הפרין, אנו מצפים ששיעור ההצלחה של השתלות אלוגניות יגדל משמעותית. כמו כן, רוב הכשלים הסינגניים התרחשו בשלב מוקדם של הפיתוח, ואנו מצפים ששיעור ההצלחה של השתלות סינגניות ישתפר גם כן.
השתמשנו במודל הדחייה החריפה של לואיס לבראון נורווגיה LTx מכיוון ששילוב הזן בראון נורווגיה ללואיס אינו דוחה16. ראוי לציין שכאשר משתמשים בשיטות השתלה אורתוטופיות עם מודל דחייה זה, ומתרחשת דחיית כבד, בעלי החיים המקבלים סובלים מתחלואה קשה מכיוון שהם הופכים למדוכאים, לא פעילים ומפסיקים לאכול לפני שהם מתים תוך14 יום 16. עם זאת, במודל LTx הטרוטופי זה, המוות אינו משמש כנקודת קצה, ותחלואה אינה מתרחשת; החיה נשארת בריאה ופעילה למשך הניסוי גם כאשר כבד העזר נדחה לחלוטין. אין ספק, מודל LTx הטרוטופי זה תורם באופן משמעותי למזעור הכאב, הסבל והמצוקה שחווים בעלי החיים המקבלים.
ההתקדמות האחרונה בזלוף כבד נורמותרמי ex vivo (NEVLP) היא התקדמות מרגשת באופן אחסון הכבד לפני השתלה קלינית 17,18,19. במהלך NEVLP, הכבד התורם חוזר לפעילות פיזיולוגית ומאפשר התערבויות טיפוליות לפני ההשתלה20,21. NEVLP משמש גם יותר ויותר להערכת הכדאיות של איברים שוליים (כבדים מתורמים מבוגרים או שמנים או כבדים שנרכשו מתורמים לאחר מוות לבבי)22,23. למרות שזה מרגש, רק קומץ מעבדות הצליחו להשתיל כבד של חולדות לאחר NEVLP24,25. סביר להניח שהסיבה לכך היא הלחץ הכירורגי על בעל החיים והביקוש הטכני הגבוה של הכנת הכבד הן ל-NEVLP והן להשתלה. לעומת זאת, הטכניקה האופרטיבית ההטרוטופית LTx המתוארת בכתב יד זה היא פחות תובענית מבחינה טכנית וגורמת פחות לחץ על החיה. ככזה, זו עשויה להיות אפשרות בת קיימא עבור מודלים של בעלי חיים קטנים של NEVLP והשתלה לאחר מכן.
לסיכום, אנו מציגים מודל חלופי להשתלת כבד עם תחלואה נמוכה שעשוי להועיל למחקרי דחיית השתלה עתידיים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה נתמך על ידי המכון הלאומי לבריאות (NIH) K08AI155816, שהוענק ל-DA.
Materials
| Name | Company | Catalog Number | Comments |
| 3-0 Silk Suture | Ethicon | C013D | |
| 5-0 Silk ties | Fine Science Tools | 18020-50 | |
| 6-0 Silk ties | Fine Science Tools | 18020-60 | |
| 7-0 Silk ties | Teleflex | 103-s | |
| 9-0 Polyamide Suture | AROSurgical | T05A09N10-13 | Black |
| Bipolar Cautery | Codman & Shurtleff Inc. | P.H. 234 | |
| Buprenorphine HCL | Hospira | 409201232 | |
| Forceps, Adson-Brown | Fine Science Tools | 11627-12 | 12.5 cm |
| Forceps, Angled Dumont | Fine Science Tools | 11253-25 | Medical #5/45 11 cm |
| Forceps, Suture Tying | Fine Science Tools | 18025-10 | 10 cm |
| Heparin Sodium Injection, USB | Fresenius Kabi | 504015 | 10,000 USP units per 10 mL |
| Hydrodissection Cannula | Ambler Surgical | 1021E | 27 G |
| Isoflurane | Dechra Vet. Products | 17033-091-25 | |
| I.V. Catheter | Kendall | 2619PUR | 26 G x 3/4" |
| Magnetic Retraction System | Fine Science Tools | 18200-50 | |
| Micro Clamps | Fine Science Tools | 18055-05 | 6 mm |
| Micro Clamps | Fine Science Tools | 18055-06 | 4 mm |
| Micro Clamp Applicator | Fine Science Tools | 18057-14 | 14 cm |
| Micro Needle Holder | S&T | C-14 | 14 cm |
| Microscope | Zeiss | Universal S3 | Dual head |
| Ophthalmic Ointment | Puralube | 14590500 | |
| Polyimidi Tubing | Cole Parmer | 95820-04 | OD 0.0215", ID 0.0195", wall 0.0010" |
| Saline | Baxter | 281324 | 0.9% Sodium Chloride |
| Surgical Spring Scissors | S&T | SDC-15 | Blunt 14 cm |
| Surgical Spring Scissors | Fine Science Tools | 15021-15 | Vannas 14 cm |
References
- Lee, S., Edgington, T. S. Heterotopic liver transplantation utilizing inbred rat strains. Am J Pathol. 52 (3), 649-669 (1968).
- Hess, F., Jerusalem, C., Van der Heyde, M. N. Advantages of auxiliary liver homotransplantation in rats. Arch Surg. 104, 76-80 (1972).
- Marni, A., Ferrero, M. Heterotopic liver grafting in the rat. A simplified method using cuff techniques. Transplantation. 39 (3), 329-331 (1985).
- Kobayashi, E., et al. Auxiliary heterotopic liver transplantation in the rat: a simplified model using cuff technique and application for congenitally hyperbilirubimemic Gunn rat. Microsurgery. 18 (2), 97-102 (1998).
- Schleimer, K., et al. Auxiliary liver transplantation with flow-regulated portal vein arterialization offers a successful therapeutic option in acute hepatic failure--investigations in heterotopic auxiliary rat liver transplantation. Transpl Int. 19 (7), 581-588 (2006).
- Qiao, J., Han, C., Zhang, J., Wang, Z., Meng, X. A new model of auxiliary partial heterotopic liver transplantation with liver dual artery supply. Exp Ther Med. 9 (2), 367-371 (2015).
- Li, J., Ren, J., Zhang, J., Meng, X. A. Modified kidney-sparing portal vein arterialization model of heterotopic auxiliary liver transplantation increases liver IL-6, TNF-α, and HGF levels and enhances liver regeneration: an animal model. BMC Surg. 2, 281-292 (2022).
- Ono, Y., et al. Regeneration and cell recruitment in an improved heterotopic auxiliary partial liver transplantation (APLT) model in the rat. Transplantation. 101 (1), 92-100 (2017).
- Wang, J., et al. Auxiliary partial liver grafting in rats: effect of host hepatectomy on graft regeneration, and review of literature on surgical technique. Microsurgery. 22 (8), 371-377 (2002).
- Schleimer, K., et al. Heterotopic auxiliary rat liver transplantation with flow-regulated portal vein arterialization in acute hepatic failure. J Vis Exp. (91), e51115 (2014).
- Prescott, M. J., Lidster, K. Improving quality of science through better animal welfare: the NC3Rs strategy. Lab Animal. 46 (4), 152-156 (2017).
- . Banff schema for grading liver allograft rejection: an international consensus document. Hepatology. 25 (3), 658-663 (1997).
- Kwong, A. J., et al. OPTN/SRTR 2020 Annual Data Report: Liver. Am J Transplant. 22, 204-309 (2022).
- Nacif, L. S., et al. Late acute rejection in liver transplant: a systematic review. Arq Bras Cir Dig. 28 (3), 212-215 (2015).
- Levitsky, J., et al. Acute rejection increases risk of graft failure and death in recent liver transplant recipients. Clin Gastroenterol Hepatol. 15 (4), 584-593 (2017).
- Gong, J., Cao, D., Chen, Y., Li, J., Gong, J., Zeng, Z. Role of programmed death ligand 1 and Kupffer cell in immune regulation after orthotopic liver transplantation in rats. Int Immunopharmacol. 48, 8-16 (2017).
- Ceresa, C. D. L., Nasralla, D., Coussios, C. C., Friend, P. J. The case for normothermic machine perfusion in liver transplantation. Liver Transpl. 24 (2), 269-275 (2018).
- Nasralla, D., et al. A randomized trial of normothermic preservation in liver transplantation. Nature. 557 (7703), 50-56 (2018).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Goldaracena, N., et al. Anti-inflammatory signaling during ex vivo liver perfusion improves the preservation of pig liver grafts before transplantation. Liver Transpl. 22 (11), 1573-1583 (2016).
- Carlson, K. N., et al. Interleukin-10 and transforming growth factor-beta cytokines decrease immune activation during normothermic ex vivo machine perfusion of the rat liver. Liver Transpl. 27 (11), 1577-1591 (2021).
- Ig-Izevbekhai, K., Goldberg, D. S., Karp, S. J., Foley, D. P., Abt, P. L. Immunosuppression in donation after circulatory death liver transplantation: Can induction modify graft survival. Liver Transpl. 26 (9), 1154-1166 (2020).
- Kageyama, S., et al. Ischemia-reperfusion Injury in allogeneic liver transplantation: A role of CD4 T cells in early allograft injury. Transplantation. 105 (9), 1989-1997 (2021).
- Oldani, G., et al. The impact of short-term machine perfusion on the risk of cancer recurrence after rat liver transplantation with donors after circulatory death. PLoS One. 14 (11), e0224890 (2019).
- Schlegel, A., Graf, R., Clavien, P. A., Dutkowski, P. Hypothermic oxygenated perfusion (HOPE) protects from biliary injury in a rodent model of DCD liver transplantation. J Hepatol. 59 (5), 984-991 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved