Method Article
Modelo de trasplante heterotópico auxiliar de hígado entero en rata que utiliza una hepaticoureterostomía para estudios de rechazo de aloinjertos
En este artículo
Resumen
El protocolo de trasplante hepático auxiliar heterotópico en ratas descrito aquí ofrece una herramienta práctica de investigación para explorar los mecanismos de rechazo del aloinjerto hepático. Este modelo ayuda a aliviar los obstáculos quirúrgicos y el estrés animal del trasplante ortotópico de hígado en ratas.
Resumen
Los modelos de trasplante de animales pequeños son indispensables para los estudios de tolerancia a órganos que investigan intervenciones terapéuticas factibles en estudios preclínicos. Los protocolos de trasplante de hígado de rata (LTx) suelen utilizar un modelo ortotópico en el que se extrae el hígado nativo de los receptores y se sustituye por el hígado de un donante. Este procedimiento quirúrgico técnicamente exigente requiere habilidades microquirúrgicas avanzadas y se complica aún más por los largos tiempos de isquemia anhepática y de la parte inferior del cuerpo. Esto impulsó el desarrollo de un método heterotópico menos complicado que se puede realizar más rápido sin tiempo de isquemia anhepática o de la parte inferior del cuerpo, lo que reduce el estrés postoperatorio para el animal receptor.
Este protocolo heterotópico de LTx incluye dos pasos principales: extirpar el hígado de la rata donante y trasplantar todo el hígado a la rata receptora. Durante la extirpación del hígado del donante, el cirujano liga la vena cava suprahepática (SHVC) y la arteria hepática (HA). En el lado receptor, el cirujano extirpa el riñón izquierdo y coloca el hígado del donante con la vena porta (VP), la vena cava infrahepática (IHVC) y el conducto biliar frente a los vasos renales. Además, el cirujano anastomosa la vena renal del receptor de extremo a extremo con el IHVC del hígado y arterializa la VP con la arteria renal utilizando un stent. La hepaticoureterostomía se utiliza para el drenaje biliar mediante la anastomosis del conducto biliar al uréter del receptor, lo que permite la descarga de la bilis a través de la vejiga.
La duración media del trasplante fue de 130 min, la duración de la isquemia fría fue de alrededor de 35 min y la duración de la isquemia caliente fue de menos de 25 min. La histología histológica de hematoxilina y eosina del hígado auxiliar de trasplantes singénicos mostró una estructura normal de los hepatocitos sin alteraciones parenquimatosas significativas a los 30 días después del trasplante. Por el contrario, las muestras de injerto alogénico postrasplante de 8 días demostraron una infiltración linfocítica extensa con una puntuación del índice de actividad de rechazo del esquema de Banff de 9. Por lo tanto, este método LTx facilita un modelo de rechazo de baja morbilidad alternativo al LTx ortotópico.
Introducción
La LTx de los animales pequeños es un modelo inestimable para investigar los mecanismos de rechazo hepático. El trasplante hepático auxiliar heterotópico con arterialización de la vena porta (HALT-PVA) en ratas fue introducido en 1968 por Lee y Edgington1cuando informaron sobre el uso de la vena renal y la arteria de un receptor para revascularizar un hígado auxiliar injertado. Posteriormente, Hess et al.2 mejoraron el protocolo con la mitigación de la competencia funcional entre los hígados nativos y auxiliares mediante la reducción del tamaño del hígado nativo y del donante, junto con la reconstrucción de la conexión del conducto biliar del donante, lo que resultó en la supervivencia del injerto a largo plazo. Con la introducción de la anastomosis del manguito 3,4 se realizaron nuevos refinamientos, y Schleimer et al.5 determinaron el diámetro óptimo del stent para regular el flujo sanguíneo con el fin de obtener el flujo portal fisiológico y evitar la hiper o hipoperfusión del injerto. Otros investigadores desarrollaron alteraciones significativas en el método mediante el uso de la arteria esplénica6 o ilíacacomún 7 para el suministro de sangre del injerto, mientras que algunos desarrollaron modelos que utilizaban solo sangre venosa8 o solo sangre arterial a través de la arteria hepática9 para suministrar el injerto hepático auxiliar.
El presente estudio planteó la hipótesis de que la competencia funcional del hígado nativo no interferiría con el rechazo del aloinjerto, por lo que desarrollamos un protocolo basado en el modelo10 de Schleimer regulado por flujo que no incluyó ninguna reducción de tamaño del hígado nativo o auxiliar. Se seleccionó el lado izquierdo del receptor para ubicar el injerto porque proporcionaba una orientación óptima entre los vasos renales del receptor y los vasos hepáticos del donante. Inicialmente, intentamos la reconstrucción biliar mediante hepaticoduodenostomía, pero estos ensayos no hicieron más que confirmar la afirmación de Schleimer de que "el drenaje biliar es el talón de Aquiles del trasplante hepático"10. Esto impulsó el desarrollo de una nueva técnica en la que el conducto biliar se anastomosa de extremo a extremo utilizando un stent con el uréter del receptor, lo que permite la descarga de bilis a través de la vejiga. Un beneficio notable del uso de una hepaticoureterostomía es que la funcionalidad del injerto hepático se puede monitorear diariamente mediante la observación de la orina; Un injerto de hígado productor de bilis colorea la orina de un amarillo brillante. La Figura 1 representa la descripción esquemática del método HALT-PVA.
Una ventaja importante de la LTx heterotópica sobre la ortotópica se relaciona con la ausencia de tiempo de isquemia anhepática o total de la parte inferior del cuerpo, lo que permite recuperaciones más rápidas y fáciles para los receptores heterotópicos. Además, los estudios inmunológicos de LTx que utilizan métodos ortotópicos a menudo se basan en el rechazo grave o la muerte del receptor como criterio de valoración experimental, lo que no es el caso de los trasplantes heterotópicos, en los que el animal permanece sano incluso si el aloinjerto deja de funcionar debido al rechazo. Ambas características del método heterotópico apoyan los principios de la iniciativa internacional de las 3R (Reemplazo, Reducción y Refinamiento)11, que promueve un marco para minimizar el dolor, el sufrimiento y la angustia experimentados por los animales de investigación y mejorar su bienestar.
El modelo HALT-PVA reportado aquí es un método práctico y confiable para investigar los mecanismos de rechazo del injerto hepático en estudios preclínicos. Esta útil técnica experimental ayuda a superar las considerables demandas quirúrgicas y el estrés animal de la LTx ortotópica en ratas. En el futuro, tenemos la intención de utilizar este método para investigar los mecanismos del rechazo inmunitario agudo mientras exploramos nuevas dianas y estrategias terapéuticas para suprimir el rechazo del injerto hepático.
Protocolo
Los animales fueron criados y alojados en condiciones específicas libres de patógenos en las instalaciones de cuidado animal del Instituto de Investigación Médica de la Universidad de Wisconsin (UW)-Madison de acuerdo con las pautas institucionales. El protocolo del estudio (No. M006022) fue aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Facultad de Medicina y Salud Pública de la Universidad de Washington, y todos los animales fueron tratados éticamente.
1. Animales
- Utilice ratas hembras Lewis adultas que pesen entre 205 y 235 g y machos Lewis que pesen 250-280 g como ratas donantes. Utilice ratas Lewis y Brown Norway macho adultas que pesen entre 365 y 420 g como recipientes.
- Realizar trasplantes singénicos mediante el trasplante de donantes de Lewis a receptores de Lewis, mientras que los trasplantes alogénicos utilizaron donantes de Lewis trasplantados a receptores de Brown Norway.
- Realizar todas las cirugías por dos personas utilizando un microscopio de doble cabezal.
2. Procedimiento auxiliar de obtención de hígado de donante
- Anestesiar a la rata donante con inhalación de isoflurano al 5% en una cámara de inducción. Registra el peso de la rata y afeita el abdomen con una tijera eléctrica.
- Coloque a la rata en posición supina sobre una almohadilla de cirugía caliente con la nariz en un cono de anestesia e inmovilice las extremidades con cinta adhesiva. Desinfectar el abdomen con alcohol al 75% y bajar el isoflurano al 2%.
- Haz una incisión longitudinal en la línea media de la piel y el músculo desde el pubis hasta el xifoides con unas tijeras. Cerca del punto medio de la incisión longitudinal, extiéndala lateralmente hacia la izquierda y la derecha, luego instale retractores a ambos lados de la pared abdominal y la apófisis xifoides.
- Con hisopos de algodón húmedos, retraiga los intestinos hacia el lado izquierdo del abdomen mientras usa tijeras de resorte para cortar los ligamentos gastrointestinales unidos al hígado, luego inmovilice los intestinos con una gasa humedecida. Cubra el hígado con un pequeño trozo de gasa estéril humedecida con solución salina tibia.
- Use hisopos de algodón húmedos para retraer el hígado y diseccionar los ligamentos falciformes, triangulares, hepatogásticos y hepatoduodenales. A continuación, cauterizar con pinzas bipolares y dividir los vasos paraesofágicos entre el lóbulo caudado lateral izquierdo y anterior.
- Con pinzas angulares o portaagujas, diseccione detrás del SHVC inferior al diafragma, luego pase una sutura de seda 5-0 por debajo del SHVC y haga un nudo doble sin apretar para su uso posterior.
- Retraiga el lóbulo lateral inferior derecho hacia arriba, corte el ligamento e inmovilice bajo una gasa humedecida. Aislar la IHVC desde el tejido retroperitoneal hasta la vena renal derecha y ligar la vena suprarrenal derecha con una sutura de seda 6-0 lo más cerca posible de la IHVC. Divida esta vena más tarde cuando se extraiga el injerto.
- Con una aguja de hidrodisección de 27 G (Figura 2A), disocie la VP del tejido conectivo circundante y sepárela de las venas pilórica y esplénica ligándolas y dividiéndolas con una sutura de seda 7-0.
- Aísle, lige con sutura de seda 6-0 y divida la arteria hepática común cerca de donde pasa por debajo de la VP.
- Ligar, el conducto biliar con una sutura de seda 5-0 en la ramificación de la arteria gastroduodenal, preservando el tejido graso alrededor del conducto biliar tanto como sea posible; En particular, evite separar el conducto biliar de la arteria hepática adecuada y mantenga la longitud total lo más corta posible.
- Con unas tijeras de resorte, haga una pequeña incisión en la pared del conducto biliar proximal a la ligadura. Inserte un stent de tubo de poliimida de 0,0215" de diámetro por 5 mm de largo en la luz del conducto biliar y asegúrelo con una sutura de seda 6-0, dejando un extremo de la sutura largo para su uso posterior. Divida el conducto biliar cortando entre las ligaduras 5-0 y 6-0.
- Marque la parte superior de la IHVC y la PV con una pluma de tinte quirúrgico para ayudar a alinear los vasos durante la anastomosis, luego pinza la vena porta con una pinza de microvasos lo más distal posible al hígado.
- Insertar una jeringa de 20 mL con una aguja de 26 G en el PV proximal a la micropinza y perfundir el hígado con 10-15 mL de solución salina heparinizada helada; Al mismo tiempo, divida el IHVC con unas tijeras de resorte lo más cerca posible de la vena renal derecha.
- Extirpar el hígado con unas tijeras de resorte diseccionando el PV proximal a la micropinza, apretando la sutura 5-0 previamente colocada alrededor del SHVC y diseccionando el diafragma para seccionar la vena cava intratorácica.
- Continúe diseccionando los ligamentos restantes en la parte posterior del hígado y divida la vena suprarrenal previamente ligada. Coloque el hígado extirpado en solución salina fría sobre hielo.
3. Procedimiento auxiliar de trasplante de receptor de hígado
- Anestesiar a la rata receptora con inhalación de isoflurano al 5% en una cámara de inducción. Registra el peso de la rata y afeita el abdomen con una tijera eléctrica.
- Coloque a la rata en posición supina sobre una almohadilla de cirugía caliente con la nariz en un cono de anestesia e inmovilice las extremidades con cinta adhesiva. Aplique un lubricante ocular, desinfecte el abdomen con alcohol al 75% y baje el isoflurano al 2%.
- Con unas tijeras, haga una incisión longitudinal en la piel y el músculo de la línea media desde el pubis hasta el xifoides, luego instale retractores a ambos lados de la pared abdominal.
- Con hisopos de algodón húmedos, retraiga los intestinos hacia el lado derecho del abdomen y cúbralos con una gasa humedecida. Aplique otra gasa húmeda para cubrir el estómago, el bazo y el hígado, exponiendo el riñón izquierdo y los vasos renales.
- Con una aguja de hidrodisección de 27 G y pinzas de punta roma, separe la vena renal izquierda de la arteria renal, eliminando cuidadosamente la grasa y el tejido conectivo de ambos vasos.
- Aísle las venas gonadales y suprarrenales, y use seda 6-0 para ligarlas proximales a la vena renal temporalmente. Cauterizar, con pinzas bipolares, todas las micro ramas laterales que aíslan la vena renal y la arteria entre la aorta/VC y el riñón.
- Movilizar y ligar el uréter con una sutura de seda 6-0 en el polo inferior. Marque la vena y la arteria renal con un bolígrafo de tinte quirúrgico para ayudar a orientar los vasos durante la anastomosis y asegurarse de que no haya torceduras.
- Pinzar la arteria renal y la vena renal con una pinza de microvasos lo más cerca posible de la aorta y la VC. Transito la arteria renal con unas tijeras de resorte justo después de la bifurcación del vaso y divide la vena renal aproximadamente a mitad de camino entre la VC y el riñón. Movilizar el riñón izquierdo del tejido conectivo circundante y extraerlo.
- Enjuague ambos vasos con solución salina heparinizada con una aguja de hidrodisección de 27 G para eliminar toda la sangre restante.
- Con unas tijeras de resorte, corte una pequeña abertura de boca de pez en la horquilla de la bifurcación de la arteria renal para hacer una abertura en forma de embudo e inserte un stent de 8 mm cortado de un catéter de 26 G (Figura 2B). Asegure el stent con una sutura de seda 6-0, dejando un extremo de la sutura largo para su uso posterior.
- Introduzca el hígado del donante y colóquelo con el PV, el IHVC y el conducto biliar frente a la vena renal y la arteria izquierda del receptor. Con una sutura de nailon 9-0, instale dos suturas de soporte en lados opuestos de la conexión entre la IHVC y la vena renal.
- Compare el ancho de los vasos y haga una pequeña incisión en la boca del pez con unas tijeras de resorte en la cara de la vena renal hasta que tenga un ancho similar al IHVC del donante (Figura 2C).
- Usando una sutura de nylon 9-0, anastomusque el IHVC hepático de extremo a extremo a la vena renal con 9 o 10 suturas continuas a través de las paredes frontal y posterior del vaso. Alternativamente, utilice un método de manguito para completar esta anastomosis 3,4.
- Confirme que la colocación de la arteria renal está por debajo de la IHVC (Figura 2D) e inserte el stent previamente colocado en la arteria renal en la vena porta del hígado y asegúrelo con una sutura de seda 6-0, dejando un extremo de la sutura largo para que se adhiera a la rosca opuesta en la arteria. Junte los extremos para evitar que cada uno se deslice fuera del stent.
- Retire primero la micropinza de la vena renal y, a continuación, retire la micropinza de la arteria renal.
- Durante la reperfusión hepática, se utilizan gasas e hisopos de algodón para aplicar una ligera presión alrededor de la región de la anastomosis hasta lograr una anastomosis permeable (Figura 2D). Retirar las ligaduras temporales previamente colocadas en las venas suprarrenal y gonadal.
- Movilice cuidadosamente aproximadamente 10 mm por el extremo del uréter izquierdo desde el tejido conectivo circundante, dejando una cantidad significativa de tejido graso adherido. Con unas tijeras de muelle, realizar una pequeña incisión en la pared del uréter proximal a la ligadura 5-0 previamente colocada.
- Insertar el stent de poliimida previamente adherido a la vía biliar en la pequeña incisión realizada en la pared del uréter. Asegúrelo con una sutura de seda 6-0 y ate un extremo con el hilo largo en el lado del conducto biliar del stent, juntando ambos extremos firmemente.
- Regrese los intestinos a su posición natural (Figura 2E), irrigar con 2-3 mL de solución salina y cierre el abdomen en dos capas con suturas de seda 3-0.
- Inyecte 0,1 mg/kg de buprenorfina por vía subcutánea, coloque al receptor en una jaula limpia y climatizada y controle la recuperación durante 1-2 horas antes de devolver al animal al establo de animales.
4. Seguimiento postquirúrgico
- A partir del día 2 después de la cirugía, inyecte heparina (1 UI/g) por vía subcutánea a los receptores de trasplantes alogénicos diariamente.
- A partir del día 2 después de la cirugía, inyecte heparina (1 UI/2 g) por vía subcutánea a los receptores de trasplantes singénicos cada dos días.
Resultados
En la actualidad, se han utilizado 29 pares de ratas para establecer el protocolo HALT-PVA, 17 trasplantes singénicos y 12 trasplantes alogénicos. Los hígados trasplantados singénicos sobrevivieron a su criterio de valoración experimental designado de 8 o 30 días con una tasa de éxito del 70%, mientras que los hígados trasplantados alogénicos sobrevivieron a sus criterios de valoración designados de 3 u 8 días con una tasa de éxito del 50%. Los fracasos incluyen ratas que murieron debido a complicaciones quirúrgicas e hígados auxiliares que fallaron incluso cuando el receptor sobrevivió.
La duración media de la operación fue de 130 min, con un tiempo de isquemia fría de unos 35 min, y un tiempo de isquemia caliente de menos de 25 min. Siempre que no hubiera complicaciones intraoperatorias, los receptores se despertaron y se activaron en 10-20 minutos, comenzaron a beber y deambular en 1 h y 24 h después, se comportaron como ratas sanas normales.
Los injertos hepáticos singénicos mostraron una excelente coloración y permeabilidad del conducto biliar a los 30 días después del trasplante (Figura 3), mientras que la histología de hematoxilina y eosina (H&E) mostró una estructura normal de los hepatocitos sin alteraciones parenquimatosas significativas en los puntos temporales de 8 y 30 días (Figura 4A, B). Después de solo 3 días, la histología de los trasplantes alogénicos mostró una inflamación portal significativa (Figura 4C), mientras que los injertos alogénicos de 8 días mostraron rechazo celular agudo con infiltración linfocítica extensa (Figura 4D).
Las muestras representativas de LTx alogénicas y singénicas fueron evaluadas por un patólogo hepático certificado, y el rechazo se puntuó mediante el índice de actividad de rechazo (RAI) del esquema de Banff12. La evaluación anatomopatológica determinó la ausencia de rechazo, con un RAI de Banff de 0, tanto en los trasplantes singénicos de 8 días como en los de 30 días, mientras que los aloinjertos de 8 días fueron rechazados severamente con una puntuación de RAI de Banff de 9 (Tabla 1).
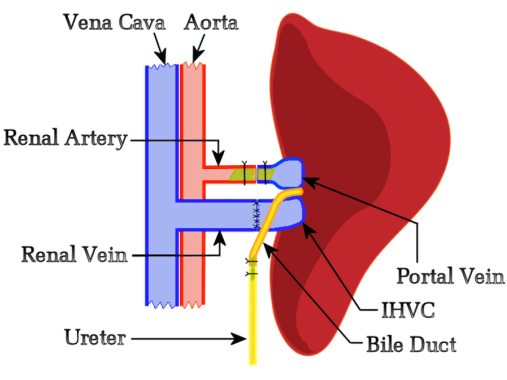
Figura 1: Diagrama esquemático del procedimiento HALT-PVA de rata. La VP se arterializa con la arteria renal izquierda mediante un stent, la IHVC se anastomosa de extremo a extremo a la vena renal izquierda y el conducto biliar se conecta al uréter mediante un stent. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Procedimiento quirúrgico. (A) Hidrodisección de PV. Disocie la PV del tejido conectivo circundante con una aguja de hidrodisección de 27 G. (B) Inserción de stent arterial. El stent arterial se inserta en una pequeña abertura en forma de embudo cortada en la horquilla de la bifurcación de la arteria renal. (C) Ensanchamiento de la vena renal. Con el fin de coincidir con el mayor ancho del IHVC del donante para la anastomosis, se hace un pequeño corte en la boca de pescado en la cara de la vena renal del receptor después de que se coloquen dos suturas de estancia. (D) Injerto de hígado perfundido inmediatamente después de la anastomosis. La colocación de la arteria renal y la conexión VP debajo de la vena renal y la IHVC es crucial para prevenir la trombosis del injerto. (E) Rata HALT-PVA in situ. El hígado auxiliar se coloca contra la pared izquierda del abdomen antes de devolver los intestinos. Haga clic aquí para ver una versión más grande de esta figura.
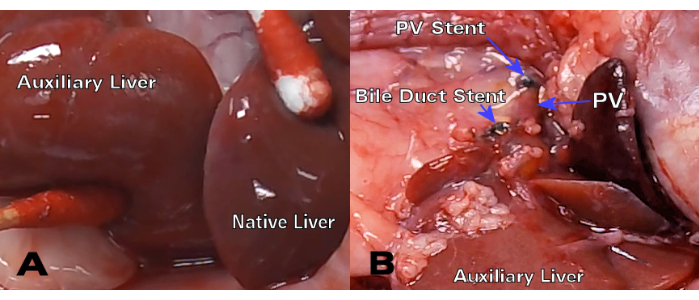
Figura 3: HALT-PVA singénico a los 30 días del trasplante. (A) Después de 30 días, el hígado auxiliar tiene un color y textura similares al hígado nativo, mientras que (B) el conducto biliar y el stent PV permanecen permeables y sin restricciones. Haga clic aquí para ver una versión más grande de esta figura.
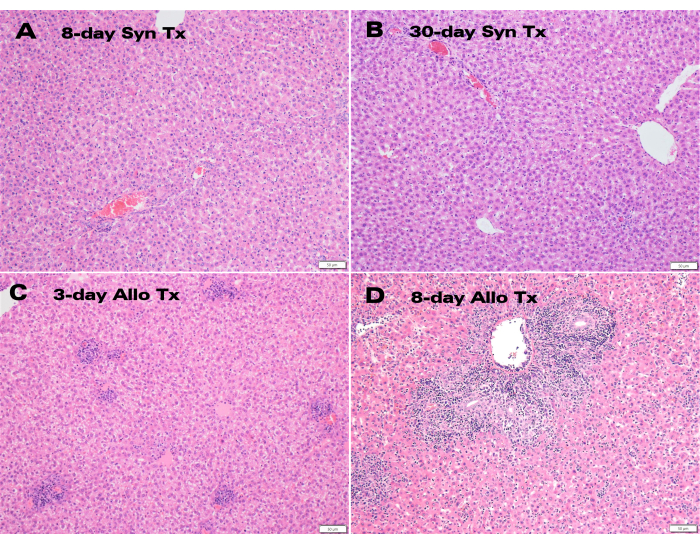
Figura 4: Histología de los injertos hepáticos auxiliares. Tinción H&E de (A) injertos singénicos post-trasplante a los 8 días y (B) a los 30 días que exhiben una estructura normal de los hepatocitos junto con (C) injertos alogénicos a los 3 días y (D) a los 8 días que muestran inflamación portal e infiltración linfocítica. Barra de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
| Tx's alogénicos | Inflamación portal | Lesión del conducto biliar | Endoinflamación venosa | Banff RAI |
| 3 días (LT-34) | 2 | 2 | 3 | 7 |
| 3 días (LT-38) | 1 | 0 | 0 | 1 |
| 8 días (LT-20) | 3 | 3 | 3 | 9 |
| 8 días (LT-40) | 3 | 3 | 3 | 9 |
| Tx's singénicos | ||||
| 8 días (LT-13) | 0 | 0 | 0 | 0 |
| 8 días (LT-19) | 0 | 0 | 0 | 0 |
| 30 días (LT-28) | 0 | 0 | 0 | 0 |
| 30 días (LT-32) | 0 | 0 | 0 | 0 |
Tabla 1: Esquema de Banff. Índice de actividad de rechazo (RAI) de LTx's alogénicos y singénicos de rata.
Discusión
El trasplante de hígado es la única opción de tratamiento para los pacientes con enfermedad hepática terminal, con casi 9.000 LTxs realizados anualmente en los EE. UU.13. Desafortunadamente, el rechazo inmunológico se observa hasta en el 25% de los receptores de LTx, y este rechazo es perjudicial para el órgano trasplantado y el paciente14,15. Para mejorar los resultados después de la LTx, se requiere el desarrollo de modelos innovadores para estudiar el rechazo de órganos e implementar estrategias para disminuir el rechazo.
En comparación con el trasplante ortotópico de hígado de rata, el modelo heterotópico actual es notablemente fácil de establecer. El grado de dificultad técnica se calcula mejor considerando el paso más difícil del procedimiento, que son las anastomosis de extremo a extremo de la IHVC a la vena renal. Nuestra preferencia personal para esta conexión es utilizar la sutura tradicional, mientras que otros encuentran más conveniente un sistema de manguito 3,4; De cualquier manera, cualquier persona que se sienta cómoda con la anastomosis de extremo a extremo de una vena de 3 mm por cualquier método tiene todas las habilidades técnicas necesarias para realizar este procedimiento. Al tener acceso a un microscopio de doble cabezal, preferimos hacer estas cirugías con dos personas; Sin embargo, esto no es un requisito para tener éxito con este protocolo, ya que también se ha realizado en solitario.
La principal complicación postoperatoria de este modelo es la trombosis del hígado del injerto, provocada por tres factores. En primer lugar, el propio stent arterial puede inducir trombosis si los extremos del stent tienen rebabas o irregularidades que causan turbulencias en el flujo sanguíneo. El stent debe cortarse con una navaja afilada, no con tijeras, y luego inspeccionarse bajo el microscopio para asegurarse de que no haya imperfecciones. En segundo lugar, si la anastomosis de la arteria renal/stent VP se coloca encima de la anastomosis de la vena renal/IHVC, restringirá el flujo sanguíneo e inducirá trombosis. La colocación final del stent arterial debe ser por debajo de la IHVC, ver Figura 2D. En tercer lugar, el tratamiento postquirúrgico con el anticoagulante heparina es esencial para prevenir la trombosis de los trasplantes alogénicos, mientras que una dosis más baja de heparina también es útil para eliminar el riesgo de trombosis en los injertos singénicos.
La menor tasa de supervivencia de los trasplantes alogénicos en comparación con los injertos singénicos reportados aquí refleja la naturaleza protrombótica del hígado auxiliar de rechazo, lo que desencadena la trombosis del stent arterial. Se necesitaron varios intentos para encontrar un esquema de dosificación de heparina que pudiera evitar que el stent trombosara en los trasplantes alogénicos. Inicialmente, de los primeros 6 receptores de aloinjertos que sobrevivieron a la cirugía, el 50% de los hígados auxiliares fracasaron debido a la trombosis, pero tras un aumento en la dosis de heparina, los siguientes tres trasplantes alogénicos posteriores sobrevivieron sin trombosis. En el futuro, una vez determinada una dosis efectiva de heparina, esperamos que la tasa de éxito de los trasplantes alogénicos aumente significativamente. Del mismo modo, la mayoría de los fracasos singénicos ocurrieron temprano en el desarrollo, y esperamos que la tasa de éxito de los trasplantes singénicos también mejore.
Utilizamos el modelo de rechazo agudo de Lewis a Brown Norway LTx porque la combinación de cepas de Brown Norway a Lewis no rechaza16. Cabe destacar que cuando se utilizan métodos de trasplante ortotópico con este modelo de rechazo, y se produce rechazo hepático, los animales receptores sufren una morbilidad severa ya que se deprimen, se vuelven inactivos y dejan de comer antes de morir dentro de los 14 días16. Sin embargo, con este modelo heterotópico de LTx, la muerte no se utiliza como criterio de valoración y no se produce morbilidad; El animal permanece sano y activo durante todo el experimento, incluso cuando el hígado auxiliar es completamente rechazado. Sin duda, este modelo heterotópico de LTx contribuye significativamente a minimizar el dolor, el sufrimiento y la angustia que experimentan los animales receptores.
Los avances recientes en la perfusión hepática normotérmica ex vivo (NEVLP) son un avance emocionante en la forma en que se almacenan los hígados antes del trasplante clínico 17,18,19. Durante la NEVLP, el hígado del donante reanuda la actividad fisiológica, lo que permite intervenciones terapéuticas previas al trasplante20,21. La NEVLP también se está utilizando cada vez más para evaluar la viabilidad de órganos marginales (hígados de donantes mayores u obesos o hígados obtenidos de donantes después de la muerte cardíaca)22,23. Aunque es emocionante, solo un puñado de laboratorios han podido trasplantar hígados de rata después de NEVLP24,25. Es probable que esto se deba al estrés quirúrgico en el animal y a la alta demanda técnica de preparar el hígado tanto para la NEVLP como para el trasplante. Por el contrario, la técnica quirúrgica heterotópica de LTx descrita en este manuscrito es menos exigente técnicamente y causa menos estrés en el animal. Como tal, puede ser una opción viable para modelos animales pequeños de NEVLP y el trasplante posterior.
En conclusión, presentamos un modelo alternativo de trasplante hepático de baja morbilidad que puede ser beneficioso para futuros estudios de rechazo al trasplante.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue apoyada por el Instituto Nacional de Salud (NIH, por sus siglas en inglés) K08AI155816, otorgado a DA.
Materiales
| Name | Company | Catalog Number | Comments |
| 3-0 Silk Suture | Ethicon | C013D | |
| 5-0 Silk ties | Fine Science Tools | 18020-50 | |
| 6-0 Silk ties | Fine Science Tools | 18020-60 | |
| 7-0 Silk ties | Teleflex | 103-s | |
| 9-0 Polyamide Suture | AROSurgical | T05A09N10-13 | Black |
| Bipolar Cautery | Codman & Shurtleff Inc. | P.H. 234 | |
| Buprenorphine HCL | Hospira | 409201232 | |
| Forceps, Adson-Brown | Fine Science Tools | 11627-12 | 12.5 cm |
| Forceps, Angled Dumont | Fine Science Tools | 11253-25 | Medical #5/45 11 cm |
| Forceps, Suture Tying | Fine Science Tools | 18025-10 | 10 cm |
| Heparin Sodium Injection, USB | Fresenius Kabi | 504015 | 10,000 USP units per 10 mL |
| Hydrodissection Cannula | Ambler Surgical | 1021E | 27 G |
| Isoflurane | Dechra Vet. Products | 17033-091-25 | |
| I.V. Catheter | Kendall | 2619PUR | 26 G x 3/4" |
| Magnetic Retraction System | Fine Science Tools | 18200-50 | |
| Micro Clamps | Fine Science Tools | 18055-05 | 6 mm |
| Micro Clamps | Fine Science Tools | 18055-06 | 4 mm |
| Micro Clamp Applicator | Fine Science Tools | 18057-14 | 14 cm |
| Micro Needle Holder | S&T | C-14 | 14 cm |
| Microscope | Zeiss | Universal S3 | Dual head |
| Ophthalmic Ointment | Puralube | 14590500 | |
| Polyimidi Tubing | Cole Parmer | 95820-04 | OD 0.0215", ID 0.0195", wall 0.0010" |
| Saline | Baxter | 281324 | 0.9% Sodium Chloride |
| Surgical Spring Scissors | S&T | SDC-15 | Blunt 14 cm |
| Surgical Spring Scissors | Fine Science Tools | 15021-15 | Vannas 14 cm |
Referencias
- Lee, S., Edgington, T. S. Heterotopic liver transplantation utilizing inbred rat strains. Am J Pathol. 52 (3), 649-669 (1968).
- Hess, F., Jerusalem, C., Van der Heyde, M. N. Advantages of auxiliary liver homotransplantation in rats. Arch Surg. 104, 76-80 (1972).
- Marni, A., Ferrero, M. Heterotopic liver grafting in the rat. A simplified method using cuff techniques. Transplantation. 39 (3), 329-331 (1985).
- Kobayashi, E., et al. Auxiliary heterotopic liver transplantation in the rat: a simplified model using cuff technique and application for congenitally hyperbilirubimemic Gunn rat. Microsurgery. 18 (2), 97-102 (1998).
- Schleimer, K., et al. Auxiliary liver transplantation with flow-regulated portal vein arterialization offers a successful therapeutic option in acute hepatic failure--investigations in heterotopic auxiliary rat liver transplantation. Transpl Int. 19 (7), 581-588 (2006).
- Qiao, J., Han, C., Zhang, J., Wang, Z., Meng, X. A new model of auxiliary partial heterotopic liver transplantation with liver dual artery supply. Exp Ther Med. 9 (2), 367-371 (2015).
- Li, J., Ren, J., Zhang, J., Meng, X. A. Modified kidney-sparing portal vein arterialization model of heterotopic auxiliary liver transplantation increases liver IL-6, TNF-α, and HGF levels and enhances liver regeneration: an animal model. BMC Surg. 2, 281-292 (2022).
- Ono, Y., et al. Regeneration and cell recruitment in an improved heterotopic auxiliary partial liver transplantation (APLT) model in the rat. Transplantation. 101 (1), 92-100 (2017).
- Wang, J., et al. Auxiliary partial liver grafting in rats: effect of host hepatectomy on graft regeneration, and review of literature on surgical technique. Microsurgery. 22 (8), 371-377 (2002).
- Schleimer, K., et al. Heterotopic auxiliary rat liver transplantation with flow-regulated portal vein arterialization in acute hepatic failure. J Vis Exp. (91), e51115(2014).
- Prescott, M. J., Lidster, K. Improving quality of science through better animal welfare: the NC3Rs strategy. Lab Animal. 46 (4), 152-156 (2017).
- Banff schema for grading liver allograft rejection: an international consensus document. Hepatology. 25 (3), 658-663 (1997).
- Kwong, A. J., et al. OPTN/SRTR 2020 Annual Data Report: Liver. Am J Transplant. 22, Suppl 2 204-309 (2022).
- Nacif, L. S., et al. Late acute rejection in liver transplant: a systematic review. Arq Bras Cir Dig. 28 (3), 212-215 (2015).
- Levitsky, J., et al. Acute rejection increases risk of graft failure and death in recent liver transplant recipients. Clin Gastroenterol Hepatol. 15 (4), 584-593 (2017).
- Gong, J., Cao, D., Chen, Y., Li, J., Gong, J., Zeng, Z. Role of programmed death ligand 1 and Kupffer cell in immune regulation after orthotopic liver transplantation in rats. Int Immunopharmacol. 48, 8-16 (2017).
- Ceresa, C. D. L., Nasralla, D., Coussios, C. C., Friend, P. J. The case for normothermic machine perfusion in liver transplantation. Liver Transpl. 24 (2), 269-275 (2018).
- Nasralla, D., et al. A randomized trial of normothermic preservation in liver transplantation. Nature. 557 (7703), 50-56 (2018).
- Markmann, J. F., et al. Impact of portable normothermic blood-based machine perfusion on outcomes of liver transplant: The OCS liver PROTECT randomized clinical trial. JAMA Surg. 157 (3), 189-198 (2022).
- Goldaracena, N., et al. Anti-inflammatory signaling during ex vivo liver perfusion improves the preservation of pig liver grafts before transplantation. Liver Transpl. 22 (11), 1573-1583 (2016).
- Carlson, K. N., et al. Interleukin-10 and transforming growth factor-beta cytokines decrease immune activation during normothermic ex vivo machine perfusion of the rat liver. Liver Transpl. 27 (11), 1577-1591 (2021).
- Ig-Izevbekhai, K., Goldberg, D. S., Karp, S. J., Foley, D. P., Abt, P. L. Immunosuppression in donation after circulatory death liver transplantation: Can induction modify graft survival. Liver Transpl. 26 (9), 1154-1166 (2020).
- Kageyama, S., et al. Ischemia-reperfusion Injury in allogeneic liver transplantation: A role of CD4 T cells in early allograft injury. Transplantation. 105 (9), 1989-1997 (2021).
- Oldani, G., et al. The impact of short-term machine perfusion on the risk of cancer recurrence after rat liver transplantation with donors after circulatory death. PLoS One. 14 (11), e0224890(2019).
- Schlegel, A., Graf, R., Clavien, P. A., Dutkowski, P. Hypothermic oxygenated perfusion (HOPE) protects from biliary injury in a rodent model of DCD liver transplantation. J Hepatol. 59 (5), 984-991 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados