Method Article
Acessando a Citotoxicidade e a Resposta Celular a Biomateriais
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Esta metodologia visa avaliar a citotoxicidade de biomateriais através da preparação de extratos solúveis, utilizando ensaios de viabilidade e análise fenotípica, incluindo citometria de fluxo, RT-PCR, imunocitoquímica e outras técnicas de biologia celular e molecular.
Resumo
Os biomateriais entram em contato direto ou indireto com os tecidos humanos, tornando importante avaliar sua citotoxicidade. Essa avaliação pode ser realizada por diversos métodos, mas existe uma grande discrepância entre as abordagens utilizadas, comprometendo a reprodutibilidade e a comparação entre os resultados obtidos. Neste trabalho, propomos um protocolo para avaliar a citotoxicidade de biomateriais utilizando extratos solúveis, que utilizamos para biomateriais odontológicos. O preparo dos extratos é detalhado, desde a produção dos pellets até sua extração em meio de cultura. A avaliação da citotoxicidade dos biomateriais é baseada na atividade metabólica pelo ensaio de MTT, viabilidade celular pelo ensaio de Sulforhodamina B (SBR), perfil de morte celular por citometria de fluxo e morfologia celular por May-Grünwald Giemsa. Além da avaliação da citotoxicidade, um protocolo para avaliar a função celular é descrito com base na expressão de marcadores específicos avaliados por imunocitoquímica e PCR. Este protocolo fornece um guia abrangente para avaliação da citotoxicidade de biomateriais e efeitos celulares, utilizando a metodologia de extratos, de forma reprodutível e robusta.
Introdução
A biocompatibilidade pode ser definida como a capacidade de um material integrar tecidos e induzir uma resposta terapêutica favorável, livre de danos locais e sistêmicos 1,2,3. A avaliação da biocompatibilidade é crucial para o desenvolvimento de qualquer material destinado a uso médico. Portanto, este protocolo fornece uma abordagem sistemática e abrangente para todo pesquisador com o objetivo de desenvolver novos biomateriais ou estudar novas aplicações para biomateriais existentes.
Testes de citotoxicidade in vitro são amplamente utilizados como primeira fase para avaliação da biocompatibilidade, utilizando culturas primárias de células ou linhagens celulares. Os resultados constituem um primeiro indicador de potencial aplicação clínica. Além de serem vitais para o desenvolvimento de biomateriais, esses testes são obrigatórios para atender às regulamentações vigentes para introdução no mercado, provenientes dos reguladores dos EUA e da UE (certificação FDA e CE)4,5,6,7,8. Além disso, testes padronizados em pesquisas biomédicas proporcionam uma vantagem significativa em termos de reprodutibilidade e comparação de resultados de diferentes estudos sobre biomateriais ou dispositivossemelhantes9.
As diretrizes da International Organization for Standardization (ISO) são amplamente utilizadas por vários laboratórios comerciais, regulatórios e acadêmicos independentes para testar materiais de maneira precisa e reprodutível. A ISO 10993-5 refere-se à avaliação da citotoxicidade in vitro e a ISO 10993-12 reporta à preparação daamostragem10,11. Para os testes de biomateriais são apresentadas três categorias, a serem selecionadas de acordo com o tipo de material, tecidos em contato e objetivo do tratamento: extratos, contato direto e contato indireto 8,11,12,13. Os extratos são obtidos pelo enriquecimento de um meio de cultura celular com o biomaterial. Para os testes de contato direto, o biomaterial é colocado diretamente sobre as culturas celulares e, no contato indireto, é realizada a incubação com as células separadas por uma barreira, como um gel de agarose11. Controles adequados são obrigatórios, e um mínimo de três experimentos independentes devem ser realizados 5,8,10,11,14.
É fundamental simular ou exagerar as condições clínicas para determinar o potencial citotóxico. No caso de ensaios de extratos, a área superficial do material; o volume médio; o pH do meio e do material; a solubilidade, osmolaridade e razão de difusão do material; e as condições de extração, como agitação, temperatura e tempo, influenciam o enriquecimento dos meios5.
A metodologia permite a avaliação quantitativa e qualitativa da citotoxicidade de diversas formulações farmacêuticas, sólidas e líquidas. Vários ensaios podem ser realizados, como o teste de captação do vermelho neutro, o teste de formação de colônias, o ensaio de MTT e o ensaio de XTT 5,10,14.
A maioria dos estudos de avaliação de citotoxicidade publicados utiliza ensaios mais simples, nomeadamente MTT e XTT, que fornecem informações limitadas. A avaliação da biocompatibilidade não deve envolver apenas a avaliação da citotoxicidade, mas também da bioatividade de um determinado material de teste2, como endossa este protocolo. Devem ser utilizados critérios de avaliação adicionais sempre que justificados e documentados. Assim, este protocolo visa fornecer um guia abrangente, detalhando um conjunto de métodos para a avaliação da citotoxicidade de biomateriais. Além disso, a avaliação de diferentes processos celulares, nomeadamente o tipo de morte celular, morfologia celular, função celular na síntese de proteínas específicas e produção tecidual específica, são descritas.
Protocolo
1. Preparação dos pellets
- Prepare os moldes de policloreto de vinila (PVC) realizando furos circulares de dimensões conhecidas em placas de PVC.
OBS: As molduras de PVC podem ser confeccionadas de diferentes tamanhos. Calcular a superfície de contato dos moldes de PVC, utilizando a fórmula A= h(2πr)+2πr2 (r: raio do cilindro; h: altura do cilindro). - Preparar o biomaterial a ser testado de acordo com as instruções do fabricante e o mais próximo possível do início do experimento.
NOTA: Para a preparação de biomateriais de formulação pasta/pasta, uma quantidade adequada de pasta base e catalisador são misturados manualmente com uma espátula de mistura. Para outros materiais à base de formulações líquidas e em pó, deve-se realizar a espatulação manual ou a mistura mecânica com vibração, seguindo as instruções do fabricante ou as adequadas para novos materiais. Para materiais líquidos, esta etapa não é necessária. Inicie o protocolo na etapa 2. - Coloque o biomaterial sobre os moldes com uma espátula e deixe-os fixos no momento adequado.
NOTA: O tempo de presa e as condições de ajuste dos biomateriais devem seguir as instruções do fabricante ou as adequadas para novos materiais. - Após a colocação, retire os pellets do biomaterial dos moldes de PVC e coloque-os em um recipiente (uma placa de 6 poços ou uma placa de Petri pode ser usada).
- Esterilize os pellets colocando-os sob uma lâmpada de luz ultravioleta (UV) por 20 minutos para cada lado.
2. Obtenção dos extratos dos biomateriais
NOTA: Todos os procedimentos devem ser realizados sob rigorosas condições estéreis.
- Determinar o número necessário de pellets calculando a superfície dos pellets com base na fórmula descrita no ponto 1.1.
NOTA: Como valor de referência, a área de superfície de contato de 250 mm2/mL11,15 é obtida pela adição de 9 pastilhas (r 3 mm x h 1,5 mm) por mL do meio. - Preparar os extratos solúveis (extrato enriquecido com o biomaterial).
- Colocar os pellets num tubo de 50 ml e adicionar o correspondente do meio de cultura celular. Coloque os tubos por 24 horas na incubadora a 37°, em rotação constante.
Observação : use o meio de cultura de células apropriado para as culturas de células. - Após 24 horas, retire os tubos da incubadora. Neste ponto, os extratos correspondem a uma concentração de 1/1 ou 100%.
- Fazer diluições do extrato por adição sequencial de volumes iguais de meio condicionado para meio de cultura celular.
NOTA: Nenhum ajuste de pH deve ser feito na mídia.- Adicionar 1 mL de meio de cultura a 1 mL de extrato a 100% para obter um extrato a 50%. Adicionar 1 mL de meio de cultura a 1 mL de extrato a 50% para obter um extrato a 25%, e assim sucessivamente (Figura 1).
NOTA: Use as concentrações consideradas relevantes para cada composto.
- Adicionar 1 mL de meio de cultura a 1 mL de extrato a 100% para obter um extrato a 50%. Adicionar 1 mL de meio de cultura a 1 mL de extrato a 50% para obter um extrato a 25%, e assim sucessivamente (Figura 1).
- Colocar os pellets num tubo de 50 ml e adicionar o correspondente do meio de cultura celular. Coloque os tubos por 24 horas na incubadora a 37°, em rotação constante.

Figura 1: Esquema de preparação e diluições dos extractos solúveis. Clique aqui para ver uma versão maior desta figura.
3. Incubação celular com extratos dos biomateriais
- Preparar uma suspensão celular e colocá-la em um recipiente celular adequado, como uma placa multipoço, de acordo com o número de células necessárias para os experimentos.
- Iniciar com um frasco das células desejadas com 80% a 90% de confluência.
- Eliminar o meio de cultura celular, lavar com solução salina tamponada com fosfato (PBS) e destacar as células com tripsina-EDTA (1 a 2 mL para um frasco de cultura celular de 75cm2 ).
- Adicionar o meio de cultura celular (2 a 4 mL para um balão de cultura de célulasde 75 cm 2 ), transferir a suspensão celular para um tubo e centrifugar a 200 x g por 5 min.
- Suspender o pellet em um volume conhecido de meio de cultura celular.
NOTA: Este protocolo é projetado para o uso de culturas de células aderentes; no entanto, adaptações simples podem ser feitas para trabalhar com culturas de células em suspensão. - Conte as células no hemocitômetro e calcule a concentração celular da suspensão celular.
- Suspender a quantidade determinada de suspensão celular em meio de cultura e transferir para placas multipoço. Como valor de referência para densidade de semeadura, considere 5 – 20 x 105 células/cm2.
NOTA: O número adequado de células deve ser calculado de acordo com o tipo de célula e as características da célula, ou seja, o tempo de duplicação celular.
- Incubar as células por 24 horas para permitir a adesão celular.
- Após este período, administrar os extratos solúveis nas placas de cultura.
- Aspirar o meio de cultura celular.
- Adicionar os extratos dos biomateriais a cada poço, de acordo com a sequência de concentrações, conforme descrito anteriormente. Adicionar meio de cultura de células fresco aos poços controle.
- Incubar as placas por 24 h ou mais.
OBS: Controles negativos devem ser realizados em cada ensaio, correspondentes às células não tratadas, mantidas no meio de cultura. Os tempos de incubação podem ser selecionados de acordo com os objetivos do estudo.
4. Avaliação da atividade metabólica
- Após a incubação das células com os extratos dos biomateriais, aspirar o meio das placas e lavar cada poço PBS.
- Colocar, em cada poço, o volume adequado de brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio (MTT) 0,5 mg/mL preparado em PBS, pH 7,4.
- Incubar as placas por 4 h ou durante a noite no escuro a 37 ° C.
- Para solubilizar os cristais de formazana obtidos, adicione o volume adequado de solução de ácido clorídrico 0,04 M em isopropanol a cada poço e agite as placas por 30 minutos.
OBS: Ajustar a quantidade de MTT e isopropanol de acordo com o tamanho dos poços. - Mexa e homogeneize o conteúdo de cada poço, se necessário, pipetando para cima e para baixo até que nenhum cristal seja visto.
- Quantificar a absorbância a um comprimento de onda de 570 nm com um filtro de referência de 620 nm, no espectrofotômetro.
- Para calcular a atividade metabólica, dividir a absorbância das células tratadas pela absorbância das culturas controle. Para obter valores percentuais, multiplique por 100.
5. Avaliação da morte celular
NOTA: Para efectuar esta avaliação deve ser utilizado um mínimo de 10a 6 células por condição.
- Utilizar tubos de centrífuga devidamente identificados, de acordo com as condições a serem avaliadas.
- Após a incubação das células com os extratos dos biomateriais, coletar o meio de cultura para o respectivo tubo.
- Separar as células e adicionar a suspensão celular aos respectivos tubos.
- Concentrar as suspensões celulares por centrifugação a 120 x g durante 5 minutos.
- Lave os pellets com PBS. Remova o PBS por centrifugação a 1.000 x g por 5 minutos.
- Adicionar 1 mL de PBS e transferir os pellets de células para tubos de citometria identificados.
- Remova o PBS por centrifugação a 1.000 x g por 5 minutos.
- Incubar com 100 μL de tampão de ligação (0,01 M HEPES, 0,14 mM NaCl e 0,25 mM CaCl2)16, e deixar as células descansarem por cerca de 15 minutos para recuperação da membrana celular.
- Adicionar 2,5 μL de Anexina-V fluorescente e 1 μL de iodeto de propídio durante 15 minutos à temperatura ambiente no escuro.
- Após a incubação, adicionar 400 μL de PBS e analisar no citômetro. Para a análise e quantificação das informações utilizar softwares apropriados.
- Apresentar resultados em porcentagem de células vivas, apoptose, apoptose/necrose tardia e necrose.
6. Avaliação morfológica
- Selecione o tamanho apropriado das lamínulas de vidro esterilizado que se encaixam dentro da placa multipoço.
- Coloque cada lâmina em um poço usando pinças estéreis.
- Distribuir uma suspensão celular em concentração adequada nos poços e deixar pernoitar em uma incubadora a 37 °C em atmosfera umidificada com 95% de ar e 5% de CO2.
- Expor as culturas celulares aos extratos, conforme descrito anteriormente.
- Aspirar o meio e lavar com PBS.
- Deixe as lamínulas secar à temperatura ambiente e, em seguida, adicione um volume suficiente de solução de May-Grünwald para cobrir as lamínulas; incubar por 3 minutos.
- Retire o corante e lave com água destilada por 1 minuto.
- Retire a água e adicione um volume suficiente de solução de Giemsa para cobrir as lamínulas; Incubar por 15 minutos.
- Lave as tampas em água corrente.
- Transfira as lamínulas para um slide.
- Olhe sob um microscópio. Tire as fotografias com a ampliação escolhida.
7. Avaliação da função celular através da reação em cadeia da polimerase com transcrição reversa (RT-PCR)
NOTA: Para efectuar esta avaliação deve ser utilizado um mínimo de 2x106 células por condição. Como exemplo, a fosfatase alcalina é apresentada como um gene de interesse para avaliação da atividade de odontoblastos. Outros genes de interesse podem ser vistos na Tabela 1.
- Plaqueie as células conforme descrito acima.
NOTA: A concentração de células plaqueadas pode precisar ser ajustada, de acordo com o tipo celular e a citotoxicidade dos biomateriais em estudo. - Incubar com extratos solúveis, conforme descrito acima.
- Separar as células para obter uma suspensão como descrito anteriormente.
- Lave as células duas vezes com PBS; para esta centrífuga a 200 x g durante 5 minutos à temperatura ambiente.
- Lisar as células suspendendo o pellet em 1 mL de solução de purificação de RNA (por exemplo, NZYol), agitação intensa e pipetagem sucessiva.
- Incubar as amostras durante 5 minutos à temperatura ambiente.
- Adicionar 200 μL de clorofórmio e agitar os tubos manualmente durante 15 segundos.
- Incubar durante 3 minutos à temperatura ambiente.
- Centrifugar lisa a 4°C por 15 min a 12.000 x g. Durante essa centrifugação, duas fases se originam na amostra, deixando o RNA na fase aquosa (superior).
- Remover a fase aquosa para um novo tubo e adicionar 500 μL de isopropanol frio para precipitar o RNA.
- Incubar as amostras à temperatura ambiente durante 10 minutos e centrifugar a 12.000 x g durante 10 minutos a 4°C.
- Retire o sobrenadante e lave o pellet com 1 mL de etanol 75% por centrifugação a 7.500 x g por 5 minutos a 4°C.
- Secar o pellet à temperatura ambiente até evaporação do etanol.
- Suspender em água livre de RNase.
- Quantificar e determinar o grau de pureza das amostras utilizando espectrofotometria de absorção, nos comprimentos de onda 260 nm e 280 nm. Determinar a pureza do RNA e usar amostras com uma relação de pureza (A260/280) em torno de 2,0.
- Armazenar amostras a -80 ° C.
- Proceder à realização do RT-PCR seguindo o protocolo do fabricante17.
OBS: De acordo com o objetivo do estudo, selecione os marcadores específicos a serem avaliados.
8. Avaliação da função celular através da identificação de proteínas
NOTA: De acordo com o objetivo do estudo, selecione as proteínas específicas a serem avaliadas. Como exemplo, a sialoproteína dentinária (DSP) é apresentada como uma proteína de interesse para a avaliação da atividade dos odontoblastos. Outras proteínas de interesse podem ser vistas na Tabela 1.
- Cultivar células em lamínulas e expor aos extratos, como descrito anteriormente.
- Lave as culturas celulares com PBS.
- Fixar com paraformaldeído a 3,7% durante 30 minutos à temperatura ambiente.
- Lave duas vezes com PBS.
- Permeabilizar com Triton a 0,5% em PBS por 15 minutos.
- Bloquear a peroxidase com peróxido de hidrogênio a 0,3% em PBS por 5 minutos.
- Lave duas vezes com PBS.
- Lavar duas vezes com albumina de soro bovino (BSA) a 0,5%.
- Bloquear culturas celulares com BSA 2% por 45 minutos.
- Lavar com BSA 0,5% em PBS.
- Incubar culturas com o anticorpo primário de acordo com a proteína selecionada por 60 minutos à temperatura ambiente.
NOTA: Este protocolo utiliza o anticorpo primário DSP(M20) (1:100) e o anticorpo secundário Policlonal Coelho Anti-caprino imunoglobulinas/HRP (1:100). - Lavar cinco vezes com BSA a 0,5% em PBS.
- Incubar com anticorpo secundário durante 90 minutos à temperatura ambiente.
NOTA: Faça as diluições de anticorpos usando BSA 0,5% em PBS. - Lavar cinco vezes com BSA 0,5% em PBS por 1 minuto em cada lavagem.
- Incubar culturas com uma mistura de substrato e cromógeno a uma concentração de 20 μL de cromogênio/mL de substrato por 25 minutos.
- Lavar duas vezes com BSA a 0,5% em PBS.
- Contracoloração com Hematoxilina por 15 minutos.
- Lavar com uma sequência de 0,037 mol/L de amoníaco e água destilada durante 5 minutos para remover o excesso de corante.
- Monte as tampas nos slides. Use glicerol como meio de montagem.
- Deixe secar durante a noite.
- Olhe sob um microscópio. Tire as fotografias com a ampliação escolhida.
9. Avaliação da mineralização pelo ensaio de Alizarin Red S
- Preparar uma solução de Alizarin Red S a uma concentração de 40 mM18. Mexa a solução para homogeneização durante 12 horas no escuro.
NOTA: Para preparar 100 mL de solução de Alizarin Red S, solubilizar 1,44 g de alizarina em pó (Peso molecular: 360 g/mol) em água ultrapura, protegida da luz. Para esta solução, o valor de pH é crítico e deve estar entre 4,1 e 4,3. - Incubar a cultura celular com extratos solúveis, conforme descrito acima.
- Lavar culturas celulares três vezes com PBS.
- Fixar com paraformaldeído a 4% durante 15 minutos à temperatura ambiente.
- Lave três vezes com PBS.
- Manchar com solução de coloração vermelha de alizarina durante 20 minutos a 37 °C no escuro.
- Após a coloração, lave as placas com PBS para remover o excesso de corante.
- Olhe sob um microscópio. Tire as fotografias com a ampliação escolhida.
- Adicionar a cada poço uma solução de extração, composta por 10% (p/v) de ácido acético e 20% (p/v) de metanol, e deixar mexer por 40 minutos à temperatura ambiente.
- Medir a absorbância no comprimento de onda de 490 nm em espectrofotômetro19.
Resultados
Os resultados representativos referem-se ao estudo dos biomateriais odontológicos. A metodologia do extrato permite obter um perfil de citotoxicidade e função celular após exposição aos materiais dentários, quanto aos efeitos sobre a atividade metabólica (Figura 2), viabilidade celular, perfil de morte celular e morfologia celular (Figura 3), e expressão de proteínas específicas (Figura 4).
O ensaio de MTT é usado para obter uma rápida visão geral da citotoxicidade dos materiais de forma direta. Pode-se fazer uma comparação entre dois ou mais materiais (Figura 2); uma redução acentuada da atividade metabólica, mesmo quando em baixas (6,25%) e médias concentrações (50%), indica maior toxicidade (Figura 2a). Ao mesmo tempo, materiais menos citotóxicos apresentam apenas redução mais leve ou nenhuma (Figura 2b). Comparações entre diferentes momentos permitem determinar efeitos citotóxicos mais imediatos ou em estágios mais avançados.
Os efeitos sobre a viabilidade celular fornecem informações importantes sobre a redução celular viável, o que pode comprometer a capacidade de recuperação dos tecidos após um efeito lesivo. A determinação da porcentagem de células viáveis permite comparar a citotoxicidade do material; mais materiais citotóxicos induzem maior morte celular para a mesma concentração (Figura 3a e 3b). Reduções superiores a 30% são críticas e definem materiais em risco de baixa biocompatibilidade (Figura 3a). Essas informações são completadas com o perfil de morte celular (Figura 3a e 3b). Nos resultados representativos, mais materiais citotóxicos são caracterizados por uma diminuição acentuada da viabilidade celular e por um perfil de morte celular tardia de apoptose e necrose (Figura 3a), enquanto os menos citotóxicos apresentam menor morte celular e um perfil mais apoptótico e apoptótico tardio (Figura 3b).
As informações obtidas a partir da avaliação da morfologia celular (Figura 3c) complementam a avaliação da viabilidade celular. Alterações da morfologia típica da célula podem indicar um perfil apoptótico ounecrótico16. Além disso, informações adicionais podem ser obtidas a partir desse protocolo, como a observação de partículas do material (setas vermelhas, Figura 3C).
Marcadores específicos, fundamentais para a função celular, afetados pela exposição ao extrato podem ser avaliados por diversas técnicas, como imunohistoquímica, PCR, citometria de fluxo, blotting ou ensaios colorimétricos (Tabela 1). Resultados representativos da expressão de DSP após exposição aos extratos são mostrados na Figura 4a, e pode-se observar que alguns materiais (cimentos de silicatos tricálcicos) estimulam as células a aumentar a expressão proteica. Em contraste, outros (cimentos de hidróxido de cálcio) promovem uma diminuição significativa na expressão proteica, independentemente da perda de viabilidade. Em ambos os casos, a concentração dos extratos influencia diretamente na expressão proteica.
Na linhagem celular MDPC-23 do fenótipo odontoblasto, a formação de depósitos de mineralização é característica. O protocolo de identificação e quantificação dos depósitos mineralizados permite avaliar a função específica deste tipo de células especializadas. No caso apresentado, observou-se que, além de menos citotóxico, o cimento de silicatos tricálcicos estimula a função celular, uma vez que foi observado aumento dos depósitos mineralizados (Figura 4b). Ao contrário, o cimento de hidróxido de cálcio, mais citotóxico, levou à redução da deposição mineral devido ao comprometimento e morte celular (Figura 4b). Além de uma avaliação qualitativa, uma determinação quantitativa pode ser realizada (Figura 4c).
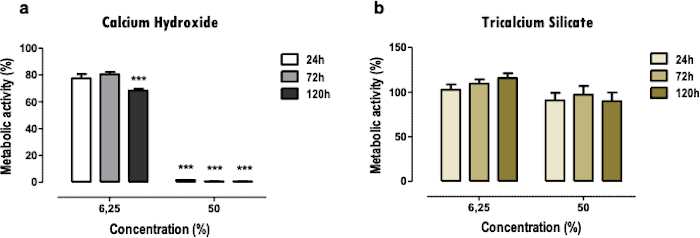
Figura 2: Atividade metabólica. Atividade metabólica de células MDPC-23 tratadas com substratos solúveis em cimento de hidróxido de cálcio [a)] e cimento de silicato tricálcico [b)] por 24, 72 e 120 horas. Os resultados são normalizados para as culturas de células controle, com um valor de 100%. As diferenças significativas são representadas por *, onde * significa p<0,05, ** significa p<0,01 e *** significa p<0,001. Parte desta Figura foi modificada de uma publicação anterior com permissão do editor20. Clique aqui para ver uma versão maior desta figura.
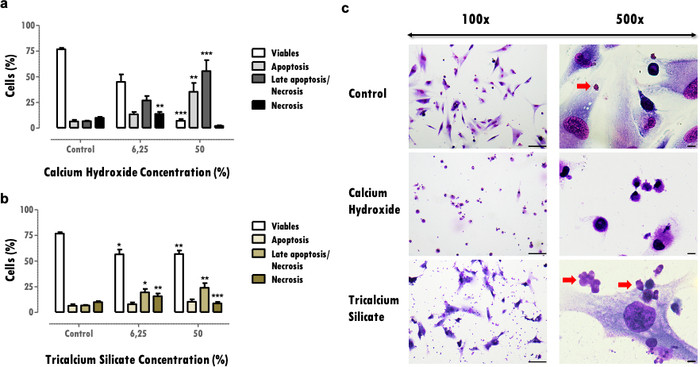
Figura 3: Viabilidade celular, perfil de morte e morfologia celular. Viabilidade celular, perfil de morte celular e morfologia celular em células MDPC-23 submetidas ao tratamento com hidróxido de cálcio e silicato tricálcico nas concentrações de 6,25% e 50%, após 120 horas de exposição. a) e b) Os resultados são plotados como a porcentagem de células vivas em apoptose, apoptose tardia ou necrose e necrose. Diferenças significativas com relação ao controle ou entre condições são representadas com *, onde * significa p <0,05, ** significa p <0,01 e *** significa p <0,001. c) Células coradas com May-Grünwald Giemsa após tratamento com concentração de 50% dos extratos solúveis dos biomateriais. O grupo controle representa células em cultura em DMEM com SFB a 10%. As imagens na coluna da esquerda foram obtidas com aumento de 100x, e as imagens na coluna da direita foram obtidas com aumento de 500x. As barras das figuras representam 100 μm. Parte desta Figura foi modificada de uma publicação anterior com permissão do editor20. Clique aqui para ver uma versão maior desta figura.
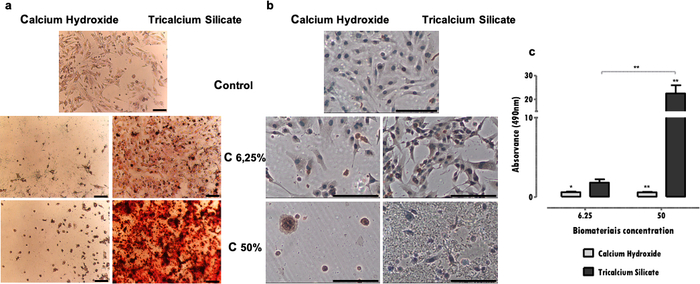
Figura 4: Expressão de DSP e formação de nódulos mineralizados. a) Células MDPC-23 marcadas por imunocitoquímica para detecção da expressão de DSP quando submetidas ao tratamento com hidróxido de cálcio e silicato tricálcico nas concentrações de 50% e 6,25% após 96 horas de incubação. b) Imagens de cultura de células MDPC-23 coradas pela coloração de Vermelho de Alizarina S quando tratadas com hidróxido de cálcio e biomateriais de silicato tricálcico nas concentrações de 50% e 6,25% após 120 horas de incubação. Todas as fotografias foram obtidas com aumento de 100x. Ambas as barras da Figura representam 150μm. c) Formação de depósitos de cálcio a partir de células MDPC-23 tratadas com hidróxido de cálcio e silicato tricálcico após 120 horas de exposição. Os resultados são a relação entre as absorbâncias das amostras e o controle. As diferenças significativas são representadas por *, onde * significa p<0,05, ** significa p<0,01 e *** significa p<0,001. Parte desta Figura foi modificada de uma publicação anterior com permissão do editor20. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Lista de marcadores de diferenciação/função odontoblástica47-79. Esta tabela fornece uma lista de marcadores odontoblásticos e métodos de detecção; Alguns desses marcadores também são expressos por outros tecidos.
| Gene ou Proteína | Método | Referências |
| Fosfatase alcalina (FA) | Colorimétrico | 47 48 |
| Imunocitoquímica | 20 49 | |
| Mancha do Norte | 50 | |
| RT-PCR | 51 52 | |
| Decorin (DCN) | ELISA Colorimétrico | 53 |
| Imunocitoquímica | 54 55 | |
| RT-PCR | 53 56 | |
| Proteína da Matriz da Dentina 1 (DMP-1) | Citometria de fluxo | 57 |
| Imunocitoquímica | 58 59 | |
| Mancha do Norte | 50 60 | |
| RT-PCR | 47 49 | |
| Mancha Ocidental | 50 60 | |
| Proteína da Matriz da Dentina 2 (DMP-2) | Imunocitoquímica | 60 61 |
| RT-PCR | 50 62 | |
| Mancha do Norte | 60 | |
| Mancha Ocidental | 62 | |
| Fosfoproteína da Dentina (DPP) | Imunocitoquímica | 63 |
| Mancha do Norte | 63 | |
| Sialoproteína da Dentina (DSP)* | Imunocitoquímica | 20 60 |
| Mancha do Norte | 60 63 | |
| RT-PCR | 50 | |
| Mancha Ocidental | 64 65 | |
| Sialofosfoproteína da Dentina (DSPP) | Citometria de fluxo | 57 |
| Imunocitoquímica | 66 54 | |
| RT-PCR | 47 49 | |
| Mancha do Norte | 67 68 | |
| Mancha Ocidental | 64 62 | |
| Isoisina/Metaloproteinase de Matriz-20 (MMP-20) | Mancha do Norte | 68 |
| RT-PCR | 49 68 | |
| Nestina | Imunocitoquímica | 54 69 |
| RT-PCR | 70 71 | |
| Mancha Ocidental | 72 | |
| Osteoaderina (OSAD) | Imunocitoquímica | 73 74 |
| Mancha do Norte | 73 | |
| RT-PCR | 75 | |
| Mancha Ocidental | 73 74 | |
| Osteopontina (OPN) | Imunocitoquímica | 76 |
| Mancha do Norte | 50 | |
| RT-PCR | 66 51 | |
| Mancha Ocidental | 77 | |
| Osteocalcina (OCN) | Imunocitoquímica | 52 |
| Mancha do Norte | 50 | |
| RT-PCR | 51 52 | |
| Mancha Ocidental | 77 78 | |
| Osterix (OSX)/ Fator de transcrição Sp7 (Sp7) | Imunocitoquímica | 54 58 |
| RT-PCR | 78 | |
| Mancha Ocidental | 78 79 | |
| Gene regulador de fosfato com homologias a endopeptidases no cromossomo X (Phex) | Mancha do Norte | 68 |
| RT-PCR | 49 68 | |
| Mancha Ocidental | 79 | |
| Fator de transcrição 2 relacionado a Runt (Runx2) | Imunocitoquímica | 66 52 |
| RT-PCR | 66 70 | |
| Mancha Ocidental | 62 77 | |
| *DPP e DSP são os produtos de clivagem do DSPP. | ||
Discussão
Esse protocolo foi elaborado levando em consideração a ISO 10993-5, que se refere à avaliação da citotoxicidade in vitro de biomateriais que entram em contato com os tecidos, para avaliar a biocompatibilidade e contribuir para a reprodutibilidade dosestudos21. Essa é uma preocupação crescente na ciência, e muitos autores já estão seguindo essas recomendações no desenho experimental de seus estudos in vitro15,22,23,24,25,26,27,28.
A metodologia proposta foi selecionada para selecionar os aspectos mais relevantes da biologia celular. Assim, este protocolo vai além das recomendações, uma vez que fornece uma abordagem completa para avaliar a citotoxicidade usando ensaios comuns e uma avaliação complementar, incluindo vários parâmetros celulares desde o fenótipo até a função. Essa avaliação complementar é importante para avaliar verdadeiramente o efeito dos biomateriais, uma vez que a viabilidade pode não traduzir alterações em nível de expressão gênica e proteica, ciclo celular ou secretoma.
Os extratos são vantajosos, principalmente em linhagens celulares aderentes, pois não há interferência na fixação celular ao substrato e em condições ótimas de cultivo, ao contrário de algumas abordagens de contato direto em que materiais são colocados na superfície da placa de cultura22,28.
Além disso, os extratos permitem a exposição celular a diferentes concentrações29, mimetizando a difusão de substâncias nos tecidos, o que simula a depuração que sofrem in vivo, principalmente quando aplicados em contato com tecidos extremamente irrigados. Os testes de contato direto podem não avaliar com precisão diferentes concentrações, e os testes de contato indireto demonstraram dificuldades potenciais com não-difusão, difusão incompleta através de membranas ou reação com ágar.
Testes que proporcionem uma avaliação quantitativa são preferidos, sendo considerada citotóxica a redução da viabilidade celular em mais de 30%11,30. No desenvolvimento de novos biomateriais, se essa redução ocorrer, determina a necessidade de reformulação ou abandono. Se resultados animadores forem alcançados, novos estudos devem ser realizados visando a avaliação in vivo29,31.
Os testes in vitro devem simular ou exagerar as condições clínicas. Assim, a determinação de relações de volume superficial adequadas para a preparação do extrato é crítica. Foram sugeridas relações superfície/volume de 1,25–6 cm2/mL. No caso de materiais com irregularidades superficiais como espumas 0,1–0,2 g/mL ou 6 cm 2/mL são um ponto de partida 15,20,2. A proporção de 250mm2por mL de meio foi utilizada em resultados representativos utilizados neste protocolo e em outrosestudos15,20.
Mesmo que não sejam utilizadas dessa forma nas clínicas, as amostras devem ser esterilizadas por métodos que não alterem suas propriedades. A irradiação UV é frequentemente uma boa escolha. Isso é de suma importância para prevenir a contaminação microbiana de culturas celulares 11,24,32.
Os meios de extração incluem meio de cultura celular com ou sem soro, solução salina fisiológica, dimetilsulfóxido ou água purificada, selecionados de acordo com as características químicas dos biomateriais 11,33. Visando estudos de cultura celular, o uso do meio de cultura celular é preferido, pois evita etapas adicionais de processamento. As condições de extração devem ser ajustadas ao modelo experimental. Nos resultados representativos apresentados neste protocolo, o meio de cultura DMEM suplementado com FBS foi utilizado por 24 ± 2 horas a 37 ± 1 °C.
Alguns biomateriais podem deixar resíduos no meio de extração, o que pode afetar negativamente as culturas celulares. Embora a filtração e as centrifugações devam ser evitadas, uma possibilidade é permitir que as partículas sedimentem antes de usar. Outra questão é o pH que pode sofrer alteração após a extração. Como não é recomendado realizar ajustes adicionais11, o pH dos extratos deve ser medido, registrado, e controles adicionais para isolar o efeito do pH devem ser incluídos no planejamento experimental, se necessário.
Embora este protocolo tenha sido descrito para culturas de células aderentes, modificações simples podem ser realizadas para usar culturas de suspensão. Da mesma forma, além do uso de biomateriais sólidos, é possível adaptar o procedimento, essencialmente as etapas de extração, para estudar líquidos, géis ou espumas34,35,36,37.
A preparação de culturas celulares com densidade adequada é crítica, especialmente em culturas celulares com alta taxa de duplicação31. De acordo com a faixa de densidade de semeadura recomendada para as células utilizadas, se forem planejadas incubações de longa duração, a redução da densidade inicial de semeadura deve ser realizada para evitar os problemas associados à confluência excessiva. Além disso, materiais altamente citotóxicos podem requerer maiores densidades iniciais de semeadura.
Além das vantagens da metodologia do extrato, não é a melhor escolha para materiais onde a avaliação da aderência celular é relevante. Nesse caso, os estudos de contato direto devem ser realizados 38,39,40,41. Embora seja uma abordagem abrangente, é importante ter em mente que se trata de uma avaliação in vitro, que não reflete totalmente as condições in vivo42.
Um biomaterial não deve apenas causar danos ao tecido, mas estimular alguns dos processos anti-inflamatórios e imunomoduladores43,44,45,46. Assim, este protocolo vai além, com a avaliação de mecanismos celulares, incluindo viabilidade celular e perfil de morte celular, bem como outros mecanismos de síntese proteica. A avaliação realizada deve permitir concluir sobre a bioatividade do biomaterial em tecidos vivos, além da citotoxicidade.
Com a explosão de novos materiais para aplicações médicas, não só para a odontologia, mas também para ortopedia, cirurgia, oftalmologia, cardiologia, etc., as triagens iniciais devem ser feitas sistematicamente. Este protocolo pode ser uma ferramenta importante para pesquisadores que desejam desenvolver e caracterizar novos biomateriais.
Divulgações
Os autores não têm interesses financeiros concorrentes ou outros conflitos de interesse.
Agradecimentos
Agradecemos o apoio: GAI 2013 (Faculdade de Medicina da Universidade de Coimbra); O CIBB é financiado por Fundos Nacionais via FCT (Fundação para a Ciência e a Tecnologia) através do Projeto Estratégico UIDB/04539/2020 e UIDP/04539/2020 (CIBB). Agradecemos a Jacques Nör, da Faculdade de Odontologia da Universidade de Michigan, pelo fornecimento da linhagem celular MDPC-23.
Materiais
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CaCl2 | Sigma | 10035-04-8 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| DAB + Chromogen | Dako | K3468 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| DSP (M-20) Antibody, 1: 100 | Santa Cruz Biotechnology | LS-C20939 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Hepes 0.01 M | Sigma | MFCD00006158 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Giemsa Stain, modified GS-500 | Sigma | MFCD00081642 | |
| Glycerol | Dako | C0563 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| May-Grünwald Stain MG500 | Sigma | MFCD00131580 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Polyclonal Rabbit Anti-goat immunoglobulins / HRP, 1: 100 | Dako | G-21234 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Substrate Buffer | Dako | 926605 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| β-actin antibody | Sigma | A5316 |
Referências
- Williams, D. F. On the mechanisms of biocompatibility. Biomaterials. 29 (20), 2941-2953 (2008).
- Bruinink, A., Luginbuehl, R. Evaluation of biocompatibility using in vitro methods: interpretation and limitations. Advances in Biochemical Engineering/Biotechnology. 126, 117-152 (2012).
- Wataha, J. C. Principles of biocompatibility for dental practitioners. The Journal of Prosthetic Dentistry. 86 (2), 203-209 (2001).
- Mishra, S. F. D. A. CE mark or something else?-Thinking fast and slow. Indian Heart Journal. 69 (1), 1-5 (2016).
- Barbeck, M., et al. Balancing Purification and Ultrastructure of Naturally Derived Bone Blocks for Bone Regeneration: Report of the Purification Effort of Two Bone Blocks. Materials. 12 (19), 3234 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- Coelho, C. C., Araújo, R., Quadros, P. A., Sousa, S. R., Monteiro, F. J. Antibacterial bone substitute of hydroxyapatite and magnesium oxide to prevent dental and orthopaedic infections. Materials Science and Engineering: C. 97, 529-538 (2019).
- Jung, O., et al. Improved In Vitro Test Procedure for Full Assessment of the Cytocompatibility of Degradable Magnesium Based on ISO 10993-5/-12. International Journal of Molecular Sciences. 20 (2), 255 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- ISO. I.O. for S. ISO 10993-12:2012 - part 12: Sample preparation and reference materials. ISO. , (2012).
- ISO. I.O. for S. ISO 10993-5:2009 Biological evaluation of medical devices - part 5: Tests for in vitro cytotoxicity. ISO. , (2009).
- Srivastava, G. K., et al. Comparison between direct contact and extract exposure methods for PFO cytotoxicity evaluation. Scientific Reports. 8 (1), 1425 (2018).
- Pusnik, M., Imeri, M., Deppierraz, G., Bruinink, A., Zinn, M. The agar diffusion scratch assay--A novel method to assess the bioactive and cytotoxic potential of new materials and compounds. Scientific Reports. 6, 20854 (2016).
- Spiller, K. L., et al. The role of macrophage phenotype in vascularization of tissue engineering scaffolds. Biomaterials. 35 (15), 4477-4488 (2014).
- Zhou, H., et al. In Vitro Cytotoxicity Evaluation of a Novel Root Repair Material. Journal of Endodontics. 39 (4), 478-483 (2013).
- Bordron, A., et al. The binding of some human antiendothelial cell antibodies induces endothelial cell apoptosis. Journal of Clinical Investigation. 101 (10), 2029-2035 (1998).
- Palmini, G., et al. Establishment of Cancer Stem Cell Cultures from Human Conventional Osteosarcoma. Journal of Visualized Experiments. (116), e53884 (2016).
- Gregory, C. A., Grady Gunn, W., Peister, A., Prockop, D. J. An Alizarin red-based assay of mineralization by adherent cells in culture: comparison with cetylpyridinium chloride extraction. Analytical Biochemistry. 329 (1), 77-84 (2004).
- Cai, S., Zhang, W., Chen, W. PDGFRβ+/c-kit+ pulp cells are odontoblastic progenitors capable of producing dentin-like structure in vitro and in vivo. BMC Oral Health. 16 (1), 113 (2016).
- Paula, A., et al. Biodentine Boosts, WhiteProRoot MTA Increases and Life Suppresses Odontoblast Activity. Materials. 12 (7), 1184 (2019).
- Chander, N. G. Standardization of in vitro studies. Journal of Indian Prosthodontic Society. 16 (3), 227-228 (2016).
- Cavalcanti, B. N., Rode de M, S., França, C. M., Marques, M. M. Pulp capping materials exert an effect on the secretion of IL-1β and IL-8 by migrating human neutrophils. Brazilian Oral Research. 25 (1), 13-18 (2011).
- Chang, S., Lee, S. Y., Ann, H. J., Kum, K. Y., Kim, E. C. Effects of calcium silicate endodontic cements on biocompatibility and mineralization-inducing potentials in human dental pulp cells. Journal of Endodontics. 40 (8), 1194-1200 (2014).
- Daltoé, M. O., Paula-Silva, F. W. G., Faccioli, L. H., Gatón-Hernández, P. M., De Rossi, A., Bezerra Silva, L. A. Expression of Mineralization Markers during Pulp Response to Biodentine and Mineral Trioxide Aggregate. Journal of Endodontics. 42 (4), 596-603 (2016).
- Elias, R. V., Demarco, F. F., Tarquinio, S. B. C., Piva, E. Pulp responses to the application of a self-etching adhesive in human pulps after controlling bleeding with sodium hypochlorite. Quintessence International. 38 (2), 67-77 (2007).
- Huang, G. T. J., Shagramanova, K., Chan, S. W. Formation of odontoblast-like cells from cultured human dental pulp cells on dentin in vitro. Journal of endodontics. 32 (11), 1066-1073 (2006).
- Jafarnia, B., et al. Evaluation of cytotoxicity of MTA employing various additives. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology. 107 (5), 739-744 (2009).
- Paranjpe, A., Smoot, T., Zhang, H., Johnson, J. D. Direct contact with mineral trioxide aggregate activates and differentiates human dental pulp cells. Journal of Endodontics. 37 (12), 1691-1695 (2011).
- Spagnuolo, G., et al. In vitro cellular detoxification of triethylene glycol dimethacrylate by adduct formation with N-acetylcysteine. Dental Materials. 29 (8), 153-160 (2013).
- Murray, P. E., García Godoy, C., García Godoy C, F. How is the biocompatibilty of dental biomaterials evaluated. Medicina Oral, Patologia Oral y Cirugia Bucal. 12 (3), 258-266 (2007).
- Hanks, C. T., Wataha, J. C., Sun, Z. In vitro models of biocompatibility: a review. Dental Materials. 12 (3), 186-193 (1996).
- Eid, A. A., et al. In Vitro Biocompatibility and Oxidative Stress Profiles of Different Hydraulic Calcium Silicate Cements. Journal of Endodontics. 40 (2), 255-260 (2014).
- Nocca, G., et al. Effects of ethanol and dimethyl sulfoxide on solubility and cytotoxicity of the resin monomer triethylene glycol dimethacrylate. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 100 (6), 1500-1506 (2012).
- Abuarqoub, D., Aslam, N., Jafar, H., Abu Harfil, Z., Awidi, A. Biocompatibility of Biodentine with Periodontal Ligament Stem Cells: In Vitro Study. Dentistry Journal. 8 (1), 17 (2020).
- Coelho, A. S., et al. Cytotoxic effects of a chlorhexidine mouthwash and of an enzymatic mouthwash on human gingival fibroblasts. Odontology. 108 (2), 260-270 (2020).
- Wang, M. O., et al. Evaluation of the In Vitro Cytotoxicity of Cross-Linked Biomaterials. Biomacromolecules. 14 (5), 1321-1329 (2013).
- Tyliszczak, B., Drabczyk, A., Kudłacik-Kramarczyk, S., Bialik-Wąs, K., Sobczak-Kupiec, A. In vitro cytotoxicity of hydrogels based on chitosan and modified with gold nanoparticles. Journal of Polymer Research. 24 (10), 153 (2017).
- Widbiller, M., et al. Three-dimensional culture of dental pulp stem cells in direct contact to tricalcium silicate cements. Clinical Oral Investigations. 20 (2), 237-246 (2016).
- Pintor, A. V. B., et al. In Vitro and In Vivo Biocompatibility of ReOss in Powder and Putty Configurations. Brazilian Dental Journal. 29 (2), 117-127 (2018).
- Pellissari, C. V. G., et al. In Vitro Toxic Effect of Biomaterials Coated with Silver Tungstate or Silver Molybdate Microcrystals. Journal of Nanomaterials. 2020, 1-9 (2020).
- Collado-González, M., et al. Cytotoxicity and bioactivity of various pulpotomy materials on stem cells from human exfoliated primary teeth. International Endodontic Journal. 50, 19-30 (2017).
- Paula, A., et al. Direct Pulp Capping: Which is the Most Effective Biomaterial? A Retrospective Clinical Study. Materials. 12 (20), 3382 (2019).
- Williams, D. F. There is no such thing as a biocompatible material. Biomaterials. 35 (38), 10009-10014 (2014).
- Schuh, J. C. L. Medical device regulations and testing for toxicologic pathologists. Toxicologic Pathology. 36 (1), 63-69 (2008).
- Pizzoferrato, A., et al. Cell culture methods for testing Biocompatibility. Clinical Materials. 15 (3), (1994).
- Pereira Paula, A. B., et al. Direct pulp capping: what is the most effective therapy? - review and meta-analysis. Journal of Evidence Based Dental Practice. , (2018).
- Caiaffa, K. S., et al. Effect of analogues of cationic peptides on dentin mineralization markers in odontoblast-like cells. Archives of Oral Biology. 103, 19-25 (2019).
- Fujiwara, S., Kumabe, S., Iwai, Y. Isolated rat dental pulp cell culture and transplantation with an alginate scaffold. Okajimas Folia Anatomica Japonica. 83 (1), 15-24 (2006).
- Nakashima, M., et al. Stimulation of Reparative Dentin Formation by Ex Vivo Gene Therapy Using Dental Pulp Stem Cells Electrotransfected with Growth/differentiation factor 11 (Gdf11). Human Gene Therapy. 15 (11), 1045-1053 (2004).
- Narayanan, K., et al. Differentiation of embryonic mesenchymal cells to odontoblast-like cells by overexpression of dentin matrix protein 1. Proceedings of the National Academy of Sciences of the United States of America. 98 (8), 4516-4521 (2001).
- Kim, H. J., Yoo, J. H., Choi, Y., Joo, J. Y., Lee, J. Y., Kim, H. J. Assessing the effects of cyclosporine A on the osteoblastogenesis, osteoclastogenesis, and angiogenesis mediated by the human periodontal ligament stem cells. Journal of Periodontology. , (2019).
- Bou Assaf, R., et al. Healing of Bone Defects in Pig's Femur Using Mesenchymal Cells Originated from the Sinus Membrane with Different Scaffolds. Stem Cells International. , (2019).
- He, W., et al. Lipopolysaccharide enhances decorin expression through the toll-like receptor 4, myeloid differentiating factor 88, nuclear factor-kappa B, and mitogen-activated protein kinase pathways in odontoblast cells. Journal of Endodontics. 38 (4), 464-469 (2012).
- Xiong, Y., et al. Wnt Production in Dental Epithelium Is Crucial for Tooth Differentiation. Journal of Dental Research. 98 (5), 580-588 (2019).
- Haruyama, N., et al. Genetic evidence for key roles of decorin and biglycan in dentin mineralization. Matrix Biology. 28 (3), 129-136 (2009).
- Sreenath, T., et al. Dentin Sialophosphoprotein Knockout Mouse Teeth Display Widened Predentin Zone and Develop Defective Dentin Mineralization Similar to Human Dentinogenesis Imperfecta Type III. Journal of Biological Chemistry. 278 (27), 24874-24880 (2003).
- Yang, Y., Zhao, Y., Liu, X., Chen, Y., Liu, P., Zhao, L. Effect of SOX2 on odontoblast differentiation of dental pulp stem cells. Molecular Medicine Reports. 16 (6), 9659-9663 (2017).
- Tao, H., et al. Klf4 Promotes Dentinogenesis and Odontoblastic Differentiation via Modulation of TGF-β Signaling Pathway and Interaction With Histone Acetylation. Journal of Bone and Mineral Research. 34 (8), 1502-1516 (2019).
- Massa, L. F., Ramachandran, A., George, A., Arana-Chavez, V. E. Developmental appearance of dentin matrix protein 1 during the early dentinogenesis in rat molars as identified by high-resolution immunocytochemistry. Histochemistry and Cell Biology. 124 (3-4), 197-205 (2005).
- Hao, J., Zou, B., Narayanan, K., George, A. Differential expression patterns of the dentin matrix proteins during mineralized tissue formation. Bone. 34 (6), 921-932 (2004).
- Tompkins, K., Alvares, K., George, A., Veis, A. Two related low molecular mass polypeptide isoforms of amelogenin have distinct activities in mouse tooth germ differentiation in vitro. Journal of Bone and Mineral Research. 20 (2), 341-349 (2005).
- Zhai, Y., et al. Activation and Biological Properties of Human β Defensin 4 in Stem Cells Derived From Human Exfoliated Deciduous Teeth. Frontiers in Physiology. 10, (2019).
- Bègue-Kirn, C., Ruch, J. V., Ridall, A. L., Butler, W. T. Comparative analysis of mouse DSP and DPP expression in odontoblasts, preameloblasts, and experimentally induced odontoblast-like cells. European Journal of Oral Sciences. 106, 254-259 (1998).
- Kikuchi, H., Suzuki, K., Sakai, N., Yamada, S. Odontoblasts induced from mesenchymal cells of murine dental papillae in three-dimensional cell culture. Cell and Tissue Research. 317 (2), 173-185 (2004).
- Li, X., Yang, G., Fan, M. Effects of homeobox gene distal-less 3 on proliferation and odontoblastic differentiation of human dental pulp cells. Journal of Endodontics. 38 (11), 1504-1510 (2012).
- Chen, S., et al. Differential regulation of dentin sialophosphoprotein expression by Runx2 during odontoblast cytodifferentiation. Journal of Biological Chemistry. 280 (33), 29717-29727 (2005).
- Narayanan, K., Gajjeraman, S., Ramachandran, A., Hao, J., George, A. Dentin matrix protein 1 regulates dentin sialophosphoprotein gene transcription during early odontoblast differentiation. Journal of Biological Chemistry. 281 (28), 19064-19071 (2006).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. A substractive PCR-based cDNA library from human odontoblast cells: identification of novel genes expressed in tooth forming cells. Matrix Biology. 19 (5), 421-430 (2000).
- Miyazaki, T., Baba, T., Mori, T., Komori, T. Collapsin Response Mediator Protein 1, a Novel Marker Protein for Differentiated Odontoblasts. Acta Histochemica et Cytochemica. 51 (6), 185-190 (2018).
- Yokoi, M., Kuremoto, K., Okada, S., Sasaki, M., Tsuga, K. Effect of attenuation of fibroblast growth factor receptor 2b signaling on odontoblast differentiation and dentin formation. In Vitro Cellular and Developmental Biology - Animal. 55 (3), 211-219 (2019).
- Tohma, A., et al. Glucose Transporter 2 and 4 Are Involved in Glucose Supply during Pulpal Wound Healing after Pulpotomy with Mineral Trioxide Aggregate in Rat Molars. Journal of Endodontics. , (2019).
- Sueyama, Y., Kaneko, T., Ito, T., Kaneko, R., Okiji, T. Implantation of Endothelial Cells with Mesenchymal Stem Cells Accelerates Dental Pulp Tissue Regeneration/Healing in Pulpotomized Rat Molars. Journal of Endodontics. 43 (6), 943-948 (2017).
- Petersson, U., Hultenby, K., Wendel, M. Identification, distribution and expression of osteoadherin during tooth formation. European Journal of Oral Sciences. 111 (2), 128-136 (2003).
- Couble, M. L., et al. Immunodetection of osteoadherin in murine tooth extracellular matrices. Histochemistry and Cell Biology. 121 (1), 47-53 (2004).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. Expression of the small leucine-rich proteoglycan osteoadherin/osteomodulin in human dental pulp and developing rat teeth. Bone. 27 (2), 265-270 (2000).
- Salmon, B., et al. Abnormal osteopontin and matrix extracellular phosphoglycoprotein localization, and odontoblast differentiation, in X-linked hypophosphatemic teeth. Connective Tissue Research. 55, 79-82 (2014).
- Liao, C., Ou, Y., Wu, Y., Zhou, Y., Liang, S., Wang, Y. Sclerostin inhibits odontogenic differentiation of human pulp-derived odontoblast-like cells under mechanical stress. Journal of Cellular Physiology. 234 (11), 20779-20789 (2019).
- Deng, X., et al. The combined effect of oleonuezhenide and wedelolactone on proliferation and osteoblastogenesis of bone marrow mesenchymal stem cells. Phytomedicine. 153103, (2019).
- Choi, H., Kim, T. H., Yun, C. Y., Kim, J. W., Cho, E. S. Testicular acid phosphatase induces odontoblast differentiation and mineralization. Cell and Tissue Research. 364 (1), 95-103 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados