Method Article
الوصول إلى السمية الخلوية واستجابة الخلايا للمواد الحيوية
* These authors contributed equally
In This Article
Summary
تهدف هذه المنهجية إلى تقييم السمية الخلوية للمواد الحيوية من خلال تحضير المستخلصات القابلة للذوبان ، باستخدام مقايسات الجدوى وتحليل النمط الظاهري ، بما في ذلك قياس التدفق الخلوي ، RT-PCR ، الكيمياء الخلوية المناعية ، وغيرها من تقنيات البيولوجيا الخلوية والجزيئية.
Abstract
تتلامس المواد الحيوية بشكل مباشر أو غير مباشر مع الأنسجة البشرية ، مما يجعل من المهم تقييم سميتها الخلوية. يمكن إجراء هذا التقييم بعدة طرق ، ولكن يوجد تباين كبير بين الأساليب المستخدمة ، مما يعرض للخطر قابلية التكرار والمقارنة بين النتائج التي تم الحصول عليها. في هذه الورقة ، نقترح بروتوكولا لتقييم السمية الخلوية للمواد الحيوية باستخدام المستخلصات القابلة للذوبان ، والتي نستخدمها للمواد الحيوية للأسنان. يتم تفصيل تحضير المستخلصات ، من إنتاج الكريات إلى استخراجها في وسط الاستزراع. يعتمد تقييم السمية الخلوية للمواد الحيوية على النشاط الأيضي باستخدام مقايسة MTT ، وصلاحية الخلية باستخدام مقايسة Sulphorhodamine B (SBR) ، وملف موت الخلية عن طريق قياس التدفق الخلوي ، ومورفولوجيا الخلية باستخدام May-Grünwald Giemsa. بالإضافة إلى تقييم السمية الخلوية ، يتم وصف بروتوكول لتقييم وظيفة الخلية بناء على التعبير عن علامات محددة تم تقييمها بواسطة الكيمياء المناعية و PCR. يوفر هذا البروتوكول دليلا شاملا للسمية الخلوية للمواد الحيوية وتقييم التأثيرات الخلوية ، باستخدام منهجية المستخلصات ، بطريقة قابلة للتكرار وقوية.
Introduction
يمكن تعريف التوافق الحيوي على أنه قدرة المادة على دمج الأنسجة وإحداث استجابة علاجية مواتية ، خالية من الأضرار المحلية والجهازية1،2،3. يعد تقييم التوافق الحيوي أمرا بالغ الأهمية لتطوير أي مادة مخصصة للاستخدام الطبي. لذلك ، يوفر هذا البروتوكول نهجا منظما وشاملا لكل باحث يهدف إلى تطوير مواد حيوية جديدة أو دراسة تطبيقات جديدة للمواد الحيوية الموجودة.
تستخدم اختبارات السمية الخلوية في المختبر على نطاق واسع كمرحلة أولى لتقييم التوافق الحيوي ، باستخدام مزارع الخلايا الأولية أو خطوط الخلايا. تشكل النتائج مؤشرا أوليا للتطبيق السريري المحتمل. إلى جانب كونه حيويا لتطوير المواد الحيوية ، فإن هذا الاختبار إلزامي للامتثال للوائح الحالية لإدخال السوق ، من منظمي EUA والاتحاد الأوروبي (شهادة FDA و CE)4،5،6،7،8. علاوة على ذلك ، يوفر الاختبار الموحد في البحوث الطبية الحيوية ميزة كبيرة من حيث قابلية التكرار ومقارنة النتائج من الدراسات المختلفة على المواد أو الأجهزة الحيويةالمماثلة 9.
تستخدم إرشادات المنظمة الدولية للتوحيد القياسي (ISO) على نطاق واسع من قبل العديد من المختبرات التجارية والتنظيمية والأكاديمية المستقلة لاختبار المواد بطريقة دقيقة وقابلة للتكرار. يشير ISO 10993-5 إلى تقييم السمية الخلوية في المختبر وتقارير ISO 10993-12 لإعداد العينات10,11. بالنسبة لاختبار المواد الحيوية ، يتم توفير ثلاث فئات ، يتم اختيارها وفقا لنوع المادة ، والأنسجة الملامسة ، وهدف العلاج: المستخلصات ، والاتصال المباشر ، والاتصال غير المباشر8،11،12،13. يتم الحصول على المستخلصات عن طريق إثراء وسط زراعة الخلايا بالمادة الحيوية. بالنسبة لاختبارات الاتصال المباشر ، يتم وضع المادة الحيوية مباشرة على مزارع الخلايا ، وفي الاتصال غير المباشر ، يتم إجراء الحضانة مع الخلايا مفصولة بحاجز ، مثل هلام الأغاروز11. الضوابط المناسبة إلزامية ، ويجب إجراء ما لا يقل عن ثلاث تجارب مستقلة5،8،10،11،14.
من الأهمية بمكان محاكاة أو المبالغة في الحالات السريرية لتحديد الإمكانات السامة للخلايا. في حالة اختبار المستخلصات ، مساحة سطح المادة ؛ الحجم المتوسط الوسط ودرجة الحموضة المادية ؛ قابلية ذوبان المواد والأسمولية ونسبة الانتشار ؛ وظروف الاستخراج مثل التحريض ودرجة الحرارة والوقت تؤثر على إثراء الوسائط5.
تسمح المنهجية بالتقييم الكمي والنوعي للسمية الخلوية للعديد من التركيبات الصيدلانية ، الصلبة والسائلة. يمكن إجراء العديد من المقايسات ، مثل اختبار امتصاص الأحمر المحايد ، واختبار تكوين المستعمرة ، ومقايسة MTT ، ومقايسة XTT5،10،14.
تستخدم معظم دراسات تقييم السمية الخلوية المنشورة مقايسات أبسط ، وهي MTT و XTT ، والتي توفر معلومات محدودة. لا ينبغي أن يتضمن تقييم التوافق الحيوي تقييم السمية الخلوية فحسب ، بل يجب أن يشمل أيضا النشاط الحيوي لمادة اختبار معينة2 ، كما يؤيد هذا البروتوكول. يجب استخدام معايير تقييم إضافية عند تبريرها وتوثيقها. وبالتالي ، يهدف هذا البروتوكول إلى توفير دليل شامل ، يفصل مجموعة من الطرق لتقييم السمية الخلوية للمواد الحيوية. إلى جانب ذلك ، يتم وصف تقييم العمليات الخلوية المختلفة ، وهي نوع موت الخلية ، ومورفولوجيا الخلية ، ووظيفة الخلية في تخليق بروتينات معينة ، وإنتاج الأنسجة المحددة.
Protocol
1. إعداد الكريات
- تحضير قوالب البولي فينيل كلوريد (PVC) عن طريق عمل ثقوب دائرية الشكل ذات أبعاد معروفة في ألواح PVC.
ملاحظة: يمكن تصنيع قوالب PVC بأحجام مختلفة. احسب سطح التلامس لقوالب PVC ، باستخدام الصيغة A = h (2πr) + 2πr2 (r: نصف قطر الأسطوانة ؛ h: ارتفاع الأسطوانة). - قم بإعداد المادة الحيوية المراد اختبارها وفقا لتعليمات الشركة الصانعة وفي أقرب وقت ممكن من بداية التجربة.
ملاحظة: لتحضير المواد الحيوية لصياغة المعجون / المعجون ، يتم خلط كمية كافية من عجينة القاعدة والمحفز يدويا باستخدام ملعقة خلط. بالنسبة للمواد الأخرى القائمة على تركيبات سائلة ومسحوق ، يجب إجراء الملعقة اليدوية أو الخلط الميكانيكي مع الاهتزاز ، باتباع تعليمات الشركة المصنعة أو المواد الجديدة المناسبة. بالنسبة للمواد السائلة ، هذه الخطوة ليست ضرورية. بدء تشغيل البروتوكول في الخطوة 2. - ضع المادة الحيوية على القوالب باستخدام ملعقة واتركها في الوقت المناسب.
ملاحظة: يجب أن يتبع وقت الإعداد وشروط الإعداد للمواد الحيوية تعليمات الشركة المصنعة أو المواد الجديدة المناسبة. - بعد الإعداد, قم بإزالة كريات المواد الحيوية من قوالب PVC وضعها في وعاء (يمكن استخدام طبق 6 بئر أو طبق بتري).
- تعقيم الكريات عن طريق وضعها تحت مصباح الأشعة فوق البنفسجية (UV) لمدة 20 دقيقة لكل جانب.
2. الحصول على مستخلصات المواد الحيوية
ملاحظة: يجب تنفيذ جميع الإجراءات في ظل ظروف معقمة صارمة.
- حدد العدد اللازم من الكريات عن طريق حساب مساحة سطح الحبيبات بناء على الصيغة الموضحة في 1.1.
ملاحظة: كقيمة مرجعية ، يتم تحقيق مساحة سطح التلامس البالغة 250 مم2 / مل11,15 بإضافة 9 كريات (ص 3 مم × ارتفاع 1.5 مم) لكل مل من الوسط. - تحضير المستخلصات القابلة للذوبان (مستخلص غني بالمادة الحيوية).
- ضع الكريات في أنبوب سعة 50 مل وأضف الوسط المقابل لزراعة الخلايا. ضع الأنابيب لمدة 24 ساعة في الحاضنة عند 37 درجة ، في دوران مستمر.
ملاحظة: استخدم وسط زراعة الخلايا المناسب لمزارع الخلايا. - بعد 24 ساعة ، قم بإزالة الأنابيب من الحاضنة. عند هذه النقطة ، تتوافق المستخلصات مع تركيز 1/1 أو 100٪.
- جعل التخفيفات من استخراج عن طريق إضافة متسلسلة من كميات متساوية من وسط مشروط إلى وسط زراعة الخلية.
ملاحظة: لا ينبغي إجراء أي تعديل على الأس الهيدروجيني للوسائط.- أضف 1 مل من وسائط الاستزراع إلى 1 مل من مستخلص 100٪ للحصول على مستخلص 50٪. أضف 1 مل من وسائط الاستزراع إلى 1 مل من مستخلص 50٪ للحصول على مستخلص 25٪ ، وهكذا (الشكل 1).
ملاحظة: استخدم التركيزات الموجودة ذات الصلة بكل مركب.
- أضف 1 مل من وسائط الاستزراع إلى 1 مل من مستخلص 100٪ للحصول على مستخلص 50٪. أضف 1 مل من وسائط الاستزراع إلى 1 مل من مستخلص 50٪ للحصول على مستخلص 25٪ ، وهكذا (الشكل 1).
- ضع الكريات في أنبوب سعة 50 مل وأضف الوسط المقابل لزراعة الخلايا. ضع الأنابيب لمدة 24 ساعة في الحاضنة عند 37 درجة ، في دوران مستمر.

الشكل 1: مخطط تحضير وتخفيفات المستخلصات القابلة للذوبان. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. حضانة الخلايا بمستخلصات المواد الحيوية
- قم بإعداد معلق خلوي ووضعه في حاوية خلية مناسبة ، مثل لوحة متعددة الآبار ، وفقا لعدد الخلايا اللازمة للتجارب.
- ابدأ بقارورة من الخلايا المرغوبة مع التقاء 80٪ إلى 90٪.
- تخلص من وسائط زراعة الخلايا ، واغسلها بمحلول ملحي مخزن بالفوسفات (PBS) وافصل الخلايا باستخدام التربسين-EDTA (1 إلى 2 مل لقارورة زراعة الخلايا 75 سم2 ).
- أضف وسائط زراعة الخلايا (2 إلى 4 مل لقارورة زراعة خلية 75 سم2 ) ، وانقل تعليق الخلية إلى أنبوب وجهاز طرد مركزي عند 200 × جم لمدة 5 دقائق.
- الحبيبات في حجم معروف من وسائط زراعة الخلايا.
ملاحظة: تم تصميم هذا البروتوكول لاستخدام مزارع الخلايا الملتصقة. ومع ذلك ، يمكن إجراء تعديلات بسيطة للعمل مع مزارع الخلايا المعلقة. - عد الخلايا في مقياس الدم وحساب تركيز الخلية لتعليق الخلية.
- تعليق الكمية المحددة من تعليق الخلية في وسط الثقافة ونقلها إلى أطباق متعددة الآبار. كقيمة مرجعية لكثافة البذر ، ضع في اعتبارك 5-20 × 105 خلايا / سم2.
ملاحظة: يجب حساب عدد الخلايا المخصص وفقا لنوع الخلية وخصائصها ، أي وقت مضاعفة الخلية.
- احتضان الخلايا لمدة 24 ساعة للسماح بالتصاق الخلية.
- بعد هذه الفترة ، قم بإدارة المستخلصات القابلة للذوبان في ألواح الاستزراع.
- نضح وسط زراعة الخلية.
- أضف مستخلصات المواد الحيوية إلى كل بئر ، وفقا لتسلسل التركيزات ، كما هو موضح سابقا. أضف وسط زراعة الخلايا الطازجة إلى آبار التحكم.
- احتضان اللوحات لمدة 24 ساعة أو أكثر.
ملاحظة: يجب إجراء الضوابط السلبية في كل فحص ، يتوافق مع الخلايا غير المعالجة ، التي يتم الاحتفاظ بها في وسط الاستزراع. يمكن اختيار أوقات الحضانة وفقا لأهداف الدراسة.
4. تقييم النشاط الأيضي
- بعد حضانة الخلية بمستخلصات المواد الحيوية ، قم بشفط الوسط من الألواح واغسل كل PBS جيدا.
- ضع في كل بئر الحجم الكافي من 0.5 ملغم / مل 3- (4،5-ثنائي ميثيل ثيازول-2-يل) -2،5-ثنائي فينيل ترازول بروميد (MTT) المحضر في PBS ، درجة الحموضة 7.4.
- احتضان لوحات لمدة 4 ساعات أو بين عشية وضحاها في الظلام عند 37 درجة مئوية.
- لإذابة بلورات الفورمازان التي تم الحصول عليها ، أضف الحجم المناسب لمحلول 0.04 متر من حمض الهيدروكلوريك في الأيزوبروبانول إلى كل بئر وحرك الألواح لمدة 30 دقيقة.
ملاحظة: اضبط كمية MTT والأيزوبروبانول وفقا لحجم الآبار. - قم بتحريك وتجانس محتويات كل بئر ، إذا لزم الأمر ، عن طريق السحب لأعلى ولأسفل حتى لا ترى أي بلورات.
- حدد كمية الامتصاص بطول موجي 570 نانومتر باستخدام مرشح مرجعي 620 نانومتر ، في مقياس الطيف الضوئي.
- لحساب النشاط الأيضي ، قسم امتصاص الخلايا المعالجة على امتصاص ثقافات التحكم. للحصول على قيم النسبة المئوية اضرب في 100.
5. تقييم موت الخلايا
ملاحظة: لإجراء هذا التقييم ، يجب استخدام ما لا يقل عن 106 خلايا لكل حالة.
- استخدام أنابيب الطرد المركزي المحددة بشكل صحيح ، وفقا للظروف التي يتم تقييمها.
- بعد حضانة الخلية بمستخلصات المواد الحيوية ، اجمع وسائط الاستزراع إلى الأنبوب المعني.
- افصل الخلايا وأضف تعليق الخلية إلى الأنابيب المعنية.
- ركز تعليق الخلية عن طريق الطرد المركزي عند 120 × جم لمدة 5 دقائق.
- اغسل الكريات باستخدام برنامج تلفزيوني. قم بإزالة PBS عن طريق الطرد المركزي عند 1000 × جم لمدة 5 دقائق.
- أضف 1 مل من برنامج تلفزيوني وانقل كريات الخلية إلى أنابيب قياس الخلايا المحددة.
- قم بإزالة PBS عن طريق الطرد المركزي عند 1000 × جم لمدة 5 دقائق.
- احتضان 100 ميكرولتر من المخزن المؤقت للربط (0.01 M HEPES و 0.14 mM NaCl و 0.25 mM CaCl2)16 ، واترك الخلايا ترتاح لمدة 15 دقيقة تقريبا لاستعادة غشاء الخلية.
- أضف 2.5 ميكرولتر من الفلورسنت المسمى Annexin-V و 1 ميكرولتر من يوديد البروبيديوم لمدة 15 دقيقة في درجة حرارة الغرفة في الظلام.
- بعد الحضانة ، أضف 400 ميكرولتر من PBS وقم بتحليلها على مقياس الخلايا. لتحليل وقياس المعلومات استخدام البرمجيات المناسبة.
- النتائج الحالية كنسبة مئوية من الخلايا الحية ، موت الخلايا المبرمج ، موت الخلايا المبرمج / النخر المتأخر ، والنخر.
6. تقييم التشكل
- حدد الحجم المناسب لأغطية الزجاج المعقمة التي تتناسب مع اللوحة متعددة الآبار.
- ضع كل شريحة في بئر باستخدام ملاقط معقمة.
- قم بتوزيع معلق خلوي بتركيز كاف في الآبار واتركه طوال الليل في حاضنة عند 37 درجة مئوية في جو مرطب مع 95٪ هواء و 5٪ CO2.
- فضح ثقافات الخلايا للمقتطفات ، كما هو موضح سابقا.
- نضح وسائل الإعلام وغسل مع برنامج تلفزيوني.
- اترك أغطية الغطاء تجف في درجة حرارة الغرفة ثم أضف كمية كافية من محلول May-Grünwald لتغطية أغطية الغطاء ؛ احتضان لمدة 3 دقائق.
- إزالة الصبغة وتغسل بالماء المقطر لمدة 1 دقيقة.
- قم بإزالة الماء وإضافة كمية كافية من محلول Giemsa لتغطية أغطية الغطاء ؛ احتضان لمدة 15 دقيقة.
- اغسل أغطية الأغطية بالماء الجاري.
- انقل قسائم الغطاء إلى شريحة.
- انظر تحت المجهر. التقط الصور مع التكبير المختار.
7. تقييم وظائف الخلية من خلال تفاعل البوليميراز المتسلسل للنسخ العكسي (RT-PCR)
ملاحظة: لإجراء هذا التقييم ، يجب استخدام ما لا يقل عن 2x106 خلايا لكل حالة. على سبيل المثال ، يتم تقديم الفوسفاتيز القلوي كجين مهم لتقييم نشاط الأرومات السنية. يمكن رؤية الجينات الأخرى ذات الأهمية في الجدول 1.
- لوحة الخلايا كما هو موضح أعلاه.
ملاحظة: قد يلزم تعديل تركيز الخلايا المطلية ، وفقا لنوع الخلية والسمية الخلوية للمواد الحيوية قيد الدراسة. - احتضان مع مقتطفات قابلة للذوبان ، كما هو موضح أعلاه.
- افصل الخلايا للحصول على تعليق كما هو موضح من قبل.
- غسل الخلايا مرتين مع برنامج تلفزيوني. لهذا الطرد المركزي في 200 × غرام لمدة 5 دقائق في درجة حرارة الغرفة.
- تحلل الخلايا عن طريق تعليق الحبيبات في 1 مل من محلول تنقية الحمض النووي الريبي (على سبيل المثال ، NZYol) ، والتحريك الشديد ، والامتصاص المتتالي.
- احتضان العينات لمدة 5 دقائق في درجة حرارة الغرفة.
- أضف 200 ميكرولتر من الكلوروفورم وهز الأنابيب باليد لمدة 15 ثانية.
- احتضان لمدة 3 دقائق في درجة حرارة الغرفة.
- يتحلل جهاز الطرد المركزي عند 4 درجات مئوية لمدة 15 دقيقة عند 12000 × جم. خلال هذا الطرد المركزي ، تنشأ مرحلتان في العينة ، تاركة الحمض النووي الريبي في المرحلة المائية (العلوية).
- قم بإزالة الطور المائي إلى أنبوب جديد وأضف 500 ميكرولتر من الأيزوبروبانول البارد لترسيب الحمض النووي الريبي.
- احتضان العينات في درجة حرارة الغرفة لمدة 10 دقائق وأجهزة الطرد المركزي عند 12000 × جم لمدة 10 دقائق عند 4 درجات مئوية.
- قم بإزالة المادة الطافية وغسل الحبيبات ب 1 مل من الإيثانول بنسبة 75٪ عن طريق الطرد المركزي عند 7500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- جفف الحبيبات في درجة حرارة الغرفة حتى يتبخر الإيثانول.
- في ماء خال من RNase.
- تحديد درجة نقاء العينات باستخدام قياس الطيف الضوئي للامتصاص ، عند الأطوال الموجية 260 نانومتر و 280 نانومتر. تحديد نقاء الحمض النووي الريبي واستخدام عينات بنسبة نقاء (A260 / 280) حوالي 2.0.
- تخزين العينات في -80 درجة مئوية.
- تابع إجراء RT-PCR باتباع بروتوكولالشركة المصنعة 17.
ملاحظة: وفقا لهدف الدراسة ، حدد العلامات المحددة المراد تقييمها.
8. تقييم وظيفة الخلية من خلال تحديد البروتين
ملاحظة: وفقا لهدف الدراسة ، حدد البروتينات المحددة المراد تقييمها. على سبيل المثال ، يتم تقديم بروتين العاج (DSP) كبروتين مهم لتقييم نشاط الأرومات السنية. يمكن رؤية البروتينات الأخرى ذات الأهمية في الجدول 1.
- خلايا الثقافة في أغطية وتعرض للمقتطفات ، كما هو موضح من قبل.
- اغسل ثقافات الخلايا باستخدام برنامج تلفزيوني.
- إصلاح مع 3.7 ٪ بارافورمالدهيد لمدة 30 دقيقة في درجة حرارة الغرفة.
- يغسل مرتين مع برنامج تلفزيوني.
- تتخلل مع 0.5٪ تريتون في برنامج تلفزيوني لمدة 15 دقيقة.
- منع بيروكسيديز مع 0.3 ٪ بيروكسيد الهيدروجين في برنامج تلفزيوني لمدة 5 دقائق.
- يغسل مرتين مع برنامج تلفزيوني.
- اغسل مرتين باستخدام 0.5٪ من ألبومين مصل الأبقار (BSA).
- كتلة الثقافات الخلوية مع 2٪ BSA لمدة 45 دقيقة.
- يغسل مع 0.5٪ BSA في برنامج تلفزيوني.
- احتضان الثقافات مع الجسم المضاد الأساسي وفقا للبروتين المحدد لمدة 60 دقيقة في درجة حرارة الغرفة.
ملاحظة: يستخدم هذا البروتوكول الجسم المضاد الأساسي DSP (M20) (1: 100) والجسم المضاد الثانوي Polyclonal Rabbit Anti-Goat immunoglobulins / HRP (1: 100). - اغسل خمس مرات باستخدام 0.5٪ BSA في برنامج تلفزيوني.
- احتضان مع الأجسام المضادة الثانوية لمدة 90 دقيقة في درجة حرارة الغرفة.
ملاحظة: قم بتخفيفات الأجسام المضادة باستخدام 0.5٪ BSA في PBS. - اغسل خمس مرات مع 0.5٪ BSA في PBS لمدة 1 دقيقة في كل غسلة.
- احتضان المستنبتات بركيزة وخليط كروموجين بتركيز 20 ميكرولتر كروموجين / مل لمدة 25 دقيقة.
- يغسل مرتين مع 0.5٪ BSA في برنامج تلفزيوني.
- كونترستيك مع الهيماتوكسيلين لمدة 15 دقيقة.
- يغسل بتسلسل 0.037 مول / لتر من الأمونيا والماء المقطر لمدة 5 دقائق لإزالة الصبغة الزائدة.
- قم بتركيب أغطية الأغطية على الشرائح. استخدم الجلسرين كوسيط للتركيب.
- السماح بالتجفيف طوال الليل.
- انظر تحت المجهر. التقط الصور مع التكبير المختار.
9. تقييم التمعدن من خلال مقايسة Alizarin Red S
- تحضير محلول Alizarin Red S بتركيز 40 mM18. حرك محلول التجانس لمدة 12 ساعة في الظلام.
ملاحظة: لتحضير 100 مل من محلول Alizarin Red S ، قم بإذابة 1.44 جم من مسحوق الأليزارين (الوزن الجزيئي: 360 جم / مول) في ماء عالي النقاء ، محمي من الضوء. بالنسبة لهذا الحل ، فإن قيمة الأس الهيدروجيني حرجة ويجب أن تكون بين 4.1 و 4.3. - احتضان ثقافة الخلايا مع مقتطفات قابلة للذوبان ، كما هو موضح أعلاه.
- اغسل ثقافات الخلايا ثلاث مرات باستخدام برنامج تلفزيوني.
- إصلاح مع 4 ٪ بارافورمالدهيد لمدة 15 دقيقة في درجة حرارة الغرفة.
- يغسل ثلاث مرات مع برنامج تلفزيوني.
- تلطخ بمحلول تلطيخ Alizarin Red لمدة 20 دقيقة عند 37 درجة مئوية في الظلام.
- بعد تلطيخ ، اغسل الألواح باستخدام برنامج تلفزيوني لإزالة الصبغة الزائدة.
- انظر تحت المجهر. التقط الصور مع التكبير المختار.
- أضف محلول استخراج ، يتكون من 10٪ (وزن / حجم) حمض الأسيتيك و 20٪ (وزن / حجم) ميثانول ، إلى كل بئر ، واتركه مع التقليب لمدة 40 دقيقة في درجة حرارة الغرفة.
- قم بقياس الامتصاص عند الطول الموجي 490 نانومتر على مقياس الطيف الضوئي19.
النتائج
تشير النتائج التمثيلية هنا إلى دراسة المواد الحيوية للأسنان. تسمح منهجية المستخلص بالحصول على ملف تعريف السمية الخلوية ووظيفة الخلية بعد عرضها على مواد طب الأسنان ، فيما يتعلق بالتأثيرات على النشاط الأيضي (الشكل 2) ، وصلاحية الخلية ، وملف موت الخلية ومورفولوجيا الخلية (الشكل 3) ، وتعبير البروتينات المحددة (الشكل 4).
يستخدم اختبار MTT للحصول على نظرة عامة سريعة على السمية الخلوية للمواد بطريقة مباشرة. يمكن إجراء مقارنة بين مادتين أو أكثر (الشكل 2) ؛ يشير الانخفاض الحاد في النشاط الأيضي ، حتى عندما يكون منخفضا (6.25٪) وتركيزات متوسطة (50٪) ، إلى سمية أعلى (الشكل 2 أ). في الوقت نفسه ، لا تقدم المواد الأقل سمية للخلايا سوى اختزال أخف أو لا يوجد أي اختزال (الشكل 2 ب). تسمح المقارنات بين النقاط الزمنية المختلفة بتحديد التأثيرات السامة للخلايا بشكل فوري أو في مراحل لاحقة.
توفر التأثيرات على صلاحية الخلية معلومات مهمة حول تقليل الخلايا القابلة للحياة ، والتي يمكن أن تضر بقدرة الأنسجة على التعافي بعد التأثير الضار. يسمح تحديد النسبة المئوية للخلايا القابلة للحياة بمقارنة السمية الخلوية للمواد. المزيد من المواد السامة للخلايا تحفز موت الخلايا أعلى لنفس التركيز (الشكل 3 أ و 3 ب). تعتبر التخفيضات التي تتجاوز 30٪ حرجة وتحدد المواد المعرضة لخطر انخفاض التوافق الحيوي (الشكل 3 أ). تكتمل هذه المعلومات بملف موت الخلية (الشكل 3 أ و 3 ب). في النتائج التمثيلية ، تتميز المزيد من المواد السامة للخلايا بانخفاض حاد في صلاحية الخلية ولموت الخلايا المبرمج المتأخر وملف موت الخلايا النخر (الشكل 3 أ) ، في حين أن المواد الأقل سمية للخلايا تقدم موتا أقل للخلايا ومظهرا أكثر موت الخلايا المبرمج والمتأخر (الشكل 3 ب).
المعلومات التي تم الحصول عليها من تقييم التشكل الخلوي (الشكل 3 ج) تكمل تقييم صلاحية الخلية. يمكن أن تشير التغييرات من التشكل النموذجي للخلية إلى ملف تعريف موت الخلايا المبرمج أو نخر16. أيضا ، يمكن الحصول على معلومات إضافية من هذا البروتوكول ، مثل مراقبة جزيئات المواد (الأسهم الحمراء ، الشكل 3C).
يمكن تقييم علامات محددة ، أساسية لوظيفة الخلية ، تتأثر بالتعرض للمستخلص من خلال عدة تقنيات ، مثل الكيمياء الهيستولوجية المناعية ، PCR ، قياس التدفق الخلوي ، النشاف ، أو المقايسات اللونية (الجدول 1). تظهر النتائج التمثيلية لتعبير DSP بعد التعرض للمستخلصات في الشكل 4 أ ، ويمكن ملاحظة أن بعض المواد (أسمنت سيليكات ثلاثي الكالسيوم) تحفز الخلايا على زيادة التعبير البروتيني. في المقابل ، يعزز البعض الآخر (أسمنت هيدروكسيد الكالسيوم) انخفاضا كبيرا في تعبير البروتين ، بغض النظر عن فقدان الجدوى. في كلتا الحالتين ، يؤثر تركيز المستخلصات بشكل مباشر على تعبير البروتين.
في خط خلية MDPC-23 من النمط الظاهري السني ، يكون تكوين رواسب التمعدن سمة مميزة. يسمح بروتوكول تحديد الرواسب المعدنية وتحديدها كميا بتقييم الوظيفة المحددة لهذا النوع من الخلايا المتخصصة. في الحالة المعروضة ، لوحظ أنه إلى جانب كونه أقل سمية للخلايا ، فإن أسمنت سيليكات ثلاثي الكالسيوم يحفز وظيفة الخلية ، بمجرد ملاحظة زيادة في الرواسب المعدنية (الشكل 4 ب). على العكس من ذلك ، أدى أسمنت هيدروكسيد الكالسيوم الأكثر سمية للخلايا إلى انخفاض ترسب المعادن بسبب ضعف الخلايا وموتها (الشكل 4 ب). بالإضافة إلى التقييم النوعي ، يمكن إجراء تحديد كمي (الشكل 4 ج).
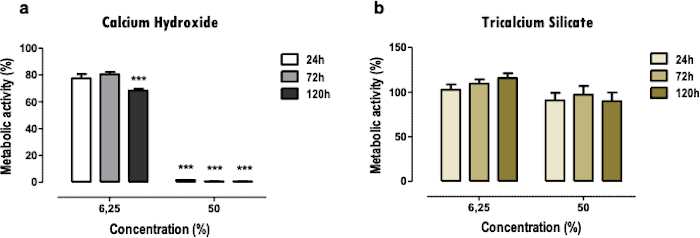
الشكل 2: النشاط الأيضي. النشاط الأيضي لخلايا MDPC-23 المعالجة بأسمنت هيدروكسيد الكالسيوم [أ)] ومستخلصات سيليكات سيليكات ثلاثي الكالسيوم [ب)] القابلة للذوبان لمدة 24 و 72 و 120 ساعة. يتم تطبيع النتائج إلى مزارع الخلايا الضابطة ، بقيمة 100٪. يتم تمثيل الاختلافات ذات الدلالة النظرية ب * ، حيث * تعني p < 0.05 ، ** تعني p < 0.01 ، و *** تعني p<0.001. تم تعديل جزء من هذا الشكل من منشور سابق بإذن من الناشر20. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
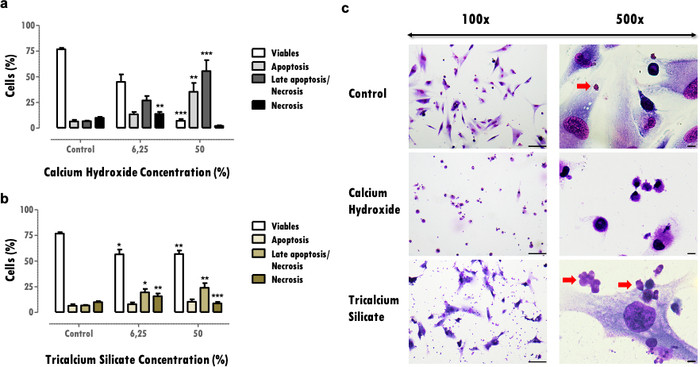
الشكل 3: صلاحية الخلية، وملف الموت، ومورفولوجيا الخلية. صلاحية الخلية ، وملف موت الخلية ، ومورفولوجيا الخلية في خلايا MDPC-23 التي خضعت للعلاج بهيدروكسيد الكالسيوم والمواد الحيوية لسيليكات ثلاثي الكالسيوم بتركيز 6.25٪ و 50٪ ، بعد 120 ساعة من التعرض. أ) و ب) يتم رسم النتائج كنسبة مئوية من الخلايا الحية في موت الخلايا المبرمج ، موت الخلايا المبرمج المتأخر أو النخر ، والنخر. يتم تمثيل الاختلافات ذات الدلالة النظرية فيما يتعلق بالتحكم أو بين الشروط ب * ، حيث * تعني p <0.05 ، ** تعني p <0.01 ، و *** تعني p <0.001. ج) الخلايا الملطخة ب May-Grünwald Giemsa بعد العلاج بتركيز 50٪ من المستخلصات القابلة للذوبان في المواد الحيوية. تمثل المجموعة الضابطة الخلايا في الثقافة في DMEM مع 10٪ FBS. تم الحصول على الصور في العمود الأيسر بتكبير 100x ، وتم الحصول على الصور الموجودة في العمود الموجود على اليمين بتكبير 500x. تمثل أشرطة الشكل 100 ميكرومتر. تم تعديل جزء من هذا الشكل من منشور سابق بإذن من الناشر20. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
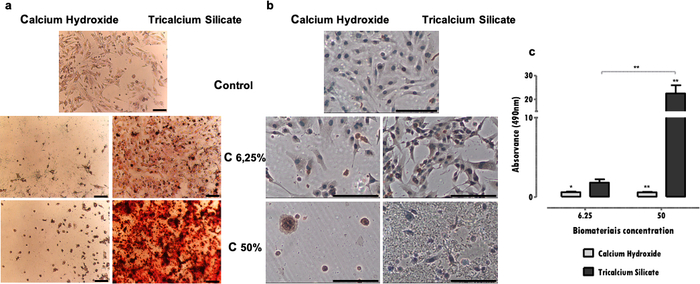
الشكل 4: تعبير DSP وتكوين العقيدات المعدنية. أ) خلايا MDPC-23 الموسومة بواسطة الكيمياء الخلوية المناعية للكشف عن تعبير DSP عند تعرضها للعلاج بهيدروكسيد الكالسيوم وسيليكات ثلاثي الكالسيوم بتركيزات 50٪ و 6.25٪ بعد 96 ساعة من الحضانة. ب) صور من خلايا MDPC-23 المستزرعة الملطخة بصبغة Alizarin Red S عند معالجتها بهيدروكسيد الكالسيوم والمواد الحيوية لسيليكات ثلاثي الكالسيوم بتركيزات 50٪ و 6.25٪ بعد 120 ساعة من الحضانة. تم الحصول على جميع الصور بتكبير 100x. يمثل كلا شريطي الشكل 150 ميكرومتر. ج) تكوين رواسب الكالسيوم من خلايا MDPC-23 المعالجة بهيدروكسيد الكالسيوم وسيليكات ثلاثي الكالسيوم بعد 120 ساعة من التعرض. النتائج هي نسبة امتصاص العينات والتحكم. يتم تمثيل الاختلافات ذات الدلالة النظرية ب * ، حيث * تعني p < 0.05 ، ** تعني p < 0.01 ، و *** تعني p<0.001. تم تعديل جزء من هذا الشكل من منشور سابق بإذن من الناشر20. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول 1: قائمة علامات التمايز / الوظيفة السنيةالأرومية 47-79. يقدم هذا الجدول قائمة بالعلامات السنية وطرق الكشف. يتم التعبير عن بعض هذه العلامات أيضا بواسطة أنسجة أخرى.
| الجين أو البروتين | أسلوب | مراجع |
| الفوسفاتيز القلوي (ALP) | القياس اللوني | 47 48 |
| الكيمياء المناعية | 20 49 | |
| اللطخة الشمالية | 50 | |
| RT-PCR | 51 52 | |
| ديكورين (DCN) | إليسا اللونية | 53 |
| الكيمياء المناعية | 54 55 | |
| RT-PCR | 53 56 | |
| بروتين مصفوفة العاج 1 (DMP-1) | قياس التدفق الخلوي | 57 |
| الكيمياء المناعية | 58 59 | |
| اللطخة الشمالية | 50 60 | |
| RT-PCR | 47 49 | |
| اللطخة الغربية | 50 60 | |
| بروتين مصفوفة العاج 2 (DMP-2) | الكيمياء المناعية | 60 61 |
| RT-PCR | 50 62 | |
| اللطخة الشمالية | 60 | |
| اللطخة الغربية | 62 | |
| بروتين فوسفوبروتين العاج (DPP) | الكيمياء المناعية | 63 |
| اللطخة الشمالية | 63 | |
| سيالوبروتين العاج (DSP)* | الكيمياء المناعية | 20 60 |
| اللطخة الشمالية | 60 63 | |
| RT-PCR | 50 | |
| اللطخة الغربية | 64 65 | |
| عاج سيالوفوسفوبروتين (DSPP) | قياس التدفق الخلوي | 57 |
| الكيمياء المناعية | 66 54 | |
| RT-PCR | 47 49 | |
| اللطخة الشمالية | 67 68 | |
| اللطخة الغربية | 64 62 | |
| إيوسين/ماتريكس ميتالوبروتيناز-20 (MMP-20) | اللطخة الشمالية | 68 |
| RT-PCR | 49 68 | |
| نستين | الكيمياء المناعية | 54 69 |
| RT-PCR | 70 71 | |
| اللطخة الغربية | 72 | |
| أوستوادهيرين (OSAD) | الكيمياء المناعية | 73 74 |
| اللطخة الشمالية | 73 | |
| RT-PCR | 75 | |
| اللطخة الغربية | 73 74 | |
| أوستيوبونتين (OPN) | الكيمياء المناعية | 76 |
| اللطخة الشمالية | 50 | |
| RT-PCR | 66 51 | |
| اللطخة الغربية | 77 | |
| أوستيوكالسين (OCN) | الكيمياء المناعية | 52 |
| اللطخة الشمالية | 50 | |
| RT-PCR | 51 52 | |
| اللطخة الغربية | 77 78 | |
| أوستيريكس (OSX) / عامل النسخ Sp7 (SP7) | الكيمياء المناعية | 54 58 |
| RT-PCR | 78 | |
| اللطخة الغربية | 78 79 | |
| الجين المنظم للفوسفات مع التماثل مع endopeptidases على كروموسوم X (Phex) | اللطخة الشمالية | 68 |
| RT-PCR | 49 68 | |
| اللطخة الغربية | 79 | |
| عامل النسخ المرتبط بالرون 2 (Runx2) | الكيمياء المناعية | 66 52 |
| RT-PCR | 66 70 | |
| اللطخة الغربية | 62 77 | |
| * DPP و DSP هما منتجان انشقاق DSPP. | ||
Discussion
تم تصميم هذا البروتوكول مع الأخذ في الاعتبار ISO 10993-5 ، والذي يشير إلى تقييم السمية الخلوية في المختبر للمواد الحيوية التي تتلامس مع الأنسجة ، لتقييم التوافق الحيوي والمساهمة في الدراسات استنساخ21. هذا مصدر قلق متزايد في العلوم ، والعديد من المؤلفين يتبعون بالفعل هذه التوصيات في التصميم التجريبي لدراساتهم في المختبر 15،22،23،24،25،26،27،28.
تم اختيار المنهجية المقترحة لفحص الجوانب الأكثر صلة ببيولوجيا الخلية. وبالتالي ، فإن هذا البروتوكول يتجاوز التوصيات ، بمجرد أن يوفر نهجا كاملا لتقييم السمية الخلوية باستخدام المقايسات الشائعة والتقييم التكميلي ، بما في ذلك العديد من معلمات الخلية من النمط الظاهري إلى الوظيفة. هذا التقييم التكميلي مهم لتقييم تأثير المواد الحيوية حقا ، بمجرد أن لا تترجم الجدوى التغيرات على مستوى التعبير الجيني والبروتيني أو دورة الخلية أو الإفراز.
تعتبر المستخلصات مفيدة ، خاصة في خطوط الخلايا الملتصقة ، لأنه لا يوجد تداخل مع ارتباط الخلية بالركيزة وظروف الثقافة المثلى ، على عكس بعض طرق الاتصال المباشر حيث يتم وضع المواد على سطح لوحة الاستزراع22,28.
علاوة على ذلك ، تسمح المستخلصات بتعرض الخلايا لتركيزات مختلفة29 ، مما يحاكي انتشار المواد في الأنسجة ، مما يحاكي الخلوص الذي تخضع له في الجسم الحي ، خاصة عندما يتم تطبيقها عند ملامستها للأنسجة المروية للغاية. قد لا تقيم اختبارات الاتصال المباشر التركيزات المختلفة بدقة ، وأظهرت اختبارات الاتصال غير المباشر صعوبات محتملة في عدم الانتشار ، أو الانتشار غير الكامل عبر الأغشية ، أو التفاعل مع أجار.
يفضل إجراء اختبارات توفر تقييما كميا ، مع اعتبار تقليل صلاحية الخلية بأكثر من 30٪ ساماللخلايا 11,30. في تطوير مواد حيوية جديدة ، إذا حدث هذا التخفيض ، فإنه يحدد الحاجة إلى إعادة الصياغة أو التخلي عنها. إذا تم تحقيق نتائج مشجعة ، فيجب إجراء مزيد من الدراسات لتصور التقييم في الجسم الحي29,31.
في الاختبارات المختبرية يجب أن تحاكي أو تبالغ في الحالات السريرية. وبالتالي ، فإن تحديد نسب حجم السطح المناسبة لإعداد المستخلص أمر بالغ الأهمية. تم اقتراح نسب السطح إلى الحجم من 1.25-6 سم2 / مل. في حالة المواد ذات المخالفات السطحية مثل الرغاوي 0.1-0.2 جم / مل أو 6 سم 2 / مل هي نقطة انطلاق15،20،2. تم استخدام نسبة 250 مم2لكل مل من الوسط في النتائج التمثيلية المستخدمة في هذا البروتوكول ودراسات أخرى15,20.
حتى لو لم يتم استخدامها بهذه الطريقة في العيادات ، يجب تعقيم العينات بطرق لا تغير خصائصها. غالبا ما يكون تشعيع الأشعة فوق البنفسجية اختيارا جيدا. هذا له أهمية قصوى لمنع التلوث الميكروبي لمزارع الخلايا11،24،32.
تشمل وسائط الاستخراج وسط زراعة الخلايا مع أو بدون مصل ، محلول ملحي فسيولوجي ، ثنائي ميثيل سلفوكسيد ، أو ماء نقي ، تم اختياره وفقا للخصائص الكيميائية للمواد الحيوية11,33. بهدف إجراء دراسات زراعة الخلايا ، يفضل استخدام وسيط زراعة الخلايا لأنه يتجنب المزيد من خطوات المعالجة. يجب تعديل شروط الاستخراج وفقا للنموذج التجريبي. في النتائج التمثيلية الموضحة في هذا البروتوكول، تم استخدام وسط الاستزراع DMEM المكمل ب FBS لمدة 24 ± ساعتين عند 37 ± 1 درجة مئوية.
قد تترك بعض المواد الحيوية بقايا في وسائط الاستخراج ، مما قد يؤثر سلبا على مزارع الخلايا. بينما يجب تجنب الترشيح والطرد المركزي ، فإن الاحتمال هو السماح للجسيمات بالترسبات قبل الاستخدام. مشكلة أخرى هي الرقم الهيدروجيني الذي قد يعاني من التغيير بعد الاستخراج. نظرا لأنه لا يوصى بإجراء مزيد من التعديلات11 ، يجب قياس الرقم الهيدروجيني للمستخلصات وتسجيله ، ويجب تضمين عناصر تحكم إضافية لعزل تأثير الأس الهيدروجيني في التصميم التجريبي إذا لزم الأمر.
بينما تم وصف هذا البروتوكول لمزارع الخلايا الملتصقة ، يمكن إجراء تعديلات بسيطة لاستخدام ثقافات التعليق. وبالمثل ، إلى جانب استخدام المواد الحيوية الصلبة ، من الممكن تكييف الإجراء ، بشكل أساسي خطوات الاستخراج ، لدراسة السوائل أو المواد الهلامية أو الرغاوي34،35،36،37.
يعد تحضير مزارع الخلايا ذات الكثافة المناسبة أمرا بالغ الأهمية ، خاصة في مزارع الخلايا ذات معدل الازدواجية العالي31. وفقا لنطاق كثافة البذر الموصى به للخلايا المستخدمة ، إذا تم التخطيط لحضانات طويلة الأمد ، فيجب إجراء تقليل كثافة البذر الأولية لتجنب المشاكل المرتبطة بالالتقاء المفرط. بالإضافة إلى ذلك ، قد تتطلب المواد شديدة السمية للخلايا كثافات أولية أعلى للبذر.
إلى جانب مزايا منهجية الاستخراج ، فهي ليست الخيار الأفضل للمواد التي يكون فيها تقييم التصاق الخلايا مناسبا. في هذه الحالة ، يجب إجراء دراسات الاتصال المباشر38،39،40،41. على الرغم من أن هذا نهج شامل ، فمن المهم أن نضع في اعتبارنا أنه تقييم في المختبر ، والذي لا يعكس تماما الظروف في الجسمالحي 42.
يجب ألا تتسبب المادة الحيوية في تلف الأنسجة فحسب ، بل يجب أن تحفز بعض العمليات المضادة للالتهابات والمناعة43،44،45،46. وبالتالي ، يذهب هذا البروتوكول إلى أبعد من ذلك ، مع تقييم الآليات الخلوية ، بما في ذلك صلاحية الخلية وملف موت الخلية ، بالإضافة إلى آليات أخرى لتخليق البروتين. يجب أن يسمح التقييم الذي تم إجراؤه باستنتاج النشاط الحيوي للمادة الحيوية في الأنسجة الحية ، إلى جانب السمية الخلوية.
مع انفجار المواد الجديدة للتطبيقات الطبية ، ليس فقط لطب الأسنان ولكن أيضا لجراحة العظام والجراحة وطب العيون وأمراض القلب وما إلى ذلك ، يجب إجراء الفحوصات الأولية بشكل منهجي. قد يكون هذا البروتوكول أداة مهمة للباحثين الذين يهدفون إلى تطوير وتوصيف مواد حيوية جديدة.
Disclosures
ليس للمؤلفين مصالح مالية متنافسة أو تضارب مصالح آخر.
Acknowledgements
نشكر ما يلي على الدعم: GAI 2013 (كلية الطب في جامعة كويمبرا) ؛ يتم تمويل CIBB من قبل الصناديق الوطنية عبر FCT (مؤسسة العلوم والتكنولوجيا) من خلال المشروع الاستراتيجي UIDB / 04539/2020 و UIDP / 04539/2020 (CIBB). نشكر جاك نور ، كلية طب الأسنان بجامعة ميشيغان ، على توفير خط الخلية MDPC-23.
Materials
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CaCl2 | Sigma | 10035-04-8 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| DAB + Chromogen | Dako | K3468 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| DSP (M-20) Antibody, 1: 100 | Santa Cruz Biotechnology | LS-C20939 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Hepes 0.01 M | Sigma | MFCD00006158 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Giemsa Stain, modified GS-500 | Sigma | MFCD00081642 | |
| Glycerol | Dako | C0563 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| May-Grünwald Stain MG500 | Sigma | MFCD00131580 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Polyclonal Rabbit Anti-goat immunoglobulins / HRP, 1: 100 | Dako | G-21234 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Substrate Buffer | Dako | 926605 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| β-actin antibody | Sigma | A5316 |
References
- Williams, D. F. On the mechanisms of biocompatibility. Biomaterials. 29 (20), 2941-2953 (2008).
- Bruinink, A., Luginbuehl, R. Evaluation of biocompatibility using in vitro methods: interpretation and limitations. Advances in Biochemical Engineering/Biotechnology. 126, 117-152 (2012).
- Wataha, J. C. Principles of biocompatibility for dental practitioners. The Journal of Prosthetic Dentistry. 86 (2), 203-209 (2001).
- Mishra, S. F. D. A. CE mark or something else?-Thinking fast and slow. Indian Heart Journal. 69 (1), 1-5 (2016).
- Barbeck, M., et al. Balancing Purification and Ultrastructure of Naturally Derived Bone Blocks for Bone Regeneration: Report of the Purification Effort of Two Bone Blocks. Materials. 12 (19), 3234 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- Coelho, C. C., Araújo, R., Quadros, P. A., Sousa, S. R., Monteiro, F. J. Antibacterial bone substitute of hydroxyapatite and magnesium oxide to prevent dental and orthopaedic infections. Materials Science and Engineering: C. 97, 529-538 (2019).
- Jung, O., et al. Improved In Vitro Test Procedure for Full Assessment of the Cytocompatibility of Degradable Magnesium Based on ISO 10993-5/-12. International Journal of Molecular Sciences. 20 (2), 255 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- ISO. I.O. for S. ISO 10993-12:2012 - part 12: Sample preparation and reference materials. ISO. , (2012).
- ISO. I.O. for S. ISO 10993-5:2009 Biological evaluation of medical devices - part 5: Tests for in vitro cytotoxicity. ISO. , (2009).
- Srivastava, G. K., et al. Comparison between direct contact and extract exposure methods for PFO cytotoxicity evaluation. Scientific Reports. 8 (1), 1425 (2018).
- Pusnik, M., Imeri, M., Deppierraz, G., Bruinink, A., Zinn, M. The agar diffusion scratch assay--A novel method to assess the bioactive and cytotoxic potential of new materials and compounds. Scientific Reports. 6, 20854 (2016).
- Spiller, K. L., et al. The role of macrophage phenotype in vascularization of tissue engineering scaffolds. Biomaterials. 35 (15), 4477-4488 (2014).
- Zhou, H., et al. In Vitro Cytotoxicity Evaluation of a Novel Root Repair Material. Journal of Endodontics. 39 (4), 478-483 (2013).
- Bordron, A., et al. The binding of some human antiendothelial cell antibodies induces endothelial cell apoptosis. Journal of Clinical Investigation. 101 (10), 2029-2035 (1998).
- Palmini, G., et al. Establishment of Cancer Stem Cell Cultures from Human Conventional Osteosarcoma. Journal of Visualized Experiments. (116), e53884 (2016).
- Gregory, C. A., Grady Gunn, W., Peister, A., Prockop, D. J. An Alizarin red-based assay of mineralization by adherent cells in culture: comparison with cetylpyridinium chloride extraction. Analytical Biochemistry. 329 (1), 77-84 (2004).
- Cai, S., Zhang, W., Chen, W. PDGFRβ+/c-kit+ pulp cells are odontoblastic progenitors capable of producing dentin-like structure in vitro and in vivo. BMC Oral Health. 16 (1), 113 (2016).
- Paula, A., et al. Biodentine Boosts, WhiteProRoot MTA Increases and Life Suppresses Odontoblast Activity. Materials. 12 (7), 1184 (2019).
- Chander, N. G. Standardization of in vitro studies. Journal of Indian Prosthodontic Society. 16 (3), 227-228 (2016).
- Cavalcanti, B. N., Rode de M, S., França, C. M., Marques, M. M. Pulp capping materials exert an effect on the secretion of IL-1β and IL-8 by migrating human neutrophils. Brazilian Oral Research. 25 (1), 13-18 (2011).
- Chang, S., Lee, S. Y., Ann, H. J., Kum, K. Y., Kim, E. C. Effects of calcium silicate endodontic cements on biocompatibility and mineralization-inducing potentials in human dental pulp cells. Journal of Endodontics. 40 (8), 1194-1200 (2014).
- Daltoé, M. O., Paula-Silva, F. W. G., Faccioli, L. H., Gatón-Hernández, P. M., De Rossi, A., Bezerra Silva, L. A. Expression of Mineralization Markers during Pulp Response to Biodentine and Mineral Trioxide Aggregate. Journal of Endodontics. 42 (4), 596-603 (2016).
- Elias, R. V., Demarco, F. F., Tarquinio, S. B. C., Piva, E. Pulp responses to the application of a self-etching adhesive in human pulps after controlling bleeding with sodium hypochlorite. Quintessence International. 38 (2), 67-77 (2007).
- Huang, G. T. J., Shagramanova, K., Chan, S. W. Formation of odontoblast-like cells from cultured human dental pulp cells on dentin in vitro. Journal of endodontics. 32 (11), 1066-1073 (2006).
- Jafarnia, B., et al. Evaluation of cytotoxicity of MTA employing various additives. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology. 107 (5), 739-744 (2009).
- Paranjpe, A., Smoot, T., Zhang, H., Johnson, J. D. Direct contact with mineral trioxide aggregate activates and differentiates human dental pulp cells. Journal of Endodontics. 37 (12), 1691-1695 (2011).
- Spagnuolo, G., et al. In vitro cellular detoxification of triethylene glycol dimethacrylate by adduct formation with N-acetylcysteine. Dental Materials. 29 (8), 153-160 (2013).
- Murray, P. E., García Godoy, C., García Godoy C, F. How is the biocompatibilty of dental biomaterials evaluated. Medicina Oral, Patologia Oral y Cirugia Bucal. 12 (3), 258-266 (2007).
- Hanks, C. T., Wataha, J. C., Sun, Z. In vitro models of biocompatibility: a review. Dental Materials. 12 (3), 186-193 (1996).
- Eid, A. A., et al. In Vitro Biocompatibility and Oxidative Stress Profiles of Different Hydraulic Calcium Silicate Cements. Journal of Endodontics. 40 (2), 255-260 (2014).
- Nocca, G., et al. Effects of ethanol and dimethyl sulfoxide on solubility and cytotoxicity of the resin monomer triethylene glycol dimethacrylate. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 100 (6), 1500-1506 (2012).
- Abuarqoub, D., Aslam, N., Jafar, H., Abu Harfil, Z., Awidi, A. Biocompatibility of Biodentine with Periodontal Ligament Stem Cells: In Vitro Study. Dentistry Journal. 8 (1), 17 (2020).
- Coelho, A. S., et al. Cytotoxic effects of a chlorhexidine mouthwash and of an enzymatic mouthwash on human gingival fibroblasts. Odontology. 108 (2), 260-270 (2020).
- Wang, M. O., et al. Evaluation of the In Vitro Cytotoxicity of Cross-Linked Biomaterials. Biomacromolecules. 14 (5), 1321-1329 (2013).
- Tyliszczak, B., Drabczyk, A., Kudłacik-Kramarczyk, S., Bialik-Wąs, K., Sobczak-Kupiec, A. In vitro cytotoxicity of hydrogels based on chitosan and modified with gold nanoparticles. Journal of Polymer Research. 24 (10), 153 (2017).
- Widbiller, M., et al. Three-dimensional culture of dental pulp stem cells in direct contact to tricalcium silicate cements. Clinical Oral Investigations. 20 (2), 237-246 (2016).
- Pintor, A. V. B., et al. In Vitro and In Vivo Biocompatibility of ReOss in Powder and Putty Configurations. Brazilian Dental Journal. 29 (2), 117-127 (2018).
- Pellissari, C. V. G., et al. In Vitro Toxic Effect of Biomaterials Coated with Silver Tungstate or Silver Molybdate Microcrystals. Journal of Nanomaterials. 2020, 1-9 (2020).
- Collado-González, M., et al. Cytotoxicity and bioactivity of various pulpotomy materials on stem cells from human exfoliated primary teeth. International Endodontic Journal. 50, 19-30 (2017).
- Paula, A., et al. Direct Pulp Capping: Which is the Most Effective Biomaterial? A Retrospective Clinical Study. Materials. 12 (20), 3382 (2019).
- Williams, D. F. There is no such thing as a biocompatible material. Biomaterials. 35 (38), 10009-10014 (2014).
- Schuh, J. C. L. Medical device regulations and testing for toxicologic pathologists. Toxicologic Pathology. 36 (1), 63-69 (2008).
- Pizzoferrato, A., et al. Cell culture methods for testing Biocompatibility. Clinical Materials. 15 (3), (1994).
- Pereira Paula, A. B., et al. Direct pulp capping: what is the most effective therapy? - review and meta-analysis. Journal of Evidence Based Dental Practice. , (2018).
- Caiaffa, K. S., et al. Effect of analogues of cationic peptides on dentin mineralization markers in odontoblast-like cells. Archives of Oral Biology. 103, 19-25 (2019).
- Fujiwara, S., Kumabe, S., Iwai, Y. Isolated rat dental pulp cell culture and transplantation with an alginate scaffold. Okajimas Folia Anatomica Japonica. 83 (1), 15-24 (2006).
- Nakashima, M., et al. Stimulation of Reparative Dentin Formation by Ex Vivo Gene Therapy Using Dental Pulp Stem Cells Electrotransfected with Growth/differentiation factor 11 (Gdf11). Human Gene Therapy. 15 (11), 1045-1053 (2004).
- Narayanan, K., et al. Differentiation of embryonic mesenchymal cells to odontoblast-like cells by overexpression of dentin matrix protein 1. Proceedings of the National Academy of Sciences of the United States of America. 98 (8), 4516-4521 (2001).
- Kim, H. J., Yoo, J. H., Choi, Y., Joo, J. Y., Lee, J. Y., Kim, H. J. Assessing the effects of cyclosporine A on the osteoblastogenesis, osteoclastogenesis, and angiogenesis mediated by the human periodontal ligament stem cells. Journal of Periodontology. , (2019).
- Bou Assaf, R., et al. Healing of Bone Defects in Pig's Femur Using Mesenchymal Cells Originated from the Sinus Membrane with Different Scaffolds. Stem Cells International. , (2019).
- He, W., et al. Lipopolysaccharide enhances decorin expression through the toll-like receptor 4, myeloid differentiating factor 88, nuclear factor-kappa B, and mitogen-activated protein kinase pathways in odontoblast cells. Journal of Endodontics. 38 (4), 464-469 (2012).
- Xiong, Y., et al. Wnt Production in Dental Epithelium Is Crucial for Tooth Differentiation. Journal of Dental Research. 98 (5), 580-588 (2019).
- Haruyama, N., et al. Genetic evidence for key roles of decorin and biglycan in dentin mineralization. Matrix Biology. 28 (3), 129-136 (2009).
- Sreenath, T., et al. Dentin Sialophosphoprotein Knockout Mouse Teeth Display Widened Predentin Zone and Develop Defective Dentin Mineralization Similar to Human Dentinogenesis Imperfecta Type III. Journal of Biological Chemistry. 278 (27), 24874-24880 (2003).
- Yang, Y., Zhao, Y., Liu, X., Chen, Y., Liu, P., Zhao, L. Effect of SOX2 on odontoblast differentiation of dental pulp stem cells. Molecular Medicine Reports. 16 (6), 9659-9663 (2017).
- Tao, H., et al. Klf4 Promotes Dentinogenesis and Odontoblastic Differentiation via Modulation of TGF-β Signaling Pathway and Interaction With Histone Acetylation. Journal of Bone and Mineral Research. 34 (8), 1502-1516 (2019).
- Massa, L. F., Ramachandran, A., George, A., Arana-Chavez, V. E. Developmental appearance of dentin matrix protein 1 during the early dentinogenesis in rat molars as identified by high-resolution immunocytochemistry. Histochemistry and Cell Biology. 124 (3-4), 197-205 (2005).
- Hao, J., Zou, B., Narayanan, K., George, A. Differential expression patterns of the dentin matrix proteins during mineralized tissue formation. Bone. 34 (6), 921-932 (2004).
- Tompkins, K., Alvares, K., George, A., Veis, A. Two related low molecular mass polypeptide isoforms of amelogenin have distinct activities in mouse tooth germ differentiation in vitro. Journal of Bone and Mineral Research. 20 (2), 341-349 (2005).
- Zhai, Y., et al. Activation and Biological Properties of Human β Defensin 4 in Stem Cells Derived From Human Exfoliated Deciduous Teeth. Frontiers in Physiology. 10, (2019).
- Bègue-Kirn, C., Ruch, J. V., Ridall, A. L., Butler, W. T. Comparative analysis of mouse DSP and DPP expression in odontoblasts, preameloblasts, and experimentally induced odontoblast-like cells. European Journal of Oral Sciences. 106, 254-259 (1998).
- Kikuchi, H., Suzuki, K., Sakai, N., Yamada, S. Odontoblasts induced from mesenchymal cells of murine dental papillae in three-dimensional cell culture. Cell and Tissue Research. 317 (2), 173-185 (2004).
- Li, X., Yang, G., Fan, M. Effects of homeobox gene distal-less 3 on proliferation and odontoblastic differentiation of human dental pulp cells. Journal of Endodontics. 38 (11), 1504-1510 (2012).
- Chen, S., et al. Differential regulation of dentin sialophosphoprotein expression by Runx2 during odontoblast cytodifferentiation. Journal of Biological Chemistry. 280 (33), 29717-29727 (2005).
- Narayanan, K., Gajjeraman, S., Ramachandran, A., Hao, J., George, A. Dentin matrix protein 1 regulates dentin sialophosphoprotein gene transcription during early odontoblast differentiation. Journal of Biological Chemistry. 281 (28), 19064-19071 (2006).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. A substractive PCR-based cDNA library from human odontoblast cells: identification of novel genes expressed in tooth forming cells. Matrix Biology. 19 (5), 421-430 (2000).
- Miyazaki, T., Baba, T., Mori, T., Komori, T. Collapsin Response Mediator Protein 1, a Novel Marker Protein for Differentiated Odontoblasts. Acta Histochemica et Cytochemica. 51 (6), 185-190 (2018).
- Yokoi, M., Kuremoto, K., Okada, S., Sasaki, M., Tsuga, K. Effect of attenuation of fibroblast growth factor receptor 2b signaling on odontoblast differentiation and dentin formation. In Vitro Cellular and Developmental Biology - Animal. 55 (3), 211-219 (2019).
- Tohma, A., et al. Glucose Transporter 2 and 4 Are Involved in Glucose Supply during Pulpal Wound Healing after Pulpotomy with Mineral Trioxide Aggregate in Rat Molars. Journal of Endodontics. , (2019).
- Sueyama, Y., Kaneko, T., Ito, T., Kaneko, R., Okiji, T. Implantation of Endothelial Cells with Mesenchymal Stem Cells Accelerates Dental Pulp Tissue Regeneration/Healing in Pulpotomized Rat Molars. Journal of Endodontics. 43 (6), 943-948 (2017).
- Petersson, U., Hultenby, K., Wendel, M. Identification, distribution and expression of osteoadherin during tooth formation. European Journal of Oral Sciences. 111 (2), 128-136 (2003).
- Couble, M. L., et al. Immunodetection of osteoadherin in murine tooth extracellular matrices. Histochemistry and Cell Biology. 121 (1), 47-53 (2004).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. Expression of the small leucine-rich proteoglycan osteoadherin/osteomodulin in human dental pulp and developing rat teeth. Bone. 27 (2), 265-270 (2000).
- Salmon, B., et al. Abnormal osteopontin and matrix extracellular phosphoglycoprotein localization, and odontoblast differentiation, in X-linked hypophosphatemic teeth. Connective Tissue Research. 55, 79-82 (2014).
- Liao, C., Ou, Y., Wu, Y., Zhou, Y., Liang, S., Wang, Y. Sclerostin inhibits odontogenic differentiation of human pulp-derived odontoblast-like cells under mechanical stress. Journal of Cellular Physiology. 234 (11), 20779-20789 (2019).
- Deng, X., et al. The combined effect of oleonuezhenide and wedelolactone on proliferation and osteoblastogenesis of bone marrow mesenchymal stem cells. Phytomedicine. 153103, (2019).
- Choi, H., Kim, T. H., Yun, C. Y., Kim, J. W., Cho, E. S. Testicular acid phosphatase induces odontoblast differentiation and mineralization. Cell and Tissue Research. 364 (1), 95-103 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved