Method Article
Accès à la cytotoxicité et à la réponse cellulaire aux biomatériaux
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cette méthodologie vise à évaluer la cytotoxicité des biomatériaux par la préparation d’extraits solubles, en utilisant des essais de viabilité et des analyses phénotypiques, y compris la cytométrie en flux, la RT-PCR, l’immunocytochimie et d’autres techniques de biologie cellulaire et moléculaire.
Résumé
Les biomatériaux entrent en contact direct ou indirect avec les tissus humains, d’où l’importance d’évaluer leur cytotoxicité. Cette évaluation peut être réalisée par plusieurs méthodes, mais il existe un écart important entre les approches utilisées, ce qui compromet la reproductibilité et la comparaison entre les résultats obtenus. Dans cet article, nous proposons un protocole pour évaluer la cytotoxicité des biomatériaux à l’aide d’extraits solubles, que nous utilisons pour les biomatériaux dentaires. La préparation des extraits est détaillée, de la production des granulés à leur extraction dans un milieu de culture. L’évaluation de la cytotoxicité des biomatériaux est basée sur l’activité métabolique à l’aide du test MTT, la viabilité cellulaire à l’aide du test de sulforhodamine B (SBR), le profil de mort cellulaire par cytométrie en flux et la morphologie cellulaire à l’aide de May-Grünwald Giemsa. En plus de l’évaluation de la cytotoxicité, un protocole d’évaluation de la fonction cellulaire est décrit en fonction de l’expression de marqueurs spécifiques évalués par immunocytochimie et PCR. Ce protocole fournit un guide complet pour l’évaluation de la cytotoxicité des biomatériaux et des effets cellulaires, en utilisant la méthodologie des extraits, de manière reproductible et robuste.
Introduction
La biocompatibilité peut être définie comme la capacité d’un matériau à intégrer les tissus et à induire une réponse thérapeutique favorable, exempte de dommages locaux et systémiques 1,2,3. L’évaluation de la biocompatibilité est cruciale pour le développement de tout matériau destiné à un usage médical. Par conséquent, ce protocole fournit une approche systématique et complète pour chaque chercheur visant à développer de nouveaux biomatériaux ou à étudier de nouvelles applications pour les biomatériaux existants.
Les tests de cytotoxicité in vitro sont largement utilisés comme première phase pour l’évaluation de la biocompatibilité, en utilisant des cultures cellulaires primaires ou des lignées cellulaires. Les résultats constituent un premier indicateur d’application clinique potentielle. En plus d’être essentiels pour le développement de biomatériaux, ces tests sont obligatoires pour se conformer aux réglementations en vigueur pour l’introduction sur le marché, des régulateurs de l’UE et de l’UE (certification FDA et CE)4,5,6,7,8. En outre, les tests standardisés dans la recherche biomédicale offrent un avantage significatif en termes de reproductibilité et de comparaison des résultats de différentes études sur des biomatériaux ou des dispositifs similaires9.
Les lignes directrices de l’Organisation internationale de normalisation (ISO) sont largement utilisées par de nombreux laboratoires commerciaux, réglementaires et universitaires indépendants pour tester les matériaux de manière précise et reproductible. L’ISO 10993-5 fait référence à l’évaluation de la cytotoxicité in vitro et l’ISO 10993-12 rend compte de la préparation de l’échantillonnage10,11. Pour les essais de biomatériaux, trois catégories sont fournies, à sélectionner en fonction du type de matériau, des tissus en contact et de l’objectif du traitement : extraits, contact direct et contact indirect 8,11,12,13. Les extraits sont obtenus en enrichissant un milieu de culture cellulaire avec le biomatériau. Pour les tests par contact direct, le biomatériau est placé directement sur les cultures cellulaires et, en contact indirect, l’incubation avec les cellules est réalisée séparées par une barrière, telle qu’un gel d’agarose11. Des contrôles appropriés sont obligatoires et au moins trois expériences indépendantes doivent être effectuées 5,8,10,11,14.
Il est essentiel de simuler ou d’exagérer les conditions cliniques pour déterminer le potentiel cytotoxique. Dans le cas de l’essai d’extraits, la surface du matériau; le volume moyen; le milieu et le pH du matériau; la solubilité, l’osmolarité et le rapport de diffusion des matériaux; et les conditions d’extraction telles que l’agitation, la température et le temps influencent les milieuxenrichisseurs 5.
La méthodologie permet l’évaluation quantitative et qualitative de la cytotoxicité de plusieurs formulations pharmaceutiques, solides et liquides. Plusieurs tests peuvent être effectués, tels que le test d’absorption du rouge neutre, le test de formation de colonies, le test MTT et le test XTT 5,10,14.
La plupart des études d’évaluation de la cytotoxicité publiées utilisent des tests plus simples, à savoir MTT et XTT, qui fournissent des informations limitées. L’évaluation de la biocompatibilité ne devrait pas seulement impliquer l’évaluation de la cytotoxicité, mais aussi la bioactivité d’une substance d’essai donnée2, comme le confirme ce protocole. Des critères d’évaluation supplémentaires devraient être utilisés lorsque cela est justifié et documenté. Ainsi, ce protocole vise à fournir un guide complet, détaillant un ensemble de méthodes pour l’évaluation de la cytotoxicité des biomatériaux. En outre, l’évaluation de différents processus cellulaires, à savoir le type de mort cellulaire, la morphologie cellulaire, la fonction cellulaire dans la synthèse de protéines spécifiques et la production tissulaire spécifique, sont décrites.
Protocole
1. Préparation des granulés
- Préparer les moules en polychlorure de vinyle (PVC) en effectuant des trous de forme circulaire de dimensions connues dans des plaques de PVC.
REMARQUE: Les moulures en PVC peuvent être faites de différentes tailles. Calculez la surface de contact des moules en PVC, en utilisant la formule A = h(2πr) + 2πr2 (r: rayon du cylindre; h: hauteur du cylindre). - Préparer le biomatériau à tester selon les instructions du fabricant et le plus près possible du début de l’expérience.
NOTE: Pour la préparation de biomatériaux de formulation pâte/pâte, une quantité adéquate de pâte de base et de catalyseur est mélangée manuellement avec une spatule de mélange. Pour les autres matériaux à base de formulations liquides et en poudre, une spatulation manuelle ou un mélange mécanique avec vibration doit être effectué, en suivant les instructions du fabricant ou le nécessaire pour les nouveaux matériaux. Pour les matériaux liquides, cette étape n’est pas nécessaire. Démarrez le protocole à l’étape 2. - Placez le biomatériau sur les moules avec une spatule et laissez-les prendre pendant le moment approprié.
NOTA : Le temps de prise et les conditions de prise des biomatériaux doivent suivre les instructions du fabricant ou les instructions adéquates pour les nouveaux matériaux. - Après le prise, retirez les granulés du biomatériau des moules en PVC et placez-les dans un récipient (une plaque à 6 puits ou une boîte de Petri peut être utilisée).
- Stérilisez les granulés en les plaçant sous une lampe à lumière ultraviolette (UV) pendant 20 minutes de chaque côté.
2. Obtention des extraits des biomatériaux
REMARQUE: Toutes les procédures doivent être effectuées dans des conditions stériles strictes.
- Déterminer le nombre nécessaire de granulés en calculant la surface des granulés selon la formule décrite au point 1.1.
NOTE: Comme valeur de référence, la surface de contact de 250 mm2/mL11,15 est obtenue en ajoutant 9 pastilles (r 3 mm x h 1,5 mm) par mL du milieu. - Préparer les extraits solubles (extrait enrichi en biomatériau).
- Placer les pastilles dans un tube de 50 mL et ajouter le correspondant du milieu de culture cellulaire. Placez les tubes pendant 24 heures dans l’incubateur à 37°, en rotation constante.
REMARQUE: Utilisez le milieu de culture cellulaire approprié pour les cultures cellulaires. - Après 24 heures, retirez les tubes de l’incubateur. A ce stade, les extraits correspondent à une concentration de 1/1 ou 100%.
- Procéder à des dilutions de l’extrait par addition séquentielle de volumes égaux de milieu conditionné à milieu de culture cellulaire.
REMARQUE: Aucun ajustement du pH ne doit être effectué sur le milieu.- Ajouter 1 mL de milieu de culture à 1 mL d’extrait à 100% pour obtenir un extrait à 50%. Ajouter 1 mL de milieu de culture à 1 mL d’extrait à 50 % pour obtenir un extrait à 25 %, et ainsi de suite (Figure 1).
NOTE: Utilisez les concentrations jugées pertinentes pour chaque composé.
- Ajouter 1 mL de milieu de culture à 1 mL d’extrait à 100% pour obtenir un extrait à 50%. Ajouter 1 mL de milieu de culture à 1 mL d’extrait à 50 % pour obtenir un extrait à 25 %, et ainsi de suite (Figure 1).
- Placer les pastilles dans un tube de 50 mL et ajouter le correspondant du milieu de culture cellulaire. Placez les tubes pendant 24 heures dans l’incubateur à 37°, en rotation constante.

Figure 1 : Schéma de préparation et de dilution des extraits solubles. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Incubation cellulaire avec les extraits des biomatériaux
- Préparez une suspension cellulaire et placez-la dans un récipient cellulaire adéquat, tel qu’une plaque multipuits, en fonction du nombre de cellules nécessaires aux expériences.
- Commencez par une fiole des cellules désirées avec 80% à 90% de confluence.
- Jeter les milieux de culture cellulaire, laver avec une solution saline tamponnée au phosphate (PBS) et détacher les cellules avec de la trypsine-EDTA (1 à 2 mL pour un ballon de culture cellulaire de 75 cm2 ).
- Ajouter le milieu de culture cellulaire (2 à 4 mL pour un ballon de culture cellulaire de 75 cm2 ), transférer la suspension cellulaire dans un tube et centrifuger à 200 x g pendant 5 min.
- Suspendre la pastille dans un volume connu de milieu de culture cellulaire.
NOTE: Ce protocole est conçu pour l’utilisation de cultures cellulaires adhérentes; Cependant, des adaptations simples peuvent être faites pour travailler avec des cultures de cellules en suspension. - Comptez les cellules dans l’hémocytomètre et calculez la concentration cellulaire de la suspension cellulaire.
- Suspendre la quantité déterminée de suspension cellulaire dans le milieu de culture et transférer dans des boîtes multipuits. Comme valeur de référence pour la densité de semis, considérons 5 – 20 x 105 cellules/cm2.
NOTE: Le nombre approprié de cellules doit être calculé en fonction du type de cellule et de ses caractéristiques, à savoir le temps de doublement de la cellule.
- Incuber les cellules pendant 24 heures pour permettre l’adhésion cellulaire.
- Après cette période, administrer les extraits solubles dans les plaques de culture.
- Aspirer le milieu de culture cellulaire.
- Ajouter les extraits de biomatériaux à chaque puits, selon la séquence des concentrations, comme décrit précédemment. Ajouter le milieu de culture de cellules fraîches aux puits témoins.
- Incuber les plaques pendant 24 h ou plus.
NOTE: Des contrôles négatifs doivent être effectués dans chaque essai, correspondant à des cellules non traitées, maintenues dans le milieu de culture. Les temps d’incubation peuvent être sélectionnés en fonction des objectifs de l’étude.
4. Évaluation de l’activité métabolique
- Après l’incubation cellulaire avec les extraits des biomatériaux, aspirer le milieu des plaques et laver chaque puits PBS.
- Placer dans chaque puits le volume adéquat de bromure de 3-(4,5-diméthylthiazol-2-yl)-2,5-diphényltétrazole (MTT) de 0,5 mg/mL préparé dans du PBS, pH 7,4.
- Incuber les plaques pendant 4 h ou toute la nuit dans l’obscurité à 37°C.
- Pour solubiliser les cristaux de formazan obtenus, ajouter le volume adéquat de solution 0,04 M d’acide chlorhydrique dans de l’isopropanol à chaque puits et agiter les plaques pendant 30 minutes.
REMARQUE: Ajustez la quantité de MTT et d’isopropanol en fonction de la taille des puits. - Remuer et homogénéiser le contenu de chaque puits, si nécessaire, en pipetant de haut en bas jusqu’à ce qu’aucun cristal ne soit vu.
- Quantifier l’absorbance à une longueur d’onde de 570 nm avec un filtre de référence de 620 nm, dans le spectrophotomètre.
- Pour calculer l’activité métabolique, divisez l’absorbance des cellules traitées par l’absorbance des cultures témoins. Pour obtenir des valeurs en pourcentage, multipliez par 100.
5. Évaluation de la mort cellulaire
REMARQUE: Pour effectuer cette évaluation, un minimum de 106 cellules par condition doit être utilisé.
- Utiliser des tubes à centrifuger correctement identifiés, en fonction des conditions évaluées.
- Après l’incubation cellulaire avec les extraits des biomatériaux, recueillir les milieux de culture dans le tube respectif.
- Détachez les cellules et ajoutez la suspension cellulaire aux tubes respectifs.
- Concentrer les suspensions cellulaires par centrifugation à 120 x g pendant 5 minutes.
- Lavez les granulés avec du PBS. Retirer le PBS par centrifugation à 1 000 x g pendant 5 minutes.
- Ajouter 1 mL de PBS et transférer les pastilles cellulaires dans des tubes de cytométrie identifiés.
- Retirer le PBS par centrifugation à 1 000 x g pendant 5 minutes.
- Incuber avec 100 μL de tampon de liaison (0,01 M HEPES, 0,14 mM NaCl et 0,25 mM CaCl2)16, et laisser les cellules reposer pendant environ 15 minutes pour la récupération de la membrane cellulaire.
- Ajouter 2,5 μL d’annexine-V marquée par fluorescence et 1 μL d’iodure de propidium pendant 15 minutes à température ambiante dans l’obscurité.
- Après l’incubation, ajouter 400 μL de PBS et analyser sur le cytomètre. Pour l’analyse et la quantification de l’information, utilisez un logiciel approprié.
- Présenter les résultats en pourcentage de cellules vivantes, d’apoptose, d’apoptose tardive/nécrose et de nécrose.
6. Évaluation morphologique
- Sélectionnez la taille appropriée des lamelles de couvercle en verre stérilisé qui s’insèrent à l’intérieur de la plaque multipuits.
- Placez chaque lame dans un puits à l’aide d’une pince à épiler stérile.
- Distribuer une suspension cellulaire à une concentration adéquate dans les puits et laisser reposer toute la nuit dans un incubateur à 37 °C dans une atmosphère humidifiée avec 95% d’air et 5% de CO2.
- Exposer les cultures cellulaires aux extraits, comme décrit précédemment.
- Aspirez les médias et lavez-les avec PBS.
- Laisser sécher les lamelles de couverture à température ambiante, puis ajouter un volume suffisant de solution May-Grünwald pour couvrir les lamelles de couverture; Incuber pendant 3 minutes.
- Retirer le colorant et laver à l’eau distillée pendant 1 minute.
- Retirer l’eau et ajouter un volume suffisant de solution Giemsa pour couvrir les lamelles de couverture; Incuber pendant 15 minutes.
- Lavez les lamelles à l’eau courante.
- Transférer les bordereaux de couverture sur une glissière.
- Regardez sous un microscope. Prenez les photos avec le grossissement choisi.
7. Évaluation de la fonction cellulaire par amplification en chaîne de la polymérase à transcription inverse (RT-PCR)
REMARQUE: Pour effectuer cette évaluation, un minimum de 2x106 cellules par condition doit être utilisé. À titre d’exemple, la phosphatase alcaline est présentée comme un gène d’intérêt pour l’évaluation de l’activité des odontoblastes. D’autres gènes d’intérêt peuvent être vus dans le tableau 1.
- Plaquez les cellules comme décrit ci-dessus.
NOTE: La concentration des cellules plaquées peut devoir être ajustée en fonction du type de cellule et de la cytotoxicité des biomatériaux étudiés. - Incuber avec des extraits solubles, comme décrit ci-dessus.
- Détacher les cellules pour obtenir une suspension comme décrit précédemment.
- Lavez les cellules deux fois avec du PBS; pour cette centrifugeuse à 200 x g pendant 5 minutes à température ambiante.
- Lyser les cellules en suspendant la pastille dans 1 mL de solution de purification de l’ARN (p. ex. NZYol), en agitant intensément et en pipetage successif.
- Incuber les échantillons pendant 5 minutes à température ambiante.
- Ajouter 200 μL de chloroforme et agiter les tubes à la main pendant 15 secondes.
- Incuber pendant 3 minutes à température ambiante.
- Lysats centrifugés à 4°C pendant 15 min à 12 000 x g. Au cours de cette centrifugation, deux phases proviennent de l’échantillon, laissant l’ARN dans la phase aqueuse (supérieure).
- Retirer la phase aqueuse dans un nouveau tube et ajouter 500 μL d’isopropanol froid pour précipiter l’ARN.
- Incuber les échantillons à température ambiante pendant 10 minutes et centrifuger à 12 000 x g pendant 10 minutes à 4°C.
- Retirer le surnageant et laver la pastille avec 1 mL d’éthanol à 75% par centrifugation à 7 500 x g pendant 5 minutes à 4°C.
- Sécher la pastille à température ambiante jusqu’à évaporation de l’éthanol.
- Suspendre dans de l’eau sans RNase.
- Quantifier et déterminer le degré de pureté des échantillons par spectrophotométrie d’absorption, aux longueurs d’onde 260 nm et 280 nm. Déterminer la pureté de l’ARN et utiliser des échantillons avec un rapport de pureté (A260/280) autour de 2,0.
- Conserver les échantillons à -80°C.
- Procédez à l’exécution de la RT-PCR en suivant le protocoledu fabricant 17.
REMARQUE : En fonction de l’objectif de l’étude, sélectionnez les marqueurs spécifiques à évaluer.
8. Évaluation de la fonction cellulaire par identification des protéines
NOTE: Selon l’objectif de l’étude, sélectionnez les protéines spécifiques à évaluer. À titre d’exemple, la dentine sialoprotéine (DSP) est présentée comme une protéine d’intérêt pour l’évaluation de l’activité des odontoblastes. D’autres protéines d’intérêt peuvent être vues dans le tableau 1.
- Cultivez les cellules dans des lamelles de couverture et exposez-les aux extraits, comme décrit précédemment.
- Lavez les cultures cellulaires avec du PBS.
- Fixer avec 3,7% de paraformaldéhyde pendant 30 minutes à température ambiante.
- Lavez deux fois avec du PBS.
- Perméabiliser avec 0,5% de Triton dans PBS pendant 15 minutes.
- Bloquer la peroxydase avec 0,3% de peroxyde d’hydrogène dans du PBS pendant 5 minutes.
- Lavez deux fois avec du PBS.
- Laver deux fois avec de l’albumine sérique bovine (BSA) à 0,5 %.
- Bloquer les cultures cellulaires avec 2% de BSA pendant 45 minutes.
- Laver avec 0,5% de BSA dans du PBS.
- Incuber les cultures avec l’anticorps primaire selon la protéine sélectionnée pendant 60 minutes à température ambiante.
REMARQUE: Ce protocole utilise l’anticorps primaire DSP(M20) Antibody (1:100) et l’anticorps secondaire Polyclonal Rabbit Anti-chèvre immunoglobulines / HRP (1:100). - Laver cinq fois avec 0,5% de BSA dans PBS.
- Incuber avec un anticorps secondaire pendant 90 minutes à température ambiante.
REMARQUE: Faire les dilutions d’anticorps en utilisant 0,5% BSA dans PBS. - Laver cinq fois avec 0,5% de BSA dans du PBS pendant 1 minute à chaque lavage.
- Incuber des cultures avec un mélange de substrat et de chromogènes à une concentration de 20 μL de substrat chromogène / mL pendant 25 minutes.
- Laver deux fois avec 0,5% de BSA dans du PBS.
- Contre-colorer avec de l’hématoxyline pendant 15 minutes.
- Laver avec une séquence de 0,037 mol/L d’ammoniac et de l’eau distillée pendant 5 minutes pour éliminer l’excès de colorant.
- Montez les lamelles de couverture sur les glissières. Utilisez du glycérol comme support de montage.
- Laisser sécher pendant la nuit.
- Regardez sous un microscope. Prenez les photos avec le grossissement choisi.
9. Évaluation de la minéralisation par le dosage Alizarin Red S
- Préparer une solution de rouge d’alizarine S à une concentration de 40 mM18. Remuer la solution pour l’homogénéisation pendant 12 heures dans l’obscurité.
NOTE: Pour préparer 100 mL de solution d’Alizarin Red S, solubiliser 1,44 g de poudre d’alizarine (poids moléculaire: 360 g / mol) dans de l’eau ultrapure, à l’abri de la lumière. Pour cette solution, la valeur du pH est critique et doit être comprise entre 4,1 et 4,3. - Incuber la culture cellulaire avec des extraits solubles, comme décrit ci-dessus.
- Lavez les cultures cellulaires trois fois avec du PBS.
- Fixer avec 4% de paraformaldéhyde pendant 15 minutes à température ambiante.
- Lavez trois fois avec du PBS.
- Colorer avec la solution de coloration rouge Alizarin pendant 20 minutes à 37 °C dans l’obscurité.
- Après la coloration, lavez les plaques avec du PBS pour enlever l’excès de colorant.
- Regardez sous un microscope. Prenez les photos avec le grossissement choisi.
- Ajouter une solution d’extraction, composée de 10 % (p/v) d’acide acétique et de 20 % (p/v) de méthanol, à chaque puits, et laisser agiter pendant 40 minutes à température ambiante.
- Mesurer l’absorbance à une longueur d’onde de 490 nm sur un spectrophotomètre19.
Résultats
Les résultats représentatifs se réfèrent ici à l’étude des biomatériaux dentaires. La méthodologie de l’extrait permet d’obtenir un profil de cytotoxicité et de fonction cellulaire après exposition au matériel dentaire, en ce qui concerne les effets sur l’activité métabolique (Figure 2), la viabilité cellulaire, le profil de mort cellulaire et la morphologie cellulaire (Figure 3), et l’expression de protéines spécifiques (Figure 4).
Le test MTT est utilisé pour obtenir un aperçu rapide de la cytotoxicité des matériaux de manière simple. Une comparaison entre deux matériaux ou plus peut être faite (Figure 2); une réduction sévère de l’activité métabolique, même à des concentrations faibles (6,25%) et moyennes (50%), indique une toxicité plus élevée (Figure 2a). Dans le même temps, les matières moins cytotoxiques ne présentent qu’une réduction plus légère ou nulle (Figure 2b). Les comparaisons entre différents points temporels permettent de déterminer des effets cytotoxiques plus immédiats ou à des stades ultérieurs.
Les effets sur la viabilité cellulaire fournissent des informations importantes sur la réduction cellulaire viable, ce qui peut compromettre la capacité des tissus à récupérer après un effet néfaste. La détermination du pourcentage de cellules viables permet de comparer la cytotoxicité matérielle; plus de matières cytotoxiques induisent une mort cellulaire plus élevée pour la même concentration (Figure 3a et 3b). Des réductions supérieures à 30 % sont critiques et définissent les matériaux à risque de faible biocompatibilité (figure 3a). Cette information est complétée par le profil de mort cellulaire (Figure 3a et 3b). Dans les résultats représentatifs, plus de matériaux cytotoxiques sont caractérisés par une diminution accentuée de la viabilité cellulaire et pour un profil d’apoptose tardive et de mort cellulaire nécrose (Figure 3a), tandis que les matériaux moins cytotoxiques présentent moins de mort cellulaire et un profil plus apoptotique et apoptotique tardif (Figure 3b).
Les informations obtenues à partir de l’évaluation de la morphologie cellulaire (Figure 3c) complètent l’évaluation de la viabilité cellulaire. Les changements par rapport à la morphologie typique de la cellule peuvent indiquer un profil apoptotique ou nécrotique16. En outre, des informations supplémentaires peuvent être obtenues à partir de ce protocole, comme l’observation des particules matérielles (flèches rouges, Figure 3C).
Les marqueurs spécifiques, fondamentaux pour la fonction cellulaire, affectés par l’exposition à l’extrait peuvent être évalués par plusieurs techniques, comme l’immunohistochimie, la PCR, la cytométrie en flux, le buvard ou les tests colorimétriques (tableau 1). Des résultats représentatifs de l’expression DSP après exposition à des extraits sont présentés à la figure 4a, et on peut voir que certains matériaux (ciments de silicates tricalciques) stimulent les cellules pour augmenter l’expression des protéines. En revanche, d’autres (ciments d’hydroxyde de calcium) favorisent une diminution significative de l’expression des protéines, indépendamment de la perte de viabilité. Dans les deux cas, la concentration des extraits influence directement l’expression des protéines.
Dans la lignée cellulaire MDPC-23 du phénotype odontoblastique, la formation de dépôts de minéralisation est caractéristique. Le protocole d’identification et de quantification des gisements minéralisés permet d’évaluer la fonction spécifique de ce type de cellules spécialisées. Dans le cas présenté, il a été observé qu’en plus d’être moins cytotoxique, le ciment silicates tricalciques stimule la fonction cellulaire, une fois qu’une augmentation des dépôts minéralisés a été observée (Figure 4b). Au contraire, le ciment d’hydroxyde de calcium plus cytotoxique a entraîné une réduction des dépôts minéraux en raison de la déficience cellulaire et de la mort (Figure 4b). En plus d’une évaluation qualitative, une détermination quantitative peut être effectuée (figure 4c).
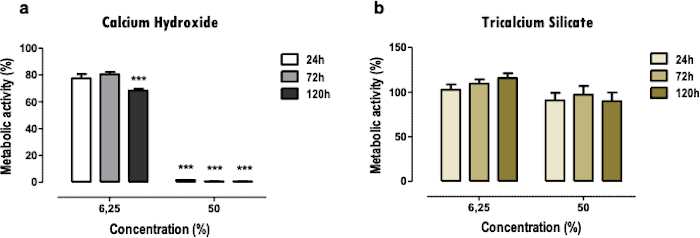
Figure 2 : Activité métabolique. Activité métabolique des cellules MDPC-23 traitées avec de l’hydroxyde de calcium-ciment [a)] et du silicate de ciment tricalcique [b)] extraits solubles pendant 24, 72 et 120 heures. Les résultats sont normalisés aux cultures cellulaires témoins, avec une valeur de 100%. Les différences significatives sont représentées par *, où * signifie p<0,05, ** signifie p<0,01 et *** signifie p<0,001. Une partie de cette figure a été modifiée à partir d’une publication précédente avec la permission de l’éditeur20. Veuillez cliquer ici pour voir une version agrandie de cette figure.
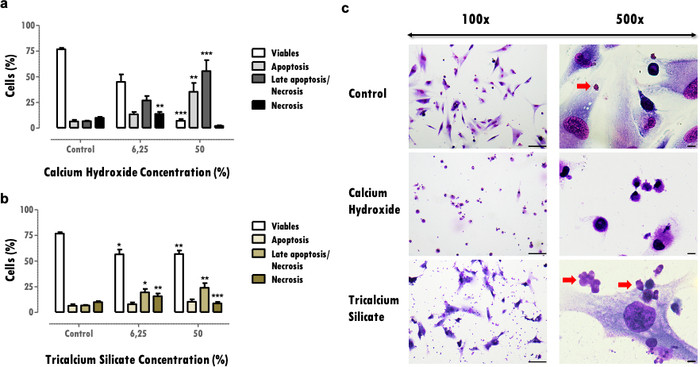
Figure 3 : Viabilité cellulaire, profil de mort et morphologie cellulaire. Viabilité cellulaire, profil de mort cellulaire et morphologie cellulaire dans les cellules MDPC-23 soumises à un traitement avec de l’hydroxyde de calcium et des biomatériaux de silicate tricalcique à des concentrations de 6,25 % et 50 %, après 120 heures d’exposition. a) et b) Les résultats sont représentés comme le pourcentage de cellules vivantes dans l’apoptose, l’apoptose tardive ou la nécrose et la nécrose. Les différences significatives par rapport au contrôle ou entre les conditions sont représentées par *, où * signifie p <0,05, ** signifie p <0,01 et *** signifie p <0,001. c) Cellules colorées avec May-Grünwald Giemsa après traitement avec une concentration de 50% d’extraits solubles de biomatériaux. Le groupe témoin représente les cellules en culture dans DMEM avec 10% FBS. Les images de la colonne de gauche ont été obtenues avec un grossissement de 100x, et les images de la colonne de droite ont été obtenues avec un grossissement de 500x. Les barres de figure représentent 100 μm. Une partie de cette figure a été modifiée à partir d’une publication précédente avec la permission de l’éditeur20. Veuillez cliquer ici pour voir une version agrandie de cette figure.
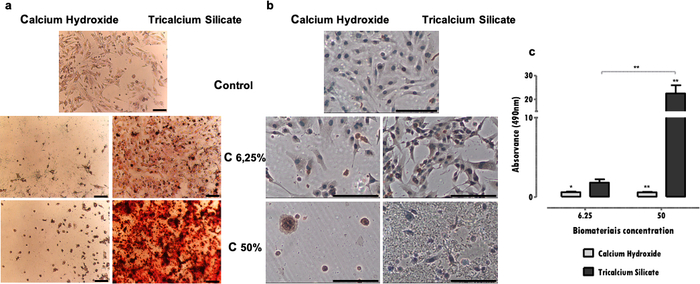
Figure 4 : Expression DSP et formation de nodules minéralisés. a) Cellules MDPC-23 marquées par immunocytochimie pour la détection de l’expression DSP lorsqu’elles sont soumises à un traitement à l’hydroxyde de calcium et au silicate tricalcique à des concentrations de 50% et 6,25% après 96 heures d’incubation. b) Images de cellules MDPC-23 en culture colorées avec de la coloration au rouge d’alizarine S lorsqu’elles sont traitées avec de l’hydroxyde de calcium et des biomatériaux de silicate tricalcique à des concentrations de 50% et 6,25% après 120 heures d’incubation. Toutes les photographies ont été obtenues avec un grossissement de 100x. Les deux barres de figure représentent 150 μm. c) Formation de dépôts de calcium à partir de cellules MDPC-23 traitées avec de l’hydroxyde de calcium et du silicate tricalcique après 120 heures d’exposition. Les résultats sont le rapport entre les absorbances des échantillons et du contrôle. Les différences significatives sont représentées par *, où * signifie p<0,05, ** signifie p<0,01 et *** signifie p<0,001. Une partie de cette figure a été modifiée à partir d’une publication précédente avec la permission de l’éditeur20. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Liste des marqueurs de différenciation/fonction odontoblastique47-79. Ce tableau fournit une liste de marqueurs odontoblastiques et de méthodes de détection; Certains de ces marqueurs sont également exprimés par d’autres tissus.
| Gène ou protéine | Méthode | Références |
| Phosphatase alcaline (PA) | Colorimétrique | 47 48 |
| Immunocytochimie | 20 49 | |
| Northern Blot | 50 | |
| RT-PCR | 51 52 | |
| Décorin (DCN) | ELISA colorimétrique | 53 |
| Immunocytochimie | 54 55 | |
| RT-PCR | 53 56 | |
| Protéine matricielle 1 de la dentine (DMP-1) | Cytométrie de flux | 57 |
| Immunocytochimie | 58 59 | |
| Northern Blot | 50 60 | |
| RT-PCR | 47 49 | |
| Western Blot | 50 60 | |
| Protéine matricielle 2 de la dentine (DMP-2) | Immunocytochimie | 60 61 |
| RT-PCR | 50 62 | |
| Northern Blot | 60 | |
| Western Blot | 62 | |
| Phosphoprotéine de dentine (DPP) | Immunocytochimie | 63 |
| Northern Blot | 63 | |
| Dentine Sialoprotéine (DSP)* | Immunocytochimie | 20 60 |
| Northern Blot | 60 63 | |
| RT-PCR | 50 | |
| Western Blot | 64 65 | |
| Dentine Sialophosphoprotéine (DSPP) | Cytométrie de flux | 57 |
| Immunocytochimie | 66 54 | |
| RT-PCR | 47 49 | |
| Northern Blot | 67 68 | |
| Western Blot | 64 62 | |
| Enamelysin/métalloprotéinase matricielle-20 (MMP-20) | Northern Blot | 68 |
| RT-PCR | 49 68 | |
| Nestin | Immunocytochimie | 54 69 |
| RT-PCR | 70 71 | |
| Western Blot | 72 | |
| Ostéoadhérine (OSAD) | Immunocytochimie | 73 74 |
| Northern Blot | 73 | |
| RT-PCR | 75 | |
| Western Blot | 73 74 | |
| Oséopontine (OPN) | Immunocytochimie | 76 |
| Northern Blot | 50 | |
| RT-PCR | 66 51 | |
| Western Blot | 77 | |
| Ostéocline (OCN) | Immunocytochimie | 52 |
| Northern Blot | 50 | |
| RT-PCR | 51 52 | |
| Western Blot | 77 78 | |
| Osterix (OSX)/ Facteur de transcription Sp7 (Sp7) | Immunocytochimie | 54 58 |
| RT-PCR | 78 | |
| Western Blot | 78 79 | |
| Gène régulateur du phosphate avec homologies avec les endopeptidases sur le chromosome X (Phex) | Northern Blot | 68 |
| RT-PCR | 49 68 | |
| Western Blot | 79 | |
| Facteur de transcription 2 lié à Runt (Runx2) | Immunocytochimie | 66 52 |
| RT-PCR | 66 70 | |
| Western Blot | 62 77 | |
| *DPP et DSP sont les produits de clivage de DSPP. | ||
Discussion
Ce protocole a été conçu en tenant compte de la norme ISO 10993-5, qui fait référence à l’évaluation de la cytotoxicité in vitro des biomatériaux en contact avec les tissus, afin d’évaluer la biocompatibilité et de contribuer aux études de reproductibilité21. C’est une préoccupation croissante en science, et de nombreux auteurs suivent déjà ces recommandations dans la conception expérimentale de leurs études in vitro 15,22,23,24,25,26,27,28.
La méthodologie proposée a été sélectionnée pour examiner les aspects les plus pertinents de la biologie cellulaire. Ainsi, ce protocole va au-delà des recommandations, dès lors qu’il fournit une approche complète pour évaluer la cytotoxicité à l’aide de tests communs et d’une évaluation complémentaire, incluant plusieurs paramètres cellulaires du phénotype à la fonction. Cette évaluation complémentaire est importante pour vraiment évaluer l’effet des biomatériaux, une fois que la viabilité peut ne pas traduire les altérations au niveau de l’expression des gènes et des protéines, du cycle cellulaire ou du sécrétome.
Les extraits sont avantageux, en particulier dans les lignées cellulaires adhérentes, car il n’y a pas d’interférence avec la fixation cellulaire au substrat et des conditions de culture optimales, contrairement à certaines approches par contact direct où les matériaux sont placés à la surface de la plaque de culture22,28.
De plus, les extraits permettent une exposition cellulaire à différentes concentrations29, imitant la diffusion de substances dans les tissus, ce qui simule la clairance qu’elles subissent in vivo, notamment lorsqu’elles sont appliquées au contact de tissus extrêmement irrigués. Les essais par contact direct peuvent ne pas évaluer avec précision les différentes concentrations, et les essais par contact indirect ont démontré des difficultés potentielles de non-diffusion, de diffusion incomplète à travers les membranes ou de réaction avec l’agar-agar.
Les tests fournissant une évaluation quantitative sont préférés, la réduction de la viabilité cellulaire de plus de 30% étant considérée comme cytotoxique11,30. Dans le développement de nouveaux biomatériaux, si une telle réduction se produit, elle détermine la nécessité d’une reformulation ou d’un abandon. Si des résultats encourageants sont obtenus, d’autres études devraient être réalisées en envisageant une évaluation in vivo29,31.
Les tests in vitro doivent simuler ou exagérer les conditions cliniques. Il est donc essentiel de déterminer les rapports de volume de surface appropriés pour la préparation des extraits. Des rapports surface/volume de 1,25 à 6 cm2/mL ont été suggérés. Dans le cas de matériaux présentant des irrégularités de surface comme les mousses de 0,1–0,2 g/mL ou 6 cm 2/mL sont un point de départ 15,20,2. Le rapport de 250mm2par mL de milieu a été utilisé dans les résultats représentatifs utilisés dans ce protocole et d’autres études15,20.
Même s’ils ne sont pas utilisés de cette manière dans les cliniques, les échantillons doivent être stérilisés par des méthodes qui n’altèrent pas leurs propriétés. L’irradiation UV est souvent un bon choix. Ceci est d’une importance capitale pour prévenir la contamination microbienne des cultures cellulaires 11,24,32.
Les milieux d’extraction comprennent le milieu de culture cellulaire avec ou sans sérum, la solution saline physiologique, le diméthylsulfoxyde ou l’eau purifiée, choisis selon les caractéristiques chimiques des biomatériaux11,33. Visant les études de culture cellulaire, l’utilisation du milieu de culture cellulaire est préférée car elle évite d’autres étapes de traitement. Les conditions d’extraction doivent être adaptées au modèle expérimental. Dans les résultats représentatifs présentés dans ce protocole, le milieu de culture DMEM complété par FBS a été utilisé pendant 24 ± 2 heures à 37 ± 1 °C.
Certains biomatériaux peuvent laisser des résidus dans le milieu d’extraction, ce qui peut affecter négativement les cultures cellulaires. Bien que la filtration et les centrifugations doivent être évitées, une possibilité est de laisser les particules sédimenter avant utilisation. Un autre problème est le pH qui peut subir une altération après l’extraction. Comme il n’est pas recommandé d’effectuer d’autres ajustements11, le pH des extraits doit être mesuré, enregistré et des contrôles supplémentaires pour isoler l’effet du pH doivent être inclus dans la conception expérimentale si nécessaire.
Bien que ce protocole ait été décrit pour les cultures cellulaires adhérentes, des modifications simples peuvent être effectuées pour utiliser des cultures en suspension. De même, outre l’utilisation de biomatériaux solides, il est possible d’adapter le procédé, essentiellement les étapes d’extraction, pour étudier les liquides, gels ou mousses34,35,36,37.
La préparation de cultures cellulaires avec une densité appropriée est essentielle, en particulier sur les cultures cellulaires avec un taux de duplication élevé31. Selon la plage de densité de semis recommandée des cellules utilisées, si des incubations de longue durée sont prévues, la réduction de la densité de semis initiale doit être effectuée pour éviter les problèmes liés à une confluence excessive. De plus, les matières hautement cytotoxiques peuvent nécessiter des densités initiales d’ensemencement plus élevées.
Outre les avantages de la méthodologie d’extraction, ce n’est pas le meilleur choix pour les matériaux où l’évaluation de l’adhérence cellulaire est pertinente. Dans ce cas, les études de contact direct doivent être réalisées 38,39,40,41. Bien qu’il s’agisse d’une approche globale, il est important de garder à l’esprit qu’il s’agit d’une évaluation in vitro, qui ne reflète pas totalement les conditions in vivo42.
Un biomatériau doit non seulement endommager les tissus, mais aussi stimuler certains des processus anti-inflammatoires et immunomodulateurs43,44,45,46. Ainsi, ce protocole va plus loin, avec l’évaluation des mécanismes cellulaires, y compris la viabilité cellulaire et le profil de mort cellulaire, ainsi que d’autres mécanismes de synthèse des protéines. L’évaluation réalisée devrait permettre de conclure sur la bioactivité des biomatériaux dans les tissus vivants, outre la cytotoxicité.
Avec l’explosion de nouveaux matériaux pour des applications médicales, non seulement pour la dentisterie, mais aussi pour l’orthopédie, la chirurgie, l’ophtalmologie, la cardiologie, etc., les premiers dépistages devraient être effectués systématiquement. Ce protocole pourrait être un outil important pour les chercheurs qui souhaitent développer et caractériser de nouveaux biomatériaux.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts financiers concurrents ou d’autres conflits d’intérêts.
Remerciements
Nous remercions les personnes suivantes pour leur soutien: GAI 2013 (Faculdade de Medicina da Universidade de Coimbra); Le CIBB est financé par des fonds nationaux via FCT (Foundation for Science and Technology) à travers les projets stratégiques UIDB/04539/2020 et UIDP/04539/2020 (CIBB). Nous remercions Jacques Nör, de la faculté dentaire de l’Université du Michigan, d’avoir fourni la lignée cellulaire MDPC-23.
matériels
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CaCl2 | Sigma | 10035-04-8 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| DAB + Chromogen | Dako | K3468 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| DSP (M-20) Antibody, 1: 100 | Santa Cruz Biotechnology | LS-C20939 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Hepes 0.01 M | Sigma | MFCD00006158 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Giemsa Stain, modified GS-500 | Sigma | MFCD00081642 | |
| Glycerol | Dako | C0563 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| May-Grünwald Stain MG500 | Sigma | MFCD00131580 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Polyclonal Rabbit Anti-goat immunoglobulins / HRP, 1: 100 | Dako | G-21234 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Substrate Buffer | Dako | 926605 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| β-actin antibody | Sigma | A5316 |
Références
- Williams, D. F. On the mechanisms of biocompatibility. Biomaterials. 29 (20), 2941-2953 (2008).
- Bruinink, A., Luginbuehl, R. Evaluation of biocompatibility using in vitro methods: interpretation and limitations. Advances in Biochemical Engineering/Biotechnology. 126, 117-152 (2012).
- Wataha, J. C. Principles of biocompatibility for dental practitioners. The Journal of Prosthetic Dentistry. 86 (2), 203-209 (2001).
- Mishra, S. F. D. A. CE mark or something else?-Thinking fast and slow. Indian Heart Journal. 69 (1), 1-5 (2016).
- Barbeck, M., et al. Balancing Purification and Ultrastructure of Naturally Derived Bone Blocks for Bone Regeneration: Report of the Purification Effort of Two Bone Blocks. Materials. 12 (19), 3234 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- Coelho, C. C., Araújo, R., Quadros, P. A., Sousa, S. R., Monteiro, F. J. Antibacterial bone substitute of hydroxyapatite and magnesium oxide to prevent dental and orthopaedic infections. Materials Science and Engineering: C. 97, 529-538 (2019).
- Jung, O., et al. Improved In Vitro Test Procedure for Full Assessment of the Cytocompatibility of Degradable Magnesium Based on ISO 10993-5/-12. International Journal of Molecular Sciences. 20 (2), 255 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- ISO. I.O. for S. ISO 10993-12:2012 - part 12: Sample preparation and reference materials. ISO. , (2012).
- ISO. I.O. for S. ISO 10993-5:2009 Biological evaluation of medical devices - part 5: Tests for in vitro cytotoxicity. ISO. , (2009).
- Srivastava, G. K., et al. Comparison between direct contact and extract exposure methods for PFO cytotoxicity evaluation. Scientific Reports. 8 (1), 1425 (2018).
- Pusnik, M., Imeri, M., Deppierraz, G., Bruinink, A., Zinn, M. The agar diffusion scratch assay--A novel method to assess the bioactive and cytotoxic potential of new materials and compounds. Scientific Reports. 6, 20854 (2016).
- Spiller, K. L., et al. The role of macrophage phenotype in vascularization of tissue engineering scaffolds. Biomaterials. 35 (15), 4477-4488 (2014).
- Zhou, H., et al. In Vitro Cytotoxicity Evaluation of a Novel Root Repair Material. Journal of Endodontics. 39 (4), 478-483 (2013).
- Bordron, A., et al. The binding of some human antiendothelial cell antibodies induces endothelial cell apoptosis. Journal of Clinical Investigation. 101 (10), 2029-2035 (1998).
- Palmini, G., et al. Establishment of Cancer Stem Cell Cultures from Human Conventional Osteosarcoma. Journal of Visualized Experiments. (116), e53884 (2016).
- Gregory, C. A., Grady Gunn, W., Peister, A., Prockop, D. J. An Alizarin red-based assay of mineralization by adherent cells in culture: comparison with cetylpyridinium chloride extraction. Analytical Biochemistry. 329 (1), 77-84 (2004).
- Cai, S., Zhang, W., Chen, W. PDGFRβ+/c-kit+ pulp cells are odontoblastic progenitors capable of producing dentin-like structure in vitro and in vivo. BMC Oral Health. 16 (1), 113 (2016).
- Paula, A., et al. Biodentine Boosts, WhiteProRoot MTA Increases and Life Suppresses Odontoblast Activity. Materials. 12 (7), 1184 (2019).
- Chander, N. G. Standardization of in vitro studies. Journal of Indian Prosthodontic Society. 16 (3), 227-228 (2016).
- Cavalcanti, B. N., Rode de M, S., França, C. M., Marques, M. M. Pulp capping materials exert an effect on the secretion of IL-1β and IL-8 by migrating human neutrophils. Brazilian Oral Research. 25 (1), 13-18 (2011).
- Chang, S., Lee, S. Y., Ann, H. J., Kum, K. Y., Kim, E. C. Effects of calcium silicate endodontic cements on biocompatibility and mineralization-inducing potentials in human dental pulp cells. Journal of Endodontics. 40 (8), 1194-1200 (2014).
- Daltoé, M. O., Paula-Silva, F. W. G., Faccioli, L. H., Gatón-Hernández, P. M., De Rossi, A., Bezerra Silva, L. A. Expression of Mineralization Markers during Pulp Response to Biodentine and Mineral Trioxide Aggregate. Journal of Endodontics. 42 (4), 596-603 (2016).
- Elias, R. V., Demarco, F. F., Tarquinio, S. B. C., Piva, E. Pulp responses to the application of a self-etching adhesive in human pulps after controlling bleeding with sodium hypochlorite. Quintessence International. 38 (2), 67-77 (2007).
- Huang, G. T. J., Shagramanova, K., Chan, S. W. Formation of odontoblast-like cells from cultured human dental pulp cells on dentin in vitro. Journal of endodontics. 32 (11), 1066-1073 (2006).
- Jafarnia, B., et al. Evaluation of cytotoxicity of MTA employing various additives. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology. 107 (5), 739-744 (2009).
- Paranjpe, A., Smoot, T., Zhang, H., Johnson, J. D. Direct contact with mineral trioxide aggregate activates and differentiates human dental pulp cells. Journal of Endodontics. 37 (12), 1691-1695 (2011).
- Spagnuolo, G., et al. In vitro cellular detoxification of triethylene glycol dimethacrylate by adduct formation with N-acetylcysteine. Dental Materials. 29 (8), 153-160 (2013).
- Murray, P. E., García Godoy, C., García Godoy C, F. How is the biocompatibilty of dental biomaterials evaluated. Medicina Oral, Patologia Oral y Cirugia Bucal. 12 (3), 258-266 (2007).
- Hanks, C. T., Wataha, J. C., Sun, Z. In vitro models of biocompatibility: a review. Dental Materials. 12 (3), 186-193 (1996).
- Eid, A. A., et al. In Vitro Biocompatibility and Oxidative Stress Profiles of Different Hydraulic Calcium Silicate Cements. Journal of Endodontics. 40 (2), 255-260 (2014).
- Nocca, G., et al. Effects of ethanol and dimethyl sulfoxide on solubility and cytotoxicity of the resin monomer triethylene glycol dimethacrylate. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 100 (6), 1500-1506 (2012).
- Abuarqoub, D., Aslam, N., Jafar, H., Abu Harfil, Z., Awidi, A. Biocompatibility of Biodentine with Periodontal Ligament Stem Cells: In Vitro Study. Dentistry Journal. 8 (1), 17 (2020).
- Coelho, A. S., et al. Cytotoxic effects of a chlorhexidine mouthwash and of an enzymatic mouthwash on human gingival fibroblasts. Odontology. 108 (2), 260-270 (2020).
- Wang, M. O., et al. Evaluation of the In Vitro Cytotoxicity of Cross-Linked Biomaterials. Biomacromolecules. 14 (5), 1321-1329 (2013).
- Tyliszczak, B., Drabczyk, A., Kudłacik-Kramarczyk, S., Bialik-Wąs, K., Sobczak-Kupiec, A. In vitro cytotoxicity of hydrogels based on chitosan and modified with gold nanoparticles. Journal of Polymer Research. 24 (10), 153 (2017).
- Widbiller, M., et al. Three-dimensional culture of dental pulp stem cells in direct contact to tricalcium silicate cements. Clinical Oral Investigations. 20 (2), 237-246 (2016).
- Pintor, A. V. B., et al. In Vitro and In Vivo Biocompatibility of ReOss in Powder and Putty Configurations. Brazilian Dental Journal. 29 (2), 117-127 (2018).
- Pellissari, C. V. G., et al. In Vitro Toxic Effect of Biomaterials Coated with Silver Tungstate or Silver Molybdate Microcrystals. Journal of Nanomaterials. 2020, 1-9 (2020).
- Collado-González, M., et al. Cytotoxicity and bioactivity of various pulpotomy materials on stem cells from human exfoliated primary teeth. International Endodontic Journal. 50, 19-30 (2017).
- Paula, A., et al. Direct Pulp Capping: Which is the Most Effective Biomaterial? A Retrospective Clinical Study. Materials. 12 (20), 3382 (2019).
- Williams, D. F. There is no such thing as a biocompatible material. Biomaterials. 35 (38), 10009-10014 (2014).
- Schuh, J. C. L. Medical device regulations and testing for toxicologic pathologists. Toxicologic Pathology. 36 (1), 63-69 (2008).
- Pizzoferrato, A., et al. Cell culture methods for testing Biocompatibility. Clinical Materials. 15 (3), (1994).
- Pereira Paula, A. B., et al. Direct pulp capping: what is the most effective therapy? - review and meta-analysis. Journal of Evidence Based Dental Practice. , (2018).
- Caiaffa, K. S., et al. Effect of analogues of cationic peptides on dentin mineralization markers in odontoblast-like cells. Archives of Oral Biology. 103, 19-25 (2019).
- Fujiwara, S., Kumabe, S., Iwai, Y. Isolated rat dental pulp cell culture and transplantation with an alginate scaffold. Okajimas Folia Anatomica Japonica. 83 (1), 15-24 (2006).
- Nakashima, M., et al. Stimulation of Reparative Dentin Formation by Ex Vivo Gene Therapy Using Dental Pulp Stem Cells Electrotransfected with Growth/differentiation factor 11 (Gdf11). Human Gene Therapy. 15 (11), 1045-1053 (2004).
- Narayanan, K., et al. Differentiation of embryonic mesenchymal cells to odontoblast-like cells by overexpression of dentin matrix protein 1. Proceedings of the National Academy of Sciences of the United States of America. 98 (8), 4516-4521 (2001).
- Kim, H. J., Yoo, J. H., Choi, Y., Joo, J. Y., Lee, J. Y., Kim, H. J. Assessing the effects of cyclosporine A on the osteoblastogenesis, osteoclastogenesis, and angiogenesis mediated by the human periodontal ligament stem cells. Journal of Periodontology. , (2019).
- Bou Assaf, R., et al. Healing of Bone Defects in Pig's Femur Using Mesenchymal Cells Originated from the Sinus Membrane with Different Scaffolds. Stem Cells International. , (2019).
- He, W., et al. Lipopolysaccharide enhances decorin expression through the toll-like receptor 4, myeloid differentiating factor 88, nuclear factor-kappa B, and mitogen-activated protein kinase pathways in odontoblast cells. Journal of Endodontics. 38 (4), 464-469 (2012).
- Xiong, Y., et al. Wnt Production in Dental Epithelium Is Crucial for Tooth Differentiation. Journal of Dental Research. 98 (5), 580-588 (2019).
- Haruyama, N., et al. Genetic evidence for key roles of decorin and biglycan in dentin mineralization. Matrix Biology. 28 (3), 129-136 (2009).
- Sreenath, T., et al. Dentin Sialophosphoprotein Knockout Mouse Teeth Display Widened Predentin Zone and Develop Defective Dentin Mineralization Similar to Human Dentinogenesis Imperfecta Type III. Journal of Biological Chemistry. 278 (27), 24874-24880 (2003).
- Yang, Y., Zhao, Y., Liu, X., Chen, Y., Liu, P., Zhao, L. Effect of SOX2 on odontoblast differentiation of dental pulp stem cells. Molecular Medicine Reports. 16 (6), 9659-9663 (2017).
- Tao, H., et al. Klf4 Promotes Dentinogenesis and Odontoblastic Differentiation via Modulation of TGF-β Signaling Pathway and Interaction With Histone Acetylation. Journal of Bone and Mineral Research. 34 (8), 1502-1516 (2019).
- Massa, L. F., Ramachandran, A., George, A., Arana-Chavez, V. E. Developmental appearance of dentin matrix protein 1 during the early dentinogenesis in rat molars as identified by high-resolution immunocytochemistry. Histochemistry and Cell Biology. 124 (3-4), 197-205 (2005).
- Hao, J., Zou, B., Narayanan, K., George, A. Differential expression patterns of the dentin matrix proteins during mineralized tissue formation. Bone. 34 (6), 921-932 (2004).
- Tompkins, K., Alvares, K., George, A., Veis, A. Two related low molecular mass polypeptide isoforms of amelogenin have distinct activities in mouse tooth germ differentiation in vitro. Journal of Bone and Mineral Research. 20 (2), 341-349 (2005).
- Zhai, Y., et al. Activation and Biological Properties of Human β Defensin 4 in Stem Cells Derived From Human Exfoliated Deciduous Teeth. Frontiers in Physiology. 10, (2019).
- Bègue-Kirn, C., Ruch, J. V., Ridall, A. L., Butler, W. T. Comparative analysis of mouse DSP and DPP expression in odontoblasts, preameloblasts, and experimentally induced odontoblast-like cells. European Journal of Oral Sciences. 106, 254-259 (1998).
- Kikuchi, H., Suzuki, K., Sakai, N., Yamada, S. Odontoblasts induced from mesenchymal cells of murine dental papillae in three-dimensional cell culture. Cell and Tissue Research. 317 (2), 173-185 (2004).
- Li, X., Yang, G., Fan, M. Effects of homeobox gene distal-less 3 on proliferation and odontoblastic differentiation of human dental pulp cells. Journal of Endodontics. 38 (11), 1504-1510 (2012).
- Chen, S., et al. Differential regulation of dentin sialophosphoprotein expression by Runx2 during odontoblast cytodifferentiation. Journal of Biological Chemistry. 280 (33), 29717-29727 (2005).
- Narayanan, K., Gajjeraman, S., Ramachandran, A., Hao, J., George, A. Dentin matrix protein 1 regulates dentin sialophosphoprotein gene transcription during early odontoblast differentiation. Journal of Biological Chemistry. 281 (28), 19064-19071 (2006).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. A substractive PCR-based cDNA library from human odontoblast cells: identification of novel genes expressed in tooth forming cells. Matrix Biology. 19 (5), 421-430 (2000).
- Miyazaki, T., Baba, T., Mori, T., Komori, T. Collapsin Response Mediator Protein 1, a Novel Marker Protein for Differentiated Odontoblasts. Acta Histochemica et Cytochemica. 51 (6), 185-190 (2018).
- Yokoi, M., Kuremoto, K., Okada, S., Sasaki, M., Tsuga, K. Effect of attenuation of fibroblast growth factor receptor 2b signaling on odontoblast differentiation and dentin formation. In Vitro Cellular and Developmental Biology - Animal. 55 (3), 211-219 (2019).
- Tohma, A., et al. Glucose Transporter 2 and 4 Are Involved in Glucose Supply during Pulpal Wound Healing after Pulpotomy with Mineral Trioxide Aggregate in Rat Molars. Journal of Endodontics. , (2019).
- Sueyama, Y., Kaneko, T., Ito, T., Kaneko, R., Okiji, T. Implantation of Endothelial Cells with Mesenchymal Stem Cells Accelerates Dental Pulp Tissue Regeneration/Healing in Pulpotomized Rat Molars. Journal of Endodontics. 43 (6), 943-948 (2017).
- Petersson, U., Hultenby, K., Wendel, M. Identification, distribution and expression of osteoadherin during tooth formation. European Journal of Oral Sciences. 111 (2), 128-136 (2003).
- Couble, M. L., et al. Immunodetection of osteoadherin in murine tooth extracellular matrices. Histochemistry and Cell Biology. 121 (1), 47-53 (2004).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. Expression of the small leucine-rich proteoglycan osteoadherin/osteomodulin in human dental pulp and developing rat teeth. Bone. 27 (2), 265-270 (2000).
- Salmon, B., et al. Abnormal osteopontin and matrix extracellular phosphoglycoprotein localization, and odontoblast differentiation, in X-linked hypophosphatemic teeth. Connective Tissue Research. 55, 79-82 (2014).
- Liao, C., Ou, Y., Wu, Y., Zhou, Y., Liang, S., Wang, Y. Sclerostin inhibits odontogenic differentiation of human pulp-derived odontoblast-like cells under mechanical stress. Journal of Cellular Physiology. 234 (11), 20779-20789 (2019).
- Deng, X., et al. The combined effect of oleonuezhenide and wedelolactone on proliferation and osteoblastogenesis of bone marrow mesenchymal stem cells. Phytomedicine. 153103, (2019).
- Choi, H., Kim, T. H., Yun, C. Y., Kim, J. W., Cho, E. S. Testicular acid phosphatase induces odontoblast differentiation and mineralization. Cell and Tissue Research. 364 (1), 95-103 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon