Method Article
Accesso alla citotossicità e alla risposta cellulare ai biomateriali
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questa metodologia mira a valutare la citotossicità dei biomateriali attraverso la preparazione di estratti solubili, utilizzando saggi di vitalità e analisi fenotipiche, tra cui citometria a flusso, RT-PCR, immunocitochimica e altre tecniche di biologia cellulare e molecolare.
Abstract
I biomateriali entrano in contatto diretto o indiretto con i tessuti umani, rendendo importante valutarne la citotossicità. Questa valutazione può essere eseguita con diversi metodi, ma esiste un'elevata discrepanza tra gli approcci utilizzati, compromettendo la riproducibilità e il confronto tra i risultati ottenuti. In questo articolo, proponiamo un protocollo per valutare la citotossicità dei biomateriali utilizzando estratti solubili, che utilizziamo per i biomateriali dentali. La preparazione degli estratti è dettagliata, dalla produzione di pellet alla sua estrazione in un terreno di coltura. La valutazione della citotossicità dei biomateriali si basa sull'attività metabolica utilizzando il saggio MTT, sulla vitalità cellulare utilizzando il saggio Sulphorhodamine B (SBR), sul profilo di morte cellulare mediante citometria a flusso e sulla morfologia cellulare utilizzando May-Grünwald Giemsa. Oltre alla valutazione della citotossicità, viene descritto un protocollo per valutare la funzione cellulare basato sull'espressione di marcatori specifici valutati mediante immunocitochimica e PCR. Questo protocollo fornisce una guida completa per la citotossicità dei biomateriali e la valutazione degli effetti cellulari, utilizzando la metodologia degli estratti, in modo riproducibile e robusto.
Introduzione
La biocompatibilità può essere definita come la capacità di un materiale di integrare il tessuto e indurre una risposta terapeutica favorevole, priva di danni locali e sistemici 1,2,3. La valutazione della biocompatibilità è fondamentale per lo sviluppo di qualsiasi materiale destinato all'uso medico. Pertanto, questo protocollo fornisce un approccio sistematico e completo per ogni ricercatore che mira a sviluppare nuovi biomateriali o a studiare nuove applicazioni per i biomateriali esistenti.
I test di citotossicità in vitro sono ampiamente utilizzati come prima fase per la valutazione della biocompatibilità, utilizzando colture cellulari primarie o linee cellulari. I risultati costituiscono un primo indicatore di potenziale applicazione clinica. Oltre ad essere vitale per lo sviluppo di biomateriali, questo test è obbligatorio per conformarsi alle normative vigenti per l'introduzione sul mercato, da parte dei regolatori EUA e UE (certificazione FDA e CE)4,5,6,7,8. Inoltre, la sperimentazione standardizzata nella ricerca biomedica offre un vantaggio significativo in termini di riproducibilità e confronto dei risultati di diversi studi su biomateriali o dispositivi simili9.
Le linee guida ISO (International Organization for Standardization) sono ampiamente utilizzate da più laboratori commerciali, normativi e accademici indipendenti per testare i materiali in modo accurato e riproducibile. La ISO 10993-5 si riferisce alla valutazione della citotossicità in vitro e la ISO 10993-12 riporta la preparazione del campionamento10,11. Per l'analisi dei biomateriali sono previste tre categorie, da selezionare in base al tipo di materiale, ai tessuti a contatto e all'obiettivo del trattamento: estratti, contatto diretto e contatto indiretto 8,11,12,13. Gli estratti sono ottenuti arricchendo un terreno di coltura cellulare con il biomateriale. Per i test di contatto diretto, il biomateriale viene posto direttamente sulle colture cellulari e, in contatto indiretto, l'incubazione con le cellule viene eseguita separata da una barriera, come un gel di agarosio11. I controlli appropriati sono obbligatori e devono essere eseguiti almeno tre esperimenti indipendenti 5,8,10,11,14.
È fondamentale simulare o esagerare le condizioni cliniche per determinare il potenziale citotossico. Nel caso di prove sugli estratti, la superficie del materiale; il volume medio; il pH del mezzo e del materiale; il rapporto di solubilità, osmolarità e diffusione del materiale; e le condizioni di estrazione come l'agitazione, la temperatura e il tempo influenzano gli arricchimenti dei mezzi5.
La metodologia consente la valutazione quantitativa e qualitativa della citotossicità di diverse formulazioni farmaceutiche, sia solide che liquide. È possibile eseguire diversi test, come il test di captazione del rosso neutro, il test di formazione delle colonie, il test MTT e il test XTT 5,10,14.
La maggior parte degli studi di valutazione della citotossicità pubblicati utilizzano saggi più semplici, vale a dire MTT e XTT, che forniscono informazioni limitate. La valutazione della biocompatibilità non dovrebbe comportare solo la valutazione della citotossicità, ma anche la bioattività di un determinato materiale di prova2, come approvato dal presente protocollo. Ulteriori criteri di valutazione dovrebbero essere utilizzati quando giustificati e documentati. Pertanto, questo protocollo mira a fornire una guida completa, dettagliando una serie di metodi per la valutazione della citotossicità dei biomateriali. Inoltre, viene descritta la valutazione di diversi processi cellulari, vale a dire il tipo di morte cellulare, la morfologia cellulare, la funzione cellulare nella sintesi di proteine specifiche e la produzione di tessuti specifici.
Protocollo
1. Preparazione del pellet
- Preparare gli stampi in cloruro di polivinile (PVC) eseguendo fori di forma circolare di dimensioni note in lastre di PVC.
NOTA: le modanature in PVC possono essere realizzate di diverse dimensioni. Calcolare la superficie di contatto degli stampi in PVC, utilizzando la formula A = h (2πr) + 2πr2 (r: raggio del cilindro; h: altezza del cilindro). - Preparare il biomateriale da testare secondo le istruzioni del produttore e il più vicino possibile all'inizio dell'esperimento.
NOTA: Per la preparazione di biomateriali di formulazione pasta/pasta, una quantità adeguata di pasta base e catalizzatore viene miscelata manualmente con una spatola di miscelazione. Per altri materiali a base di formulazioni liquide e in polvere, deve essere eseguita la spatolazione manuale o la miscelazione meccanica con vibrazioni, seguendo le istruzioni del fabbricante o quelle adeguate per i nuovi materiali. Per i materiali liquidi, questo passaggio non è necessario. Avviare il protocollo nel passaggio 2. - Posizionare il biomateriale sugli stampi con una spatola e lasciarli riposare per il tempo opportuno.
NOTA: Il tempo di presa e le condizioni di regolazione dei biomateriali devono seguire le istruzioni del produttore o le istruzioni adeguate per i nuovi materiali. - Dopo la presa, rimuovere i pellet del biomateriale dagli stampi in PVC e metterli in un contenitore (è possibile utilizzare una piastra a 6 pozzetti o una capsula di Petri).
- Sterilizzare i pellet mettendoli sotto una lampada a luce ultravioletta (UV) per 20 minuti per ciascun lato.
2. Ottenere gli estratti dei biomateriali
NOTA: Tutte le procedure devono essere eseguite in condizioni sterili rigorose.
- Determinare il numero necessario di pellet calcolando la superficie del pellet in base alla formula descritta al punto 1.1.
NOTA: Come valore di riferimento, la superficie di contatto di 250 mm2/mL11,15 si ottiene aggiungendo 9 pellet (r 3 mm x h 1,5 mm) per mL del mezzo. - Preparare gli estratti solubili (estratto arricchito con il biomateriale).
- Mettere i pellet in un tubo da 50 mL e aggiungere il corrispondente mezzo di coltura cellulare. Posizionare i tubi per 24 ore nell'incubatore a 37°, in rotazione costante.
NOTA: utilizzare il terreno di coltura cellulare appropriato per le colture cellulari. - Dopo 24 ore, rimuovere i tubi dall'incubatore. A questo punto, gli estratti corrispondono ad una concentrazione di 1/1 o 100%.
- Effettuare diluizioni dell'estratto mediante aggiunta sequenziale di volumi uguali di terreno condizionato a terreno di coltura cellulare.
NOTA: non deve essere effettuata alcuna regolazione del pH del fluido.- Aggiungere 1 mL di terreno di coltura a 1 mL di estratto al 100% per ottenere un estratto al 50%. Aggiungere 1 mL di terreno di coltura a 1 mL di estratto al 50% per ottenere un estratto al 25% e così via (Figura 1).
NOTA: Utilizzare le concentrazioni ritenute rilevanti per ciascun composto.
- Aggiungere 1 mL di terreno di coltura a 1 mL di estratto al 100% per ottenere un estratto al 50%. Aggiungere 1 mL di terreno di coltura a 1 mL di estratto al 50% per ottenere un estratto al 25% e così via (Figura 1).
- Mettere i pellet in un tubo da 50 mL e aggiungere il corrispondente mezzo di coltura cellulare. Posizionare i tubi per 24 ore nell'incubatore a 37°, in rotazione costante.

Figura 1: Schema della preparazione e delle diluizioni degli estratti solubili. Fare clic qui per visualizzare una versione ingrandita di questa figura.
3. Incubazione cellulare con estratti di biomateriali
- Preparare una sospensione cellulare e placcarla in un contenitore cellulare adeguato, come una piastra multipozzetto, in base al numero di cellule necessarie per gli esperimenti.
- Inizia con un pallone delle celle desiderate con confluenza dall'80% al 90%.
- Eliminare i terreni di coltura cellulare, lavare con soluzione salina tamponata fosfato (PBS) e staccare le cellule con tripsina-EDTA (da 1 a 2 ml per un matraccio di coltura cellulare da 75 cma 2 cellule).
- Aggiungere il terreno di coltura cellulare (da 2 a 4 ml per un matraccio di coltura cellulare da 75 cm a 2 cellule), trasferire la sospensione cellulare in una provetta e centrifugarea 200 x g per 5 minuti.
- Sospendere il pellet in un volume noto di terreni di coltura cellulare.
NOTA: Questo protocollo è progettato per l'uso di colture cellulari aderenti; Tuttavia, è possibile apportare semplici adattamenti per lavorare con colture cellulari in sospensione. - Contare le cellule nell'emocitometro e calcolare la concentrazione cellulare della sospensione cellulare.
- Sospendere la quantità determinata di sospensione cellulare nel terreno di coltura e trasferirla in piastre multipozzetto. Come valore di riferimento per la densità di semina, considerare 5 – 20 x 105 celle/cm2.
NOTA: Il numero appropriato di celle deve essere calcolato in base al tipo di cella e alle caratteristiche della cella, vale a dire il tempo di raddoppio delle celle.
- Incubare le cellule per 24 ore per consentire l'adesione cellulare.
- Dopo questo periodo, somministrare gli estratti solubili nelle piastre di coltura.
- Aspirare il terreno di coltura cellulare.
- Aggiungere gli estratti dei biomateriali a ciascun pozzetto, secondo la sequenza delle concentrazioni, come descritto in precedenza. Aggiungere terreno di coltura cellulare fresco ai pozzetti di controllo.
- Incubare le piastre per 24 ore o più.
NOTA: I controlli negativi devono essere eseguiti in ogni test, corrispondenti alle cellule non trattate, mantenute nel terreno di coltura. I tempi di incubazione possono essere selezionati in base agli obiettivi dello studio.
4. Valutazione dell'attività metabolica
- Dopo l'incubazione cellulare con gli estratti dei biomateriali, aspirare il mezzo dalle piastre e lavare ogni pozzetto PBS.
- Collocare, in ciascun pozzetto, il volume adeguato di 0,5 mg/mL 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolo bromuro (MTT) preparato in PBS, pH 7,4.
- Incubare le piastre per 4 ore o durante la notte al buio a 37 ° C.
- Per solubilizzare i cristalli di formazan ottenuti, aggiungere il volume adeguato di soluzione 0,04 M di acido cloridrico in isopropanolo a ciascun pozzetto e mescolare le piastre per 30 minuti.
NOTA: Regolare la quantità di MTT e isopropanolo in base alle dimensioni dei pozzetti. - Mescolare e omogeneizzare il contenuto di ciascun pozzetto, se necessario, pipettando su e giù fino a quando non si vedono cristalli.
- Quantificare l'assorbanza ad una lunghezza d'onda di 570 nm con un filtro di riferimento di 620 nm, nello spettrofotometro.
- Per calcolare l'attività metabolica, dividere l'assorbanza delle cellule trattate per l'assorbanza delle colture di controllo. Per ottenere valori percentuali moltiplicare per 100.
5. Valutazione della morte cellulare
NOTA: Per eseguire questa valutazione devono essere utilizzate almeno 106 cellule per condizione.
- Utilizzare provette da centrifuga opportunamente identificate, in base alle condizioni valutate.
- Dopo l'incubazione cellulare con gli estratti dei biomateriali, raccogliere i terreni di coltura nella rispettiva provetta.
- Staccare le celle e aggiungere la sospensione cellulare ai rispettivi tubi.
- Concentrare le sospensioni cellulari mediante centrifugazione a 120 x g per 5 minuti.
- Lavare il pellet con PBS. Rimuovere il PBS mediante centrifugazione a 1.000 x g per 5 minuti.
- Aggiungere 1 mL di PBS e trasferire i pellet cellulari alle provette citometriche identificate.
- Rimuovere il PBS mediante centrifugazione a 1.000 x g per 5 minuti.
- Incubare con 100 μL di tampone di legame (0,01 M HEPES, 0,14 mM NaCl e 0,25 mM CaCl2)16, e lasciare riposare le cellule per circa 15 minuti per il recupero della membrana cellulare.
- Aggiungere 2,5 μL di Annexin-V marcata con fluorescenza e 1 μL di ioduro di propidio per 15 minuti a temperatura ambiente al buio.
- Dopo l'incubazione, aggiungere 400 μL di PBS e analizzare sul citometro. Per l'analisi e la quantificazione delle informazioni utilizzare software appropriati.
- Presentare i risultati come percentuale di cellule vive, apoptosi, apoptosi tardiva / necrosi e necrosi.
6. Valutazione morfologica
- Selezionare la dimensione appropriata dei vetrini di vetro sterilizzati che si adattano all'interno della piastra multipozzetto.
- Posizionare ogni vetrino in un pozzetto usando una pinzetta sterile.
- Distribuire una sospensione cellulare ad una concentrazione adeguata nei pozzetti e lasciare per una notte in un incubatore a 37 °C in atmosfera umidificata con il 95% di aria e il 5% di CO2.
- Esporre le colture cellulari agli estratti, come descritto in precedenza.
- Aspirare il supporto e lavare con PBS.
- Lasciare asciugare i coperchi a temperatura ambiente e quindi aggiungere un volume sufficiente di soluzione di May-Grünwald per coprire i vetrini; Incubare per 3 minuti.
- Rimuovere il colorante e lavare con acqua distillata per 1 minuto.
- Rimuovere l'acqua e aggiungere un volume sufficiente di soluzione di Giemsa per coprire i vetrini; Incubare per 15 minuti.
- Lavare i coperchi in acqua corrente.
- Trasferire i vetrini in una diapositiva.
- Guarda al microscopio. Scatta le fotografie con l'ingrandimento scelto.
7. Valutazione della funzionalità cellulare mediante reazione a catena della polimerasi a trascrizione inversa (RT-PCR)
NOTA: Per eseguire questa valutazione è necessario utilizzare almeno 2x106 celle per condizione. Ad esempio, la fosfatasi alcalina è presentata come un gene di interesse per la valutazione dell'attività degli odontoblasti. Altri geni di interesse possono essere visti nella Tabella 1.
- Placcare le celle come descritto sopra.
NOTA: Potrebbe essere necessario aggiustare la concentrazione delle cellule placcate, in base al tipo di cellula e alla citotossicità dei biomateriali studiati. - Incubare con estratti solubili, come descritto sopra.
- Staccare le celle per ottenere una sospensione come descritto in precedenza.
- Lavare le celle due volte con PBS; Per questa centrifuga a 200 x g per 5 minuti a temperatura ambiente.
- Lisare le cellule sospendendo il pellet in 1 mL di soluzione di purificazione dell'RNA (ad esempio, NZYol), agitazione intensa e pipettaggio successivo.
- Incubare i campioni per 5 minuti a temperatura ambiente.
- Aggiungere 200 μL di cloroformio e agitare i tubi a mano per 15 secondi.
- Incubare per 3 minuti a temperatura ambiente.
- Centrifugare lisati a 4°C per 15 min a 12.000 x g. Durante questa centrifugazione, due fasi hanno origine nel campione, lasciando l'RNA nella fase acquosa (superiore).
- Rimuovere la fase acquosa in un nuovo tubo e aggiungere 500 μL di isopropanolo freddo per precipitare l'RNA.
- Incubare i campioni a temperatura ambiente per 10 minuti e centrifugare a 12.000 x g per 10 minuti a 4°C.
- Rimuovere il surnatante e lavare il pellet con 1 ml di etanolo al 75% mediante centrifugazione a 7.500 x g per 5 minuti a 4°C.
- Asciugare il pellet a temperatura ambiente fino all'evaporazione dell'etanolo.
- Sospendere in acqua priva di RNasi.
- Quantificare e determinare il grado di purezza dei campioni utilizzando la spettrofotometria di assorbimento, alle lunghezze d'onda 260 nm e 280 nm. Determinare la purezza dell'RNA e utilizzare campioni con un rapporto di purezza (A260/280) intorno a 2,0.
- Conservare i campioni a -80 ° C.
- Procedere all'esecuzione della RT-PCR seguendo il protocollo17 del produttore.
NOTA: In base all'obiettivo dello studio, selezionare i marcatori specifici da valutare.
8. Valutazione della funzionalità cellulare attraverso l'identificazione delle proteine
NOTA: In base all'obiettivo dello studio, selezionare le proteine specifiche da valutare. Ad esempio, la sialoproteina della dentina (DSP) è presentata come una proteina di interesse per la valutazione dell'attività degli odontoblasti. Altre proteine di interesse possono essere viste nella Tabella 1.
- Colture di cellule in vetrini ed esporre agli estratti, come descritto prima.
- Lavare le colture cellulari con PBS.
- Fissare con paraformaldeide al 3,7% per 30 minuti a temperatura ambiente.
- Lavare due volte con PBS.
- Permeabilizzare con Tritone allo 0,5% in PBS per 15 minuti.
- Bloccare la perossidasi con perossido di idrogeno allo 0,3% in PBS per 5 minuti.
- Lavare due volte con PBS.
- Lavare due volte con albumina sierica bovina allo 0,5% (BSA).
- Bloccare le colture cellulari con BSA al 2% per 45 minuti.
- Lavare con BSA allo 0,5% in PBS.
- Incubare le colture con l'anticorpo primario in base alla proteina selezionata per 60 minuti a temperatura ambiente.
NOTA: Questo protocollo utilizza l'anticorpo primario DSP (M20) (1:100) e l'anticorpo secondario Polyclonal Rabbit Anti-goat immunoglobuline/HRP (1:100). - Lavare cinque volte con BSA allo 0,5% in PBS.
- Incubare con anticorpi secondari per 90 minuti a temperatura ambiente.
NOTA: Effettuare le diluizioni anticorpali utilizzando lo 0,5% di BSA in PBS. - Lavare cinque volte con BSA allo 0,5% in PBS per 1 minuto in ogni lavaggio.
- Incubare colture con un substrato e una miscela di cromogeno ad una concentrazione di 20 μL di substrato cromogeno/mL per 25 minuti.
- Lavare due volte con BSA allo 0,5% in PBS.
- Controcolorazione con Ematossilina per 15 minuti.
- Lavare con una sequenza di 0,037 mol/L di ammoniaca e acqua distillata per 5 minuti per rimuovere il colorante in eccesso.
- Montare i coprivetrini sulle diapositive. Utilizzare il glicerolo come mezzo di montaggio.
- Lasciare asciugare durante la notte.
- Guarda al microscopio. Scatta le fotografie con l'ingrandimento scelto.
9. Valutazione della mineralizzazione mediante saggio Alizarin Red S
- Preparare una soluzione di Alizarin Red S ad una concentrazione di 40 mM18. Mescolare la soluzione per l'omogeneizzazione per 12 ore al buio.
NOTA: Per preparare 100 mL di soluzione di Alizarin Red S, solubilizzare 1,44 g di polvere di alizarina (Peso molecolare: 360 g/mol) in acqua ultrapura, al riparo dalla luce. Per questa soluzione, il valore del pH è critico e dovrebbe essere compreso tra 4,1 e 4,3. - Incubare la coltura cellulare con estratti solubili, come descritto sopra.
- Lavare le colture cellulari tre volte con PBS.
- Fissare con paraformaldeide al 4% per 15 minuti a temperatura ambiente.
- Lavare tre volte con PBS.
- Colorare con Alizarin Red Staining solution per 20 minuti a 37 °C al buio.
- Dopo la colorazione, lavare le piastre con PBS per rimuovere il colorante in eccesso.
- Guarda al microscopio. Scatta le fotografie con l'ingrandimento scelto.
- Aggiungere una soluzione di estrazione, composta da acido acetico al 10% (p/v) e metanolo al 20% (p/v), in ciascun pozzetto e lasciare agitare per 40 minuti a temperatura ambiente.
- Misurare l'assorbanza alla lunghezza d'onda di 490 nm su uno spettrofotometro19.
Risultati
I risultati rappresentativi qui si riferiscono allo studio dei biomateriali dentali. La metodologia dell'estratto consente di ottenere un profilo di citotossicità e funzione cellulare dopo l'esposizione ai materiali dentali, per quanto riguarda gli effetti sull'attività metabolica (Figura 2), la vitalità cellulare, il profilo di morte cellulare e la morfologia cellulare (Figura 3) e l'espressione di proteine specifiche (Figura 4).
Il test MTT viene utilizzato per ottenere una rapida panoramica della citotossicità dei materiali in modo semplice. È possibile effettuare un confronto tra due o più materiali (Figura 2); una grave riduzione dell'attività metabolica, anche quando a basse (6,25%) e medie concentrazioni (50%), indica una maggiore tossicità (Figura 2a). Allo stesso tempo, meno materiali citotossici presentano solo una riduzione più leggera o nulla (Figura 2b). I confronti tra diversi punti temporali consentono di determinare effetti citotossici più immediati o in fasi successive.
Gli effetti sulla vitalità cellulare forniscono importanti informazioni sulla riduzione delle cellule vitali, che può compromettere la capacità dei tessuti di recuperare dopo un effetto dannoso. La determinazione della percentuale di cellule vitali consente di confrontare la citotossicità del materiale; più materiali citotossici inducono una maggiore morte cellulare per la stessa concentrazione (Figure 3a e 3b). Riduzioni superiori al 30% sono fondamentali e definiscono i materiali a rischio di bassa biocompatibilità (Figura 3a). Queste informazioni sono completate con il profilo di morte cellulare (Figura 3a e 3b). Nei risultati rappresentativi, più materiali citotossici sono caratterizzati da un'accentuata diminuzione della vitalità cellulare e per un profilo di morte cellulare tardiva di apoptosi e necrosi (Figura 3a), mentre quelli meno citotossici presentano meno morte cellulare e un profilo più apoptotico e tardivo (Figura 3b).
Le informazioni ottenute dalla valutazione della morfologia cellulare (Figura 3c) completano la valutazione della vitalità cellulare. I cambiamenti rispetto alla morfologia tipica della cellula possono indicare un profilo apoptotico o necrotico16. Inoltre, ulteriori informazioni possono essere ottenute da questo protocollo, come l'osservazione delle particelle materiali (frecce rosse, Figura 3C).
Marcatori specifici, fondamentali per la funzione cellulare, influenzati dall'esposizione all'estratto possono essere valutati con diverse tecniche, come immunoistochimica, PCR, citometria a flusso, blotting o saggi colorimetrici (Tabella 1). I risultati rappresentativi dell'espressione di DSP dopo l'esposizione agli estratti sono mostrati nella Figura 4a, e si può vedere che alcuni materiali (cementi di silicati tricalcici) stimolano le cellule ad aumentare l'espressione proteica. Al contrario, altri (cementi idrossido di calcio) promuovono una significativa diminuzione dell'espressione proteica, indipendentemente dalla perdita di vitalità. In entrambi i casi, la concentrazione degli estratti influenza direttamente l'espressione proteica.
Nella linea cellulare MDPC-23 del fenotipo odontoblasto, la formazione di depositi di mineralizzazione è caratteristica. Il protocollo per l'identificazione e la quantificazione dei depositi mineralizzati permette di valutare la funzione specifica di questo tipo di cellule specializzate. Nel caso presentato, è stato osservato che oltre ad essere meno citotossico, il cemento ai silicati tricalcici stimola la funzione cellulare, una volta osservato un aumento dei depositi mineralizzati (Figura 4b). Al contrario, il cemento idrossido di calcio più citotossico ha portato a una ridotta deposizione minerale a causa della compromissione e della morte cellulare (Figura 4b). Oltre a una valutazione qualitativa, può essere eseguita una determinazione quantitativa (Figura 4c).
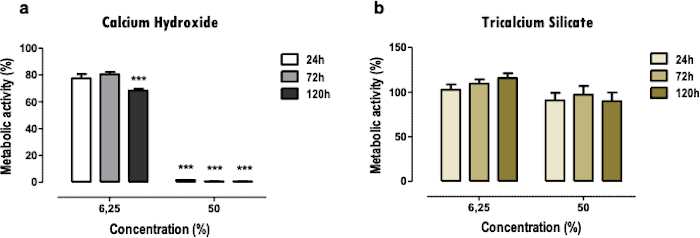
Figura 2: Attività metabolica. Attività metabolica delle cellule MDPC-23 trattate con idrossido di calcio cemento [a)] e cemento silicato tricalcico [b)] estratti solubili per 24, 72 e 120 ore. I risultati sono normalizzati alle colture cellulari di controllo, con un valore del 100%. Le differenze significative sono rappresentate da *, dove * significa p<0,05, ** significa p<0,01 e *** significa p<0,001. Parte di questa figura è stata modificata da una precedente pubblicazione con il permesso dell'editore20. Fare clic qui per visualizzare una versione ingrandita di questa figura.
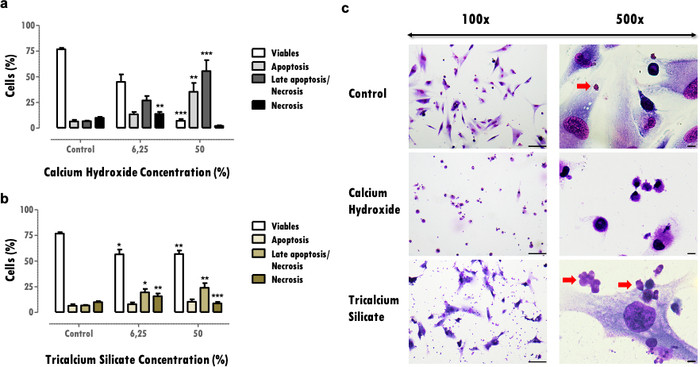
Figura 3: Vitalità cellulare, profilo di morte e morfologia cellulare. Vitalità cellulare, profilo di morte cellulare e morfologia cellulare in cellule MDPC-23 sottoposte a trattamento con idrossido di calcio e biomateriali silicati tricalcici a concentrazione del 6,25% e del 50%, dopo 120 ore di esposizione. a) e b) I risultati sono tracciati come la percentuale di cellule viventi in apoptosi, apoptosi tardiva o necrosi e necrosi. Differenze significative rispetto al controllo o tra le condizioni sono rappresentate con *, dove * significa p <0,05, ** significa p <0,01 e *** significa p <0,001. c) Cellule colorate con May-Grünwald Giemsa dopo trattamento con una concentrazione del 50% di estratti solubili biomateriali. Il gruppo di controllo rappresenta le cellule in coltura in DMEM con il 10% di FBS. Le immagini nella colonna di sinistra sono state ottenute con un ingrandimento di 100x e le immagini nella colonna a destra sono state ottenute con un ingrandimento di 500x. Le barre delle figure rappresentano 100 μm. Parte di questa figura è stata modificata da una precedente pubblicazione con il permesso dell'editore20. Fare clic qui per visualizzare una versione ingrandita di questa figura.
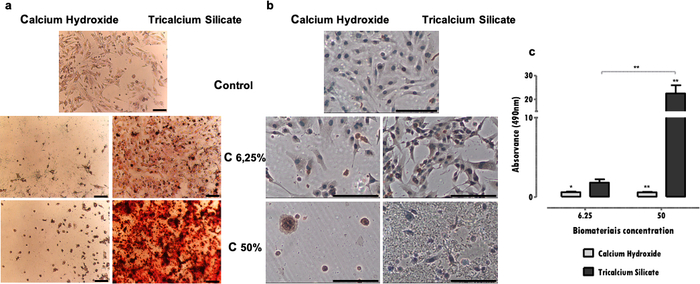
Figura 4: Espressione di DSP e formazione di noduli mineralizzati. a) Cellule MDPC-23 marcate mediante immunocitochimica per la rilevazione dell'espressione di DSP quando sottoposte a trattamento con idrossido di calcio e silicato tricalcico a concentrazioni del 50% e del 6,25% dopo 96 ore di incubazione. b) Immagini da cellule MDPC-23 in coltura colorate con colorazione Alizarin Red S trattate con biomateriali idrossido di calcio e silicato tricalcico a concentrazioni del 50% e del 6,25% dopo 120 ore di incubazione. Tutte le fotografie sono state ottenute con un ingrandimento di 100x. Entrambe le barre di figura rappresentano 150μm. c) Formazione di depositi di calcio da cellule MDPC-23 trattate con idrossido di calcio e silicato tricalcico dopo 120 ore di esposizione. I risultati sono il rapporto tra le assorbanze dei campioni e il controllo. Le differenze significative sono rappresentate da *, dove * significa p<0,05, ** significa p<0,01 e *** significa p<0,001. Parte di questa figura è stata modificata da una precedente pubblicazione con il permesso dell'editore20. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella 1: Elenco dei marcatori di differenziazione/funzione odontoblastica47-79. Questa tabella fornisce un elenco di marcatori odontoblastici e metodi di rilevamento; Alcuni di questi marcatori sono espressi anche da altri tessuti.
| Gene o proteina | Metodo | Referenze |
| Fosfatasi alcalina (ALP) | Colorimetrico | 47 48 |
| Immunocitochimica | 20 49 | |
| Macchia settentrionale | 50 | |
| RT-PCR | 51 52 | |
| Decorin (DCN) | ELISA colorimetrica | 53 |
| Immunocitochimica | 54 55 | |
| RT-PCR | 53 56 | |
| Proteina della matrice della dentina 1 (DMP-1) | Citometria a flusso | 57 |
| Immunocitochimica | 58 59 | |
| Macchia settentrionale | 50 60 | |
| RT-PCR | 47 49 | |
| Macchia occidentale | 50 60 | |
| Proteina 2 della matrice della dentina (DMP-2) | Immunocitochimica | 60 61 |
| RT-PCR | 50 62 | |
| Macchia settentrionale | 60 | |
| Macchia occidentale | 62 | |
| Fosfoproteina della dentina (DPP) | Immunocitochimica | 63 |
| Macchia settentrionale | 63 | |
| Dentina Sialoproteina (DSP)* | Immunocitochimica | 20 60 |
| Macchia settentrionale | 60 63 | |
| RT-PCR | 50 | |
| Macchia occidentale | 64 65 | |
| Dentina Sialofosfoproteina (DSPP) | Citometria a flusso | 57 |
| Immunocitochimica | 66 54 | |
| RT-PCR | 47 49 | |
| Macchia settentrionale | 67 68 | |
| Macchia occidentale | 64 62 | |
| Smaltata/Matrice Metalloproteinasi-20 (MMP-20) | Macchia settentrionale | 68 |
| RT-PCR | 49 68 | |
| Nestina | Immunocitochimica | 54 69 |
| RT-PCR | 70 71 | |
| Macchia occidentale | 72 | |
| Osteoaderente (OSAD) | Immunocitochimica | 73 74 |
| Macchia settentrionale | 73 | |
| RT-PCR | 75 | |
| Macchia occidentale | 73 74 | |
| Osteopontina (OPN) | Immunocitochimica | 76 |
| Macchia settentrionale | 50 | |
| RT-PCR | 66 51 | |
| Macchia occidentale | 77 | |
| Osteocalcina (OCN) | Immunocitochimica | 52 |
| Macchia settentrionale | 50 | |
| RT-PCR | 51 52 | |
| Macchia occidentale | 77 78 | |
| Osterix (OSX)/ Fattore di trascrizione Sp7 (Sp7) | Immunocitochimica | 54 58 |
| RT-PCR | 78 | |
| Macchia occidentale | 78 79 | |
| Gene regolatore del fosfato con omologie alle endopeptidasi sul cromosoma X (Phex) | Macchia settentrionale | 68 |
| RT-PCR | 49 68 | |
| Macchia occidentale | 79 | |
| Fattore di trascrizione correlato a Runt 2 (Runx2) | Immunocitochimica | 66 52 |
| RT-PCR | 66 70 | |
| Macchia occidentale | 62 77 | |
| *DPP e DSP sono i prodotti di scissione di DSPP. | ||
Discussione
Questo protocollo è stato progettato prendendo in considerazione la ISO 10993-5, che si riferisce alla valutazione della citotossicità in vitro dei biomateriali che entrano in contatto con i tessuti, per valutare la biocompatibilità e contribuire alla riproducibilità degli studi21. Questa è una preoccupazione crescente nella scienza, e molti autori stanno già seguendo queste raccomandazioni nella progettazione sperimentale dei loro studi in vitro 15,22,23,24,25,26,27,28.
La metodologia proposta è stata selezionata per esaminare gli aspetti più rilevanti della biologia cellulare. Pertanto, questo protocollo va oltre le raccomandazioni, una volta che fornisce un approccio completo per valutare la citotossicità utilizzando saggi comuni e una valutazione complementare, includendo diversi parametri cellulari dal fenotipo alla funzione. Questa valutazione complementare è importante per valutare veramente l'effetto dei biomateriali, una volta che la vitalità potrebbe non tradurre alterazioni a livello di espressione genica e proteica, ciclo cellulare o secretoma.
Gli estratti sono vantaggiosi, in particolare nelle linee cellulari aderenti, perché non vi è alcuna interferenza con l'attaccamento cellulare al substrato e condizioni ottimali di coltura, in contrasto con alcuni approcci di contatto diretto in cui i materiali sono posti sulla superficie della piastra di coltura22,28.
Inoltre, gli estratti consentono l'esposizione cellulare a diverse concentrazioni29, imitando la diffusione di sostanze nei tessuti, che simula la clearance che subiscono in vivo, in particolare quando vengono applicati a contatto con tessuti estremamente irrigati. I test di contatto diretto potrebbero non valutare accuratamente le diverse concentrazioni e i test a contatto indiretto hanno dimostrato potenziali difficoltà con la non diffusione, la diffusione incompleta attraverso le membrane o la reazione con l'agar.
Sono preferibili test che forniscano una valutazione quantitativa, con una riduzione della vitalità cellulare di oltre il 30% considerata citotossica11,30. Nello sviluppo di nuovi biomateriali, se si verifica tale riduzione, determina la necessità di riformulazione o abbandono. Se si ottengono risultati incoraggianti, dovrebbero essere effettuati ulteriori studi che prevedano la valutazione in vivo29,31.
I test in vitro dovrebbero simulare o esagerare le condizioni cliniche. Pertanto, la determinazione dei rapporti di volume superficiale appropriati per la preparazione dell'estratto è fondamentale. Sono stati suggeriti rapporti superficie/volume di 1,25-6 cm2/ml. Nel caso di materiali con irregolarità superficiali come schiume 0,1-0,2 g/ml o 6 cm 2/mL sono un punto di partenza 15,20,2. Il rapporto di 250 mm2per ml di terreno è stato utilizzato nei risultati rappresentativi utilizzati in questo protocollo e in altri studi15,20.
Anche se non utilizzati in questo modo nelle cliniche, i campioni devono essere sterilizzati con metodi che non alterino le loro proprietà. L'irradiazione UV è spesso una buona scelta. Questo è di fondamentale importanza per prevenire la contaminazione microbica delle colture cellulari 11,24,32.
I terreni di estrazione comprendono terreno di coltura cellulare con o senza siero, soluzione fisiologica salina, dimetilsolfossido, o acqua purificata, selezionati in base alle caratteristiche chimiche dei biomateriali11,33. Puntando a studi su colture cellulari, è preferibile l'uso del terreno di coltura cellulare poiché evita ulteriori fasi di elaborazione. Le condizioni per l'estrazione dovrebbero essere adattate al modello sperimentale. Nei risultati rappresentativi mostrati in questo protocollo, il terreno di coltura DMEM integrato con FBS è stato utilizzato per 24 ± 2 ore a 37 ± 1 °C.
Alcuni biomateriali possono lasciare residui nei mezzi di estrazione, che possono influire negativamente sulle colture cellulari. Mentre la filtrazione e le centrifugazioni dovrebbero essere evitate, una possibilità è quella di consentire alle particelle di sedimentare prima dell'uso. Un altro problema è il pH che può subire alterazioni dopo l'estrazione. Poiché non è consigliabile eseguire ulteriori regolazioni11, il pH degli estratti deve essere misurato, registrato e, se necessario, devono essere inclusi controlli aggiuntivi per isolare l'effetto del pH nel disegno sperimentale.
Mentre questo protocollo è stato descritto per colture cellulari aderenti, è possibile eseguire semplici modifiche per utilizzare colture in sospensione. Allo stesso modo, oltre all'utilizzo di biomateriali solidi, è possibile adattare la procedura, essenzialmente le fasi di estrazione, per studiare liquidi, gel o schiume34,35,36,37.
La preparazione di colture cellulari con densità appropriata è fondamentale, specialmente su colture cellulari con alto tasso di duplicazione31. Secondo l'intervallo di densità di semina raccomandato delle celle utilizzate, se sono pianificate incubazioni a lungo termine, è necessario eseguire la riduzione della densità di semina iniziale per evitare i problemi associati all'eccessiva confluenza. Inoltre, materiali altamente citotossici possono richiedere densità iniziali di semina più elevate.
Oltre ai vantaggi della metodologia dell'estratto, non è la scelta migliore per i materiali in cui la valutazione dell'aderenza cellulare è rilevante. In questo caso, gli studi di contatto diretto devono essere eseguiti 38,39,40,41. Sebbene si tratti di un approccio globale, è importante tenere presente che si tratta di una valutazione in vitro, che non riflette totalmente le condizioni in vivo42.
Un biomateriale non dovrebbe solo causare danni al tessuto, ma stimolare alcuni dei processi antinfiammatori e immunomodulanti43,44,45,46. Pertanto, questo protocollo va oltre, con la valutazione dei meccanismi cellulari, compresa la vitalità cellulare e il profilo di morte cellulare, nonché altri meccanismi di sintesi proteica. La valutazione effettuata dovrebbe consentire di concludere sulla bioattività dei biomateriali nei tessuti viventi, oltre che sulla citotossicità.
Con l'esplosione di nuovi materiali per applicazioni mediche, non solo per l'odontoiatria ma anche per l'ortopedia, la chirurgia, l'oftalmologia, la cardiologia, ecc., Gli screening iniziali dovrebbero essere effettuati sistematicamente. Questo protocollo potrebbe essere uno strumento importante per i ricercatori che mirano a sviluppare e caratterizzare nuovi biomateriali.
Divulgazioni
Gli autori non hanno interessi finanziari concorrenti o altri conflitti di interesse.
Riconoscimenti
Si ringraziano per il supporto: GAI 2013 (Faculdade de Medicina da Universidade de Coimbra); CIBB è finanziato da fondi nazionali tramite FCT (Foundation for Science and Technology) attraverso il progetto strategico UIDB/04539/2020 e UIDP/04539/2020 (CIBB). Ringraziamo Jacques Nör, University of Michigan Dental School, per aver fornito la linea cellulare MDPC-23.
Materiali
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CaCl2 | Sigma | 10035-04-8 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| DAB + Chromogen | Dako | K3468 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| DSP (M-20) Antibody, 1: 100 | Santa Cruz Biotechnology | LS-C20939 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Hepes 0.01 M | Sigma | MFCD00006158 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Giemsa Stain, modified GS-500 | Sigma | MFCD00081642 | |
| Glycerol | Dako | C0563 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| May-Grünwald Stain MG500 | Sigma | MFCD00131580 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Polyclonal Rabbit Anti-goat immunoglobulins / HRP, 1: 100 | Dako | G-21234 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Substrate Buffer | Dako | 926605 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| β-actin antibody | Sigma | A5316 |
Riferimenti
- Williams, D. F. On the mechanisms of biocompatibility. Biomaterials. 29 (20), 2941-2953 (2008).
- Bruinink, A., Luginbuehl, R. Evaluation of biocompatibility using in vitro methods: interpretation and limitations. Advances in Biochemical Engineering/Biotechnology. 126, 117-152 (2012).
- Wataha, J. C. Principles of biocompatibility for dental practitioners. The Journal of Prosthetic Dentistry. 86 (2), 203-209 (2001).
- Mishra, S. F. D. A. CE mark or something else?-Thinking fast and slow. Indian Heart Journal. 69 (1), 1-5 (2016).
- Barbeck, M., et al. Balancing Purification and Ultrastructure of Naturally Derived Bone Blocks for Bone Regeneration: Report of the Purification Effort of Two Bone Blocks. Materials. 12 (19), 3234 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- Coelho, C. C., Araújo, R., Quadros, P. A., Sousa, S. R., Monteiro, F. J. Antibacterial bone substitute of hydroxyapatite and magnesium oxide to prevent dental and orthopaedic infections. Materials Science and Engineering: C. 97, 529-538 (2019).
- Jung, O., et al. Improved In Vitro Test Procedure for Full Assessment of the Cytocompatibility of Degradable Magnesium Based on ISO 10993-5/-12. International Journal of Molecular Sciences. 20 (2), 255 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- ISO. I.O. for S. ISO 10993-12:2012 - part 12: Sample preparation and reference materials. ISO. , (2012).
- ISO. I.O. for S. ISO 10993-5:2009 Biological evaluation of medical devices - part 5: Tests for in vitro cytotoxicity. ISO. , (2009).
- Srivastava, G. K., et al. Comparison between direct contact and extract exposure methods for PFO cytotoxicity evaluation. Scientific Reports. 8 (1), 1425 (2018).
- Pusnik, M., Imeri, M., Deppierraz, G., Bruinink, A., Zinn, M. The agar diffusion scratch assay--A novel method to assess the bioactive and cytotoxic potential of new materials and compounds. Scientific Reports. 6, 20854 (2016).
- Spiller, K. L., et al. The role of macrophage phenotype in vascularization of tissue engineering scaffolds. Biomaterials. 35 (15), 4477-4488 (2014).
- Zhou, H., et al. In Vitro Cytotoxicity Evaluation of a Novel Root Repair Material. Journal of Endodontics. 39 (4), 478-483 (2013).
- Bordron, A., et al. The binding of some human antiendothelial cell antibodies induces endothelial cell apoptosis. Journal of Clinical Investigation. 101 (10), 2029-2035 (1998).
- Palmini, G., et al. Establishment of Cancer Stem Cell Cultures from Human Conventional Osteosarcoma. Journal of Visualized Experiments. (116), e53884 (2016).
- Gregory, C. A., Grady Gunn, W., Peister, A., Prockop, D. J. An Alizarin red-based assay of mineralization by adherent cells in culture: comparison with cetylpyridinium chloride extraction. Analytical Biochemistry. 329 (1), 77-84 (2004).
- Cai, S., Zhang, W., Chen, W. PDGFRβ+/c-kit+ pulp cells are odontoblastic progenitors capable of producing dentin-like structure in vitro and in vivo. BMC Oral Health. 16 (1), 113 (2016).
- Paula, A., et al. Biodentine Boosts, WhiteProRoot MTA Increases and Life Suppresses Odontoblast Activity. Materials. 12 (7), 1184 (2019).
- Chander, N. G. Standardization of in vitro studies. Journal of Indian Prosthodontic Society. 16 (3), 227-228 (2016).
- Cavalcanti, B. N., Rode de M, S., França, C. M., Marques, M. M. Pulp capping materials exert an effect on the secretion of IL-1β and IL-8 by migrating human neutrophils. Brazilian Oral Research. 25 (1), 13-18 (2011).
- Chang, S., Lee, S. Y., Ann, H. J., Kum, K. Y., Kim, E. C. Effects of calcium silicate endodontic cements on biocompatibility and mineralization-inducing potentials in human dental pulp cells. Journal of Endodontics. 40 (8), 1194-1200 (2014).
- Daltoé, M. O., Paula-Silva, F. W. G., Faccioli, L. H., Gatón-Hernández, P. M., De Rossi, A., Bezerra Silva, L. A. Expression of Mineralization Markers during Pulp Response to Biodentine and Mineral Trioxide Aggregate. Journal of Endodontics. 42 (4), 596-603 (2016).
- Elias, R. V., Demarco, F. F., Tarquinio, S. B. C., Piva, E. Pulp responses to the application of a self-etching adhesive in human pulps after controlling bleeding with sodium hypochlorite. Quintessence International. 38 (2), 67-77 (2007).
- Huang, G. T. J., Shagramanova, K., Chan, S. W. Formation of odontoblast-like cells from cultured human dental pulp cells on dentin in vitro. Journal of endodontics. 32 (11), 1066-1073 (2006).
- Jafarnia, B., et al. Evaluation of cytotoxicity of MTA employing various additives. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology. 107 (5), 739-744 (2009).
- Paranjpe, A., Smoot, T., Zhang, H., Johnson, J. D. Direct contact with mineral trioxide aggregate activates and differentiates human dental pulp cells. Journal of Endodontics. 37 (12), 1691-1695 (2011).
- Spagnuolo, G., et al. In vitro cellular detoxification of triethylene glycol dimethacrylate by adduct formation with N-acetylcysteine. Dental Materials. 29 (8), 153-160 (2013).
- Murray, P. E., García Godoy, C., García Godoy C, F. How is the biocompatibilty of dental biomaterials evaluated. Medicina Oral, Patologia Oral y Cirugia Bucal. 12 (3), 258-266 (2007).
- Hanks, C. T., Wataha, J. C., Sun, Z. In vitro models of biocompatibility: a review. Dental Materials. 12 (3), 186-193 (1996).
- Eid, A. A., et al. In Vitro Biocompatibility and Oxidative Stress Profiles of Different Hydraulic Calcium Silicate Cements. Journal of Endodontics. 40 (2), 255-260 (2014).
- Nocca, G., et al. Effects of ethanol and dimethyl sulfoxide on solubility and cytotoxicity of the resin monomer triethylene glycol dimethacrylate. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 100 (6), 1500-1506 (2012).
- Abuarqoub, D., Aslam, N., Jafar, H., Abu Harfil, Z., Awidi, A. Biocompatibility of Biodentine with Periodontal Ligament Stem Cells: In Vitro Study. Dentistry Journal. 8 (1), 17 (2020).
- Coelho, A. S., et al. Cytotoxic effects of a chlorhexidine mouthwash and of an enzymatic mouthwash on human gingival fibroblasts. Odontology. 108 (2), 260-270 (2020).
- Wang, M. O., et al. Evaluation of the In Vitro Cytotoxicity of Cross-Linked Biomaterials. Biomacromolecules. 14 (5), 1321-1329 (2013).
- Tyliszczak, B., Drabczyk, A., Kudłacik-Kramarczyk, S., Bialik-Wąs, K., Sobczak-Kupiec, A. In vitro cytotoxicity of hydrogels based on chitosan and modified with gold nanoparticles. Journal of Polymer Research. 24 (10), 153 (2017).
- Widbiller, M., et al. Three-dimensional culture of dental pulp stem cells in direct contact to tricalcium silicate cements. Clinical Oral Investigations. 20 (2), 237-246 (2016).
- Pintor, A. V. B., et al. In Vitro and In Vivo Biocompatibility of ReOss in Powder and Putty Configurations. Brazilian Dental Journal. 29 (2), 117-127 (2018).
- Pellissari, C. V. G., et al. In Vitro Toxic Effect of Biomaterials Coated with Silver Tungstate or Silver Molybdate Microcrystals. Journal of Nanomaterials. 2020, 1-9 (2020).
- Collado-González, M., et al. Cytotoxicity and bioactivity of various pulpotomy materials on stem cells from human exfoliated primary teeth. International Endodontic Journal. 50, 19-30 (2017).
- Paula, A., et al. Direct Pulp Capping: Which is the Most Effective Biomaterial? A Retrospective Clinical Study. Materials. 12 (20), 3382 (2019).
- Williams, D. F. There is no such thing as a biocompatible material. Biomaterials. 35 (38), 10009-10014 (2014).
- Schuh, J. C. L. Medical device regulations and testing for toxicologic pathologists. Toxicologic Pathology. 36 (1), 63-69 (2008).
- Pizzoferrato, A., et al. Cell culture methods for testing Biocompatibility. Clinical Materials. 15 (3), (1994).
- Pereira Paula, A. B., et al. Direct pulp capping: what is the most effective therapy? - review and meta-analysis. Journal of Evidence Based Dental Practice. , (2018).
- Caiaffa, K. S., et al. Effect of analogues of cationic peptides on dentin mineralization markers in odontoblast-like cells. Archives of Oral Biology. 103, 19-25 (2019).
- Fujiwara, S., Kumabe, S., Iwai, Y. Isolated rat dental pulp cell culture and transplantation with an alginate scaffold. Okajimas Folia Anatomica Japonica. 83 (1), 15-24 (2006).
- Nakashima, M., et al. Stimulation of Reparative Dentin Formation by Ex Vivo Gene Therapy Using Dental Pulp Stem Cells Electrotransfected with Growth/differentiation factor 11 (Gdf11). Human Gene Therapy. 15 (11), 1045-1053 (2004).
- Narayanan, K., et al. Differentiation of embryonic mesenchymal cells to odontoblast-like cells by overexpression of dentin matrix protein 1. Proceedings of the National Academy of Sciences of the United States of America. 98 (8), 4516-4521 (2001).
- Kim, H. J., Yoo, J. H., Choi, Y., Joo, J. Y., Lee, J. Y., Kim, H. J. Assessing the effects of cyclosporine A on the osteoblastogenesis, osteoclastogenesis, and angiogenesis mediated by the human periodontal ligament stem cells. Journal of Periodontology. , (2019).
- Bou Assaf, R., et al. Healing of Bone Defects in Pig's Femur Using Mesenchymal Cells Originated from the Sinus Membrane with Different Scaffolds. Stem Cells International. , (2019).
- He, W., et al. Lipopolysaccharide enhances decorin expression through the toll-like receptor 4, myeloid differentiating factor 88, nuclear factor-kappa B, and mitogen-activated protein kinase pathways in odontoblast cells. Journal of Endodontics. 38 (4), 464-469 (2012).
- Xiong, Y., et al. Wnt Production in Dental Epithelium Is Crucial for Tooth Differentiation. Journal of Dental Research. 98 (5), 580-588 (2019).
- Haruyama, N., et al. Genetic evidence for key roles of decorin and biglycan in dentin mineralization. Matrix Biology. 28 (3), 129-136 (2009).
- Sreenath, T., et al. Dentin Sialophosphoprotein Knockout Mouse Teeth Display Widened Predentin Zone and Develop Defective Dentin Mineralization Similar to Human Dentinogenesis Imperfecta Type III. Journal of Biological Chemistry. 278 (27), 24874-24880 (2003).
- Yang, Y., Zhao, Y., Liu, X., Chen, Y., Liu, P., Zhao, L. Effect of SOX2 on odontoblast differentiation of dental pulp stem cells. Molecular Medicine Reports. 16 (6), 9659-9663 (2017).
- Tao, H., et al. Klf4 Promotes Dentinogenesis and Odontoblastic Differentiation via Modulation of TGF-β Signaling Pathway and Interaction With Histone Acetylation. Journal of Bone and Mineral Research. 34 (8), 1502-1516 (2019).
- Massa, L. F., Ramachandran, A., George, A., Arana-Chavez, V. E. Developmental appearance of dentin matrix protein 1 during the early dentinogenesis in rat molars as identified by high-resolution immunocytochemistry. Histochemistry and Cell Biology. 124 (3-4), 197-205 (2005).
- Hao, J., Zou, B., Narayanan, K., George, A. Differential expression patterns of the dentin matrix proteins during mineralized tissue formation. Bone. 34 (6), 921-932 (2004).
- Tompkins, K., Alvares, K., George, A., Veis, A. Two related low molecular mass polypeptide isoforms of amelogenin have distinct activities in mouse tooth germ differentiation in vitro. Journal of Bone and Mineral Research. 20 (2), 341-349 (2005).
- Zhai, Y., et al. Activation and Biological Properties of Human β Defensin 4 in Stem Cells Derived From Human Exfoliated Deciduous Teeth. Frontiers in Physiology. 10, (2019).
- Bègue-Kirn, C., Ruch, J. V., Ridall, A. L., Butler, W. T. Comparative analysis of mouse DSP and DPP expression in odontoblasts, preameloblasts, and experimentally induced odontoblast-like cells. European Journal of Oral Sciences. 106, 254-259 (1998).
- Kikuchi, H., Suzuki, K., Sakai, N., Yamada, S. Odontoblasts induced from mesenchymal cells of murine dental papillae in three-dimensional cell culture. Cell and Tissue Research. 317 (2), 173-185 (2004).
- Li, X., Yang, G., Fan, M. Effects of homeobox gene distal-less 3 on proliferation and odontoblastic differentiation of human dental pulp cells. Journal of Endodontics. 38 (11), 1504-1510 (2012).
- Chen, S., et al. Differential regulation of dentin sialophosphoprotein expression by Runx2 during odontoblast cytodifferentiation. Journal of Biological Chemistry. 280 (33), 29717-29727 (2005).
- Narayanan, K., Gajjeraman, S., Ramachandran, A., Hao, J., George, A. Dentin matrix protein 1 regulates dentin sialophosphoprotein gene transcription during early odontoblast differentiation. Journal of Biological Chemistry. 281 (28), 19064-19071 (2006).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. A substractive PCR-based cDNA library from human odontoblast cells: identification of novel genes expressed in tooth forming cells. Matrix Biology. 19 (5), 421-430 (2000).
- Miyazaki, T., Baba, T., Mori, T., Komori, T. Collapsin Response Mediator Protein 1, a Novel Marker Protein for Differentiated Odontoblasts. Acta Histochemica et Cytochemica. 51 (6), 185-190 (2018).
- Yokoi, M., Kuremoto, K., Okada, S., Sasaki, M., Tsuga, K. Effect of attenuation of fibroblast growth factor receptor 2b signaling on odontoblast differentiation and dentin formation. In Vitro Cellular and Developmental Biology - Animal. 55 (3), 211-219 (2019).
- Tohma, A., et al. Glucose Transporter 2 and 4 Are Involved in Glucose Supply during Pulpal Wound Healing after Pulpotomy with Mineral Trioxide Aggregate in Rat Molars. Journal of Endodontics. , (2019).
- Sueyama, Y., Kaneko, T., Ito, T., Kaneko, R., Okiji, T. Implantation of Endothelial Cells with Mesenchymal Stem Cells Accelerates Dental Pulp Tissue Regeneration/Healing in Pulpotomized Rat Molars. Journal of Endodontics. 43 (6), 943-948 (2017).
- Petersson, U., Hultenby, K., Wendel, M. Identification, distribution and expression of osteoadherin during tooth formation. European Journal of Oral Sciences. 111 (2), 128-136 (2003).
- Couble, M. L., et al. Immunodetection of osteoadherin in murine tooth extracellular matrices. Histochemistry and Cell Biology. 121 (1), 47-53 (2004).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. Expression of the small leucine-rich proteoglycan osteoadherin/osteomodulin in human dental pulp and developing rat teeth. Bone. 27 (2), 265-270 (2000).
- Salmon, B., et al. Abnormal osteopontin and matrix extracellular phosphoglycoprotein localization, and odontoblast differentiation, in X-linked hypophosphatemic teeth. Connective Tissue Research. 55, 79-82 (2014).
- Liao, C., Ou, Y., Wu, Y., Zhou, Y., Liang, S., Wang, Y. Sclerostin inhibits odontogenic differentiation of human pulp-derived odontoblast-like cells under mechanical stress. Journal of Cellular Physiology. 234 (11), 20779-20789 (2019).
- Deng, X., et al. The combined effect of oleonuezhenide and wedelolactone on proliferation and osteoblastogenesis of bone marrow mesenchymal stem cells. Phytomedicine. 153103, (2019).
- Choi, H., Kim, T. H., Yun, C. Y., Kim, J. W., Cho, E. S. Testicular acid phosphatase induces odontoblast differentiation and mineralization. Cell and Tissue Research. 364 (1), 95-103 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon