Method Article
生体材料に対する細胞毒性と細胞応答へのアクセス
* これらの著者は同等に貢献しました
要約
この方法論は、フローサイトメトリー、RT-PCR、免疫細胞化学、およびその他の細胞および分子生物学的手法を含む生存率アッセイおよび表現型分析を使用して、可溶性抽出物の調製を通じて生体材料の細胞毒性を評価することを目的としています。
要約
生体材料はヒト組織と直接的または間接的に接触するため、その細胞毒性を評価することが重要です。この評価はいくつかの方法で実行できますが、使用するアプローチの間に大きな不一致が存在し、再現性と得られた結果の比較が損なわれます。本論文では、歯科用生体材料に使用する可溶性抽出物を用いて生体材料の細胞毒性を評価するためのプロトコルを提案する。抽出物の調製は、ペレットの製造から培養培地での抽出まで、詳細に説明されています。生体材料の細胞毒性評価は、MTTアッセイを使用した代謝活性、スルホルホダミンB(SBR)アッセイを使用した細胞生存率、フローサイトメトリーを使用した細胞死プロファイル、およびMay-Grünwald Giemsaを使用した細胞形態に基づいています。細胞毒性評価に加えて、免疫細胞化学およびPCRによって評価された特異的マーカーの発現に基づいて細胞機能を評価するためのプロトコルが記載されている。このプロトコルは、抽出物の方法論を使用して、再現性のある堅牢な方法で、生体材料の細胞毒性および細胞効果評価のための包括的なガイドを提供します。
概要
生体適合性は、局所的および全身的な損傷のない、組織を統合し、好ましい治療反応を誘発する材料の能力として定義することができます1,2,3。生体適合性評価は、医療用材料の開発に不可欠です。したがって、このプロトコルは、新しい生体材料の開発を目指す、または既存の生体材料の新しいアプリケーションの研究を目指すすべての研究者に体系的かつ包括的なアプローチを提供します。
in vitro細胞毒性試験は、初代細胞培養または細胞株を用いた生体適合性評価の第1段階として広く使用されています。結果は、潜在的な臨床応用の最初の指標を構成します。この試験は、生体材料の開発に不可欠であることに加えて、EUAおよびEU規制当局(FDAおよびCE認証)4,5,6,7,8からの市場導入に関する現在の規制に準拠するために必須です。さらに、生物医学研究における標準化された試験は、類似の生体材料またはデバイスに関する異なる研究からの結果の再現性および比較の点で大きな利点を提供する9。
国際標準化機構(ISO)のガイドラインは、正確で再現性のある方法で材料を試験するために、複数の独立した商業、規制、および学術研究所で広く使用されています。ISO 10993-5はin vitro細胞毒性評価を指し、ISO 10993-12はサンプリング調製10,11に報告しています。生体材料試験には、材料の種類、接触組織、および治療目標に応じて選択される3つのカテゴリが提供されます:抽出物、直接接触、および間接接触8,11,12,13。抽出物は、細胞培養培地を生体材料で濃縮することによって得られる。直接接触試験のためには、生体材料を細胞培養物上に直接配置し、そして、間接接触において、細胞とのインキュベーションをアガロースゲル11などの障壁によって分離して行う。適切なコントロールが必須であり、少なくとも3つの独立した実験を実行する必要があります5、8、10、11、14。
細胞毒性の可能性を判断するには、臨床状態をシミュレートまたは誇張することが重要です。抽出物試験の場合、材料の表面積。 中程度の量;培地および材料pH;材料の溶解度、浸透圧および拡散比。攪拌、温度、時間などの抽出条件は、培地濃縮に影響を与える5。
この方法論により、固体および液体の両方のいくつかの医薬製剤の細胞毒性の定量的および定性的評価が可能になります。中性赤色取り込み試験、コロニー形成試験、MTTアッセイ、およびXTTアッセイ5、10、14などのいくつかのアッセイを実施することができる。
発表されたほとんどの細胞毒性評価研究では、より単純なアッセイ、すなわちMTTおよびXTTが使用されており、限られた情報しか提供されない。生体適合性の評価には、細胞毒性の評価だけでなく、このプロトコルが承認しているように、特定の試験材料の生物活性も含まれる必要があります2。正当化され、文書化されている場合は、追加の評価基準を使用する必要があります。したがって、このプロトコルは、生体材料の細胞毒性評価のための一連の方法を詳述した包括的なガイドを提供することを目的としています。さらに、さまざまな細胞プロセス、すなわち細胞死の種類、細胞形態、特定のタンパク質の合成における細胞機能、および特定の組織産生の評価について説明します。
プロトコル
1.ペレットの準備
- PVCプレートに既知寸法の円形の穴を開けることにより、ポリ塩化ビニル(PVC)型を作製する。
注意: PVC成形品はさまざまなサイズで作ることができます。式 A= h(2πr)+2πr2 (r: 円柱の半径、h: 円柱の高さ) を使用して、PVC 金型の接触面を計算します。 - 製造元の指示に従って、実験の開始にできるだけ近いところで試験する生体材料を準備します。
注:ペースト/ペースト製剤の生体材料の調製のために、適切な量のベースペーストと触媒を混合スパチュラで手動で混合します。液体および粉末の配合に基づく他の材料については、製造元の指示に従うか、新しい材料に適した指示に従って、手動のへらまたは振動を伴う機械的混合を実行する必要があります。液体材料の場合、このステップは必要ありません。手順 2 でプロトコルを開始します。 - へらで型の上に生体材料を置き、適切な時間に設定します。
注意: 生体材料の硬化時間と設定条件は、製造元の指示に従うか、新しい材料に適している必要があります。 - 固めた後、生体材料のペレットをPVC型から取り出し、容器に入れます(6ウェルプレートまたはペトリ皿を使用できます)。
- ペレットを紫外線(UV)ランプの下に各面で20分間置き、滅菌します。
2. 生体材料抽出物の入手
注意: すべての手順は、厳格な無菌条件下で実行する必要があります。
- 1.1に記載の式に基づいてペレット表面積を計算して、必要なペレット数を決定します。
注:基準値として、250 mm2 / mL 11,15の接触表面積は、培地1mLあたり9ペレット(r 3 mm x h 1.5 mm)を添加することによって達成されます。 - 可溶性抽出物(生体材料が豊富な抽出物)を調製する。
- ペレットを50 mLチューブに入れ、対応する細胞培養培地を加えます。チューブを37°のインキュベーターに24時間、一定の回転で置きます。
注:細胞培養に適した細胞培養培地を使用してください。 - 24時間後、インキュベーターからチューブを取り外します。この時点で、抽出物は1/1または100%の濃度に対応する。
- 等量のコンディショニング培地を細胞培養培地に順次添加することにより、抽出物の希釈を行います。
注意: メディアのpH調整は行わないでください。- 100%抽出物1mLに培養液1mLを加え、50%抽出物を得た。50%抽出物1 mLに培地1 mLを加えて25%抽出物を得る、以下同様です(図1)。
注:各化合物に関連する濃度を使用してください。
- 100%抽出物1mLに培養液1mLを加え、50%抽出物を得た。50%抽出物1 mLに培地1 mLを加えて25%抽出物を得る、以下同様です(図1)。
- ペレットを50 mLチューブに入れ、対応する細胞培養培地を加えます。チューブを37°のインキュベーターに24時間、一定の回転で置きます。

図1:可溶性抽出物の調製および希釈のスキーム。この図の拡大版を表示するには、ここをクリックしてください。
3. 生体材料抽出物を用いた細胞インキュベーション
- 細胞懸濁液を調製し、実験に必要な細胞数に応じて、マルチウェルプレートなどの適切な細胞容器にプレートします。
- 80%〜90%のコンフルエントを有する所望の細胞のフラスコから始める。
- 細胞培養培地を廃棄し、リン酸緩衝生理食塩水(PBS)で洗浄し、トリプシン-EDTA(75 cm 2細胞培養フラスコの場合は1〜2 mL)で細胞を剥離します。
- 細胞培養培地(75 cm 2細胞培養フラスコの場合は2 〜4 mL)を加え、細胞懸濁液をチューブに移し、200 x g で5分間遠心分離します。
- ペレットを既知量の細胞培養培地に懸濁します。
注:このプロトコルは、接着細胞培養の使用用に設計されています。ただし、浮遊細胞培養で機能するように簡単に適応させることができます。 - 血球計算盤で細胞を数え、細胞懸濁液の細胞濃度を計算します。
- 決定された量の細胞懸濁液を培地に懸濁し、マルチウェルディッシュに移します。播種密度の基準値として、5 – 20 x 105 セル/ cm2を検討してください。
注:適切な細胞数は、細胞の種類と細胞特性、つまり細胞倍加時間に応じて計算する必要があります。
- 細胞を24時間インキュベートして、細胞接着を可能にします。
- この期間の後、可溶性抽出物を培養プレートに投与する。
- 細胞培養培地を吸引する。
- 前述のように、濃度の順序に従って、生体材料の抽出物を各ウェルに追加します。新鮮な細胞培養培地をコントロールウェルに加えます。
- プレートを24時間以上インキュベートします。
注:ネガティブコントロールは、培養液中に維持されている未処理の細胞に対応する各アッセイで実行する必要があります。インキュベーション時間は、研究目標に応じて選択できます。
4.代謝活性の評価
- 生体材料の抽出物との細胞インキュベーションの後、プレートから培地を吸引し、各ウェルPBSを洗浄します。
- PBS、pH 7.4で調製した0.5 mg/mL 3-(4,5-ジメチルチアゾール-2-イル)-2,5-ジフェニルテトラゾールブロミド(MTT)を各ウェルに入れます。
- プレートを4時間または37°Cの暗所で一晩インキュベートする。
- 得られたホルマザン結晶を可溶化するために、イソプロパノール中の塩酸の0.04M溶液の適量を各ウェルに加え、プレートを30分間撹拌する。
注:ウェルのサイズに応じて、MTTとイソプロパノールの量を調整してください。 - 必要に応じて、結晶が見られなくなるまで上下にピペッティングして、各ウェルの内容物を攪拌および均質化します。
- 分光光度計で、620 nmのリファレンスフィルターを使用して波長570 nmの吸光度を定量します。
- 代謝活性を計算するには、処理した細胞の吸光度を対照培養物の吸光度で割ります。パーセンテージ値を取得するには、100を掛けます。
5. 細胞死評価
注:この評価を実行するには、条件ごとに最低10個の6 セルを使用する必要があります。
- 評価される条件に応じて、適切に識別された遠心チューブを使用してください。
- 生体材料の抽出物との細胞インキュベーションの後、培養液をそれぞれのチューブに集めます。
- 細胞を剥離し、細胞懸濁液をそれぞれのチューブに加えます。
- 細胞懸濁液を120 x g で5分間遠心分離して濃縮します。
- ペレットをPBSで洗浄します。1,000 x g で5分間遠心分離することにより、PBSを除去します。
- 1 mLのPBSを添加し、細胞ペレットを同定したサイトメトリーチューブに移します。
- 1,000 x g で5分間遠心分離することにより、PBSを除去します。
- 100 μLの結合バッファー(0.01 M HEPES、0.14 mM NaCl、0.25 mM CaCl2)16でインキュベートし、細胞膜を回収するために細胞を約15分間休止させます。
- 蛍光標識されたアネキシンV2.5 μLとヨウ化プロピジウム1 μLを室温暗所で15分間加えます。
- インキュベーション後、400 μLのPBSを添加し、サイトメーターで分析します。情報の分析と定量化には、適切なソフトウェアを使用してください。
- 生細胞、アポトーシス、後期アポトーシス/壊死、および壊死の割合として結果を提示します。
6. 形態評価
- マルチウェルプレート内に収まる滅菌ガラスカバーガラスの適切なサイズを選択してください。
- 滅菌ピンセットを使用して各スライドをウェルに入れます。
- 細胞懸濁液を適切な濃度でウェルに分配し、95%の空気と5%のCO 2を含む加湿雰囲気下で37°Cのインキュベーターで一晩放置します。
- 前述のように、細胞培養物を抽出物にさらします。
- メディアを吸引し、PBSで洗浄します。
- カバーガラスを室温で乾燥させてから、カバーガラスを覆うのに十分な量のメイ・グリューンヴァルト溶液を加えます。3分間インキュベートします。
- 染料を取り除き、蒸留水で1分間洗浄します。
- 水を取り除き、カバーガラスを覆うのに十分な量のギムザ溶液を追加します。15分間インキュベートします。
- カバーガラスを流水で洗います。
- カバーガラスをスライドに転送します。
- 顕微鏡で見てください。選択した倍率で写真を撮ります。
7. 逆転写ポリメラーゼ連鎖反応(RT-PCR)による細胞機能評価
注: この評価を実行するには、条件ごとに最低 2x106 セル を使用する必要があります。一例として、アルカリホスファターゼは、歯芽細胞活性評価のための関心のある遺伝子として提示される。関心のある他の遺伝子を 表1に見ることができる。
- 上記のように細胞をプレートします。
注:播種する細胞の濃度は、研究対象の生体材料の細胞タイプと細胞毒性に応じて調整する必要がある場合があります。 - 上記のように、可溶性抽出物と一緒にインキュベートします。
- 細胞を剥離し、前述のように懸濁液を得る。
- 細胞をPBSで2回洗浄する。この遠心分離機では、室温で5分間200 x gで。
- ペレットを1 mLのRNA精製溶液(NZYolなど)に懸濁し、激しく攪拌し、連続したピペッティングを行うことにより、細胞を溶解します。
- サンプルを室温で5分間インキュベートします。
- 200 μLのクロロホルムを加え、チューブを手で15秒間振とうします。
- 室温で3分間インキュベートします。
- 遠心分離機は、4°Cで12,000 x gで15分間溶解します。この遠心分離中、2つの相がサンプルに由来し、RNAは水性(上)相に残ります。
- 水相を新しいチューブに移し、500 μLの冷イソプロパノールを加えてRNAを沈殿させます。
- サンプルを室温で10分間インキュベートし、12,000 x g で4°Cで10分間遠心分離します。
- 上清を除去し、7,500 x g で4°Cで5分間遠心分離することにより、ペレットを1 mLの75%エタノールで洗浄します。
- エタノールが蒸発するまでペレットを室温で乾燥させる。
- RNaseフリーの水に懸濁します。
- 波長260 nmおよび280 nmで、吸収分光光度法を使用してサンプルの純度を定量および決定します。RNAの純度を決定し、純度比(A260/280)が約2.0のサンプルを使用します。
- サンプルは-80°Cで保存してください。
- 製造元のプロトコル17に従ってRT-PCRの実行に進みます。
注:研究の目標に応じて、評価する特定のマーカーを選択します。
8. タンパク質同定による細胞機能評価
注:研究目標に応じて、評価する特定のタンパク質を選択します。一例として、象牙質シアロタンパク質(DSP)は、歯芽細胞活性評価のための関心のあるタンパク質として提示される。関心のある他のタンパク質は 、表1に見ることができます。
- カバーガラスで細胞を培養し、前述のように抽出物にさらします。
- 細胞培養物をPBSで洗浄する。
- 室温で30分間3.7%パラホルムアルデヒドで固定します。
- PBSで2回洗ってください。
- PBS中の0.5%トリトンで15分間透過処理します。
- ペルオキシダーゼをPBS中の0.3%過酸化水素で5分間ブロックします。
- PBSで2回洗ってください。
- 0.5%ウシ血清アルブミン(BSA)で2回洗浄します。
- 細胞培養を2%BSAで45分間ブロックします。
- PBS中の0.5%BSAで洗浄します。
- 選択したタンパク質に応じた一次抗体で培養物を室温で60分間インキュベートします。
注:このプロトコルは、一次抗体DSP(M20)抗体(1:100)と二次抗体ポリクローナルウサギ抗ヤギ免疫グロブリン/ HRP(1:100)を使用します。 - PBS中の0.5%BSAで5回洗浄します。
- 二次抗体とともに室温で90分間インキュベートします。
注:PBS中の0.5%BSAを使用して抗体希釈を行います。 - PBS中の0.5%BSAで各洗浄で1分間5回洗浄します。
- 基質と色原体混合物を20 μLのクロモゲン/mL基質の濃度で25分間インキュベートします。
- PBS中の0.5%BSAで2回洗浄する。
- ヘマトキシリンで15分間対比染色する。
- 0.037 mol/Lのアンモニアと蒸留水のシーケンスで5分間洗浄し、余分な染料を除去します。
- スライドにカバーガラスを取り付けます。封入剤としてグリセロールを使用してください。
- 一晩乾燥させます。
- 顕微鏡で見てください。選択した倍率で写真を撮ります。
9.アリザリンレッドSアッセイによる石灰化評価
- アリザリンレッドS溶液を40mMの濃度で調製する18。ホモジナイズ用の溶液を暗所で12時間攪拌します。
注:アリザリンレッドS溶液100 mLを調製するには、1.44 gのアリザリン粉末(分子量:360 g / mol)を光から保護された超純水に可溶化します。このソリューションでは、pH値が重要であり、4.1〜4.3である必要があります。 - 上記のように、可溶性抽出物を用いて細胞培養物をインキュベートする。
- 細胞培養物をPBSで3回洗浄します。
- 室温で15分間4%パラホルムアルデヒドで固定します。
- PBSで3回洗ってください。
- アリザリンレッド染色液で37°C暗所で20分間染色します。
- 染色後、プレートをPBSで洗浄して余分な染料を除去します。
- 顕微鏡で見てください。選択した倍率で写真を撮ります。
- 10%(w/v)酢酸と20%(w/v)メタノールからなる抽出溶液を各ウェルに加え、室温で40分間攪拌します。
- 分光光度計19で波長490nmの吸光度を測定する。
結果
ここでの代表的な結果は、歯科用生体材料の研究に関するものです。抽出物の方法論により、代謝活性(図2)、細胞生存率、細胞死プロファイルと細胞形態(図3)、および特定のタンパク質発現(図4)への影響に関して、歯科材料に曝露した後の細胞毒性プロファイルと細胞機能を得ることができます。
MTTアッセイは、材料の細胞毒性の概要を簡単な方法ですばやく得るために使用されます。2つ以上の材料を比較することができます(図2)。低濃度(6.25%)および中濃度(50%)の場合でも、代謝活性の大幅な低下は、より高い毒性を示します(図2a)。同時に、細胞毒性の低い物質は、より軽いか、または還元されない(図2b)。異なる時点間の比較により、より即時の細胞毒性効果または後の段階で決定することができます。
細胞生存率への影響は、生細胞の減少に関する重要な情報を提供し、有害な影響の後に回復する組織の能力を損なう可能性があります。生細胞の割合の決定は、材料の細胞毒性を比較することを可能にする。より多くの細胞傷害性物質は、同じ濃度に対してより高い細胞死を誘導する(図3aおよび3b)。30%を超える削減は重要であり、生体適合性が低いリスクのある材料を定義します(図3a)。この情報は、細胞死プロファイルで完成します(図3aおよび3b)。代表的な結果では、細胞毒性物質が多いほど細胞生存率の低下が強調され、アポトーシスおよび壊死細胞死プロファイルが促進されますが(図3a)、細胞毒性の低い物質は細胞死が少なく、アポトーシス性および後期アポトーシスプロファイルが高くなります(図3b)。
細胞形態評価(図3c)から得られた情報は、細胞生存率評価を補完する。細胞の典型的な形態からの変化は、アポトーシスまたは壊死性プロファイルを示すことができる16。また、物質粒子の観察など、このプロトコルから追加情報を得ることができます(赤い矢印、 図3C)。
細胞機能の基本となる特異的マーカーは、抽出物曝露の影響を受け、免疫組織化学、PCR、フローサイトメトリー、ブロッティング、または比色アッセイなどのいくつかの技術によって評価することができる(表1)。抽出物への曝露後のDSP発現の代表的な結果を 図4aに示し、いくつかの材料(三カルシウムシリケートセメント)が細胞を刺激してタンパク質発現を増加させることがわかる。対照的に、他のもの(水酸化カルシウムセメント)は、生存率の損失とは無関係に、タンパク質発現の有意な減少を促進する。どちらの場合も、抽出物の濃度はタンパク質発現に直接影響します。
歯芽細胞表現型のMDPC-23細胞株では、石灰化沈着物の形成が特徴的である。石灰化堆積物の同定と定量のためのプロトコルは、このタイプの特殊細胞の特定の機能を評価することを可能にします。提示されたケースでは、細胞毒性が低いことに加えて、石灰化沈着物の増加が観察されると、三カルシウムケイ酸塩セメントが細胞機能を刺激することが観察されました(図4b)。反対に、より細胞毒性の高い水酸化カルシウムセメントは、細胞の障害と死によるミネラル沈着の減少につながりました(図4b)。定性的評価に加えて、定量的決定を行うことができます(図4c)。
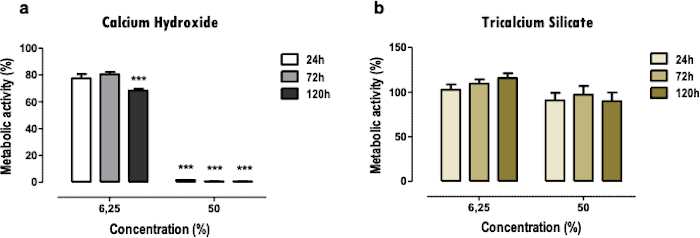
図2:代謝活動。 水酸化カルシウムセメント[a]および三カルシウムシリケートセメント[b]で処理したMDPC-23細胞の24、72、および120時間の可溶性抽出物の代謝活性。結果は、100%の値で、対照細胞培養物に対して正規化される。有意差は*で表され、*はp<0.05、**はp<0.01、***はp<0.001を意味します。この図の一部は、出版社20の許可を得て以前の出版物から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
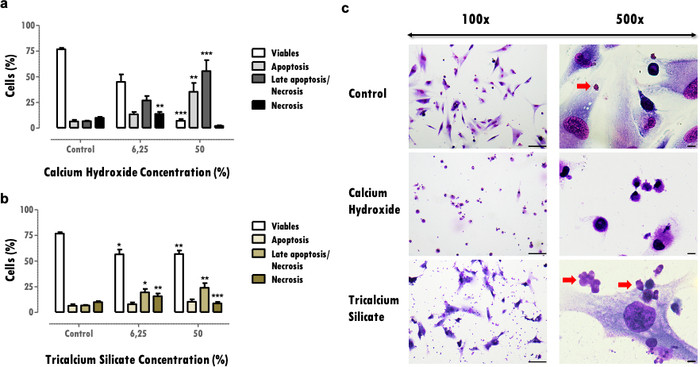
図3:細胞生存率、死プロファイル、および細胞形態。 MDPC-23細胞の細胞生存率、細胞死プロファイル、および細胞形態は、120時間の曝露後、6.25%および50%の濃度で水酸化カルシウムおよびケイ酸三カルシウム生体材料で処理されました。 a)および b)結果は、アポトーシス、遅発性アポトーシスまたは壊死、および壊死における生細胞の割合としてプロットされる。対照に関して、または条件間の有意差は*で表され、*はp <0.05を意味し、**はp <0.01を意味し、***はp <0.001を意味します。 c)50%濃度の生体材料可溶性抽出物で処理した後、メイ・グリュンヴァルト・ギムザで染色された細胞。対照群は、10%FBSを有するDMEMで培養中の細胞を表す。左の列の画像は100倍の倍率で取得され、右側の列の画像は500倍の倍率で取得されました。図中のバーは100μmを表す。この図の一部は、出版社20の許可を得て以前の出版物から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
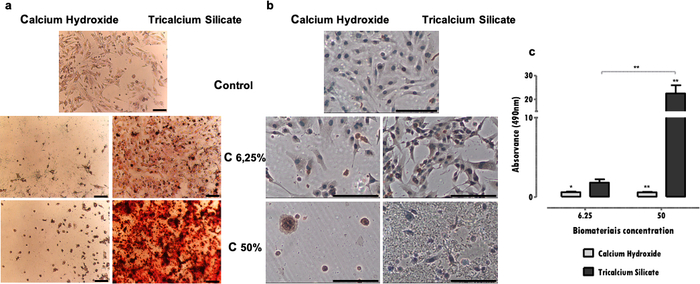
図4:DSP発現と鉱化結節形成。 a)96時間のインキュベーション後に50%および6.25%の濃度で水酸化カルシウムおよびケイ酸三カルシウムで処理を行った場合のDSP発現の検出のために免疫細胞化学によって標識されたMDPC-23細胞。 b)120時間のインキュベーション後に50%および6.25%の濃度で水酸化カルシウムおよびケイ酸三カルシウム生体材料で処理した場合、アリザリンレッドS染色で染色された培養MDPC-23細胞からの画像。すべての写真は100倍の倍率で取得されました。両図のバーは150μmを表す。 c)120時間の曝露後の水酸化カルシウムおよびケイ酸三カルシウムで処理したMDPC-23細胞からのカルシウム沈着物の形成。結果は、サンプルとコントロールの吸光度の比です。有意差は*で表され、*はp<0.05、**はp<0.01、***はp<0.001を意味します。この図の一部は、出版社20の許可を得て以前の出版物から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
表1:歯芽球分化/機能マーカーのリスト47〜79。この表は、歯芽球マーカーと検出方法のリストを提供します。これらのマーカーのいくつかは他の組織によっても発現される。
| 遺伝子またはタンパク質 | 方式 | 参照 |
| アルカリホスファターゼ(ALP) | 測 色 | 47 48 |
| 免疫細胞化学 | 20 49 | |
| ノーザンブロット | 50 | |
| RT-PCR法 | 51 52 | |
| デコリン (DCN) | 比色エリサ | 53 |
| 免疫細胞化学 | 54 55 | |
| RT-PCR法 | 53 56 | |
| 象牙質マトリックスタンパク質1(DMP-1) | フローサイトメトリー | 57 |
| 免疫細胞化学 | 58 59 | |
| ノーザンブロット | 50 60 | |
| RT-PCR法 | 47 49 | |
| ウェスタンブロット | 50 60 | |
| 象牙質マトリックスプロテイン2 (DMP-2) | 免疫細胞化学 | 60 61 |
| RT-PCR法 | 50 62 | |
| ノーザンブロット | 60 | |
| ウェスタンブロット | 62 | |
| 象牙質リンタンパク質(DPP) | 免疫細胞化学 | 63 |
| ノーザンブロット | 63 | |
| 象牙質シアロプロテイン(DSP)* | 免疫細胞化学 | 20 60 |
| ノーザンブロット | 60 63 | |
| RT-PCR法 | 50 | |
| ウェスタンブロット | 64 65 | |
| 象牙質シアロリンタンパク質(DSPP) | フローサイトメトリー | 57 |
| 免疫細胞化学 | 66 54 | |
| RT-PCR法 | 47 49 | |
| ノーザンブロット | 67 68 | |
| ウェスタンブロット | 64 62 | |
| すなわちシン/マトリックスメタロプロテイナーゼ-20 (MMP-20) | ノーザンブロット | 68 |
| RT-PCR法 | 49 68 | |
| ネスチン | 免疫細胞化学 | 54 69 |
| RT-PCR法 | 70 71 | |
| ウェスタンブロット | 72 | |
| オステオアドヘリン(OSAD) | 免疫細胞化学 | 73 74 |
| ノーザンブロット | 73 | |
| RT-PCR法 | 75 | |
| ウェスタンブロット | 73 74 | |
| オステオポンチン(OPN) | 免疫細胞化学 | 76 |
| ノーザンブロット | 50 | |
| RT-PCR法 | 66 51 | |
| ウェスタンブロット | 77 | |
| オステオカルシン(OCN) | 免疫細胞化学 | 52 |
| ノーザンブロット | 50 | |
| RT-PCR法 | 51 52 | |
| ウェスタンブロット | 77 78 | |
| オステリックス(OSX)/転写因子Sp7(Sp7) | 免疫細胞化学 | 54 58 |
| RT-PCR法 | 78 | |
| ウェスタンブロット | 78 79 | |
| X染色体上のエンドペプチダーゼと相同性を有するリン酸調節遺伝子(Phex) | ノーザンブロット | 68 |
| RT-PCR法 | 49 68 | |
| ウェスタンブロット | 79 | |
| ラント関連転写因子2(Runx2) | 免疫細胞化学 | 66 52 |
| RT-PCR法 | 66 70 | |
| ウェスタンブロット | 62 77 | |
| ※DPPとDSPはDSPPの切断製品です。 | ||
ディスカッション
このプロトコルは、組織と接触する生体材料のin vitro細胞毒性の評価を指すISO 10993-5を考慮して設計され、生体適合性を評価し、研究の再現性に貢献する21。これは科学における懸念の高まりであり、多くの著者は、in vitro研究の実験デザインですでにこれらの推奨事項に従っています15、22、23、24、25、26、27、28。
提案された方法論は、細胞生物学の最も関連性の高い側面をスクリーニングするために選択されました。したがって、このプロトコルは、一般的なアッセイを使用して細胞毒性を評価するための完全なアプローチと、表現型から機能までのいくつかの細胞パラメーターを含む補完的な評価を提供すると、推奨事項を超えます。この補完的な評価は、生存率が遺伝子およびタンパク質発現、細胞周期、またはセクレトームのレベルでの変化を翻訳しない可能性がある場合、生体材料の効果を真に評価するために重要です。
抽出物は、特に接着細胞株において、基質への細胞付着および最適な培養条件との干渉がないため、材料が培養プレートの表面に置かれるいくつかの直接接触アプローチとは対照的に有利である22、28。
さらに、抽出物は、組織中の物質の拡散を模倣して、異なる濃度への細胞曝露を可能にし29、特にそれらが極度に灌漑された組織と接触して適用される場合に、それらが生体内で受けるクリアランスをシミュレートする。直接接触試験では、異なる濃度を正確に評価できない可能性があり、間接接触試験では、非拡散、膜を介した不完全な拡散、または寒天との反応に関する潜在的な困難が示されました。
定量的評価を提供する試験が好ましく、細胞生存率が30%以上低下することが細胞毒性と見なされます11,30。新しい生体材料の開発において、そのような減少が起こるならば、それは再処方または放棄の必要性を決定する。有望な結果が達成された場合、in vivo評価を想定してさらなる研究を実施する必要があります29,31。
インビトロテストは、臨床状態をシミュレートまたは誇張する必要があります。.したがって、抽出物調製のための適切な表面体積比の決定は重要です。表面体積比は1.25〜6 cm2 / mLであることが示唆されました。フォームのような表面凹凸のある材料の場合、0.1〜0.2 g / mLまたは6 cm 2 / mLが開始点15,20,2です。培地1mL当たり250mm2の比率を、このプロトコールおよび他の研究で用いた代表的な結果15、20に用いた。
診療所でこのように使用されなくても、サンプルはその特性を変えない方法で滅菌する必要があります。多くの場合、UV照射は良い選択です。これは、細胞培養物の微生物汚染を防ぐために最も重要である11、24、32。
抽出培地は、血清の有無にかかわらず細胞培養培地、生理食塩水、ジメチルスルホキシド、または精製水を含み、生体材料の化学的特性11、33に従って選択される。細胞培養研究を目指して、細胞培養培地の使用は、さらなる処理工程を回避するので好ましい。抽出の条件は実験モデルに合わせて調整する必要があります。このプロトコルに示された代表的な結果では、FBSを添加したDMEM培養培地を37±1°Cで24±2時間使用した。
一部の生体材料は、抽出培地に残留物を残す可能性があり、細胞培養に悪影響を与える可能性があります。ろ過や遠心分離は避けるべきですが、使用する前に粒子を沈殿させる可能性があります。別の問題は、抽出後に変化する可能性のあるpHです。それ以上の調整を行うことは推奨されないため11、抽出物のpHを測定し、登録し、必要に応じてpH効果を分離するための追加のコントロールを実験デザインに含める必要があります。
このプロトコルは接着細胞培養について説明されていますが、浮遊培養を使用するために簡単な変更を行うことができます。同様に、固体生体材料を使用することに加えて、手順、本質的に抽出ステップを、液体、ゲル、または泡を研究するように適合させることができる34、35、36、37。
適切な密度の細胞培養物の調製は、特に複製率の高い細胞培養物では重要です31。使用する細胞の推奨播種密度範囲に従って、長時間のインキュベーションが計画されている場合、過度のコンフルエントに関連する問題を回避するために、初期播種密度の低下を実行する必要があります。さらに、細胞毒性の高い材料は、より高い初期播種密度を必要とする場合があります。
抽出法の利点に加えて、細胞接着の評価が関連する材料には最適ではありません。この場合、直接接触研究は実行されなければなりません38,39,40,41。これは包括的なアプローチですが、インビトロ評価であり、インビボ条件を完全に反映しているわけではないことに留意することが重要です42。
生体材料は、組織に損傷を与えるだけでなく、抗炎症および免疫調節プロセスのいくつかを刺激する必要があります43、44、45、46。したがって、このプロトコルは、細胞生存率や細胞死プロファイル、およびタンパク質合成の他のメカニズムを含む細胞メカニズムの評価でさらに進んでいます。実施された評価は、細胞毒性に加えて、生体組織における生体材料の生物活性について結論付けることを可能にするはずである。
歯科だけでなく、整形外科、外科、眼科、循環器科などの医療用途の新素材が爆発的に増加しているため、最初のスクリーニングを計画的に行う必要があります。このプロトコルは、新規生体材料の開発と特性評価を目指す研究者にとって重要なツールとなる可能性があります。
開示事項
著者には、競合する金銭的利益やその他の利益相反はありません。
謝辞
GAI 2013 (コインブラ大学医学部);CIBBは、戦略プロジェクトUIDB/04539/2020およびUIDP/04539/2020(CIBB)を通じて、FCT(科学技術財団)を介して国家基金によって資金提供されています。細胞株MDPC-23を提供してくれたミシガン大学デンタルスクールのJacques Nörに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CaCl2 | Sigma | 10035-04-8 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| DAB + Chromogen | Dako | K3468 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| DSP (M-20) Antibody, 1: 100 | Santa Cruz Biotechnology | LS-C20939 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Hepes 0.01 M | Sigma | MFCD00006158 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Giemsa Stain, modified GS-500 | Sigma | MFCD00081642 | |
| Glycerol | Dako | C0563 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| May-Grünwald Stain MG500 | Sigma | MFCD00131580 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Polyclonal Rabbit Anti-goat immunoglobulins / HRP, 1: 100 | Dako | G-21234 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Substrate Buffer | Dako | 926605 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| β-actin antibody | Sigma | A5316 |
参考文献
- Williams, D. F. On the mechanisms of biocompatibility. Biomaterials. 29 (20), 2941-2953 (2008).
- Bruinink, A., Luginbuehl, R. Evaluation of biocompatibility using in vitro methods: interpretation and limitations. Advances in Biochemical Engineering/Biotechnology. 126, 117-152 (2012).
- Wataha, J. C. Principles of biocompatibility for dental practitioners. The Journal of Prosthetic Dentistry. 86 (2), 203-209 (2001).
- Mishra, S. F. D. A. CE mark or something else?-Thinking fast and slow. Indian Heart Journal. 69 (1), 1-5 (2016).
- Barbeck, M., et al. Balancing Purification and Ultrastructure of Naturally Derived Bone Blocks for Bone Regeneration: Report of the Purification Effort of Two Bone Blocks. Materials. 12 (19), 3234 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- Coelho, C. C., Araújo, R., Quadros, P. A., Sousa, S. R., Monteiro, F. J. Antibacterial bone substitute of hydroxyapatite and magnesium oxide to prevent dental and orthopaedic infections. Materials Science and Engineering: C. 97, 529-538 (2019).
- Jung, O., et al. Improved In Vitro Test Procedure for Full Assessment of the Cytocompatibility of Degradable Magnesium Based on ISO 10993-5/-12. International Journal of Molecular Sciences. 20 (2), 255 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- ISO. I.O. for S. ISO 10993-12:2012 - part 12: Sample preparation and reference materials. ISO. , (2012).
- ISO. I.O. for S. ISO 10993-5:2009 Biological evaluation of medical devices - part 5: Tests for in vitro cytotoxicity. ISO. , (2009).
- Srivastava, G. K., et al. Comparison between direct contact and extract exposure methods for PFO cytotoxicity evaluation. Scientific Reports. 8 (1), 1425 (2018).
- Pusnik, M., Imeri, M., Deppierraz, G., Bruinink, A., Zinn, M. The agar diffusion scratch assay--A novel method to assess the bioactive and cytotoxic potential of new materials and compounds. Scientific Reports. 6, 20854 (2016).
- Spiller, K. L., et al. The role of macrophage phenotype in vascularization of tissue engineering scaffolds. Biomaterials. 35 (15), 4477-4488 (2014).
- Zhou, H., et al. In Vitro Cytotoxicity Evaluation of a Novel Root Repair Material. Journal of Endodontics. 39 (4), 478-483 (2013).
- Bordron, A., et al. The binding of some human antiendothelial cell antibodies induces endothelial cell apoptosis. Journal of Clinical Investigation. 101 (10), 2029-2035 (1998).
- Palmini, G., et al. Establishment of Cancer Stem Cell Cultures from Human Conventional Osteosarcoma. Journal of Visualized Experiments. (116), e53884 (2016).
- Gregory, C. A., Grady Gunn, W., Peister, A., Prockop, D. J. An Alizarin red-based assay of mineralization by adherent cells in culture: comparison with cetylpyridinium chloride extraction. Analytical Biochemistry. 329 (1), 77-84 (2004).
- Cai, S., Zhang, W., Chen, W. PDGFRβ+/c-kit+ pulp cells are odontoblastic progenitors capable of producing dentin-like structure in vitro and in vivo. BMC Oral Health. 16 (1), 113 (2016).
- Paula, A., et al. Biodentine Boosts, WhiteProRoot MTA Increases and Life Suppresses Odontoblast Activity. Materials. 12 (7), 1184 (2019).
- Chander, N. G. Standardization of in vitro studies. Journal of Indian Prosthodontic Society. 16 (3), 227-228 (2016).
- Cavalcanti, B. N., Rode de M, S., França, C. M., Marques, M. M. Pulp capping materials exert an effect on the secretion of IL-1β and IL-8 by migrating human neutrophils. Brazilian Oral Research. 25 (1), 13-18 (2011).
- Chang, S., Lee, S. Y., Ann, H. J., Kum, K. Y., Kim, E. C. Effects of calcium silicate endodontic cements on biocompatibility and mineralization-inducing potentials in human dental pulp cells. Journal of Endodontics. 40 (8), 1194-1200 (2014).
- Daltoé, M. O., Paula-Silva, F. W. G., Faccioli, L. H., Gatón-Hernández, P. M., De Rossi, A., Bezerra Silva, L. A. Expression of Mineralization Markers during Pulp Response to Biodentine and Mineral Trioxide Aggregate. Journal of Endodontics. 42 (4), 596-603 (2016).
- Elias, R. V., Demarco, F. F., Tarquinio, S. B. C., Piva, E. Pulp responses to the application of a self-etching adhesive in human pulps after controlling bleeding with sodium hypochlorite. Quintessence International. 38 (2), 67-77 (2007).
- Huang, G. T. J., Shagramanova, K., Chan, S. W. Formation of odontoblast-like cells from cultured human dental pulp cells on dentin in vitro. Journal of endodontics. 32 (11), 1066-1073 (2006).
- Jafarnia, B., et al. Evaluation of cytotoxicity of MTA employing various additives. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology. 107 (5), 739-744 (2009).
- Paranjpe, A., Smoot, T., Zhang, H., Johnson, J. D. Direct contact with mineral trioxide aggregate activates and differentiates human dental pulp cells. Journal of Endodontics. 37 (12), 1691-1695 (2011).
- Spagnuolo, G., et al. In vitro cellular detoxification of triethylene glycol dimethacrylate by adduct formation with N-acetylcysteine. Dental Materials. 29 (8), 153-160 (2013).
- Murray, P. E., García Godoy, C., García Godoy C, F. How is the biocompatibilty of dental biomaterials evaluated. Medicina Oral, Patologia Oral y Cirugia Bucal. 12 (3), 258-266 (2007).
- Hanks, C. T., Wataha, J. C., Sun, Z. In vitro models of biocompatibility: a review. Dental Materials. 12 (3), 186-193 (1996).
- Eid, A. A., et al. In Vitro Biocompatibility and Oxidative Stress Profiles of Different Hydraulic Calcium Silicate Cements. Journal of Endodontics. 40 (2), 255-260 (2014).
- Nocca, G., et al. Effects of ethanol and dimethyl sulfoxide on solubility and cytotoxicity of the resin monomer triethylene glycol dimethacrylate. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 100 (6), 1500-1506 (2012).
- Abuarqoub, D., Aslam, N., Jafar, H., Abu Harfil, Z., Awidi, A. Biocompatibility of Biodentine with Periodontal Ligament Stem Cells: In Vitro Study. Dentistry Journal. 8 (1), 17 (2020).
- Coelho, A. S., et al. Cytotoxic effects of a chlorhexidine mouthwash and of an enzymatic mouthwash on human gingival fibroblasts. Odontology. 108 (2), 260-270 (2020).
- Wang, M. O., et al. Evaluation of the In Vitro Cytotoxicity of Cross-Linked Biomaterials. Biomacromolecules. 14 (5), 1321-1329 (2013).
- Tyliszczak, B., Drabczyk, A., Kudłacik-Kramarczyk, S., Bialik-Wąs, K., Sobczak-Kupiec, A. In vitro cytotoxicity of hydrogels based on chitosan and modified with gold nanoparticles. Journal of Polymer Research. 24 (10), 153 (2017).
- Widbiller, M., et al. Three-dimensional culture of dental pulp stem cells in direct contact to tricalcium silicate cements. Clinical Oral Investigations. 20 (2), 237-246 (2016).
- Pintor, A. V. B., et al. In Vitro and In Vivo Biocompatibility of ReOss in Powder and Putty Configurations. Brazilian Dental Journal. 29 (2), 117-127 (2018).
- Pellissari, C. V. G., et al. In Vitro Toxic Effect of Biomaterials Coated with Silver Tungstate or Silver Molybdate Microcrystals. Journal of Nanomaterials. 2020, 1-9 (2020).
- Collado-González, M., et al. Cytotoxicity and bioactivity of various pulpotomy materials on stem cells from human exfoliated primary teeth. International Endodontic Journal. 50, 19-30 (2017).
- Paula, A., et al. Direct Pulp Capping: Which is the Most Effective Biomaterial? A Retrospective Clinical Study. Materials. 12 (20), 3382 (2019).
- Williams, D. F. There is no such thing as a biocompatible material. Biomaterials. 35 (38), 10009-10014 (2014).
- Schuh, J. C. L. Medical device regulations and testing for toxicologic pathologists. Toxicologic Pathology. 36 (1), 63-69 (2008).
- Pizzoferrato, A., et al. Cell culture methods for testing Biocompatibility. Clinical Materials. 15 (3), (1994).
- Pereira Paula, A. B., et al. Direct pulp capping: what is the most effective therapy? - review and meta-analysis. Journal of Evidence Based Dental Practice. , (2018).
- Caiaffa, K. S., et al. Effect of analogues of cationic peptides on dentin mineralization markers in odontoblast-like cells. Archives of Oral Biology. 103, 19-25 (2019).
- Fujiwara, S., Kumabe, S., Iwai, Y. Isolated rat dental pulp cell culture and transplantation with an alginate scaffold. Okajimas Folia Anatomica Japonica. 83 (1), 15-24 (2006).
- Nakashima, M., et al. Stimulation of Reparative Dentin Formation by Ex Vivo Gene Therapy Using Dental Pulp Stem Cells Electrotransfected with Growth/differentiation factor 11 (Gdf11). Human Gene Therapy. 15 (11), 1045-1053 (2004).
- Narayanan, K., et al. Differentiation of embryonic mesenchymal cells to odontoblast-like cells by overexpression of dentin matrix protein 1. Proceedings of the National Academy of Sciences of the United States of America. 98 (8), 4516-4521 (2001).
- Kim, H. J., Yoo, J. H., Choi, Y., Joo, J. Y., Lee, J. Y., Kim, H. J. Assessing the effects of cyclosporine A on the osteoblastogenesis, osteoclastogenesis, and angiogenesis mediated by the human periodontal ligament stem cells. Journal of Periodontology. , (2019).
- Bou Assaf, R., et al. Healing of Bone Defects in Pig's Femur Using Mesenchymal Cells Originated from the Sinus Membrane with Different Scaffolds. Stem Cells International. , (2019).
- He, W., et al. Lipopolysaccharide enhances decorin expression through the toll-like receptor 4, myeloid differentiating factor 88, nuclear factor-kappa B, and mitogen-activated protein kinase pathways in odontoblast cells. Journal of Endodontics. 38 (4), 464-469 (2012).
- Xiong, Y., et al. Wnt Production in Dental Epithelium Is Crucial for Tooth Differentiation. Journal of Dental Research. 98 (5), 580-588 (2019).
- Haruyama, N., et al. Genetic evidence for key roles of decorin and biglycan in dentin mineralization. Matrix Biology. 28 (3), 129-136 (2009).
- Sreenath, T., et al. Dentin Sialophosphoprotein Knockout Mouse Teeth Display Widened Predentin Zone and Develop Defective Dentin Mineralization Similar to Human Dentinogenesis Imperfecta Type III. Journal of Biological Chemistry. 278 (27), 24874-24880 (2003).
- Yang, Y., Zhao, Y., Liu, X., Chen, Y., Liu, P., Zhao, L. Effect of SOX2 on odontoblast differentiation of dental pulp stem cells. Molecular Medicine Reports. 16 (6), 9659-9663 (2017).
- Tao, H., et al. Klf4 Promotes Dentinogenesis and Odontoblastic Differentiation via Modulation of TGF-β Signaling Pathway and Interaction With Histone Acetylation. Journal of Bone and Mineral Research. 34 (8), 1502-1516 (2019).
- Massa, L. F., Ramachandran, A., George, A., Arana-Chavez, V. E. Developmental appearance of dentin matrix protein 1 during the early dentinogenesis in rat molars as identified by high-resolution immunocytochemistry. Histochemistry and Cell Biology. 124 (3-4), 197-205 (2005).
- Hao, J., Zou, B., Narayanan, K., George, A. Differential expression patterns of the dentin matrix proteins during mineralized tissue formation. Bone. 34 (6), 921-932 (2004).
- Tompkins, K., Alvares, K., George, A., Veis, A. Two related low molecular mass polypeptide isoforms of amelogenin have distinct activities in mouse tooth germ differentiation in vitro. Journal of Bone and Mineral Research. 20 (2), 341-349 (2005).
- Zhai, Y., et al. Activation and Biological Properties of Human β Defensin 4 in Stem Cells Derived From Human Exfoliated Deciduous Teeth. Frontiers in Physiology. 10, (2019).
- Bègue-Kirn, C., Ruch, J. V., Ridall, A. L., Butler, W. T. Comparative analysis of mouse DSP and DPP expression in odontoblasts, preameloblasts, and experimentally induced odontoblast-like cells. European Journal of Oral Sciences. 106, 254-259 (1998).
- Kikuchi, H., Suzuki, K., Sakai, N., Yamada, S. Odontoblasts induced from mesenchymal cells of murine dental papillae in three-dimensional cell culture. Cell and Tissue Research. 317 (2), 173-185 (2004).
- Li, X., Yang, G., Fan, M. Effects of homeobox gene distal-less 3 on proliferation and odontoblastic differentiation of human dental pulp cells. Journal of Endodontics. 38 (11), 1504-1510 (2012).
- Chen, S., et al. Differential regulation of dentin sialophosphoprotein expression by Runx2 during odontoblast cytodifferentiation. Journal of Biological Chemistry. 280 (33), 29717-29727 (2005).
- Narayanan, K., Gajjeraman, S., Ramachandran, A., Hao, J., George, A. Dentin matrix protein 1 regulates dentin sialophosphoprotein gene transcription during early odontoblast differentiation. Journal of Biological Chemistry. 281 (28), 19064-19071 (2006).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. A substractive PCR-based cDNA library from human odontoblast cells: identification of novel genes expressed in tooth forming cells. Matrix Biology. 19 (5), 421-430 (2000).
- Miyazaki, T., Baba, T., Mori, T., Komori, T. Collapsin Response Mediator Protein 1, a Novel Marker Protein for Differentiated Odontoblasts. Acta Histochemica et Cytochemica. 51 (6), 185-190 (2018).
- Yokoi, M., Kuremoto, K., Okada, S., Sasaki, M., Tsuga, K. Effect of attenuation of fibroblast growth factor receptor 2b signaling on odontoblast differentiation and dentin formation. In Vitro Cellular and Developmental Biology - Animal. 55 (3), 211-219 (2019).
- Tohma, A., et al. Glucose Transporter 2 and 4 Are Involved in Glucose Supply during Pulpal Wound Healing after Pulpotomy with Mineral Trioxide Aggregate in Rat Molars. Journal of Endodontics. , (2019).
- Sueyama, Y., Kaneko, T., Ito, T., Kaneko, R., Okiji, T. Implantation of Endothelial Cells with Mesenchymal Stem Cells Accelerates Dental Pulp Tissue Regeneration/Healing in Pulpotomized Rat Molars. Journal of Endodontics. 43 (6), 943-948 (2017).
- Petersson, U., Hultenby, K., Wendel, M. Identification, distribution and expression of osteoadherin during tooth formation. European Journal of Oral Sciences. 111 (2), 128-136 (2003).
- Couble, M. L., et al. Immunodetection of osteoadherin in murine tooth extracellular matrices. Histochemistry and Cell Biology. 121 (1), 47-53 (2004).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. Expression of the small leucine-rich proteoglycan osteoadherin/osteomodulin in human dental pulp and developing rat teeth. Bone. 27 (2), 265-270 (2000).
- Salmon, B., et al. Abnormal osteopontin and matrix extracellular phosphoglycoprotein localization, and odontoblast differentiation, in X-linked hypophosphatemic teeth. Connective Tissue Research. 55, 79-82 (2014).
- Liao, C., Ou, Y., Wu, Y., Zhou, Y., Liang, S., Wang, Y. Sclerostin inhibits odontogenic differentiation of human pulp-derived odontoblast-like cells under mechanical stress. Journal of Cellular Physiology. 234 (11), 20779-20789 (2019).
- Deng, X., et al. The combined effect of oleonuezhenide and wedelolactone on proliferation and osteoblastogenesis of bone marrow mesenchymal stem cells. Phytomedicine. 153103, (2019).
- Choi, H., Kim, T. H., Yun, C. Y., Kim, J. W., Cho, E. S. Testicular acid phosphatase induces odontoblast differentiation and mineralization. Cell and Tissue Research. 364 (1), 95-103 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved