Method Article
Acceso a la citotoxicidad y respuesta celular a los biomateriales
* Estos autores han contribuido por igual
En este artículo
Resumen
Esta metodología tiene como objetivo evaluar la citotoxicidad de biomateriales a través de la preparación de extractos solubles, utilizando ensayos de viabilidad y análisis fenotípicos, incluyendo citometría de flujo, RT-PCR, inmunocitoquímica y otras técnicas de biología celular y molecular.
Resumen
Los biomateriales entran en contacto directo o indirecto con los tejidos humanos, por lo que es importante evaluar su citotoxicidad. Esta evaluación puede realizarse por varios métodos, pero existe una alta discrepancia entre los enfoques utilizados, comprometiendo la reproducibilidad y la comparación entre los resultados obtenidos. En este trabajo, proponemos un protocolo para evaluar la citotoxicidad de los biomateriales utilizando extractos solubles, que utilizamos para biomateriales dentales. Se detalla la preparación de los extractos, desde la producción de pellets hasta su extracción en un medio de cultivo. La evaluación de la citotoxicidad de los biomateriales se basa en la actividad metabólica mediante el ensayo MTT, la viabilidad celular mediante el ensayo de sulforodamina B (SBR), el perfil de muerte celular mediante citometría de flujo y la morfología celular mediante May-Grünwald Giemsa. Además de la evaluación de citotoxicidad, se describe un protocolo para evaluar la función celular basado en la expresión de marcadores específicos evaluados por inmunocitoquímica y PCR. Este protocolo proporciona una guía completa para la evaluación de la citotoxicidad de los biomateriales y los efectos celulares, utilizando la metodología de extractos, de una manera reproducible y robusta.
Introducción
La biocompatibilidad puede definirse como la capacidad de un material para integrar tejido e inducir una respuesta terapéutica favorable, libre de daños locales y sistémicos 1,2,3. La evaluación de la biocompatibilidad es crucial para el desarrollo de cualquier material destinado a uso médico. Por lo tanto, este protocolo proporciona un enfoque sistemático e integral para cada investigador que desee desarrollar nuevos biomateriales o estudiar nuevas aplicaciones para biomateriales existentes.
Las pruebas de citotoxicidad in vitro se utilizan ampliamente como primera fase para la evaluación de la biocompatibilidad, utilizando cultivos celulares primarios o líneas celulares. Los resultados constituyen un primer indicador de potencial aplicación clínica. Además de ser vital para el desarrollo de biomateriales, estas pruebas son obligatorias para cumplir con las regulaciones vigentes para la introducción en el mercado, de los reguladores de la UE y la EUA (certificación FDA y CE)4,5,6,7,8. Además, las pruebas estandarizadas en la investigación biomédica proporcionan una ventaja significativa en términos de reproducibilidad y comparación de resultados de diferentes estudios sobre biomateriales o dispositivos similares9.
Las directrices de la Organización Internacional de Normalización (ISO) son ampliamente utilizadas por múltiples laboratorios comerciales, reguladores y académicos independientes para probar materiales de manera precisa y reproducible. La ISO 10993-5 se refiere a la evaluación de citotoxicidad in vitro y la ISO 10993-12 informa a la preparación de muestreo10,11. Para las pruebas de biomateriales se proporcionan tres categorías, que se seleccionarán de acuerdo con el tipo de material, los tejidos en contacto y el objetivo del tratamiento: extractos, contacto directo y contacto indirecto 8,11,12,13. Los extractos se obtienen enriqueciendo un medio de cultivo celular con el biomaterial. Para las pruebas de contacto directo, el biomaterial se coloca directamente sobre los cultivos celulares y, en contacto indirecto, la incubación con las células se realiza separada por una barrera, como un gel de agarosa11. Los controles apropiados son obligatorios, y se debe realizar un mínimo de tres experimentos independientes 5,8,10,11,14.
Es fundamental simular o exagerar las condiciones clínicas para determinar el potencial citotóxico. En el caso de las pruebas de extractos, el área de superficie del material; el volumen medio; el medio y el pH del material; la solubilidad del material, la osmolaridad y la relación de difusión; y las condiciones de extracción como agitación, temperatura y tiempo influyen en los medios de enriquecimiento5.
La metodología permite la evaluación cuantitativa y cualitativa de la citotoxicidad de varias formulaciones farmacéuticas, tanto sólidas como líquidas. Se pueden realizar varios ensayos, como la prueba de captación de rojo neutro, la prueba de formación de colonias, el ensayo MTT y el ensayo XTT 5,10,14.
La mayoría de los estudios de evaluación de citotoxicidad publicados utilizan ensayos más simples, a saber, MTT y XTT, que proporcionan información limitada. La evaluación de la biocompatibilidad no sólo debe implicar la evaluación de la citotoxicidad, sino también la bioactividad de un material de ensayo determinado2, como lo respalda este protocolo. Deben utilizarse criterios de evaluación adicionales cuando estén justificados y documentados. Por lo tanto, este protocolo tiene como objetivo proporcionar una guía completa, detallando un conjunto de métodos para la evaluación de la citotoxicidad de biomateriales. Además, se describe la evaluación de diferentes procesos celulares, a saber, el tipo de muerte celular, la morfología celular, la función celular en la síntesis de proteínas específicas y la producción de tejidos específicos.
Protocolo
1. Preparación de pellets
- Prepare los moldes de cloruro de polivinilo (PVC) realizando orificios de forma circular de dimensiones conocidas en placas de PVC.
NOTA: Las molduras de PVC se pueden hacer de diferentes tamaños. Calcule la superficie de contacto de los moldes de PVC, utilizando la fórmula A = h (2πr) + 2πr2 (r: radio del cilindro; h: altura del cilindro). - Prepare el biomaterial que se probará de acuerdo con las instrucciones del fabricante y lo más cerca posible del comienzo del experimento.
NOTA: Para la preparación de biomateriales de formulación de pasta/pasta, una cantidad adecuada de pasta base y catalizador se mezclan manualmente con una espátula de mezcla. Para otros materiales basados en formulaciones líquidas y en polvo, se debe realizar la espatulación manual o la mezcla mecánica con vibración, siguiendo las instrucciones del fabricante o las adecuadas para nuevos materiales. Para materiales líquidos, este paso no es necesario. Inicie el protocolo en el paso 2. - Coloque el biomaterial sobre los moldes con una espátula y déjelos reposar durante el tiempo adecuado.
NOTA: El tiempo de fraguado y las condiciones de ajuste de los biomateriales deben seguir las instrucciones del fabricante o las adecuadas para nuevos materiales. - Después del fraguado, retire los gránulos de biomaterial de los moldes de PVC y colóquelos en un recipiente (se puede usar una placa de 6 pocillos o una placa de Petri).
- Esterilice los gránulos colocándolos bajo una lámpara de luz ultravioleta (UV) durante 20 minutos para cada lado.
2. Obtención de los extractos de biomateriales
NOTA: Todos los procedimientos deben realizarse bajo estrictas condiciones estériles.
- Determinar el número necesario de pellets calculando la superficie del pellet basándose en la fórmula descrita en el punto 1.1.
NOTA: Como valor de referencia, la superficie de contacto de 250 mm2/mL11,15 se consigue añadiendo 9 pellets (r 3 mm x h 1,5 mm) por ml del medio. - Preparar los extractos solubles (extracto enriquecido con el biomaterial).
- Colocar los pellets en un tubo de 50 mL y añadir el correspondiente del medio de cultivo celular. Colocar los tubos durante 24 horas en la incubadora a 37°, en rotación constante.
NOTA: Utilice el medio de cultivo celular apropiado para los cultivos celulares. - Después de 24 horas, retire los tubos de la incubadora. En este punto, los extractos corresponden a una concentración de 1/1 o 100%.
- Realizar diluciones del extracto mediante la adición secuencial de volúmenes iguales de medio acondicionado al medio de cultivo celular.
NOTA: No se debe realizar ningún ajuste de pH en el medio.- Agregue 1 ml de medios de cultivo a 1 ml de extracto 100% para obtener un extracto al 50%. Agregue 1 ml de medios de cultivo a 1 ml de extracto al 50% para obtener un extracto al 25%, y así sucesivamente (Figura 1).
NOTA: Utilice las concentraciones que se consideren relevantes para cada compuesto.
- Agregue 1 ml de medios de cultivo a 1 ml de extracto 100% para obtener un extracto al 50%. Agregue 1 ml de medios de cultivo a 1 ml de extracto al 50% para obtener un extracto al 25%, y así sucesivamente (Figura 1).
- Colocar los pellets en un tubo de 50 mL y añadir el correspondiente del medio de cultivo celular. Colocar los tubos durante 24 horas en la incubadora a 37°, en rotación constante.

Figura 1: Esquema de preparación y diluciones de extractos solubles. Haga clic aquí para ver una versión más grande de esta figura.
3. Incubación celular con extractos de biomateriales
- Prepare una suspensión celular y colóquela en un recipiente de celda adecuado, como una placa de múltiples pocillos, de acuerdo con el número de células necesarias para los experimentos.
- Comience con un matraz de las células deseadas con 80% a 90% de confluencia.
- Deseche los medios de cultivo celular, lave con solución salina tamponada con fosfato (PBS) y separe las células con tripsina-EDTA (1 a 2 ml para un matraz de cultivo celular de 75 cm2 ).
- Añadir el medio de cultivo celular (2 a 4 ml para un matraz de cultivo celular de 75 cm2 ), transferir la suspensión celular a un tubo y centrifugar a 200 x g durante 5 min.
- Suspender el pellet en un volumen conocido de medios de cultivo celular.
NOTA: Este protocolo está diseñado para el uso de cultivos celulares adherentes; Sin embargo, se pueden hacer adaptaciones simples para trabajar con cultivos celulares en suspensión. - Cuente las células en el hemocitómetro y calcule la concentración celular de la suspensión celular.
- Suspender la cantidad determinada de suspensión celular en medio de cultivo y transferir a placas multipocillos. Como valor de referencia para la densidad de siembra, considere 5 – 20 x 105 celdas/cm2.
NOTA: El número apropiado de celdas debe calcularse de acuerdo con el tipo de celda y las características de la celda, es decir, el tiempo de duplicación de la celda.
- Incubar las células durante 24 horas para permitir la adhesión celular.
- Después de este período, administrar los extractos solubles en las placas de cultivo.
- Aspirar el medio de cultivo celular.
- Añadir los extractos de los biomateriales a cada pocillo, según la secuencia de concentraciones, como se ha descrito anteriormente. Agregue un medio de cultivo celular fresco a los pocillos de control.
- Incubar las placas durante 24 h o más.
NOTA: Se deben realizar controles negativos en cada ensayo, correspondientes a células no tratadas, mantenidas en el medio de cultivo. Los tiempos de incubación se pueden seleccionar de acuerdo con los objetivos del estudio.
4. Evaluación de la actividad metabólica
- Después de la incubación celular con los extractos de los biomateriales, aspirar el medio de las placas y lavar cada PBS de pozo.
- Colocar, en cada pocillo, el volumen adecuado de 0,5 mg/ml de bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazol (MTT) preparado en PBS, pH 7.4.
- Incubar las placas durante 4 h o durante la noche en la oscuridad a 37 ° C.
- Para solubilizar los cristales de formazán obtenidos, añadir el volumen adecuado de solución 0,04 M de ácido clorhídrico en isopropanol a cada pocillo y agitar las placas durante 30 minutos.
NOTA: Ajuste la cantidad de MTT e isopropanol de acuerdo con el tamaño de los pocillos. - Revuelva y homogeneice el contenido de cada pocillo, si es necesario, pipeteando hacia arriba y hacia abajo hasta que no se vean cristales.
- Cuantificar la absorbancia a una longitud de onda de 570 nm con un filtro de referencia de 620 nm, en el espectrofotómetro.
- Para calcular la actividad metabólica, divida la absorbancia de las células tratadas por la absorbancia de los cultivos de control. Para obtener valores porcentuales multiplicar por 100.
5. Evaluación de la muerte celular
NOTA: Para realizar esta evaluación se debe utilizar un mínimo de 10a 6 celdas por condición.
- Utilizar tubos centrífugos debidamente identificados, de acuerdo con las condiciones que se evalúan.
- Después de la incubación celular con los extractos de los biomateriales, recolectar los medios de cultivo en el tubo respectivo.
- Separe las celdas y agregue la suspensión celular a los tubos respectivos.
- Concentrar las suspensiones celulares por centrifugación a 120 x g durante 5 minutos.
- Lave los pellets con PBS. Retire el PBS por centrifugación a 1.000 x g durante 5 minutos.
- Agregue 1 ml de PBS y transfiera los gránulos celulares a los tubos de citometría identificados.
- Retire el PBS por centrifugación a 1.000 x g durante 5 minutos.
- Incubar con 100 μL de tampón de unión (0,01 M HEPES, 0,14 mM NaCl y 0,25 mM CaCl2)16, y dejar que las células reposen durante unos 15 minutos para la recuperación de la membrana celular.
- Añadir 2,5 μL de anexina-V marcada con fluorescencia y 1 μL de yoduro de propidio durante 15 minutos a temperatura ambiente en la oscuridad.
- Después de la incubación, agregue 400 μL de PBS y analice en el citómetro. Para el análisis y cuantificación de la información se utiliza el software adecuado.
- Presentar los resultados como porcentaje de células vivas, apoptosis, apoptosis/necrosis tardía y necrosis.
6. Evaluación morfológica
- Seleccione el tamaño apropiado de cubreobjetos de vidrio esterilizados que encajen dentro de la placa multipocillo.
- Coloque cada portaobjetos en un pozo con pinzas estériles.
- Distribuir una suspensión celular a una concentración adecuada en los pocillos y dejar pasar la noche en una incubadora a 37 °C en atmósfera humidificada con 95% de aire y 5% deCO2.
- Exponga los cultivos celulares a los extractos, como se describió anteriormente.
- Aspirar el medio y lavar con PBS.
- Deje secar los cubreobjetos a temperatura ambiente y, a continuación, añada un volumen suficiente de solución de May-Grünwald para cubrir los cubreobjetos; Incubar durante 3 minutos.
- Retire el tinte y lave con agua destilada durante 1 minuto.
- Retire el agua y añada un volumen suficiente de solución Giemsa para cubrir los cubreobjetos; Incubar durante 15 minutos.
- Lave los cubreobjetos con agua corriente.
- Transfiera los cubreobjetos a una corredera.
- Mire bajo un microscopio. Toma las fotografías con el aumento elegido.
7. Evaluación de la función celular mediante reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR)
NOTA: Para realizar esta evaluación se debe utilizar un mínimo de 2x106 celdas por condición. Como ejemplo, la fosfatasa alcalina se presenta como un gen de interés para la evaluación de la actividad de los odontoblastos. Otros genes de interés se pueden ver en la Tabla 1.
- Coloque las celdas como se describió anteriormente.
NOTA: Es posible que sea necesario ajustar la concentración de células plateadas, de acuerdo con el tipo de célula y la citotoxicidad de los biomateriales que se están estudiando. - Incubar con extractos solubles, como se describió anteriormente.
- Separe las celdas para obtener una suspensión como se describió anteriormente.
- Lave las células dos veces con PBS; Para ello centrifugar a 200 x g durante 5 minutos a temperatura ambiente.
- Lise las células suspendiendo el pellet en 1 ml de solución de purificación de ARN (por ejemplo, NZYol), agitación intensa y pipeteo sucesivo.
- Incubar las muestras durante 5 minutos a temperatura ambiente.
- Añadir 200 μL de cloroformo y agitar los tubos a mano durante 15 segundos.
- Incubar durante 3 minutos a temperatura ambiente.
- La centrífuga lisa a 4 ° C durante 15 min a 12,000 x g. Durante esta centrifugación, dos fases se originan en la muestra, dejando el ARN en la fase acuosa (superior).
- Retire la fase acuosa a un nuevo tubo y agregue 500 μL de isopropanol frío para precipitar el ARN.
- Incubar muestras a temperatura ambiente durante 10 minutos y centrifugar a 12.000 x g durante 10 minutos a 4ºC.
- Retirar el sobrenadante y lavar el pellet con 1 mL de etanol al 75% por centrifugación a 7.500 x g durante 5 minutos a 4ºC.
- Seque el pellet a temperatura ambiente hasta que el etanol se evapore.
- Suspender en agua libre de RNasa.
- Cuantificar y determinar el grado de pureza de las muestras mediante espectrofotometría de absorción, en las longitudes de onda 260 nm y 280 nm. Determine la pureza del ARN y utilice muestras con una relación de pureza (A260/280) de alrededor de 2,0.
- Almacenar las muestras a -80 ° C.
- Proceder a realizar RT-PCR siguiendo el protocolodel fabricante 17.
NOTA: De acuerdo con el objetivo del estudio, seleccione los marcadores específicos que se evaluarán.
8. Evaluación de la función celular a través de la identificación de proteínas
NOTA: De acuerdo con el objetivo del estudio, seleccione las proteínas específicas a evaluar. Como ejemplo, la sialoproteína de dentina (DSP) se presenta como una proteína de interés para la evaluación de la actividad de los odontoblastos. Otras proteínas de interés se pueden ver en la Tabla 1.
- Cultivar células en cubreobjetos y exponerlas a los extractos, como se describió anteriormente.
- Lave los cultivos celulares con PBS.
- Fijar con paraformaldehído al 3,7% durante 30 minutos a temperatura ambiente.
- Lavar dos veces con PBS.
- Permeabilizar con Tritón al 0,5% en PBS durante 15 minutos.
- Bloquee la peroxidasa con peróxido de hidrógeno al 0,3% en PBS durante 5 minutos.
- Lavar dos veces con PBS.
- Lavar dos veces con albúmina sérica bovina (BSA) al 0,5%.
- Bloquear cultivos celulares con BSA al 2% durante 45 minutos.
- Lavar con BSA al 0,5% en PBS.
- Incubar cultivos con el anticuerpo primario de acuerdo con la proteína seleccionada durante 60 minutos a temperatura ambiente.
NOTA: Este protocolo utiliza el anticuerpo primario DSP (M20) Anticuerpo (1:100) y el anticuerpo secundario Policlonal Conejo Anti-cabras inmunoglobulinas/HRP (1:100). - Lave cinco veces con BSA al 0.5% en PBS.
- Incubar con anticuerpos secundarios durante 90 minutos a temperatura ambiente.
NOTA: Haga las diluciones de anticuerpos usando BSA al 0.5% en PBS. - Lave cinco veces con BSA al 0.5% en PBS durante 1 minuto en cada lavado.
- Incubar cultivos con una mezcla de sustrato y cromógeno a una concentración de 20 μL de sustrato cromogenado/ml durante 25 minutos.
- Lavar dos veces con BSA al 0,5% en PBS.
- Contratinción con hematoxilina durante 15 minutos.
- Lavar con una secuencia de 0,037 mol/L de amoníaco y agua destilada durante 5 minutos para eliminar el exceso de tinte.
- Monte los cubreobjetos en las diapositivas. Utilice glicerol como medio de montaje.
- Dejar secar durante la noche.
- Mire bajo un microscopio. Toma las fotografías con el aumento elegido.
9. Evaluación de mineralización mediante el ensayo Alizarin Red S
- Preparar una solución de Alizarin Red S a una concentración de 40 mM18. Revuelva la solución para homogeneizar durante 12 horas en la oscuridad.
NOTA: Para preparar 100 ml de solución de Alizarin Red S, solubilice 1,44 g de alizarina en polvo (Peso molecular: 360 g/mol) en agua ultrapura, protegida de la luz. Para esta solución, el valor de pH es crítico y debe estar entre 4.1 y 4.3. - Incubar el cultivo celular con extractos solubles, como se describió anteriormente.
- Lave los cultivos celulares tres veces con PBS.
- Fijar con paraformaldehído al 4% durante 15 minutos a temperatura ambiente.
- Lavar tres veces con PBS.
- Tinción con Alizarin Red Staining solution durante 20 minutos a 37 °C en la oscuridad.
- Después de la tinción, lave las placas con PBS para eliminar el exceso de tinte.
- Mire bajo un microscopio. Toma las fotografías con el aumento elegido.
- Agregue una solución de extracción, compuesta por 10% (p/v) de ácido acético y 20% (p/v) de metanol, a cada pocillo y deje remover durante 40 minutos a temperatura ambiente.
- Mida la absorbancia a una longitud de onda de 490 nm en un espectrofotómetro19.
Resultados
Los resultados representativos aquí se refieren al estudio de los biomateriales dentales. La metodología del extracto permite obtener un perfil de citotoxicidad y función celular después de la exposición a los materiales dentales, en cuanto a los efectos sobre la actividad metabólica (Figura 2), la viabilidad celular, el perfil de muerte celular y la morfología celular (Figura 3), y la expresión de proteínas específicas (Figura 4).
El ensayo MTT se utiliza para obtener una visión general rápida de la citotoxicidad de los materiales de una manera sencilla. Se puede hacer una comparación entre dos o más materiales (Figura 2); una reducción severa de la actividad metabólica, incluso cuando se encuentra en concentraciones bajas (6,25%) y medias (50%), indica una mayor toxicidad (Figura 2a). Al mismo tiempo, los materiales menos citotóxicos presentan solo una reducción más ligera o nula (Figura 2b). Las comparaciones entre diferentes puntos temporales permiten determinar efectos citotóxicos más inmediatos o en etapas posteriores.
Los efectos sobre la viabilidad celular proporcionan información importante sobre la reducción celular viable, que puede comprometer la capacidad de los tejidos para recuperarse después de un efecto dañino. La determinación del porcentaje de células viables permite comparar la citotoxicidad del material; más materiales citotóxicos inducen una mayor muerte celular para la misma concentración (Figura 3a y 3b). Las reducciones superiores al 30% son críticas y definen materiales con riesgo de baja biocompatibilidad (Figura 3a). Esta información se completa con el perfil de muerte celular (Figura 3a y 3b). En los resultados representativos, los materiales más citotóxicos se caracterizan por una disminución acentuada de la viabilidad celular y para un perfil de muerte celular de apoptosis y necrosis tardía (Figura 3a), mientras que los menos citotóxicos presentan menos muerte celular y un perfil más apoptótico y apoptótico tardío (Figura 3b).
La información obtenida de la evaluación de la morfología celular (Figura 3c) complementa la evaluación de la viabilidad celular. Los cambios de la morfología típica de la célula pueden indicar un perfil apoptótico o necrótico16. Además, se puede obtener información adicional de este protocolo, como la observación de partículas materiales (flechas rojas, Figura 3C).
Los marcadores específicos, fundamentales para la función celular, afectados por la exposición al extracto pueden evaluarse mediante varias técnicas, como inmunohistoquímica, PCR, citometría de flujo, blotting o ensayos colorimétricos (Tabla 1). Los resultados representativos de la expresión de DSP después de la exposición a extractos se muestran en la Figura 4a, y se puede ver que algunos materiales (cementos de silicatos tricálcico) estimulan las células para aumentar la expresión de proteínas. En contraste, otros (cementos de hidróxido de calcio) promueven una disminución significativa en la expresión de proteínas, independientemente de la pérdida de viabilidad. En ambos casos, la concentración de los extractos influye directamente en la expresión proteica.
En la línea celular MDPC-23 del fenotipo odontoblasto, la formación de depósitos de mineralización es característica. El protocolo para la identificación y cuantificación de depósitos mineralizados permite evaluar la función específica de este tipo de células especializadas. En el caso presentado, se observó que además de ser menos citotóxico, el cemento de silicatos tricálcicos estimula la función celular, una vez que se observó un aumento en los depósitos mineralizados (Figura 4b). Por el contrario, el cemento de hidróxido de calcio más citotóxico condujo a una reducción de la deposición mineral debido al deterioro celular y la muerte (Figura 4b). Además de una evaluación cualitativa, se puede realizar una determinación cuantitativa (Figura 4c).
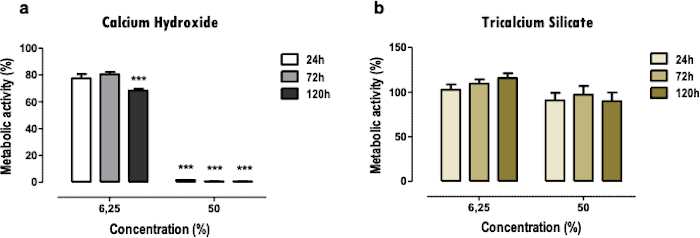
Figura 2: Actividad metabólica. Actividad metabólica de células MDPC-23 tratadas con cemento de hidróxido de calcio [a)] y cemento de silicato tricálcico [b)] extractos solubles durante 24, 72 y 120 horas. Los resultados se normalizan a los cultivos celulares control, con un valor del 100%. Las diferencias significativas están representadas por *, donde * significa p<0.05, ** significa p<0.01 y *** significa p<0.001. Parte de esta figura ha sido modificada de una publicación anterior con permiso de la editorial20. Haga clic aquí para ver una versión más grande de esta figura.
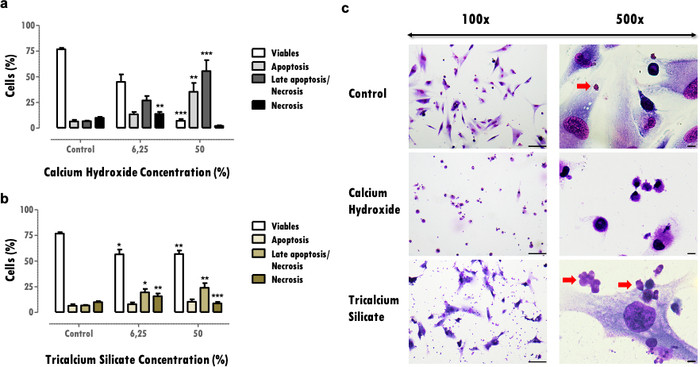
Figura 3: Viabilidad celular, perfil de muerte y morfología celular. Viabilidad celular, perfil de muerte celular y morfología celular en células MDPC-23 sometidas a tratamiento con hidróxido de calcio y biomateriales de silicato tricálcico a una concentración del 6,25% y 50%, después de 120 horas de exposición. a) y b) Los resultados se representan como el porcentaje de células vivas en apoptosis, apoptosis tardía o necrosis y necrosis. Las diferencias significativas con respecto al control o entre condiciones se representan con *, donde * significa p <0,05, ** significa p <0,01 y *** significa p <0,001. c) Células teñidas con May-Grünwald Giemsa después del tratamiento con una concentración del 50% de extractos solubles de biomateriales. El grupo control representa células en cultivo en DMEM con 10% de FBS. Las imágenes en la columna izquierda se obtuvieron con un aumento de 100x, y las imágenes en la columna de la derecha se obtuvieron con un aumento de 500x. Las barras de la figura representan 100 μm. Parte de esta figura ha sido modificada de una publicación anterior con permiso de la editorial20. Haga clic aquí para ver una versión más grande de esta figura.
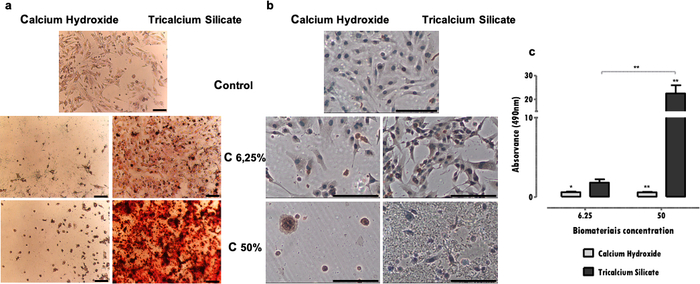
Figura 4: Expresión de DSP y formación de nódulos mineralizados. a) Células MDPC-23 marcadas por inmunocitoquímica para la detección de expresión de DSP cuando se someten a tratamiento con hidróxido de calcio y silicato tricálcico a concentraciones de 50% y 6,25% después de 96 horas de incubación. b) Imágenes de células MDPC-23 cultivadas teñidas con tinción S de Alizarin Red cuando se trataron con hidróxido de calcio y biomateriales de silicato tricálcico a concentraciones de 50% y 6,25% después de 120 horas de incubación. Todas las fotografías fueron obtenidas con un aumento de 100x. Ambas barras de figuras representan 150μm. c) Formación de depósitos de calcio a partir de células MDPC-23 tratadas con hidróxido de calcio y silicato tricálcico después de 120 horas de exposición. Los resultados son la relación de las absorbancias de las muestras y el control. Las diferencias significativas están representadas por *, donde * significa p<0.05, ** significa p<0.01 y *** significa p<0.001. Parte de esta figura ha sido modificada de una publicación anterior con permiso de la editorial20. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Lista de marcadores de diferenciación/función odontoblástica47-79. Esta tabla proporciona una lista de marcadores odontoblásticos y métodos de detección; Algunos de estos marcadores también son expresados por otros tejidos.
| Gen o proteína | Método | Referencias |
| Fosfatasa alcalina (ALP) | Colorimétrico | 47 48 |
| Inmunocitoquímica | 20 49 | |
| Northern Blot | 50 | |
| RT-PCR | 51 52 | |
| Decorin (DCN) | ELISA colorimétrico | 53 |
| Inmunocitoquímica | 54 55 | |
| RT-PCR | 53 56 | |
| Proteína 1 de la matriz de dentina (DMP-1) | Citometría de flujo | 57 |
| Inmunocitoquímica | 58 59 | |
| Northern Blot | 50 60 | |
| RT-PCR | 47 49 | |
| Western Blot | 50 60 | |
| Proteína 2 de la matriz de dentina (DMP-2) | Inmunocitoquímica | 60 61 |
| RT-PCR | 50 62 | |
| Northern Blot | 60 | |
| Western Blot | 62 | |
| Fosfoproteína dentina (DPP) | Inmunocitoquímica | 63 |
| Northern Blot | 63 | |
| Sialoproteína dentina (DSP)* | Inmunocitoquímica | 20 60 |
| Northern Blot | 60 63 | |
| RT-PCR | 50 | |
| Western Blot | 64 65 | |
| Sialofosfoproteína de la dentina (DSPP) | Citometría de flujo | 57 |
| Inmunocitoquímica | 66 54 | |
| RT-PCR | 47 49 | |
| Northern Blot | 67 68 | |
| Western Blot | 64 62 | |
| Enamelysin/Matrix Metaloproteinase-20 (MMP-20) | Northern Blot | 68 |
| RT-PCR | 49 68 | |
| Néstina | Inmunocitoquímica | 54 69 |
| RT-PCR | 70 71 | |
| Western Blot | 72 | |
| Osteoadherina (OSAD) | Inmunocitoquímica | 73 74 |
| Northern Blot | 73 | |
| RT-PCR | 75 | |
| Western Blot | 73 74 | |
| Osteopontina (OPN) | Inmunocitoquímica | 76 |
| Northern Blot | 50 | |
| RT-PCR | 66 51 | |
| Western Blot | 77 | |
| Osteocalcina (OCN) | Inmunocitoquímica | 52 |
| Northern Blot | 50 | |
| RT-PCR | 51 52 | |
| Western Blot | 77 78 | |
| Osterix (OSX)/ Factor de transcripción Sp7 (Sp7) | Inmunocitoquímica | 54 58 |
| RT-PCR | 78 | |
| Western Blot | 78 79 | |
| Gen regulador de fosfato con homologías a endopeptidasas en el cromosoma X (Phex) | Northern Blot | 68 |
| RT-PCR | 49 68 | |
| Western Blot | 79 | |
| Factor de transcripción 2 relacionado con Runt (Runx2) | Inmunocitoquímica | 66 52 |
| RT-PCR | 66 70 | |
| Western Blot | 62 77 | |
| *DPP y DSP son los productos de escisión de DSPP. | ||
Discusión
Este protocolo fue diseñado teniendo en cuenta la norma ISO 10993-5, que se refiere a la evaluación de la citotoxicidad in vitro de los biomateriales que entran en contacto con los tejidos, para evaluar la biocompatibilidad y contribuir a los estudios de reproducibilidad21. Esta es una preocupación creciente en la ciencia, y muchos autores ya están siguiendo estas recomendaciones en el diseño experimental de sus estudios in vitro 15,22,23,24,25,26,27,28.
La metodología propuesta fue seleccionada para examinar los aspectos más relevantes de la biología celular. Por lo tanto, este protocolo va más allá de las recomendaciones, una vez que proporciona un enfoque completo para evaluar la citotoxicidad utilizando ensayos comunes y una evaluación complementaria, incluyendo varios parámetros celulares desde el fenotipo hasta la función. Esta evaluación complementaria es importante para evaluar realmente el efecto de los biomateriales, una vez que la viabilidad puede no traducir alteraciones a nivel de expresión génica y proteica, ciclo celular o secretoma.
Los extractos son ventajosos, particularmente en líneas celulares adherentes, porque no hay interferencia con la unión celular al sustrato y las condiciones óptimas de cultivo, en oposición a algunos enfoques de contacto directo donde los materiales se colocan en la superficie de la placa de cultivo22,28.
Además, los extractos permiten la exposición celular a diferentes concentraciones29, imitando la difusión de sustancias en los tejidos, lo que simula el aclaramiento al que se someten in vivo, particularmente cuando se aplican en contacto con tejidos extremadamente irrigados. Las pruebas de contacto directo pueden no evaluar con precisión las diferentes concentraciones, y las pruebas de contacto indirecto demostraron dificultades potenciales con la no difusión, la difusión incompleta a través de las membranas o la reacción con el agar.
Se prefieren las pruebas que proporcionan una evaluación cuantitativa, considerándose citotóxica una reducción de la viabilidad celular en más del 30%11,30. En el desarrollo de nuevos biomateriales, si se produce dicha reducción, determina la necesidad de reformulación o abandono. Si se logran resultados alentadores, se deben realizar estudios adicionales que prevean la evaluación in vivo29,31.
Las pruebas in vitro deben simular o exagerar las condiciones clínicas. Por lo tanto, la determinación de las proporciones de volumen superficial apropiadas para la preparación del extracto es crítica. Se sugirieron relaciones superficie/volumen de 1,25-6 cm2/ml. En el caso de materiales con irregularidades superficiales como espumas 0.1–0.2 g/mL o 6 cm 2/mL son un punto de partida 15,20,2. La relación de 250 mm2por ml de medio fue utilizada en los resultados representativos utilizados en este protocolo y otros estudios15,20.
Incluso si no se utilizan de esta manera en las clínicas, las muestras deben ser esterilizadas por métodos que no alteren sus propiedades. La irradiación UV es con frecuencia una buena opción. Esto es de suma importancia para prevenir la contaminación microbiana de cultivos celulares 11,24,32.
Los medios de extracción incluyen medio de cultivo celular con o sin suero, solución salina fisiológica, dimetilsulfóxido o agua purificada, seleccionados de acuerdo con las características químicas de los biomateriales11,33. Con el objetivo de estudios de cultivo celular, se prefiere el uso del medio de cultivo celular, ya que evita pasos de procesamiento adicionales. Las condiciones de extracción deben ajustarse al modelo experimental. En los resultados representativos mostrados en este protocolo, el medio de cultivo DMEM suplementado con FBS se utilizó durante 24 ± 2 horas a 37 ± 1 °C.
Algunos biomateriales pueden dejar residuos en los medios de extracción, lo que puede afectar negativamente a los cultivos celulares. Si bien se deben evitar la filtración y las centrifugaciones, existe la posibilidad de permitir que las partículas sedimenten antes de usarlas. Otra cuestión es el pH que puede sufrir alteración tras la extracción. Dado que no se recomienda realizar ajustes adicionales11, el pH de los extractos debe medirse, registrarse y se deben incluir controles adicionales para aislar el efecto del pH en el diseño experimental si es necesario.
Si bien este protocolo se describió para cultivos celulares adherentes, se pueden realizar modificaciones simples para usar cultivos en suspensión. Del mismo modo, además de utilizar biomateriales sólidos, es posible adaptar el procedimiento, esencialmente los pasos de extracción, para estudiar líquidos, geles o espumas34,35,36,37.
La preparación de cultivos celulares con densidad adecuada es crítica, especialmente en cultivos celulares con alta tasa de duplicación31. De acuerdo con el rango de densidad de siembra recomendado de las células utilizadas, si se planifican incubaciones a largo plazo, se debe realizar la reducción de la densidad de siembra inicial para evitar los problemas asociados con la confluencia excesiva. Además, los materiales altamente citotóxicos pueden requerir densidades de siembra iniciales más altas.
Además de las ventajas de la metodología de extracto, no es la mejor opción para materiales donde la evaluación de la adherencia celular es relevante. En este caso, los estudios de contacto directo deben realizarse 38,39,40,41. Aunque se trata de un abordaje integral, es importante tener en cuenta que se trata de una evaluación in vitro, que no refleja totalmente las condiciones in vivo42.
Un biomaterial no sólo debe causar daño al tejido, sino estimular algunos de los procesos antiinflamatorios e inmunomoduladores43,44,45,46. Por lo tanto, este protocolo va más allá, con la evaluación de los mecanismos celulares, incluida la viabilidad celular y el perfil de muerte celular, así como otros mecanismos de síntesis de proteínas. La evaluación realizada debe permitir concluir sobre la bioactividad del biomaterial en los tejidos vivos, además de la citotoxicidad.
Con la explosión de nuevos materiales para aplicaciones médicas, no solo para odontología sino también para ortopedia, cirugía, oftalmología, cardiología, etc., las evaluaciones iniciales deben hacerse sistemáticamente. Este protocolo podría ser una herramienta importante para los investigadores que buscan desarrollar y caracterizar nuevos biomateriales.
Divulgaciones
Los autores no tienen intereses financieros contrapuestos u otros conflictos de intereses.
Agradecimientos
Agradecemos el apoyo de GAI 2013 (Faculdade de Medicina da Universidade de Coimbra); CIBB está financiado por Fondos Nacionales a través de FCT (Fundación para la Ciencia y la Tecnología) a través del Proyecto Estratégico UIDB/04539/2020 y UIDP/04539/2020 (CIBB). Agradecemos a Jacques Nör, de la Facultad de Odontología de la Universidad de Michigan, por proporcionar la línea celular MDPC-23.
Materiales
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Merck Millipore | 100983 | |
| Accutase | Gibco | A1110501 | StemPro Accutas Cell Dissociation Reagent |
| ALDH antibody | Santa Cruz Biotechnology | SC166362 | |
| Annexin V FITC | BD Biosciences | 556547 | |
| Antibiotic antimycotic solution | Sigma | A5955 | |
| BCA assay | Thermo Scientific | 23225 | Pierce BCA Protein Assay Kit |
| Bovine serum albumin | Sigma | A9418 | |
| CaCl2 | Sigma | 10035-04-8 | |
| CD133 antibody | Miteny Biotec | 293C3-APC | Allophycocyanin (APC) |
| CD24 antibody | BD Biosciences | 658331 | Allophycocyanin-H7 (APC-H7) |
| CD44 antibody | Biolegend | 103020 | Pacific Blue (PB) |
| Cell strainer | BD Falcon | 352340 | 40 µM |
| Collagenase, type IV | Gibco | 17104-019 | |
| cOmplete Mini | Roche | 118 361 700 0 | |
| DAB + Chromogen | Dako | K3468 | |
| Dithiothreitol | Sigma | 43815 | |
| DMEM-F12 | Sigma | D8900 | |
| DNAse I | Roche | 11284932001 | |
| DSP (M-20) Antibody, 1: 100 | Santa Cruz Biotechnology | LS-C20939 | |
| ECC-1 | ATCC | CRL-2923 | Human endometrium adenocarcinoma cell line |
| Epidermal growth factor | Sigma | E9644 | |
| Hepes 0.01 M | Sigma | MFCD00006158 | |
| Fibroblast growth factor basic | Sigma | F0291 | |
| Giemsa Stain, modified GS-500 | Sigma | MFCD00081642 | |
| Glycerol | Dako | C0563 | |
| Haemocytometer | VWR | HERE1080339 | |
| HCC1806 | ATCC | CRL-2335 | Human mammary squamous cell carcinoma cell line |
| Insulin, transferrin, selenium Solution | Gibco | 41400045 | |
| May-Grünwald Stain MG500 | Sigma | MFCD00131580 | |
| MCF7 | ATCC | HTB-22 | Human mammary adenocarcinoma cell line |
| Methylcellulose | AlfaAesar | 45490 | |
| NaCl | JMGS | 37040005002212 | |
| Polyclonal Rabbit Anti-goat immunoglobulins / HRP, 1: 100 | Dako | G-21234 | |
| Poly(2-hydroxyethyl-methacrylate | Sigma | P3932 | |
| Putrescine | Sigma | P7505 | |
| RL95-2 | ATCC | CRL-1671 | Human endometrium carcinoma cell line |
| Sodium deoxycholic acid | JMS | EINECS 206-132-7 | |
| Sodium dodecyl sulfate | Sigma | 436143 | |
| Substrate Buffer | Dako | 926605 | |
| Tris | JMGS | 20360000BP152112 | |
| Triton-X 100 | Merck | 108603 | |
| Trypan blue | Sigma | T8154 | |
| Trypsin-EDTA | Sigma | T4049 | |
| β-actin antibody | Sigma | A5316 |
Referencias
- Williams, D. F. On the mechanisms of biocompatibility. Biomaterials. 29 (20), 2941-2953 (2008).
- Bruinink, A., Luginbuehl, R. Evaluation of biocompatibility using in vitro methods: interpretation and limitations. Advances in Biochemical Engineering/Biotechnology. 126, 117-152 (2012).
- Wataha, J. C. Principles of biocompatibility for dental practitioners. The Journal of Prosthetic Dentistry. 86 (2), 203-209 (2001).
- Mishra, S. F. D. A. CE mark or something else?-Thinking fast and slow. Indian Heart Journal. 69 (1), 1-5 (2016).
- Barbeck, M., et al. Balancing Purification and Ultrastructure of Naturally Derived Bone Blocks for Bone Regeneration: Report of the Purification Effort of Two Bone Blocks. Materials. 12 (19), 3234 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- Coelho, C. C., Araújo, R., Quadros, P. A., Sousa, S. R., Monteiro, F. J. Antibacterial bone substitute of hydroxyapatite and magnesium oxide to prevent dental and orthopaedic infections. Materials Science and Engineering: C. 97, 529-538 (2019).
- Jung, O., et al. Improved In Vitro Test Procedure for Full Assessment of the Cytocompatibility of Degradable Magnesium Based on ISO 10993-5/-12. International Journal of Molecular Sciences. 20 (2), 255 (2019).
- Ruzza, P., et al. H-Content Is Not Predictive of Perfluorocarbon Ocular Endotamponade Cytotoxicity in Vitro. ACS Omega. 4 (8), 13481-13487 (2019).
- ISO. I.O. for S. ISO 10993-12:2012 - part 12: Sample preparation and reference materials. ISO. , (2012).
- ISO. I.O. for S. ISO 10993-5:2009 Biological evaluation of medical devices - part 5: Tests for in vitro cytotoxicity. ISO. , (2009).
- Srivastava, G. K., et al. Comparison between direct contact and extract exposure methods for PFO cytotoxicity evaluation. Scientific Reports. 8 (1), 1425 (2018).
- Pusnik, M., Imeri, M., Deppierraz, G., Bruinink, A., Zinn, M. The agar diffusion scratch assay--A novel method to assess the bioactive and cytotoxic potential of new materials and compounds. Scientific Reports. 6, 20854 (2016).
- Spiller, K. L., et al. The role of macrophage phenotype in vascularization of tissue engineering scaffolds. Biomaterials. 35 (15), 4477-4488 (2014).
- Zhou, H., et al. In Vitro Cytotoxicity Evaluation of a Novel Root Repair Material. Journal of Endodontics. 39 (4), 478-483 (2013).
- Bordron, A., et al. The binding of some human antiendothelial cell antibodies induces endothelial cell apoptosis. Journal of Clinical Investigation. 101 (10), 2029-2035 (1998).
- Palmini, G., et al. Establishment of Cancer Stem Cell Cultures from Human Conventional Osteosarcoma. Journal of Visualized Experiments. (116), e53884 (2016).
- Gregory, C. A., Grady Gunn, W., Peister, A., Prockop, D. J. An Alizarin red-based assay of mineralization by adherent cells in culture: comparison with cetylpyridinium chloride extraction. Analytical Biochemistry. 329 (1), 77-84 (2004).
- Cai, S., Zhang, W., Chen, W. PDGFRβ+/c-kit+ pulp cells are odontoblastic progenitors capable of producing dentin-like structure in vitro and in vivo. BMC Oral Health. 16 (1), 113 (2016).
- Paula, A., et al. Biodentine Boosts, WhiteProRoot MTA Increases and Life Suppresses Odontoblast Activity. Materials. 12 (7), 1184 (2019).
- Chander, N. G. Standardization of in vitro studies. Journal of Indian Prosthodontic Society. 16 (3), 227-228 (2016).
- Cavalcanti, B. N., Rode de M, S., França, C. M., Marques, M. M. Pulp capping materials exert an effect on the secretion of IL-1β and IL-8 by migrating human neutrophils. Brazilian Oral Research. 25 (1), 13-18 (2011).
- Chang, S., Lee, S. Y., Ann, H. J., Kum, K. Y., Kim, E. C. Effects of calcium silicate endodontic cements on biocompatibility and mineralization-inducing potentials in human dental pulp cells. Journal of Endodontics. 40 (8), 1194-1200 (2014).
- Daltoé, M. O., Paula-Silva, F. W. G., Faccioli, L. H., Gatón-Hernández, P. M., De Rossi, A., Bezerra Silva, L. A. Expression of Mineralization Markers during Pulp Response to Biodentine and Mineral Trioxide Aggregate. Journal of Endodontics. 42 (4), 596-603 (2016).
- Elias, R. V., Demarco, F. F., Tarquinio, S. B. C., Piva, E. Pulp responses to the application of a self-etching adhesive in human pulps after controlling bleeding with sodium hypochlorite. Quintessence International. 38 (2), 67-77 (2007).
- Huang, G. T. J., Shagramanova, K., Chan, S. W. Formation of odontoblast-like cells from cultured human dental pulp cells on dentin in vitro. Journal of endodontics. 32 (11), 1066-1073 (2006).
- Jafarnia, B., et al. Evaluation of cytotoxicity of MTA employing various additives. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology, and Endodontology. 107 (5), 739-744 (2009).
- Paranjpe, A., Smoot, T., Zhang, H., Johnson, J. D. Direct contact with mineral trioxide aggregate activates and differentiates human dental pulp cells. Journal of Endodontics. 37 (12), 1691-1695 (2011).
- Spagnuolo, G., et al. In vitro cellular detoxification of triethylene glycol dimethacrylate by adduct formation with N-acetylcysteine. Dental Materials. 29 (8), 153-160 (2013).
- Murray, P. E., García Godoy, C., García Godoy C, F. How is the biocompatibilty of dental biomaterials evaluated. Medicina Oral, Patologia Oral y Cirugia Bucal. 12 (3), 258-266 (2007).
- Hanks, C. T., Wataha, J. C., Sun, Z. In vitro models of biocompatibility: a review. Dental Materials. 12 (3), 186-193 (1996).
- Eid, A. A., et al. In Vitro Biocompatibility and Oxidative Stress Profiles of Different Hydraulic Calcium Silicate Cements. Journal of Endodontics. 40 (2), 255-260 (2014).
- Nocca, G., et al. Effects of ethanol and dimethyl sulfoxide on solubility and cytotoxicity of the resin monomer triethylene glycol dimethacrylate. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 100 (6), 1500-1506 (2012).
- Abuarqoub, D., Aslam, N., Jafar, H., Abu Harfil, Z., Awidi, A. Biocompatibility of Biodentine with Periodontal Ligament Stem Cells: In Vitro Study. Dentistry Journal. 8 (1), 17 (2020).
- Coelho, A. S., et al. Cytotoxic effects of a chlorhexidine mouthwash and of an enzymatic mouthwash on human gingival fibroblasts. Odontology. 108 (2), 260-270 (2020).
- Wang, M. O., et al. Evaluation of the In Vitro Cytotoxicity of Cross-Linked Biomaterials. Biomacromolecules. 14 (5), 1321-1329 (2013).
- Tyliszczak, B., Drabczyk, A., Kudłacik-Kramarczyk, S., Bialik-Wąs, K., Sobczak-Kupiec, A. In vitro cytotoxicity of hydrogels based on chitosan and modified with gold nanoparticles. Journal of Polymer Research. 24 (10), 153 (2017).
- Widbiller, M., et al. Three-dimensional culture of dental pulp stem cells in direct contact to tricalcium silicate cements. Clinical Oral Investigations. 20 (2), 237-246 (2016).
- Pintor, A. V. B., et al. In Vitro and In Vivo Biocompatibility of ReOss in Powder and Putty Configurations. Brazilian Dental Journal. 29 (2), 117-127 (2018).
- Pellissari, C. V. G., et al. In Vitro Toxic Effect of Biomaterials Coated with Silver Tungstate or Silver Molybdate Microcrystals. Journal of Nanomaterials. 2020, 1-9 (2020).
- Collado-González, M., et al. Cytotoxicity and bioactivity of various pulpotomy materials on stem cells from human exfoliated primary teeth. International Endodontic Journal. 50, 19-30 (2017).
- Paula, A., et al. Direct Pulp Capping: Which is the Most Effective Biomaterial? A Retrospective Clinical Study. Materials. 12 (20), 3382 (2019).
- Williams, D. F. There is no such thing as a biocompatible material. Biomaterials. 35 (38), 10009-10014 (2014).
- Schuh, J. C. L. Medical device regulations and testing for toxicologic pathologists. Toxicologic Pathology. 36 (1), 63-69 (2008).
- Pizzoferrato, A., et al. Cell culture methods for testing Biocompatibility. Clinical Materials. 15 (3), (1994).
- Pereira Paula, A. B., et al. Direct pulp capping: what is the most effective therapy? - review and meta-analysis. Journal of Evidence Based Dental Practice. , (2018).
- Caiaffa, K. S., et al. Effect of analogues of cationic peptides on dentin mineralization markers in odontoblast-like cells. Archives of Oral Biology. 103, 19-25 (2019).
- Fujiwara, S., Kumabe, S., Iwai, Y. Isolated rat dental pulp cell culture and transplantation with an alginate scaffold. Okajimas Folia Anatomica Japonica. 83 (1), 15-24 (2006).
- Nakashima, M., et al. Stimulation of Reparative Dentin Formation by Ex Vivo Gene Therapy Using Dental Pulp Stem Cells Electrotransfected with Growth/differentiation factor 11 (Gdf11). Human Gene Therapy. 15 (11), 1045-1053 (2004).
- Narayanan, K., et al. Differentiation of embryonic mesenchymal cells to odontoblast-like cells by overexpression of dentin matrix protein 1. Proceedings of the National Academy of Sciences of the United States of America. 98 (8), 4516-4521 (2001).
- Kim, H. J., Yoo, J. H., Choi, Y., Joo, J. Y., Lee, J. Y., Kim, H. J. Assessing the effects of cyclosporine A on the osteoblastogenesis, osteoclastogenesis, and angiogenesis mediated by the human periodontal ligament stem cells. Journal of Periodontology. , (2019).
- Bou Assaf, R., et al. Healing of Bone Defects in Pig's Femur Using Mesenchymal Cells Originated from the Sinus Membrane with Different Scaffolds. Stem Cells International. , (2019).
- He, W., et al. Lipopolysaccharide enhances decorin expression through the toll-like receptor 4, myeloid differentiating factor 88, nuclear factor-kappa B, and mitogen-activated protein kinase pathways in odontoblast cells. Journal of Endodontics. 38 (4), 464-469 (2012).
- Xiong, Y., et al. Wnt Production in Dental Epithelium Is Crucial for Tooth Differentiation. Journal of Dental Research. 98 (5), 580-588 (2019).
- Haruyama, N., et al. Genetic evidence for key roles of decorin and biglycan in dentin mineralization. Matrix Biology. 28 (3), 129-136 (2009).
- Sreenath, T., et al. Dentin Sialophosphoprotein Knockout Mouse Teeth Display Widened Predentin Zone and Develop Defective Dentin Mineralization Similar to Human Dentinogenesis Imperfecta Type III. Journal of Biological Chemistry. 278 (27), 24874-24880 (2003).
- Yang, Y., Zhao, Y., Liu, X., Chen, Y., Liu, P., Zhao, L. Effect of SOX2 on odontoblast differentiation of dental pulp stem cells. Molecular Medicine Reports. 16 (6), 9659-9663 (2017).
- Tao, H., et al. Klf4 Promotes Dentinogenesis and Odontoblastic Differentiation via Modulation of TGF-β Signaling Pathway and Interaction With Histone Acetylation. Journal of Bone and Mineral Research. 34 (8), 1502-1516 (2019).
- Massa, L. F., Ramachandran, A., George, A., Arana-Chavez, V. E. Developmental appearance of dentin matrix protein 1 during the early dentinogenesis in rat molars as identified by high-resolution immunocytochemistry. Histochemistry and Cell Biology. 124 (3-4), 197-205 (2005).
- Hao, J., Zou, B., Narayanan, K., George, A. Differential expression patterns of the dentin matrix proteins during mineralized tissue formation. Bone. 34 (6), 921-932 (2004).
- Tompkins, K., Alvares, K., George, A., Veis, A. Two related low molecular mass polypeptide isoforms of amelogenin have distinct activities in mouse tooth germ differentiation in vitro. Journal of Bone and Mineral Research. 20 (2), 341-349 (2005).
- Zhai, Y., et al. Activation and Biological Properties of Human β Defensin 4 in Stem Cells Derived From Human Exfoliated Deciduous Teeth. Frontiers in Physiology. 10, (2019).
- Bègue-Kirn, C., Ruch, J. V., Ridall, A. L., Butler, W. T. Comparative analysis of mouse DSP and DPP expression in odontoblasts, preameloblasts, and experimentally induced odontoblast-like cells. European Journal of Oral Sciences. 106, 254-259 (1998).
- Kikuchi, H., Suzuki, K., Sakai, N., Yamada, S. Odontoblasts induced from mesenchymal cells of murine dental papillae in three-dimensional cell culture. Cell and Tissue Research. 317 (2), 173-185 (2004).
- Li, X., Yang, G., Fan, M. Effects of homeobox gene distal-less 3 on proliferation and odontoblastic differentiation of human dental pulp cells. Journal of Endodontics. 38 (11), 1504-1510 (2012).
- Chen, S., et al. Differential regulation of dentin sialophosphoprotein expression by Runx2 during odontoblast cytodifferentiation. Journal of Biological Chemistry. 280 (33), 29717-29727 (2005).
- Narayanan, K., Gajjeraman, S., Ramachandran, A., Hao, J., George, A. Dentin matrix protein 1 regulates dentin sialophosphoprotein gene transcription during early odontoblast differentiation. Journal of Biological Chemistry. 281 (28), 19064-19071 (2006).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. A substractive PCR-based cDNA library from human odontoblast cells: identification of novel genes expressed in tooth forming cells. Matrix Biology. 19 (5), 421-430 (2000).
- Miyazaki, T., Baba, T., Mori, T., Komori, T. Collapsin Response Mediator Protein 1, a Novel Marker Protein for Differentiated Odontoblasts. Acta Histochemica et Cytochemica. 51 (6), 185-190 (2018).
- Yokoi, M., Kuremoto, K., Okada, S., Sasaki, M., Tsuga, K. Effect of attenuation of fibroblast growth factor receptor 2b signaling on odontoblast differentiation and dentin formation. In Vitro Cellular and Developmental Biology - Animal. 55 (3), 211-219 (2019).
- Tohma, A., et al. Glucose Transporter 2 and 4 Are Involved in Glucose Supply during Pulpal Wound Healing after Pulpotomy with Mineral Trioxide Aggregate in Rat Molars. Journal of Endodontics. , (2019).
- Sueyama, Y., Kaneko, T., Ito, T., Kaneko, R., Okiji, T. Implantation of Endothelial Cells with Mesenchymal Stem Cells Accelerates Dental Pulp Tissue Regeneration/Healing in Pulpotomized Rat Molars. Journal of Endodontics. 43 (6), 943-948 (2017).
- Petersson, U., Hultenby, K., Wendel, M. Identification, distribution and expression of osteoadherin during tooth formation. European Journal of Oral Sciences. 111 (2), 128-136 (2003).
- Couble, M. L., et al. Immunodetection of osteoadherin in murine tooth extracellular matrices. Histochemistry and Cell Biology. 121 (1), 47-53 (2004).
- Buchaille, R., Couble, M. L., Magloire, H., Bleicher, F. Expression of the small leucine-rich proteoglycan osteoadherin/osteomodulin in human dental pulp and developing rat teeth. Bone. 27 (2), 265-270 (2000).
- Salmon, B., et al. Abnormal osteopontin and matrix extracellular phosphoglycoprotein localization, and odontoblast differentiation, in X-linked hypophosphatemic teeth. Connective Tissue Research. 55, 79-82 (2014).
- Liao, C., Ou, Y., Wu, Y., Zhou, Y., Liang, S., Wang, Y. Sclerostin inhibits odontogenic differentiation of human pulp-derived odontoblast-like cells under mechanical stress. Journal of Cellular Physiology. 234 (11), 20779-20789 (2019).
- Deng, X., et al. The combined effect of oleonuezhenide and wedelolactone on proliferation and osteoblastogenesis of bone marrow mesenchymal stem cells. Phytomedicine. 153103, (2019).
- Choi, H., Kim, T. H., Yun, C. Y., Kim, J. W., Cho, E. S. Testicular acid phosphatase induces odontoblast differentiation and mineralization. Cell and Tissue Research. 364 (1), 95-103 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados