Method Article
자가 혈전을 이용한 폐색전증의 최소 침습적 쥐 모델 확립
요약
자가 혈전을 사용하여 폐색전증의 최소 침습 랫드 모델을 확립하기 위한 자세한 방법론이 설명됩니다. 경색 부위를 정량화하고 폐동맥 나무를 시각화하기 위한 추가 방법도 제공됩니다.
초록
폐색전증(PE)은 심혈관 질환으로 인한 사망의 주요 원인 중 하나이며, 이로 인해 사회경제적 부담이 크게 발생합니다. 현재의 치료법은 주로 항응고제와 혈전용해술에 초점을 맞추고 있지만, 병태생리학에 대한 더 나은 이해와 새로운 치료 전략의 개발이 시급히 필요합니다. 동물 모델은 PE를 이해하고 질병에 대한 새로운 치료법을 개발하는 데 중요한 역할을 하며, 설치류는 윤리적 및 비용 고려 사항으로 인해 일반적으로 사용됩니다. 그러나 PE에 대한 기존 설치류 모델은 표준화된 절차가 부족하여 재현성 및 교차 연구 비교를 방해합니다. 본 연구는 자가 혈전을 이용하여 PE의 최소 침습적 쥐 모델을 확립하는 것을 목표로 한다. 이 모델은 최소 침습 혈액 샘플링 기술, 표준화된 혈전 생성 절차 및 최소 침습 정맥 접근을 특징으로 합니다. 또한 경색 부위를 정량화하고 폐동맥 나무를 시각화하기 위한 프로토콜이 제공됩니다. 이러한 절차는 PE 진행을 연구하기 위한 설치류 모델의 신뢰성을 높이고 새로운 치료법의 개발을 촉진하는 것을 목표로 합니다.
서문
폐색전증(PE)은 병원 내 사망의 주요 원인이며 심혈관 질환으로 인한 사망 원인 중 세 번째로 흔한 질환입니다. 높은 발병률에도 불구하고 예방과 신속한 진단은 여전히 어려운 과제입니다 1,2. 항응고 요법과 혈전용해 요법은 조루병 치료에 매우 중요하지만, 질병 관리를 개선하기 위해서는 질병 진행에 대한 심층적인 이해와 새로운 치료법이 필수적이다3.
현대 생물의학 연구에서 동물 모델은 인간 질병의 메커니즘을 밝히고 새로운 치료법을 개발하는 데 중추적인 역할을 합니다 4,5. 생쥐, 쥐, 햄스터 및 토끼는 윤리적 고려 사항과 비용 효율성으로 인해 PE 모델링에 자주 사용됩니다 6,7,8,9,10. PE 모델링 접근 방식은 일반적으로 생체 내 혈전 형성, 체외 혈전 주입 및 비혈전성 입자 투여의 세 가지 범주로 나뉩니다. 동물 종과 모델링 기법의 선택은 모든 목적에 적합한 단일 모델이 없기 때문에 특정 연구 목표에 따라 결정됩니다. 예를 들어, 새로운 혈전용해 요법을 탐구하는 데 초점을 맞춘 연구에서는 비혈전성 입자 대신 자가 혈전과 관련된 모델을 사용하는 경우가 많습니다.
설치류의 PE를 모델링하는 현재 방법은 상세하고 표준화된 방법론이 없기 때문에 어려움에 직면해 있습니다. 이는 혈액 샘플링, 혈전 형성 및 후속 색전술과 같은 주요 프로세스에 영향을 미치며, 이 모든 것은 연구 전반에 걸쳐 재현 가능한 결과를 보장하는 데 중요합니다. 또한, 색전술 부위를 정량화하고 색전술 후 색전술의 분포를 정확하게 매핑하는 능력에는 상당한 격차가 있습니다. 이러한 단점을 해결하는 것은 PE 연구에서 설치류 모델의 신뢰성과 유용성을 발전시키는 데 필수적입니다.
본 연구에서는 자가 혈전을 이용하여 PE의 랫트 모델을 확립하기 위한 상세한 프로토콜에 대해 설명한다. 이 모델은 최소 침습 혈액 샘플링 기술, 표준화된 혈전 생성 절차 및 최소 침습 정맥 접근을 특징으로 합니다. 또한 폐의 경색 부위를 정량화하고 폐동맥 나무를 시각화하기 위한 프로토콜이 제공되어 추가 연구 발견을 용이하게 할 수 있습니다.
프로토콜
모든 동물 실험은 중국의학원 및 북경연합 의과대학의 동물관리 및 사용 위원회(승인번호: IRM/2-1ACUC-2311-015)의 승인 하에 수행되었습니다. 이 연구에는 생후 6주, 체중 약 250g의 수컷 Sprague-Dawley 쥐가 사용되었습니다. 동물들은 균형 잡힌 차우 식단과 물을 자유롭게 이용할 수 있는 특정 병원체가 없는 환경에 수용되었습니다. 그들은 22 ° C ± 2 ° C의 실내 온도에서 12 시간의 라이트 / 다크 사이클 하에서 유지되었습니다. 동물들은 수술을 받기 전에 1주일 동안 환경에 적응하도록 허용되었습니다. 이 연구에 사용된 시약 및 장비의 세부 정보는 재료 표에 나열되어 있습니다.
1. 장비 및 재료
- 마취 장비: 작은 동물과 이소플루란을 위한 가스 마취기를 사용합니다.
- 수술 재료 : 면봉, 요오드 소독제, 실체 현미경, 면도기, 의료용 테이프, 1mL 주사기와 27G 주사기, 5mL 주사기, 10mL 주사기, 생리식염수, 거즈, 8-0 나일론 실, 봉합사 바늘이 있는 6-0 나일론 실, 마이크로 지혈 클램프, 마이크로 핀셋 및 가는 가위.
- 기타 재료: 의료용 주사기와 호환되는 19G 및 18G 디스펜싱 바늘, 내경 1.2mm, 길이 10cm의 실리콘 튜브, 내경 3.0mm, 길이 20cm의 주입 튜브, 1.5mL 원심분리 튜브, 피펫 및 피펫 팁을 얻습니다.
- 자체 제작한 혈전 발생기 및 혈전 주입기(그림 1): 1mL 주사기에 부착된 19G 디스펜싱 바늘에 실리콘 튜브를 연결하여 혈전 발생기를 만듭니다. 주입 튜브의 한쪽 끝을 18G 디스펜싱 바늘에 연결하고 다른 쪽 끝을 5mL 주사기에 연결하여 혈전 주입기를 만듭니다.
2. 자가 혈전 준비
- 마취
- 동물을 마취 유도실 내부에 넣고 4% 이소플루란과 실내 공기의 혼합물을 2-3분 동안 2L/min의 유속으로 투여합니다(기관에서 승인한 프로토콜에 따름).
- 동물을 누운 자세로 작업 플랫폼에 놓습니다. 0.4L/min의 유속으로 2.5% 이소플루란을 투여하여 마취를 유지합니다. 페달 반사를 테스트하여 적절한 마취가 이루어졌는지 확인하십시오.
- 양쪽 앞다리를 몸에서 수평으로 뻗고 뒷다리를 뻗어 사타구니 부위를 적절하게 노출시킵니다. 의료용 테이프를 사용하여 이 위치에 동물을 고정합니다(그림 2A).
- 두개대정맥(CVC)을 통한 혈액 샘플링
- 면도기와 제모 크림을 사용하여 마누브리움 주변의 털을 제거합니다. 요오드로 피부를 소독한다.
- 그림 27A와 같이 1mL 주사기에 부착된 2G 바늘을 8mm 깊이까지 수직으로 삽입하여 왼쪽 또는 오른쪽 CVC에 구멍을 뚫습니다.
참고: CVC의 본체 표면 돌출부는 제조관 측면으로 5mm입니다. 양쪽 모두를 사용할 수 있으며 선택은 다음 단계에 영향을 미치지 않습니다. - 주사기를 잡고 플런저를 부드럽게 뒤로 당겨 배럴 내부에 음압을 생성합니다. 혈액이 들어올 때까지 바늘을 서서히 빼낸 다음 0.3mL의 혈액이 수집될 때까지 그 위치를 유지합니다(그림 2B).
- 혈전 준비
- 수집된 혈액을 1.5mL 원심분리기 튜브에 밀어 넣고 거품이 생성되지 않도록 주의합니다.
- 혈액 기둥의 길이가 10cm가 될 때까지 자체 제작 혈전 발생기의 실리콘 튜브로 혈액을 끌어들입니다.
참고: 원심분리기 튜브에서 응고가 시작되고 전파되어 채취된 혈전의 질을 저하시키므로 이 두 단계를 빠르게 수행하십시오. - 혈액이 완전히 혈전이 될 때까지 30분 동안 기다립니다. 이 기간 동안 같은 방법으로 다른 동물을 위한 혈액 기둥을 준비하십시오.
- 혈전이 형성된 혈액 기둥을 일반 식염수가 들어 있는 페트리 접시에 세척하고 혈전 기둥을 일반 식염수로 세 번 세척합니다(그림 2C).
- 가는 가위를 사용하여 혈전 기둥을 각각 4mm 길이의 균일한 혈전으로 자릅니다(그림 2D). 2mL의 생리식염수가 미리 채워진 자체 제작 주입기에 10-20개의 혈전을 뽑습니다.
참고: 혈전의 길이는 1cm를 초과해서는 안 되며, 그렇지 않으면 혈전이 우심실에 갇히게 됩니다.
3. 정맥 접근 준비
- 표재성 상복부 혈관 노출
- 2.1단계에서 설명한 대로 동물을 마취하고 고정합니다.
- 왼쪽 사타구니 부위를 둘러싼 수염을 면도합니다. 이 부위에 제모 크림을 바르고 1분 정도 기다린 후 거즈로 크림을 닦아냅니다. 요오드로 피부를 소독한다.
- 사타구니 부위의 표재성 상복부 혈관 원점 위로 5mm 피부 절개를 만듭니다. 일반적으로 표재성 상복부 혈관의 기원은 사타구니 부위의 작은 맥동을 관찰하여 추적할 수 있습니다.
- 10배 확대 실체 현미경을 사용하여 피하 지방의 얇은 층을 분리하여 표재성 상복부 혈관을 노출시킵니다(그림 3A).
- 표재성 상복부 정맥 분리
- 동맥, 신경 및 지방 조직에서 표재성 상복부 정맥을 조심스럽게 분리하십시오. 이 두 가지를 근방으로, 대퇴 정맥으로 배출되는 지점까지, 그리고 원위부에서는 첫 번째 정맥 분기점까지 수행합니다.
- 8-0으로 말단부 합자 마이크로 클램프로 나사산을 끼우고 고정합니다. 8-0으로 근위측을 제어합니다. 다른 마이크로 cl에 연결된 나사 루프amp(그림 3B).
- 분리된 정맥의 원위부에 작은 횡방향 절개를 만듭니다. 출혈을 피하기 위해 근위부를 조절하십시오. 정맥 내강에 남아 있는 혈액을 생리식염수로 씻어냅니다. 정맥이 깨끗해지면 마이크로 핀셋을 사용하여 정맥 절개 부위를 확대합니다.
4. 색전술
- 정맥 캐뉼레이션
- 자체 제작 인젝터의 바늘을 정맥 절개를 통해 정맥에 부드럽게 삽입합니다. 세 번째 클램프로 바늘을 고정합니다.amp 정맥에서 미끄러지는 것을 방지합니다.
- 색전술 절차
- 플런저를 천천히 밀어 소량의 생리식염수를 투여합니다. 저항이 없는 정맥의 충만함은 정맥 접근이 막히지 않았음을 나타냅니다(그림 3D).
- 플런저를 계속 밀어 표재성 상복부 정맥 접근을 통해 대퇴 정맥으로 혈전을 투여합니다. 색전술 속도를 분당 5회 색전으로 조절합니다. 동물의 호흡을 모니터링하십시오. 호흡곤란이 나타나고 악화되는 것은 성공적인 색전술을 나타냅니다.
- 미리 정해진 양의 혈전을 주입한 후 바늘을 빼내고 표재성 상복부 정맥의 근위측을 결찰합니다.
- 절개 부위를 봉합하고 동물을 따뜻한 상자에 넣습니다. 동물이 깨어나면 우리로 옮깁니다.
5. 경색 부위의 정량화
- 안락사와 심장 관류
- 생리 식염수 250mL에 헤파린 나트륨 25,000U를 넣고 잘 섞습니다. 병을 주입 장치에 연결하고 병을 80cm 높이에 거꾸로 걸어둡니다. 주입 장치의 밸브를 닫습니다.
- 이소플루란을 과다 투여한 동물을 안락사시킵니다(제도적으로 승인된 프로토콜에 따름).
- 큰 가위로 갈비뼈를 자르고 가슴을 열어 폐와 큰 혈관이 손상되지 않도록 합니다.
- 주입 장치의 바늘을 좌심실에 삽입합니다. 주입 장치의 밸브를 열어 간경화염수를 주입할 수 있도록 합니다. 가위를 사용하여 하대정맥과 왼쪽 부속물을 잘라 배수를 허용합니다. 관류 속도를 50mL/분으로 제어합니다.
참고: 이 절차를 수행하는 동안 정상적인 폐 조직은 하얗게 변하고 색전술된 영역은 녹슨 상태로 유지됩니다. - 헤파린화된 식염수로 관류를 완료한 후 4% 파라포름알데히드 용액으로 채워진 10mL 주사기를 사용하여 우심실을 통해 폐동맥 줄기를 뚫습니다. 총 30mL의 부피에 대해 폐를 통해 4% 파라포름알데히드 관류를 수행하여 폐 조직을 고정합니다.
- Infarction Ratio라는 인덱스를 소개합니다.
- 고정 후 척추와 횡격막에서 폐, 심장, 기관, 식도, 흉선 및 큰 혈관 전체를 절제한다11.
- 초기 종괴에서 식도, 흉선 및 지방 조직을 조심스럽게 제거하고 심장, 폐 및 큰 혈관만 남깁니다.
- 나머지 부분을 적절한 양의 4% 파라포름알데히드 용액에 최소 48시간 동안 담그십시오.
- 분석 저울을 사용하여 전체 폐의 무게를 측정합니다. 가는 가위를 사용하여 폐의 경색된 부분을 분리하고 동일한 저울로 경색된 조직의 무게를 잰다. 다음 방정식을 사용하여 Infarction Ratio를 계산합니다.
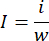
i는 경색된 조직의 무게, w는 전체 폐의 무게, i 는 경색 비율을 나타냅니다. - 경색 부위를 정량화한 후, 파라핀 포매링을 위해 파라포름알데히드로 고정된 폐 조직을 다듬습니다11.
6. 폐동맥 나무의 시각화
- 폐동맥 주물
- 동물을 안락사시키고 5.1단계에서 설명한 대로 심장 관류를 수행합니다.
- 실리콘 주조 화합물에 동일한 양(중량 기준)의 희석제를 첨가하고 혼합물을 혼합한 다음 경화제의 5%(중량 또는 부피 기준)를 첨가합니다. 혼합물을 다시 섞습니다.
- 혼합물 1mL를 1mL 주사기에 넣고 공기를 배출한 다음 바늘을 우심실을 통해 폐동맥 줄기에 삽입합니다. 미끄러짐과 역류를 방지하기 위해 바늘을 폐동맥에 고정합니다.
- 플런저를 부드럽게 눌러 실리콘 주조 혼합물이 폐동맥 나무를 채울 수 있도록 합니다. 정상적인 폐 부위는 주조 혼합물에 의해 염색되고 경색된 부위는 녹슨 빨간색으로 유지됩니다.
참고: 폐동맥 깁스는 손상되지 않은 폐 조직에만 적용해야 합니다. 일반적으로 0.6-0.8mL의 주조 혼합물은 폐동맥 트리를 채우기에 충분합니다. 주조 혼합물을 과도하게 주입하면 폐정맥 주조가 발생할 수 있으며, 이는 폐동맥 나무의 시각화에 영향을 미칩니다. 주조 혼합물은 경화제를 첨가한 후 20분 이내에 사용해야 하며, 이 시간이 지나면 결정화됩니다. - 관류를 시전한 후 주사기를 빼내고, 폐동맥 줄기를 결찰하고, 5.2단계에서 설명한 대로 폐, 심장 및 큰 혈관을 적출합니다. 전체 덩어리를 페트리 접시에 넣고 주조 혼합물이 결정화될 수 있도록 4°C 냉장고에 밤새 보관하십시오.
- 정리 및 시각화
- 가위로 폐에서 심장과 큰 혈관을 제거한 다음 폐 표면에서 경화 혼합물 파편을 청소합니다.
- 각각 24시간 동안 25%, 50%, 75%, 95% 및 100% 에틸 알코올 용액에 폐를 순차적으로 담그십시오. 이 절차는 폐를 완전히 탈수시킵니다.
- 탈수된 폐를 메틸 살리실레이트에 24시간 동안 담급니다. 이 제거 과정 후에 폐동맥 나무가 보이고 메틸 살리실레이트가 헤모글로빈을 제거하지 않기 때문에 색전도 볼 수 있습니다(그림 4B, D).
결과
PE 모델의 증상 및 병리학
색전술 동안 쥐는 호흡 곤란을 경험했고 흉부의 변동이 넓어졌습니다. 거의 모든 동물이 10cm 미만의 혈전이 투여되었을 때 폐색전증 에피소드에서 살아남았습니다(모델링된 동물 15마리 중 14마리). 우리로 돌아간 후, 동물들은 구석에 웅크리고 앉아 음식과 물에 대한 관심이 줄어든 모습을 보였다. 그러나 이러한 증상은 빠르게 해결되었고 몇 시간 안에 동물들은 정상적으로 행동했습니다. 색전술 후 기준선과 24시간 경과 시점 사이에 체중 차이는 없었다(341.8 ± 10.4 vs. 343.3 ± 8.5, p =0.25).
총체적 병리학에 의하면 색전술된(경색된) 부위는 쐐기 모양이며, 대부분 폐의 하부에 위치하며, 경계가 뚜렷한 것으로 밝혀졌다. 색전은 경색 부위의 정점에서 발견되어 폐동맥의 첫 번째 및 두 번째 가지를 막고 있었습니다. 헤마톡실린-에오신 염색을 사용한 현미경 병리학은 폐동맥 분지의 색전술을 확인했습니다(그림 4F).
혈전 부하 및 경색 부위
혈전 부하가 폐 경색에 미치는 영향에 대한 예비 조사에서 낮은 혈전 부하(6cm 혈전 기둥, 15개의 응고)와 높은 혈전 부하(10cm 혈전 기둥, 25개의 응고)를 모두 테스트했습니다. 예상대로, 색전의 부하가 높을수록 폐 경색의 영역이 더 넓어졌습니다(그림 5A-C).
24시간 이내 내인성 섬유소용해
색전술 직후 채취한 폐 샘플과 비교했을 때, 색전술 직후 24시간 후에 채취한 폐 샘플에서는 경색 부위가 현저히 감소한 것으로 나타났으며, 이는 쥐에서 강력한 내인성 섬유소 용해 가능성을 나타냅니다(그림 5D).
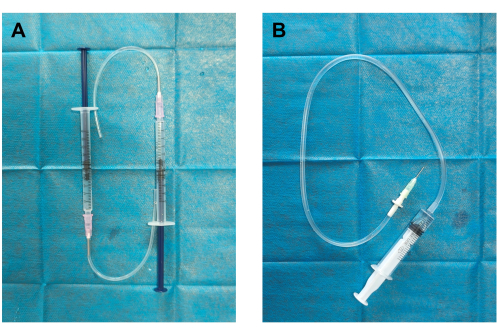
그림 1: 혈전 발생기 및 혈전 주입기의 구조. (A) 혈전 발생기는 실리콘 튜브를 18G 분주 바늘(외경 12mm)과 0.5mL 생리식염수가 미리 채워진 1mL 주사기에 연결하여 조립했습니다. (B) 혈전 주입기는 19G 분배 바늘(내경 0.84mm, 외경 1.08mm)을 주입 튜브(혈전 용기)에 연결하고 2mL 생리식염수가 미리 채워진 5mL 주사기로 구성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 혈액 채취 및 혈전 준비. (A) 쥐를 마취하고 누운 자세로 고정했습니다. 점선이 있는 흰색 원은 마누브리움을 나타내며 신체 표면 마커 역할을 합니다. 흰색 원 옆에 있는 빨간색 점은 양측 두개골 대정맥(CVC)에 접근하기 위한 천자 부위를 나타냅니다. 그림의 아래 부분은 manubrium, CVC 및 천자 부위의 상대적 위치에 대한 부검 그림을 보여줍니다. (B) 올바른 CVC를 통한 성공적인 혈액 샘플링. (C) 자체 제작 혈전 발생기에서 혈전이 발생한 혈액 기둥이 씻겨 나오는 것. (D) 혈전증된 혈액주에서 유래한 혈전. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 정맥 접근 및 색전술. (A) 5mm 피부 절개를 통한 표재성 상복부 혈관의 노출, 파란색 화살표는 표재성 상복부 정맥을 나타내고 빨간색 화살표는 표재성 상복부 동맥을 나타냅니다. (B) 주변 조직으로부터 표재성 상복부 정맥을 분리하고 나일론 실로 정맥을 조절합니다. (C) 혈전을 함유한 자체 제작 주사기. (D) 자체 제작 주사기의 분배 바늘로 정맥을 캐뉼레이션하고 정맥 접근을 통해 혈전을 투여합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 폐색전증의 병리학. (A) 심염수 관류 및 4% 파라포름알데히드 고정 후 정상 폐. (B) 실리콘 주조 혼합물과 메틸 살리실레이트 투명화에 의해 시각화된 정상 폐, 특허 폐동맥 나무와 미세혈관 구조를 보여줍니다. (C) 색전술 직후 자가 혈전이 있는 폐로, 색전술로 인한 폐 경색을 나타내는 표시된 영역이 있는 폐. (D) 실리콘 혼합물 주조 및 메틸 살리실레이트 투명화에 의해 시각화된 병든 폐, 검은색 화살표는 폐동맥 가지를 막고 있음을 나타내고 흰색 점선 원은 경색된 영향을 받은 부위를 나타냅니다. (E) 폐동맥 분지에서 색전(빨간색 화살표)을 보여주는 왼쪽 폐엽 절개. (F) Hematoxylin 및 eosin 염색을 사용한 폐동맥 분지의 혈전 색전술의 현미경 이미지. 눈금 막대 : 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 폐 경색 비율의 정량화. (A) 10cm의 혈전(총 길이)이 있는 색전술 후 쥐에서 즉시 채취한 폐. (B) 6cm의 혈전으로 색전술 후 쥐에서 즉시 채취한 폐. (C) 8cm의 혈전으로 색전술 후 쥐에서 즉시 채취한 폐. (D) 색전술 후 24시간 후에 8cm의 혈전이 있는 쥐에서 채취한 폐. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본 연구에서는 자가 혈전을 이용한 PE의 최소 침습적 쥐 모델을 성공적으로 확립하였다. 이 모델링 절차를 마스터하면 30분 이내에 완료할 수 있습니다. 이 모델은 병리학적 검사로 확인된 임상 PE의 주요 특징을 효과적으로 포착합니다. 결과적으로, PE 후 합병증의 혈역학적 변화 및 발병 기전을 설명하고, 새로운 진단 바이오마커 및 치료 표적을 개발하고, 새로운 항혈전 치료를 테스트하는 데 유용한 도구를 제공합니다.
PE 동물 모델을 개발하기 위해 수십 년 동안 상당한 노력이 기울여졌지만 PE12 모델링에 최적화된 단일 방법은 확인되지 않았습니다. 이 기사에서 변형된 PE 모델은 다음과 같은 몇 가지 뚜렷한 특징을 보여줍니다: (1) 중심정맥 카테터(CVC)에서 혈액 채취: 설치류에서 CVC는 쇄골하정맥과 내경정맥의 합류점과 연결되어 꼬리 방향으로 흉강으로 확장됩니다13. 왼쪽 및 오른쪽 CVC는 거의 대칭입니다. CVC는 경정맥보다 더 큰 내강을 가지고 있고, 마누브리움 가까이에 위치하며, 대흉근 아래에 있습니다. 이러한 해부학적 특성으로 인해 정확한 정맥 천자, 더 많은 혈액 샘플링 볼륨, 빠른 지혈이 가능하여 높은 성공률을 얻을 수 있습니다. 또한 CVC에서 혈액을 채취하는 것은 다른 혈액 채취 경로에 비해 오염에 덜 민감하며 혈종, 혈전증 및 기흉과 같은 합병증과 같은 합병증이 발생할 가능성이 적습니다. 지혈은 일반적으로 압력에 따라 자동 또는 빠르게 달성됩니다. (2) 표재성 상복부 정맥을 통한 주입 : 일반적으로 PE 6,8,9를 유도하기 위해 혈전 주사에 외부 경정맥을 사용하며 노출을 위한 피부 절개는 최소화할 수 있습니다. 그러나 외부 경정맥의 캐뉼레이션은 종종 정맥 폐색으로 이어지며, 이는 외부 경정맥이 출생 후 쥐의 주요 두개골 유출이기 때문에 후속 실험에 부정적인 영향을 미칠 수 있습니다14 우심실압력 측정을 위해 다른 외부 경정맥의 캐뉼레이션이 필요하기 6,8,10. 이 수정된 모델에서는 표재성 상복부 정맥을 희생하는 것이 신체에 미치는 영향을 최소화합니다. 또한, 혈전 주사를 위한 이 경로는 대부분의 색전이 하지 정맥에서 발생하는 임상 PE를 모방합니다. 표재성 상복부 동맥의 정확한 위치는 작은 절개 부위에 매우 중요합니다. 표재성 상복부 동맥의 맥동은 일반적으로 사타구니의 피부 표면에 기록될 수 있으며, 이는 혈관 식별에 도움이 됩니다. (3) 맞춤형 색전 부담: 색전 부담은 혈액 기둥의 직경과 총 길이에 의해 결정됩니다. 이 연구에 사용된 혈전 발생기는 표준 및 맞춤형 색전 부하 준비를 가능하게 합니다. 연구원은 연구 요구 사항에 따라 이러한 매개변수를 조정할 수 있습니다. 이 경우 색전부하가 눈에 띄는 증상과 징후를 유발하지만 사망에 이를 가능성은 적습니다. 일반적으로 10cm 미만의 혈전을 주입하면 안전합니다. 무호흡증이 발생하면 즉시 주사를 중단해야 합니다. 그런 다음 실험자는 손가락을 측면 및 전방 흉벽에 놓고 동물의 가슴을 잡고 리드미컬한 흉부 압박을 수행해야 합니다. 동물의 호흡은 이러한 기동 후에 회복될 수 있습니다. (4) 경색 부위의 폐 관류 및 정량화: 본 연구는 PE 유도 후 폐 경색의 더 나은 시각화를 위한 상세한 폐 관류 기술을 소개합니다. 이를 바탕으로 경색 부위를 정량화하는 지표인 경색 비율(infarction ratio)이 개발되었습니다. 현재 결과는 이 지수가 색전량 부하 및 내인성 혈전용해술에 반응할 수 있음을 시사하며, 새로운 항혈전 요법을 조사하는 연구에서 그룹 간 비교에 잠재적으로 유용할 수 있음을 시사합니다.
PE 모델링과 비교했을 때, PE의 심각한 장기 합병증인 만성 혈전색전성 폐고혈압(CTEPH)을 모델링하는 것은 설치류의 높은 섬유소 용해 활성으로 인해 더 어렵습니다. 잠재적인 해결책으로는 반복적인 색전술과 섬유소 용해 억제제인 트라넥삼산(TXA)의 투여 7,10,12,15가 있습니다. 그러나 정맥 접근 손상과 TXA의 빠른 혈장 제거로 인해 CTEPH 모델링이 계속 어려워지고 있습니다. 여기에 제시된 모델 및 수반되는 시각화 프로토콜은 신뢰할 수 있는 CTEPH 모델을 설정하는 데 도움이 되는 통찰력을 제공할 수 있습니다.
이 원고의 한계 또한 다루어져야 한다. 첫째, 이 모델에 대한 우심실 압력 및 심초음파와 같은 혈류역학적 측정이 부족합니다. 그러나 이것은 병리학적으로 검증된 모델이므로 모델의 유효성을 부정하지는 않습니다. 연구자들은 혈류역학적 측정에 대한 자세한 방법론을 위해 다른 문헌을 참조할 수 있다16. 둘째, 와파린과 우로키나제의 투여와 같이 이 PE 모델에서 약물 반응을 평가하기 위한 치료군은 포함되지 않았으며, 이는 모델의 유용성을 추가로 입증할 수 있었습니다.
결론적으로, 최소 침습적 접근 방식을 특징으로 하는 PE의 수정된 설치류 모델이 성공적으로 확립되었습니다. 경색 부위를 정량화하고 폐동맥 나무를 시각화하는 방법도 제공되었습니다. 이 모델은 조루증 합병증의 예방 및 치료에 관한 중요한 질문을 해결할 수 있는 가능성을 가지고 있습니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 Wu Jieping Medical Foundation(320.6750.19089-36)의 보조금으로 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Analytical balance | METTLER TOLEDO | MA55/A | None |
| Dispensing needle | Jinrong electronics | None | 19 G and 18 G |
| Fine scissors | Stronger | XGJ1300 | None |
| Heparin sodium salt | Solarbio | 01-08-9041 | 140U/mg |
| Isoflurane | RWD | R510-22-10 | None |
| Methyl salicylate | Macklin | M813577 | AR, 99% |
| Micro clamp | JZ | W40160 | None |
| Micro tweezers | Stronger | XGN1310 | None |
| Silicone casting compound | Flow Tech | MV-130 | None |
| Sprague-Dawley rats | Vital River | SD-IGS | None |
| Stereo microscope | Murzider | MSD204 | None |
참고문헌
- Götzinger, F., et al. Interventional therapies for pulmonary embolism. Nat Rev Cardiol. 20 (10), 670-684 (2023).
- Falster, C., et al. Comparison of international guideline recommendations for the diagnosis of pulmonary embolism. Lancet Haematol. 10 (11), e922-e935 (2023).
- Konstantinides, S. V., et al. ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 41 (4), 543-603 (2020).
- Domínguez-Oliva, A., et al. The importance of animal models in biomedical research: Current insights and applications. Animals (Basel). 13 (7), 1223 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Tang, Z., et al. Gene expression profiling of pulmonary artery in a rabbit model of pulmonary thromboembolism. PLoS One. 11 (10), e0164530 (2016).
- Deng, C., et al. Expression of tissue factor and forkhead box transcription factor o-1 in a rat model for chronic thromboembolic pulmonary hypertension. J Thromb Thrombolysis. 42 (4), 520-528 (2016).
- Runyon, M. S., Gellar, M. A., Sanapareddy, N., Kline, J. A., Watts, J. A. Development and comparison of a minimally-invasive model of autologous clot pulmonary embolism in Sprague-Dawley and Copenhagen rats. Thromb J. 8, 3 (2010).
- Li, S. Q., et al. Comparative proteomic study of acute pulmonary embolism in a rat model. Proteomics. 7 (13), 2287-2299 (2007).
- Deng, C., et al. Role of FOXO1 and apoptosis in pulmonary vascular remolding in a rat model of chronic thromboembolic pulmonary hypertension. Sci Rep. 7 (1), 2270 (2017).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Karpov, A. A., Vaulina, D. D., Smirnov, S. S., Moiseeva, O. M., Galagudza, M. M. Rodent models of pulmonary embolism and chronic thromboembolic pulmonary hypertension. Heliyon. 8 (3), e09014 (2022).
- Picazo, M. G., Benito, P. J., García-Olmo, D. C. Efficiency and safety of a technique for drawing blood from the hamster cranial vena cava. Lab Anim (NY). 38 (6), 211-216 (2009).
- Szabó, K. The cranial venous system in the rat: Anatomical pattern and ontogenetic development. Ii. Dorsal drainage. Ann Anat. 177 (4), 313-322 (1995).
- Li, C. Y., et al. The effects and mechanism of ginsenoside rg1 on myocardial remodeling in an animal model of chronic thromboembolic pulmonary hypertension. Eur J Med Res. 18 (1), 16 (2013).
- Sullivan, D. M., Watts, J. A., Kline, J. A. Biventricular cardiac dysfunction after acute massive pulmonary embolism in the rat. J Appl Physiol (1985). 90 (5), 1648-1656 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유