Method Article
Mise en place d’un modèle d’embolie pulmonaire peu invasif chez le rat à l’aide de caillots sanguins autologues
Dans cet article
Résumé
Une méthodologie détaillée pour établir un modèle d’embolie pulmonaire peu invasive chez le rat à l’aide de caillots sanguins autologues est décrite. Des méthodes supplémentaires pour quantifier la zone infarctus et visualiser l’arbre artériel pulmonaire sont également fournies.
Résumé
L’embolie pulmonaire (EP) est l’une des principales causes de décès cardiovasculaires, entraînant un fardeau socio-économique important. Bien que les traitements actuels se concentrent principalement sur l’anticoagulation et la thrombolyse, il est urgent de mieux comprendre sa physiopathologie et de développer de nouvelles stratégies de traitement. Les modèles animaux jouent un rôle crucial dans la compréhension de l’EP et le développement de nouvelles thérapies pour la maladie, les rongeurs étant couramment utilisés pour des raisons éthiques et de coût. Cependant, les modèles existants de rongeurs pour l’EP sont limités par l’absence de procédures normalisées, ce qui entrave la reproductibilité et les comparaisons entre études. Cette étude vise à établir un modèle de PE peu invasif chez le rat à l’aide de caillots sanguins autologues. Le modèle comprend une technique de prélèvement sanguin peu invasive, une procédure standardisée de génération de thrombus et un accès veineux mini-invasif. De plus, des protocoles permettant de quantifier les zones infarctus et de visualiser l’arbre artériel pulmonaire sont fournis. Ces procédures visent à améliorer la fiabilité des modèles de rongeurs pour l’étude de la progression de l’EP et à faciliter le développement de nouveaux traitements.
Introduction
L’embolie pulmonaire (EP) est l’une des principales causes de décès à l’hôpital et la troisième cause la plus fréquente de décès cardiovasculaires. Malgré son incidence élevée, la prévention et le diagnostic rapide restent difficiles 1,2. Les traitements anticoagulants et thrombolytiques sont essentiels dans le traitement de l’EP, mais une compréhension plus approfondie de la progression de la maladie et de nouvelles approches thérapeutiques sont essentielles pour améliorer la prise en charge de la maladie3.
Dans la recherche biomédicale moderne, les modèles animaux jouent un rôle central dans l’élucidation des mécanismes des maladies humaines et le développement de nouvelles thérapies 4,5. Les souris, les rats, les hamsters et les lapins sont fréquemment utilisés dans la modélisation de l’EP en raison de considérations éthiques et de rentabilité 6,7,8,9,10. Les approches de modélisation de l’EP se divisent généralement en trois catégories : la formation de thrombus in vivo, l’injection in vitro de caillots sanguins et l’administration de particules non thrombotiques. Le choix de l’espèce animale et de la technique de modélisation est déterminé par les objectifs de recherche spécifiques, car aucun modèle unique ne convient à tous les usages. Par exemple, les études axées sur l’exploration de nouvelles thérapies thrombolytiques utilisent souvent des modèles impliquant des caillots sanguins autologues au lieu de particules non thrombotiques.
Les méthodes actuelles de modélisation de l’EP chez les rongeurs se heurtent à des défis en raison du manque de méthodologies détaillées et standardisées. Cela affecte des processus clés tels que l’échantillonnage sanguin, la formation de caillots sanguins et l’embolisation ultérieure, qui sont tous cruciaux pour garantir des résultats reproductibles dans toutes les études. De plus, il existe une lacune importante dans la capacité de quantifier la zone embolisée et de cartographier avec précision la distribution des embolies après l’embolisation. Il est essentiel de remédier à ces lacunes pour faire progresser la fiabilité et l’utilité des modèles de rongeurs dans la recherche sur l’EP.
Dans cette étude, des protocoles détaillés pour établir un modèle d’EP chez le rat à l’aide de caillots sanguins autologues sont décrits. Ce modèle est doté d’une technique de prélèvement sanguin mini-invasive, d’une procédure standardisée de génération de thrombus et d’un accès veineux mini-invasif. De plus, des protocoles permettant de quantifier les zones infarctus dans les poumons et de visualiser l’arbre artériel pulmonaire sont fournis, ce qui pourrait faciliter d’autres découvertes de recherche.
Protocole
Toutes les expériences sur les animaux ont été menées avec l’approbation du Comité de soin et d’utilisation des animaux de l’Académie chinoise des sciences médicales et du Collège médical de l’Union de Pékin (numéro d’approbation : IRM/2-1ACUC-2311-015). Des rats Sprague-Dawley mâles, âgés de 6 semaines et pesant environ 250 g, ont été utilisés dans cette étude. Les animaux ont été logés dans un environnement spécifique exempt d’agents pathogènes avec un accès ad libitum à une alimentation équilibrée et à de l’eau. Ils ont été conservés sous un cycle lumière/obscurité de 12 heures à une température ambiante de 22 °C ± 2 °C. Les animaux ont été laissés s’adapter à l’environnement pendant 1 semaine avant de subir des interventions chirurgicales. Les détails des réactifs et de l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Équipement et matériaux
- Équipement d’anesthésie : Utilisez un appareil d’anesthésie gazeuse pour les petits animaux et l’isoflurane.
- Matériel chirurgical : Préparez des cotons-tiges, un désinfectant à l’iodophor, un stéréomicroscope, un rasoir, du ruban médical, une seringue de 1 ml avec une aiguille de 27 g, une seringue de 5 ml, une seringue de 10 ml, une solution saline normale, de la gaze, 8-0 Fils de nylon, fil de nylon 6-0 avec une aiguille de suture, micro-pinces hémostatiques, micro-pinces à épiler et ciseaux fins.
- Autres matériaux : Procurez-vous des aiguilles de distribution de 19 G et 18 G compatibles avec les seringues médicales, un tube en silicone d’un diamètre intérieur de 1,2 mm et d’une longueur de 10 cm, d’un tube de perfusion d’un diamètre intérieur de 3,0 mm et d’une longueur de 20 cm, d’un tube à centrifuger de 1,5 ml, d’une pipette et d’embouts de pipette.
- Générateur de thrombus et injecteur de caillots sanguins fabriqués par vos soins (Figure 1) : Connectez le tube en silicone à l’aiguille de distribution de 19 G fixée à une seringue de 1 ml pour créer le générateur de thrombus. Connectez une extrémité du tube de perfusion à l’aiguille de distribution de 18 G et fixez l’autre extrémité à une seringue de 5 ml pour créer l’injecteur de caillot.
2. Préparation autologue du caillot sanguin
- Anesthésie
- Placez l’animal à l’intérieur de la chambre d’induction de l’anesthésie et administrez-lui un mélange d’isoflurane à 4 % avec de l’air ambiant à un débit de 2 L/min pendant 2 à 3 minutes (en suivant les protocoles approuvés par l’établissement).
- Positionnez l’animal sur la plate-forme d’opération en position couchée. Maintenez l’anesthésie en administrant de l’isoflurane à 2,5 % à un débit de 0,4 L/min. Testez le réflexe de la pédale pour vous assurer qu’une anesthésie adéquate est obtenue.
- Étendez les deux membres antérieurs horizontalement du corps et étendez les membres postérieurs pour exposer adéquatement la région de l’aine. Fixez l’animal dans cette position à l’aide d’un ruban adhésif médical (figure 2A).
- Prélèvement sanguin par la veine cave crânienne (CVC)
- Retirez les poils autour du manubrium à l’aide d’un rasoir et d’une crème dépilatoire. Désinfectez la peau avec de l’iodophore.
- Insérez l’aiguille de 27 G fixée à la seringue de 1 mL verticalement jusqu’à une profondeur de 8 mm pour percer le CVC gauche ou droit, comme illustré à la figure 2A.
REMARQUE : La projection de la surface du corps du CVC est de 5 mm latérale au manubrium. Les deux côtés peuvent être utilisés, et le choix n’affecte pas les étapes suivantes. - Tenez la seringue et tirez doucement le piston vers l’arrière pour créer une pression négative à l’intérieur du cylindre. Retirez graduellement l’aiguille jusqu’à ce que le sang coule, puis maintenez cette position jusqu’à ce que 0,3 mL de sang soit prélevé (figure 2B).
- Préparation des caillots sanguins
- Poussez le sang recueilli dans un tube à centrifuger de 1,5 ml, en prenant soin de ne pas produire de bulles.
- Aspirez le sang dans le tube en silicone du générateur de thrombus fabriqué par vos soins jusqu’à ce que la colonne sanguine atteigne 10 cm de long.
REMARQUE : Effectuez ces deux étapes rapidement, car la coagulation commencera et se propagera dans le tube de centrifugation, abaissant la qualité des caillots sanguins récoltés. - Attendez 30 minutes jusqu’à ce que le sang soit complètement thrombosé. Pendant ce temps, préparez des colonnes de sang pour les autres animaux de la même manière.
- Rincez la colonne sanguine thrombosée dans une boîte de Pétri contenant une solution saline normale et lavez la colonne thrombus avec une solution saline normale trois fois (Figure 2C).
- À l’aide de ciseaux fins, la colonne du thrombus est découpée en caillots sanguins uniformes de 4 mm de longueur chacun (figure 2D). Aspirez 10 à 20 caillots dans l’injecteur fait maison pré-rempli de 2 ml de solution saline normale.
REMARQUE : La longueur des caillots sanguins ne doit pas dépasser 1 cm, sinon ils se coinceront dans le ventricule droit.
3. Préparation de l’accès veineux
- Exposer les vaisseaux épigastriques superficiels
- Anesthésie et fixe l’animal comme décrit à l’étape 2.1.
- Rasez les poils entourant la région de l’aine gauche. Appliquez de la crème dépilatoire sur ces zones, attendez 1 minute, puis essuyez la crème avec de la gaze. Désinfectez la peau avec de l’iodophore.
- Faites une incision cutanée de 5 mm au-dessus de l’origine des vaisseaux épigastriques superficiels dans la région de l’aine. Habituellement, l’origine des vaisseaux épigastriques superficiels peut être retracée en observant une minuscule pulsation dans la région de l’aine.
- À l’aide d’un stéréomicroscope à grossissement 10x, séparez une fine couche de graisse sous-cutanée pour exposer les vaisseaux épigastriques superficiels (Figure 3A).
- Isolement de la veine épigastrique superficielle
- Isolez soigneusement la veine épigastrique superficielle de l’artère, du nerf et du tissu adipeux. Effectuez cela à la fois proximalement, jusqu’au point où il s’écoule dans la veine fémorale, et distalement, jusqu’à la première bifurcation veineuse.
- Ligate du côté distal avec 8-0 Vissez et serrez le filetage à l’aide d’une micro-pince. Contrôlez le côté proximal avec un 8-0 boucle de filetage fixée à une autre micro-pince (Figure 3B).
- Faites une petite incision transversale sur le côté distal de la veine isolée. Contrôlez le côté proximal pour éviter les saignements. Rincez le sang restant dans la lumière veineuse avec une solution saline normale. Une fois que la veine est dégagée, utilisez une micro-pince à épiler pour élargir l’incision veineuse.
4. Embolisation
- Canulation veineuse
- Insérez doucement l’aiguille de l’injecteur fait maison dans la veine par l’incision veineuse. Fixez l’aiguille avec une troisième pince pour l’empêcher de glisser hors de la veine.
- Procédure d’embolisation
- Poussez lentement le piston pour administrer une petite quantité de solution saline normale. La plénitude de la veine sans résistance indique un accès veineux non obstrué (Figure 3D).
- Continuez à pousser le piston pour administrer des caillots dans la veine fémorale par l’accès superficiel de la veine épigastrique. Contrôlez la vitesse d’embolisation à 5 embolies par minute. Surveiller la respiration de l’animal ; L’apparition et l’exacerbation de la dyspnée indiquent une embolisation réussie.
- Après avoir injecté la quantité prédéfinie de caillots sanguins, retirez l’aiguille et ligaturez le côté proximal de la veine épigastrique superficielle.
- Suturez l’incision et placez l’animal dans une boîte chaude. Transférez l’animal dans sa cage une fois qu’il s’est réveillé.
5. Quantification de la zone infarctus
- Euthanasie et perfusion cardiaque
- Ajoutez 25 000 U d’héparine sodique à 250 ml de solution saline normale et mélangez soigneusement. Connectez le flacon à un appareil de perfusion et suspendez le flacon à l’envers à une hauteur de 80 cm. Fermez la valve de l’appareil de perfusion.
- Euthanasier les animaux présentant une surdose d’isoflurane (en suivant les protocoles approuvés par l’établissement).
- Coupez les côtes avec de grands ciseaux et ouvrez la poitrine, en évitant d’endommager les poumons et les gros vaisseaux.
- Insérez l’aiguille du dispositif de perfusion dans le ventricule gauche. Ouvrez la valve du dispositif de perfusion pour permettre la perfusion de solution saline héparinisée. Utilisez des ciseaux pour couper la veine cave inférieure et l’appendice gauche pour permettre le drainage. Contrôler la vitesse de perfusion à 50 mL/min.
REMARQUE : Au cours de cette procédure, le tissu pulmonaire normal deviendra blanc, tandis que la zone embolisée reste rouillée. - Après avoir terminé la perfusion avec une solution saline héparinisée, percer le tronc de l’artère pulmonaire à travers le ventricule droit à l’aide d’une seringue de 10 ml remplie d’une solution de paraformaldéhyde à 4 %. Fixer le tissu pulmonaire en effectuant une perfusion de paraformaldéhyde à 4 % dans les poumons pour un volume total de 30 mL.
- Introduction d’un indice appelé taux d’infarctus
- Après la fixation, excisez les poumons, le cœur, la trachée, l’œsophage, le thymus et les gros vaisseaux dans leur ensemble de la colonne vertébrale et du diaphragme11.
- Retirez soigneusement l’œsophage, le thymus et le tissu adipeux de la masse initiale, ne laissant que le cœur, les poumons et les gros vaisseaux.
- Immerger la partie restante dans un volume adéquat de solution de paraformaldéhyde à 4 % pendant au moins 48 h.
- Utilisez une balance analytique pour peser l’ensemble des poumons. Utilisez des ciseaux fins pour séparer la partie infarctus des poumons et pesez le tissu infarctus avec la même balance. Calculez le taux d’infarctus à l’aide de l’équation suivante :
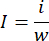
i est le poids du tissu infarctus, w est le poids de l’ensemble des poumons, I représente le taux d’infarctus. - Après avoir quantifié la zone infarctus, coupez le tissu pulmonaire fixé au paraformaldéhyde pour l’incorporation de paraffine11.
6. Visualisation de l’arbre artériel pulmonaire
- Moulage de l’artère pulmonaire
- Euthanasier l’animal et effectuer une perfusion cardiaque comme décrit à l’étape 5.1.
- Ajoutez une quantité égale (en poids) de diluant à la pâte de coulée de silicone, mélangez le mélange, puis ajoutez 5 % (en poids ou en volume) de l’agent de durcissement. Mélangez à nouveau le mélange.
- Prélevez 1 mL du mélange dans une seringue de 1 mL, évacuez l’air et insérez l’aiguille dans le tronc de l’artère pulmonaire par le ventricule droit. Fixez l’aiguille à l’artère pulmonaire pour éviter le glissement et le reflux.
- Appuyez doucement sur le piston pour permettre au mélange de coulée de silicone de remplir l’arbre artériel pulmonaire. Les zones pulmonaires normales seront teintées par le mélange de coulée, tandis que les zones infarctus resteront rouge rouille.
REMARQUE : Le plâtre de l’artère pulmonaire ne doit être appliqué que sur du tissu pulmonaire intact. En règle générale, 0,6 à 0,8 mL du mélange de coulée est suffisant pour remplir l’arbre artériel pulmonaire. Une injection excessive du mélange de coulée peut entraîner un plâtre de la veine pulmonaire, ce qui a un impact sur la visualisation de l’arbre artériel pulmonaire. Le mélange de coulée doit être utilisé dans les 20 minutes suivant l’ajout de l’agent de durcissement, car il cristallise au-delà de ce temps. - Retirez la seringue après la perfusion du plâtre, ligaturez le tronc de l’artère pulmonaire et prélevez les poumons, le cœur et les gros vaisseaux comme décrit à l’étape 5.2. Placez toute la masse dans une boîte de Pétri et conservez-la dans un réfrigérateur à 4 °C pendant la nuit pour permettre au mélange de coulée de cristalliser.
- Nettoyage et visualisation
- Retirez le cœur et les gros vaisseaux des poumons avec des ciseaux, puis nettoyez les débris du mélange de durcissement de la surface des poumons.
- Immergez les poumons séquentiellement dans des solutions d’alcool éthylique à 25 %, 50 %, 75 %, 95 % et 100 %, pendant 24 h chacune. Cette procédure déshydratera complètement les poumons.
- Immerger les poumons déshydratés dans du salicylate de méthyle pendant 24 h. Après ce processus de nettoyage, l’arbre artériel pulmonaire sera visible, et les emboles peuvent également être vus, car le salicylate de méthyle n’élimine pas l’hémoglobine (Figure 4B, D).
Résultats
Symptômes et pathologie du modèle EP
Pendant l’embolisation, les rats ont ressenti un essoufflement et le thorax a montré des fluctuations élargies. Presque tous les animaux ont survécu à l’épisode d’embolie pulmonaire lorsque moins de 10 cm de caillots sanguins ont été administrés (14 animaux modélisés sur 15). Après avoir été renvoyés dans leurs cages, les animaux se sont recroquevillés dans des coins et ont montré un intérêt réduit pour la nourriture et l’eau. Cependant, ces symptômes ont disparu rapidement et, en quelques heures, les animaux se sont comportés normalement. Il n’y avait pas de différence significative de poids entre le départ et 24 h après l’embolisation (341,8 ± 10,4 vs 343,3 ± 8,5, p = 0,25).
La pathologie macroscopique a révélé que les zones embolisées (infarctus) étaient en forme de coin, principalement situées dans la partie inférieure des poumons, avec des bords clairs. Les emboles ont été trouvés à l’apex des zones infarctuses, bloquant les première et deuxième branches de l’artère pulmonaire. Une pathologie microscopique utilisant une coloration à l’hématoxyline-éosine a confirmé l’embolisation d’une branche de l’artère pulmonaire (Figure 4F).
Charge de caillots sanguins et zone infarctus
Dans une étude préliminaire sur l’impact de la charge de caillots sanguins sur l’infarctus du poumon, nous avons testé à la fois une faible charge de caillots sanguins (colonne de thrombus de 6 cm, 15 caillots) et une charge de caillot sanguin élevée (colonne de thrombus de 10 cm, 25 caillots). Comme prévu, une charge plus élevée d’embolies a entraîné une plus grande zone d’infarctus pulmonaire (figure 5A-C).
Fibrinolyse intrinsèque dans les 24 h
Par rapport aux échantillons pulmonaires prélevés immédiatement après l’embolisation, les échantillons pulmonaires prélevés 24 heures après l’embolisation ont montré une diminution marquée des zones infarctuses, indiquant un fort potentiel de fibrinolyse intrinsèque chez le rat (figure 5D).
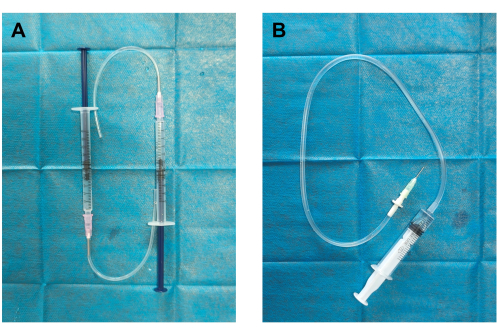
Figure 1 : Construction du générateur de thrombus et de l’injecteur de caillots sanguins. (A) Le générateur de thrombus a été assemblé en connectant un tube de silicium à une aiguille de distribution de 18 G (diamètre extérieur de 12 mm) et à une seringue de 1 mL préremplie de 0,5 mL de solution saline normale. (B) L’injecteur de caillot sanguin a été construit en connectant une aiguille de distribution de 19 G (diamètre intérieur de 0,84 mm, diamètre extérieur de 1,08 mm) à un tube de perfusion (récipient de caillot) et à une seringue de 5 mL préremplie de solution saline normale de 2 mL. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Prélèvement sanguin et préparation du caillot. (A) Le rat a été anesthésié et fixé en position couchée. Le cercle blanc avec une ligne pointillée indique le manubrium, servant de marqueur de surface corporelle. Les points rouges à côté du cercle blanc indiquent les sites de ponction permettant d’accéder à la veine cave crânienne bilatérale (CVC). La partie inférieure de la figure montre une illustration d’autopsie des positions relatives du manubrium, des CVC et des sites de ponction. (B) Prélèvement sanguin réussi grâce au CVC droit. (C) Colonne de sang thrombosée évacuée du générateur de thrombus fabriqué par ses soins. (D) Caillots sanguins dérivés de la colonne sanguine thrombosée. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Accès veineux et embolisation. (A) Exposition des vaisseaux épigastriques superficiels par une incision cutanée de 5 mm, la flèche bleue indiquant la veine épigastrique superficielle et la flèche rouge indiquant l’artère épigastrique superficielle. (B) Isolement de la veine épigastrique superficielle des tissus environnants et contrôle de la veine avec des fils de nylon. (C) L’injecteur fabriqué par ses soins contenant des caillots sanguins. (D) Canulation de la veine avec l’aiguille de distribution de l’injecteur fabriqué par l’utilisateur et administration de caillots sanguins par l’accès veineux. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Pathologie de l’embolie pulmonaire. (A) Poumons normaux après perfusion de solution saline cardiaque et fixation à 4 % de paraformaldéhyde. (B) Poumons normaux visualisés par un mélange de moulage de silicone et une clairance de salicylate de méthyle, montrant un arbre artériel pulmonaire perméable et une microvascularisation. (C) Poumons immédiatement après l’embolisation avec des caillots sanguins autologues, avec des zones marquées indiquant un infarctus pulmonaire dû à l’embolisation. (D) Poumons malades visualisés par moulage d’un mélange de silicone et élimination du salicylate de méthyle, avec des flèches noires indiquant les emboles obstruant les branches de l’artère pulmonaire et des cercles pointillés blancs indiquant leurs zones touchées, qui sont infarctus. (E) Dissection du lobe pulmonaire gauche montrant des embolies (flèches rouges) dans les branches de l’artère pulmonaire. (F) Images microscopiques de l’embolisation d’un caillot sanguin dans une branche de l’artère pulmonaire à l’aide d’une coloration à l’hématoxyline et à l’éosine. Barre d’échelle : 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Quantification du taux d’infarctus du poumon. (A) Poumons prélevés immédiatement sur un rat après embolisation avec 10 cm de caillots sanguins (longueur totale). (B) Poumons prélevés immédiatement sur un rat après embolisation avec 6 cm de thrombus. (C) Poumons immédiatement prélevés sur un rat après embolisation avec 8 cm de caillots sanguins. (D) Poumons prélevés sur un rat 24 h après l’embolisation avec 8 cm de caillots sanguins. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans cette étude, un modèle de PE peu invasif chez le rat utilisant des caillots sanguins autologues a été établi avec succès. Une fois maîtrisée, cette procédure de modélisation peut être réalisée en 30 min. Le modèle capture efficacement les principales caractéristiques de l’EP clinique, telles que confirmées par les examens pathologiques. Par conséquent, il offre un outil précieux pour élucider les changements hémodynamiques et la pathogenèse des complications après l’EP, développer de nouveaux biomarqueurs diagnostiques et cibles thérapeutiques, et tester de nouveaux traitements anti-thrombotiques.
Des efforts importants ont été déployés depuis plusieurs décennies pour développer un modèle animal d’EP, mais aucune méthode unique n’a été identifiée comme optimale pour modéliser l’EP12. Dans cet article, le modèle PE modifié présente plusieurs caractéristiques distinctes : (1) Prélèvement de sang à partir du cathéter veineux central (CVC) : Chez les rongeurs, le CVC se connecte à la confluence des veines jugulaires sous-clavière et interne et s’étend caudalement dans la cavité thoracique13. Les CVC gauche et droit sont presque symétriques. Le CVC a une lumière plus grande que les veines jugulaires, est situé près du manubrium et se trouve sous le grand pectoral. Ces caractéristiques anatomiques permettent une ponction veineuse précise, des volumes de sang plus importants et une hémostase rapide, ce qui se traduit par un taux de réussite élevé. De plus, le prélèvement de sang à partir du CVC est moins sensible à la contamination que par d’autres voies de prélèvement sanguin, et les complications telles que l’hématome, la thrombose et le pneumothorax sont moins probables. L’hémostase est généralement obtenue automatiquement ou rapidement avec la pression. (2) Injection par la veine épigastrique superficielle : En règle générale, les veines jugulaires externes sont utilisées pour l’injection de caillots sanguins afin d’induire l’EP6, 8, 9, et l’incision cutanée pour l’exposition peut être minime. Cependant, la canulation de la veine jugulaire externe entraîne souvent une occlusion veineuse, ce qui peut avoir un impact négatif sur les expériences ultérieures, car la veine jugulaire externe est le principal écoulement crânien chez les rats après la naissance14, et la canulation de l’autre veine jugulaire externe est nécessaire pour la mesure de la pression du ventricule droit 6,8,10. Dans ce modèle modifié, le sacrifice de la veine épigastrique superficielle a un impact minimal sur le corps. De plus, cette voie d’injection de caillots sanguins imite l’EP clinique, où la plupart des embolies proviennent des veines des membres inférieurs. L’emplacement précis de l’artère épigastrique superficielle est crucial pour une petite incision. La pulsation de l’artère épigastrique superficielle peut généralement être notée à la surface de la peau de l’aine, ce qui facilite l’identification des vaisseaux. (3) Charge d’embole personnalisée : La charge d’embole est déterminée par le diamètre et la longueur totale de la colonne de sang. Le générateur de thrombus utilisé dans cette étude permet une préparation standard et personnalisée de la charge d’embole. Les chercheurs peuvent ajuster ces paramètres en fonction de leurs besoins de recherche. Dans ce cas, la charge d’embole induit des symptômes et des signes notables, mais est moins susceptible d’entraîner la mort. Il est généralement sans danger si moins de 10 cm de caillots sanguins sont injectés. En cas d’apnée, l’injection doit être arrêtée immédiatement. L’expérimentateur doit ensuite tenir la poitrine de l’animal avec les doigts placés sur la paroi thoracique latérale et antérieure et effectuer des compressions thoraciques rythmées ; La respiration de l’animal peut se rétablir après ces manœuvres. (4) Perfusion pulmonaire et quantification des zones infarctus : Cette étude présente des techniques de perfusion pulmonaire détaillées pour une meilleure visualisation de l’infarctus pulmonaire après l’induction de l’EP. Sur cette base, un indice permettant de quantifier la zone infarctus, appelé taux d’infarctus, a été développé. Les résultats actuels indiquent que cet indice peut répondre à la charge d’embolie et à la thrombolyse intrinsèque, ce qui suggère son utilité potentielle pour les comparaisons entre groupes dans les études portant sur de nouvelles thérapies antithrombotiques.
Par rapport à la modélisation de l’EP, la modélisation de l’hypertension pulmonaire thromboembolique chronique (HPTEC), une complication grave à long terme de l’EP, est plus difficile en raison de la forte activité fibrinolytique chez les rongeurs. Les solutions potentielles comprennent l’embolisation répétée et l’administration d’acide tranexamique (TXA), un inhibiteur de la fibrinolyse 7,10,12,15. Cependant, les dommages à l’accès veineux et la clairance rapide du plasma de TXA continuent de rendre la modélisation CTEPH difficile. Le modèle et les protocoles de visualisation qui l’accompagnent présentés ici peuvent fournir des informations sur l’établissement d’un modèle CTEPH fiable.
Les limites de ce manuscrit doivent également être abordées. Tout d’abord, il y a un manque de mesures hémodynamiques pour ce modèle, telles que la pression du ventricule droit et l’échocardiographie. Cependant, cela n’enlève rien à la validité du modèle, car il a été validé pathologiquement. Les chercheurs peuvent se référer à d’autres publications pour des méthodologies détaillées sur les mesures hémodynamiques16. Deuxièmement, un groupe de traitement pour évaluer les réponses médicamenteuses dans ce modèle d’EP n’a pas été inclus, comme l’administration de warfarine et d’urokinase, ce qui aurait pu démontrer davantage l’utilité du modèle.
En conclusion, un modèle modifié de PE chez le rongeur caractérisé par son approche peu invasive a été établi avec succès. Des méthodes permettant de quantifier les zones infarctus et de visualiser l’arbre artériel pulmonaire ont également été fournies. Ce modèle est prometteur pour répondre à des questions cruciales concernant la prévention et le traitement des complications de l’EP.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Cette étude est financée par une subvention de la Fondation médicale Wu Jieping (320.6750.19089-36).
matériels
| Name | Company | Catalog Number | Comments |
| Analytical balance | METTLER TOLEDO | MA55/A | None |
| Dispensing needle | Jinrong electronics | None | 19 G and 18 G |
| Fine scissors | Stronger | XGJ1300 | None |
| Heparin sodium salt | Solarbio | 01-08-9041 | 140U/mg |
| Isoflurane | RWD | R510-22-10 | None |
| Methyl salicylate | Macklin | M813577 | AR, 99% |
| Micro clamp | JZ | W40160 | None |
| Micro tweezers | Stronger | XGN1310 | None |
| Silicone casting compound | Flow Tech | MV-130 | None |
| Sprague-Dawley rats | Vital River | SD-IGS | None |
| Stereo microscope | Murzider | MSD204 | None |
Références
- Götzinger, F., et al. Interventional therapies for pulmonary embolism. Nat Rev Cardiol. 20 (10), 670-684 (2023).
- Falster, C., et al. Comparison of international guideline recommendations for the diagnosis of pulmonary embolism. Lancet Haematol. 10 (11), e922-e935 (2023).
- Konstantinides, S. V., et al. ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 41 (4), 543-603 (2020).
- Domínguez-Oliva, A., et al. The importance of animal models in biomedical research: Current insights and applications. Animals (Basel). 13 (7), 1223 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Tang, Z., et al. Gene expression profiling of pulmonary artery in a rabbit model of pulmonary thromboembolism. PLoS One. 11 (10), e0164530 (2016).
- Deng, C., et al. Expression of tissue factor and forkhead box transcription factor o-1 in a rat model for chronic thromboembolic pulmonary hypertension. J Thromb Thrombolysis. 42 (4), 520-528 (2016).
- Runyon, M. S., Gellar, M. A., Sanapareddy, N., Kline, J. A., Watts, J. A. Development and comparison of a minimally-invasive model of autologous clot pulmonary embolism in Sprague-Dawley and Copenhagen rats. Thromb J. 8, 3 (2010).
- Li, S. Q., et al. Comparative proteomic study of acute pulmonary embolism in a rat model. Proteomics. 7 (13), 2287-2299 (2007).
- Deng, C., et al. Role of FOXO1 and apoptosis in pulmonary vascular remolding in a rat model of chronic thromboembolic pulmonary hypertension. Sci Rep. 7 (1), 2270 (2017).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Karpov, A. A., Vaulina, D. D., Smirnov, S. S., Moiseeva, O. M., Galagudza, M. M. Rodent models of pulmonary embolism and chronic thromboembolic pulmonary hypertension. Heliyon. 8 (3), e09014 (2022).
- Picazo, M. G., Benito, P. J., García-Olmo, D. C. Efficiency and safety of a technique for drawing blood from the hamster cranial vena cava. Lab Anim (NY). 38 (6), 211-216 (2009).
- Szabó, K. The cranial venous system in the rat: Anatomical pattern and ontogenetic development. Ii. Dorsal drainage. Ann Anat. 177 (4), 313-322 (1995).
- Li, C. Y., et al. The effects and mechanism of ginsenoside rg1 on myocardial remodeling in an animal model of chronic thromboembolic pulmonary hypertension. Eur J Med Res. 18 (1), 16 (2013).
- Sullivan, D. M., Watts, J. A., Kline, J. A. Biventricular cardiac dysfunction after acute massive pulmonary embolism in the rat. J Appl Physiol (1985). 90 (5), 1648-1656 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon