Method Article
הקמת מודל חולדה זעיר פולשני של תסחיף ריאתי באמצעות קרישי דם אוטולוגיים
In This Article
Summary
מתוארת מתודולוגיה מפורטת להקמת מודל חולדה זעיר פולשני של תסחיף ריאתי באמצעות קרישי דם אוטולוגיים. ניתנות גם שיטות נוספות לכימות האזור האוטם ולהמחשת עץ העורקים הריאתי.
Abstract
תסחיף ריאתי (PE) הוא אחד הגורמים המובילים למוות קרדיווסקולרי, וכתוצאה מכך נטל סוציו-אקונומי משמעותי. למרות שהטיפולים הנוכחיים מתמקדים בעיקר בנוגדי קרישה ופקקת, יש צורך דחוף בהבנה טובה יותר של הפתופיזיולוגיה שלה ופיתוח אסטרטגיות טיפול חדשות. מודלים של בעלי חיים ממלאים תפקיד מכריע בהבנת PE ובפיתוח טיפולים חדשים למחלה, כאשר מכרסמים נמצאים בשימוש נפוץ משיקולים אתיים ועלות. עם זאת, מודלים קיימים של מכרסמים ל-PE מוגבלים על ידי היעדר נהלים סטנדרטיים, מה שמפריע לשחזור והשוואות צולבות. מחקר זה נועד לבסס מודל חולדות זעיר פולשני של PE באמצעות קרישי דם אוטולוגיים. המודל כולל טכניקת דגימת דם זעיר פולשנית, הליך יצירת פקקת סטנדרטי וגישה זעיר פולשנית לורידים. בנוסף, ניתנים פרוטוקולים לכימות אזורים עם אוטם והדמיה של עץ עורקי הריאה. הליכים אלה נועדו לשפר את האמינות של מודלים של מכרסמים לחקר התקדמות PE ולהקל על פיתוח טיפולים חדשים.
Introduction
תסחיף ריאתי (PE) הוא הגורם המוביל למוות בבית החולים והגורם השלישי בשכיחותו למוות קרדיווסקולרי. למרות השכיחות הגבוהה שלו, מניעה ואבחון מהיר נותרו מאתגרים 1,2. טיפולים נוגדי קרישה וטרומבוליטיים הם קריטיים בטיפול ב-PE, אך הבנה מעמיקה יותר של התקדמות המחלה וגישות טיפוליות חדשות חיוניות לשיפור ניהול המחלה3.
במחקר הביו-רפואי המודרני, מודלים של בעלי חיים ממלאים תפקיד מרכזי בהבהרת המנגנונים של מחלות אנושיות ובפיתוח טיפולים חדשים 4,5. עכברים, חולדות, אוגרים וארנבות משמשים לעתים קרובות במודלים של PE בשל שיקולים אתיים וחסכוניות 6,7,8,9,10. גישות מודלים של PE מתחלקות בדרך כלל לשלוש קטגוריות: היווצרות פקקת in vivo, הזרקת קרישי דם במבחנה ומתן חלקיקים שאינם פקקת. בחירת מיני בעלי החיים וטכניקת המידול נקבעת על ידי יעדי המחקר הספציפיים, מכיוון שאין מודל יחיד המתאים לכל המטרות. לדוגמה, מחקרים המתמקדים בחקר טיפולים טרומבוליטיים חדשים משתמשים לעתים קרובות במודלים הכוללים קרישי דם אוטולוגיים במקום חלקיקים שאינם טרומבוטיים.
השיטות הנוכחיות למידול PE במכרסמים מתמודדות עם אתגרים בשל היעדר מתודולוגיות מפורטות וסטנדרטיות. זה משפיע על תהליכי מפתח כגון דגימת דם, היווצרות קרישי דם ותסחיף לאחר מכן, כולם חיוניים להבטחת תוצאות הניתנות לשחזור בכל המחקרים. בנוסף, קיים פער משמעותי ביכולת לכמת את השטח המוטבע ולמפות במדויק את התפלגות התסחיפים לאחר האמבוליזציה. טיפול בחסרונות אלה חיוני לקידום האמינות והתועלת של מודלים של מכרסמים במחקר PE.
במחקר זה מתוארים פרוטוקולים מפורטים להקמת מודל חולדה של PE באמצעות קרישי דם אוטולוגיים. מודל זה כולל טכניקת דגימת דם זעיר פולשנית, הליך יצירת פקקת סטנדרטי וגישה זעיר פולשנית לורידים. בנוסף, ניתנים פרוטוקולים לכימות אזורים עם אוטם בריאות והדמיה של עץ עורקי הריאה, שעשויים להקל על תגליות מחקר נוספות.
Protocol
כל הניסויים בבעלי חיים נערכו באישור הוועדה לטיפול ושימוש בבעלי חיים של האקדמיה הסינית למדעי הרפואה והמכללה הרפואית של פקין (מספר אישור: IRM/2-1ACUC-2311-015). במחקר זה נעשה שימוש בחולדות Sprague-Dawley זכרות, בנות 6 שבועות ובמשקל של כ-250 גרם. בעלי החיים שוכנו בסביבה ספציפית נטולת פתוגנים עם גישה אד ליביטום לתזונה מאוזנת של צ'או ומים. הם נשמרו במחזור אור/חושך של 12 שעות בטמפרטורת החדר של 22 מעלות צלזיוס ±-2 מעלות צלזיוס. בעלי החיים הורשו להסתגל לסביבה למשך שבוע לפני שעברו הליכים כירורגיים כלשהם. פרטי הריאגנטים והציוד המשמשים במחקר זה מפורטים בטבלת החומרים.
1. ציוד וחומרים
- ציוד הרדמה: השתמש במכונת הרדמה בגז עבור בעלי חיים קטנים ואיזופלורן.
- חומרים כירורגיים: הכינו צמר גפן, חומר חיטוי יודופור, מיקרוסקופ סטריאו, מכונת גילוח, סרט רפואי, מזרק 1 מ"ל עם מחט 27 גרם, מזרק 5 מ"ל, מזרק 10 מ"ל, מי מלח רגילים, גזה, 8-0 חוטי ניילון, חוט ניילון 6-0 עם מחט תפרים, מהדקים מיקרו המוסטטיים, פינצטה מיקרו ומספריים עדינים.
- חומרים אחרים: השג מחטי חלוקה של 19 גרם ו-18 גרם התואמות למזרקים רפואיים, צינור סיליקון בקוטר פנימי של 1.2 מ"מ ואורך של 10 ס"מ, צינור עירוי בקוטר פנימי של 3.0 מ"מ ואורך של 20 ס"מ, צינור צנטריפוגה של 1.5 מ"ל, פיפטה וקצות פיפטה.
- מחולל פקקת מתוצרת עצמית ומזרק קרישי דם (איור 1): חברו את שפופרת הסיליקון למחט החלוקה G 19 המחוברת למזרק של 1 מ"ל כדי ליצור את מחולל הפקקת. חבר קצה אחד של צינור העירוי למחט החלוקה של 18 G והצמד את הקצה השני למזרק של 5 מ"ל כדי ליצור את מזרק הקריש.
2. הכנת קרישי דם אוטולוגיים
- הרדמה
- הנח את בעל החיים בתוך תא האינדוקציה של ההרדמה ומתן תערובת של 4% איזופלורן עם אוויר בחדר בקצב זרימה של 2 ליטר לדקה למשך 2-3 דקות (בהתאם לפרוטוקולים שאושרו על ידי המוסד).
- מקם את החיה על משטח הניתוח במצב שכיבה. שמור על הרדמה על ידי מתן 2.5% איזופלורן בקצב זרימה של 0.4 ליטר לדקה. בדוק את רפלקס הדוושה כדי להבטיח הרדמה מספקת.
- הארך את שתי הגפיים הקדמיות אופקית מהגוף, והאריך את הגפיים האחוריות כדי לחשוף כראוי את אזור המפשעה. אבטחו את החיה בתנוחה זו באמצעות סרט רפואי (איור 2A).
- דגימת דם דרך הווריד הנבוב הגולגולתי (CVC)
- הסר את השיער סביב המנובריום באמצעות מכונת גילוח וקרם להסרת שיער. לחטא את העור ביודופור.
- הכנס את מחט ה-27 G המחוברת למזרק 1 מ"ל אנכית לעומק של 8 מ"מ כדי לנקב את ה-CVC השמאלי או הימני, כפי שמוצג באיור 2A.
הערה: הקרנת פני הגוף של ה-CVC היא 5 מ"מ לרוחב המנובריום. ניתן להשתמש בשני הצדדים, והבחירה אינה משפיעה על השלבים הבאים. - החזק את המזרק ומשוך בעדינות את הבוכנה לאחור כדי ליצור לחץ שלילי בתוך הקנה. משכו את המחט בהדרגה עד שהדם זורם פנימה, ואז שמרו על המיקום הזה עד שנאסף 0.3 מ"ל דם (איור 2B).
- הכנת קרישי דם
- דחף את הדם שנאסף לצינור צנטריפוגה בנפח 1.5 מ"ל, הקפד לא לייצר בועות.
- שואבים את הדם לצינור הסיליקון של מחולל הפקקת מתוצרת עצמית עד שאורך עמוד הדם הוא 10 ס"מ.
הערה: בצע את שני השלבים הללו במהירות, מכיוון שהקרישה תתחיל ותתפשט בצינור הצנטריפוגה, ותפחית את איכות קרישי הדם שנקטפו. - המתן 30 דקות עד שהדם פקק לחלוטין. במהלך תקופה זו, הכינו עמודי דם לבעלי חיים אחרים באותו אופן.
- שטפו את עמוד הדם הטרומבוזי לתוך צלחת פטרי המכילה מי מלח רגילים, ושטפו את עמוד הפקקת במי מלח רגילים שלוש פעמים (איור 2C).
- השתמשו במספריים עדינים כדי לחתוך את עמוד הפקקת לקרישי דם אחידים, כל אחד באורך 4 מ"מ (איור 2D). צייר 10-20 קרישים למזרק מתוצרת עצמית מלא מראש ב-2 מ"ל של מי מלח רגילים.
הערה: אורך קרישי הדם לא יעלה על 1 ס"מ, אחרת הם יילכדו בחדר הימני.
3. הכנת גישה לוורידים
- חשיפת כלי הדם האפיגסטריים השטחיים
- להרדים ולתקן את החיה כמתואר בשלב 2.1.
- לגלח את השיער המקיף את אזור המפשעה השמאלית. מרחו קרם להסרת שיער על אזורים אלה, המתינו דקה אחת ואז נגבו את הקרם בגזה. לחטא את העור ביודופור.
- בצע חתך עור של 5 מ"מ מעל מקור כלי הדם האפיגסטריים השטחיים באזור המפשעה. בדרך כלל, ניתן לאתר את מקורם של כלי הדם האפיגסטריים השטחיים על ידי התבוננות בפעימה זעירה באזור המפשעה.
- באמצעות מיקרוסקופ סטריאו בהגדלה של פי 10, הפרד שכבה דקה של שומן תת עורי כדי לחשוף את כלי הדם האפיגסטריים השטחיים (איור 3A).
- בידוד הווריד האפיגסטרי השטחי
- בודד בזהירות את הווריד האפיגסטרי השטחי מרקמת העורק, העצב והשומן. בצע זאת הן בסמיכות, עד לנקודה שבה הוא מתנקז לווריד הירך, והן באופן דיסטלי, עד להתפצלות הווריד הראשון.
- קשר את הצד הדיסטלי עם 8-0 השחילו והדק את החוט בעזרת מיקרו-מהדק. שלוט בצד הפרוקסימלי עם 8-0 לולאת חוט המחוברת למיקרו-מהדק אחר (איור 3B).
- בצע חתך רוחבי זעיר בצד הדיסטלי של הווריד המבודד. שלוט בצד הפרוקסימלי כדי למנוע דימום. שטפו את שארית הדם בלומן הווריד במי מלח רגילים. לאחר שהווריד נקי, השתמש בפינצטה מיקרו כדי להגדיל את החתך הוורידי.
4. אמבוליזציה
- קנולציה של ורידים
- הכנס בעדינות את המחט של המזרק מתוצרת עצמית לווריד דרך חתך הווריד. אבטח את המחט בעזרת מהדק שלישי כדי למנוע ממנה להחליק מהווריד.
- הליך אמבוליזציה
- דחף לאט את הבוכנה כדי לתת כמות קטנה של מי מלח רגילים. מלאות הווריד ללא התנגדות מעידה על גישה ללא הפרעה לווריד (איור 3D).
- המשך לדחוף את הבוכנה כדי לתת קרישים לווריד הירך דרך הגישה השטחית לווריד האפיגסטרי. שלוט במהירות האמבוליזציה ב -5 תסחיפים לדקה. לפקח על הנשימה של החיה; קוצר נשימה מתעורר ומחמיר מעיד על אמבוליזציה מוצלחת.
- לאחר הזרקת הכמות המוגדרת מראש של קרישי דם, משוך את המחט וקשר את הצד הפרוקסימלי של הווריד האפיגסטרי השטחי.
- תפרו את החתך והניחו את החיה בקופסה חמה. העבירו את החיה לכלוב שלה לאחר שהתעוררה.
5. כימות שטח האוטם
- המתת חסד וזלוף לב
- הוסף 25,000 U של נתרן הפרין ל-250 מ"ל של מי מלח רגילים וערבב היטב. חבר את הבקבוק למכשיר עירוי ותלה את הבקבוק הפוך בגובה 80 ס"מ. סגור את השסתום של מכשיר העירוי.
- המתת חסד של בעלי החיים עם מנת יתר של איזופלורן (בהתאם לפרוטוקולים שאושרו על ידי המוסד).
- חותכים את הצלעות במספריים גדולים ופותחים את החזה, תוך הימנעות מפגיעה בריאות ובכלי הדם הגדולים.
- הכנס את המחט של מכשיר העירוי לחדר השמאלי. פתח את השסתום של מכשיר העירוי כדי לאפשר עירוי מי מלח הפריני. השתמש במספריים כדי לחתוך את הווריד הנבוב התחתון ואת הנספח השמאלי כדי לאפשר ניקוז. שלוט במהירות הזלוף ב-50 מ"ל/דקה.
הערה: במהלך הליך זה, רקמת ריאה תקינה תהפוך ללבנה, בעוד שהאזור המוטבע נשאר חלוד. - לאחר השלמת הזלוף במי מלח הפריניים, יש לנקב את תא המטען של עורק הריאה דרך החדר הימני באמצעות מזרק של 10 מ"ל מלא בתמיסת פרפורמלדהיד של 4%. תקן את רקמת הריאה על ידי ביצוע זלוף פרפורמלדהיד 4% דרך הריאות לנפח כולל של 30 מ"ל.
- היכרות עם מדד בשם Infarction Ratio
- לאחר הקיבוע יש להוציא את הריאות, הלב, קנה הנשימה, הוושט, התימוס וכלי הדם הגדולים בכללותם מעמוד השדרה והסרעפת11.
- הסר בזהירות את הוושט, התימוס ורקמת השומן מהמסה הראשונית, והשאיר רק את הלב, הריאות וכלי הדם הגדולים.
- טבלו את החלק הנותר בנפח מספיק של תמיסת פרפורמלדהיד של 4% למשך 48 שעות לפחות.
- השתמש באיזון אנליטי כדי לשקול את כל הריאות. השתמש במספריים עדינים כדי להפריד את החלק האוטם של הריאות ולשקול את הרקמה האוטמת באותו איזון. חשב את יחס האוטם באמצעות המשוואה הבאה:
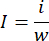
i הוא משקל הרקמה האוטמת, w הוא משקל הריאות כולן, I מייצג את יחס האוטם. - לאחר כימות האזור האוטם, חתוך את רקמת הריאה הקבועה בפרפורמלדהיד להטמעת פרפין11.
6. הדמיה של עץ עורקי ריאה
- יציקת עורק ריאה
- המתת חסד של החיה וביצוע זלוף לב כמתואר בשלב 5.1.
- הוסף כמות שווה (לפי משקל) של מדלל לתרכובת יציקת הסיליקון, ערבב את התערובת ולאחר מכן הוסף 5% (לפי משקל או נפח) של חומר הריפוי. ערבבו שוב את התערובת.
- שואבים 1 מ"ל מהתערובת למזרק של 1 מ"ל, מוציאים את האוויר ומכניסים את המחט לתא המטען של עורק הריאה דרך החדר הימני. אבטח את המחט לעורק הריאה כדי למנוע החלקה וזרימה חוזרת.
- לחץ בעדינות על הבוכנה כדי לאפשר לתערובת יציקת הסיליקון למלא את עץ עורק הריאה. אזורי הריאות הרגילים ייצבעו על ידי תערובת היציקה, בעוד שהאזורים האוטמים יישארו אדומים חלודים.
הערה: יש ליישם יציקת עורק ריאה רק על רקמת ריאה שלמה. בדרך כלל, 0.6-0.8 מ"ל מתערובת היציקה מספיקים למילוי עץ עורק הריאה. הזרקת יתר של תערובת היציקה עלולה להוביל ליציקת ורידים ריאתיים, המשפיעה על ההדמיה של עץ עורק הריאה. יש להשתמש בתערובת היציקה תוך 20 דקות לאחר הוספת חומר הריפוי, מכיוון שהיא תתגבש מעבר לזמן זה. - משוך את המזרק לאחר יציקת זלוף, קשר את תא המטען של עורק הריאה וקצור את הריאות, הלב וכלי הדם הגדולים כמתואר בשלב 5.2. מניחים את כל המסה בצלחת פטרי ושומרים אותה במקרר של 4 מעלות צלזיוס למשך הלילה כדי לאפשר לתערובת היציקה להתגבש.
- ניקוי והדמיה
- הסר את הלב וכלי הדם הגדולים מהריאות בעזרת מספריים, ולאחר מכן נקה את שאריות תערובת הריפוי מפני השטח של הריאות.
- טבלו את הריאות ברצף בתמיסות אלכוהול אתילי של 25%, 50%, 75%, 95% ו-100%, כל אחת למשך 24 שעות. הליך זה ייבש לחלוטין את הריאות.
- טבלו את הריאות המיובשות במתיל סליצילאט למשך 24 שעות. אחרי תהליך הפינוי הזה, עץ העורקים הריאתי יהיה גלוי, ואפשר גם לראות את התסחיפים, מאחר שמתיל סליצילאט לא מנקה המוגלובין (איור 4B,D).
תוצאות
תסמינים ופתולוגיה של מודל PE
במהלך האמבוליזציה, החולדות חוו קוצר נשימה, ובית החזה הראה תנודות מורחבות. כמעט כל בעלי החיים שרדו את התקף התסחיף הריאתי כאשר ניתנו פחות מ-10 ס"מ של קרישי דם (14 מתוך 15 בעלי חיים מודליים). לאחר שהוחזרו לכלובים שלהם, החיות התכרבלו בפינות והראו עניין מופחת במזון ובמים. עם זאת, תסמינים אלה נעלמו במהירות, ותוך מספר שעות החיות התנהגו כרגיל. לא היה הבדל משמעותי במשקל בין קו הבסיס ל-24 שעות לאחר האמבוליזציה (341.8 ± 10.4 לעומת 343.3 ± 8.5, p = 0.25).
פתולוגיה גסה גילתה כי האזורים המוטבעים (האוטמים) היו בצורת טריז, הממוקמים ברובם בחלק התחתון של הריאות, עם גבולות ברורים. התסחיפים נמצאו בקודקוד אזורי האוטם וחסמו את הענפים הראשונים והמשניים של עורק הריאה. פתולוגיה מיקרוסקופית באמצעות צביעת המטוקסילין-אאוזין אישרה אמבוליזציה של ענף עורק ריאתי (איור 4F).
עומס קרישי דם ואזור אוטם
במחקר ראשוני של השפעת עומס קרישי הדם על אוטם הריאות, בדקנו הן עומס קרישי דם נמוך (עמוד פקקת 6 ס"מ, 15 קרישי דם) והן עומס קרישי דם גבוה (עמוד פקקת 10 ס"מ, 25 קרישי דם). כצפוי, עומס גבוה יותר של תסחיפים הביא לאזור גדול יותר של אוטם ריאות (איור 5A-C).
פיברינוליזה פנימית תוך 24 שעות
בהשוואה לדגימות ריאה שנלקחו מיד לאחר האמבוליזציה, דגימות הריאה שנאספו 24 שעות לאחר האמבוליזציה הראו ירידה ניכרת באזורי האוטם, מה שמעיד על פוטנציאל פיברינוליזה פנימי חזק בחולדות (איור 5D).
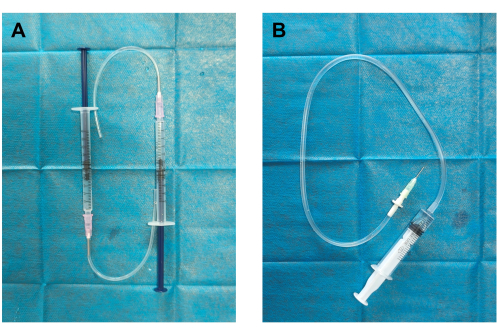
איור 1: בניית מחולל פקקת ומזרק קרישי דם. (A) מחולל הפקקת הורכב על ידי חיבור שפופרת סיליקון למחט חלוקה של 18 G (קוטר חיצוני של 12 מ"מ) ומזרק של 1 מ"ל מלא מראש בתמיסת מלח רגילה של 0.5 מ"ל. (B) מזרק קרישי הדם נבנה על ידי חיבור מחט ניפוק 19 גרם (קוטר פנימי של 0.84 מ"מ, קוטר חיצוני של 1.08 מ"מ) לצינור עירוי (מיכל קרישה) ומזרק של 5 מ"ל מלא מראש בתמיסת מלח רגילה של 2 מ"ל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: דגימת דם והכנת קרישי דם. (A) החולדה הורדמה וקובעה במצב שכיבה. העיגול הלבן עם הקו המקווקו מציין את המנובריום, המשמש כסמן פני הגוף. הנקודות האדומות ליד העיגול הלבן מציינות את אתרי הניקוב לגישה לווריד הנבוב הגולגולתי הדו-צדדי (CVC). החלק התחתון של האיור מציג איור נתיחה שלאחר המוות של המיקומים היחסיים של המנובריום, ה-CVC ואתרי הניקוב. (B) דגימת דם מוצלחת דרך ה-CVC הימני. (C) עמוד דם פקק שנשטף החוצה ממחולל הפקקת מתוצרת עצמית. (D) קרישי דם שמקורם בעמוד הדם הטרומבוזי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: גישה לוורידים ואמבוליזציה. (A) חשיפת כלי הדם האפיגסטריים השטחיים דרך חתך עור של 5 מ"מ, כאשר החץ הכחול מציין את הווריד האפיגסטרי השטחי והחץ האדום מציין את העורק האפיגסטרי השטחי. (B) בידוד הווריד האפיגסטרי השטחי מהרקמה הסובבת ושליטה על הווריד באמצעות חוטי ניילון. (ג) מזרק מתוצרת עצמית המכיל קרישי דם. (ד) קנולציה של הווריד עם מחט החלוקה של המזרק מתוצרת עצמית ומתן קרישי דם דרך הגישה לווריד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 4: פתולוגיה של תסחיף ריאתי. (A) ריאות תקינות לאחר זלוף מי מלח לבבי וקיבוע פרפורמלדהיד 4%. (B) ריאות רגילות שמודגמות על ידי תערובת יציקת סיליקון וניקוי מתיל סליצילאט, שמציגות עץ עורק ריאתי פטנט ומיקרו-כלי דם. (C) ריאות מיד אחרי תסחיף עם קרישי דם אוטולוגיים, עם אזורים מסומנים המעידים על אוטם ריאות כתוצאה מתסחיף. (D) ריאות חולות שמודגמות על ידי יציקת תערובת סיליקון וניקוי מתיל סליצילאט, עם חיצים שחורים שמציינים תסחיפים החוסמים ענפי עורק ריאה ועיגולים מקווקווים לבנים שמציינים את האזורים הפגועים שלהם, שהם אוטמים. (E) דיסקציה של אונת הריאה השמאלית שמראה תסחיפים (חיצים אדומים) בענפי עורק הריאה. (F) תמונות מיקרוסקופיות של תסחיף קרישי דם בענף של עורק ריאתי באמצעות צביעת המטוקסילין ואאוזין. סרגל קנה מידה: 200 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: כימות יחס אוטם הריאות. (A) ריאות שנלקחו מיד מחולדה לאחר אמבוליזציה עם 10 ס"מ של קרישי דם (אורך כולל). (B) ריאות שנלקחו מיד מחולדה אחרי אמבוליזציה עם 6 סנטימטרים של פקקת. (C) ריאות שנלקחו מיד מחולדה אחרי אמבוליזציה עם 8 סנטימטרים של קרישי דם. (D) ריאות שנלקחו מחולדה 24 שעות אחרי אמבוליזציה עם 8 סנטימטרים של קרישי דם. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
במחקר זה, מודל חולדה זעיר פולשני של PE באמצעות קרישי דם אוטולוגיים הוקם בהצלחה. לאחר השליטה, ניתן להשלים הליך דוגמנות זה תוך 30 דקות. המודל לוכד ביעילות מאפיינים מרכזיים של PE קליני, כפי שאושר על ידי בדיקות פתולוגיות. כתוצאה מכך, הוא מציע כלי רב ערך להבהרת השינויים ההמודינמיים והפתוגנזה של סיבוכים בעקבות PE, פיתוח סמנים ביולוגיים אבחנתיים חדשים ומטרות טיפוליות, ובדיקת טיפולים אנטי-טרומבוטיים חדשים.
מאמצים משמעותיים נעשו במשך כמה עשורים לפיתוח מודל בעלי חיים PE, אך אף שיטה אחת לא זוהתה כאופטימלית למידול PE12. במאמר זה, מודל ה-PE המותאם מציג מספר מאפיינים מובהקים: (1) שאיבת דם מהצנתר הוורידי המרכזי (CVC): במכרסמים, ה-CVC מתחבר למפגש של ורידים תת-בריחיים ופנימיים ומשתרע בזנב לתוך חלל בית החזה13. ה-CVC השמאלי והימני הם כמעט סימטריים. ל-CVC לומן גדול יותר מוורידי הצוואר, הוא ממוקם קרוב למנובריום ונמצא מתחת לחזה הגדול. מאפיינים אנטומיים אלו מאפשרים ניקוב ורידים מדויק, נפחי דגימת דם גדולים יותר והמוסטזיס מהיר, וכתוצאה מכך אחוזי הצלחה גבוהים. נוסף על כך, שאיבת דם מ-CVC פחות רגישה לזיהום בהשוואה לדגימת דם אחרת, והסבירות לסיבוכים כמו המטומה, פקקת ופנאומוטורקס נמוכה יותר. המוסטזיס מושג בדרך כלל באופן אוטומטי או מהיר עם לחץ. (2) הזרקה דרך הווריד האפיגסטרי השטחי: בדרך כלל, ורידי הצוואר החיצוניים משמשים להזרקת קריש דם כדי לגרום ל-PE 6,8,9, וחתך העור לחשיפה יכול להיות מינימלי. עם זאת, קנולציה של וריד הצוואר החיצוני מובילה לעתים קרובות לחסימת ורידים, מה שעלול להשפיע לרעה על הניסויים הבאים מכיוון שווריד הצוואר החיצוני הוא יציאת הגולגולת העיקרית בחולדות לאחר הלידה14, ויש צורך בקנולציה של וריד הצוואר החיצוני השני למדידת לחץ החדר הימני 6,8,10. במודל שונה זה, להקרבת הווריד האפיגסטרי השטחי יש השפעה מינימלית על הגוף. בנוסף, מסלול זה להזרקת קרישי דם מחקה PE קליני, שבו רוב התסחיפים מקורם בוורידים של הגפיים התחתונות. המיקום המדויק של העורק האפיגסטרי השטחי הוא קריטי לחתך קטן. בדרך כלל ניתן להבחין בפעימה של העורק האפיגסטרי השטחי על פני העור של המפשעה, מה שמסייע בזיהוי כלי הדם. (3) עומס תסחיף מותאם אישית: עומס התסחיף נקבע על פי הקוטר והאורך הכולל של עמוד הדם. מחולל הפקקת המשמש במחקר זה מאפשר הכנת עומס תסחיף סטנדרטית ומותאמת אישית. חוקרים יכולים להתאים פרמטרים אלה על סמך צרכי המחקר שלהם. במקרה זה, עומס התסחיף גורם לתסמינים וסימנים בולטים אך פחות סביר שיגרום למוות. זה בדרך כלל בטוח אם מזריקים פחות מ-10 ס"מ של קרישי דם. אם מתרחשת דום נשימה, יש להפסיק את ההזרקה מיד. לאחר מכן על הנסיין להחזיק את החזה של החיה עם אצבעות המונחות על דופן החזה הצדדית והקדמית ולבצע לחיצות חזה קצביות; הנשימה של החיה עשויה להתאושש לאחר תמרונים אלה. (4) זלוף ריאות וכימות של אזורים עם אוטם: מחקר זה מציג טכניקות מפורטות של זלוף ריאות להדמיה טובה יותר של אוטם ריאות לאחר השראת PE. על סמך זה פותח מדד לכימות האזור האוטם, המכונה יחס האוטם. התוצאות הנוכחיות מצביעות על כך שמדד זה עשוי להגיב לעומס תסחיף ולפקקת פנימית, מה שמרמז על התועלת הפוטנציאלית שלו להשוואות בין קבוצות במחקרים החוקרים טיפולים אנטי-טרומבוטיים חדשים.
בהשוואה למודלים של PE, מידול יתר לחץ דם ריאתי טרומבואמבולי כרוני (CTEPH), סיבוך חמור לטווח ארוך של PE, מאתגר יותר בשל הפעילות הפיברינוליטית הגבוהה במכרסמים. פתרונות פוטנציאליים כוללים אמבוליזציה חוזרת ומתן חומצה טרנקסמית (TXA), מעכב פיברינוליזה 7,10,12,15. עם זאת, נזק לגישה לוורידים ופינוי הפלזמה המהיר של TXA ממשיכים להקשות על מידול CTEPH. המודל ופרוטוקולי ההדמיה הנלווים המוצגים כאן עשויים לספק תובנות להקמת מודל CTEPH אמין.
יש להתייחס גם למגבלות של כתב יד זה. ראשית, חסרות מדידות המודינמיות למודל זה, כגון לחץ בחדר ימין ואקו-לב. עם זאת, זה לא שולל את תוקף המודל, מכיוון שהוא תוקף פתולוגית. חוקרים עשויים לעיין בספרות אחרת למתודולוגיות מפורטות על מדידות המודינמיות16. שנית, קבוצת טיפול להערכת תגובות לתרופות במודל PE זה לא נכללה, כגון מתן וורפרין ואורוקינאז, מה שיכול היה להדגים עוד יותר את התועלת של המודל.
לסיכום, מודל מכרסמים שונה של PE המאופיין בגישתו הזעיר פולשנית הוקם בהצלחה. כמו כן סופקו שיטות לכימות אזורים עם אוטם והדמיה של עץ עורקי הריאה. מודל זה טומן בחובו הבטחה להתייחסות לשאלות קריטיות הנוגעות למניעה וטיפול בסיבוכי PE.
Disclosures
המחברים מצהירים שאין ניגוד עניינים.
Acknowledgements
מחקר זה נתמך על ידי מענק מהקרן הרפואית וו ג'יפינג (320.6750.19089-36).
Materials
| Name | Company | Catalog Number | Comments |
| Analytical balance | METTLER TOLEDO | MA55/A | None |
| Dispensing needle | Jinrong electronics | None | 19 G and 18 G |
| Fine scissors | Stronger | XGJ1300 | None |
| Heparin sodium salt | Solarbio | 01-08-9041 | 140U/mg |
| Isoflurane | RWD | R510-22-10 | None |
| Methyl salicylate | Macklin | M813577 | AR, 99% |
| Micro clamp | JZ | W40160 | None |
| Micro tweezers | Stronger | XGN1310 | None |
| Silicone casting compound | Flow Tech | MV-130 | None |
| Sprague-Dawley rats | Vital River | SD-IGS | None |
| Stereo microscope | Murzider | MSD204 | None |
References
- Götzinger, F., et al. Interventional therapies for pulmonary embolism. Nat Rev Cardiol. 20 (10), 670-684 (2023).
- Falster, C., et al. Comparison of international guideline recommendations for the diagnosis of pulmonary embolism. Lancet Haematol. 10 (11), e922-e935 (2023).
- Konstantinides, S. V., et al. ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 41 (4), 543-603 (2020).
- Domínguez-Oliva, A., et al. The importance of animal models in biomedical research: Current insights and applications. Animals (Basel). 13 (7), 1223 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Tang, Z., et al. Gene expression profiling of pulmonary artery in a rabbit model of pulmonary thromboembolism. PLoS One. 11 (10), e0164530 (2016).
- Deng, C., et al. Expression of tissue factor and forkhead box transcription factor o-1 in a rat model for chronic thromboembolic pulmonary hypertension. J Thromb Thrombolysis. 42 (4), 520-528 (2016).
- Runyon, M. S., Gellar, M. A., Sanapareddy, N., Kline, J. A., Watts, J. A. Development and comparison of a minimally-invasive model of autologous clot pulmonary embolism in Sprague-Dawley and Copenhagen rats. Thromb J. 8, 3 (2010).
- Li, S. Q., et al. Comparative proteomic study of acute pulmonary embolism in a rat model. Proteomics. 7 (13), 2287-2299 (2007).
- Deng, C., et al. Role of FOXO1 and apoptosis in pulmonary vascular remolding in a rat model of chronic thromboembolic pulmonary hypertension. Sci Rep. 7 (1), 2270 (2017).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Karpov, A. A., Vaulina, D. D., Smirnov, S. S., Moiseeva, O. M., Galagudza, M. M. Rodent models of pulmonary embolism and chronic thromboembolic pulmonary hypertension. Heliyon. 8 (3), e09014 (2022).
- Picazo, M. G., Benito, P. J., García-Olmo, D. C. Efficiency and safety of a technique for drawing blood from the hamster cranial vena cava. Lab Anim (NY). 38 (6), 211-216 (2009).
- Szabó, K. The cranial venous system in the rat: Anatomical pattern and ontogenetic development. Ii. Dorsal drainage. Ann Anat. 177 (4), 313-322 (1995).
- Li, C. Y., et al. The effects and mechanism of ginsenoside rg1 on myocardial remodeling in an animal model of chronic thromboembolic pulmonary hypertension. Eur J Med Res. 18 (1), 16 (2013).
- Sullivan, D. M., Watts, J. A., Kline, J. A. Biventricular cardiac dysfunction after acute massive pulmonary embolism in the rat. J Appl Physiol (1985). 90 (5), 1648-1656 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved