Method Article
Etablierung eines minimal-invasiven Rattenmodells der Lungenembolie mittels autologer Blutgerinnsel
In diesem Artikel
Zusammenfassung
Eine detaillierte Methodik zur Etablierung eines minimal-invasiven Rattenmodells der Lungenembolie unter Verwendung autologer Blutgerinnsel wird beschrieben. Zusätzliche Methoden zur Quantifizierung des Infarktbereichs und zur Visualisierung des Lungenarterienbaums werden ebenfalls zur Verfügung gestellt.
Zusammenfassung
Die Lungenembolie (LE) ist eine der Hauptursachen für kardiovaskuläre Todesfälle und führt zu einer erheblichen sozioökonomischen Belastung. Obwohl sich die derzeitigen Behandlungen in erster Linie auf Antikoagulation und Thrombolyse konzentrieren, besteht ein dringender Bedarf an einem besseren Verständnis der Pathophysiologie und der Entwicklung neuer Behandlungsstrategien. Tiermodelle spielen eine entscheidende Rolle beim Verständnis von Lungenembolie und bei der Entwicklung neuer Therapien für die Krankheit, wobei Nagetiere aus ethischen und Kostengründen häufig eingesetzt werden. Bestehende Nagetiermodelle für PE sind jedoch durch einen Mangel an standardisierten Verfahren eingeschränkt, was die Reproduzierbarkeit und studienübergreifende Vergleiche erschwert. Ziel dieser Studie ist es, ein minimal-invasives Rattenmodell der Lungenembolie unter Verwendung von autologen Blutgerinnseln zu etablieren. Das Modell verfügt über eine minimalinvasive Blutentnahmetechnik, ein standardisiertes Verfahren zur Thrombuserzeugung und einen minimalinvasiven Venenzugang. Zusätzlich werden Protokolle zur Quantifizierung von Infarktgebieten und zur Visualisierung des Lungenarterienbaums zur Verfügung gestellt. Diese Verfahren zielen darauf ab, die Zuverlässigkeit von Nagetiermodellen für die Untersuchung des Fortschreitens der Lungenembolie zu verbessern und die Entwicklung neuartiger Behandlungen zu erleichtern.
Einleitung
Lungenembolie (LE) ist eine der Hauptursachen für Todesfälle im Krankenhaus und die dritthäufigste Ursache für kardiovaskuläre Todesfälle. Trotz der hohen Inzidenz sind Prävention und schnelle Diagnose nach wie vor eine Herausforderung 1,2. Antikoagulation und thrombolytische Therapien sind bei der Behandlung von Lungenembolie von entscheidender Bedeutung, doch ein tieferes Verständnis des Krankheitsverlaufs und neuer therapeutischer Ansätze ist für die Verbesserung des Krankheitsmanagements unerlässlich3.
In der modernen biomedizinischen Forschung spielen Tiermodelle eine zentrale Rolle bei der Aufklärung der Mechanismen menschlicher Krankheiten und der Entwicklung neuer Therapien 4,5. Mäuse, Ratten, Hamster und Kaninchen werden aufgrund ethischer Überlegungen und der Kosteneffizienz häufig in der PE-Modellierung verwendet 6,7,8,9,10. PE-Modellierungsansätze lassen sich im Allgemeinen in drei Kategorien einteilen: in vivo Thrombusbildung, in vitro Injektion von Blutgerinnseln und die Verabreichung von nicht-thrombotischen Partikeln. Die Wahl der Tierart und der Modellierungstechnik wird durch die spezifischen Forschungsziele bestimmt, da kein einzelnes Modell für alle Zwecke geeignet ist. So werden in Studien, die sich auf die Erforschung neuer thrombolytischer Therapien konzentrieren, häufig Modelle mit autologen Blutgerinnseln anstelle von nicht-thrombotischen Partikeln verwendet.
Aktuelle Methoden zur Modellierung von PE bei Nagetieren stehen vor Herausforderungen, da es an detaillierten, standardisierten Methoden mangelt. Dies betrifft Schlüsselprozesse wie die Blutentnahme, die Bildung von Blutgerinnseln und die anschließende Embolisation, die alle entscheidend sind, um reproduzierbare Ergebnisse in allen Studien zu gewährleisten. Darüber hinaus besteht eine erhebliche Lücke in der Fähigkeit, den embolisierten Bereich zu quantifizieren und die Verteilung der Embolien nach der Embolisation genau zu kartieren. Die Behebung dieser Mängel ist unerlässlich, um die Zuverlässigkeit und den Nutzen von Nagetiermodellen in der PE-Forschung zu verbessern.
In dieser Studie werden detaillierte Protokolle zur Etablierung eines Rattenmodells der Lungenembolie unter Verwendung von autologen Blutgerinnseln beschrieben. Dieses Modell zeichnet sich durch eine minimalinvasive Blutentnahmetechnik, ein standardisiertes Verfahren zur Thrombuserzeugung und einen minimalinvasiven Venenzugang aus. Darüber hinaus werden Protokolle zur Quantifizierung von Infarktbereichen in der Lunge und zur Visualisierung des Lungenarterienbaums bereitgestellt, die weitere Forschungsentdeckungen erleichtern können.
Protokoll
Alle Tierversuche wurden mit Genehmigung des Animal Care and Use Committee der Chinese Academy of Medical Sciences & Peking Union Medical College (Zulassungsnummer: IRM/2-1ACUC-2311-015) durchgeführt. In dieser Studie wurden männliche Sprague-Dawley-Ratten, 6 Wochen alt und etwa 250 g schwer, verwendet. Die Tiere wurden in einer spezifischen, pathogenfreien Umgebung mit ad libitum Zugang zu einer ausgewogenen Futternahrung und Wasser untergebracht. Sie wurden in einem 12-stündigen Hell-Dunkel-Zyklus bei einer Raumtemperatur von 22 °C ± 2 °C gehalten. Die Tiere durften sich 1 Woche lang an die Umgebung anpassen, bevor sie sich chirurgischen Eingriffen unterzogen. Die Einzelheiten zu den in dieser Studie verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Ausrüstung und Materialien
- Anästhesiegerät: Verwenden Sie ein Gasanästhesiegerät für Kleintiere und Isofluran.
- Chirurgische Materialien: Bereiten Sie Wattestäbchen, Iodophor-Desinfektionsmittel, ein Stereomikroskop, einen Rasierer, medizinisches Klebeband, eine 1-mL-Spritze mit einer 27-G-Nadel vor, eine 5-mL-Spritze, eine 10-mL-Spritze, normale Kochsalzlösung, Gaze, 8-0 Nylonfäden, 6-0 Nylonfaden mit Nahtnadel, mikrohämostatische Klemmen, Mikropinzette und feine Schere.
- Andere Materialien: Besorgen Sie sich 19 G und 18 G Dosiernadeln, die mit medizinischen Spritzen kompatibel sind, einen Silikonschlauch mit einem Innendurchmesser von 1,2 mm und einer Länge von 10 cm, einen Infusionsschlauch mit einem Innendurchmesser von 3,0 mm und einer Länge von 20 cm, ein 1,5 mL Zentrifugenröhrchen, eine Pipette und Pipettenspitzen.
- Selbstgebauter Thrombusgenerator und Blutgerinnselinjektor (Abbildung 1): Verbinden Sie den Silikonschlauch mit der 19 G-Dosiernadel, die an einer 1 mL-Spritze befestigt ist, um den Thrombusgenerator zu erzeugen. Verbinden Sie ein Ende des Infusionsschlauchs mit der 18-G-Abgabenadel und befestigen Sie das andere Ende an einer 5-ml-Spritze, um den Gerinnselinjektor herzustellen.
2. Vorbereitung autologer Blutgerinnsel
- Anästhesie
- Setzen Sie das Tier in die Anästhesie-Induktionskammer und verabreichen Sie ein Gemisch aus 4% Isofluran mit Raumluft bei einer Durchflussrate von 2 l/min für 2-3 min (gemäß den institutionell anerkannten Protokollen).
- Positionieren Sie das Tier in Rückenlage auf der Operationsplattform. Halten Sie die Anästhesie aufrecht, indem Sie 2,5 % Isofluran bei einer Flussrate von 0,4 l/min verabreichen. Testen Sie den Pedalreflex, um sicherzustellen, dass eine angemessene Anästhesie erreicht wird.
- Strecken Sie beide Vordergliedmaßen horizontal vom Körper aus und strecken Sie die Hintergliedmaßen aus, um die Leistengegend ausreichend freizulegen. Sichern Sie das Tier in dieser Position mit medizinischem Klebeband (Abbildung 2A).
- Blutentnahme durch die Hohlvene (ZVK)
- Entfernen Sie die Haare um das Manubrium herum mit einem Rasierer und einer Haarentfernungscreme. Desinfizieren Sie die Haut mit Jodophor.
- Führen Sie die an der 1-ml-Spritze befestigte 27-G-Nadel senkrecht bis zu einer Tiefe von 8 mm ein, um entweder den linken oder den rechten ZVK zu punktieren, wie in Abbildung 2A gezeigt.
HINWEIS: Der Körperoberflächenvorsprung des ZVK beträgt 5 mm lateral zum Manubrium. Beide Seiten können verwendet werden, und die Auswahl hat keinen Einfluss auf die folgenden Schritte. - Halten Sie die Spritze fest und ziehen Sie den Kolben vorsichtig zurück, um einen Unterdruck im Zylinder zu erzeugen. Ziehen Sie die Nadel nach und nach zurück, bis Blut einströmt, und halten Sie diese Position, bis 0,3 ml Blut entnommen sind (Abbildung 2B).
- Vorbereitung von Blutgerinnseln
- Schieben Sie das gesammelte Blut in ein 1,5-ml-Zentrifugenröhrchen und achten Sie darauf, keine Blasen zu bilden.
- Ziehen Sie das Blut in den Silikonschlauch des selbstgebauten Thrombusgenerators, bis die Blutsäule 10 cm lang ist.
HINWEIS: Führen Sie diese beiden Schritte schnell durch, da die Gerinnung im Zentrifugenröhrchen eingeleitet und sich ausbreitet, wodurch die Qualität der entnommenen Blutgerinnsel verringert wird. - Warten Sie 30 Minuten, bis das Blut vollständig thrombosiert ist. Bereiten Sie in dieser Zeit auf die gleiche Weise Blutsäulen für andere Tiere vor.
- Spülen Sie die thrombosierte Blutsäule in eine Petrischale, die normale Kochsalzlösung enthält, und waschen Sie die Thrombussäule dreimal mit normaler Kochsalzlösung (Abbildung 2C).
- Schneiden Sie die Thrombussäule mit einer feinen Schere in gleichmäßige Blutgerinnsel von jeweils 4 mm Länge (Abbildung 2D). Ziehen Sie 10-20 Gerinnsel in den selbstgemachten Injektor, der mit 2 mL normaler Kochsalzlösung vorgefüllt ist.
HINWEIS: Die Länge der Blutgerinnsel sollte 1 cm nicht überschreiten, da sie sonst in der rechten Herzkammer eingeschlossen werden.
3. Vorbereitung des Venenzugangs
- Freilegung der oberflächlichen epigastrischen Gefäße
- Betäuben und fixieren Sie das Tier wie in Schritt 2.1 beschrieben.
- Rasiere die Haare um die linke Leistengegend. Tragen Sie Haarentfernungscreme auf diese Bereiche auf, warten Sie 1 Minute und wischen Sie die Creme dann mit Gaze ab. Desinfizieren Sie die Haut mit Jodophor.
- Machen Sie einen 5 mm breiten Hautschnitt oberhalb des Ursprungs der oberflächlichen epigastrischen Gefäße in der Leistengegend. In der Regel kann die Entstehung der oberflächlichen epigastrischen Gefäße durch die Beobachtung einer winzigen Pulsation in der Leistengegend verfolgt werden.
- Trennen Sie mit einem Stereomikroskop mit 10-facher Vergrößerung eine dünne Schicht Unterhautfett, um die oberflächlichen epigastrischen Gefäße freizulegen (Abbildung 3A).
- Isolierung der oberflächlichen Magenvene
- Isolieren Sie die oberflächliche Magenvene vorsichtig von der Arterie, dem Nerven und dem Fettgewebe. Führen Sie dies sowohl proximal bis zu dem Punkt durch, an dem es in die Oberschenkelvene abfließt, als auch distal bis zur ersten Venengabelung.
- Lital die distale Seite mit 8-0 Gewinde einfädeln und das Gewinde mit einer Mikroklemme festklemmen. Kontrollieren Sie die proximale Seite mit einem 8-0 Gewindeschlaufe, die an einer anderen Mikroklemme befestigt ist (Abbildung 3B).
- Machen Sie einen winzigen Querschnitt an der distalen Seite der isolierten Vene. Kontrollieren Sie die proximale Seite, um Blutungen zu vermeiden. Spülen Sie das restliche Blut im Venenlumen mit normaler Kochsalzlösung. Sobald die Vene frei ist, verwenden Sie eine Mikropinzette, um den venösen Schnitt zu vergrößern.
4. Embolisation
- Kanülierung von Venen
- Führen Sie die Nadel des selbstgebauten Injektors vorsichtig durch den Venenschnitt in die Vene ein. Sichern Sie die Nadel mit einer dritten Klemme, um zu verhindern, dass sie aus der Vene rutscht.
- Ablauf der Embolisation
- Drücken Sie langsam auf den Kolben, um eine kleine Menge normaler Kochsalzlösung zu verabreichen. Die Fülle der Vene ohne Widerstand deutet auf einen ungehinderten Zugang der Vene hin (Abbildung 3D).
- Schieben Sie weiter auf den Kolben, um Gerinnsel durch den oberflächlichen Zugang der Oberschenkelvene in die Oberschenkelvene zu verabreichen. Kontrollieren Sie die Embolisationsgeschwindigkeit mit 5 Embolien pro Minute. Überwachen Sie die Atmung des Tieres; Entstehende und sich verschlimmernde Dyspnoe deutet auf eine erfolgreiche Embolisation hin.
- Nach der Injektion der vordefinierten Menge an Blutgerinnseln ziehen Sie die Nadel zurück und ligieren die proximale Seite der oberflächlichen Magenvene.
- Nähen Sie den Schnitt und legen Sie das Tier in eine warme Box. Bringen Sie das Tier in seinen Käfig, sobald es aufgewacht ist.
5. Quantifizierung der Infarktfläche
- Euthanasie und Herzperfusion
- Fügen Sie 25.000 U Heparin-Natrium zu 250 ml normaler Kochsalzlösung hinzu und mischen Sie es gründlich. Verbinden Sie die Flasche mit einem Infusionsgerät und hängen Sie die Flasche kopfüber in einer Höhe von 80 cm auf. Schließen Sie das Ventil des Infusionsgeräts.
- Die Tiere mit einer Überdosis Isofluran einschläfern (nach institutionell anerkannten Protokollen).
- Schneiden Sie die Rippen mit einer großen Schere ab und öffnen Sie den Brustkorb, um Schäden an der Lunge und den großen Gefäßen zu vermeiden.
- Führen Sie die Nadel des Infusionsgeräts in die linke Herzkammer ein. Öffnen Sie das Ventil des Infusionsgeräts, um die Infusion von heparinisierter Kochsalzlösung zu ermöglichen. Schneiden Sie mit einer Schere die untere Hohlvene und den linken Anhang ab, um die Drainage zu ermöglichen. Kontrollieren Sie die Perfusionsgeschwindigkeit auf 50 mL/min.
HINWEIS: Während dieses Eingriffs wird normales Lungengewebe weiß, während die embolisierte Zone rostig bleibt. - Nachdem Sie die Perfusion mit heparinisierter Kochsalzlösung abgeschlossen haben, punktieren Sie den Lungenarterienstamm durch den rechten Ventrikel mit einer 10-ml-Spritze, die mit einer 4%igen Paraformaldehydlösung gefüllt ist. Fixieren Sie das Lungengewebe, indem Sie eine 4%ige Paraformaldehyd-Perfusion durch die Lunge für ein Gesamtvolumen von 30 ml durchführen.
- Einführung eines Index namens Infarktverhältnis
- Nach der Fixation werden die Lunge, das Herz, die Luftröhre, die Speiseröhre, der Thymus und die großen Gefäße als Ganzes von der Wirbelsäule und dem Zwerchfell entfernt11.
- Entfernen Sie vorsichtig die Speiseröhre, den Thymus und das Fettgewebe aus der ursprünglichen Masse und lassen Sie nur das Herz, die Lunge und die großen Gefäße übrig.
- Den restlichen Teil mindestens 48 h lang in ein ausreichendes Volumen von 4%iger Paraformaldehydlösung tauchen.
- Verwenden Sie eine Analysenwaage, um die gesamte Lunge zu wiegen. Trennen Sie den infarktierten Teil der Lunge mit einer feinen Schere und wiegen Sie das infarzierte Gewebe mit der gleichen Waage. Berechnen Sie das Infarktverhältnis mit der folgenden Gleichung:
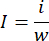
i ist das Gewicht des infarktierten Gewebes, w ist das Gewicht der gesamten Lunge, i steht für das Infarktverhältnis. - Nach Quantifizierung des Infarktbereichs wird das Paraformaldehyd-fixierte Lungengewebe für die Paraffineinbettunggekürzt 11.
6. Visualisierung des Lungenarterienbaums
- Gießen der Pulmonalarterie
- Das Tier einschläfern und eine Herzperfusion durchführen, wie in Schritt 5.1 beschrieben.
- Geben Sie eine gleiche Menge (nach Gewicht) Verdünnungsmittel zur Silikongießmasse, mischen Sie die Mischung und fügen Sie dann 5 % (nach Gewicht oder Volumen) des Härters hinzu. Die Mischung erneut pürieren.
- Ziehen Sie 1 ml der Mischung in eine 1 ml-Spritze, lassen Sie die Luft ab und führen Sie die Nadel durch den rechten Ventrikel in den Stamm der Lungenarterie ein. Befestigen Sie die Nadel an der Lungenarterie, um ein Verrutschen und einen Rückfluss zu verhindern.
- Drücken Sie vorsichtig auf den Kolben, damit die Silikongießmischung den Lungenarterienbaum füllen kann. Die normalen Lungenbereiche werden durch die Gussmischung eingefärbt, während die infarzierten Bereiche rostrot bleiben.
HINWEIS: Der Pulmonalarterienabguss sollte nur auf intaktes Lungengewebe angewendet werden. In der Regel reichen 0,6-0,8 ml der Gießmischung aus, um den Lungenarterienbaum zu füllen. Eine Überinjektion der Gipsmischung kann zu einem Lungenvenenabguss führen, der sich auf die Visualisierung des Lungenarterienbaums auswirkt. Die Gießmischung sollte innerhalb von 20 min nach Zugabe des Härters verwendet werden, da sie nach dieser Zeit kristallisiert. - Ziehen Sie die Spritze nach dem Gießen der Perfusion zurück, ligieren Sie den Stamm der Lungenarterie und entnehmen Sie die Lunge, das Herz und die großen Gefäße, wie in Schritt 5.2 beschrieben. Die ganze Masse in eine Petrischale geben und über Nacht im Kühlschrank bei 4 °C aufbewahren, damit die Gussmischung kristallisieren kann.
- Clearing und Visualisierung
- Entfernen Sie das Herz und die großen Gefäße mit einer Schere aus der Lunge und reinigen Sie dann die Lungenoberfläche von den Rückständen der Pökelmischung.
- Tauchen Sie die Lunge nacheinander 24 Stunden lang in 25 %, 50 %, 75 %, 95 % und 100 % Ethylalkohollösungen. Durch dieses Verfahren wird die Lunge vollständig dehydriert.
- Tauchen Sie die dehydrierte Lunge 24 Stunden lang in Methylsalicylat. Nach diesem Reinigungsprozess ist der Lungenarterienbaum sichtbar, und die Embolien sind ebenfalls zu sehen, da Methylsalicylat das Hämoglobin nicht beseitigt (Abbildung 4B, D).
Ergebnisse
Symptome und Pathologie des PE-Modells
Während der Embolisation traten bei den Ratten Atemnot auf, und der Thorax zeigte erweiterte Schwankungen. Fast alle Tiere überlebten die Lungenembolie, bei der weniger als 10 cm Blutgerinnsel verabreicht wurden (14 von 15 modellierten Tieren). Nachdem sie in ihre Käfige zurückgebracht worden waren, rollten sich die Tiere in Ecken zusammen und zeigten weniger Interesse an Futter und Wasser. Diese Symptome verschwanden jedoch schnell, und innerhalb weniger Stunden verhielten sich die Tiere normal. Es gab keinen signifikanten Gewichtsunterschied zwischen dem Ausgangswert und 24 h nach der Embolisation (341,8 ± 10,4 vs. 343,3 ± 8,5, p = 0,25).
Die grobe Pathologie zeigte, dass die embolisierten (infarzierten) Bereiche keilförmig waren, meist im unteren Teil der Lunge gelegen, mit klaren Rändern. Die Embolien wurden an der Spitze der infarktierten Bereiche gefunden und blockierten den ersten und sekundären Ast der Lungenarterie. Eine mikroskopische Pathologie mit Hämatoxylin-Eosin-Färbung bestätigte die Embolisation eines Lungenarterienastes (Abbildung 4F).
Blutgerinnselbelastung und Infarktbereich
In einer Voruntersuchung des Einflusses der Blutgerinnsellast auf den Lungeninfarkt untersuchten wir sowohl eine niedrige Blutgerinnsellast (6 cm Thrombussäule, 15 Gerinnsel) als auch eine hohe Blutgerinnsellast (10 cm Thrombussäule, 25 Gerinnsel). Erwartungsgemäß führte eine höhere Belastung durch Embolien zu einer größeren Lungeninfarktfläche (Abbildung 5A-C).
Intrinsische Fibrinolyse innerhalb von 24 h
Im Vergleich zu Lungenproben, die unmittelbar nach der Embolisation entnommen wurden, zeigten die Lungenproben, die 24 Stunden nach der Embolisation entnommen wurden, deutlich verminderte Infarktbereiche, was auf ein starkes intrinsisches Fibrinolysepotenzial bei Ratten hinweist (Abbildung 5D).
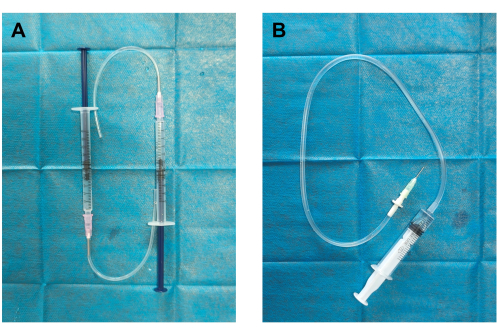
Abbildung 1: Aufbau des Thrombusgenerators und des Blutgerinnselinjektors. (A) Der Thrombusgenerator wurde zusammengebaut, indem ein Silikonschlauch an eine 18 G Dosiernadel (12 mm Außendurchmesser) und eine 1 mL Spritze, die mit 0,5 mL normaler Kochsalzlösung vorgefüllt war, verbunden wurde. (B) Der Blutgerinnselinjektor wurde konstruiert, indem eine 19-G-Abgabenadel (0,84 mm Innendurchmesser, 1,08 mm Außendurchmesser) mit einem Infusionsschlauch (Gerinnselbehälter) und einer 5-ml-Spritze, die mit 2 mL normaler Kochsalzlösung vorgefüllt war, verbunden wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Blutentnahme und Gerinnselvorbereitung. (A) Die Ratte wurde betäubt und in Rückenlage fixiert. Der weiße Kreis mit einer gestrichelten Linie zeigt das Manubrium an und dient als Markierung der Körperoberfläche. Die roten Punkte neben dem weißen Kreis zeigen die Punktionsstellen für den Zugang zu den bilateralen kranialen Hohlvenen (ZVKs) an. Der untere Teil der Abbildung zeigt eine Autopsiedarstellung der relativen Positionen des Manubriums, der ZVK und der Einstichstellen. (B) Erfolgreiche Blutentnahme durch das richtige ZVK. (C) Thrombosierte Blutsäule, die aus dem selbstgebauten Thrombusgenerator ausgespült wird. (D) Blutgerinnsel, die aus der thrombosierten Blutsäule stammen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Venenzugang und Embolisation. (A) Freilegung der oberflächlichen epigastrischen Gefäße durch einen 5 mm Hautschnitt, wobei der blaue Pfeil die oberflächliche Oberkiefervene und der rote Pfeil die oberflächliche Oberkieferarterie anzeigt. (B) Isolierung der oberflächlichen Magenvene vom umgebenden Gewebe und Kontrolle der Vene mit Nylonfäden. (C) Der selbstgebaute Injektor, der Blutgerinnsel enthält. (D) Kanülierung der Vene mit der Abgabenadel des selbstgemachten Injektors und Verabreichung von Blutgerinnseln über den Venenzugang. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Pathologie der Lungenembolie. (A) Normale Lunge nach kardialer Kochsalzperfusion und 4%iger Paraformaldehyd-Fixierung. (B) Normale Lunge, sichtbar durch Silikongussmischung und Methylsalicylat-Clearing, zeigt einen offenen Lungenarterienbaum und Mikrovaskulatur. (C) Lunge unmittelbar nach der Embolisation mit autologen Blutgerinnseln, mit markierten Bereichen, die auf einen Lungeninfarkt aufgrund der Embolisation hinweisen. (D) Erkrankte Lungen, sichtbar durch Gießen von Silikonmischungen und Methylsalicylat-Clearing, mit schwarzen Pfeilen, die Embolien anzeigen, die die Äste der Lungenarterie blockieren, und weißen gestrichelten Kreisen, die ihre betroffenen Bereiche anzeigen, die infarkt sind. (E) Dissektion des linken Lungenlappens mit Embolien (rote Pfeile) in den Ästen der Lungenarterien. (F) Mikroskopische Bilder der Embolisation von Blutgerinnseln in einem Lungenarterienast unter Verwendung von Hämatoxylin- und Eosin-Färbung. Maßstab: 200 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Quantifizierung des Lungeninfarktverhältnisses. (A) Lungen, die einer Ratte unmittelbar nach der Embolisation mit 10 cm Blutgerinnseln (Gesamtlänge) entnommen wurden. (B) Lunge, die einer Ratte unmittelbar nach der Embolisation mit 6 cm Thrombus entnommen wurde. (C) Lunge, die einer Ratte unmittelbar nach der Embolisation mit 8 cm Blutgerinnseln entnommen wurde. (D) Lunge, die einer Ratte 24 Stunden nach der Embolisation entnommen wurde, mit 8 cm Blutgerinnseln. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
In dieser Studie wurde erfolgreich ein minimal-invasives Rattenmodell der Lungenembolie mit autologen Blutgerinnseln etabliert. Einmal gemeistert, kann dieses Modellierungsverfahren innerhalb von 30 Minuten abgeschlossen werden. Das Modell erfasst effektiv die wichtigsten Merkmale der klinischen Lungenembolie, die durch pathologische Untersuchungen bestätigt werden. Folglich bietet es ein wertvolles Werkzeug zur Aufklärung der hämodynamischen Veränderungen und der Pathogenese von Komplikationen nach LE, zur Entwicklung neuer diagnostischer Biomarker und therapeutischer Ziele sowie zur Erprobung neuartiger antithrombotischer Behandlungen.
Über mehrere Jahrzehnte hinweg wurden erhebliche Anstrengungen unternommen, um ein PE-Tiermodell zu entwickeln, aber es wurde keine einzige Methode als optimal für die Modellierung von PE12 identifiziert. In diesem Artikel weist das modifizierte PE-Modell mehrere Besonderheiten auf: (1) Blutentnahme aus dem zentralen Venenkatheter (ZVK): Bei Nagetieren verbindet sich der ZVK mit dem Zusammenfluss der Vena subclavia und der Vena jugularis interna und erstreckt sich kaudal in die Brusthöhle13. Der linke und der rechte ZVK sind nahezu symmetrisch. Der ZVK hat ein größeres Lumen als die Vena jugularis, befindet sich in der Nähe des Manubriums und liegt unterhalb des Pectoralis major. Diese anatomischen Eigenschaften ermöglichen eine präzise Venenpunktion, größere Blutentnahmemengen und eine schnelle Blutstillung, was zu einer hohen Erfolgsquote führt. Darüber hinaus ist die Blutentnahme aus dem ZVK im Vergleich zu anderen Blutentnahmewegen weniger anfällig für Kontaminationen, und Komplikationen wie Hämatome, Thrombosen und Pneumothorax sind weniger wahrscheinlich. Die Blutstillung wird in der Regel automatisch oder schnell mit Druck erreicht. (2) Injektion durch die oberflächliche Magenvene: Typischerweise werden die äußeren Halsvenen für die Injektion von Blutgerinnseln verwendet, um PE 6,8,9 zu induzieren, und der Hautschnitt für die Exposition kann minimal sein. Die Kanülierung der Vena jugularis externa führt jedoch häufig zu einem Venenverschluss, was sich negativ auf nachfolgende Experimente auswirken kann, da die Vena jugularis externa bei Ratten nach der Geburt der wichtigste kraniale Abfluss ist14 und eine Kanülierung der anderen Vena jugularis externa für die Druckmessung des rechten Ventrikels erforderlich ist 6,8,10. Bei diesem modifizierten Modell hat das Opfern der oberflächlichen Magenvene nur minimale Auswirkungen auf den Körper. Darüber hinaus ahmt dieser Weg zur Injektion von Blutgerinnseln die klinische Lungenembolie nach, bei der die meisten Embolien aus den Venen der unteren Extremitäten stammen. Die genaue Lage der oberflächlichen Oberbaucharterie ist entscheidend für einen kleinen Schnitt. Das Pulsieren der oberflächlichen Oberbaucharterie kann in der Regel auf der Hautoberfläche der Leiste festgestellt werden, was bei der Identifizierung der Gefäße hilft. (3) Maßgeschneiderte Emboliebelastung: Die Emboliebelastung wird durch den Durchmesser und die Gesamtlänge der Blutsäule bestimmt. Der in dieser Studie verwendete Thrombusgenerator ermöglicht eine standardmäßige und kundenspezifische Emboluslastvorbereitung. Forscher können diese Parameter je nach Forschungsbedarf anpassen. In diesem Fall führt die Emboliebelastung zu spürbaren Symptomen und Anzeichen, führt aber mit geringerer Wahrscheinlichkeit zum Tod. Es ist im Allgemeinen sicher, wenn weniger als 10 cm Blutgerinnsel injiziert werden. Tritt eine Apnoe auf, sollte die Injektion sofort abgebrochen werden. Der Versuchsleiter sollte dann die Brust des Tieres mit den Fingern an der seitlichen und vorderen Brustwand halten und rhythmische Herzdruckmassagen durchführen; Die Atmung des Tieres kann sich nach diesen Manövern erholen. (4) Lungenperfusion und Quantifizierung von Infarktbereichen: In dieser Studie werden detaillierte Lungenperfusionstechniken zur besseren Visualisierung des Lungeninfarkts nach PE-Induktion vorgestellt. Darauf aufbauend wurde ein Index zur Quantifizierung der Infarktfläche, das sogenannte Infarktverhältnis, entwickelt. Die aktuellen Ergebnisse deuten darauf hin, dass dieser Index auf die Emboluslast und die intrinsische Thrombolyse ansprechen kann, was auf seine potenzielle Nützlichkeit für gruppenübergreifende Vergleiche in Studien zur Untersuchung neuer antithrombotischer Therapien hindeutet.
Im Vergleich zur PE-Modellierung ist die Modellierung der chronischen thromboembolischen pulmonalen Hypertonie (CTEPH), einer schweren Langzeitkomplikation der Lungenembolie, aufgrund der hohen fibrinolytischen Aktivität bei Nagetieren schwieriger. Mögliche Lösungen umfassen die wiederholte Embolisation und die Verabreichung von Tranexamsäure (TXA), einem Fibrinolysehemmer 7,10,12,15. Die Schädigung des Erzgangzugangs und die schnelle Plasmaclearance von TXA erschweren jedoch weiterhin die CTEPH-Modellierung. Das hier vorgestellte Modell und die begleitenden Visualisierungsprotokolle können Einblicke in die Etablierung eines zuverlässigen CTEPH-Modells geben.
Die Einschränkungen dieses Manuskripts sollten ebenfalls angesprochen werden. Erstens fehlen für dieses Modell hämodynamische Messungen, wie z. B. der Druck des rechten Ventrikels und die Echokardiographie. Dies negiert jedoch nicht die Gültigkeit des Modells, da es pathologisch validiert wurde. Forscher können sich auf andere Literatur beziehen, um detaillierte Methoden zu hämodynamischen Messungen zu erhalten16. Zweitens wurde eine Behandlungsgruppe zur Bewertung des Arzneimittelansprechens in diesem PE-Modell nicht eingeschlossen, wie z. B. die Verabreichung von Warfarin und Urokinase, was den Nutzen des Modells weiter hätte demonstrieren können.
Zusammenfassend lässt sich sagen, dass es gelungen ist, ein modifiziertes Nagetiermodell der PE zu etablieren, das sich durch seinen minimal-invasiven Ansatz auszeichnet. Methoden zur Quantifizierung von Infarktbereichen und zur Visualisierung des Lungenarterienbaums wurden ebenfalls zur Verfügung gestellt. Dieses Modell ist vielversprechend, um kritische Fragen zur Prävention und Behandlung von PE-Komplikationen zu beantworten.
Offenlegungen
Die Autoren erklären, dass kein Interessenkonflikt besteht.
Danksagungen
Diese Studie wird durch einen Zuschuss der Wu Jieping Medical Foundation (320.6750.19089-36) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Analytical balance | METTLER TOLEDO | MA55/A | None |
| Dispensing needle | Jinrong electronics | None | 19 G and 18 G |
| Fine scissors | Stronger | XGJ1300 | None |
| Heparin sodium salt | Solarbio | 01-08-9041 | 140U/mg |
| Isoflurane | RWD | R510-22-10 | None |
| Methyl salicylate | Macklin | M813577 | AR, 99% |
| Micro clamp | JZ | W40160 | None |
| Micro tweezers | Stronger | XGN1310 | None |
| Silicone casting compound | Flow Tech | MV-130 | None |
| Sprague-Dawley rats | Vital River | SD-IGS | None |
| Stereo microscope | Murzider | MSD204 | None |
Referenzen
- Götzinger, F., et al. Interventional therapies for pulmonary embolism. Nat Rev Cardiol. 20 (10), 670-684 (2023).
- Falster, C., et al. Comparison of international guideline recommendations for the diagnosis of pulmonary embolism. Lancet Haematol. 10 (11), e922-e935 (2023).
- Konstantinides, S. V., et al. ESC guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 41 (4), 543-603 (2020).
- Domínguez-Oliva, A., et al. The importance of animal models in biomedical research: Current insights and applications. Animals (Basel). 13 (7), 1223 (2023).
- Mukherjee, P., Roy, S., Ghosh, D., Nandi, S. K. Role of animal models in biomedical research: A review. Lab Anim Res. 38 (1), 18 (2022).
- Tang, Z., et al. Gene expression profiling of pulmonary artery in a rabbit model of pulmonary thromboembolism. PLoS One. 11 (10), e0164530 (2016).
- Deng, C., et al. Expression of tissue factor and forkhead box transcription factor o-1 in a rat model for chronic thromboembolic pulmonary hypertension. J Thromb Thrombolysis. 42 (4), 520-528 (2016).
- Runyon, M. S., Gellar, M. A., Sanapareddy, N., Kline, J. A., Watts, J. A. Development and comparison of a minimally-invasive model of autologous clot pulmonary embolism in Sprague-Dawley and Copenhagen rats. Thromb J. 8, 3 (2010).
- Li, S. Q., et al. Comparative proteomic study of acute pulmonary embolism in a rat model. Proteomics. 7 (13), 2287-2299 (2007).
- Deng, C., et al. Role of FOXO1 and apoptosis in pulmonary vascular remolding in a rat model of chronic thromboembolic pulmonary hypertension. Sci Rep. 7 (1), 2270 (2017).
- Morton, J., Snider, T. A. Guidelines for collection and processing of lungs from aged mice for histological studies. Pathobiol Aging Age Relat Dis. 7 (1), 1313676 (2017).
- Karpov, A. A., Vaulina, D. D., Smirnov, S. S., Moiseeva, O. M., Galagudza, M. M. Rodent models of pulmonary embolism and chronic thromboembolic pulmonary hypertension. Heliyon. 8 (3), e09014 (2022).
- Picazo, M. G., Benito, P. J., García-Olmo, D. C. Efficiency and safety of a technique for drawing blood from the hamster cranial vena cava. Lab Anim (NY). 38 (6), 211-216 (2009).
- Szabó, K. The cranial venous system in the rat: Anatomical pattern and ontogenetic development. Ii. Dorsal drainage. Ann Anat. 177 (4), 313-322 (1995).
- Li, C. Y., et al. The effects and mechanism of ginsenoside rg1 on myocardial remodeling in an animal model of chronic thromboembolic pulmonary hypertension. Eur J Med Res. 18 (1), 16 (2013).
- Sullivan, D. M., Watts, J. A., Kline, J. A. Biventricular cardiac dysfunction after acute massive pulmonary embolism in the rat. J Appl Physiol (1985). 90 (5), 1648-1656 (2001).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten